马铃薯(Solanum tuberosum L.)是世界上的第四大食用作物[1],目前已经成为最普遍、最重要的非谷类粮食作物,因此,维护马铃薯的安全生产已成为世界粮食安全的重要保障之一。据联合国粮农组织统计,我国2016年的马铃薯种植面积达到了581.51 hm2,年产量达9 912.24万t,是世界第一大马铃薯生产国[2]。马铃薯产业已经发展成为我国农村经济支柱的产业之一[3]。但是,由于疫霉菌(Phytophthora infestans)侵染导致的晚疫病严重发生,造成马铃薯产量和品质的下降,从而制约了我国马铃薯产业的发展[4]。每年由于马铃薯晚疫病对马铃薯造成的减产为10%~20%,病害发生严重时期减产可高达50%~70%,甚至绝收[5]。因此,挖掘抗病基因,并利用基因工程手段进行抗晚疫病育种,对保障马铃薯产业的安全具有非常重要的意义[6]。
植物对病原菌侵染的抗性反应最初表现为细胞死亡,称之为过敏反应(Hypersensitive response,HR)[7];在过敏反应发生后,被侵染植株则会产生抗性,甚至具有了很强的广谱抗性,称为系统获得性抗性(Systemic acquired resistance,SAR)[8]。已有研究表明,H2O2是诱导植物HR反应的信号分子之一[9-10],Houot等[9]发现H2O2具有诱导烟草细胞程序性死亡的功能。H2O2作为活性氧(Active oxygen,AO)组成中的一员,通过诱发过敏性坏死反应,使得植物具有了抵抗病原菌侵染的第一道防线[11];同时,H2O2的大量积累还可以直接杀死病原菌并且参与植物细胞壁增厚和木质素的合成过程[12]。但是过高浓度的活性氧会对寄主植物造成损伤,而ROS清除酶如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等则起到平衡植物体中活性氧浓度的作用。SOD是一类含金属的酶类,可将超氧阴离子歧化为过氧化氢和氧气。SOD还能去除单线态氧,防止羟自由基的形成,并且已被认为是清除ROS的最基本防御机制。CAT可将H2O2分解成水和氧气,而POD活性的增加与木质素类物质积累以及过敏反应的启动有关[13-14]。因此,活性氧参与一系列抗病防御反应,其代谢水平的调控在植物与病原物互作中扮演着重要的角色[15]。
BAG(Bcl-2 associated athanogene)是一类具有多种功能的蛋白家族,具有与细胞凋亡和肿瘤发生相关的各种功能[16]。BAG基因的首次发现于小鼠胚胎cDNA文库中[17],目前,已经确定人类基因组中有6个BAG家族成员,它们可以调节多种生理过程,如细胞凋亡、肿瘤发生等[18-19]。而植物中的AtBAG1~AtBAG4的结构与动物中的BAG非常相似,预示着其功能可能与该同源蛋白在动物中的功能相似[16]。有人认为BAG蛋白不仅通过结合钙调蛋白,还可以通过结合其他的蛋白来实现细胞内的信号传递,使其能够调控植物叶片衰老以及对逆境的响应等生理过程[20-21],而且在拟南芥的耐寒、抗旱和耐盐性中都具有一定的功能[22-23]。也有研究表明,BAG蛋白可能与植物的抗病性有关。为了证实上述的研究结果,研究者对敲除AtBAG4和AtBAG6后的拟南芥接种灰葡萄孢菌(Botrytis cinerea),结果表明AtBAG4和AtBAG6介导植物对病原菌的防卫反应[22]。Ghag等[24]在利用香蕉中细胞凋亡相关基因构建转基因过表达香蕉植株的过程中发现,过表达MusaBAG1的转基因香蕉植株对香蕉的枯萎病菌(Fusarium oxysporum)抗性增强。
本研究以马铃薯叶片为试验材料,利用农杆菌介导的瞬时表达体系,分别从接种部位病斑大小的变化、坏死细胞的数量、H2O2水平以及ROS清除酶的活性等方面初步探究了马铃薯的StBAG3在对晚疫病抗性建立过程中可能具有的功能,此研究结果为后续深入研究StBAG3基因在马铃薯抗性建立过程中的调控机制奠定一定的理论基础。
1 材料和方法
1.1 供试材料
供试病原菌:马铃薯晚疫菌由内蒙古农业大学园艺与植物保护学院植物分子病理实验室保存,其交配型为A1型;供试马铃薯材料:人工气候箱内生长30 d的夏坡蒂叶片;供试农杆菌:本实验室存留的含有pCAMBIA1302-GFP-BAG质粒和pCAMBIA1302-GFP质粒的农杆菌LB4404菌株[25]。
1.2 试验方法
1.2.1 农杆菌介导的瞬时表达 将备好的含有pCAMBIA1302-GFP-BAG超表达载体与空载体的农杆菌菌液室温静置3 h后用于接种;用去掉针头的注射器将含有pCAMBIA1302-GFP-BAG以及空载体的农杆菌菌液分别注射到马铃薯离体叶片的背面,24 h后人工接种马铃薯晚疫病菌的游动孢子液(1×106 个/mL)。
1.2.2 病原菌的接种 将在黑麦培养基上培养20 d的致病疫霉菌转入装有无菌水的离心管中,4 ℃下放置3 h诱导游动孢子的释放,将孢子浓度调至1×106 个/mL。在叶片的右侧接种10 μL的孢子液,叶片的左侧接种水作为对照。将接种叶片放置在光照培养箱中(光照16 h,黑暗8 h,温度为18~22 ℃,湿度为80%)培养。分别在接种后0,24,48,72,96 h测量病斑的面积,并运用Motic Images Plus 2.0辅助计算接种部位相对病斑面积,相对病斑面积/%=接种部位的病斑面积/(0.25×单个叶片面积),接种情况见图1。
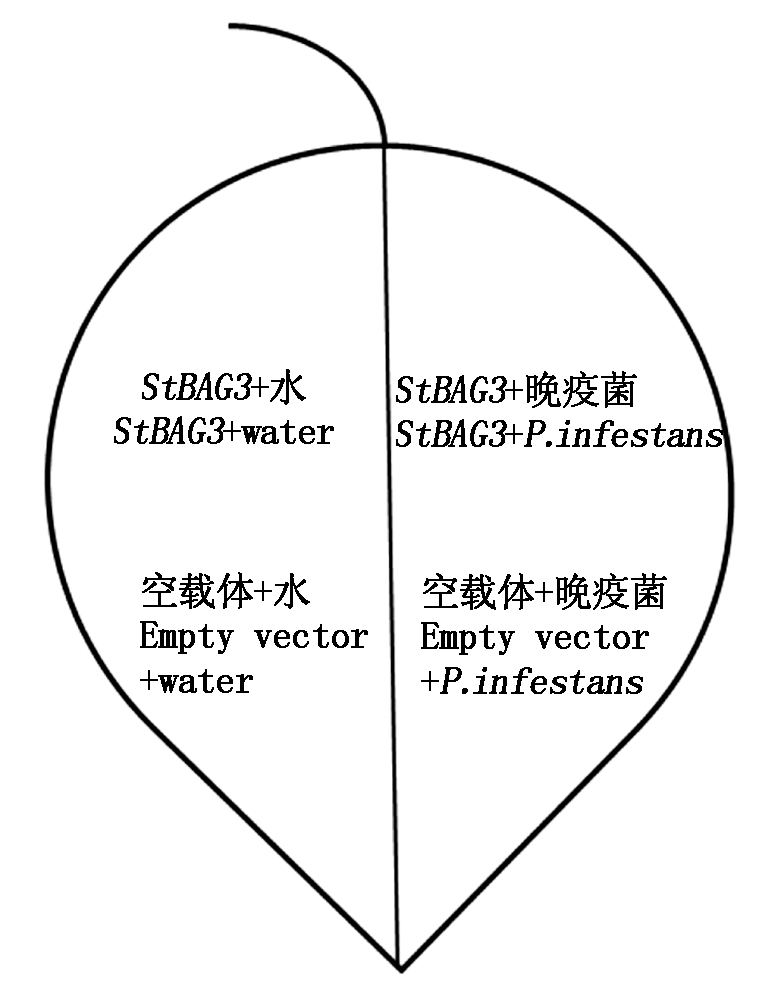
图1 马铃薯离体叶片瞬时表达StBAG3后接种晚疫菌的示意图
Fig.1 The leaf of potato inoculated with P.infestans after transient expression of StBAG3
1.2.3 染色 采用Zheng等[26]的方法,用台盼蓝对马铃薯叶片进行染色;采用Thordal-Christensen等[27]的方法,用DAB对马铃薯叶片进行染色。
1.2.4 过氧化氢含量的测定 称取1 g接种马铃薯晚疫病菌后0,24,48,72,96 h后瞬时表达目的基因的叶片,按材料与提取液1∶1的比例加入预冷的丙酮并研磨后,6 000 r/min离心10 min。取1 mL上清液,加入5%硫酸钛和浓氨水,待沉淀形成后,6 000 r/min离心10 min,弃上清液。用丙酮洗涤3~5次。加入5 mL 2 mol/L硫酸,待沉淀溶解后,在415 nm波长下测定吸光度。H2O2含量/(μmol/g)=(C×Vt)/(FW×V1),式中,C代表标准曲线上查得的H2O2浓度,Vt代表样品提取液总体积,V1代表测定时样品体积,FW代表植物组织鲜质量。
1.2.5 ROS清除酶活性测定 SOD活性的测定采用李合生[28]的NBT显色法,分别在瞬时表达StBAG3和空载体的叶片上接种马铃薯晚疫菌,然后在接种0,24,48,60,72 h后分别取0.1 g新鲜叶片进行测定;POD活性的测定采用郝再彬等[29]的愈创木酚法,取样方法同上;CAT活性的测定采用李合生[28]的方法,取样方法同上。
1.3 统计分析
采用Microsoft Excel 2010和SPSS 25.0进行数据的统计和分析,在α=0.05水平上进行差异显著性分析。
2 结果与分析
2.1 瞬时表达StBAG3基因后对马铃薯抗晚疫病水平的影响
为了探究StBAG3基因在马铃薯抵抗晚疫病菌侵染过程中的作用,以瞬时表达空载体后接种晚疫菌的叶片部位作为对照,测定了在瞬时表达StBAG3基因的马铃薯离体叶片上接种晚疫病菌后不同时间点病斑的大小,结果表明(图2),接种48 h后,当对照的叶片部位开始出现水渍状的病斑,而瞬时表达StBAG3基因的部位却基本未见病斑的出现;接种72 h后对照叶片部位病斑面积明显扩大,但是表达StBAG3基因部位病斑面积只有小幅度增加。直到接种96 h后,当对照叶片从接种部位开始腐烂时,表达StBAG3基因部位病斑面积依然较小。相对病斑面积计算的结果表明,在不同的接种时间点瞬时表达StBAG3基因后的叶片的相对病斑面积分别为0(0 h),0.58%(24 h),2.78%(48 h),3.90%(72 h),6.21%(96 h);而对照相应接种时间点的相对病斑面积分别为0(0 h),2.50%(24 h),11.58%(48 h),28.29%(72 h),45.36%(96 h)。24,48,72,96 h后接种位置病斑的相对面积较对照病斑显著减少了1.92~39.15 百分点。显而易见,瞬时表达StBAG3基因后叶片上病斑相对面积均显著低于对照,预示着超表达StBAG3基因后能够提高马铃薯对晚疫病的抗性水平。
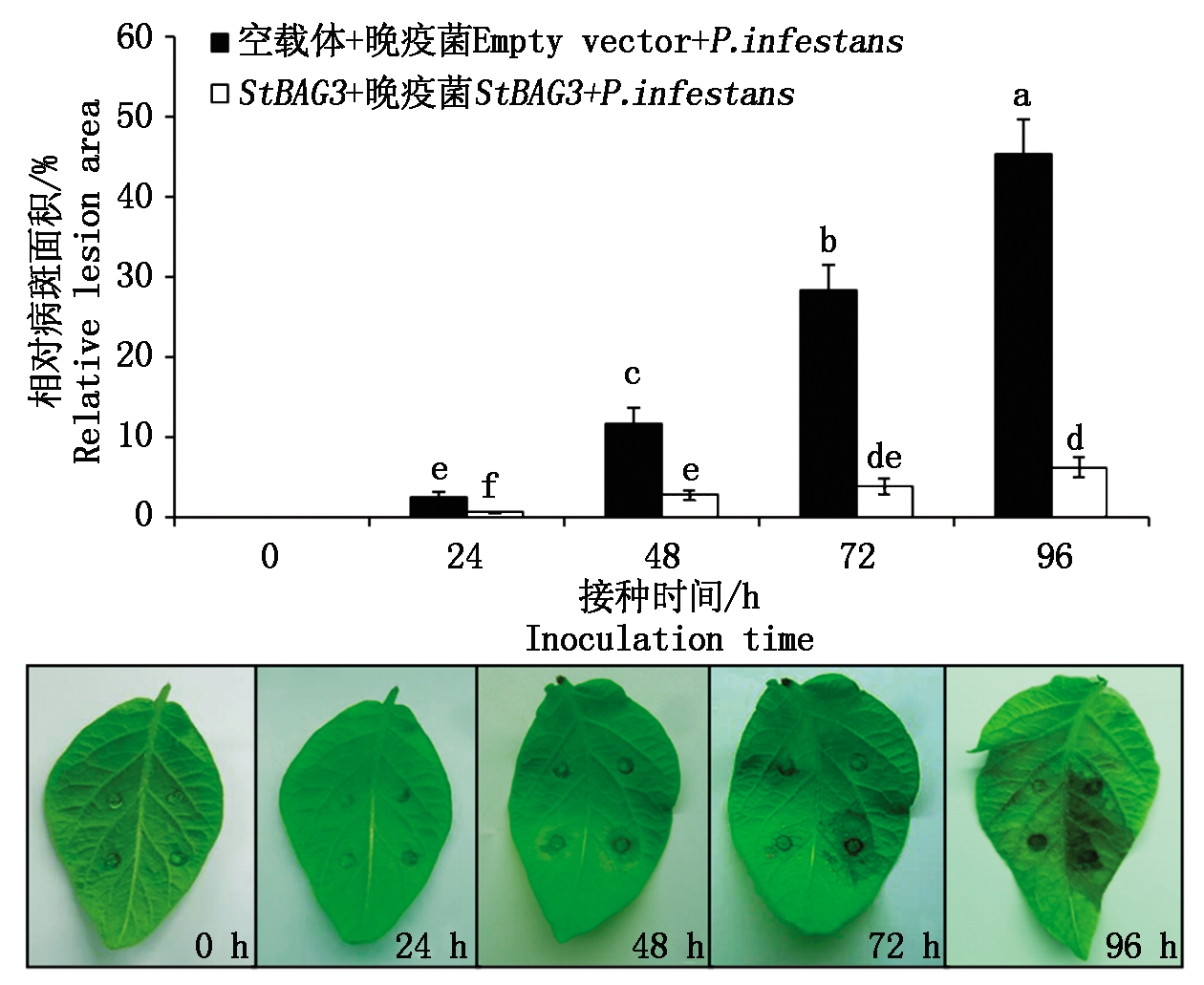
马铃薯离体叶片左侧接种水;右侧接种晚疫菌。图3-4同。
Potato leaves were inoculated with water on the left and P.infestans on the right. The same as Fig.3-4.
图2 瞬时表达StBAG3后接种晚疫菌病斑的变化
Fig.2 Statistical analysis of lesion inoculated withP.infestans after transient expression of StBAG3
由于台盼蓝染色可以用来定性研究坏死细胞的数量,因此,可以利用接种部位染色面积的大小和颜色定性比较病斑的大小。由图3可知,在接种24 h后,瞬时表达StBAG3基因部位的死亡细胞数量与瞬时表达空载体的对照没有明显的差异,然而在接种48 h后,对照部位蓝色的面积以及深度都要大于瞬时表达StBAG3部位,预示着瞬时表达目的基因部位坏死细胞数量少于对照部位。这种差异随着接种时间的推移更加明显。由此可知,瞬时表达StBAG3基因后叶片死亡细胞数量少是直接导致接种部位病斑变小的主要原因。
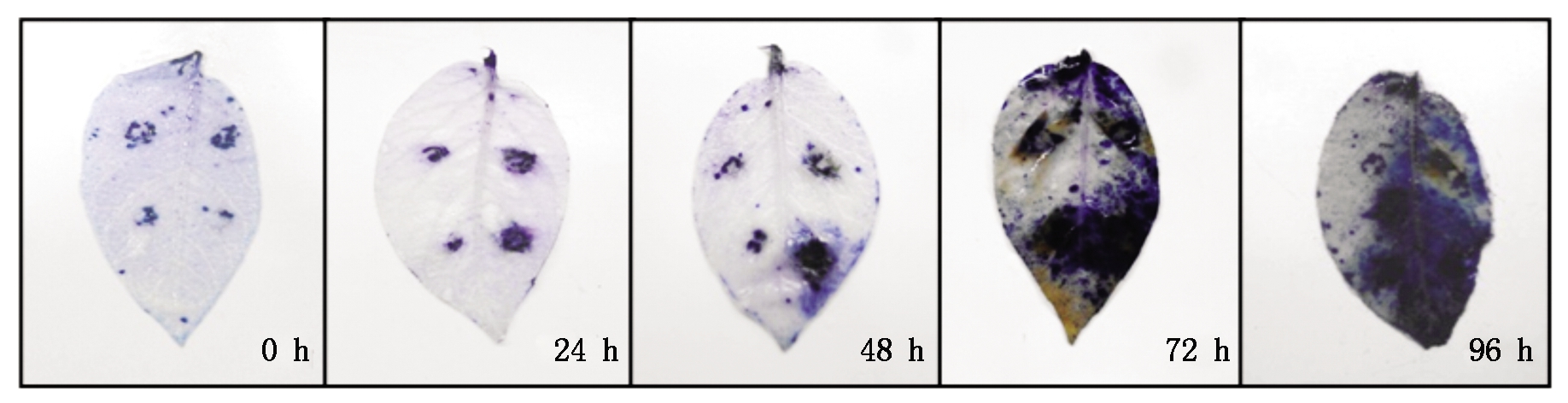
图3 瞬时表达StBAG3叶片接种晚疫菌后死亡细胞数量的检测(台盼蓝染色)
Fig.3 The number of dead cells detection of leaves inoculated with P.infestansafter transient expression of StBAG3(Trypan blue staining)
2.2 瞬时表达StBAG3基因后对马铃薯离体叶片中H2O2产生的影响
过氧化氢的大量积累往往被认为是标定植物抗病水平的一个重要指标,因此,过氧化氢浓度的定量测定能够客观的反映接种部位的抗性水平。为了明确瞬时表达StBAG3基因后导致的病斑变化原因是否为过氧化氢积累水平,对瞬时表达目的基因和空载体后马铃薯离体叶片进行晚疫病菌接种,对接种后不同时间点的叶片中过氧化氢的水平进行测定。结果表明(图4),在接种48 h之前,瞬时表达目的基因和对照部位的过氧化氢都表现出相同的小幅度上升趋势,但二者没有显著差异;接种48 h后,瞬时表达StBAG3基因部位的过氧化氢积累的水平急剧增加,接种72 h后达到一个高峰值,为0.146 μmol/g,而此时间点对照叶片中的过氧化氢含量仅为0.086 μmol/g,尽管对照样本相比前面的接种时间点仍然有上升的趋势,但是增加幅度较小;从接种72 h后开始,瞬时表达StBAG3基因部位的过氧化氢的积累量从第一个峰值开始下降到0.120 μmol/g,而对照相应的也从最高点降低到0.071 μmol/g,在这一时间点,二者在过氧化氢积累水平上仍然表现出显著的差异。在相同的试验设计下利用DAB染色定性测定的结果和定量测定结果基本一致,即在接种72 h后,过氧化氢在瞬时表达目的基因的部位颜色和面积明显高于对照部位,且这种差异到接种96 h后虽然有所缓解,但是仍然存在一定的差异。上述的结果表明过氧化氢参与了StBAG3介导的马铃薯对晚疫病的抗性过程。

图4 瞬时表达StBAG3基因后定量和定性检测接种部位H2O2的积累量
Fig.4 Quantitative and qualitative detection of accumulation of H2O2 in inoculation areas after transient expression of StBAG3
2.3 瞬时表达StBAG3基因后对ROS清除酶活性的影响
为了进一步确定瞬时表达StBAG3基因后能够诱导H2O2的积累,对瞬时表达目的基因和对照的离体马铃薯叶片接种不同的时间点后的ROS清除酶活性进行了测定。结果表明(图5),不同的ROS清除酶活性在接种后不同时间点的变化趋势明显的不同。人工接种后,CAT酶的活性在瞬时表达目的基因的叶片中以及对照叶片中均呈现“先降低后升高再降低又升高”的变化模式,并分别在接种后48,96 h形成2个峰值,分别为0.061,0.041 U/(g·min)和0.074,0.040 U/(g·h);瞬时表达目的基因叶片中CAT活性均高于对照叶片,其中接种后48~96 h二者差异显著。SOD活性在接种后的瞬时表达目的基因叶片中呈现出“先降低后升高再降低”的变化模式,在接种72 h时出现1个高峰值,而在对照叶片中接种后的各时间点却无显著变化,除接种后24 h外,其他时间点瞬时表达目的基因叶片SOD活性均显著高于对照叶片;POD酶活性在瞬时表达目的基因叶片以及对照叶片中均呈现上升的态势,且二者之间在除96 h外的其他时间点均无显著差异,在接种96 h后,瞬时表达目的基因叶片中POD酶活性显著高于对照叶片。
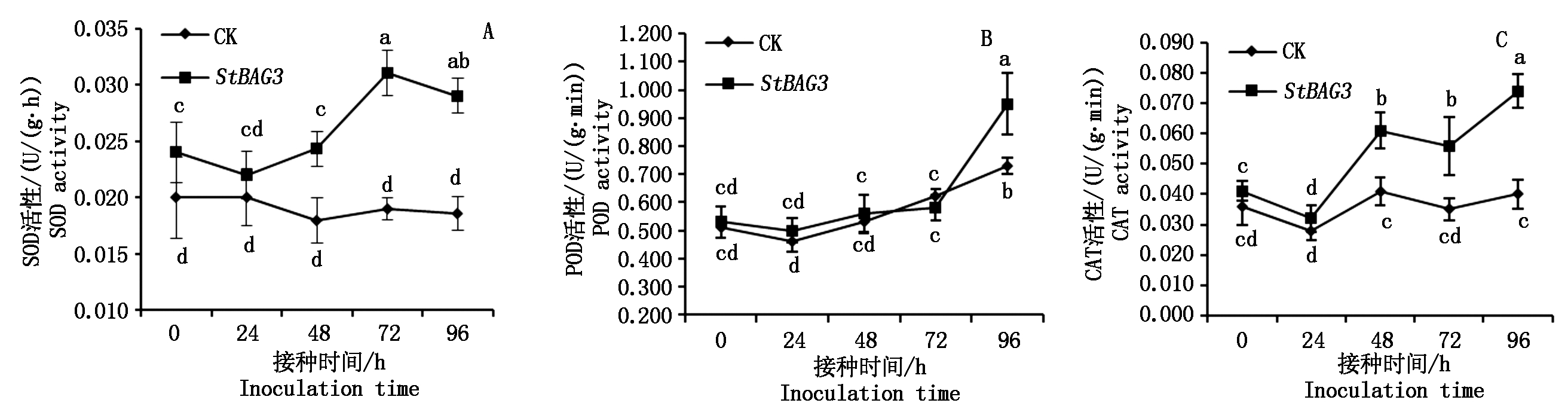
图5 瞬时表达StBAG3基因后接种叶片ROS清除酶活性的变化
Fig.5 Variation of ROS scavenging enzymes activity of leaves after transient expression of StBAG3 and inoculated with P.infestans
3 结论与讨论
研究表明,当植物遇到外界刺激时,比如病原菌侵染,植物往往会有一系列的应激反应,从而提高植物自身的抵抗能力,HR反应就是植物抵抗病原的一个最为强烈且典型的抗性反应。而过氧化氢是诱发HR反应最重要的因素[10]。本研究以本实验室已经克隆得到的马铃薯中的Bcl-2结合抗凋亡基因StBAG3为研究对象,利用农杆菌介导的瞬时表达体系,研究了StBAG3基因在马铃薯抗性建立过程中可能具有的功能,并初步探究了过氧化氢在StBAG3基因介导马铃薯抗性建立过程中的作用,旨在为马铃薯的抗病育种提供新的思路。初步的研究结果表明,StBAG3基因能够提高马铃薯对晚疫病的抗性水平。在You等[30]对水稻中的OsBAG4基因的研究结果表明,由于OsBAG4过量积累,导致诱发先天性免疫表型和自发的细胞死亡、活性氧积累现象,从而使得水稻产生先天性免疫和广谱抗病性;Kabbage等[31]发现拟南芥中的AtBAG6可以通过被蛋白酶水解从而被激活,进而诱导植物产生对病原菌的抗病性。上述的研究结果和本研究结果相似。
此外,定性和定量检测的结果表明过氧化氢在StBAG3基因介导的马铃薯抗性建立过程中也发挥非常重要的作用。Patykowski等[32]发现2个抗病性不同的番茄品种在受到灰霉病菌(Botrytis cinerea)侵染后均能检测到H2O2含量升高,并且抗病品种较感病品种出现的早,生成量更高,说明H2O2 与植物抗病性紧密相关,在受到病原菌侵染时参与了植物体自身的防御反应。林志强等[33]研究发现,外源施加H2O2 能减缓葡萄霜霉病菌(Plasmopara viticola)侵染过程,降低发病率和病情指数。黄贝梅[34]的研究表明,温室条件下,抗病和感病的沙打旺植株在接种埃里砖格孢菌(Embellisia astragali)后,H2O2含量均高于未被侵染的植株,而未被侵染的植株H2O2含量相对稳定。施加外源H2O2后,感病沙打旺的病情指数和发病率均显著低于对照,并且有效提高了POD、CAT、SOD等酶对抗病过程的调节作用,从而强化了寄主的病害防御体系,增加了对埃里砖格孢菌的抗性。以上研究结果与本试验的研究一致,均表明了H2O2参与了植物的抗性过程的建立。据已有研究表明,HR反应通过细胞程序性死亡实现,该反应发生时,胼胝质含量增高[35-36]。而过表达AtBAG6的植株细胞中的胼胝质含量也显著增加,这说明AtBAG6参与植物对生物胁迫的应答可能是通过调节HR反应来实现的。而活性氧能够诱导MAPK激酶,使HR反应中的细胞程序性死亡发生[37-38]。所以,在本试验中H2O2含量的增加可能是因为StBAG3的过表达诱导了接种晚疫菌的叶片的HR反应。另一方面,ROS易对细胞造成毒害,此时需要ROS清除机制来降低ROS的毒害[39-40],本试验中ROS清除酶活性出现不同程度的升高,可能因为H2O2含量的增加。
本研究利用瞬时表达体系得到了有关StBAG3基因调控马铃薯抗性的一些初步结果,但是由于瞬时表达体系相比稳定表达StBAG3株系具有一些缺点,如该方法技术条件要求高并且得到的蛋白质产物保存的时间较短,这些缺点将会限制研究者对StBAG3基因的调控模式、调控信号网络等进行深入细致的研究。因此,利用农杆菌介导的遗传转化获得稳定表达上述目的基因的转基因株系,以及利用RNAi或VIGS体系对内源的目的基因进行沉默是研究上述基因在马铃薯抗病乃至抗逆过程中调控功能的当务之急。
[1] 安娜,董美,李凯,宛煜嵩,金芜军,韩阳,李亮.转基因马铃薯检测用质粒标准分子研制[J].中国农业科技导报, 2017,19(2):130-136.doi:10.13304/j.nykjdb.2016.262.
An N,Dong M,Li K,Wan Y S,Jin W J,Han Y,Li L.Development of a reference plasmid for genetically modified potatoes detection [J].Journal of Agricultural Science and Technology,2017,19(2):130-136.
[2] 金黎平,屈冬玉,谢开云,卞春松,段绍光.我国马铃薯种质资源和育种技术研究进展[J].种子,2003(5):98-100. doi:10.16590/j.cnki.1001-4705.2003.05.100.
Jin L P,Qu D Y,Xie K Y,Bian C S,Duan S G.Advances in research on potato germplasm resources andbreeding techniques in China[J].Seed,2003(5):98-100.
[3] 谢从华.马铃薯产业的现状与发展[J].华中农业大学学报(社会科学版),2012(1):1-4.doi:10.13300/j.cnki.hnwkxb.2012.01.017.
Xie C H.Potato industry:status and development[J].Journal of Huazhong Agricultural University (Social Sciences Edition),2012(1):1-4.
[4] Garelik G.Taking the bite out of potato blight[J].Science,2002,298(5599):1702-1704.doi:10.1126/science.298.5599.1702.
[5] 林传光,黄河,王高才,霍守祥,王道本.马铃暮晚疫病的田间动态观察与防治试验[J].植物病理学报,1995,1(1): 312-441.
Lin C G,Huang H,Wang G C,Huo S X,Wang D B.Field dynamic observation and control experiment of potato late blight[J].Acta Phytopathologica Sinica,1995,1(1): 312-441.
[6] 周倩,秦玉芝,吴秋云,熊兴耀.马铃薯晚疫病抗病育种研究进展[J].分子植物育种,2016,14(4):929-934.doi:10.13271/j.mpb.014.000929.
Zhou Q,Qin Y Z,Wu Q Y,Xiong X Y.Research advances on resistance breeding of potato late blight[J].Molecular Plant Breeding,2016,14(4):929-934.
[7] Dangl J L,Horvath D M, Staskawicz B J.Pivoting the plant immune system from dissection to deployment[J].Science,2013,341(6147):746-751.doi:10.1126/science.1236011.
[8] Dangl J L, Jones J D G.Plant pathogens and integrated defence responses to infection[J].Nature,2001,411(6839):826-833.doi:10.1038/35081161.
[9] Houot V,Etienne P,Petitot A S,Barbier S,Blein J P,Suty L.Hydrogen peroxide induces programmed cell death features in cultured tobacco BY-2 cells,in a dose-dependent manner[J].J Experimental Botany,2001,52(361):1721-1730.doi:10.1093/jxb/52.361.1721.
[10] Delledonne M,Xia Y J,Dixon R A, Lamb C.Nitric oxide functions as a signal in plant disease resistance[J].Nature,1998,394(6693):585-588.doi:10.1038/29087.
[11] Thakur M,Sohal B S.Role of elicitors in inducing resistance in plants against pathogen infection:a review[J].Isrn Biochem,2013,2013(2):762412.doi:10.1155/2013/762412.
[12] Neill S J,Desikan R,Clarke A,Hurst R D,Hancock J T.Hydrogen peroxide and nitric oxide as signaling molecules in plants[J].Journal of Experimental Botany,2002,53(372):1237.doi:10.1093/jexbot/53.372.1237.
[13] Halliwell B. Oxidizing the genes oxidative stress and the molecular biology of antioxidant defences[J]. Trends in Biochemical Sciences,1997,22(10):409.doi:10.1016/S0968-0004(97)82530-3.
[14] Reimers P J,Leach J E. Race-specific resistance to Xanthomonas oryzae pv.oryzae conferred by bacterial bligh resistance gene xa-10 in rice(Oryza stativa) involves accumulation of alignin-like substance in host tissues[J].Physiol Mol Plant pathol, 1991,38(3):39-45.doi:10.1016/S0885-5765(05)80141-9.
[15] 陈晓梅,郭顺星.植物抗病性物质的研究进展[J].植物学通报,1999,16(6):658-664.doi:10.3969/j.issn.1674-3466.1999.06.007.
Chen X M,Guo S X.Research advances in plant disease resistive material[J].Chinese Bulletin of Botany,1999,16(6):658-664.
[16] Kabbage M,Dickman M B.The BAG proteins:a ubiquitous family of chaperone regulators[J].Cellular and Molecular Life Sciences,2008,65(9):1390-1402.doi:10.1007/s00018-008-7535-2.
[17] Takayama S,Sato T,Krajewski S,Kochelv K, Irie S, Millan J A, Reed J C.Cloning and functional analysis of BAG-1:A novel Bcl-2-binding protein with anti-cell death activity[J].Cell,1995,80(2):279-284.doi:10.1016/0092-8674(95)90410-7.
[18] Zeiner M,Gehring U. A protein that interacts with members of the nuclear hormone receptor family: iden-tification and cDNA cloning[J].Proceedings of the National Academy of Sciences of the United States of America,1995,92(25):11465-11469.doi:10.10731pnas.92.25.11465.
[19] Takayama S,Reed J C.Molecular chaperone targeting and regulation by BAG family proteins[J].Nature Cell Biology,2001,3(10):237-241.doi:10.1038/ncb1001-e237.
[20] Li L H,Xing Y F,Chang D,Fang S S,Cui B Y,Li Q,Wang X J,Guo S,Yang X,Men S Z,Shen Y Q.CaM/BAG5/Hsc70 signaling complex dynamically regulates leaf senescence[J].Sci Rep,2016,6:31889.doi:10.1038/srep31889.
[21] Williams B,Kabbage M,Britt R,Martin B.AtBAG7,an Arabidopsis Bcl-2-associated athanogene,resides in the endoplasmic reticulum and is involved in the unfolded protein response[J].Proc Natl Acad Sci USA,2010,107(13):6088-6093.doi:10.1073/pnas.0912670107.
[22] Doukhanina E V,Chen S R,van der Zalm E, Godzik A, Reed J, Dickman M B.Identification and fu-nctional characterization of the BAG protein family in Arabidopsis thaliana[J].J Biol Chem,2006,281:18793-18801.doi:10.1074/jbc.M511794200.
[23] Nishizawa-Yokoi A,Yoshida E,Yabuta Y, Shigeoka S.Analysis of the regulation of target genes by an Arabidopsis heat shock transcription factor,HsfA2[J].Journal of the Agricultural Chemical Society of Japan,2009,73(4):890-895.doi:10.1271/bbb.80809.
[24] Ghag S B,Shekhawat U K S,Ganapathi T R.Native cell-death genes as candidates for developing wilt resistance in transgenic banana plants[J].AoB PLANTS,2014,6:37.doi:10.1093/aobpla/plu037.
[25] 卢兴国,张贵,田再民,侯丁一,赵君,张之为.马铃薯StBAG3基因cDNA的克隆及晚疫菌对其诱导表达[J]. 华北农学报,2017,32(5):142-148.doi:10.7668/hbnxb.2017.05.022.
Lu X G,Zhang G,Tian Z M,Hou D Y,Zhao J,Zhang Z W.Cloning of cDNA StBAG3 and induced express by pathogen of potato late blight[J].Acta Agriculturae Boreali-Sinica,2017,32(5):142-148.
[26] Zheng W, Han M, Dong C H,Ji R Q, Cai L, Fu H, Liu S Y.Overexpression of Brassica napus MPK4 enhances resistance to Sclerotinia sclerotiorum in oilseed rape[J].MPMI,2009,22(3):235-244.doi:10.1094/MPMI-22-3-0235.
[27] Thordal-Christensen H, Zhang Z G, Wei Y D, Collinge D B.Subcellular localization of H2O2 in plants.H2O2 accumulation in papillae and hypersensitive response during the barley-powdery mildew interaction[J]. The Plant Journal,1997,11(6):1187-1194.doi:10.1046/j.1365-313X.1997.11061187.x.
[28] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:260-261.
LI H S.Principles and techniques of plant physiological and biochemical experiments[M].Beijing:Higher Education Press,2000:260-261.
[29] 郝再彬,苍晶,徐仲.植物生理实验技术[M].哈尔滨:哈尔滨出版社,2002:204-205.
Hao Z B,Cang J,Xu Z.Plant physiology experiment Technique[M].Harbin:Harbin Press,2002:204-205.
[30] You Q Y, Zhai K R, Yang D L, Yang W B, Wu J N, Liu J Z, Pan W B,Wang J J, Zhu X D, Jian Y K, Liu J Y, Zhang Y Y, Deng Y W, Li Q, Lou Y G, Xie Q, He Z H. An E3 ubiquitin Ligase-BAG protein module controls plant innate immunity and Broad-spectrum disease resistance[J].Cell Host & Microbe,2016,20(6):758-769.doi:10.1016/j.chom.2016.10.023.
[31] Kabbage M, Kessens R, Dickman M B. A plant Bcl-2-associated athanogene is proteolytically activated to confer fungal resistance[J].Microbial Cell,2016,3(5):224-226.doi:10.15698/mic2016.05.501.
[32] Patykowski J,Urbanek H.Activity of enzymes related to H2O2 generation and metabolism in leaf apoplastic fraction of tomato leaves infected with Botrytis cinerea[J].Journal of Phytopathology,2003,151(3):153-161.doi:10.1046/j.1439-0434.2003.00697.x.
[33] 林志强,郭秀萍,车永梅,卢江,刘新.NO和H2O2提高葡萄抗霜霉病的生理作用机制[J].植物病理学报,2011,41(6):576-586.doi:10.13926/j.cnki.apps.2011.06.003.
Lin Z Q,Guo X P,Che Y M,Lu J,Liu X.The physiological mechanisms of NO and H2O2 in increasing resistances of grapevine to Plasmopara viticola[J].Acta Phytopathologica Sinca,2011,41(6):576-586.
[34] 黄贝梅.外源NO和H2O2对沙打旺(Astrgalus adsurgens)抗黄矮根腐病(Embellisia astragali)的影响[D].兰州:兰州大学,2014.
Huang B M.Effect of exogenous nitric oxide and hydrogen peroxide on resistance of yellow stunt-root rot of Astrgalus adsurgens[D].Lanzhou:Lanzhou University,2014.
[35] Dietrich R A,Delaney T P,Uknes S J,Ward E R,Ryals J A,Dangl J L. Arabidopsis mutants simulating disease resistance response[J].Cell,1994,77(4):565-577.doi:10.1016/0092-8674(94)90218-6.
[36] Holt III B F,Mackey D,Dangl J L.Recognition of pathogens by plants[J].Current Biology,2000,10(1):R5-R7.doi:10.1016/S0960-9822(99)00273-0.
[37] Kang C H, Jung W Y, Kang Y H, Kim J Y , Kim D G, Jeong J C, Baek D W, Jin J B, Lee J Y, Kim M O, Chung W S, Mengiste T, Koiwa H, Kwak S S, Bahk J D, Lee S Y, Nam J S, Yun D J, Cho M J. AtBAG6, a novel calmodulin-binding protein, induces programmed cell death in yeast and plants[J]. Cell Death and Differentiation,2006,13(1):84-95.doi:10.1038/sj.cdd.4401712.
[38] Samuel M A, Miles G P, Ellis B E. Ozone treatment rapidly activates MAP kinase signalling in plants[J]. The Plant Journal,2000,22(4):367-376.doi:10.1046/j.1365-313x.2000.00741.x.
[39] Mittler R.Oxidative stress, antioxidants and stress tolerance[J].Trends in Plant Sci,2002,7(9):405-410.doi:10.1016/S1360-1385(02)02312-9.
[40] Mittler R,Vanderauwera S,Gollery M,Breusegem F V.Reactive oxygen gene network of plants[J].Trends in Plant Science, 2004, 9(10): 490-498.doi:10.1016/j.tplants.2004.08.009.
