CO2和水分影响植物的整个生育进程,二者的协同作用共同影响植物的光合作用能力,进而影响植物生理生态及生态系统[1]。近年来,CO2加富和水分处理对植物光合与生长影响的研究有一定的进展。CO2加富在水分的影响下,促进植物的生长发育,水分不足时对植物的生物量影响较小或无影响[2-3]。有研究表明,CO2加富可以提高植物光合速率、降低蒸腾速率,同时还可以提高植株的农艺性状,如株高、茎粗、叶面积、叶片SPAD值等[4-5];水分胁迫会抑制植株生长发育,导致植株叶片气孔关闭、气孔导度下降,使光合作用降低[6]。也有研究表明,高CO2浓度可以在一定程度上缓解水分不足对植物的影响[7]。
菜豆(Phaseolus vulgaris Linn.)是豆科菜豆属植物,富含蛋白质及少量胡萝卜素、维生素B和维生素C,是一种营养价值较高的蔬菜。近年来,关于CO2加富对作物影响的研究已经很成熟[8-10],灌溉对作物影响机制的研究也较多[11],但对CO2加富及灌溉共同作用对菜豆产生的影响研究相对还较少。
本研究采用盆栽试验,探究在CO2加富环境下不同灌溉次数对菜豆各时期生长发育及光合特性的影响,旨在为全面了解设施菜豆栽培提供一定的理论依据。
1 材料和方法
1.1 试验地概况
试验在山西农业大学园艺站温室中进行。该地点位于山西省晋中市太谷县(37.42°N,112.58°E),栽培基质为田园土与草炭按3∶1比例加珍珠岩混合配制。田园土及混合基质的基本理化性质如表1所示。
表1 供试土壤基本理化性质
Tab.1 Basic properties of soil tested
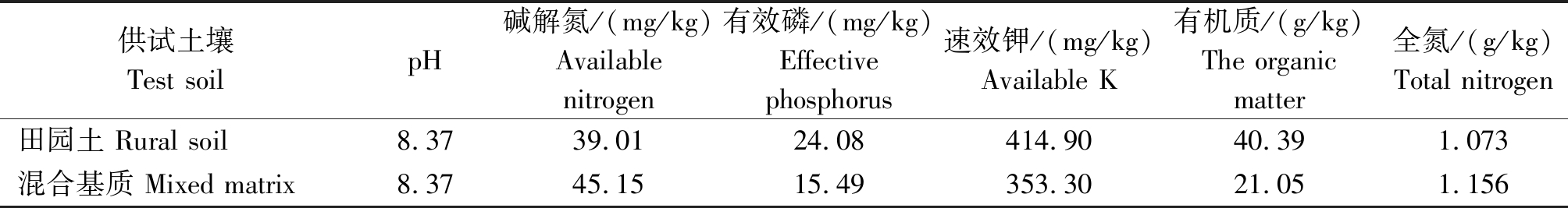
供试土壤Test soilpH碱解氮/(mg/kg)Available nitrogen有效磷/(mg/kg)Effective phosphorus速效钾/(mg/kg)Available K有机质/(g/kg)The organic matter全氮/(g/kg)Total nitrogen田园土 Rural soil8.3739.0124.08414.9040.391.073混合基质 Mixed matrix8.3745.1515.49353.3021.051.156
1.2 供试材料
供试菜豆品种为超早一尺秀,由太原市乐丰园种业有限公司提供。
1.3 试验设计
采用盆栽试验,每盆播种3穴,每穴3粒。出苗后待幼苗长至三叶期,将每穴定苗2株,常规田间管理。试验处理为2个CO2浓度水平:(390±20)μmol/mol(C390,为正常大气浓度作为CK),(800±50) μmol/mol(C800);2个灌溉水平:全生育期灌溉12次(W12),全生育期灌溉18次(W18),单次灌溉量均达到田间持水量的80%。4个处理分别为C390W12、C390W18、C800W12、C800W18,每处理5盆,3次重复,共计60盆。
试验温室中间位置用塑料薄膜隔开,分成2个相对独立的隔间,富碳环境以高压CO2钢瓶为碳源,智能自动控制释放系统于每天6:00准时向隔间中上部释放CO2,当温室内温度高于35 ℃时手动停止释放,在此期间温室内CO2浓度始终维持在设定值。
1.4 测定指标及方法
1.4.1 农艺性状测定 在菜豆各生育期测定农艺性状,采用卷尺测定主干根部到生长点的高度,即为株高;采用游标卡尺测定地面以上1 cm处量茎粗;取自植株由上至下第3片完全展开的叶片测定叶面积;将植株于110 ℃杀青30 min,80 ℃烘干48 h,至恒质量时进行称量,即为干质量。
1.4.2 光合相关指标测定 于晴天9:00-11:00在自然光照条件下用Li-6400XT光合仪测定菜豆叶片各生育期净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)。叶绿素含量的测定采用80%丙酮直接浸提法,在645,663,652 nm下比色测定。剪下结荚期的新鲜叶片,并立即置于液氮中,带回实验室后按照ELISA试剂盒说明书(北京索莱宝科技有限公司提供)测定碳酸酐酶(CA)、核酮糖-1,5-二磷酸羧化酶(Rubisco)、果糖-1,6-二磷酸酶(FBP)、景天庚酮糖-1,7-二磷酸酶(SBP)的活性。每处理3次重复,每重复取样2株。
1.5 数据处理与分析
采用Microsoft Excel 2013软件对数据进行处理和作图,采用SPSS 20.0和SAS 9.0软件进行统计分析。
2 结果与分析
2.1 CO2加富和不同灌溉次数对菜豆农艺性状的影响
由图1可知,菜豆的株高、茎粗、叶面积、干质量在整个发育过程中逐渐增加。CO2加富与水分协同对苗期的株高、茎粗以及开花期的干质量影响显著,并且株高、茎粗、叶面积在开花期之后增幅减小;在CO2加富下,苗期C800W18处理相比C800W12处理茎粗、叶面积分别降低5.0%和36.7%,结荚期C800W18处理相比C800W12处理株高降低1.4%,但差异不显著,其余指标在不同生育时期均随灌溉次数的增加而呈上升趋势。在灌溉次数一定时,C800W18处理的茎粗、叶面积、干质量在不同生育时期均大于C390W18处理,开花期C800W18处理的干质量相比C390W18处理提高了54.5%,且差异达显著水平;开花期C800W12处理的叶面积相比C390W12处理降低3.2%,其余指标在不同生育时期均随CO2浓度的升高而呈上升趋势。
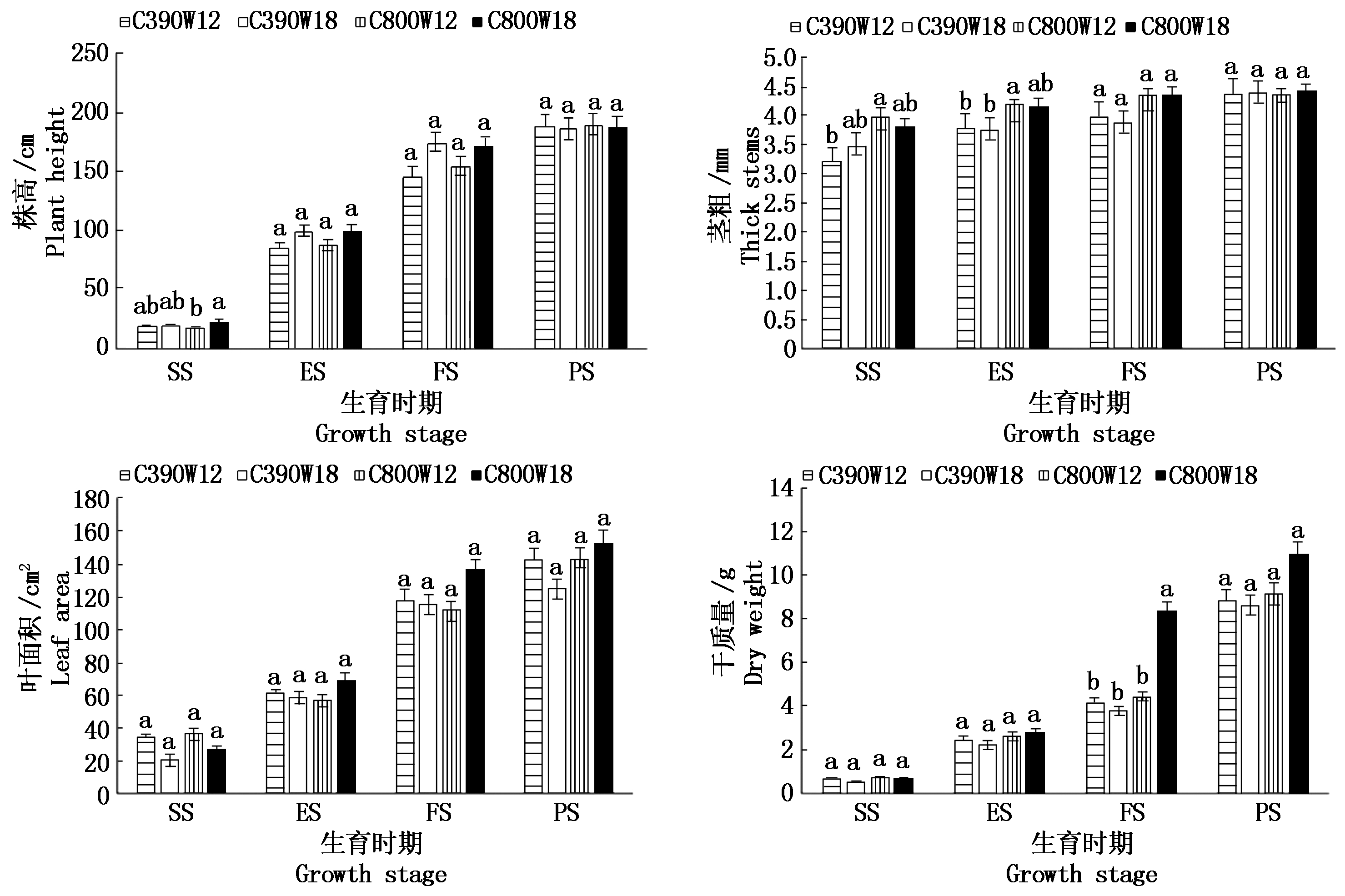
SS.苗期;ES.伸蔓期;FS.开花期;PS.结荚期。不同小写字母表示同一时期不同处理在0.05水平差异显著。图2同。 SS. Seedling stage; ES. Extension stage; FS. Flowering stage; PS.Podding stage. Different smaller letters mean significantly difference at 0.05 level in different treatments in the same period.The same as Fig.2.
图1 不同水碳组合对菜豆不同生育时期农艺性状的影响
Fig.1 Effects of different water and carbon combinations on agronomic trait in different growth stages of kidney bean
2.2 CO2加富和不同灌溉次数对菜豆光合指标的影响
2.2.1 CO2加富和灌溉变化对菜豆不同生育时期净光合速率(Pn)的影响 净光合速率(Pn)大小直接反映叶片功能和植株的生育状况。由表2可知,不同生育时期菜豆植株叶片净光合速率存在差异,CO2加富后菜豆植株的净光合速率高于正常大气环境。苗期各处理表现为C800W18>C390W18>C800W12>C390W12;在伸蔓期、结荚期各处理净光合速率大小表现为C800W18>C800W12>C390W18>C390W12;开花期各处理净光合速率大小表现为C800W18>C800W12>C390W12>C390W18。C800W18处理的Pn始终最大,表明CO2加富和增加灌溉次数可以提高净光合速率。无论是CO2加富环境还是正常大气环境,净光合速率随着生育期的推进都表现出先增加后降低的趋势。净光合速率在伸蔓期时CO2水平与灌溉水平作为主效应作用极显著,在开花期时CO2水平作为主因素影响极显著。
表2 不同水碳组合对菜豆不同生育时期净光合速率的影响
Tab.2 Effects of different water and carbon combinations on net photosynthetic rate in different growth stages of kidney bean μmol/(m2·s)
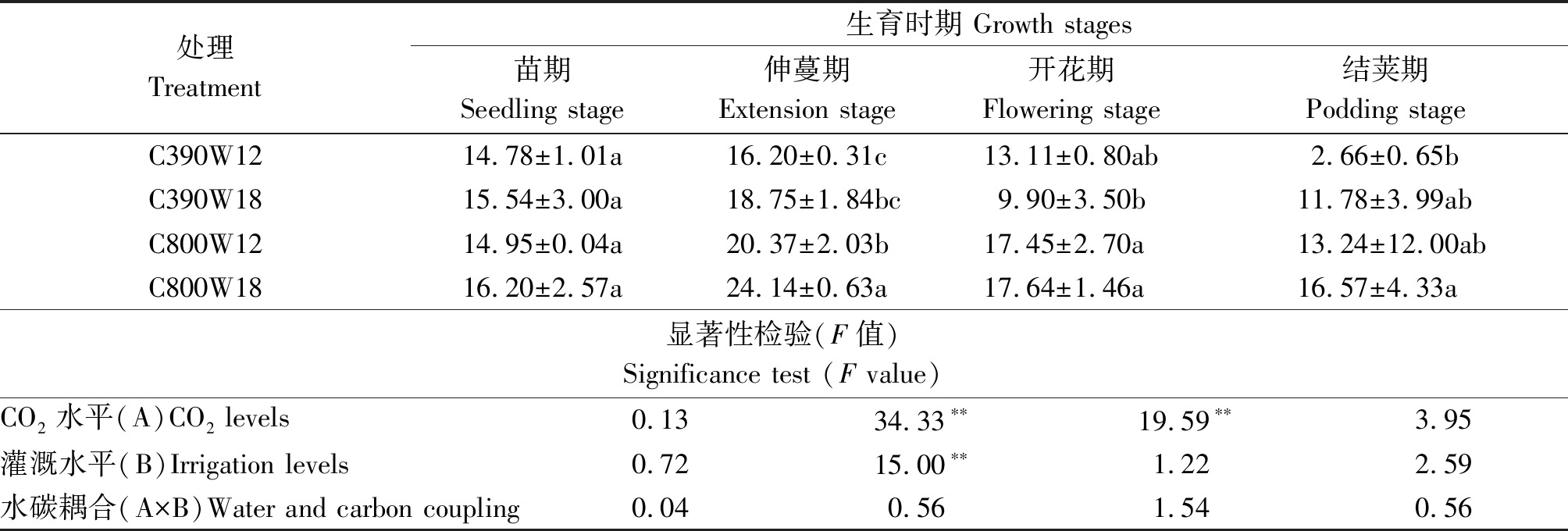
处理Treatment生育时期 Growth stages苗期Seedling stage伸蔓期Extension stage开花期Flowering stage结荚期Podding stageC390W1214.78±1.01a16.20±0.31c13.11±0.80ab2.66±0.65bC390W1815.54±3.00a18.75±1.84bc 9.90±3.50b11.78±3.99abC800W1214.95±0.04a20.37±2.03b17.45±2.70a13.24±12.00abC800W1816.20±2.57a24.14±0.63a17.64±1.46a16.57±4.33a显著性检验(F值)Significance test (F value)CO2水平(A)CO2 levels 0.1334.33∗∗19.59∗∗3.95灌溉水平(B)Irrigation levels0.7215.00∗∗1.222.59水碳耦合(A×B)Water and carbon coupling0.040.561.540.56
注:表中数据为平均值±标准误;不同小写字母表示同一时期不同处理在0.05水平差异显著;*、**分别表示方差分析结果在0.05,0.01水平显著。表3-7同。
Note:Results stand for means±standard errors; Different smaller letters mean significantly difference at 0.05 level in different treatments in the same period;*,** represents the significantly result at 0.05, 0.01 level, respectively. The same as Tab.3-7.
2.2.2 CO2加富和不同灌溉次数对菜豆各生育期胞间CO2浓度(Ci)的影响 CO2是植物进行光合作用的主要原料,胞间CO2浓度高,说明其光合能力弱、消耗CO2量少,不利于同化物的积累。由表3可知,在苗期各处理胞间CO2浓度大小表现为C800W12>C390W12>C800W18>C390W18,表明增加灌溉次数后胞间CO2浓度降低;伸蔓期、开花期各处理胞间CO2浓度大小表现为C800W18>C800W12>C390W18>C390W12;结荚期各处理胞间CO2浓度大小表现为C800W12>C800W18>C390W18>C390W12,CO2加富使胞间CO2浓度升高。CO2加富对C800W12、C800W18处理除苗期外的其他生育时期胞间CO2浓度影响较大,这2组处理相对于C390W12、C390W18数据变化幅度较大。胞间CO2浓度在苗期时灌溉水平影响极显著;在伸蔓期时,CO2水平与灌溉水平作为主效应影响极显著并具有极显著交互作用,表现为CO2水平>灌溉水平>水碳耦合;在开花期,CO2水平作为主因素影响极显著。在结荚期,CO2水平作为主因素影响显著。
表3 不同水碳组合对菜豆各生育期胞间CO2浓度的影响
Tab.3 Effects of different water and carbon combinations on intercellular CO2 concentration in different growth stages of kidney bean μmol/mol
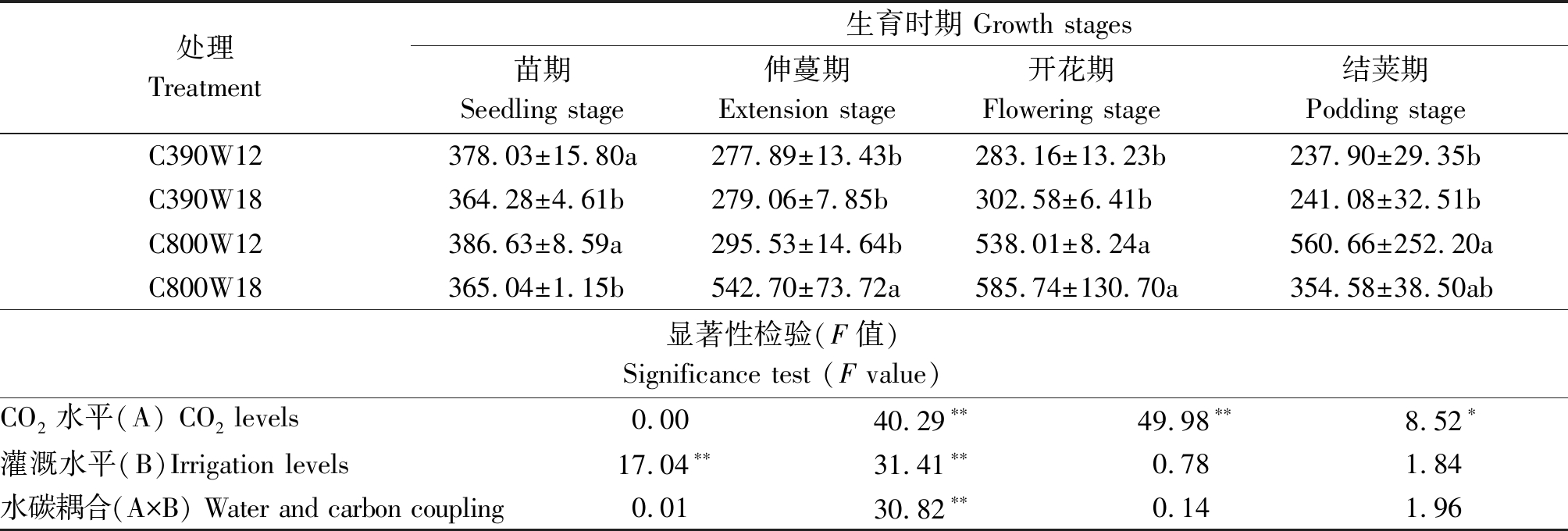
处理Treatment生育时期 Growth stages苗期Seedling stage伸蔓期Extension stage开花期Flowering stage结荚期Podding stageC390W12378.03±15.80a277.89±13.43b283.16±13.23b237.90±29.35bC390W18364.28±4.61b279.06±7.85b302.58±6.41b241.08±32.51bC800W12386.63±8.59a295.53±14.64b538.01±8.24a560.66±252.20aC800W18365.04±1.15b542.70±73.72a585.74±130.70a354.58±38.50ab显著性检验(F值)Significance test (F value)CO2水平(A) CO2 levels0.0040.29∗∗49.98∗∗8.52∗灌溉水平(B)Irrigation levels17.04∗∗31.41∗∗0.781.84水碳耦合(A×B) Water and carbon coupling0.0130.82∗∗0.141.96
2.2.3 CO2加富和不同灌溉次数对菜豆不同生育时期气孔导度(Gs)的影响 气孔的开闭会影响植物的蒸腾及光合生理过程,气孔导度是决定气体交换量和水分蒸腾量的重要指标。由表4可知,菜豆植株各处理的气孔导度在整个生育期整体呈下降趋势。苗期各处理气孔导度大小表现为C800W12>C390W12>C800W18>C390W18,但无显著性差异,表明苗期灌溉次数越多气孔导度越小;伸蔓期各处理气孔导度大小表现为C800W12>C390W18>C390W12>C800W18,开花期各处理气孔导度大小表现为C800W18>C390W12>C390W18>C800W12,CO2与水分交互作用影响气孔导度;结荚期各处理气孔导度大小表现为C800W18>C390W18>C800W12>C390W12,表明灌溉次数增加气孔导度越大,但差异不显著。在伸蔓期时,灌溉水平作为主效应作用显著,水碳耦合对菜豆作用极显著。
表4 不同水碳组合对菜豆各生育期气孔导度的影响
Tab.4 Effects of different water and carbon combinations on stomatal conductance in different growth stages of kidney bean mol/(m2·s)
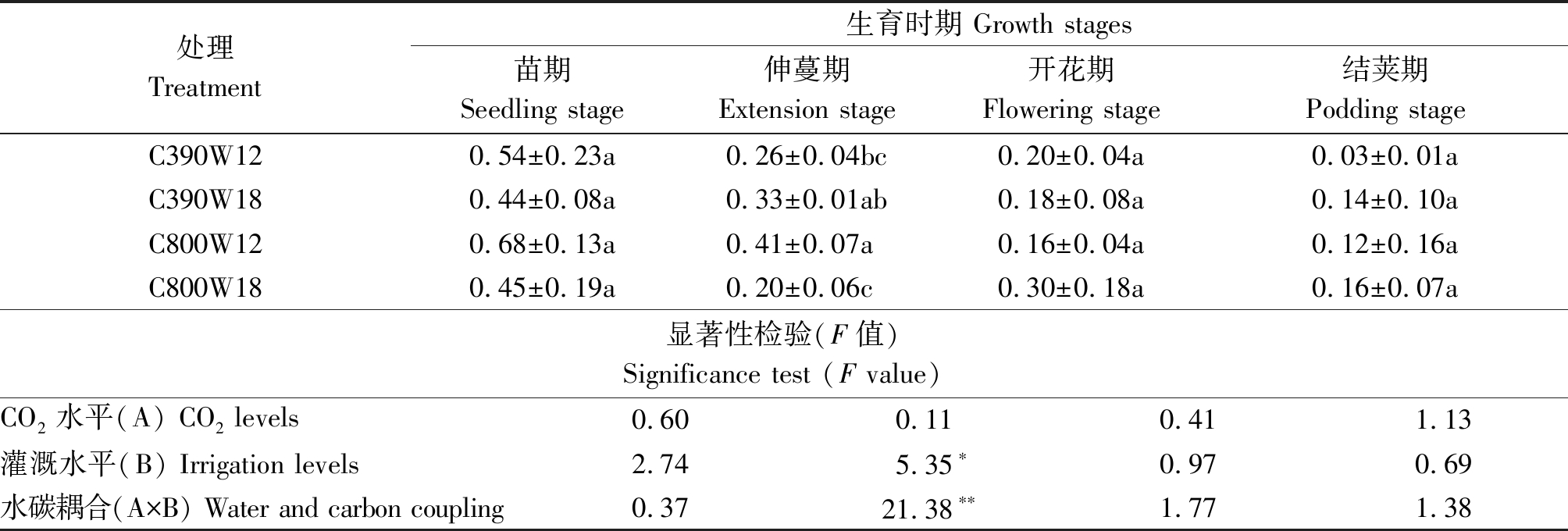
处理Treatment生育时期 Growth stages苗期Seedling stage伸蔓期Extension stage开花期Flowering stage结荚期Podding stageC390W120.54±0.23a0.26±0.04bc0.20±0.04a0.03±0.01aC390W180.44±0.08a0.33±0.01ab0.18±0.08a0.14±0.10aC800W120.68±0.13a0.41±0.07a0.16±0.04a0.12±0.16aC800W180.45±0.19a0.20±0.06c0.30±0.18a0.16±0.07a显著性检验(F值)Significance test (F value)CO2水平(A) CO2 levels0.600.110.411.13灌溉水平(B) Irrigation levels2.745.35∗0.970.69水碳耦合(A×B) Water and carbon coupling0.3721.38∗∗1.771.38
2.2.4 CO2加富和不同灌溉次数对菜豆不同生育时期蒸腾速率(Tr)的影响 蒸腾作用表示植物光合作用叶片的蒸腾失水过程,蒸腾速率是表示水分代谢的重要指标。由表5可知,菜豆植株各处理的蒸腾速率在整个生育期整体呈下降趋势。苗期各处理蒸腾速率大小表现为C800W12>C390W12>C390W18>C800W18,伸蔓期各处理蒸腾速率大小表现为C390W12>C800W12>C390W18>C800W18,灌溉次数越多蒸腾速率越小;开花期各处理蒸腾速率大小表现为C800W18>C390W12>C390W18>C800W12;结荚期各处理蒸腾速率大小表现为C800W18>C390W18>C800W12>C390W12。开花期和结荚期C800W18处理与C800W12处理相比,蒸腾速率提高,且具有显著性差异,表明CO2加富和增加灌溉次数可以提高开花期、结荚期的蒸腾速率。蒸腾速率在结荚期时灌溉水平作为主因素影响显著。
表5 不同水碳组合对菜豆各生育期蒸腾速率的影响
Tab.5 Effects of different water and carbon combinations on transpiration rate in different growth stages of kidney bean mmol/(m2·s)
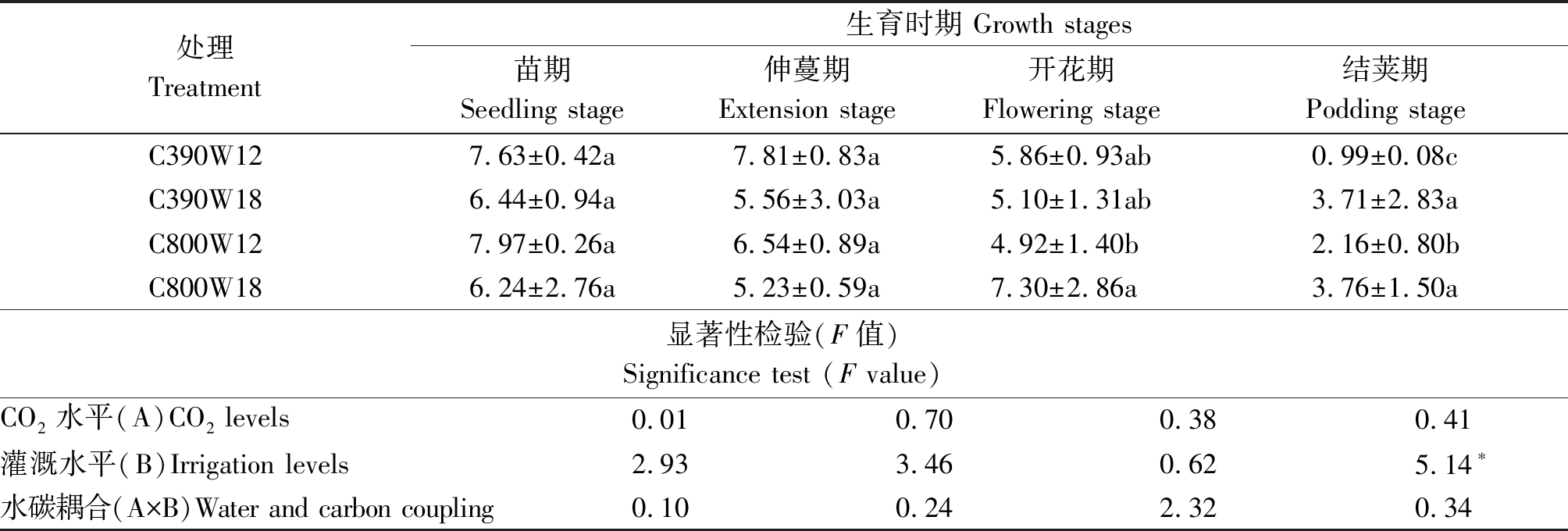
处理Treatment生育时期 Growth stages苗期Seedling stage伸蔓期Extension stage开花期Flowering stage结荚期Podding stageC390W127.63±0.42a7.81±0.83a5.86±0.93ab0.99±0.08cC390W186.44±0.94a5.56±3.03a5.10±1.31ab3.71±2.83aC800W127.97±0.26a6.54±0.89a4.92±1.40b2.16±0.80bC800W186.24±2.76a5.23±0.59a7.30±2.86a3.76±1.50a显著性检验(F值)Significance test (F value)CO2水平(A)CO2 levels0.010.700.380.41灌溉水平(B)Irrigation levels2.933.460.625.14∗水碳耦合(A×B)Water and carbon coupling0.100.242.320.34
2.3 CO2加富和不同灌溉次数对菜豆不同生育时期总叶绿素的影响
由表6可知,在苗期、伸蔓期各处理间的总叶绿素含量差异未达显著水平。在开花期、结荚期,C800W12处理的总叶绿素含量相较C390W12处理分别提高了39.6%和50.9%,C800W18处理总叶绿素含量相较C390W18处理分别提高了53.6%和31.5%,差异均达到显著水平,说明在灌溉次数相同的情况下,CO2加富可以提高开花期、结荚期的叶绿素含量;在开花期CO2浓度一定时,总叶绿素含量C390W18处理较C390W12处理降低,C800W18处理较C800W12处理降低,其他时期则相反。叶绿素在开花期CO2水平作为主因素对其影响极显著,结荚期CO2水平与灌溉水平作为主效应对其影响极显著。
表6 不同水碳组合对菜豆不同生育时期总叶绿素含量的影响
Tab.6 Effects of different water and carbon combinations on total chlorophyll content in different growth stages of kidney bean mg/g
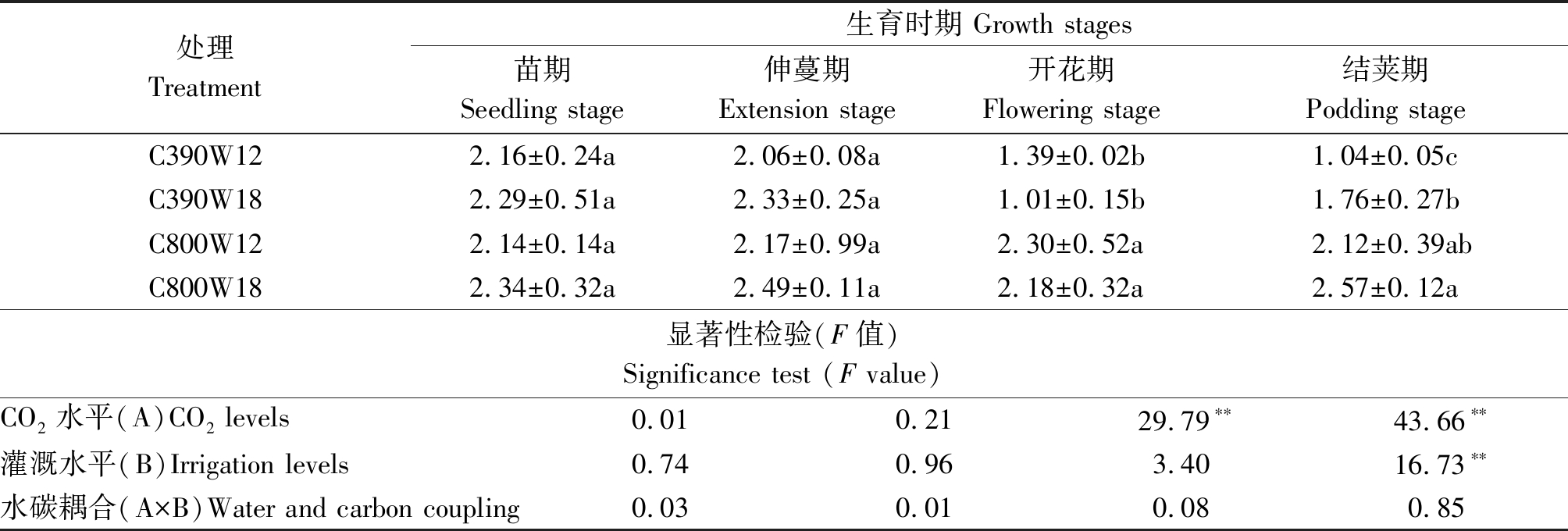
处理Treatment生育时期 Growth stages苗期Seedling stage伸蔓期Extension stage开花期Flowering stage结荚期Podding stageC390W122.16±0.24a2.06±0.08a1.39±0.02b1.04±0.05cC390W182.29±0.51a2.33±0.25a1.01±0.15b1.76±0.27bC800W122.14±0.14a2.17±0.99a2.30±0.52a 2.12±0.39abC800W182.34±0.32a2.49±0.11a2.18±0.32a2.57±0.12a显著性检验(F值)Significance test (F value)CO2水平(A)CO2 levels0.010.2129.79∗∗43.66∗∗灌溉水平(B)Irrigation levels0.740.963.4016.73∗∗水碳耦合(A×B)Water and carbon coupling0.030.010.080.85
2.4 CO2加富和不同灌溉次数对菜豆叶片光合酶的影响
由表7可知,CO2水平与灌溉水平作为主效应对碳酸酐酶(CA)、景天庚酮糖-1,7-二磷酸酶(SBP)影响极显著,水碳耦合对CA作用显著,对SBP作用极显著,对2种酶都表现出CO2水平>灌溉水平>水碳耦合;CO2水平作为主因素对核酮糖-1,5-二磷酸羧化酶(Rubisco)、果糖-1,6-二磷酸酶(FBP)有极显著影响,同时水碳耦合对核酮糖-1,5-二磷酸羧化酶(Rubisco)影响显著。
表7 不同水碳组合对菜豆叶片酶活的双因素方差分析
Tab.7 Table of two-factor anova of different water-carbon combinations on key enzyme activity of carbon assimilation in leaf of kidney bean
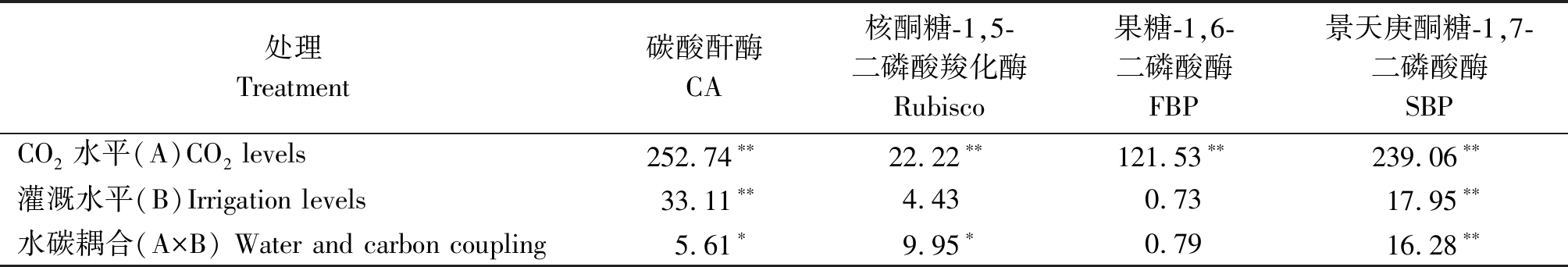
处理Treatment碳酸酐酶CA核酮糖-1,5-二磷酸羧化酶Rubisco果糖-1,6-二磷酸酶FBP景天庚酮糖-1,7-二磷酸酶SBPCO2水平(A)CO2 levels252.74∗∗22.22∗∗121.53∗∗239.06∗∗灌溉水平(B)Irrigation levels33.11∗∗4.430.7317.95∗∗水碳耦合(A×B) Water and carbon coupling5.61∗9.95∗0.7916.28∗∗
2.4.1 核酮糖-1,5-二磷酸羧化酶(Rubisco) Rubisco是植物进行光合作用的关键酶,催化RuBP与CO2结合进行羧化反应。由图2可知,C800W12处理相比C390W12处理Rubisco活性提高了28.8%,且差异达到显著水平;C800W18处理相比C390W18处理Rubisco活性提高了8.7%,但差异未到显著水平,说明在灌溉次数一定时,CO2加富可以提高Rubisco活性;在CO2浓度一定时,C800W18处理较C800W12处理Rubisco活性降低了24.2%,且差异达到显著水平,说明在CO2加富后Rubisco活性在C800W12处理下活性较高。
2.4.2 碳酸酐酶(CA) 碳酸酐酶(CA)可以通过提高羧化酶周围无机碳的浓度增加CO2的固定速率,提高植物光合效率。由图2可知,在灌溉次数一定时,C800W12较C390W12处理、C800W18较C390W18处理CA活性分别提高了47.0%和38.9%,差异显著,说明CO2加富可以提高CA活性;C390W18相比C390W12处理CA活性降低了13.2%,C800W18相比C800W12处理CA活性降低了30.6%,说明CO2浓度一定时,在全生育期灌溉12次CA活性较高。
2.4.3 果糖-1,6-二磷酸酶(FBP) 果糖-1,6-二磷酸酶(FBP)在光合作用同化物蔗糖的合成中起关键作用。由图2可知,在C800W12较C390W12处理,C800W18较C390W18处理FBP活性分别提高了29.8%和26.7%,差异显著,说明CO2加富可以提高FBP酶活性;C390W18与C390W12处理相比FBP活性升高10.0%,C800W18与C800W12处理相比FBP活性升高了5.6%,差异不显著,说明CO2浓度一定时,灌溉水平对酶活性影响不大。
2.4.4 景天庚酮糖-1,7-二磷酸酶(SBP) 景天庚酮糖-1,7-二磷酸酶(SBP)对维持Calvin循环以及碳源的流通具有重要的作用。由图2可知,C800W12相比C390W12处理,C800W18相比C390W18处理SBP活性分别提高36.2%,48.9%,差异显著,说明灌溉次数一定时,CO2加富可以提高SBP活性;C390W18与C390W12处理相比SBP活性未达到显著水平,说明在正常大气浓度下灌溉水平对SBP活性影响不大,而C800W18与C800W12处理SBP活性提高了20.7%,差异达到显著水平,说明CO2加富在全生育期灌溉18次SBP活性升高。

图2 不同水碳组合对菜豆叶片酶活的影响
Fig.2 Effects of different water and carbon combinations on key enzyme activity of carbon assimilation in leaf of kidney bean
3 结论与讨论
3.1 CO2加富和不同灌溉次数对菜豆生长发育的影响
形态指标能够反映植株各生育期生长发育情况。高宇等[12]研究表明,CO2加富可以提高植株的株高、茎粗、叶面积。本试验发现,在CO2加富与水分协同作用下,菜豆植株的各项农艺性状指标随着生长发育进程都呈上升趋势,CO2加富主要影响苗期的株高、茎粗,各处理间的株高、茎粗、叶面积在生长发育后期无显著差异,尤其是在开花期之后,增长幅度较小,说明在开花期与结荚期水碳因子都作用于产品器官的形成,对株高、茎粗、叶面积影响不大;在全生育期灌溉次数相同条件下,CO2对生长发育后期干物质积累影响较大,开花期与结荚期供水较多,这一时期生殖生长逐步加快,干物质累积猛增,在结荚期达到最高,尤其是C800W18处理菜豆植株干物质积累达到最大,这与殷常青等[13]研究结果基本一致。
3.2 CO2加富和不同灌溉次数对菜豆植株光合特性的影响
CO2并非独立地对植物产生影响,温度、光照、水分、矿质营养水平等外在因素等也会作用于植物,其中,CO2浓度与水分对植株影响较大[14]。前人研究发现,高CO2浓度和灌溉互作可以明显提高净光合速率,但长时间高CO2浓度处理存在光合适应现象,光合能力下调[15-16],表明短期CO2加富会使净光合速率增加。本试验中,菜豆苗期灌溉处理作用大于CO2作用,但各处理净光合速率差异均不显著;伸蔓期主要以营养生长为主,净光合速率相较苗期有所增加,且随着CO2加富和灌溉次数增加而增加;开花期是植株营养生长向生殖生长的过渡期,净光合速率有所降低,在此时期,CO2加富有助于净光合速率的提高;结荚期菜豆主要以生殖生长为主,CO2加富和灌溉次数增多,净光合速率提高。
菜豆苗期时温室内温度较低、光照辐射较弱,植株生长对水碳的需求较小,光合能力不强,所以胞间CO2浓度较高;随着生长发育进程的推进,温室内气温不断升高、光照强度增加,光合能力增强,对水分需求增加,胞间CO2浓度降低。有研究表明,长期CO2加富会导致胞间CO2浓度升高,适宜的水分增加会使光合速率提高[16-17]。本试验结果显示,在常规环境条件下不同灌溉次数对菜豆植株伸蔓期-结荚期胞间CO2浓度影响不大,而在CO2加富环境下,C800W12与C800W18相比C390W12处理与C390W18处理在开花期胞间CO2浓度都显著较高。
有研究表明,气孔导度降低是植物对CO2加富的普遍响应,气孔导度降低引起水分由叶片向外排放的阻力增大,导致蒸腾速率降低[18]。短时间的CO2加富会促进植物的光合作用,但是长时间就会产生光合适应现象,造成叶片气孔关闭、气孔开张度减小,最终胞间CO2浓度升高,植物的蒸腾作用降低[19-20]。水分增加对高浓度CO2条件下植株叶片的光合速率具有显著促进作用,并对蒸腾速率和气孔导度的降低有一定补偿效应[21]。本试验研究结果显示,菜豆叶片气孔导度与蒸腾速率随着生长发育进程的推进基本呈下降趋势;CO2加富对各生育期菜豆叶片气孔导度和蒸腾速率影响均不显著,灌溉次数在伸蔓期对气孔导度影响显著且与CO2互作效应极显著,表现为常规CO2浓度时促进而CO2加富后却抑制,在结荚期对蒸腾速率的促进效应显著。
3.3 CO2加富和不同灌溉次数对菜豆植株光合酶活的影响
Calvin循环(也称C3循环)在所有光合生物碳素光合流动过程中作为中心环节起重要作用,其中,碳同化关键酶不可或缺。果糖-1,6-二磷酸酶(FBP)在控制光合速率上起关键作用,当FBP活性降低后,对叶片生长起抑制作用并降低光合能力[22]。FBP活性的强弱也直接影响到光合中间产物的产出,有研究表明,在水分不足的情况下,叶内CO2浓度显著升高,FBP活性会显著下降[23]。本试验中,CO2加富使FBP酶活性显著升高,但在同一CO2处理下,灌水次数的增加对其影响不显著。景天庚酮糖-1,7-二磷酸酶(SBP)的表达对光合能力影响较大,抑制SBP活性同时也会抑制光合效率,且SBP能够提高植株固定CO2的能力,促进光合能力,促进植株生长发育[24]。本研究中,CO2加富可显著提高SBP活性,灌溉次数在仅CO2加富条件下可显著提高SBP活性。
碳酸酐酶(CA)活性可以在很短时间内将![]() 转化成H2O和CO2,弥补水分不足对植物造成的影响。在水分不足情况下,碳酸酐酶的活性升高,有效将CO2转化
转化成H2O和CO2,弥补水分不足对植物造成的影响。在水分不足情况下,碳酸酐酶的活性升高,有效将CO2转化![]() 促进光合作用[25]。本试验研究结果显示,C800W18处理的CA活性小于C800W12处理,表明全生育期灌溉12次对菜豆植株来说可能不足,CA活性升高来应对灌溉不足对菜豆植株的影响。核酮糖-1,5-二磷酸羧化酶(Rubisco)的羧化活性决定着光合作用[26],CO2加富可以提高Rubisco活性[27-28]。李金航等[29]研究发现,长期水分胁迫下的植物叶片中Rubisco含量高于非水分胁迫下叶片中的Rubisco含量,推断出可能是植物对水分不足产生的一种适应性反应,也说明这种作物有耐旱性。本试验研究中CO2加富后Rubisco活性升高,但灌溉次数增多Rubisco活性反而降低,表明菜豆植株可能具有一定的耐旱性,能够适应水分不足带来的影响。
促进光合作用[25]。本试验研究结果显示,C800W18处理的CA活性小于C800W12处理,表明全生育期灌溉12次对菜豆植株来说可能不足,CA活性升高来应对灌溉不足对菜豆植株的影响。核酮糖-1,5-二磷酸羧化酶(Rubisco)的羧化活性决定着光合作用[26],CO2加富可以提高Rubisco活性[27-28]。李金航等[29]研究发现,长期水分胁迫下的植物叶片中Rubisco含量高于非水分胁迫下叶片中的Rubisco含量,推断出可能是植物对水分不足产生的一种适应性反应,也说明这种作物有耐旱性。本试验研究中CO2加富后Rubisco活性升高,但灌溉次数增多Rubisco活性反而降低,表明菜豆植株可能具有一定的耐旱性,能够适应水分不足带来的影响。
3.4 CO2加富和不同灌溉次数对菜豆植株叶片叶绿素的影响
叶绿素是植物叶片的主要光合色素,在光合作用的光能吸收、传递和转化中起不可或缺的作用,其含量是评价植株体生理状况的一项重要指标。高浓度CO2能提高植株叶片的SPAD值,提高光合作用能力[30]。杨小振[31]研究结果显示,在开花坐果期灌溉量的降低能够提高叶绿素含量。本试验结果表明,CO2加富提高了菜豆各时期叶绿素的含量,其中在开花期和结荚期效应达显著水平,而灌溉次数仅在结荚期对菜豆叶绿素含量有显著的促进效应。
综上所述,水碳耦合影响菜豆的生长发育,在不同生育时期水分和CO2各自作为主因素或者二者交互作用对菜豆生长及光合特性产生影响,CO2加富条件下全生育期灌溉18次有利于菜豆生长,但在CO2加富条件下最适宜的灌溉次数还有待进一步探究。
[1] Tissue D T, Lewis J D.Learning from the past: How low CO2 studies inform plant and ecosystem response to future climate change[J]. New Phytologist,2012, 194(1):4-6.doi:10.1111/j.1469-8137.2012.04081.x.
[2] 石耀辉,周广胜,蒋延玲,王慧,许振柱.CO2浓度和降水协同作用对短花针茅生长的影响[J].生态学报,2013,33(14):4478-4485. doi:10.5846/stxb201204160546.
Shi Y H,Zhou G S,Jiang Y L, Wang H, Xu Z Z.Effects of interactive CO2concentration and precipitation on growth characteristics of Stipa breviflora[J].Acta Ecologica Sinica, 2013,33(14):4478-4485.
[3] Xu Z Z,Zhou G S,Wang Y H. Combined effects of elevated CO2 and soil drought on carbon and nitrogen allocationofthe desert shrub Caragana intermedia[J]. Plant and Soil, 2007, 301(1-2):87-97. doi:10.1007/s11104-007-9424-0.
[4] 高素华,郭建平.高CO2浓度条件下小麦、大豆对土壤水分胁迫的响应[J].环境科学学报,2000,20(5):648-650. doi:10.13671/j.hjkxxb.2000.05.030.
Gao S H, Guo J P. The response of winter wheat and soybean to drought stress under the increased CO2concentration[J].Acta Scientiae Circumstantiae, 2000,20(5):648-650.
[5] Onoda Y, Hirose T, Hikosaka K. Effect of elevated CO2levels on leaf starch, nitrogen and photosynthesis of plants growing at three natural CO2 springs in Japan[J]. Ecological Research, 2007, 22(3):475-484. doi:10.1007/s11284-006-0030-z.
[6] 高宇,崔世茂,宋阳,孙世君.CO2加富对温室辣椒幼苗生长及光合特性的影响[J].作物杂志,2017(5):80-84. doi:10.16035/j.issn.1001-7283.2017.05.014.
Gao Y, Cui S M, Song Y, Sun S J. Effects of CO2 enrichment on growth and photosynthetic characteristics of pepperseedings in greenhouse[J]. Crops,2017(5):80-84.
[7] 田琳,谢晓金,包云轩,胡继超,於俐,王金鑫.不同生育期水分胁迫对夏玉米叶片光合生理特性的影响[J].中国农业气象,2013,34(6):655-660. doi:10.3969/j.issn.1000-6362.2013.06.006.
Tian L, Xie X J, Bao Y X, Hu J C, Yu L, Wang J X. Effects of moisture stress on photosynthetic characteristics of summer maise leaf during growth stages[J]. Chinese Journal of Agrometeorology, 2013,34(6):655-660.
[8] 王秋兰,靳鲲鹏,曹晋军. 大气CO2浓度升高对玉米叶片光合生理指标及其产量的影响[J]. 山西农业科学,2018,46(12):2051-2053,2061.doi:10.3969/j.issn.1002-2481.2018.12.21.
Wang Q L, Jin K P, Cao J J.Effects of atmospheric CO2 concentration enhancement on photosynthetic physiological indexes and yield of maize leaves[J]. Journal of Shanxi Agricultural Sciences, 2018,46(12):2051-2053,2061.
[9] 张仟雨,聂磊云,李萍,宗毓铮,董琦,郝兴宇. 大气CO2浓度升高对小白菜生长发育及品质的影响[J]. 山西农业科学,2017,45(3):428-432. doi:10.3969/j.issn.1002-2481.2017.03.27.
Zhang Q Y, Nie L Y, Li P, Zong Y Z, Dong Q, Hao X Y. Effects of elevated CO2 on pakchoi growth and quality[J]. Journal of Shanxi Agricultural Science, 2017,45(3):428-432.
[10] 潘璐,李志鑫,崔世茂,宋阳,杜宪,田露文,白杰. 高温、加富CO2耦合对温室黄瓜光合作用及叶片衰老的影响[J]. 华北农学报,2017,32(3):168-173. doi:10.7668/hbnxb.2017.03.026.
Pan L, Li Z X, Cui S M, Song Y, Du X, Tian L W, Bai J.Effect of high temperature and elevated CO2 coupling on photosynthesis and leaf senescence of cucumber in greenhouse[J]. Acta Agriculturae Boreali-Sinica, 2017,32(3):168-173.
[11] 夏璐,赵蕊,王怡针,金海燕,吴锡冬,葛均筑,臧凤艳,李子芳,王金龙. 干旱胁迫对夏玉米光合作用和叶绿素荧光特性的影响[J]. 华北农学报,2019,34(3):102-110.doi: 10.7668/hbnxb.201751385.
Xia L, Zhao R, Wang Y Z, Jin H Y, Wu X D, Ge J Z, Zang F Y, Li Z F, Wang J L.Effects of drought stress on photosynthesis and chlorophyll fluorescence characteristics of summer maize[J]. Acta Agriculturae Boreali-Sinica, 2019,34(3):102-110.
[12] 高宇,崔世茂,宋阳,孙世军.CO2加富对番茄幼苗生长及光合特性的影响[J].江苏农业科学,2018,46(24):147-149.doi:10.15889/j.issn.1002-1302.2018.24.039.
Gao Y, Cui S M, Song Y, Sun S J. Impacts of CO2enrichment on growth and photosynthetic characteristics of tomato seedings[J]. Jiangsu Agricultural Sciences, 2018,46(24):147-149.
[13] 殷常青,费良军,刘利华,代智光,刘乐,汪爱科.水肥耦合效应对设施豇豆生理特性的影响[J].排灌机械工程学报,2018,36(3):267-276. doi:10.3969/j.issn.1674-8530.16.0226.
Yin C Q, Fei L J, Liu L H, Dai Z G, Liu L, Wang A K. Effects of water-fertilizer coupling on physiological characteristics of facility planting cowpea[J]. Journal of Drainage and Irrigation Machinery Engineering, 2018,36(3):267-276.
[14] 孟凡超,张佳华,姚凤梅.CO2加富和降水增加协同作用对玉米产量及生长发育的影响[J].植物生态学报,2014,38(10):1064-1073. doi:10.3724/SP.J.1258.2014.00100.
Meng F C,Zhang J H,Yao F M. Interactive effects of elevated CO2 concentration and increasing precipitation on yield and growth development in maize[J]. Chinese Journal of Plant Ecology, 2014,38(10):1064-1073.
[15] 王慧,周广胜,蒋延玲,石耀辉,许振柱.降水与CO2浓度协同作用对短花针茅光合特性的影响[J].植物生态学报,2012,36(7): 597-606. doi:10.3724/SP.J.1258.2012.00597.
Wang H, Zhou G S, Jiang Y L, Shi Y H, Xu Z Z. Interactive effects of changing precipitation and elevated CO2 concentration on photosynthetic parameters of Stipabreviflora[J]. Chinese Journal of Plant Ecology, 2012,36(7):597-606.
[16] 杨志刚.长期CO2加富对温室辣椒结果期生长的影响及生理基础研究[D].呼和浩特:内蒙古农业大学,2016.
Yang Z G. Effects of long-time CO2enrichment on the growth of pepper in greenhouse during fruiting and its physiological basis[D].Hohhot:Inner Mongolia University of Technology, 2016.
[17] 林祥磊,许振柱,王玉辉,周广胜.羊草(Leymus chinensis)叶片光合参数对干旱与复水的响应机理与模拟[J].生态学报,2008,28(10): 4718-4724. doi:10.3321/j.issn:1000-0933.2008.10.012.
Lin X L, Xu Z Z, Wang Y H, Zhou G S. Modeling the responses of leaf photosynthetic parameters of Leymuschinensis to drought and rewatering[J]. Acta Ecologica Sinica, 2008,28(10):4718-4724.
[18] 杨惠敏,王根轩.干旱和CO2浓度升高对干旱区春小麦气孔密度及分布的影响[J].植物生态学报,2001,25(3):312-316.doi:10.1088/0256-307X/18/11/313.
Yang H M, Wang G X. Leaf stomatal densities and distribution in Tricum aestivum under drought and CO2enrichment[J]. Chinese Journal of Plant Ecology, 2001,25(3): 312-316.
[19] 张振贤,程智慧.高级蔬菜生理学[M].北京:中国农业大学出版社,2008: 28-34.
Zhang Z X, Cheng Z H. Advanced vegetable physiology[M]. Beijing: China Agricultural University Press, 2008:28-34.
[20] 刘丽娜.CO2加富对红掌光合作用及生长发育的影响[D].广州:华南师范大学,2004. doi:10.7666/d.y594812.
Liu L N. Effects of CO2enrichment on photosynthesis and growth of anthurium[D].Guangzhou: South China Normal University, 2004.
[21] 种培芳,詹瑾,贾向阳,李毅.模拟CO2浓度升高及降雨变化对荒漠灌木红砂光合及生长的影响[J].林业科学,2018,54(9):27-37.doi:10.11707/j.1001-7488.20180904.
Zhong P F, Zhan J, Jia X Y, Li Y. Influence of elevated CO2 and precipitation regimes on photosynthesis and growth of desert shrub Reaumuria soongarica[J].Scientia Silvae Sinicae, 2018,54(9):27-37.
[22] 孙得壬,田丰,张静雅,陈贵松,郭蔼光,徐虹.小麦苗期对非生物胁迫的响应及叶绿体果糖-1,6-二磷酸醛缩酶基因的表达分析[J].麦类作物学报,2013,33(4):739-745. doi:10.7606/j.issn.1009-1041.2013.04.021.
Sun D R,Tian F,Zhang J Y, Chen G S, Guo A G, Xu H. The response of wheat seedlings to abiotic stress and the expression of chloroplast fructose-1,6-bisphosphate aldolase gene[J]. Journal of Triticeae Crops, 2013, 33(4):739-745.
[23] 刘艳,王丽雪,王有年.水分胁迫对苹果叶片叶绿体1.6-二磷酸果糖磷酸酯酶活性的影响[J].内蒙古农业大学学报(自然科学版),2002,23(4):42-45. doi:10.3969/j.issn.1009-3575.2002.04.010.
Liu Y, Wang L X,Wang Y N. The effects of active FBP enzyme in chloroplast under water stress on apple tree leaves[J]. Journal of Inner Mongolia Agricultural University (Natural Science Edition), 2002,23(4):42-45.
[24] 袁传忠,韩雪娟,李轶群,莫瑶瑶,郭方月,李卫国,盖英萍,冀宪领.桑树景天庚酮糖-1,7-二磷酸酶基因的遗传转化及生物学功能分析[J].蚕业科学,2013,39(3):413-419.doi:10.13441/j.cnki.cykx.2013.03.014.
Yuan C Z, Han X J, Li Y Q, Mo Y Y, Guo F Y, Li W G, Gai Y P, Ji X L. Genetic transformation and biological function analysis of the sedoheptulose-1,7-bisphosphatase gene from Mulberry [J]. Acta Sericologica Sinica, 2013,39(3): 413-419.
[25] 孙卫红,吴秋霞,温新宇,何华纲,吴沿友,丁佳俊,封丽娜.干旱胁迫下番茄叶片碳酸酐酶活性的变化[J].植物生理学报,2015,51(4):424-428. doi:10.13592/j.cnki.ppj.2014.0464.
Sun W H, Wu Q X, Wen X Y, He H G, Wu Y Y, Ding J J, Feng L N. Changes of carbonic anhydrase activities in tomato leaves under drought stress[J]. Plant Physiology Journal, 2015,51(4):424-428.
[26] 何亚飞,李霞,谢寅峰.Rubisco与Rubisco活化酶的分子机理研究进展[J].分子植物育种,2017,15(8):399-405. doi:10.13271/j.mpb.015.003295.
He Y F, Li X, Xie Y F. Advance in molecular mechanisms of rubisco and rubiscoactivase[J]. Molecular Plant Breeding, 2017,15(8):399-405.
[27] 潘璐,刘杰才,李晓静,宋阳,张之为,马立国,崔世茂.高温和加富CO2温室中黄瓜Rubisco和Rubisco活化酶与光合作用的关系[J].园艺学报,2014,41(8):38-48. doi:10.16420/j.issn.0513-353x.2014.08.007.
Pan L, Liu J C, Li X J, Song Y, Zhang Z W, Ma L G, Cui S M. Correlation between Rubisco, Rubisco activase and photosynthesis rate of greenhouse cucumber under the condition of high temperature and elevated CO2[J].Acta Horticulturae Sinica,2014,41(8):38-48.
[28] 杨志刚,崔世茂,胡栓红,马生碧,谢拴玲,廉勇.长期CO2加富对日光温室秋冬茬甜椒光合生理及低温适应性的影响[J].北方园艺,2017,41(13):84-90. doi:10.11937/bfyy.20164467.
Yang Z H, Cui S M, Hu S H, Ma S B, Xie S L, Lian Y. Effect of CO2 enrichment on photosynthesis physiology and low temperature resistance of pepper in solar greenhouse at autumn-winter season[J]. Northern Horticulture, 2017,41(13):84-90.
[29] 李金航,齐秀慧,徐程扬,王畅,刘海轩,孙鹏. 黄栌幼苗叶片气体交换对干旱胁迫的短期响应[J]. 林业科学,2015,51(1):29-41. doi: 10.11707/j.1001-7488. 20150104.
Li J H, Qi X H, Xu C Y, Wang C, Liu H X, Sun P. Short-term responses of leaf gas exchange characteristics to drought stress of Cotinus coggygria seedlings[J]. Scientia Silvae Sinicae,2015,51(1):29-41.
[30] 熊珺,曲英华,范冰琳,张淦,杨娜娜.不同CO2浓度下番茄苗期及果期的光合特性[J].北方园艺,2015,39(9):6-9. doi:10.11937/bfyy.201509002.
Xiong J, Qu Y H, Fan B L, Zhang G, Yang N N. Effect of different CO2 on tomato photosynthesis in seeding and fruiting[J]. Northern Horticulture, 2015,39(9):6-9.
[31] 杨小振.滴灌条件下大棚西瓜水肥耦合效应研究[D].杨凌:西北农林科技大学,2014.
Yang Z N. Study on the effect of watermelon with coupling of water and fertilizer under drip irrigation in plastic tunnel [D]. Yangling: Northwest A&F University, 2014.