植物在生长发育和产量形成过程中,经常遭遇冷冻、高温、干旱、盐碱、涝害等逆境。当植物处于非生物胁迫时,其体内会产生大量的超氧阴离子![]() 过氧化氢(H2O2)和羟自由基(·OH)等活性氧(ROS)[1],当活性氧水平增高到超出抗氧化系统的清除能力时,ROS会使清除酶活性、抗氧化剂和其他保护物质含量降低,导致整个氧化还原系统的代谢紊乱,损伤生物大分子,从而导致体内代谢失调。同时,ROS积累过多会使膜系统遭受损伤,破坏细胞膜结构,进而引发一系列生理生化代谢的紊乱,严重时导致植物死亡[2-3]。抗坏血酸谷胱甘肽循环(ASA-GSH)是植物抗氧化系统中最重要的防御机制[4]。抗坏血酸过氧化物酶(Ascorbic acid peroxidase,APX)是 ASA-GSH 循环中的一种关键酶,它对抗坏血酸盐具有高度的特异性,并且具有清除电子把 H2O2转化为水的功能,是保护植物细胞免受超氧化物氧化胁迫的重要酶类之一。
过氧化氢(H2O2)和羟自由基(·OH)等活性氧(ROS)[1],当活性氧水平增高到超出抗氧化系统的清除能力时,ROS会使清除酶活性、抗氧化剂和其他保护物质含量降低,导致整个氧化还原系统的代谢紊乱,损伤生物大分子,从而导致体内代谢失调。同时,ROS积累过多会使膜系统遭受损伤,破坏细胞膜结构,进而引发一系列生理生化代谢的紊乱,严重时导致植物死亡[2-3]。抗坏血酸谷胱甘肽循环(ASA-GSH)是植物抗氧化系统中最重要的防御机制[4]。抗坏血酸过氧化物酶(Ascorbic acid peroxidase,APX)是 ASA-GSH 循环中的一种关键酶,它对抗坏血酸盐具有高度的特异性,并且具有清除电子把 H2O2转化为水的功能,是保护植物细胞免受超氧化物氧化胁迫的重要酶类之一。
APX广泛存在于高等植物、真核藻类及某些蓝细菌中[5],由4个亚家族组成,分别涉及叶绿体、线粒体、细胞质和过氧化物酶体基因亚家族成员。有研究证明APX基因在植物响应逆境胁迫中具有重要的作用。李泽琴等[6]通过对植物APX的酶学特征、关键催化部位、基因表达调控分子机制以及对植物非生物逆境胁迫响应的途径和生理功能的研究,揭示了该类酶在多种非生物逆境胁迫应答调控网络中的重要作用。研究人员已在多种植物如拟南芥[7]、玉米[8]、水稻[9]、甘蔗[10]、棉花[11]等中分离到APX基因。多项研究证明,提高植物体内抗氧化酶类活性和增强抗氧化代谢水平是提高植物抗逆性的有效途径之一。孙卫红等[12]发现,通过在烟草中过量表达StAPX基因能够有效清除H2O2,从而提高烟草的抗氧化胁迫能力。郁征宇等[13]通过实时荧光定量分析表明,SoAPX在菠菜各个组织器官中呈组成型表达,并在抗盐、耐寒、抗旱以及抗氧化过程中起到重要作用。
小麦是我国主要的粮食作物之一,但高温、干旱、冷冻和盐碱等非生物胁迫严重影响其品质与产量,因此,提高小麦抵抗逆境的能力显得分外重要。本研究利用生物信息学分析方法,在小麦全基因组中鉴定小麦APX家族成员,对其理化性质、基因结构、保守基序、蛋白质结构及细胞定位进行预测与分析,并构建系统进化树,以分析该基因在不同物种间的进化关系;利用实时荧光定量技术分析TaAPX基因组织表达特异性以及对各种非生物胁迫响应的表达特性,为TaAPX基因的研究提供基础资料,并为提高小麦对逆境胁迫的适应能力提供了一定的理论依据。
1 材料和方法
1.1 植物材料种植与处理
选取小麦品种百农207为试验材料,由河南省粮食作物基因组编辑工程技术研究中心保存。选取饱满度一致的种子播种于苗盆中,以体积比例为1∶1∶3的蛭石、黄土、营养土为基质,置于人工气候室中培养,光周期为16 h光照/8 h黑暗,温度控制在25 ℃(光照) /16 ℃(黑暗),光照强度约为5 000 lx,湿度控制在65%左右。出苗后10 d,选取生长势一致的幼苗,进行环境模拟胁迫,采用10 mmol/L的H2O2处理模拟氧化胁迫,通过添加浓度为200 mmol/L的NaCl溶液模拟盐胁迫环境,通过20% 的 PEG4 000 处理模拟干旱胁迫条件,通过100 μmol/L的ABA处理模拟渗透胁迫条件,调节人工气候培养箱的温度模拟低温胁迫(4 ℃)。分别胁迫0,1,3,6,12,24 h后用无菌剪刀剪取叶片,并用锡箔纸包裹经液氮处理后置于-80 ℃冰箱中保存,备用。
采集田间正常生长的健康小麦植株的幼根、幼叶、茎、叶鞘、茎节、雄蕊和雌蕊样品,用锡箔纸包裹经液氮处理立即于-80 ℃冰箱保存,用于小麦RNA的提取、基因克隆、组织表达模式分析。
1.2 菌株与试剂
DNA凝胶回收试剂盒及质粒小量抽提试剂盒,均购自TIANGEN公司;大肠杆菌(Escherichia coli)DH5α由河南省粮食作物基因组编辑工程技术研究中心提供;RT-qPCR试剂盒(TB Green® Premix Ex TaqTMⅡ(Tli RNaseH Plus))、RNA 提取试剂盒、cDNA合成试剂盒、pMD-19T载体、连接酶、限制性内切酶,均购自TaKaRa生物技术有限公司;DL2000+与DL5000 DNA Marker购自宝生物工程(大连)有限公司。引物由武汉金开瑞生物科技有限公司合成。其余化学试剂均为国产分析纯。
1.3 试验方法
1.3.1 小麦总RNA的提取和反转录 称取0.1 g小麦幼苗的叶片,置于研钵中,迅速在液氮中研磨成粉末,依照TaKaRa试剂盒说明提取样品总RNA。提取后,经1%琼脂糖凝胶电泳检测RNA完整性和核酸蛋白分析仪测定其A260、A280值,检测RNA浓度和纯度。根据TaKaRa公司的PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit反转录试剂盒进行cDNA第一链的合成。
1.3.2 TaAPX基因的扩增 根据GenBank中小麦APX基因(登录号:EF555121)序列,采用Primer 5.0软件设计P1引物对(表1),以小麦叶片cDNA为模板,PCR扩增TaAPX全长序列。PCR扩增反应体系为50 μL,包括10 μL 5×PrimeSTAR GXL Buffer(Mg2+ plus)、4 μL 2.5 mmol/L dNTPs、2 μL 10 μmol/L正向引物、2 μL 10 μmol/L反向引物、1 μL PrimeSTAR GXL DNA polymerase(TaKaRa,R050A)、5 μL cDNA模板和26 μL ddH2O。PCR程序为:94 ℃ 2 min; 94 ℃ 30 s,58 ℃ 1.5 min,32个循环;72 ℃ 7 min。PCR扩增产物经凝胶回收试剂盒回收并与 pMD-19T 载体连接,构建重组质粒转化E.coli DH5α感受态细胞,筛选阳性克隆,送至深圳华大生物技术有限公司测序。
表1 引物序列
Tab.1 Primer sequences
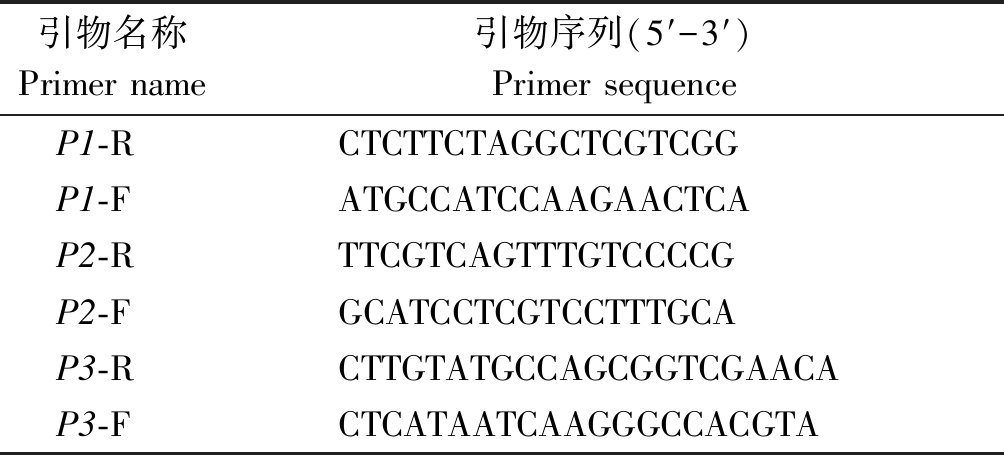
引物名称Primer name引物序列(5′-3′)Primer sequenceP1-RCTCTTCTAGGCTCGTCGGP1-FATGCCATCCAAGAACTCAP2-RTTCGTCAGTTTGTCCCCGP2-FGCATCCTCGTCCTTTGCAP3-RCTTGTATGCCAGCGGTCGAACAP3-FCTCATAATCAAGGGCCACGTA
1.3.3 TaAPX基因的生物信息学分析 利用 NCBI ORF finder确定该基因的开放阅读框;用NCBI的CDS(Find conserved domains)寻找保守区,预测蛋白质家族;利用ProtParam分析TaAPX蛋白质的基本理化性质。运用TMHMM 2.0 Server分析TaAPX跨膜结构;利用ClustralW和DNAMAN软件对不同物种APX蛋白氨基酸序列进行比对与分析,采用Neighbor-joining方法,构建不同生物APX基因系统进化树,用以分析不同物种之间的进化关系。
1.3.4 TaAPX基因表达特性分析 提取小麦百农207幼根、茎、幼叶、茎节、叶鞘、雌蕊、雄蕊的RNA以及不同非生物逆境胁迫不同时间后叶片的RNA,参照1.3.1方法检测RNA浓度和纯度,根据反转录试剂盒进行cDNA第一链的合成,合成后将cDNA质量浓度调至50 μg/μL。依据所克隆的APX基因的编码序列设计定量PCR的引物(P2),以Actin作为内参基因(P3),根据TB Green® Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒进行实时荧光定量PCR(Real-time fluorescent quantitative PCR,qPCR),取384孔PCR板置于冰上,依次加入TB Green Premix Ex Taq Ⅱ 10 μL、PCR Forward Primer 0.8 μL、PCR Reverse Primer 0.8 μL、ROX Reference Dye(50×)0.4 μL、cDNA(50 μg/μL)2 μL、ddH2O 6 μL,共20 μL,尽可能在弱光下配制以上体系。qPCR反应在QuantStudio 7 Flex实时荧光定量PCR仪中进行,扩增标准程序:预变性95 ℃ 2 min;变性95 ℃ 15 s,退火60 ℃ 30 s,40个循环;获取熔解曲线(95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s)。生物学重复和技术重复各3次,利用 Opticon Monitor 2.02软件进行保存和分析,利用2-ΔΔCt方法分析TaAPX基因在小麦不同组织部位的表达水平和逆境胁迫下的表达特性。
1.4 数据处理
用 Excel 2010进行数据处理,所有数据采用SAS 8.0进行方差分析和差异显著性检验。
2 结果与分析
2.1 TaAPX基因的克隆与生物信息学分析
以小麦叶片cDNA为模板,采用PCR进行目的基因扩增,扩增产物经1.0%琼脂糖凝胶电泳,结果显示,扩增得到与目标片段大小一致(约900 bp)的条带(图1)。测序结果表明,该序列全长923 bp。经ORF finder预测,发现该序列具有完整的开放阅读框(Open reading frame,ORF),长876 bp,编码291个氨基酸(图2),将此序列命名为TaAPX。通过ProtParam分析其理化性质,推测TaAPX蛋白的分子式C1417H2246N394O423S5,分子质量为31.73 ku,理论等电点pI为7.74。理论推导其半衰期大约为30 h,不稳定参数为31.14,蛋白质性质稳定,脂肪指数为87.90,总平均亲水性为-0.264,介于-0.5~0.5,推测其可能是两性蛋白,其亲/疏水信号如图3,
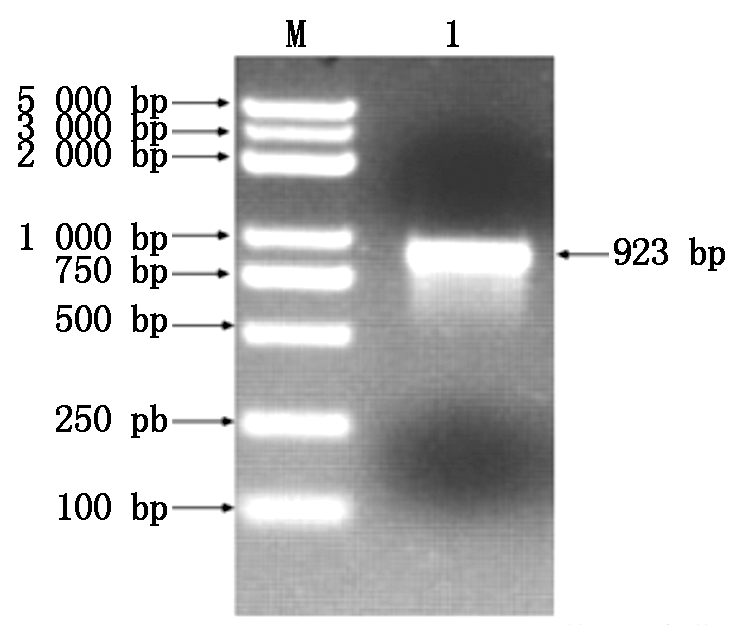
M.DL5000 bp DNA Marker; 1.cDNA的PCR产物。 M.DL5000 bp DNA Marker; 1.PCR product of cDNA.
图1 小麦TaAPX基因的PCR扩增
Fig.1 PCR amplification of wheat TaAPX gene
其中第275位点具有最高分值,为3.167,疏水性最强,第234位点具有最低分值为-2.744,亲水性较强。TaAPX中的酸性氨基酸(Asp+Glu)39个,碱性氨基酸(Arg+Lys)40个。采用SingalP进行信号肽预测显示,APX的氨基酸序列无信号肽位点,属于非分泌性蛋白质。用TMHMM 2.0 Server分析TaAPX跨膜结构,结果显示,TaAPX蛋白序列的第262-284位具有一跨膜区(图4)。对TaAPX蛋白的氨基酸序列用NCBI的CDS(Find conserved domains)寻找保守区(图5),发现其含有APX蛋白家族的保守序列,属于植物类POD超家族。

图2 小麦TaAPX基因开放阅读框序列和其推导的氨基酸序列
Fig.2 ORF sequence and predicted amino acids sequence of TaAPX gene
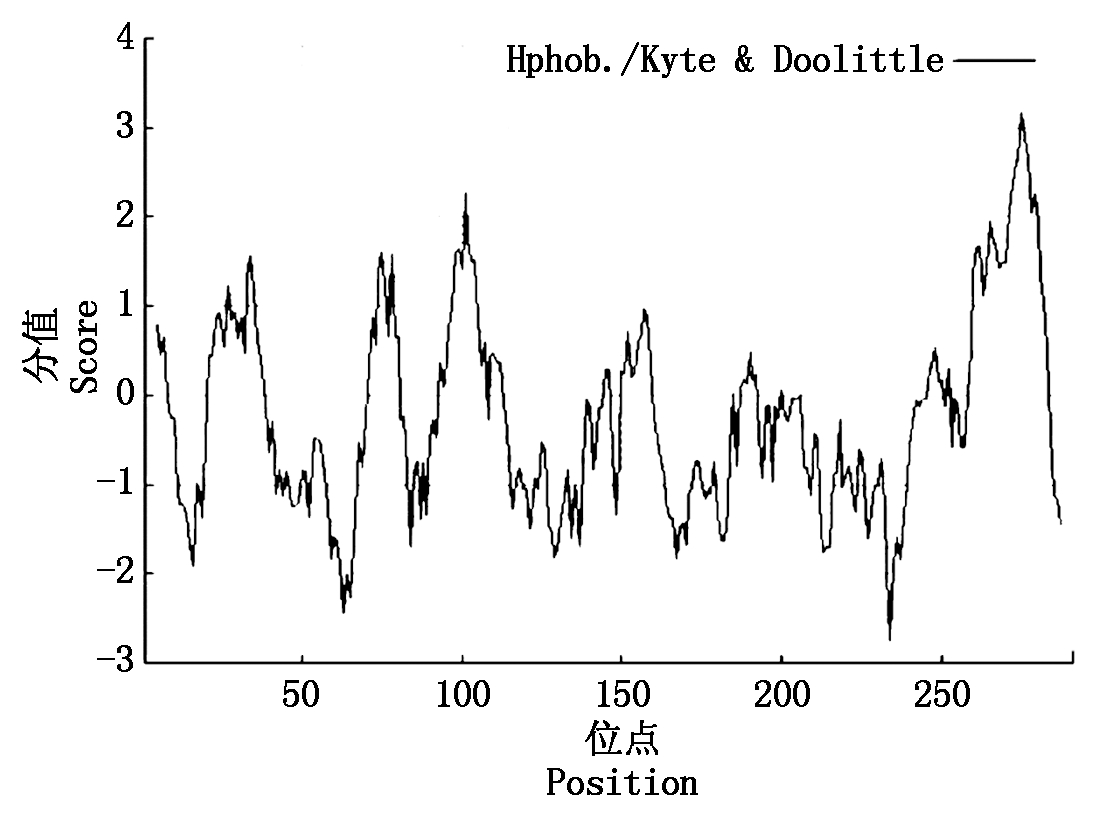
图3 TaAPX蛋白亲疏水性分析
Fig.3 Hydrophilictity/hydrophobicity prediction of TaAPX
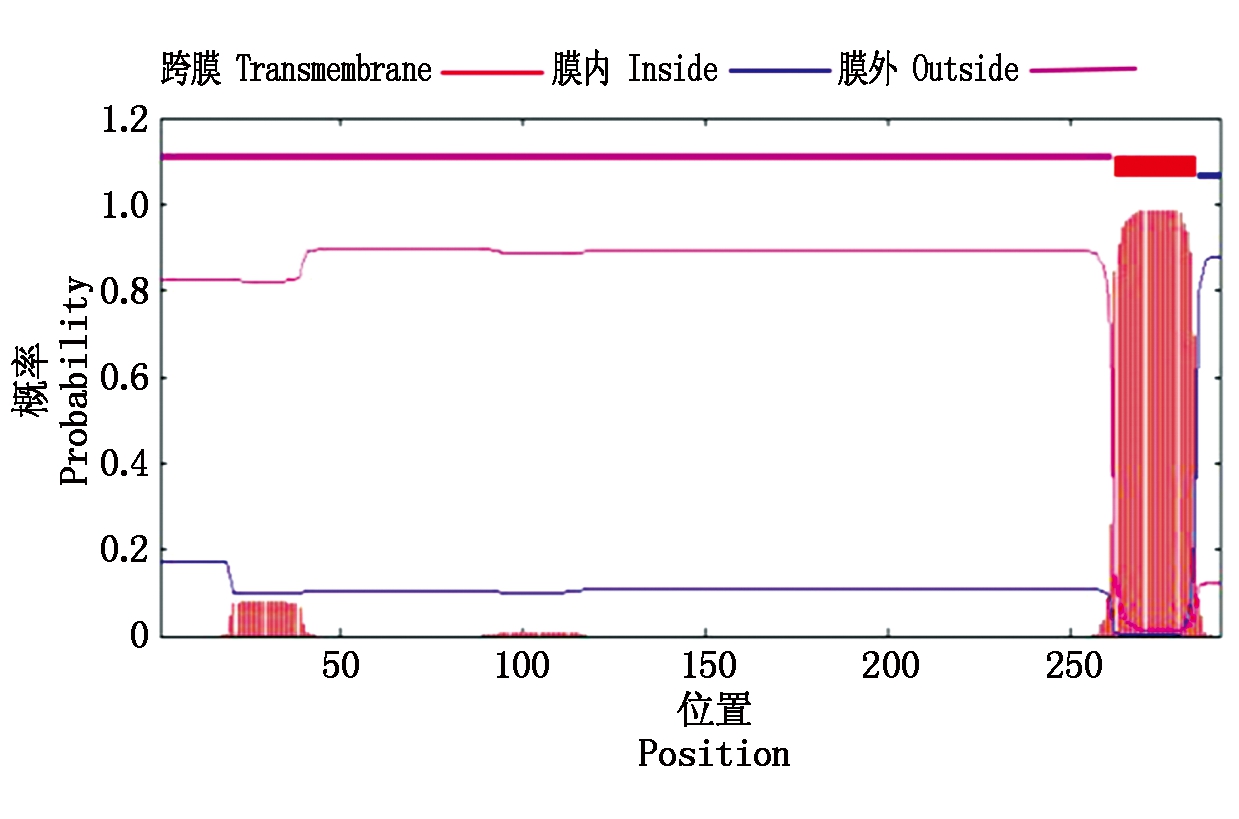
图4 TaAPX蛋白的跨膜区分析
Fig.4 Transmembrane domain prediction of TaAPX
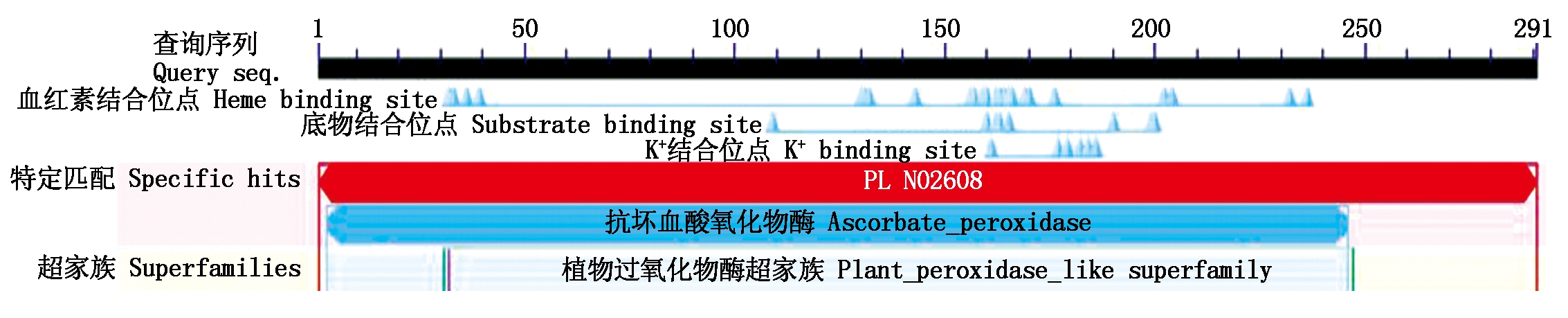
图5 TaAPX蛋白保守区预测
Fig.5 Conserved domain prediction of TaAPX
2.2 TaAPX基因的进化关系分析
将小麦TaAPX基因编码的氨基酸序列进行BlastP比对,发现其与大麦(Hordeum vulgare,AXF50251)、二穗短柄草(Brachypodium distachyon,XP_003574893)、水稻(Oryza sativa,XP_015650808)、玉米(Zea mays,NP_001132505)、谷子(Setaria italica,XP_004974146)、高粱(Sorghum bicolor,XP_002446119)和柑橘(Citrus sinensis,XP_006486751)APX基因编码的氨基酸序列相似性分别为97.25%,93.47%,91.07%,89.69%,89.00%,73.54%和77.66%,说明APX具有较高的保守性(图6)。通过MEGA 5.0中的ClustalW比对,采用Neighbor-joining方法,构建了不同物种APX基因进化树。结果表明,小麦APX基因与大麦亲缘关系最近 (图7) 。

图6 小麦TaAPX编码氨基酸序列与其他物种APX编码氨基酸序列比对
Fig.6 Multiple alignment of amino acid sequences coded by TaAPX and other plant APX
2.3 小麦TaAPX基因在各组织中的表达模式
基于实时荧光定量PCR技术,利用TaAPX基因特异引物进行组织特异性表达分析,分析了TaAPX在小麦幼根、茎、幼叶、茎节、叶鞘、雌蕊、雄蕊不同组织中的相对表达量。以茎的表达量为参照基准,结果表明(图8),小麦TaAPX基因在所检测部位中均有表达,但其表达量差异较大。在幼叶中表达最高,显著高于其他组织(P<0.05);其次是茎、茎节;在幼根、叶鞘中表达量较低,幼叶中的表达量分别是幼根和叶鞘的16.69,37.33倍;在雄蕊和雌蕊中几乎不表达,表达量显著低于幼叶、茎、茎节(P<0.05)。
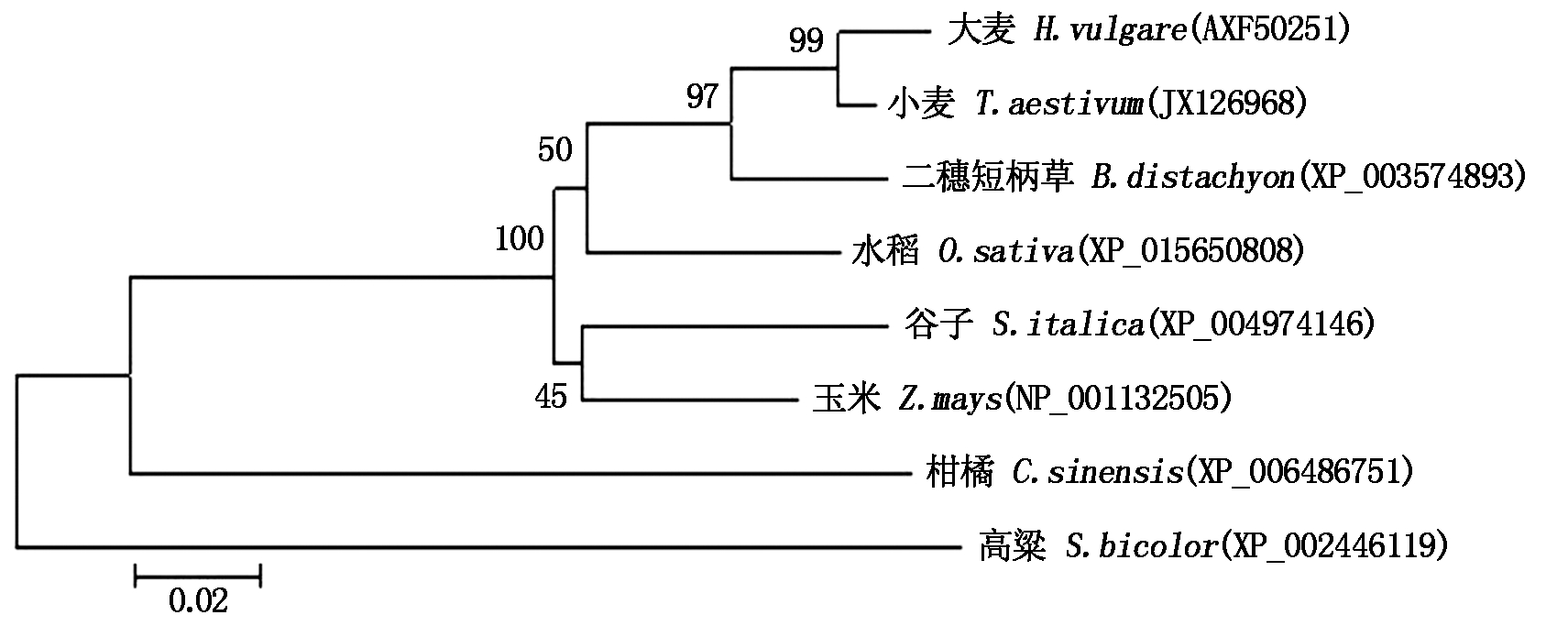
图7 TaAPX基因的遗传进化分析
Fig.7 Phylogenetic analysis of TaAPX
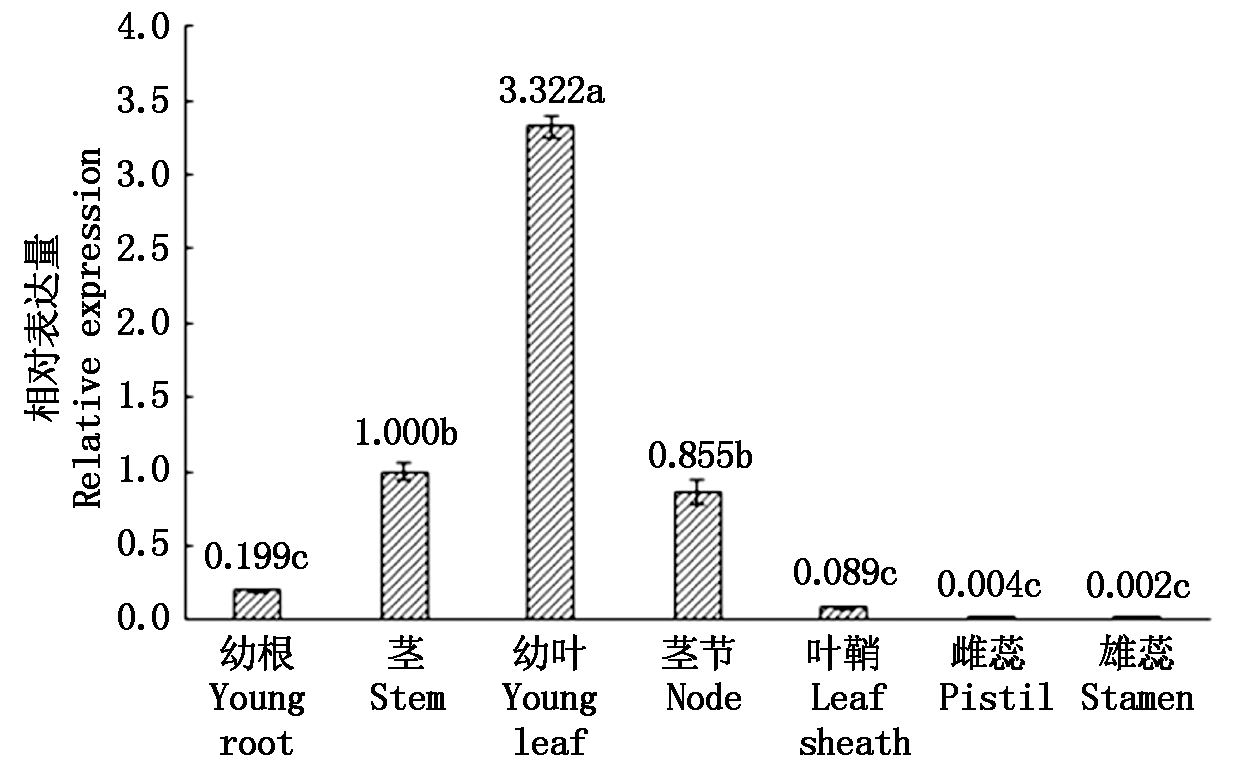
不同字母表示差异显著性(P<0.05)。 Different letters indicate significant differences(P<0.05).
图8 TaAPX基因在小麦不同组织部位的表达分析
Fig.8 Expression analysis of TaAPX gene in different tissues of wheat
2.4 小麦TaAPX基因对非生物胁迫响应的表达分析
采用高盐、干旱、低温、H2O2、ABA等5种非生物胁迫处理小麦,可以较全面地反映TaAPX基因在非生物胁迫中的应答机制。RT-qPCR结果表明(图9),TaAPX基因对以上5种逆境胁迫均有应答,但是表达模式存在明显差异。干旱处理下(图9-A),TaAPX的响应较为强烈,随着胁迫处理时间的延长,TaAPX表达量呈现2次先增高后降低的趋势,并在12 h时表达量达到最高峰,上调到对照组的2.19倍。在低温处理下(图9-B),随着胁迫处理时间的延长,TaAPX基因表达量呈先降低然后增高到最高峰之后降低再增高的趋势,经低温处理1 h后,TaAPX的表达被抑制,处理 3 h 后上调达到高峰,表
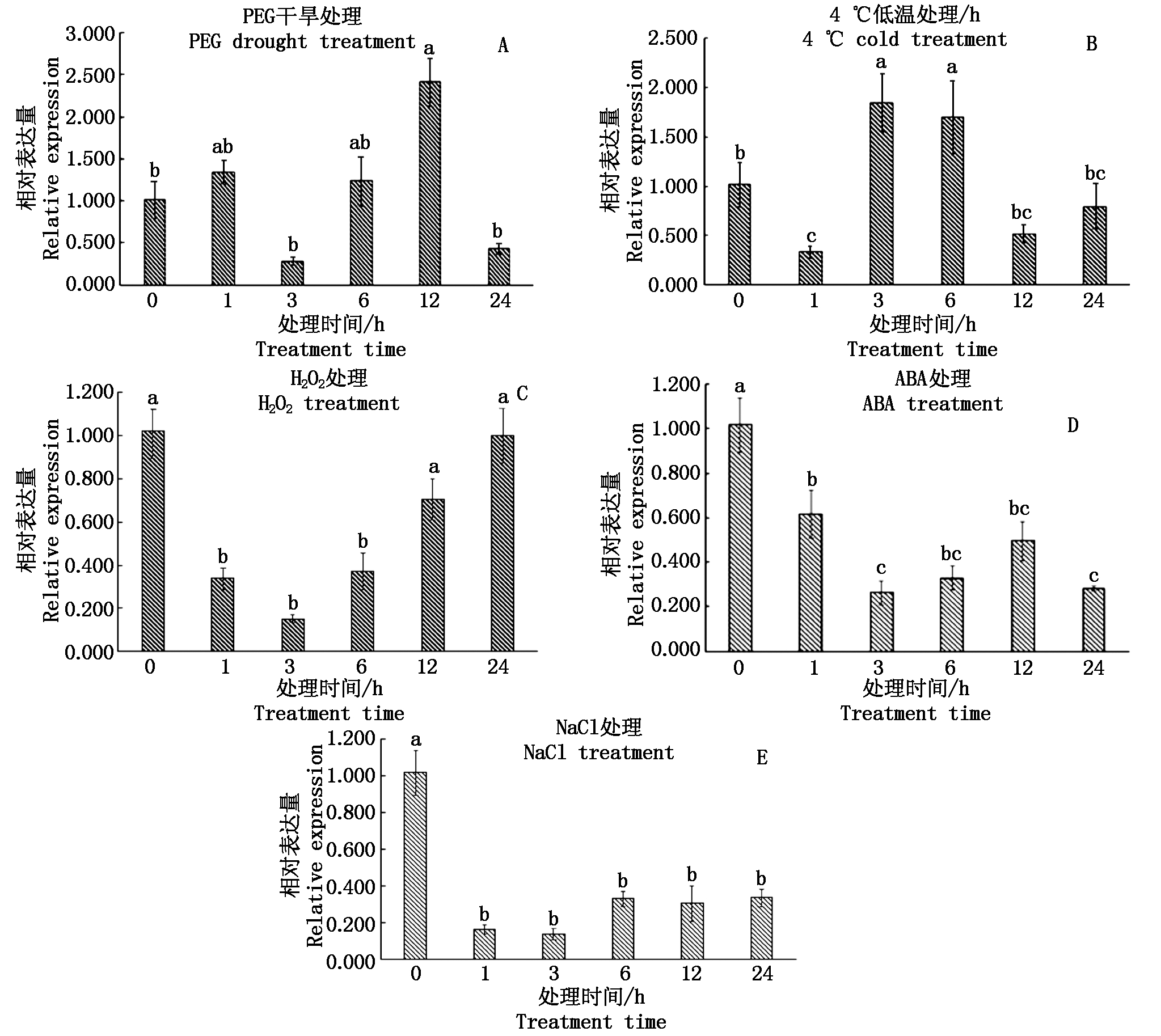
图9 小麦TaAPX基因对非生物胁迫响应的表达分析
Fig.9 Expression analysis of wheat TaAPX gene in response to abiotic stress
达量为对照组的1.81倍,随后又呈下降趋势。在H2O2处理条件下(图9-C),表达量呈先下降然后再上调的趋势。在ABA处理条件下(图9-D),表达量呈现先下调后上调再下调的趋势。在盐胁迫处理下(图9-E),TaAPX基因表达量显著下调,1~24 h基因下调的表达量差异不显著。综上表明,TaAPX基因的表达受干旱、低温等逆境的诱导或抑制,可能与小麦抵御非生物胁迫有密切的关系。
3 结论与讨论
本研究从小麦中分离到一个抗坏血酸过氧化物酶基因TaAPX,开放阅读框长876 bp,编码291个氨基酸。TaAPX氨基酸序列无信号肽位点,推测其为非分泌蛋白,氨基酸序列与大麦相似度达97.25%。TaAPX为组成型表达基因,在小麦各组织中均有表达,但表达量在幼叶最高,雌蕊、雄蕊中最低。在非生物胁迫条件下,尽管TaAPX表达量变化特点存在差异,但表现出对干旱、低温等胁迫的显著性响应。
在盐渍、干旱、高温、低温等逆境条件下,由于细胞代谢过程不协调会导致各种活性氧的升高,从而造成氧化胁迫,并通过脂质过氧化和蛋白质氧化作用损伤DNA 以及其他细胞成分,对植物细胞造成严重的伤害[14]。ROS具有双重功能:一方面适量的活性氧为生物体所必须,作为信号分子参与信号网络调控;另一方面,过量的活性氧对细胞有毒害作用,这些活性氧若不及时清除,会氧化各种细胞组分,导致细胞的破坏[15-16]。因此,平衡细胞内活性氧产生和清除尤为重要,植物会通过酶或非酶机制维系机体活性氧的动态平衡,并在进化过程中形成了完整的抗氧化系统[17]。APX作为清除活性氧的关键组分,具有在非生物胁迫下清除和防御活性氧自由基的功能,增强植物抗性,保护植物细胞免受氧化伤害,在细胞 H2O2 代谢过程中起着至关重要的作用。因此,研究小麦APX基因功能对提高小麦抗非生物胁迫具有现实性意义。
目前,已从玉米、大麦、高粱、烟草、水稻、菠菜、百合等多种植物中分离获得APX基因的cDNA,本研究克隆获得的小麦TaAPX基因开放阅读框为876 bp,编码291个氨基酸。通过氨基酸序列比对及系统进化树分析,TaAPX基因与大麦APX基因编码蛋白的氨基酸全长序列相似性达到97.25%,亲缘关系最近,推测两基因可能在调控植物生长方面的功能比较接近;预测分析显示,TaAPX可能是两性蛋白,无信号肽,为非分泌蛋白,而高粱APX蛋白也不含信号肽,疏水性弱,与TaAPX蛋白氨基酸序列同源性为73.54%,推测两者可能属于APX基因家族具有相同功能的成员[18]。
在大多数禾本科植物中,抗逆基因在各器官中均有表达,但表达模式存在差异,同时非生物胁迫对这些基因的表达有显著性影响[19-23]。本研究结果表明,小麦TaAPX基因在各个组织均有表达。其他研究证明,枸杞APX在根、叶片、叶柄等组织中具有表达特异性,并且在叶中表达量最高[24],菠菜SoAPX2基因在各个组织均有表达,在叶中的表达量比根中高很多[13],与本研究结果一致。小麦中TaAPX基因表达呈现出明显的组织特异性,其在幼叶中的表达量最高,在雌蕊、雄蕊中表达较低。小麦TaAPX应答不同非生物胁迫的表达量分析结果表明,TaAPX对低温、干旱、盐害、ABA、H2O2 等非生物胁迫均有响应,在不同胁迫中呈现不同的响应情况。TaAPX在PEG处理12 h表达量达到最大,之后降低;在低温胁迫3 h表达最强,之后降低,表明TaAPX对低温、干旱响应较为显著。许多研究报道,APX参与多种逆境胁迫,可以提高植物在逆境胁迫条件下的抗性,例如水稻OsAPX8经RNAi沉默后比非转化植物对缺水更敏感,说明APX是抗旱性基因[25-27];在拟南芥APX家族基因中,APX1、APX3、APX5、APX6 对盐、干旱胁迫有显著响应[7];Yan等[28]发现,过表达 AtAPX3 的烟草在适度干旱条件下种子产量增加。说明APX基因在不同作物中行使同样的抗旱功能。在甘薯[29]、番茄[30-31]幼苗中表达APX基因可提高APX的活性,显著增强植株的耐低温和抗寒能力,表明APX基因参与植物响应和耐受低温胁迫;在拟南芥植株中转入大麦 pAPX基因,转基因植株增强了对盐的耐性[32];过量表达 GhAPX 基因提高了中林美荷杨耐盐性[33];过量表达叶绿体APX基因,可提高棉花PSⅡ光化学活性和抗氧化能力[34]。一系列研究证明,APX基因参与多种非生物胁迫环境响应,而本研究结果显示,APX基因对盐胁迫和渗透胁迫响应的表达量较低,可能由于不同作物种类原因,APX基因的功能有不同的针对性,进一步验证APX在不同作物中对非生物逆境胁迫的耐受能力不同。
本研究从小麦中克隆获得TaAPX基因,对进一步研究小麦APX基因生理功能及其相关的抗氧化机理提供了基础。下一步将构建过表达载体和干扰载体,通过转基因进一步研究该基因在小麦抗寒、抗旱、抗氧化等方面中的具体作用。依据该基因相关信息,利用分子育种手段可以提高小麦抗非生物胁迫的能力并进行品种改良。
[1] Mittler R,Vanderauwera S, Suzuki N, Miller G, Tognetti V B, Vandepoele K, Gollery M, Shulaev V,Van Breusegem F. ROS signaling: the new wave?[J]. Trends in Plant Science,2011,16(6):300-309.doi:10.1016/j.tplants.2011.03.007.
[2] 陈露. 小麦抗氧化物质对低温的动态响应及相关基因差异表达分析[D]. 哈尔滨:东北农业大学,2017.
Chen L. Dynamic response of wheat atioxidant to low temperature and differential expression analysis of related genes[D].Harbin:Northeast Agricultural University, 2017.
[3] Zuo L, Zhou T, Pannell B K, Ziegler A C, Best T M. Biological and physiological role of reactive oxygen species-the good, the bad and the ugly[J].Acta Physiologica,2015,214(3):329-348.doi:10.1111/apha.12515.
[4] 乔新荣,张继英. 植物谷胱甘肽过氧化物酶(GPX)研究进展[J]. 生物技术通报,2016,32(9):7-13.doi:10.13560/j.cnki.biotech.bull.1985.2016.09.002.
Qiao X R, Zhang J Y. Research progress on GPX in plants[J]. Biotechnology Bulletin,2016,32(9):7-13.
[5] Shafi A, Gill T, Zahoor I, Ahuja P S, Sreenivasulu Y, Kumar S, Singh A K. Ectopic expression of SOD and APX genes in Arabidopsis alters metabolic pools and genes related to secondary cell wall cellulose biosynthesis and improve salt tolerance[J].Molecular Biology Reports,2019,46(2):1985-2002.doi:10.1007/s11033-019-04648-3.
[6] 李泽琴,李静晓,张根发. 植物抗坏血酸过氧化物酶的表达调控以及对非生物胁迫的耐受作用[J]. 遗传,2013,35(1):45-54.doi:10.3724/SP.J.1005.2013.00045.
Li Z Q, Li J X, Zhang G F. Expression regulation of plant ascorbate peroxidase and its tolerance to abiotic stresses[J]. Hereditas,2013,35(1):45-54.
[7] 李泽琴,李锦涛,邴杰,张根发. 拟南芥APX家族基因在植物生长发育与非生物逆境胁迫响应中的作用分析[J].遗传,2019,41(6):534-549.doi:10.16288/j.yczz.19-026.
Li Z Q, Li J T, Bing J, Zhang G F. The role analysis of APX gene family in the growth and developmental processes and in response to abiotic stresses in Arabidopsis thaliana[J]. Hereditas,2019,41(6):534-549.
[8] Liu Y J, Yuan Y, Liu Y Y, Liu Y, Fu J J, Zheng J, Wang G Y. Gene families of maize glutathione ascorbate redox cycle respond differently to abiotic stresses[J].Journal of Plant Physiology,2011,169(2):183-192. doi:10.1016/j.jplph.2011.08.018.
[9] Maruta T, Sawa Y, Shigeoka S, Ishikawa T. Diversity and evolution of ascorbate peroxidase functions in chloroplasts: More than just a classical antioxidant enzyme? [J]. Plant Cell Physiol, 2016,57(7):1377-1386.doi:10.1093/pcp/pcv203.
[10] 王竹青,陈云,杨玉婷,苏亚春,陈珊珊,吴期滨,许莉萍. 甘蔗抗坏血酸过氧化物酶基因(ScAPX)的克隆及表达分析[J].农业生物技术学报,2015,23(2):170-180.doi:10.3969/j.issn.1674-7968.2015.02.004.
Wang Z Q, Chen Y, Yang Y T, Su Y C, Chen S S, Wu Q B, Xu L P. Cloning and expression analysis of ascorbate peroxidase gene (ScAPX) in sugarcane(Saccharum officinarum) [J]. Journal of Agricultural Biotechnology,2015,23(2):170-180.
[11] 吴文超. 棉花抗旱性评价及抗旱基因GhAPX2的克隆和表达模式分析[D].乌鲁木齐:新疆农业大学,2016.
Wu W C. Evaluation of cotton drought resistant, cloning of GhAPX2 and expression patterns analysis[D].Urumchi:Xinjiang Agricultural University,2016.
[12] 孙卫红,陈相燕,杜斌,宋皖,周越,王云.过量表达番茄类囊体膜抗坏血酸过氧化物酶基因(StAPX)提高了烟草种苗的抗氧化能力[J].植物生理学报,2011,47(6):613-618. doi:10.13592/j.cnki.ppj.2011.06.007.
Sun W H, Chen X Y, Du B, Song W, Zhou Y, Wang Y. Tobacco seedlings overexpressing StAPX enhanced resistance to oxidative stress[J]. Plant Physiology Journal, 2011,47(6):613-618.
[13] 郁征宇,葛晨辉,王小丽,徐晨曦,王全华,蔡晓锋. 菠菜抗坏血酸过氧化物酶基因家族的鉴定及表达分析[J].上海师范大学学报(自然科学版),2018,47(6):664-672.doi:10.3969/J.ISSN.1000-5137.2008.06.005.
Yu Z Y, Ge C H, Wang X L, Xu C X, Wang Q H, Cai X F. Identification and expression analysis of ascorbate peroxidase gene family in spinach[J].Journal of Shanghai Normal University (Natural Sciences),2018,47(6):664-672.
[14] Livak K J, Schmittgen T D. Analysis of relative gene expression data using Real-time quantitative PCR and the 2-ΔΔCT method[J].Methods,2001,25(4):402-408.doi:10.1006/meth.2001.1262.
[15] Davletova S, Rizhsky L, Liang H J, Zhong S Q, Oliver D J, Coutus J, Shulaev V, Schlauch K, Mittler R. Cytosolic ascorbate peroxidase 1 is a central component of the reactive oxygen gene network of Arabidopsis[J]. Plant Cell,2005,17(1): 268-281.doi:10.1105/tpc.104.026971.
[16] Foyer C H, Shigeoka S. Understanding oxidative stress and antioxidant functions to enhance photosynthesis[J]. Plant Physiology,2011,155(1): 93-100.doi:10.1104/pp.110.166181.
[17] Shigeoka S, Ishikawa T, Tamoi M, Miyagawa Y, Takeda T, Yabuta Y, Yoshimura K. Regulation and function of ascorbate peroxidase isoenzymes[J].Journal of Experimental Botany,2002,53(372):1305-1319.doi:10.1093/jexbot/53.372.1305.
[18] 陈国强,孟鹏,刘李黎,陈刚,王萍.高粱抗坏血酸过氧化物酶基因的电子克隆及序列分析[J].生物信息学,2011,9(2):125-130.doi:10.3969/j.issn.1672-5565.2011.02.007.
Chen G Q, Meng P, Liu L L, Chen G, Wang P. In silico cloning and characterization of sorghum APX gene[J]. China Journal of Bioinformatics,2011,9(2):125-130.
[19] 王俊斌,杨文丽,丁博,吴天文,王海凤,谢晓东.小麦TaWRKY71a基因克隆、生物信息学及表达分析[J].华北农学报,2018,33(3):7-13. doi:10.7668/hbnxb.2018.03.002.
Wang J B, Yang W L, Ding B, Wu T W, Wang H F, Xie X D. Cloning, bioinformatics and expression analysis of TaWRKY71a gene in wheat[J].Acta Agriculturae Boreali-Sinica,2018,33(3):7-13.
[20] 袁珍,张鹏钰,王国瑞,曹丽茹,库丽霞,卫丽. 玉米ZmPP2C6-01基因的克隆及表达分析[J].华北农学报,2019,34(2):8-18. doi:10.7668/hbnxb.201751477.
Yuan Z, Zhang P Y, Wang G R, Cao L R, Ku L X, Wei L. Cloning and expression of ZmPP2C6-01 gene in maize[J]. Acta Agriculturae Boreali-Sinica, 2019,34(2):8-18.
[21] 周硕,刘永伟,董福双,杨帆,赵和,柴建芳,吕孟雨,孙果忠,王海波.小麦类钙调素TaCML79基因的克隆和表达分析[J].华北农学报,2016,31(6):1-6. doi:10.7668/hbnxb.2016.06.001.
Zhou S, Liu Y W, Dong F S, Yang F, Zhao H, Chai J F, Lü M Y, Sun G Z, Wang H B. Cloning and expression analysis of TaCML79 in wheat[J]. Acta Agriculturae Boreali-Sinica, 2016,31(6):1-6.
[22] 朱昀,李朝炜,刘颖,魏景芳.小麦VP基因的克隆、生物信息学分析及功能初探[J].河南农业科学,2019,48(2):8-16.doi:10.15933/j.cnki.1004-3268.2019.02.002.
Zhu Y, Li C W, Liu Y, Wei J F. Cloning, bioinformatics analysis and preliminary functional study of wheat VP gene[J].Journal of Henan Agricultural Sciences,2019,48(2):8-16.
[23] 朱素琴,马红,田洋,尹文娟,许浣文,周毅,杨平.玉米ZmGLDH基因的克隆与表达分析[J].河南农业科学,2017,46(12):17-23.doi:10.15933/j.cnki.1004-3268.2017.12.004.
Zhu S Q, Ma H, Tian Y, Yin W J, Xu H W, Zhou Y, Yang P. Cloning and expression analysis of ZmGLDH gene in Zea mays L.[J].Journal of Henan Agricultural Sciences, 2017,46(12):17-23.
[24] 乔枫,耿贵工,曾阳,金兰,谢惠春.枸杞抗坏血酸过氧化物酶基因的克隆与表达分析[J].中国农业大学学报,2019,24(4):64-72.
Qiao F, Geng G G, Zeng Y, Jin L, Xie H C. Molecular cloning and expression patterns of LCAPX from Lycium chinense[J]. Journal of China Agricultural University,2019,24(4):64-72.
[25] 许惠滨,连玲,魏毅东,朱永生,谢华安,王宗华,张建福.水稻OsAPX基因的克隆及过表达载体的构建[J].福建农业学报,2013,28(2):101-106.doi:10.19303/j.issn.1008-0384.2013.02.003.
Xu H B, Lian L, Wei Y D, Zhu Y S, Xie H A, Wang Z H, Zhang J F. Cloning and construction of overexpression vector of OsAPX gene[J]. Agricultural Journal of Fujian,2013,28(2):101-106.
[26] 管清杰. 盐碱胁迫下水稻OsAPX家族基因表达特性差异研究[D].哈尔滨:东北林业大学,2007.
Guan Q J. Differential studies on the expression of rice OsAPX family genes under alkaline saline stress[D]. Harbin:Northeast Forestry University,2007.
[27] Cunha J R, Carvalho F E L, Lima-Neto M C, Jardimmesseder D, Cerqueira J V A, Martins M O, Fontenele A V, Márgis-Pinheiro M, Komatsu S, Silveira J A G. Proteomic and physiological approaches reveal new insights for uncover the role of rice thylakoidal APX in response to drought stress[J]. Journal of Proteomics, 2019,192: 125-136.doi:10.1016/j.jprot.2018.08.014.
[28] Yan J Q, Wang J, Tissue D, Holaday A S, Allen R, Zhang H. Photosynthesis and seed production under water-deficit conditions in transgenic tobacco plants that overexpress an Arabidopsis ascorbate peroxidase gene[J]. Crop Sci,2003,43(4): 1477-1483.doi:10.2135/cropsci2003.1477.
[29] 伍小兵,成雨洁,邓西平,郭尚洙. 叶片喷施H2O2以及转入Cu/Zn SOD和APX基因对甘薯幼苗冷后恢复的作用[J].中国农业科学,2010,43(7):1379-1388.doi:10.3864/j.issn.0578-1752.2010.07.008.
Wu X B, Cheng Y J, Deng X P, Guo S Z. Effect of foliar spraying of H2O2 and Cu/Zn SOD and APX gene transferred in chloroplasts on the recoverability of sweet potato after chilling stress[J]. Scientia Agricultura Sinica,2010,43(7):1379-1388.
[30] Duan M, Feng H L, Wang L Y, Li D, Meng Q W.Overexpression of thylakoidal ascorbate peroxidase shows enhanced resistance to chilling stress in tomato[J]. Journal of Plant Physiology, 2012,169(9): 867-877.doi:10.1016/j.jplph.2012.02.012.
[31] 段明.低温胁迫下番茄类囊体膜抗坏血酸过氧化物酶基因的表达和功能研究[D].泰安:山东农业大学,2012.
Duan M. Expression and functional analysis of the LetAPX in tomato under chilling stress[D]. Taian:Shandong Agricultural University,2012.
[32] Tiwari V, Chaturvedi A K, Mishra A, Jha B. The transcriptional regulatory mechanism of the peroxisomal ascorbate peroxidase (pAPX) gene cloned from an extreme halophyte, Salicornia brachiata[J]. Plant and Cell Physiology,2014,55(1):201-217.doi:10.1093/pcp/pct172.
[33] 王亦学,杜建中,郝曜山,张欢欢,王晓清,孙毅. 过量表达GhAPX基因提高中林美荷杨耐盐性[J].分子植物育种,2017,15(7):2579-2583.doi:10.13271/j.mpb.015.002579.
Wang Y X, Du J Z, Hao Y S, Zhang H H, Wang X Q, Sun Y. Over expression of GhAPX gene in the improvement of salt tolerance in Populus sp.[J].Molecular Plant Breeding,2017,15(7):2579-2583.
[34] Kornyeyev D, Logan B A, Payton P, Allen R D, Holaday A S. Enhanced photochemical light utilization and decreased chilling-induced photoinhibition of photosystem Ⅱ in cotton overexpressing genes encoding chloroplast-targeted antioxidant enzymes[J].Physiologia Plantarum,2001,113(3):323-331.doi:10.1034/j.1399-3054.2001.1130304.x.