大豆是我国重要的粮食作物和油料作物,也是我国人民植食性蛋白的主要来源[1]。异黄酮是一种黄酮类化合物,又称植物雌激素[2],包括游离型的大豆黄素、染料木素和黄豆黄素3种[3],主要存在于大豆、菜豆、苜蓿等豆科植物中,其中以大豆的含量最高[4]。大豆异黄酮是大豆重要的次生代谢产物之一。它不仅参与调节植物的生长活动,还对人体健康具有重要作用。为了满足市场对大豆异黄酮的需求,高异黄酮含量的大豆品种选育成为育种人员的重要目标之一。
异黄酮主要通过苯丙氨酸代谢途径进行生物合成,这一途径是从莽草酸途径衍生的植物特有的次生代谢途径,也是植物三大次生代谢途径之一[5]。在自然状态中,异黄酮以3种母核的形式存在,它们通过β-糖苷键和葡萄糖结合,形成异黄酮葡萄糖苷,在大豆中存在[6]。黄酮类色素等次生代谢产物的糖苷主要经过糖基化修饰,存在于植物天然次生代谢产物合成的最后一步[7]。UGT是存在于自然界中的一种重要修饰分子,UDP(尿嘧啶二磷酸腺苷)所活化的糖分子也能被UGT转移到生物大分子上。UGT可修饰大豆中的黄酮类化合物,形成异黄酮糖苷,也是异黄酮的合成过程中的一类重要次生代谢产物[8]。目前,UGT基因已在多种植物(如水稻[9]、玉米[10]、荞麦[11]、三花龙胆[12])中被研究,付晓雯 [8]从葛根中成功克隆出具有糖基转移酶活性的GT4基因,并验证该基因可以影响大豆苷元、染料木素、黄豆黄素等物质的合成。李红艳等[13]在丹参中成功克隆糖基转移酶基因SmUF3GT,发现其可以将不稳定的类黄酮色素转化为稳定类黄酮苷元。尤章 [14]发现紫花苜蓿中MsUGT73B2基因影响黄酮物质的合成。Achnine等[15]发现蒺藜苜蓿GT99D基因参与合成黄酮类物质。而大豆糖基转移酶基因功能尚鲜见报道。
本研究以高异黄酮品种中豆27为试验材料,克隆GmUGT73全长序列并构建植物表达载体pCambia3300-GmUGT73,利用发根农杆菌介导大豆快速转化技术来验证GmUGT73基因与异黄酮含量的关系,进而为分子标记辅助育种提供基因资源。
1 材料和方法
1.1 试验材料
大豆品种:中豆27由中国农业科学院作物所培育;东农50由东北农业大学大豆研究所提供。
菌种和载体:K599发根农杆菌、pCambia3300载体、大肠杆菌DH5α感受态。
1.2 试验方法
1.2.1 大豆总RNA提取及反转录 将大豆材料中豆27的种子种在12 cm×12 cm的小方钵中,钵中装灭菌蛭石。将材料放置于16 h光和8 h暗,温度(23±2)℃,湿度60%的光照培养箱内。待大豆幼苗第一轮三出复叶完全展开时,取叶片组织15~30 mg,置于液氮中,依照TRIzol的方法提取高异黄酮品种中豆27叶片的总RNA。采用东洋坊反转录试剂盒说明书进行操作,将RNA反转录成cDNA。
1.2.2 GmUGT73的生物信息学分析 通过测序获得了DNA序列,并且利用DNAMAN软件将其翻译氨基酸序列。利用ProtParam、ProtCcale、TMpred和MEMSAT-SVM在线软件,可以对氨基酸的理化性质、亲水性、疏水性、跨膜结构等指标进行初步分析,进而初步预测基因的功能。
1.2.3 RT-PCR法克隆GmUGT73全长基因 在Phytozomev 11.0数据库查找GmUGT73基因的全长序列,GmUGT73 CDS区域全长1 395 bp,根据GmUGT73 基因的CDS序列设计引物(表1),将cDNA作为模板DNA进行PCR扩增,反应体系和反应程序根据高保真DNA聚合酶(Phanta Super-Fidelity DNA Polymerase)说明书进行操作。用琼脂糖凝胶电泳检测的方法对目的基因片段进行电泳检测。
表1 PCR引物
Tab.1 Primers for PCR

引物名称 Primer name引物序列 (5′-3′) Primer sequenceGmUGT73-FAGAACACGGGGGACTATGGAGCAACCAACTAGTGTGGmUGT73-RATCCTCTGTTTCTAGTCATAAGGATTCAAGTCCTTG
1.2.4 目的片段回收 获得的PCR产物经琼脂糖凝胶电泳,紫外灯照射下,用解剖刀迅速切下含目的片段的琼脂糖凝胶(质量一般小于0.3 g),放入干净的1.5 mL离心管中,利用胶回收试剂盒将目的片段进行回收,放入-20 ℃冰箱中保存。
1.2.5 表达载体构建与目的基因片段连接 在pCambia3300表达载体上找到单酶切位点,采用XbaⅠ酶,在37 ℃水浴锅中5 h将其载体线性化,采用电泳的方法检验酶切结果。采用电击法将目的片段与植物表达载体相连接,采用的大肠杆菌感受态DH5α是博迈德生物技术公司生产的。
1.2.6 菌液验证及测序 利用PCR鉴定阳性克隆的方法,对菌液进行PCR检测(Easy-Taq为PCR扩增酶)。将鉴定为阳性克隆的菌液送到测序公司测序。利用OMEGA公司生产的提质粒盒子(Plasmid Mini Kit(D6942-02*))对测序合格的样品提取质粒。
1.2.7 大豆根部转化与异黄酮含量测定 根据陈安乐[16]大豆发根转化方法对GmUGT73基因以东农50为材料进行K599发根农杆菌转化与侵染,对根部进行DNA提取,采用PCR鉴定的方法,并根据朱莹等[17]液相色谱法(HPLC)测定异黄酮含量的方法,对大豆根部异黄酮进行测定。
2 结果与分析
2.1 GmUGT73基因的克隆与转化
选取中豆27的第一轮完全展开的三出复叶提取总RNA,通过琼脂糖电泳检测,其中18S和28S条带清晰可见(图1)。通过Nanovue仪器对提取的总RNA进行浓度检测,结果表明,RNA纯度较高,完整性好,适合反转录成cDNA,进行基因克隆。
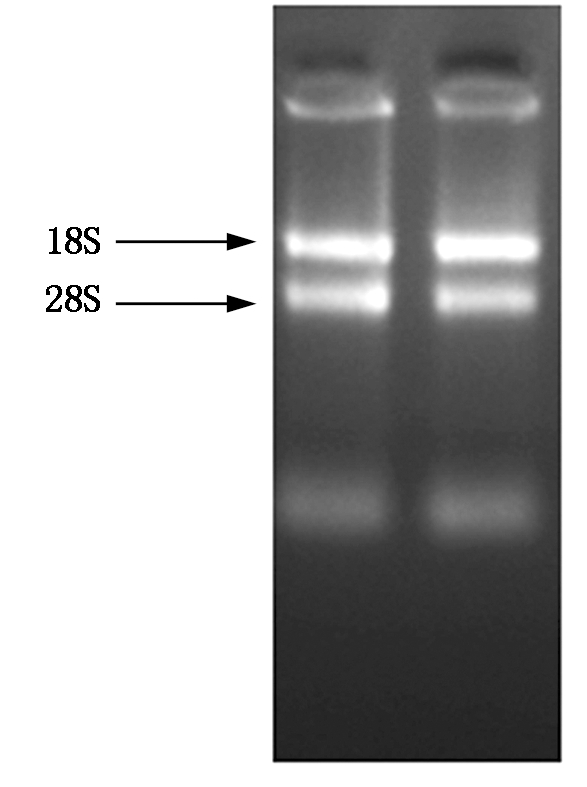
图1 RNA电泳图
Fig.1 Agarosegel electrophoriesis of RNA
将中豆27的第一轮三出复叶总RNA逆转录成cDNA,并以其为模板、GmUGT73-R和GmUGT73-F为引物,经PCR反应后获得目的片段,其长度为1 000~2 000 bp,与目的基因片段长度一致(图2),然后通过In-Fusion连接的方法将目的基因连接到植物过表达载体上。
对转化大肠杆菌的菌液进行PCR阳性检测(图2),将阳性克隆的菌液送至测序公司进行测序,下载全基因组基因序列与测序结果比对,将完全匹配的序列作为最终序列。

图2 目的基因电泳图
Fig.2 Electrophoresis result of gene amplification
2.2 生物信息学分析
利用在线软件对GmUGT73蛋白序列的一级结构进行分析,结果表明,GmUGT73基因的编码区编码464个氨基酸,分子质量为51.186 5 ku,理论等电点(pI)为6.27,其原子总数为7 176,其分子式是C2281H3580N608O685S22。在GmUGT73蛋白的氨基酸序列中,含量最多的是Leu,占总数的11.6%;不存在Pyl和Sec 2种氨基酸。GmUGT73蛋白质总正电和负电残基数分别为37和41,蛋白不稳定系数为36.93,表明该蛋白相对比较稳定。GmUGT73蛋白GRAVY值为-0.111,脂溶指数为86.19,属于亲水性蛋白。蛋白质二级结构预测得到GmUGT73蛋白质中含有33.19% α-螺旋、41.59%片层结构、4.74% β-转角、20.47%无规则卷曲。用在线软件SWISS-MODEL预测中豆27中GmUGT73蛋白的三级结构(图3)。
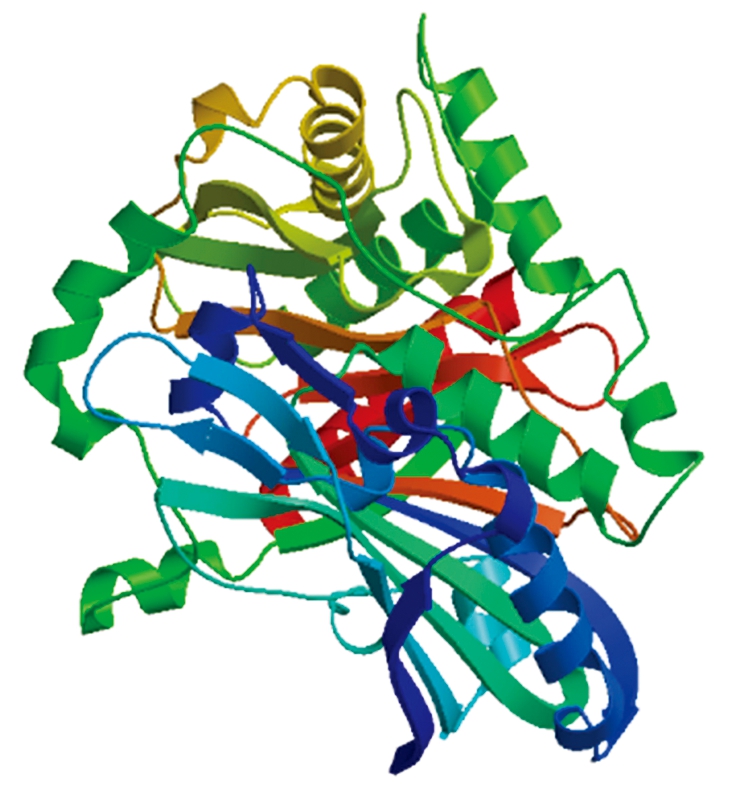
图3 GmUGT73蛋白三级结构的预测
Fig.3 Predict of 3-D structure of GmUGT73 protein
2.3 PCR鉴定发根农杆菌阳性克隆
用基因克隆引物对含有目的基因的发根农杆菌采取PCR阳性鉴定,结果显示,菌液均为阳性克隆,代表目标转化成功(图4)。
2.4 转基因阳性根鉴定
对接种20 d后的发根植株,随机选取10株,提取根部中的DNA,采用PCR检测的方法对其进行阳性鉴定,结果显示其中9株为阳性(图5)。
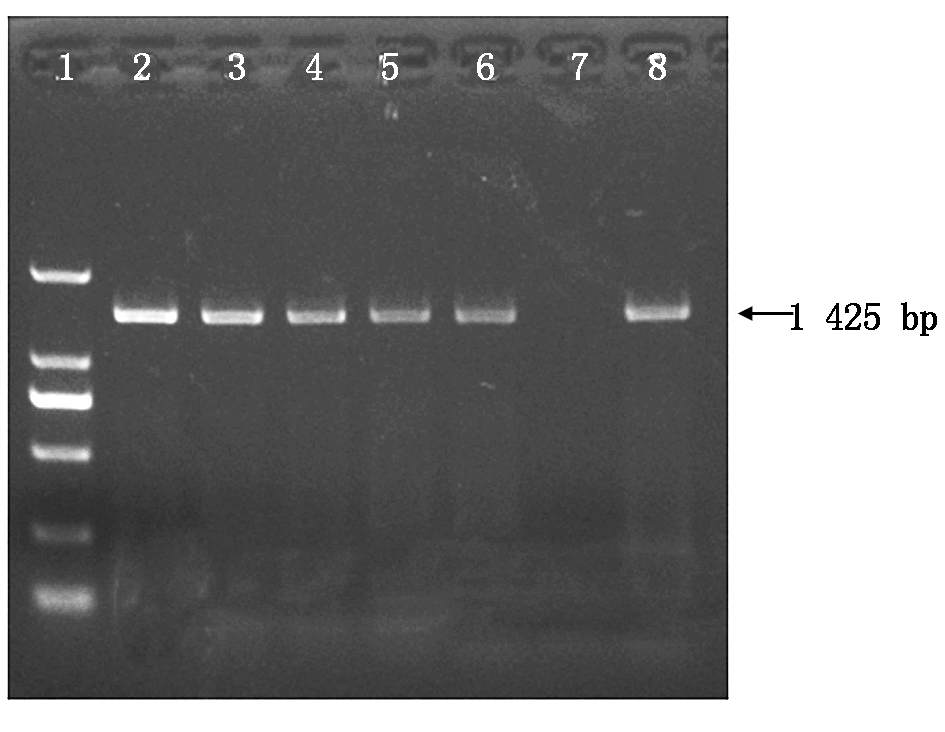
1.DL2000 Marker;2-6.5个不同单克隆菌液;7.水阴性对照; 8.大肠重组质粒pCambia3300-GmUGT73阳性对照。 1.DL2000 Marker;2-6.Five different monoclonal solutions; 7.Water negative control;8.E.coli plasmids pCambia3300-GmUGT73.
图4 pCambia3300-GmUGT73转大肠杆菌PCR初步鉴定
Fig.4 PCR results of Escherichia coli containing the recombinant plasmid pCambia3300-GmUGT73
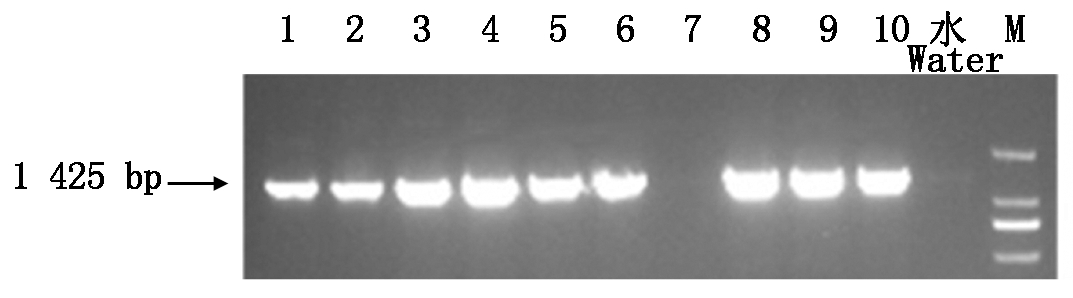
1-10.选取的10株发根植株;水.阴性对照;M.DL2000 Marker。 1-10.Chosen ten root plants;Water.Negative control;M.DL2000 Marker.
图5 PCR鉴定阳性根结果
Fig.5 Positive root PCR results
2.5 转基因阳性根异黄酮含量测定
随机选取5株转基因阳性根,并将其与对照处理同等条件下采用高效液相色谱(HPLC)进行异黄酮相关含量的测量,结果显示,转基因阳性根中大豆苷元和大豆苷含量极显著高于对照材料,其他组分无显著变化,对2组数据进行差异性分析,差异达极显著水平(P<0.01),所以初步认定GmUGT73基因具有促进异黄酮合成的作用(图6)。
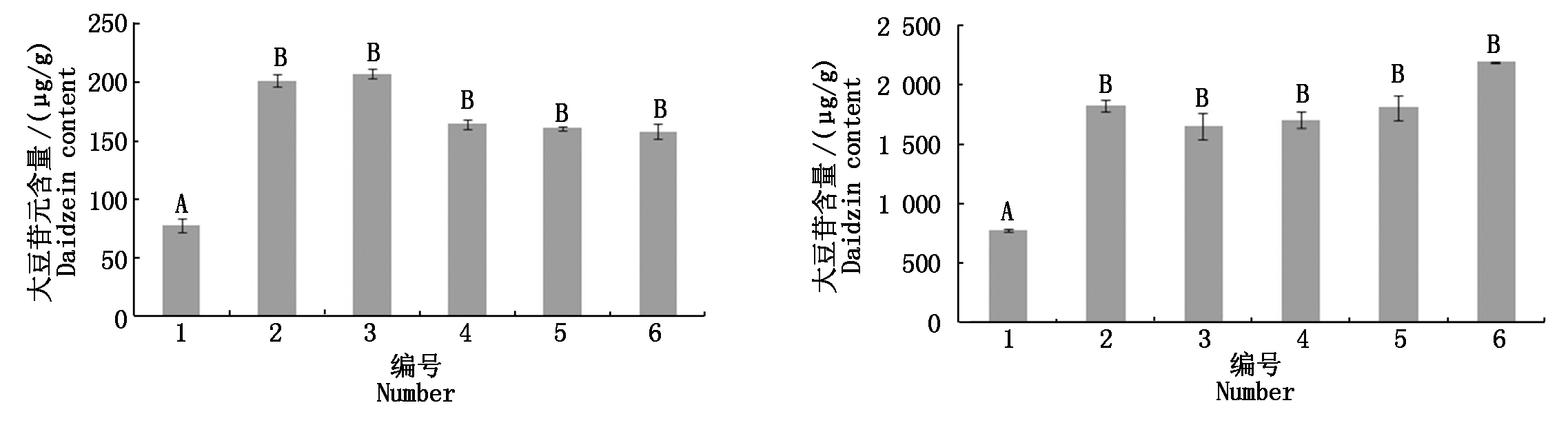
1.对照大豆根系;2-6.转基因阳性发根根系。不同大写字母代表对照与转基因根系之间异黄酮含量的差异极显著(P<0.01)。 1.Control roots;2-6. Transgenic positive roots.Different capital letters represent extremely significant differences in isoflavone content between control and transgenic roots(P<0.01).
图6 转基因阳性根异黄酮含量
Fig.6 Isoflavone content of transgenic positive roots
3 讨论与结论
转基因技术和基因编辑技术不断提高,伴随产生了更多的遗传转化方法和技术,给分子育种和定向改良作物性状提供新思路。至今在植物中使用较多的方法有农杆菌介导法、基因枪法、花粉管通道法等,其中科研人员最为热衷的是农杆菌介导法,主要是其价格成本低、耗时短[18]。采取发根农杆菌转化的方法,可以影响次生代谢产物的合成[19]。证明发根农杆菌转化在筛选异黄酮合成基因方面具有可行性。付晓雯 [8]研究发现,葛根中异黄酮含量受到糖基转移酶相关基因的影响。Baek等[20]研究发现,朝鲜黑莓中糖基转移酶基因在类黄酮合成过程中发挥重要作用。本研究通过发根农杆菌介导法将GmUGT73基因转入东农50品种中,获得15个转基因阳性根,用高效液相色谱法测定转基因阳性根组织的异黄酮含量,验证GmUGT73基因是否参与大豆异黄酮的合成过程。结果证明GmUGT73基因可能参与大豆异黄酮的积累过程。
大豆异黄酮多以苷元形式发挥生物功能,糖基化后其生理作用发生改变[21-23]。因此,糖基化对异黄酮组分的生物功能具有重要的作用。最早发现的大豆异黄酮特异UGT基因是GmIF7GT,它是在大豆幼苗中提取出来的[24],它对异黄酮合成具有促进作用。后来Dhaubhadel等[25]发现UGT73F2糖基转移酶基因可以促进染料木素和黄酮黄豆黄素合成,从而使黄豆黄苷和染料木苷的含量增多。本研究以中豆27为试验材料,克隆出糖基转移酶基因GmUGT73,连接pCambia3300过表达载体,通过K599转化发根农杆菌,结果表明,发根中的大豆苷元(Daidzein)和大豆苷(Daidzin)含量增加,异黄酮含量显著提高,这表明GmUGT73参与大豆异黄酮代谢过程。
通过RT-PCR方法从大豆中豆27中克隆获得GmUGT73基因的CDS全长序列;GmUGT73基因编码区编码464个氨基酸,分子质量为51.186 5 ku,该基因编码的蛋白比较稳定,亲水性较强;成功构建pCambia3300-GmUGT73植物表达载体,发根农杆菌介导法转化大豆东农50,获得的转基因阳性根中异黄酮含量和对照处理相比极显著提高(P<0.01),说明该基因可能具有合成大豆异黄酮的功能。
[1] Wrather J A,Koenning S R.Estimates of disease effects on soybean yields in the United States 2003 to 2005[J].Journal of Nematology,2006,38(2):173-180.doi:10.1094/PHP-2009-0401-01-RS.
[2] Ishimi Y,Takano F, Yamauchi J. Study on food labeling and the content of soybean isoflavones in health foods[J]. Japanese Journal of Nutrition & Dietetics,2009,67(2):49-57.doi:10.5264/eiyogakuzashi.67.49.
[3] 李冬梅.基于全基因组关联分析的大豆异黄酮组分基因克隆与功能鉴定[D].沈阳:沈阳农业大学,2018.
Li D M.Gene cloning and functional identification of soybean isoflavones based on genome-wide association analysis[D]. Shenyang:Shenyang Agricultural University,2018.
[4] Ravindranath M H,Muthugounder S,Presser N,Viswanathan S.Anticancer therapeutic potential of soy isoflavone,genistein[J].Advances in Experimental Medicine & Biology,2004,546(1):121-165.doi:10.1007/978-1-4757-4820-8_11.
[5] 钟巍然,柴友荣,张凯,陈晓丹,卢坤,陶澜.苯丙烷代谢途径中细胞色素P450的研究[J].安徽农业科学2008,36(13):5285-5289.doi:10.13989/j.cnki.0517-6611.2008.13.005.
Zhong W R,Chai Y R,Zhang K,Chen X D,Lu K,Tao L.Study on the cytochrome P450s in phenylpropanoid metabolic pathway[J]. Anhui Agricultural Sciences,2008,36(13):5285-5289.
[6] 高荣海,张春红,赵秀红,郑艳,刘长江.大豆异黄酮研究进展[J].粮食与油脂,2009(5):1-4.doi: 10.3969/j.issn.1008-9578.2009.05.001.
Gao R H,Zhang C H,Zhao X H,Zheng Y,Liu C J.Research progress on soybean isoflavone[J].Cereals & Oils,2009(5):1-4.
[7] Vogt T,Jones P.Glycosyltransferases in plant natural product synthesis characterization of a supergene family[J].Trends in Plant Science,2000,5(9): 380-386.doi:10.1016/S1360-1385(00)01720-9.
[8] 付晓雯.葛根糖基转移酶基因的克隆与功能鉴定[D].武汉:华中农业大学,2017.
Fu X W.Cloning and functional identification of glycosyltransferase gene in Pueraria labota[D].Wuhan:Huazhong Agriculture University,2017.
[9] Brazierhicks M,Evans K M,Gershater M C,Puschmann H,Steel P G,Edwards R.The C-glycosylation of flavonoids in cereals[J].J Biol Chem,2009,284(27):17926-17934.doi: 10.1074/jbc.M109.009258.
[10] Ferreyra M L F,Rodriguez E,Casas M I,Labadie G,Grotewold E,Casati P.Identification of a bifunctional maize C-and O-Glucosyltransferase[J].J Biol Chem,2013,288(44):31678-31688.doi:10.1074/jbc.M113.510040.
[11] Nagatomo Y,Usui S,Ito T,Kato A,Shimosaka M,Taguchi G.Purification,molecular cloning and functional characterization of flavonoid C-glucosyltransferases from Fagopyrum esculentum M.(buckwheat)cotyledon[J]. The Plant Journal,2014,80(3):437-448.doi:10.1111/tpj.12645.
[12] Sasaki N,Nishizaki Y,Yamada E,Tatsuzawa F,Nakatsuka T,Takahashi H,Nishihara M.Identification of the glucosyltransferase that mediates direct flavone C-glucosylation in Gentiana triflora[J].FEBS Lett,2015,589(1):182-187.doi:10.1016/j.febslet.2014.11.045.
[13] 李红艳,刘景玲,金伟波,梁宗锁.丹参类黄酮3-O糖基转移酶基因SmUF3GT的克隆、亚细胞定位及时空表达分析[J].中国中药杂志,2019(10):2038-2045.doi:10.19540/j.cnki.cjcmm.20190301.009.
Li H Y,Liu J L,Jin W B,Liang Z S.Cloning,subcellular localization and spatio-temporal expression analysis of a flavonoid 3-O-glucosyltransferase gene(SmUF3GT)in Salvia miltiorrhiza[J].China Journal of Chinese Materia Medica,2019(10):2038-2045.
[14] 尤章.紫花苜蓿MsUGT73B2基因的克隆、表达及转化研究[D].杨凌:西北农林科技大学,2018.
You Z.Cloning,expression and transformation of a MsUGT73B2 gene from alfalfa(Medicago sativa L.)[D]. Yangling:Northwest Agriculture Forestry University,2018.
[15] Achnine L, Huhman D V, Farag M A, Sumner L W, Blount J W, Dixon R A. Genomics-based selection and functional characterization of triterpene glycosyltransferases from the model legume Medicago truncatula[J]. Plant J,2005,41(6):875-877.doi:10.1111/j.1365-313X.2005.02344.x.
[16] 陈安乐.大豆发根转化方法的建立及GmFRD3在大豆耐铝性中的作用[D].长春:吉林大学,2014.
Chen A L.Establishment of the Agrobacterium rhizogenes-mediated transformation of soybean and function of GmFRD3 under Al stress in soybean[D].Changchun:Jilin University,2014.
[17] 朱莹,褚姗姗,张培培,程浩,喻德跃,王娇.R2R3-MYB转录因子GmMYB184调节大豆异黄酮合成[J].作物学报,2018,44(2):185-196.doi:10.3724/SP.J.1006.2018.00185.
Zhu Y,Chu S S,Zhang P P,Cheng H,Yu D Y,Wang J.An R2R3-MYB transcription factor GmMYB184 regulates soybean isoflavone synthesis[J].Acta Agronomica Sinica,2018,44(2):185-196.
[18] 杨柳,于翠梅,刘铭,赵明哲,谢甫绨.农杆菌介导大豆遗传转化影响因素研究进展[J].大豆科学,2018,37(5):803-806.doi:10.11861/j.issn.1000-9841.2018.05.0803.
Yang L,Yu C M,Liu M,Zhao M Z,Xie F T.Research advances of Agrobacterium-mediated transformation affecting factors in soybean[J].Soybean Science,2018,37(5):803-806.
[19] 姜伊娜.大豆黄酮合成酶基因的克隆与RNA干扰调控异黄酮含量的研究[D].上海:上海交通大学,2013.
Jiang Y N.Cloning of soybean(Glycine max)flavone synthase gene and RNA interference regulation in isoflavone production[D].Shanghai:Shanghai Jiaotong University,2013.
[20] Baek M H,Chung B Y,Kim J H,Kim J S,Lee S S,An B C,Lee I J,Kim T H.cDNA cloning and expression pattern of Cinnamate-4-hydroxylase in the Korean black raspberry[J].BMB Rep,2008,41(7):529-536.doi:10.5483/BMBRep.2008.41.7.529.
[21] Yu O,Jung W,Shi J,Croes R A,Fader G M,McGonigle B,Odell J T.Production of the isoflavones genistein and daidzein in non-legume dicot and monocot tissues[J].Plant Physiology,2000,124(2):781-794.doi:10.1104/pp.124.2.781.
[22] Yu O,Shi J,Hession A O,Maxwell C A,McGonigle B,Odell J T.Metabolic engineering to increase isoflavone biosynthesis in soybean seed[J]. Phytochemistry,2003,63(7): 753-763.doi:10.1016/S0031-9422(03)00345-5.
[23] Yu O,McGonigle B.Metabolic engineering of isoflavone biosynthesis [J].Advances in Agronomy,2005,86:147-190.doi:10.1016/S0065-2113(05)86003-1.
[24] Noguchi A,Saito A,Homma Y, Nakao M, Sasaki N, Nishino T, Takahashi S, Nakayama T.A UDP-glucose:isoflavone 7-O-glucosyltransferase from the roots of soybean(Glycine max)seedlings purification,gene cloning,phylogenetics,and an implication for an alternative strategy of enzyme catalysis[J].Journal of Biological Chemistry,2007,282:23581-23590.doi: 10.1074/jbc.M702651200.
[25] Dhaubhadel S,Farhangkhoee M,Chapman R.Identification and characterization of isoflavonoid specific glycosyltransferase and malonyltransferase from soybean seeds [J].Journal of Experimental Botany,2008,59(4):981-994.doi: 10.1093/jxb/ern046.