由立枯丝核菌(Rhizoctonia solani Kuhn AG1-IA)引起的水稻纹枯病是世界性的水稻病害之一[1]。近年来,随着水稻矮秆多蘖品种的密植以及氮肥过量施用等原因[2],水稻纹枯病逐渐成为危害水稻生产的第一大病害[3],每年可导致数亿公斤水稻产量的损失,严重时可以使水稻减产50%,甚至绝收[4-5]。化学防治由于其具有经济高效、防治简便等优点一直被用于防治水稻纹枯病。但是,过度使用化学药剂引发了众多随之而来的问题,如环境污染、纹枯病菌耐药性增强等。因此,开发广谱、高效、低毒、环保的微生物农药用于防治水稻纹枯病迫在眉睫。
近年来,植物病害的生物防治引起了广泛的关注,研究者也对植物潜在的抗病机理进行了探索。植物与病原生物在长期互作、协同进化中逐渐形成了一系列防卫机制,即植物受物理、化学或生物方法处理后,对随后某种或某些病原物的侵染所产生的诱导抗病性。坏死型病原物侵染或某些生化制剂诱导处理后,植株未受侵染或处理部位产生对随后病原物侵染的抗性,称为系统性获得抗性(Systemic acquired resistance,SAR)[6],这种抗性是在水杨酸(Salicylic acid,SA)以及病程相关蛋白(Pathogenesis-related proteins,PR蛋白)的积累后诱发的。NPR1(Nonexpressor of PR genes 1)基因是控制SA积累的关键基因[7],能够激活多种抗病相关基因(PR1等)的表达,提高植物的抗病性[8]。另一种与SAR相似的抗性表型可以被一些非致病性的细菌刺激,称为诱导性系统抗性(Induced systemic resistance,ISR)[9-10]。与SAR不同,ISR是由茉莉酸和乙烯(Jasmonic acid/ethylene,JA/ET)信号传导途径介导的[11-12]。
目前已有很多报道表明,生防菌可以诱导植物产生SAR或ISR从而提高植物对病原菌的抗病性。在水稻中,陈志谊等[13]报道了枯草芽孢杆菌(Bacillus subtilis)Bs-916可以诱导苯丙氨酸解氨酶(PAL)、超氧化物歧化酶(SOD)等抗病性有关的酶类活性大幅度提高,从而控制水稻纹枯病(R.solani)和稻曲病(Ustilaginoidea oryzae)的发生[14]。戴秀华[15]研究发现,解淀粉芽孢杆菌(B. amyloliquefaciens)Lx-11能够诱导PR4、PR10a、LOX等基因的表达以及过氧化物酶(POD)、SOD等抗氧化酶活性的变化,从而起到防止水稻细菌性条斑病菌(Xanthomonas oryzae)侵染与蔓延的作用。近年来,Rais等[16]也报道了芽孢杆菌(Bacillus spp.)KFP-5等菌株可以诱导水稻体内SOD和POD等抗氧化防御酶活性的提高,从而降低稻瘟病(Pyricularia oryzae)的发病率。
在其他作物中,Viswanathan等[17]报道了甘蔗根际促生菌株可诱导甘蔗对镰刀菌的抗病反应,经处理后甘蔗组织中几丁质酶、POD等防御酶的水平显著提高。Sharma等[18]研究发现,恶臭假单胞菌(Pseudomonas putida)CRN-09和枯草芽孢杆菌(B.subtilis)CRN-16能够协同诱导绿豆的系统抗性,从而抑制了壳球孢菌(Macrophomina phaseolina)的侵染。Droby等[19]发现了假丝酵母菌(Candida oleophila)能诱导葡萄柚的系统性抗性,抑制果实采后腐烂病菌青霉菌的孢子萌发和芽管生长。除了生防菌本身的直接诱导作用,其产生的活性物质同样可以诱导植物的抗性。芽孢杆菌(Bacillus sp.)JS菌株的挥发物通过激活PR基因的表达并诱导烟草植株产生系统抗性[20]。棘孢木霉(Trichoderma asperellum)T-34菌株产生的挥发性化合物可以局部触发根系中铁稳态的重新调整,通过启动依赖于JA的防御系统从而诱发植物产生ISR[21]。
根据梁小文等[22]之前的报道,克里本类芽孢杆菌(Paenibacillus kribbensis)PS04可以抑制水稻纹枯病菌的生长并激发水稻的系统诱导抗性[23],其发酵液的最高防治效率达93.65%,粗代谢产物的最高防治效率为73.85%[24]。在国家重点研发项目的支持下,热带与亚热带真菌研究室利用该菌株制备成了生防菌剂,在广东省内的水稻生产基地进行了大面积的推广示范,取得良好的田间防病促生效果,但有关该菌对水稻的诱导抗病机理和抗病途径的调控还不清楚。因此,本研究的目的是揭示在克里本类芽孢杆菌处理下水稻抗病相关基因表达的动态变化,并确定该菌诱导寄主产生抗病性的途径。
1 材料和方法
1.1 PS04发酵液的制备
将PS04菌株接种到LB液体培养基中活化,将活化好的种子培养液,按5%的比例接种到改良查氏培养液(3%蔗糖,0.15% NaNO3,0.1% K2HPO4,0.05% MgSO4,0.05% KCl,0.001% FeSO4)中,在30 ℃条件下以180 r/min培养84 h得到发酵原液。发酵原液稀释200倍后用于喷施水稻。
1.2 水稻的种植和处理
将水稻(品种9311)催芽后播于白色的箱中,每盆6排,每排10株,共播15盆。待稻苗长至三叶一心期时进行人工喷施处理,接种菌液量为100 mL/盆,以清水喷施为对照。以不处理的样本为0 h。喷施24 h后开始计时取样,再按3,6,9,12,24 h分别采集叶片,立即投入液氮中,于-80 ℃冰箱保存。
1.3 cDNA第一链合成及实时荧光定量PCR
采用Plant RNA Extraction Kit(TaKaRa,中国,大连)提取水稻叶片的总RNA,用DNase Ⅰ(TaKaRa,中国,大连)处理后,用反转录试剂盒PrimeScript 1st Strand cDNA Synthesis Kit(TaKaRa,中国,大连)进行反转录。实时荧光定量PCR(Real-time PCR)在Bio-Rad荧光定量PCR仪(Bio-Rad,美国,加利福尼亚州)上进行反应。Real-time PCR反应程序为:94 ℃预变性30 s;94 ℃变性5 s,退火温度15 s,72 ℃延伸10 s,40个循环。每个样品3个技术重复和3个生物学重复。本研究所用引物序列如表1所示。相对表达量的计算用2-ΔΔCt方法进行分析,以水稻Actin基因为内参。显著性分析用SPSS 23软件(IBM,美国,纽约)进行。
表1 使用的PCR引物序列
Tab.1 Sequences of all PCR primers used in this study

基因名称Gene name上游引物(5′-3′)Forward primer (5′-3′)下游引物(5′-3′)Reverse primer (5′-3′)OsPR1CGTCTTCATCACCTGCAACTACTCCATGCATAAACACGTAGCATAGCAOsPR2ATCGACTCCATGCGCATCTAGCCTGGATGTTGTTCTGGACOsPR3GGGTTACTGCTTCAAAGAGGAGGGCTGCTTGGTAGTTCGATTOsPR4GTGTCTTCGGGTGACGAATAGGTCAGTGTCGATCTTGGAGAAGOsPR5TAAATACAACCTGCTCAAATCCTGTCATCGACCTTACCAAACOsPR6TGGCTGCTACTTCCATCCTGTTGTTGTGGTATGCGGAGGGCOsPR8TCGGCATCAAGGTCATGTTCTTGATGTACCTGGCCAAGTCOsPR9GACTGCTTCGTCCAAGGGTGCAGGGAGGTCGGTATTTGCOsPR10CCCTGCCGAATACGCCTAACTCAAACGCCACGAGAATTTGOsPR13TCGGTTCTGAAAGGGTATCAATGTATGGCTCAAGGATOsPR14CGTCAGGAGCCTCAACTCCGGGCTGATGGTGTAGGGGATOsPR16GGCTTCACCATCTTCCTTCTAGCACAGGTGAGTGCTTATCNPR1CCCTTGACTCTGACGATGTAAAGCTCGGTTGTAATTTGGPALGCACATCTTGGAGGGAAGCTGCGCGGATAACCTCAATTTGOsNAC4AGACGGACTGGATCATGCACGATCCAGCTTCTGTGAGCCCTTCTTGAOS2CTCGTCGGAAGGCTGTTGCTACGATTGACGGCGGAGGTTLOXGCATCCCCAACAGCACATCAATAAAGATTTGGGAGTGACATATTGGEIN2CAAGGAACCAGTGACAACCAGCAGTCGTCTCCGCAGTTAGActinTCCATCTTGGCATCTCTCAGGTACCCGCATCAGGCATCTG
2 结果与分析
2.1 PS04诱导PR途径基因表达
RT-qPCR结果表明,PS04菌株发酵液能够诱导水稻防卫反应基因OsPR1、OsPR2、OsPR3、OsPR4、OsPR5、OsPR10和OsPR16的表达。OsPR1基因在第9小时表达量最高随后下降;OsPR2基因在9 h表达量较高,此后缓慢降低,到24 h表达量达到最大值;OsPR3、OsPR4、OsPR5和OsPR16基因从3 h逐渐升高至6 h出现峰值,随后急剧下降;OsPR10基因从9 h升高至12 h表达量最高随后急剧下降;NPR1基因在第3小时表达量最高随后急剧下降(图1)。但本研究发现,水稻的OsPR6、OsPR8、OsPR9、OsPR13和OsPR14基因均不表达。
2.2 PS04诱导SA途径基因表达
RT-qPCR结果表明,PS04菌株发酵液能够诱导基因PAL和OsNAC4的表达。PAL基因在6 h表达量急剧升高到最大值随后急剧降低;OsNAC4基因从3 h逐渐升高至9 h出现峰值,在此后缓慢降低,但直到24 h的表达量仍显著高于对照(图2),说明生防菌对水稻诱导抗性作用与水杨酸合成途径有关。
2.3 PS04诱导JA途径基因表达
RT-qPCR结果表明,PS04菌株发酵液能够诱导LOX基因的表达。AOS2基因在未喷施菌株发酵液时表达很高,喷施后表达受到抑制,表达量从3 h逐渐升高至6 h出现高峰,在此后急剧下降,且直到24 h的表达量与对照相比均显著降低,这说明该基因的表达是受到抑制的;LOX基因在3 h时表达量急剧升高到峰值随后急剧下降(图3)。这些结果表明,该菌对水稻诱导抗性作用与茉莉酸合成途径也有关,发挥主要诱导作用的是LOX基因。
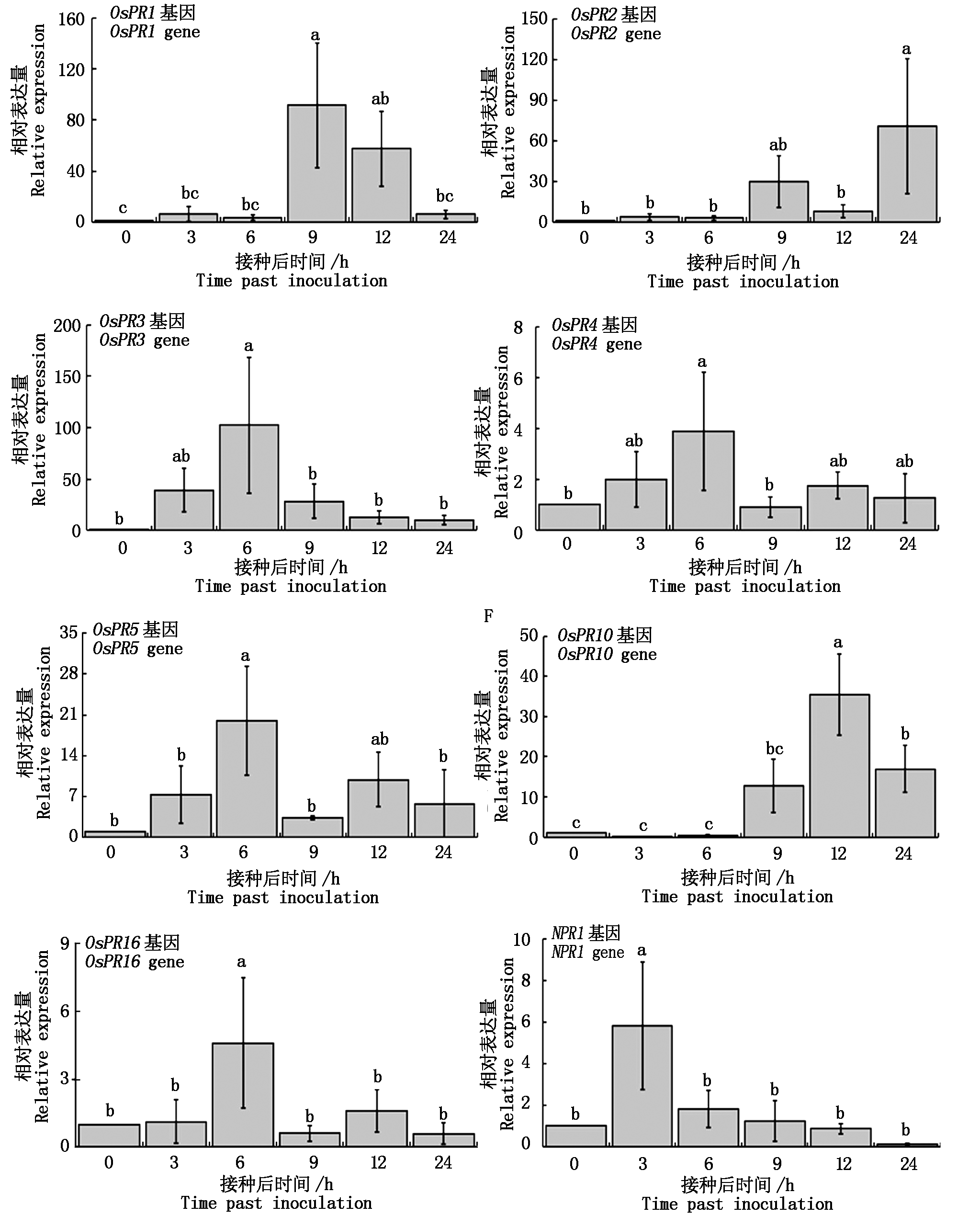
图1 PS04诱导水稻PR途径基因表达
Fig.1 Effect of PS04 on the expression of PR pathway genes in rice plant
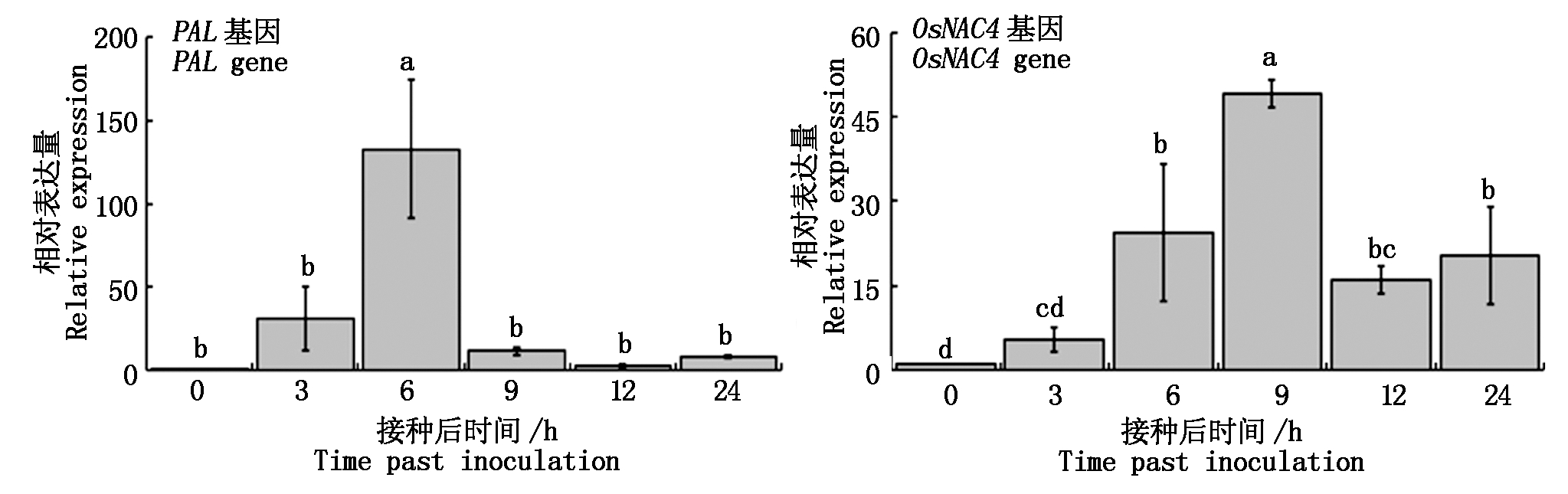
图2 PS04诱导水稻SA途径基因表达
Fig.2 Effect of PS04 on the expression of SA pathway genes in rice plant
2.4 PS04诱导ET途径基因表达
RT-qPCR结果表明,EIN2基因在3 h与对照相比显著降低,3 h后逐渐升高至9 h出现小高峰,此后缓慢降低,但到24 h的表达量达到最大值,且与对照相比仍然显著升高(图4)。结果表明,生防菌对水稻诱导抗性作用与乙烯合成途径有关。
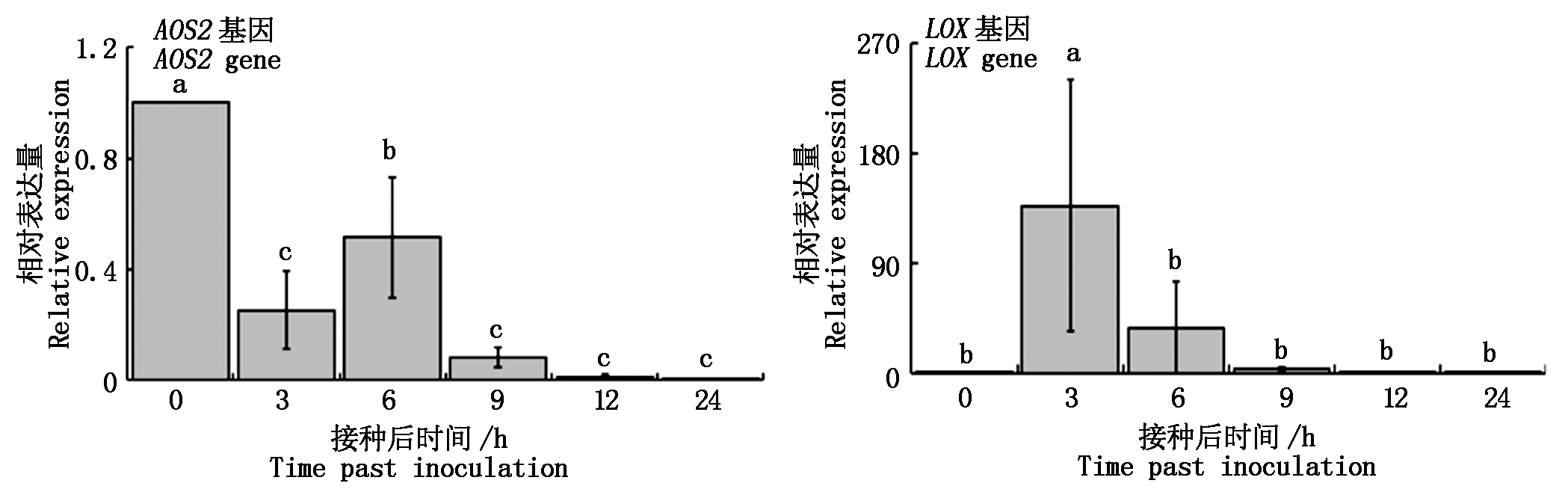
图3 PS04诱导水稻JA途径基因表达
Fig.3 Effect of PS04 on the expression of JA pathway genes in rice plant
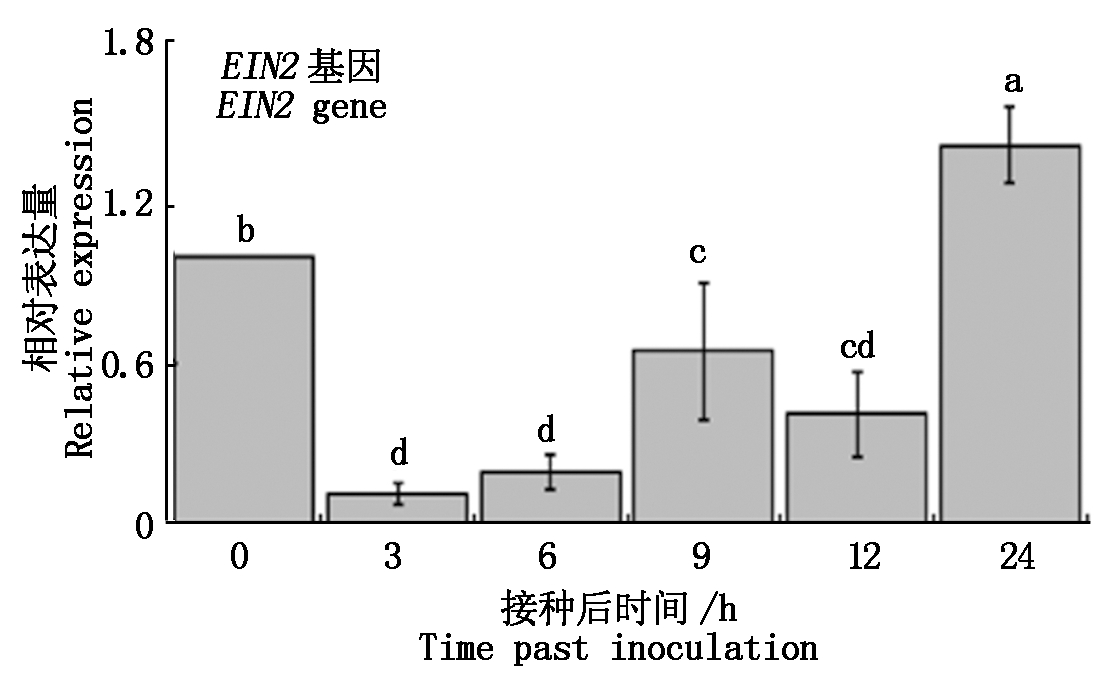
图4 PS04诱导水稻ET途径基因表达
Fig.4 Effect of PS04 on the expression of ET pathway gene in rice plant
3 讨论
本研究利用荧光定量PCR技术对水稻应答克里本类芽孢杆菌PS04处理后诱导抗性相关基因的表达谱进行表达分析。本研究结果发现,PS04菌株诱导了水稻防卫反应基因OsPR1、OsPR2、OsPR3、OsPR4、OsPR5、OsPR10、OsPR16的表达,说明克里本类芽孢杆菌对水稻具有诱导抗性作用。但对于水稻抗性基因的诱导具有明显的时间特性,推测其原因是PS04菌株诱导一定时间后相关抗性基因表达水平逐步达到峰值,抗病水平也达到最高,但随着时间的推移,生防菌在植物体内的浓度逐渐下降直至消失,诱导的抗病性水平也随之下降[25]。NPR1被认为是SA和JA途径交叉的关键节点,是植物系统性抗性的重要调节中心。NPR1基因在细胞核内的积累是诱导水杨酸(SA)介导的PR基因表达和SAR产生的充分必要条件。NPR1通过与TGA转录因子相互作用调控PR基因表达。本研究发现NPR1基因在3 h时表达量最高,随后表达量迅速下降,PS04处理可以很快诱导NPR1的表达。在其他研究中,枯草芽孢杆菌(B.subtilis)PTS-394诱导番茄抗病信号通路节点基因NPR1在24~72 h得到了显著表达;烟草的NPR1基因在枯草芽孢杆菌(B. subtilis)OKB105处理12 h后有明显的表达[26];普城沙雷菌(Serratia plymuthica)A21-4处理辣椒后体内的NPR1基因从第3天显著增加到第7天表达量达到最大[27]。因此本研究发现,克里本类芽报杆菌诱导水稻的NPR1基因显著表达的时间是接种后3 h,这个时间点比其他菌株报道的时间快,说明喷施PS04后,水稻的抗性相关基因很快就被调动起来。
JA通常与ET协同发挥其刺激抗性的作用,ET/JA信号会对SA信号通路产生负向影响,从而微调植物的防御反应。本研究选取了2个SA途径相关基因PAL、OsNAC4进行表达分析,结果显示,PAL基因在6 h时表达量达到最大值,随后急剧降低;OsNAC4基因在9 h时表达量最高随后下降。这2个基因的表达量变化受到克里本类芽孢杆菌显著诱导,说明克里本类芽孢杆菌是通过SA途径起诱导抗性的作用。JA合成途径开始于α亚麻酸,LOX和AOS是该途径的2个重要的基因。本研究发现,受克里本类芽孢杆菌处理后,LOX基因在3 h时表达量最高随后急剧下降,说明克里本类芽孢杆菌也通过JA途径起作用。张荣胜[28]的研究也发现,喷施解淀粉芽孢杆菌(B.amyloliguefaciens)Lx-11 24 h后水稻植株中PAL和NPR1基因的表达量达到最大值,随着时间的增加,基因表达水平有所降低,LOX基因的表达水平也有所提高。因此本研究发现,克里本类芽孢杆菌可能是通过JA途径介导的诱导抗性。综上,本研究的结果表明,克里本类芽孢杆菌可以同时诱导水稻的SAR和ISR途径基因的表达,从而提高了水稻的抗病性。
[1] 俞寅达,孙婳珺,夏志辉. 水稻纹枯病生物防控研究进展[J]. 分子植物育种,2019, 17(2): 600-605. doi: 10.13271/j.mpb.017.000600.
Yu Y D, Sun H J, Xia Z H. Progress on biological control of rice sheath blight[J]. Molecular Plant Breeding,2019, 17(2): 600-605.
[2] 李勇. 水稻纹枯病防治效果试验报告[J]. 现代农业,2015(4):8-9.doi: 10.3969/j.issn.1008-0708.2015.04.005.
Li Y. Experimental report on control effect of rice sheath blight[J]. Modern Agriculture,2015(4): 8-9.
[3] 李涛,路雪君,廖晓兰,欧晓明. 水稻纹枯病的发生及其防治策略[J]. 江西农业学报,2010, 22(9): 91-93. doi: 10.19386/j.cnki.jxnyxb.2010.09.027.
Li T, Lu X J, Liao X L, Ou X M. Occurrence and control strategy of rice sheath blight[J]. Acta Agriculturae Jiangxi,2010, 22(9): 91-93.
[4] 张云欢,郑文博,赵美,王陈骄子,周而勋,舒灿伟. 水稻纹枯病菌谷胱甘肽S-转移酶基因的生物信息学及表达分析[J]. 华北农学报,2018, 33(1): 45-51. doi: 10.7668/hbnxb.2018.01.008.
Zhang Y H, Zheng W B, Zhao M, Wang C J Z, Zhou E X, Shu C W. Bioinformatics and expression analysis of glutathione S-transferase gene in Rhizoctonia solani AG1-IA[J]. Acta Agriculturae Boreali-Sinica,2018, 33(1): 45-51.
[5] 杨迎青,杨媚,兰波,周而勋,李湘民. 水稻纹枯病菌致病机理的研究进展[J]. 中国农学通报,2014, 30(28): 245-250. doi: 10.11924/j.issn.1000-6850.2014-1538.
Yang Y Q, Yang M, Lan B, Zhou E X, Li X M. Research progress in pathogenic mechanisms of rice sheath blight pathogen[J]. Chinese Agricultural Science Bulletin,2014, 30(28): 245-250.
[6] 蔡新忠,郑重. 植物系统性获得抗病性的产生机理和途径[J]. 植物保护学报,1999, 26(1): 83-90. doi: 10.13802/j.cnki.zwbhxb.1999.01.017.
Cai X Z, Zheng Z. Mechanisms and pathways of plant systemic acquired resistance[J]. Acta Phytophylacica Sinica,1999, 26(1): 83-90.
[7] Lucas W J, Groover A, Lichtenberger R, Furuta K, Yadav S R, Helariutta Y, He X Q, Fukuda H, Kang J L, Brady S M, Patrick J W, Sperry J, Yoshida A, López-Millán A F, Grusak M A, Kachroo P. The plant vascular system: evolution, development and functions[J].Journal of Integrative Plant Biology,2013, 55(4): 294-388. doi: 10.1111/jipb.12041.
[8] 白薇. 水稻系统获得抗性相关基因的分子研究[D]. 呼和浩特:内蒙古农业大学, 2010.
Bai W. Molecular study of disease resistance in rice[D]. Huhhot:Inner Mongolia Agricultural University, 2010.
[9] 陈英,谭碧玥,黄敏仁. 植物天然免疫系统研究进展[J]. 南京林业大学学报(自然科学版),2012, 36(1): 129-136. doi: 10.3969/j.issn.1000-2006.2012.01.027.
Chen Y, Tan B Y, Huang M R. Recent advances in plant immune system[J]. Journal of Nanjing Forestry University(Natural Science Edition),2012, 36(1): 129-136.
[10] 刘晓光,高克祥,康振生,何邦令. 生防菌诱导植物系统抗性及其生化和细胞学机制[J]. 应用生态学报,2007, 18(8): 1861-1868. doi: 10.13287/j.1001-9332.2007.0304.
Liu X G, Gao K X, Kang Z S, He B L. Systemic resistance induced by biocontrol agents in plants and its biochemical and cytological mechanisms[J]. Chinese Journal of Applied Ecology,2007, 18(8): 1861-1868.
[11] 陈英,黄敏仁,诸葛强,王明庥. 植物抗病信号传导途径及其相互作用[J]. 南京林业大学学报(自然科学版),2002, 26(3): 85-90. doi: 10.3969/j.issn.1000-2006.2002.03.022.
Chen Y, Huang M R, Zhuge Q, Wang M X. Signaling pathways and interplay in plant disease resistance[J].Journal of Nanjing Forestry University (Natural Science Edition),2002, 26(3): 85-90.
[12] Feys B J, Parker J E. Interplay of signaling pathways in plant disease resistance[J]. Trends in Genetics,2000, 16(10): 449-455. doi: 10.1016/S0168-9525(00)02107-7.
[13] 陈志谊,许志刚,陆凡,刘永锋. 拮抗细菌B-916对水稻植株的抗性诱导作用[J]. 西南农业学报,2001, 14(2): 44-48. doi: 10.16213/j.cnki.scjas.2001.02.012.
Chen Z Y, Xu Z G, Lu F, Liu Y F. The inducing resistance effect of antagonistic bacterium B-916 on rice plant[J].Southwest China Journal of Agricultural Sciences,2001,14(2):44-48.
[14] 李德全,陈志谊,聂亚锋. 生防菌Bs-916及高效突变菌株抗菌物质及其对水稻抗性诱导作用的研究[J]. 植物病理学报,2008, 38(2): 192-198. doi: 10.13926/j.cnki.apps.2008.02.008.
Li D Q, Chen Z Y, Nie Y F. Antifungal substances producted by a high-yielding mutant of Bs-916 and their effects inducting-resistance on rice plant[J]. Acta Phytophologica Sinica,2008,38(2):192-198.
[15] 戴秀华. 解淀粉芽胞杆菌Lx-11防治水稻细菌性条斑病的促生、控病机理研究[D]. 南京:南京农业大学, 2015.
Dai X H. Study on the mechanism of Bacillus amyloliquefaciens Lx-11 against Xanthomonas oryzae pv. oryzicola and promote the growth of rice[D]. Nanjing:Nanjing Agricultural University,2015.
[16] Rais A, Jabeen Z, Shair F, Hafeez F Y, Hassan M N. Bacillus spp., a bio-control agent enhances the activity of antioxidant defense enzymes in rice against Pyricularia oryzae[J]. PLoS One,2017, 12(11): e187412. doi: 10.1371/journal.pone.0187412.
[17] Viswanathan R, Samiyappan R. Induction of systemic resistance by plant growth promoting rhizobacteria against red rot disease in sugarcane[J]. Sugar Tech,1999, 1(3): 67-76. doi: 10.1007/bf02945166.
[18] Sharma C K, Vishnoi V K, Dubey R C, Maheshwari D K. A twin rhizospheric bacterial consortium induces systemic resistance to a phytopathogen Macrophomina phaseolina in mung bean[J]. Rhizosphere,2018, 5:71-75. doi: 10.1016/j.rhisph.2018.01.001.
[19] Droby S, Vinokur V, Weiss B, Cohen L,Daus A, Goldschmidt E E, Porat R. Induction of resistance to Penicillium digitatum in grapefruit by the yeast biocontrol agent Candida oleophila[J]. Phytopathology,2002, 92(4): 393-399. doi: 10.1094/PHYTO.2002.92.4.393.
[20] Kim J S, Lee J, Lee C H, Woo S Y, Kang H, Seo S G, Kim S H. Activation of pathogenesis-related genes by the rhizobacterium, Bacillus sp. JS, which induces systemic resistance in tobacco plants[J]. The Plant Pathology Journal,2015, 31(2): 195-201. doi: 10.5423/PPJ.NT.11.2014.0122.
[21] Martínez-Medina A, Van Wees S C M, Pieterse C M J. Airborne signals from Trichoderma fungi stimulate iron uptake responses in roots resulting in priming of jasmonic acid-dependent defences in shoots of Arabidopsis thaliana and Solanum lycopersicum[J]. Plant, Cell and Environment,2017,40(11):2691-2705.doi: 10.1111/pce.13016.
[22] 梁小文,王根豪,陈晓燕,廖美德,范志金,周立峰,李肖宇,马忠岩,曾繁富,肖筱成,熊建生,曾升华,吴俊杰,钱凤,朱湘盛. 一株克里本类芽孢杆菌及其应用[P]. CN201310643992.5. 2014-04-30.
Liang X W, Wang G H, Chen X Y, Liao M D, Fan Z J, Zhou L F, Li X Y, Ma Z Y, Zeng F F, Xiao X C, Xiong J S, Zeng S H, Wu J J, Qian F, Zhu X S. A strain of Paenibacillus kribbensis and its application[P]. CN201310643992.5. 2014-04-30.
[23] Guo T, Liao M D. Suppression of Rhizoctonia solani and induction of host plant resistance by Paenibacillus kribbensis PS04 towards controlling of rice sheath blight[J]. Biocontrol Science and Technology,2014, 24(1): 116-121. doi: 10.1080/09583157.2013.844224.
[24] 郭田,王刘庆,廖美德. PS04菌株对水稻纹枯病的防效及对水稻2种防御性酶活性的诱导[J]. 西北农林科技大学学报(自然科学版),2013, 41(6): 98-102. doi: 10.13207/j.cnki.jnwafu.2013.06.016.
Guo T, Wang L Q, Liao M D. Biocontrol of PS04 against rice sheath blight and its induced activities to two rice defense enzymes[J]. Journal of Northwest A&F University (Nat Sci Ed),2013, 41(6): 98-102.
[25] 牛吉山,刘靖,倪永静,尹钧. 茉莉酸对PR-1、PR-2、PR-5和Ta-JA2基因表达以及小麦白粉病抗性的诱导[J]. 植物病理学报,2011, 41(3): 270-277. doi: 10.13926/j.cnki.apps.2011.03.018.
Niu J S, Liu J, Ni Y J, Yin J. Introduction of PR-1, PR-2, PR-5, Ta-JA2 and wheat powdery mildew resistance in response to MeJA treatment[J]. Acta Phytophologica Sinica,2011, 41(3): 270-277.
[26] 王帅. 芽孢杆菌及其脂肽类化合物防治植物病害和促进植物生长的研究[D]. 南京:南京农业大学, 2009.
Wang S. Plant growth promotion and control of plant disease with Bacillus spp. and lipopeptide[D]. Nanjing: Nanjing Agricultural University, 2009.
[27] 张维娜. 普城沙雷菌A21-4对辣椒诱导抗性机理的初步研究[D]. 郑州:河南农业大学, 2013.
Zhang W N. Preliminary study on mechanism of induced systemic resistance by Serratia plymuthica A21-4[D]. Zhengzhou:Henan Agricultural University, 2009.
[28] 张荣胜. 水稻细菌性条斑病菌遗传多样性研究与生防菌剂研发[D]. 南京:南京农业大学, 2012.
Zhang R S. Genetic diversity of Xanthomonas oryzae pv. oryzicola strains and research and development of biocontrol agents[D]. Nanjing:Nanjing Agricultural University, 2012.