土壤盐渍化是制约农业发展的重要非生物逆境。盐渍地上由于NaCl大量积累,植物遭受渗透胁迫、离子毒害及氧化胁迫,造成植物种子萌发率降低、叶绿素降解及光合速率降低,从而影响植物的生长[1]。盐胁迫下植株体内离子代谢不均衡,Na+、Cl-等有害离子积累,而P、K+及![]() 含量降低及其他矿质营养缺乏[2]。
含量降低及其他矿质营养缺乏[2]。
氮被称为植物的“生命元素”,一些报道发现盐胁迫抑制氮吸收和代谢,尤其影响硝酸盐的吸收。氮代谢水平可以通过氮形态及氮代谢相关酶活性变化表现出来。盐胁迫影响植株![]() 含量的吸收,体内
含量的吸收,体内![]() 下降[3];盐胁迫下
下降[3];盐胁迫下![]() 含量的变化不同植物反应不同[4-5]。不同植物参与氮代谢酶活性在盐胁迫下有不同表现,Singh等[4]发现番茄幼苗在NaCl处理后硝酸还原酶(NR)、亚硝酸还原酶(NiR)活性及参与氨同化的谷氨酰胺合成酶(GS)、谷氨酸合酶(GOGAT)活性均下降,谷氨酸脱氢酶(GDH)活性升高;张毅等[5]发现盐胁迫下的番茄幼苗中天冬氨酸转氨酶(AST)活性下降;Surabhi等[6]发现盐胁迫下桑树幼苗GS、GOGAT、GDH及AST及丙氨酸氨基转移酶(ALAT)活性均升高。盐胁迫下不同抗性植物品种氮代谢存在差异,
含量的变化不同植物反应不同[4-5]。不同植物参与氮代谢酶活性在盐胁迫下有不同表现,Singh等[4]发现番茄幼苗在NaCl处理后硝酸还原酶(NR)、亚硝酸还原酶(NiR)活性及参与氨同化的谷氨酰胺合成酶(GS)、谷氨酸合酶(GOGAT)活性均下降,谷氨酸脱氢酶(GDH)活性升高;张毅等[5]发现盐胁迫下的番茄幼苗中天冬氨酸转氨酶(AST)活性下降;Surabhi等[6]发现盐胁迫下桑树幼苗GS、GOGAT、GDH及AST及丙氨酸氨基转移酶(ALAT)活性均升高。盐胁迫下不同抗性植物品种氮代谢存在差异,![]() 同化过程可能与耐盐性相关。盐胁迫下耐盐荞麦叶片比盐敏感品种能保持较高的
同化过程可能与耐盐性相关。盐胁迫下耐盐荞麦叶片比盐敏感品种能保持较高的![]() 含量、NR和NiR活性[7],不同抗性甜菜也具有相似表现[8]。植物地上部分和地下部分对盐胁迫的响应存在差异,玉米幼苗在盐胁迫后根系NR活性比对照提高而叶片中酶活性降低[9],在番茄中NR和GS在叶中酶活性降低而根中酶活性升高。盐胁迫下不同响应差异反映出氮代谢的复杂性[3]。
含量、NR和NiR活性[7],不同抗性甜菜也具有相似表现[8]。植物地上部分和地下部分对盐胁迫的响应存在差异,玉米幼苗在盐胁迫后根系NR活性比对照提高而叶片中酶活性降低[9],在番茄中NR和GS在叶中酶活性降低而根中酶活性升高。盐胁迫下不同响应差异反映出氮代谢的复杂性[3]。
盐胁迫对植物氮代谢的影响在分子水平上也初步进行研究,Lü 等[10]研究了鳗草在NaCl胁迫下的转录组,发现盐胁迫后鳗草的NR、NiR基因表达显著上调。相比盐胁迫下氮代谢酶活性的研究,氮代谢相关基因在盐胁迫后的表达变化报道较少。
水稻是重要的粮食作物,盐胁迫下氮代谢调节机制将对整个生命活动起到重要作用,但盐胁迫下氮代谢整个过程的研究还不够系统、深入,特别是不同抗性品种氮代谢相关基因在盐胁迫下差异表达有待研究。
为了探讨水稻的耐盐机制,本研究以抗性品种东稻4号和盐敏感品种日本晴为材料,研究水稻幼苗根和叶中氮的吸收![]() 的还原及氨同化过程中相关酶活性及基因的表达变化,以探讨抗盐性与氮代谢的关系,为抗性水稻品种的培育及关键基因的筛选提供参考。
的还原及氨同化过程中相关酶活性及基因的表达变化,以探讨抗盐性与氮代谢的关系,为抗性水稻品种的培育及关键基因的筛选提供参考。
1.1.1 试验材料 试验选用抗性粳稻(Oryza sativa subsp. Keng)品种东稻4号以及盐敏感品种日本晴(Oryza sativa L.spp.japonica)。
将水稻种子用0.1%的HgCl2消毒10 min,用蒸馏水冲洗3~4次,于蒸馏水中浸泡12 h,然后将种子置于培养皿中,在28 °C恒温培养箱中催芽萌发。
将萌发后种子置于96孔板中进行水培,培养液为1/4 Hoagland营养液(pH值6.0),光周期/黑暗为14 h/10 h,温度29 ℃/25 ℃。培养12 d后进行盐胁迫处理。
1.1.2 试验材料的处理 青岛农业大学植物生理实验室前期试验表明,在0.3%的NaCl胁迫下2个水稻品种有显著差异,因此,盐处理液用1/4 Hoagland营养液配制成0.3%的NaCl溶液,对照组为1/4 Hoagland营养液。每天更换一次培养液。处理24 h,取根和叶用于基因的检测;4 d后,对水稻幼苗叶和根进行取样,用于相关生理指标的测定,所取材料保存于-80 ℃超低温冰箱中。
1.2.1 氮相关物质含量的测定 铵态氮含量测定采用茚三酮显色法[11],硝态氮含量测定采用水杨酸-硫酸显色法[12]。
1.2.2 氮代谢相关酶活性的测定 硝酸还原酶活性参照施晟璐等[13]的方法,谷氨酰胺合成酶GS活性测定参照刘丽等[14]的方法;谷氨酸合成酶NADH-GOGAT及谷氨酸脱氢酶GDH活性测定,参照林清华等[15]的方法;谷氨酸合成酶Fd-GOGAT的测定参照滕祥勇[16]的方法;天冬氨酸转氨酶AST活性测定参照梁成刚等[17]的方法。
1.2.3 氮代谢基因表达量测定 采用改良TRIzol法提取总RNA[18]。利用实时荧光定量PCR技术检测氮代谢相关基因,包括硝酸根转运蛋白基因OsNRT1;1、OsNRT1;5、OsNRT1;8和OsNRT2;1,铵转运蛋白基因OsAMT1;1和OsAMT1;2,硝酸还原酶基因OsNR1,谷氨酰胺合成酶基因OsGS1;2及谷氨酸合酶基因OsNADH-GOGAT和OsFd-GOGAT以及天冬氨酸转氨酶基因OsAS。水稻基因名称和引物设计见表1。PCR扩增程序为:95 ℃ 30 s;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,40个循环;从72 ℃至99 ℃,第1步维持45 s,以后每升高1 ℃维持5 s,按2-ΔΔCT方法计算。
表1 基因定量表达引物序列
Tab.1 The primers sequences for quantitative expression of genes

基因名称Gene name引物序列Primer sequence上游引物 Forward primer下游引物 Reverse primerOsNRT1;1 GGGCAGAGTTCAGCAATCGGGAAGGACGCCGCAGGTOsNRT1;5TGTCATTGGACTTTCATCGCCCCACAACCTCTTGGTCTAATCOsNRT1;8GGCTTCAGATTCTTGGATAGAACCACAGAGTAGAGGATGGOsNRT2;1ACGGCACAAAGTACAAGACGCCACTGCGGGAAGTAGATGOsAMT1;1GCCTCCAACAGCAACAACC CCAAACAGAAACTGGCAATCAOsAMT1;2CACGGTGGCGATGAAAGG TTGGAGATGGTGGTGAAGGACOsNR1 CCTACTACTAAATTATACGCACCG CAGGAAGGAATCAACCGCTAOsGS1;2 GCCCACAGGGACCATACTACT CGTTGATGCCACTGATGTTGATOsNADH-GOGAT TTGCGGTTACAAGACACTCTAC TG GCTCCCGTCCCTCCATCAOsFd-GOGAT TGGTCTCCGCCCAGCAC CAGTTTGTAGGTCAACCGTTATCATOsASGCCCTATTTACCTAAGCACATTC AGGCTGCGTCCCATTCA
所有试验数据至少3次重复,用Excel数据处理系统作图,用SAS V8对测定结果进行显著性分析,不同小写字母的差异代表在P<0.05水平上显著。
无机态的硝态氮和铵态氮是植物的主要氮源。植物吸收![]() 除了主要作为营养外,也作为渗透调节物质和信号分子起作用。铵态氮来源比较多,可以来自土壤的吸收、硝态氮的还原,也来自体内氨基酸的分解。从图1-A可以看出,硝态氮(以鲜质量计)在水稻根部的积累量显著高于叶部,盐胁迫后根部硝态氮含量显著下降,日本晴下降幅度大,根和叶分别下降39.5%和63.0%,东稻4号根硝态氮含量均显著高于日本晴,叶中高于日本晴,但不显著。铵态氮(以鲜质量计)与硝态氮情况相反(图1-B),叶中的含量显著高于根部,盐胁迫后铵态氮含量都显著升高,日本晴根和叶铵态氮含量比对照分别升高116.0%和43.7%,盐胁迫后显著高于东稻4号。东稻4号硝态氮降低和铵态氮的升高幅度较小,在盐胁迫下保持水稻氮含量稳定。
除了主要作为营养外,也作为渗透调节物质和信号分子起作用。铵态氮来源比较多,可以来自土壤的吸收、硝态氮的还原,也来自体内氨基酸的分解。从图1-A可以看出,硝态氮(以鲜质量计)在水稻根部的积累量显著高于叶部,盐胁迫后根部硝态氮含量显著下降,日本晴下降幅度大,根和叶分别下降39.5%和63.0%,东稻4号根硝态氮含量均显著高于日本晴,叶中高于日本晴,但不显著。铵态氮(以鲜质量计)与硝态氮情况相反(图1-B),叶中的含量显著高于根部,盐胁迫后铵态氮含量都显著升高,日本晴根和叶铵态氮含量比对照分别升高116.0%和43.7%,盐胁迫后显著高于东稻4号。东稻4号硝态氮降低和铵态氮的升高幅度较小,在盐胁迫下保持水稻氮含量稳定。
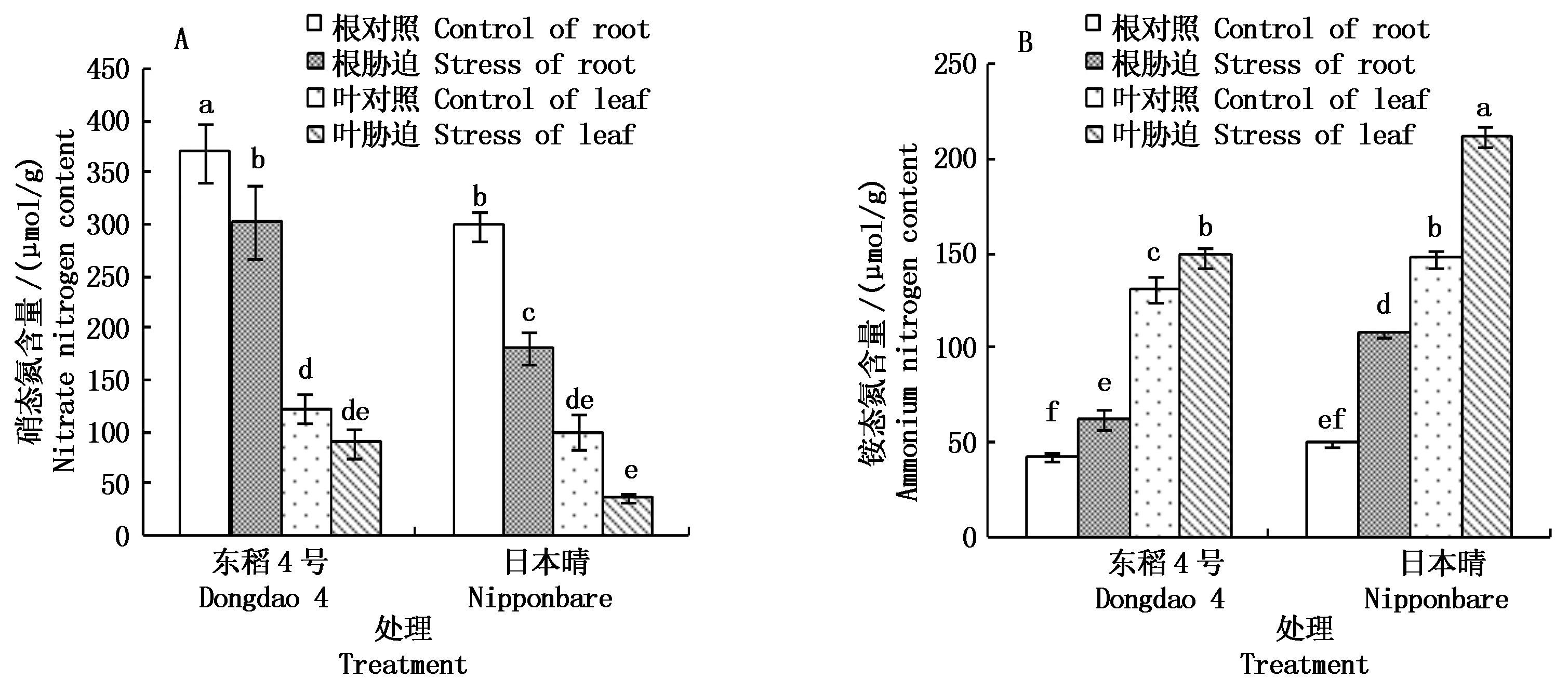
不同小写字母表示处理间差异显著(P<0.05)。图2-7同。 Different lowercase letters represents significant difference among treatments(P<0.05).The same as Fig.2-7。
图1 NaCl胁迫下水稻根和叶中硝态氮和铵态氮含量的变化
Fig.1 Changes of nitrate nitrogen and ammonium nitrogen contents in roots and leaves of different rice varieties under NaCl stress
![]() 必须还原为
必须还原为![]() 才能被植物利用,NR是
才能被植物利用,NR是![]() 还原过程中的限速酶,其活性高低反映植物氮代谢能力。从图2可知,叶部NR活性显著高于根部,说明水稻叶部具有较强的硝酸盐还原能力。正常情况下东稻4号根和叶中NR活性均显著高于日本晴,这说明不同抗性水稻硝酸盐还原能力存在差异。NaCl胁迫后NR活性都有显著降低,但东稻4号较日本晴降幅小。NR是诱导酶,NR活性降低可能是
还原过程中的限速酶,其活性高低反映植物氮代谢能力。从图2可知,叶部NR活性显著高于根部,说明水稻叶部具有较强的硝酸盐还原能力。正常情况下东稻4号根和叶中NR活性均显著高于日本晴,这说明不同抗性水稻硝酸盐还原能力存在差异。NaCl胁迫后NR活性都有显著降低,但东稻4号较日本晴降幅小。NR是诱导酶,NR活性降低可能是![]() 含量下降的一种适应性反应,也可能是NaCl胁迫抑制了NR的合成。
含量下降的一种适应性反应,也可能是NaCl胁迫抑制了NR的合成。
谷氨酸合成酶循环是氨同化的主要途径,谷氨酰胺合成酶(GS)催化![]() 同化生成谷氨酰胺,再由谷氨酸合酶(GOGAT)催化谷氨酰胺与α-酮戊二
同化生成谷氨酰胺,再由谷氨酸合酶(GOGAT)催化谷氨酰胺与α-酮戊二
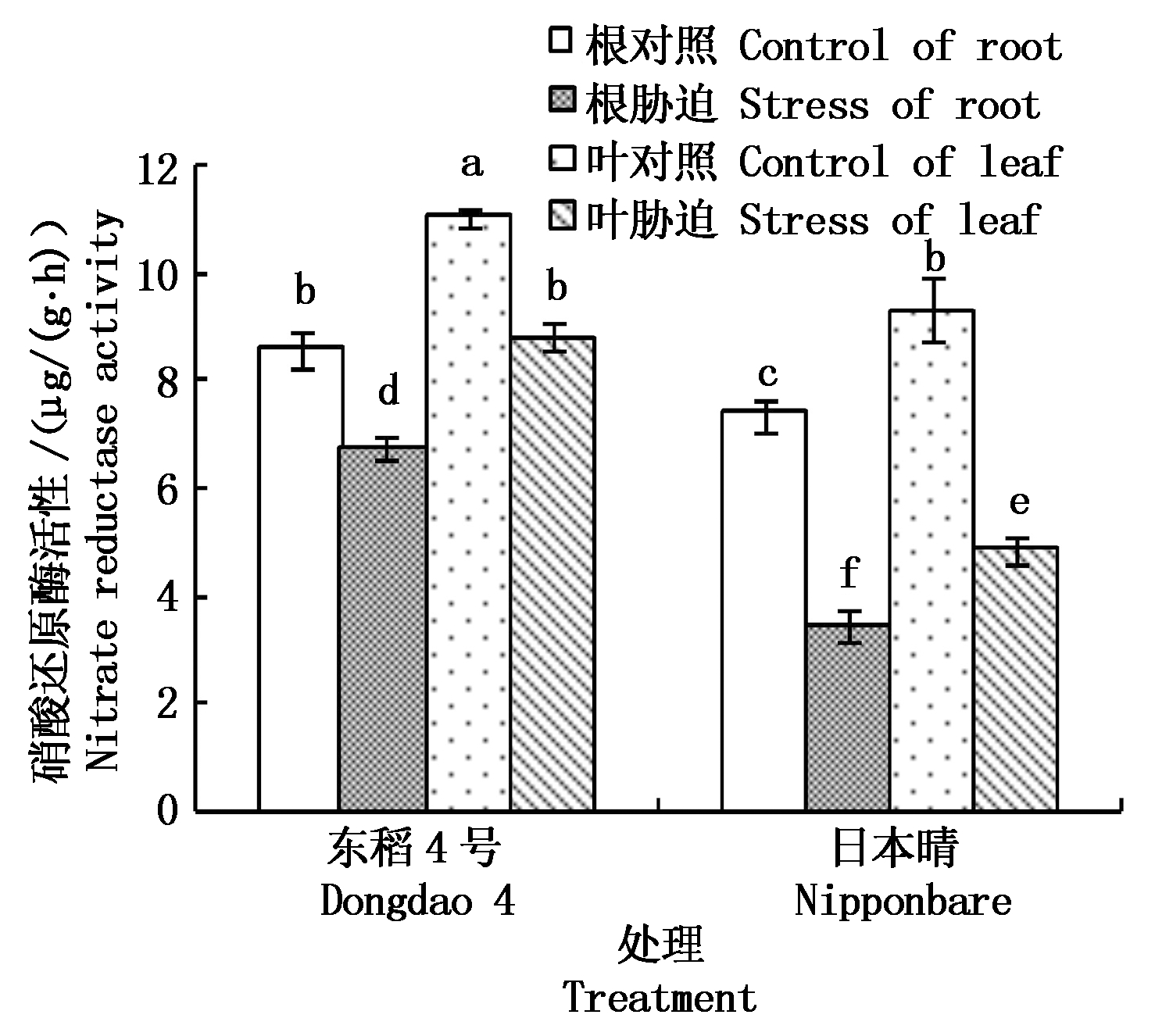
图2 NaCl胁迫下不同品种水稻根和叶中NR活性的变化
Fig.2 Changes of nitrate reductase activity in roots and leaves of different rice varieties under NaCl stress
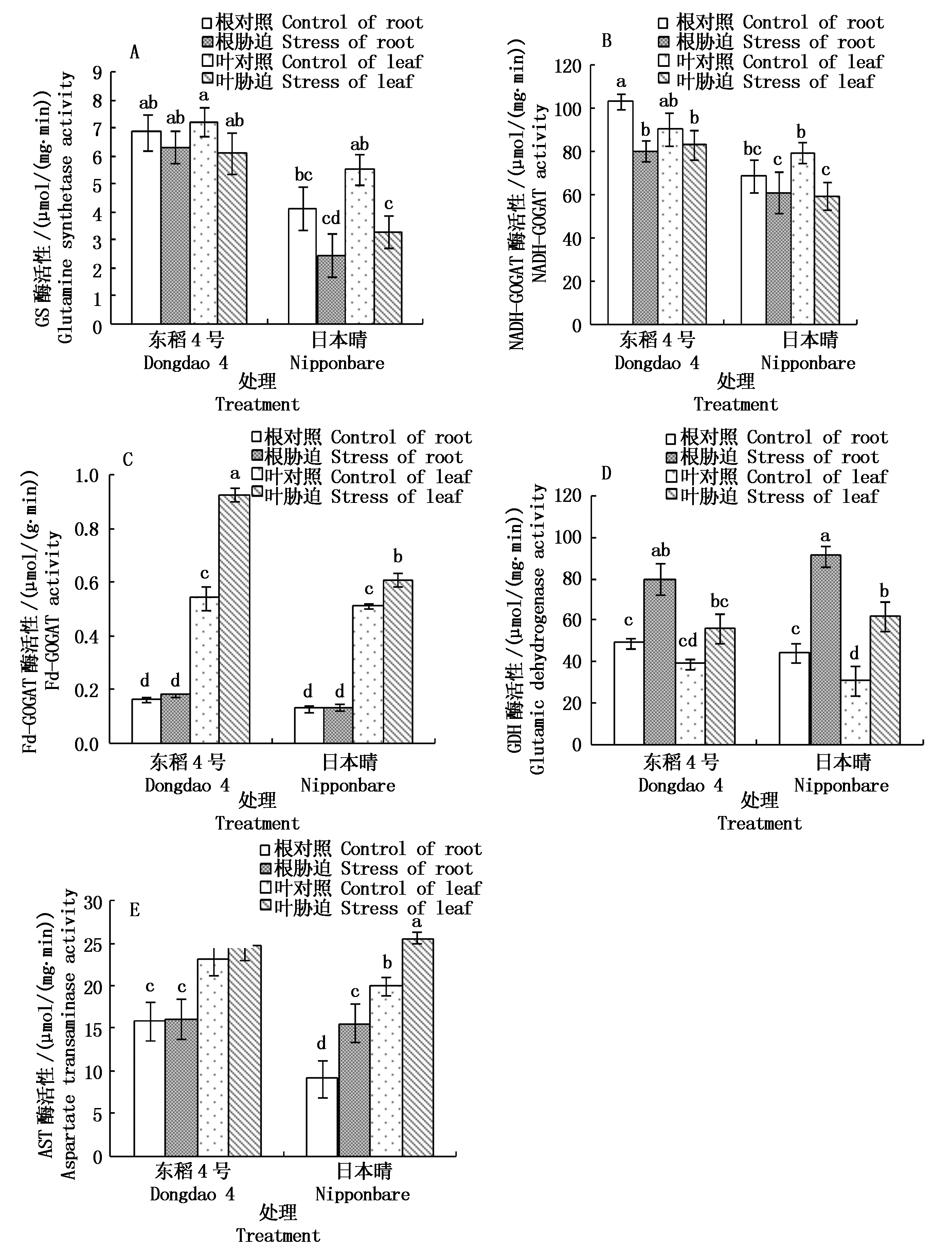
图3 NaCl胁迫下不同品种水稻根和叶中氨同化相关酶活性的变化
Fig.3 Changes of ammonium assimilation enzymes in roots and leaves of different rice varieties under NaCl stress
酸合成2分子谷氨酸。由图3-A可知,东稻4号的GS活性高于日本晴,根和叶中差异不显著。NaCl胁迫后GS活性下降, 日本晴中下降较多。以NADH作为电子供体的NADH-GOGAT(图3-B)表现出与GS相似的趋势,而以Fd作为电子供体的Fd-GOGAT(以鲜质量计)(图3-C)在叶中的活性显著高于根部,在盐胁迫后升高,且东稻4号叶片活性的增加显著高于日本晴,这也增强了东稻4号对氨的同化能力。谷氨酸脱氢酶(GDH)是在氨基酸分解过程中起主要作用的一种酶,在![]() 浓度较高时催化逆反应进行氨基酸的合成。由图3-D可知,NaCl胁迫后,根和叶中GDH酶活性升高,日本晴升高的幅度稍高于东稻4号,但品种间差异不大。这表明氨同化依赖GDH的途径增强,也可能氨基酸分解增强。
浓度较高时催化逆反应进行氨基酸的合成。由图3-D可知,NaCl胁迫后,根和叶中GDH酶活性升高,日本晴升高的幅度稍高于东稻4号,但品种间差异不大。这表明氨同化依赖GDH的途径增强,也可能氨基酸分解增强。![]() 离子在同化为谷氨酸后可以通过转氨作用生成新的氨基酸,天冬氨酸转氨酶(AST)催化天冬氨酸的形成。图3-E显示,盐胁迫使AST酶活性均有升高,品种间差异不显著,盐胁迫下AST酶活性上升也许是对
离子在同化为谷氨酸后可以通过转氨作用生成新的氨基酸,天冬氨酸转氨酶(AST)催化天冬氨酸的形成。图3-E显示,盐胁迫使AST酶活性均有升高,品种间差异不显著,盐胁迫下AST酶活性上升也许是对![]() 升高的一种反映。
升高的一种反映。
2.4.1 NaCl胁迫对不同水稻品种硝酸盐转运蛋白(OsNRTs)基因表达量的影响 本试验研究了盐胁迫下水稻硝酸盐转运蛋白OsNRT1家族OsNRT1;1、OsNRT1;5和OsNRT1;8基因及OsNRT2家族OsNRT2;1基因的相对表达量变化。OsNRT1;1编码双亲和转运体,OsNRT1;5和OsNRT1;8编码低亲和转运体(Low-affinity transporters,LATs)[19],而OsNRT2家族均为高亲和转运体(High-affinity transporters,HATs)[20]。由图4可知,不同的基因在根和叶中的表达量差异很大。OsNRT1;1(图4-A)和OsNRT1;5(图4-B)表达相似,叶中的表达量高于根部;OsNRT1;8(图4-C)和OsNRT2;1(图4-D)在根中的表达量高于叶部,这些OsNRTs基因在盐胁迫后都有升高,总体上来看,抗性品种东稻4号的相对表达量高于日本晴,这也许说明东稻4号有较强的![]() 吸收及转运能力。
吸收及转运能力。

图4 NaCl胁迫下不同品种水稻根和叶中硝酸盐转运蛋白基因(OsNRTs)相对表达量的变化
Fig.4 Changes of OsNRTs relative expression in roots and leaves of different rice varieties under NaCl stress
2.4.2 NaCl胁迫对不同水稻品种铵态氮转运蛋白(OsAMTs )基因表达量的影响 植物铵态氮转运蛋白(AMT)负责对环境中![]() 吸收和转运,本研究对水稻OsAMT1家族OsAMT1;1和OsAMT1;2基因表达进行研究。结果发现,OsAMT1;1(图5-A)主要在根中表达,OsAMT1;2(图5-B)在根和叶中均有表达,两基因盐胁迫后表达量升高,OsAMT1;2在日本晴根和叶中分别升高5.8,1.9倍,而东稻4号叶中显著升高,但根中升高不显著。在盐胁迫下日本晴中OsAMT1;1和OsAMT1;2升高幅度较大,且二者在日本晴根中的相对表达量显著高于东稻4号,而OsAMT1;2在叶中的相对表达量显著低于东稻4号。
吸收和转运,本研究对水稻OsAMT1家族OsAMT1;1和OsAMT1;2基因表达进行研究。结果发现,OsAMT1;1(图5-A)主要在根中表达,OsAMT1;2(图5-B)在根和叶中均有表达,两基因盐胁迫后表达量升高,OsAMT1;2在日本晴根和叶中分别升高5.8,1.9倍,而东稻4号叶中显著升高,但根中升高不显著。在盐胁迫下日本晴中OsAMT1;1和OsAMT1;2升高幅度较大,且二者在日本晴根中的相对表达量显著高于东稻4号,而OsAMT1;2在叶中的相对表达量显著低于东稻4号。
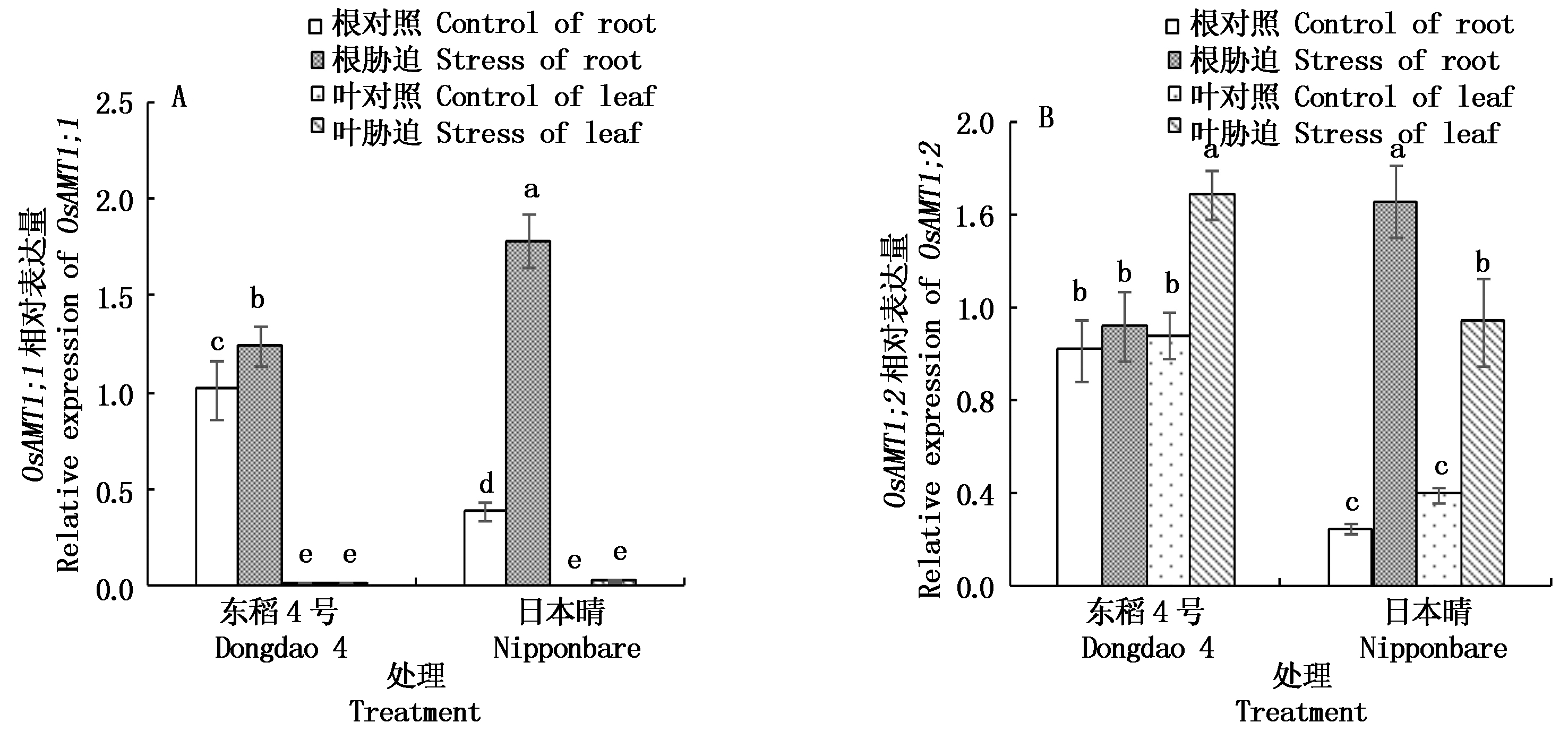
图5 NaCl胁迫下不同品种水稻根和叶中铵态氮转运蛋白(OsAMTs)基因相对表达量的变化
Fig.5 Changes of OsAMTs relative expression in roots and leaves of different rice varieties under NaCl stress
2.4.3 NaCl胁迫对不同抗性水稻品种硝酸还原酶基因OsNR1表达量的影响 NR是![]() 还原过程中限速酶。由图6可知,水稻NR基因OsNR1在叶中的表达量远远高于根部,这也说明水稻中
还原过程中限速酶。由图6可知,水稻NR基因OsNR1在叶中的表达量远远高于根部,这也说明水稻中![]() 主要在叶中还原。盐胁迫后OsNR1的表达量在不同品种叶中均显著下降,无论是正常情况下还是盐胁迫后OsNR1在东稻4号的表达量都高于日本晴,从而也保持了相对较高的NR酶活性。
主要在叶中还原。盐胁迫后OsNR1的表达量在不同品种叶中均显著下降,无论是正常情况下还是盐胁迫后OsNR1在东稻4号的表达量都高于日本晴,从而也保持了相对较高的NR酶活性。
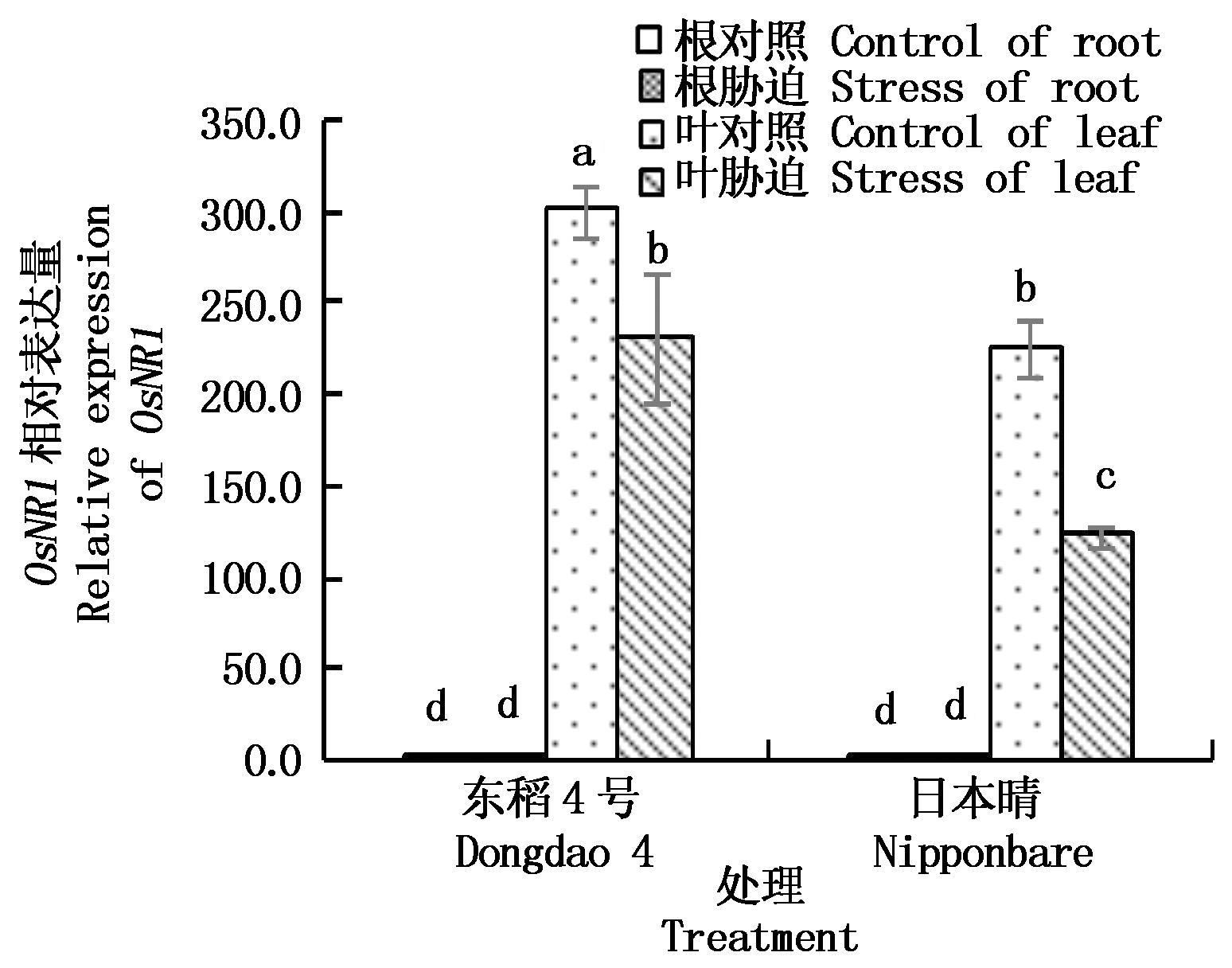
图6 NaCl胁迫下不同品种水稻根和 叶中硝酸还原酶基因相对表达量的变化
Fig.6 Changes of OsNR1 relative expression in roots and leaves of different rice varieties under NaCl stress
2.4.4 NaCl胁迫对不同抗性水稻中氨同化相关酶基因表达量的影响 谷氨酰胺合成酶基因OsGS1;2在根和叶中均有表达(图7-A),在NaCl胁迫后显著升高。谷氨酸合酶根据其电子供体的不同有NADH-GOGAT和Fd-GOGAT合成酶,分析其相应表达基因,由图7-B、C可知,OsNADH-GOGAT主要在根部表达,OsFd-GOGAT主要在叶中表达,除OsNADH-GOGAT在东稻4号根中没有显著升高外之外,NaCl胁迫后两基因在高表达部位都显著升高。在NaCl胁迫下东稻4号OsGS1;2和OsFd-GOGAT在主要部位表达量均高于日本晴,推测盐胁迫诱导GS和GOGAT酶活性降低,植株通过提高基因相对表达量来应对酶活性的下降。OsGDH 基因表达(图7-D)在盐胁迫后升高,除日本晴根之外,升高均不显著。天冬氨酸转氨酶(AST)基因OsAS(图7-E)在叶中的表达量显著高于根部,盐胁迫后除东稻4号根之外,均显著升高,可以看作对高浓度游离![]() 的一种反应。
的一种反应。
盐胁迫影响植物对矿质营养的吸收,造成氮、磷、钾等元素的缺乏[21-22],Gong等[23]认为Na+的积累和K+含量的降低导致![]() 含量的下降。本研究中NaCl胁迫下水稻根和叶
含量的下降。本研究中NaCl胁迫下水稻根和叶![]() 含量均显著下降,抗性品种东稻4号下降幅度较小。研究发现,不同抗性水稻在盐胁迫下表现不同,Wang等[24]发现抗性品种水稻在盐碱胁迫下硝态氮含量较高。基因的表达与抗性也有密切关系,不同品种表达量有差异。可能由于盐胁迫使水稻体内
含量均显著下降,抗性品种东稻4号下降幅度较小。研究发现,不同抗性水稻在盐胁迫下表现不同,Wang等[24]发现抗性品种水稻在盐碱胁迫下硝态氮含量较高。基因的表达与抗性也有密切关系,不同品种表达量有差异。可能由于盐胁迫使水稻体内![]() 含量降低,硝酸盐转运蛋白基因OsNRT1;1、OsNRT1;5、OsNRT1;8和OsNRT2;1表达量升高,增强水稻对硝酸盐的吸收及在体内的转运,以应对
含量降低,硝酸盐转运蛋白基因OsNRT1;1、OsNRT1;5、OsNRT1;8和OsNRT2;1表达量升高,增强水稻对硝酸盐的吸收及在体内的转运,以应对![]() 含量的下降,东稻4号的OsNRTs表达量总体上高于日本晴。王欢[25]也发现,水稻在碱胁迫后OsNRT2;1表达量升高。
含量的下降,东稻4号的OsNRTs表达量总体上高于日本晴。王欢[25]也发现,水稻在碱胁迫后OsNRT2;1表达量升高。
与硝态氮含量变化相反,铵态氮含量在盐胁迫后显著升高,且日本晴上升的幅度较大。在含硝态氮和铵态氮的溶液中,水稻优先利用铵态氮。研究发现,多种逆境条件下,植物体内硝态氮含量下降,![]() 含量增加[5-6]。但
含量增加[5-6]。但![]() 含量变化也有相反情况,Meng等[26]在杨树幼苗盐胁迫后发现
含量变化也有相反情况,Meng等[26]在杨树幼苗盐胁迫后发现![]() 含量下降。胁迫后
含量下降。胁迫后![]() 含量变化不同可能与植物种类及胁迫因素有关。铵态氮转运蛋白基因OsAMT1;1和OsAMT1;22个基因都受氮水平的影响,在氮浓度升高时上调表达[27]。
含量变化不同可能与植物种类及胁迫因素有关。铵态氮转运蛋白基因OsAMT1;1和OsAMT1;22个基因都受氮水平的影响,在氮浓度升高时上调表达[27]。
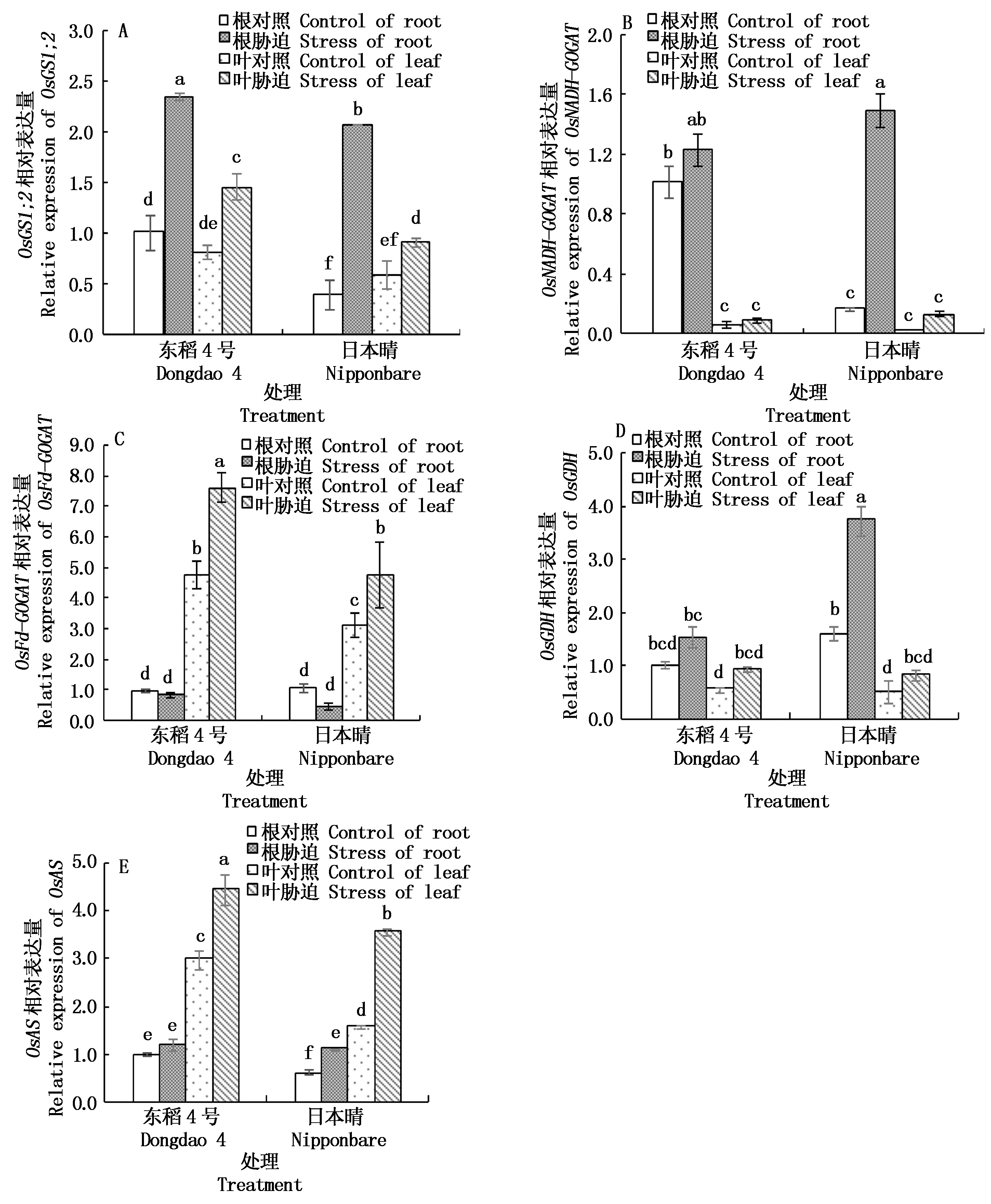
图7 NaCl胁迫下不同品种水稻根和叶中氨同化相关酶基因表达量的变化
Fig.7 Changes of relative expression of genes involved in ammonium assimilation in roots and leaves of different rice varieties under NaCl stress
![]() 可以作为重要的信号分子调节氮的代谢,盐胁迫使NR活性显著下降,NR活性降低可能受低浓度
可以作为重要的信号分子调节氮的代谢,盐胁迫使NR活性显著下降,NR活性降低可能受低浓度![]() 信号的影响,也可能盐胁迫直接影响了酶的活性,日本晴下降幅度较大。水稻NR活性及其基因OsNR1在叶中的表达量显著高于根部,这说明水稻中
信号的影响,也可能盐胁迫直接影响了酶的活性,日本晴下降幅度较大。水稻NR活性及其基因OsNR1在叶中的表达量显著高于根部,这说明水稻中![]() 主要在叶中还原。盐胁迫使OsNR1表达量下降,日本晴下降幅度较大,这与NR活性变化相一致。GS /GOGAT催化的谷氨酸合成酶循环是
主要在叶中还原。盐胁迫使OsNR1表达量下降,日本晴下降幅度较大,这与NR活性变化相一致。GS /GOGAT催化的谷氨酸合成酶循环是![]() 同化的主要途径,盐胁迫下GS和NADH-GOGAT酶活性下降,
同化的主要途径,盐胁迫下GS和NADH-GOGAT酶活性下降,![]() 同化能力减弱,为了防止
同化能力减弱,为了防止![]() 浓度升高造成毒害,研究还发现AST酶活性升高。东稻4号受影响较小,能保持较强的酶活性,特别是Fd-GOGAT活性在盐胁迫后升高,且叶中的活性显著高于根部。Berteli等[28]发现,盐胁迫后番茄叶中的Fd-GOGAT活性上升2倍。茄子、番茄在NaCl胁迫下GS、GOGAT活性均下降[4,23],Debouba等[3]发现,NR、GS在盐胁迫后番茄叶中活性下降,而根中升高。Surabhi等[6]发现,在桑葚叶中NR、GS、GOGAT活性均有升高表现,且抗性品种升高较多,Aydi等[29]发现,在NaCl胁迫下,水稻抗性品系比敏感品系能保持稳定的GS活性。
浓度升高造成毒害,研究还发现AST酶活性升高。东稻4号受影响较小,能保持较强的酶活性,特别是Fd-GOGAT活性在盐胁迫后升高,且叶中的活性显著高于根部。Berteli等[28]发现,盐胁迫后番茄叶中的Fd-GOGAT活性上升2倍。茄子、番茄在NaCl胁迫下GS、GOGAT活性均下降[4,23],Debouba等[3]发现,NR、GS在盐胁迫后番茄叶中活性下降,而根中升高。Surabhi等[6]发现,在桑葚叶中NR、GS、GOGAT活性均有升高表现,且抗性品种升高较多,Aydi等[29]发现,在NaCl胁迫下,水稻抗性品系比敏感品系能保持稳定的GS活性。
对氮代谢相关基因表达量进行研究,Cai等[30]发现,谷氨酰胺合成酶基因OsGS1;2 过表达突变体能增强对非生物胁迫的抵抗能力。本研究表明,OsGS1;2在NaCl胁迫后显著升高,与王欢[25]研究结果较一致。主要在根部表达的谷氨酸合酶基因OsNADH-GOGAT和在叶部表达的OsFd-GOGAT盐胁迫后都升高,以保持在盐胁迫下的GOGAT酶活性,东稻4号OsGS/OsFd-GOGAT表达量在胁迫条件下均高于日本晴,这与东稻4号GS/GOGAT酶活性高于日本晴相一致,同时升高表达量的还有OsAS基因,而Wang等[24]发现,水稻不同抗性品种在盐碱胁迫后OsNADH-GOGAT、OsFd-GOGAT、OsAS都有显著降低。
本研究中由于受盐胁迫影响,GDH酶活性及其基因OsGDH表达量均增加,且日本晴OsGDH表达量高于东稻4号。Wang等[24]在水稻中、Singh等[4]在茄子中均发现盐胁迫使GDH活性增强。谷氨酸脱氢酶GDH主要催化氨基酸的分解,只有![]() 浓度较高时才催化氨基酸的合成,有人认为GDH活性升高是依赖于GDH氨同化途径增强[5-6,24]。本研究中日本晴体内的
浓度较高时才催化氨基酸的合成,有人认为GDH活性升高是依赖于GDH氨同化途径增强[5-6,24]。本研究中日本晴体内的![]() 浓度高于东稻4号,那么高浓度的
浓度高于东稻4号,那么高浓度的![]() 可能是吸收增强,也可能由于氨同化速度变慢的积累,或者是GDH活性增强使氨基酸降解增加[31]。林清华等[15]根据GS/GDH 比值判断,无论有无NaCl胁迫,水稻的氨同化都以GS/GOGAT途径为主。
可能是吸收增强,也可能由于氨同化速度变慢的积累,或者是GDH活性增强使氨基酸降解增加[31]。林清华等[15]根据GS/GDH 比值判断,无论有无NaCl胁迫,水稻的氨同化都以GS/GOGAT途径为主。
本研究中根和叶部酶活性变化基本一致,不同基因在不同部位表达存在差异,但结果也表明,品种抗性与氮代谢相关基因表达量密切相关,也为进一步研究盐胁迫下氮代谢相关基因提出了必要性。
综合来看,抗性品种东稻4号在盐胁迫下保持了较高的氮代谢酶活性及较稳定的氮代谢方式,这也许是抗性水稻耐盐的一个重要原因。
[1] Guo R, Shi L X, Yang Y F. Germination, growth, osmotic adjustment and ionic balance of wheat in response to saline and alkaline stresses[J]. Soil Science and Plant Nutrition, 2009, 55(5):667-679. doi:10.1111/j.1747-0765.2009.00406.x.
[2] Meloni D A, Gulotta M R, Martínez C A. Salinity tolerance in Schinopsis quebracho colorado: seed, germination, growth, ion relations and metabolic response[J]. Journal of Arid Environments, 2008, 72(10): 1785-1792.doi:10.1016/j.jaridenv.2008.05.003.
[3] Debouba M, Gouia H, Suzuki A, Ghorbel M H. NaCl stress effects on enzymes involved in nitrogen assimilation pathway in tomato Lycopersicon esculentum seedlings[J]. Journal of Plant Physiology,2006,163(12): 1247-1258. doi:10.1016/j.jplph.2005.09.012.
[4] Singh M, Singh V P, Prasad S M. Responses of photosynthesis, nitrogen and proline metabolism to salinity stress in Solanum lycopersicum under different levels of nitrogen supplementation[J]. Plant Physiology and Biochemistry, 2016, 109: 72-83. doi: 10.1016/j.plaphy.2016.08.021.
[5] 张毅, 石玉, 胡晓辉, 邹志荣, 曹凯, 张浩. 外源Spd对盐碱胁迫下番茄幼苗氮代谢及主要矿质元素含量的影响[J].应用生态学,2013, 24(5): 1401-1408. doi: 10.13287/j.1001-9332.2013.0306.
Zhang Y, Shi Y, Hu X H, Zou Z R, Cao K,Zhang H. Effects of exogenous spermidine on the nitrogen metabolism and main mineral elements contents of tomato seedlings under saline-alkali stress[J]. Chinese Journal of Applied Ecology, 2013, 24(5): 1401-1408. doi: 10.13287/j.1001-9332.2013.0306.
[6] Surabhi G K, Reddy A M, Kumari G J, Sudhakar C.Modulations in key enzymes of nitrogen metabolism in two high yielding genotypes of mulberry (Morus alba L.) with differential sensitivity to salt stress[J]. Environmental and Experimental Botany, 2008, 64(2): 171-179. doi:10.1016/j.envexpbot.2008.04.006.
[7] 杨洪兵. 渗透胁迫和盐胁迫对荞麦硝酸还原酶及亚硝酸还原酶活性的影响[J]. 作物杂志,2013,29(3): 53-55. doi: 10.16035/j.issn.1001-7283.2013.03.016.
Yang H B. Effects of osmotic and salt and nitrite reductase stress on nitrate reductase activities of buckwheat[J]. Crops, 2013,29(3): 53-55.
[8] 刘洋, 李彩凤, 洪鑫, 徐颖, 郭剑, 陈明,于洋,王玉波,马凤鸣. 盐碱胁迫对甜菜氮代谢相关酶活性及产量和含糖率的影响[J]. 核农学报, 2015, 29(2): 397-404.doi:10.11869/j.issn.100-8551.2015.02.0397.
Liu Y, Li C F, Hong X, Xu Y, Guo J, Chen M, Yu Y, Wang Y B, Ma F M. Effects of saline-alkali stress on nitrogen metabolism activity and root yield and sugar content of suger beet[J]. Journal of Nuclear Agricultural Scierrces,2015, 29(2): 397-404.
[9] 斯琴巴特尔, 吴红英. 不同逆境对玉米幼苗根系活力及硝酸还原酶活性的影响[J]. 干旱地区农业研究, 2001,19(2): 67-70. doi:10.3321/j.issn:1000-7601.2001.02.012.
Sechenbater,Wu H Y. Effect of different stress on roots activity and nitrate reductase activity in Zea mays L.[J]. Agricultural Research in the Arid Areas, 2001,19(2): 67-70.
[10] Lü X F, Yu P, Deng W H, Li Y C. Transcriptomic analysis reveals the molecular adaptation to NaCl stress in Zostera marina L.[J]. Plant Physiol Biochem, 2018,130: 61-68.doi:10.1016/j.plaphy.2018.06.022.
[11] Krom M D. Spectrophotometric determination of ammonia:a study of a modified berthelot reaction using salicylate and dichloroisocyanurate[J]. Analyst, 1980, 105(1249): 305-316. doi:10.1039/AN9800500305.
[12] 于媛媛, 郭芸珲, 温立柱, 孙翠慧, 樊红梅, 孙宪芝, 王文莉, 孙霞, 郑成淑. 菊花基因组DNA甲基化水平对根系硝态氮吸收的影响[J]. 植物生理学报, 2018, 54 (5): 199-207. doi: 10.13592/j.cnki.ppj.2017.0514.
Yu Y Y, Guo Y H, Wen L Z, Sun C H, Fan H M, Sun X Z, Wang W L, Sun X, Zheng C S. Effects of DNA methylation level on the nitrate uptake of roots in Chrysanthemum morifolium[J]. Plant Physiology Communications, 2018, 54 (5): 199-207.
[13] 施晟璐,叶冰竹,张润枝,聂鹏卿,唐晓清,王康才. 缺氮和复氮对菘蓝幼苗生长及氮代谢的影响[J]. 西北植物学报,2015,35(3):523-529. doi:10.7606/j.issn.1000-4025.2015.03.0523.
Shi C L, Ye B Z, Zhang R Z, Nie P Q,Tang X Q,Wang K C. Effect of N deficiency and N recovery on growth and nitrogen metabolism of Isatia indigotica seedlings[J]. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(3): 523-529.
[14] 刘丽,邹德堂.氮素用量对水稻籽粒谷氨酰胺合成酶活性及产量的影响[J].东北农业大学学报,2009,40(10): 1-4. doi: 10.3969/j.issn.1005-9369.2009.10.001.
Liu L, Zou D T.Effect of nitrogen application on glutamine synthetase activity and yield of rice grain[J]. Journal of Northeast Agricultural University, 2009, 40(10): 1-4.
[15] 林清华, 李常健, 彭进, 张楚富. NaCl对水稻谷氨酸合酶和谷氨酸脱氢酶的胁迫作用[J]. 武汉植物学研究, 2000,18(3):206-210. doi:10.3969/j.issn.2095-0837.2000.03.007.
Lin Q H, Li C J, Peng J, Zhang C F. Effect of NaCl stress on glutamate synthase and glutamate dehydrogenase of rice plants[J]. Journal of Wuhan Botanical Research, 2000, 18(3):206-210.
[16] 滕祥勇. 甜菜谷氨酸合成酶(GOGAT)酶学特性及氮素对其酶活性的调控[D]. 哈尔滨:东北农业大学, 2012.
Teng X Y. Enzymological characteristics of glutamate synthase and nitrogen regulation on the enzyme activity in sugar beet (Beta vulgaris L.)[D]. Harbin: Northeast Agricultural University,2012.
[17] 梁成刚, 张青, 李敬,熊丹,许光利, 汪燕, 刘泉, 黄鹏,李天. 水稻灌浆期高温对天冬氨酸代谢酶活性及其家族氨基酸含量的影响[J]. 中国水稻科学,2013, 27(1):71-76. doi: 10.3969/j.issn.1001-7216.2013.01.010.
Liang C G, Zhang Q, Li J, Xiong D, Xu G L, Wang Y, Liu Q, Huang P, Li T. Effect of high temperature on aspartate metabolism enzyme activities and aspartate-family amino acids contents at rice grain-filling stage[J]. Chinese Journal of Rice Science, 2013, 27(1): 71-76.
[18] 郭扬,侯丽霞,朱丹,刘新.葡萄温度胁迫相关基因VvMIPS的克隆及功能分析[J].农业生物技术学报,2017,25(4):558-566. doi: 10.3969/j.issn.1674-7968.2017.04.005.
Guo Y, Hou L X, Zhu D, Liu X. Cloning and functional analysis of VvMIPS relevant to temperature stress in grape (Vitis vinifera) [J]. Journal of Agricultural Biotechnology, 2017,25(4):558-566.
[19] Lin C M, Koh S, Stacey G, Yu S M, Lin T Y, Tsay Y F. Cloning and functional characterization of a constitutively expressed nitrate transporter gene, OsNRT1, from rice[J]. Plant Physiology,2000,122(2): 379-388. doi: 10.1104/pp.122.2.379.
[20] Li W B, Wang Y, Okamoto M, Crawford N M, Siddiqi M Y,Glass A D M. Dissection of the AtNRT2.1∶AtNRT2.2 inducible high-affinity nitrate transporter gene cluster[J]. Plant Physiology, 2007, 143(1): 425-433. doi: 10.1104/pp.106.091223.
[21] Li Q, Yang A, Zhang W H. Comparative studies on tolerance of rice genotypes differing in their tolerance to moderate salt stress[J]. BMC Plant Biology, 2017, 17:141-154.doi:10.1186/s12870-017-1089-0.
[22] Wang H, Lin X, Cao S, Wu Z. Alkali tolerance in rice (Oryza sativa L.): growth, photosynthesis, nitrogen metabolism, and ion homeostasis[J]. Photosynthetica, 2015,53 (1):55-65. doi:10.1007/s11099-015-0079-4.
[23] Gong B, Wen D, VandenLangenberg K, Wei W, Yang F J, Shi Q H, Wang X F. Comparative effects of NaCl and NaHCO3 stress on photosynthetic parameters, nutrient metabolism, and the antioxidant system in tomato leaves[J]. Scientia Horticulturae, 2013, 157: 1-12. doi:10.1016/j.scienta.2013.03.032.
[24] Wang H, Zhang M S, Guo R, Shi D C, Liu B, Lin X Y, Yang C W. Effects of salt stress on ion balance and nitrogen metabolism of old and young leaves in rice(Oryza sativa L.) [J]. BMC Plant Biology, 2012, 12:194. doi: 10.1186/1471-2229-12-194.
[25] 王欢. 碱胁迫下水稻氮代谢调节机制[D]. 长春: 东北师范大学, 2013.
Wang H. Regulatory mechanisms of nitrogen metabolism under alkali stress in rice (Oryza sativa L.) [D]. Changchun: Northeast Normal University, 2013.
[26] Meng S, Su L, Li Y M, Wang Y J, Zhang C X, Zhao Z. Nitrate and ammonium contribute to the distinct nitrogen metabolism of Populus simonii during moderate salt stress[J]. PLoS One, 2016,11(3): e0150354. doi:10.1371/journal.pone.0150354.
[27] Kumar A, Silim S N, Okamoto M, Siddiqi M Y, Glass A D M. Differential expression of three members of the AMT1 gene family encoding putative high-affinity ![]() transporters in roots of Oryza sativa subspecies indica[J].Plant Cell Environ, 2003, 26(6): 907-914. doi:10.1046/j.1365-3040.2003.01023.x.
transporters in roots of Oryza sativa subspecies indica[J].Plant Cell Environ, 2003, 26(6): 907-914. doi:10.1046/j.1365-3040.2003.01023.x.
[28] Berteli F, Corrales E, Guerrero C, Ariza M J, Pliego F, Victoriano V. Salt stress increases ferrodoxin-dependen glutamate synthase activity and protein level in the leaves of tomato[J]. Physiologia Plantarum, 2008, 93(2): 259-264. doi: 10.1034/j.1399-3054.1995.930208.x.
[29] Aydi S, Sassi S, Debouba M, Hessini K, Larrainzar E, Gouia H, Abdelly C. Resistance of Medicago truncatula to salt stress is related to glutamine synthetase activity and sodium sequestration [J]. Journal of Plant Nutrition and Soil Science, 2010, 173(6): 892-899. doi: 10.1002/jpln.200900235.
[30] Cai H M, Zhou Y, Xiao J H, Li X H, Zhang Q F, Lian X M. Overexpressed glutamine synthetase gene modifies nitrogen metabolism and abiotic stress responses in rice[J]. Plant Cell Rep,2009, 28(3): 527-537. doi: 10.1007/s00299-008-0665-z.
[31] 黄国存,田波.高等植物中的谷氨酸脱氢酶及其生理作用[J].植物学报,2001,18(4):396-401.doi: 10.3969/j.issn.1674-3466.2001.04.002.
Huang G C, Tian B. The physiological role of glutamate dehydrogenase in higher plants[J]. Bulletin of Botany, 2001,18(4): 396-401.