近年来,由于工矿三废的排放、无机化肥的过量使用,导致有毒重金属在土壤中过量积累,严重污染环境,对人类健康造成巨大威胁 [1]。镉(Cadmium,Cd)作为有一种有害重金属,易被植物吸收,具有很强的生物毒性和化学活性,可以通过多种途径对植物产生毒害 [2]。
据联合国粮食及农业组织 FAOSTAT 数据库(2016年8月更新数据)统计2015年中国甜瓜的生产面积和产量均居世界第一位。薄皮甜瓜的生育期80~90 d,具有果实成熟期早,产值高等优势,可有效增加农民收入,同时可以填补夏初水果淡季市场供应的空白。湖南省的甜瓜生产和消费以薄皮甜瓜为主,产区主要集中在常德、益阳、邵阳、岳阳、长沙、衡阳、永州等地区 [3]。Cd2+在植物体内过量积累会破坏细胞内的氧化还原平衡,诱导细胞中活性氧物质的大量产生与积累,进而致使植物受到氧化损伤 [4]。近年来国内外有关镉对水稻、小麦等大田作物和黄瓜等蔬菜作物种子萌发、生理生化的影响已有不少报道 [2,5]。
2014年随着湖南省开展重金属超标地区种植结构的调整,在长株潭部分轻度和中度镉超标地区正在进行甜瓜的试种。本研究根据前期镉在薄皮甜瓜植株中的分布及低累积品种筛选的结果 [6],选用X-T-G(相对高积累品种)和IVF-28(相对低积累品种),研究不同浓度的Cd胁迫对薄皮甜瓜植株生长和生理生化特性的影响,揭示X-T-G和IVF-28薄皮甜瓜品种响应Cd胁迫的生理机制,为深入研究薄皮甜瓜Cd胁迫制提供理论依据。
1 材料和方法
1.1 试验材料
2017年4月,在湖南农业大学蔬菜瓜类研究所进行。供试薄皮甜瓜品种为X-T-G和IVF-28,X-T-G由湖南雪峰种业有限公司提供,IVF-28由中国农业科学院蔬菜花卉研究所甜瓜课题王怀松老师提供。挑选籽粒饱满的X-T-G和IVF-28种子,用0.5‰的次氯酸钠溶液浸泡消毒30 min,然后用灭菌的蒸馏水反复将种子表面的次氯酸钠冲洗干净,用湿纱布包裹,置于发芽箱中30 ℃催芽24 h,挑选芽长一致的甜瓜种子播于口径52 mm的育苗杯中,每品种播150杯,置于人工气候室内,光照16 h,温度25 ℃,黑暗8 h,温度18 ℃,每天用 Hoagland营养液补充到恒质量(维持含水量在75%)。当甜瓜幼苗第2片真叶长出时,进行不同浓度CdCl2胁迫,试验共设4个处理,营养液中Cd离子浓度(按CdCl2中Cd计)依次为0(对照,CK),30,60,100 mg/L,3次重复,每3 d更换1次营养液,7 d后当甜瓜幼苗第3片真叶显现时进行取样分析。
1.2 试验方法
1.2.1 测定指标和方法 株高和茎粗的测定:当甜瓜幼苗第3片真叶显现时,随机选取各处理3株甜瓜幼苗,用直尺测定甜瓜幼苗的株高、用数显游标卡尺测量甜瓜幼苗的下胚轴粗度。
每个处理选取5株长势基本一致的甜瓜幼苗,将植株从营养杯中取出,先用自来水冲洗植株根部表面的杂质,然后再用去离子水漂洗根部,用吸水纸吸干根系表面水分,并将根部和地上部于茎基切断分开,将根系放在扫描仪的托盘中,将盛有清水的托盘置于扫描仪上,然后用毛刷和镊子等工具使根系完全展开,最后利用根系分析系统(WinRHIZO,Regent Instruments Inc Cancand)对其进行扫描和分析。
抗氧化酶活性和抗氧化物质含量的测定:超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)、丙二醛(Malondialdehyde,MDA)、脯氨酸(Proline,PRO)、谷胱甘肽(Glutathione,GSH)、过氧化氢(Hydrogen peroxide,H2O2)的测定试剂盒均由南京建成生物工程研究所提供。
1.2.2 数据处理 试验数据采用SPSS 22.0软件进行统计分析,Microsoft Excel 2013作图。
2 结果与分析
2.1 不同浓度CdCl2对薄皮甜瓜植株生长的影响
从表1中数据可以看出,随着CdCl2浓度的增加,X-T-G和IVF-28甜瓜品种幼苗的生长受到抑制,X-T-G和IVF-28的株高、茎粗呈现逐渐降低的趋势,不同浓度处理间差异均达到了显著水平。
从表2中可以看出,随着CdCl2浓度的增加,2个甜瓜品种幼苗的总根长、根表面积、根体积和根尖数均呈现下降的趋势,30,60,100 mg/L Cd胁迫处理均与对照差异显著。其中,30,60,100 mg/L Cd处理下的IVF-28的根长分别为对照的32.04%,20.84%,22.62%,在100 mg/L时比60 mg/L时有所提高但差异未达显著水平,X-T-G的根长分别为对照的71.57%,35.85%,25.45%;30,60,100 mg/L Cd处理下IVF-28的根表面积分别为对照的54.31%,38.15%,41.15%,在100 mg/L时比60 mg/L时有所提高但差异未达显著水平,X-T-G的根表面积分别为对照的76.60%,38.02%,33.32%;30,60,100 mg/L Cd处理下IVF-28的根体积分别为对照的43.10%,36.21%,37.93%,100 mg/L时比60 mg/L时有所提高但差异未达显著水平,X-T-G的根体积分别为对照的49.21%,36.51%,33.33%;30,60,100 mg/L Cd处理下IVF-28的根尖数仅为对照的43.78%,26.97%,25.58%,X-T-G的根尖数仅为对照的69.50%,38.53%,31.99%。甜瓜根系分形维数亦随着CdCl2浓度的增加而下降,但不同品种各浓度之间差异显著性不同,IVF-28的分形维数在Cd处理与对照间差异均达到显著水平,其中100 mg/L Cd处理分形维数仅为对照的79.77%;X-T-G的根系分形维数在60,100 mg/L时与对照差异达到显著水平,100 mg/L的分形维数与其他Cd处理差异亦达显著水平,仅为对照的78.41%。
表1 不同浓度CdCl2对薄皮甜瓜地上部分生长的影响
Tab.1 Effect of CdCl2 in different concentration on the growth of the ground part of melon cm
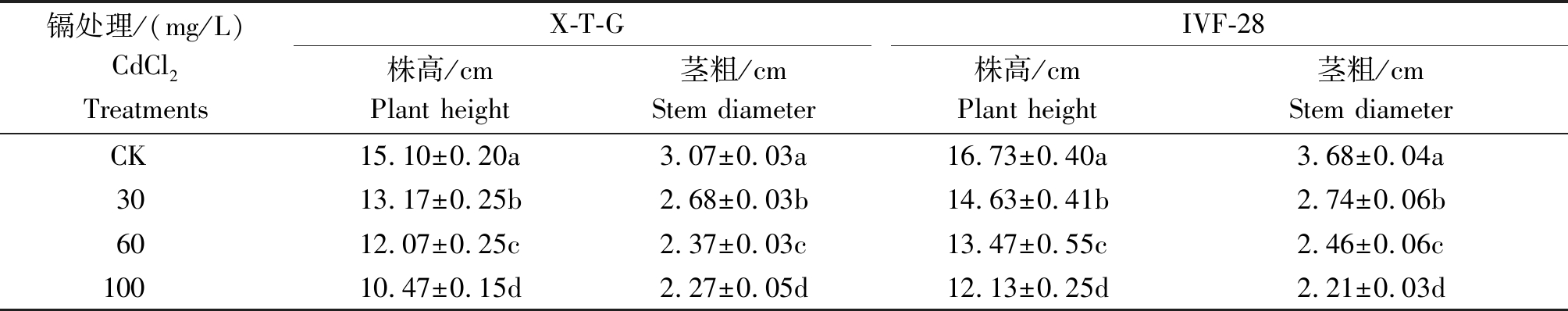
镉处理/(mg/L)CdCl2 TreatmentsX-T-GIVF-28株高/cmPlant height茎粗/cmStem diameter株高/cmPlant height茎粗/cmStem diameterCK15.10±0.20a3.07±0.03a16.73±0.40a3.68±0.04a3013.17±0.25b2.68±0.03b14.63±0.41b2.74±0.06b6012.07±0.25c2.37±0.03c13.47±0.55c2.46±0.06c10010.47±0.15d2.27±0.05d12.13±0.25d2.21±0.03d
注:同列数据后不同字母代表差异显著(P<0.05)。表2同。
Note: Different small letters indicates significant difference among treatments at 0.05 level.The same as Tab.2.
表2 不同浓度CdCl2对甜瓜根系生长的影响
Tab.2 Effect of CdCl2 in different concentration on the growth of the root of melon
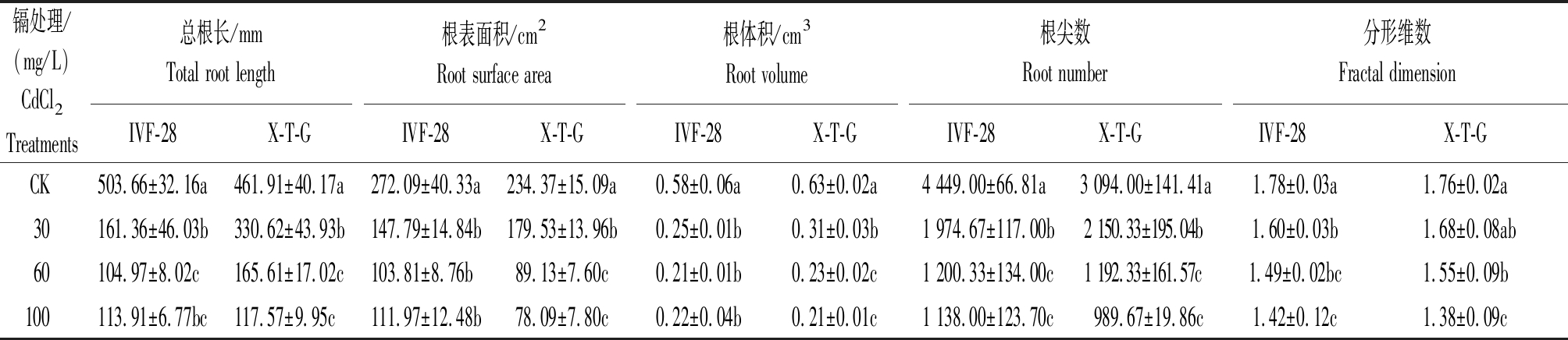
镉处理/(mg/L)CdCl2 Treatments总根长/mmTotal root length根表面积/cm2 Root surface area根体积/cm3 Root volume根尖数Root number分形维数Fractal dimensionIVF-28X-T-GIVF-28X-T-GIVF-28X-T-GIVF-28X-T-GIVF-28X-T-GCK503.66±32.16a461.91±40.17a272.09±40.33a234.37±15.09a0.58±0.06a0.63±0.02a4 449.00±66.81a3 094.00±141.41a1.78±0.03a1.76±0.02a30161.36±46.03b330.62±43.93b147.79±14.84b179.53±13.96b0.25±0.01b0.31±0.03b1 974.67±117.00b2 150.33±195.04b1.60±0.03b1.68±0.08ab60104.97±8.02c165.61±17.02c103.81±8.76b89.13±7.60c0.21±0.01b0.23±0.02c1 200.33±134.00c1 192.33±161.57c1.49±0.02bc1.55±0.09b100113.91±6.77bc117.57±9.95c111.97±12.48b78.09±7.80c0.22±0.04b0.21±0.01c1 138.00±123.70c989.67±19.86c1.42±0.12c1.38±0.09c
2.2 不同浓度CdCl2处理对甜瓜叶片保护酶体系的影响
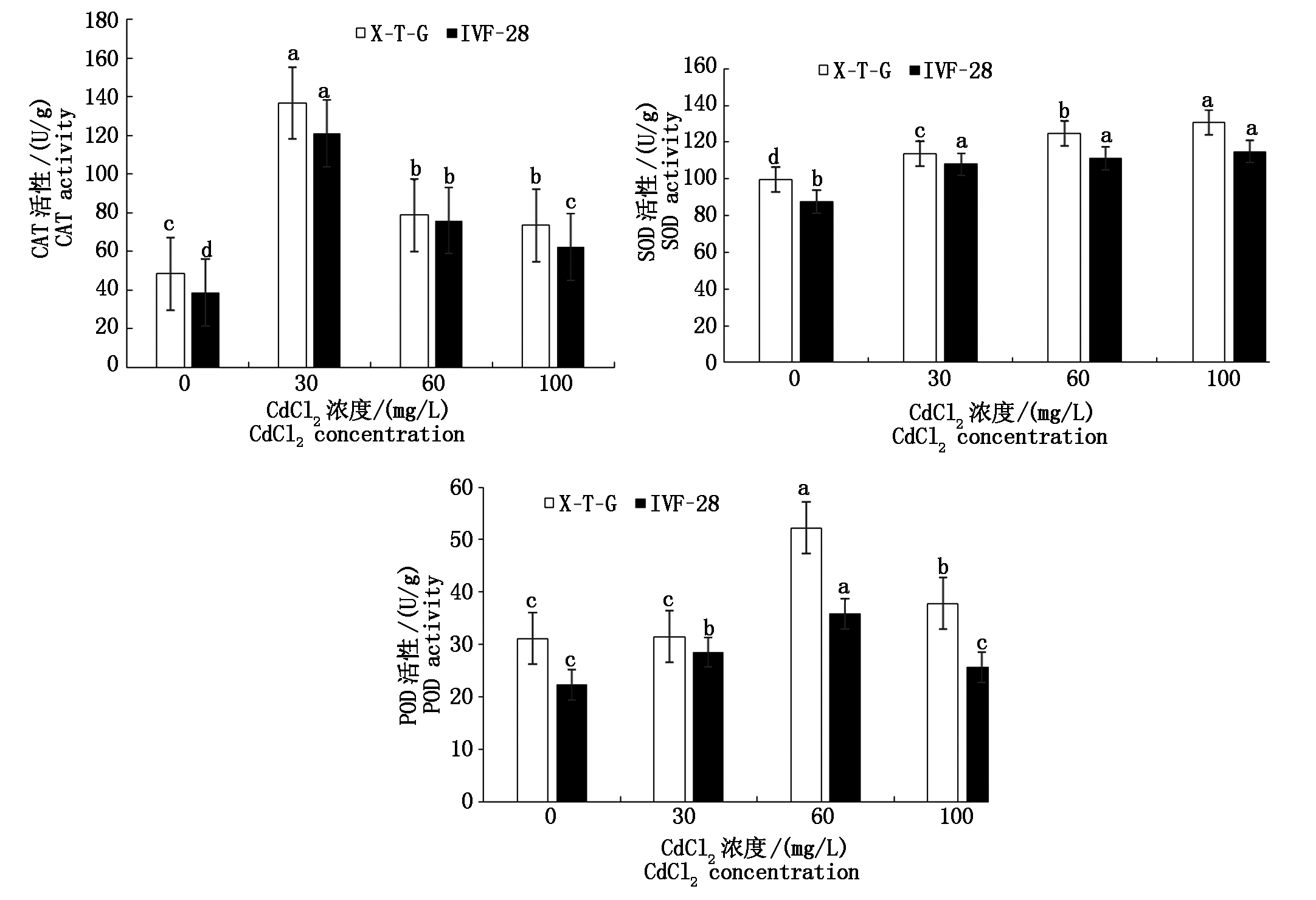
CAT、SOD、POD等酶的协同作用可以有效地帮助植物清除体内应对逆境胁迫产生的H2O2和![]() 防止活性氧或其他过氧化物自由基对细胞系统造成伤害,减缓叶绿素和蛋白质的降解,增强机体抗逆性,延长叶片功能期。从图1中可以看出,随着CdCl2浓度的增加,X-T-G和IVF-28薄皮甜瓜品种叶片中CAT活性(以鲜质量计)呈先升高后降低的趋势,Cd胁迫处理均显著高于对照,在30 mg/L的CdCl2胁迫时,X-T-G和IVF-28品种叶片的CAT活性最强。CdCl2处理提高了X-T-G和IVF-28叶片中SOD的活性(以鲜质量计),SOD的活性随着CdCl2浓度的增加呈增强的趋势,与对照的差异均达到显著水平。随着CdCl2浓度的增加,2个甜瓜品种体内的POD活性(以鲜质量计)呈先升高后降低的趋势,均于60 mg/L处理达到最大值,且CdCl2胁迫处理甜瓜POD活性均高于对照,其中,X-T-G在60,100 mg/L Cd处理及IVF-28在30,60 mg/L Cd处理叶片中POD活性与对照差异显著。
防止活性氧或其他过氧化物自由基对细胞系统造成伤害,减缓叶绿素和蛋白质的降解,增强机体抗逆性,延长叶片功能期。从图1中可以看出,随着CdCl2浓度的增加,X-T-G和IVF-28薄皮甜瓜品种叶片中CAT活性(以鲜质量计)呈先升高后降低的趋势,Cd胁迫处理均显著高于对照,在30 mg/L的CdCl2胁迫时,X-T-G和IVF-28品种叶片的CAT活性最强。CdCl2处理提高了X-T-G和IVF-28叶片中SOD的活性(以鲜质量计),SOD的活性随着CdCl2浓度的增加呈增强的趋势,与对照的差异均达到显著水平。随着CdCl2浓度的增加,2个甜瓜品种体内的POD活性(以鲜质量计)呈先升高后降低的趋势,均于60 mg/L处理达到最大值,且CdCl2胁迫处理甜瓜POD活性均高于对照,其中,X-T-G在60,100 mg/L Cd处理及IVF-28在30,60 mg/L Cd处理叶片中POD活性与对照差异显著。
2.3 不同浓度CdCl2对甜瓜叶片H2O2、MDA、GSH和PRO含量的影响
如图2所示,X-T-G和IVF-28叶片中的H2O2含量随着CdCl2胁迫浓度的增加呈增加趋势,不同浓度Cd处理间差异均达到了达到显著水平,且X-T-G在各浓度处理下H2O2含量均高于IVF-28。X-T-G和IVF-28 2个甜瓜品种叶片内MDA含量随Cd浓度的增加而逐渐增加,其中X-T-G MDA含量在不同Cd浓度处理间差异达到显著水平,IVF-28在100 mg/L CdCl2处理时MDA含量与对照及其他Cd胁迫处理差异显著,而30,60 mg/L CdCl2处理时MDA含量与对照差异未达到显著水平。随着CdCl2浓度的增加,X-T-G和IVF-28叶片中的GSH含量先增加后降低,Cd胁迫处理均显著高于对照,X-T-G各处理的GSH含量均高于IVF-28,在60 mg/L CdCl2处理下2个品种GSH的含量达到峰值。随着CdCl2浓度的增加,X-T-G和IVF-28叶片中PRO含量呈先升高后降低的趋势,二者均在30 mg/L CdCl2处理时达到最大值,X-T-G在Cd胁迫处理均显著高于对照,而IVF-28仅在30 mg/L CdCl2显著高于对照,其他Cd胁迫处理略低于对照但差异未达显著水平。
不同字母代表差异显著(P<0.05)。图2同。
Different small letters indicates significant difference among treatments at 0.05 level.The same as Fig.2.
图1 不同浓度Cd处理对甜瓜叶片CAT、SOD和POD活性的影响
Fig.1 Effect of cadmium treatment on CAT,SOD and POD activity in melon leaf
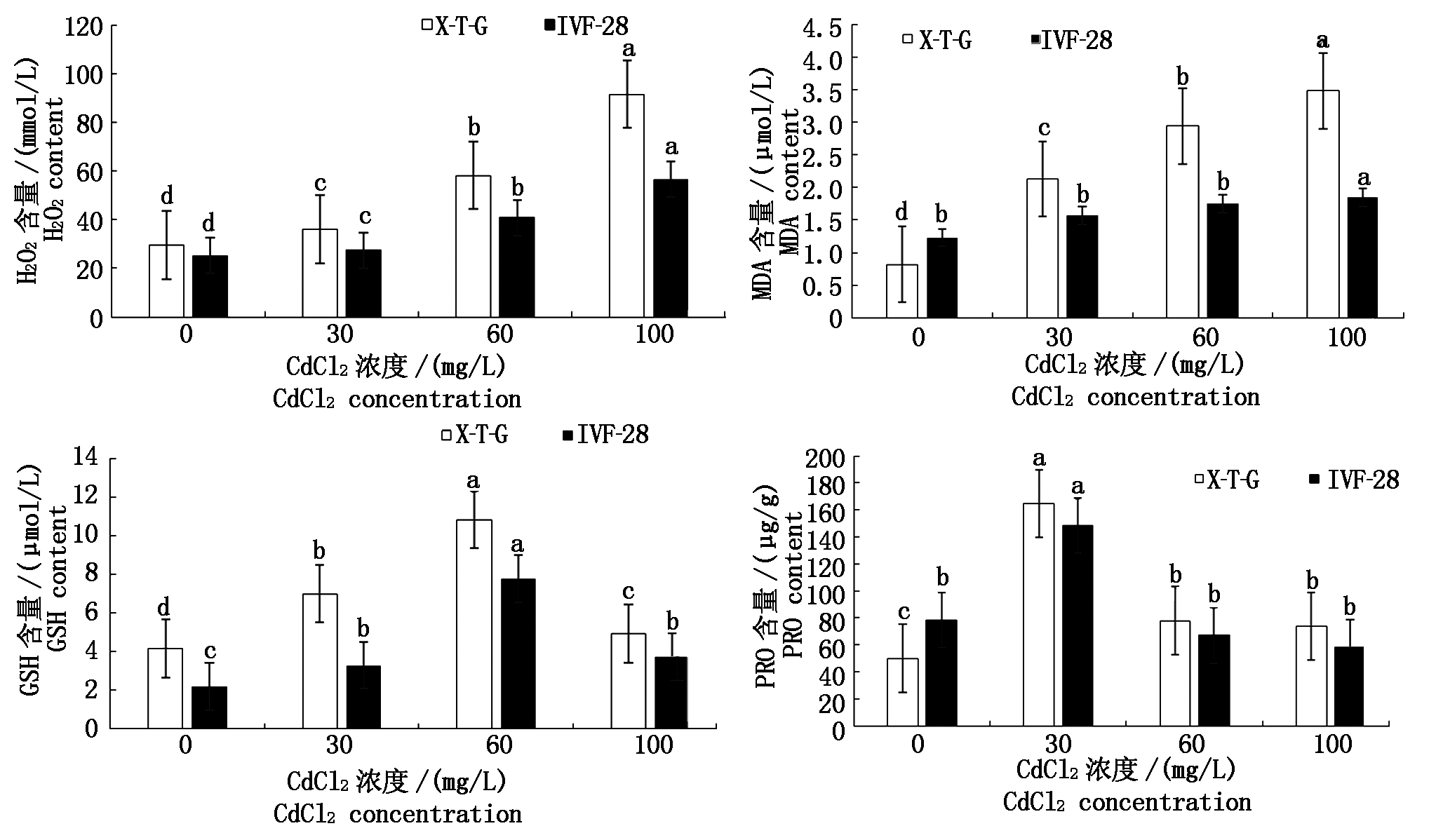
图2 不同浓度CdCl2对甜瓜叶片H2O2、MDA、GSH和PRO含量的影响
Fig.2 Effect of cadmium concentration on the content of H2O2,MDA,GSH and PRO in melon leaves
3 讨论
3.1 不同浓度Cd对甜瓜幼苗生长的影响
生长量是逆境胁迫对植物影响的综合体现及其对胁迫的综合适应。Cd是一种植物生长的非必需金属元素,在植物体内的积累量达到或超过一定数量时会对植物生长发育造成毒害甚至减产[6]。不同种属的植物或同一植物不同基因型的品种对Cd的解毒机制也不相同,通常情况下,植物受到重金属胁迫后会出现生理代谢紊乱,生长发育速度变缓的现象,容易增加农作物减产或绝收的风险[7]。张永平等[8]研究发现,低浓度的Cd处理对甜瓜生长影响不大,随着Cd浓度的增加,抑制作用增强,说明Cd对甜瓜生长的影响存在剂量效应,同时也表明不同品种的甜瓜对Cd的耐性存在差异。周建等[9]通过对Cd胁迫下刺槐幼苗生长的研究发现刺槐幼苗的株高、地径粗度、干质量受到的抑制程度随着土壤中Cd含量的增加而增加。何梨香等[10]研究发现圆叶决明在4 mg/kg Cd处理时,显著降低了植株生长量,地下部、地上部生物产量仅为对照的59.69%,63.77%,且随Cd浓度的升高,对圆叶决明生长的抑制作用加强。本研究表明,Cd对甜瓜幼苗生长有影响,甜瓜幼苗的株高和下胚轴的粗度随着CdCl2浓度的增加呈逐渐下降的趋势,不同浓度CdCl2处理与对照差异显著。植物主要依靠根系从土壤或培养介质中吸收矿质营养和水分,从而供给植物生长发育、新陈代谢等生理活动所必需的养分。因此,根系的生长情况直接影响到整个植株的生长发育,更易对土壤环境做出反应。当植物遭受盐胁迫时,植物根系感应并迅速发出信号,于是整个植株对胁迫做出反应,同时根系通过调整形态特征和生物量的分配来影响植物地上部的生长发育以适应盐胁迫环境。不同的植物有不同的生物量分配策略来适应盐胁迫,如海滨锦葵(Kosteletzkya virginica)[11]、圆柏(Juniperus chinensis)[12]等通过减少根系的生物量分配比例以降低盐分的吸收和向地上部的运输,而沙枣(Elaeagnus angustifolia)[13]、麻栎(Quercus acutissima)和弗吉尼亚栎(Quercus virginiana)[14]等则通过增加根系的生物量,改善根系对水分和养分的吸收,从而加快植物的生长,稀释进入体内的盐分。本研究中,随着CdCl2浓度的增加,2个甜瓜品种的株高逐渐降低,总根长、根表面积、根体积、根尖数和分形维数都呈下降趋势,与前人研究结果一致。
3.2 不同浓度Cd对甜瓜叶片生理生化的影响
一般认为植物体内通过SOD、POD和CAT等抗氧化保护酶系统和丙二醛、总酚、类黄酮、类胡萝卜素、抗坏血酸和谷胱甘肽等抗氧化物质控制活性氧平衡。CAT是一种含Fe的蛋白酶,主要是降解SOD的歧化产物H2O2,降低H2O2过量积累对植物组织和细胞的伤害[15]。SOD可以歧化细胞内的![]() 自由基,POD清除细胞产生的H2O2,3种保护酶协同作用,共同维持植物组织或细胞内
自由基,POD清除细胞产生的H2O2,3种保护酶协同作用,共同维持植物组织或细胞内![]() 和H2O2的平衡,达到减少植物体内羟自由基(-OH)形成的作用。SOD活性的高低可以反映出植物组织在胁迫条件下的应激调节能力[16]。Cd胁迫可激发甜瓜幼苗启动抗氧化酶系统及渗透调节系统,减少不利环境对植物的伤害。本试验中Cd胁迫提高了甜瓜叶片中3种酶的活性,表明了保护能力的启动和增强,是甜瓜应激产生的保护作用以降低膜质过氧化程度,清除氧自由基,抵御损伤,对甜瓜抗Cd引起的氧化胁迫有重要作用,其中在30 mg/L CdCl2胁迫中,X-T-G和IVF-28的CAT活性最高,而POD活性在60 mg/L时达到峰值,X-T-G和IVF-28叶片中的SOD活性随着CdCl2浓度的增加而逐渐增强,CAT、POD和SOD活性的变化与前人在玉米[17]、紫苏[18]上的研究结果一致。但是随着胁迫浓度的增强,对X-T-G和IVF-28甜瓜叶片的损伤加重,100 mg/L胁迫时达到或超出了X-T-G和IVF-28甜瓜的耐受性,其自身的防御措施也就相应地减弱,X-T-G和IVF-28叶片中CAT和POD活性也显著降低了,这与Mobin等[19]在芥菜的研究结果一致。
和H2O2的平衡,达到减少植物体内羟自由基(-OH)形成的作用。SOD活性的高低可以反映出植物组织在胁迫条件下的应激调节能力[16]。Cd胁迫可激发甜瓜幼苗启动抗氧化酶系统及渗透调节系统,减少不利环境对植物的伤害。本试验中Cd胁迫提高了甜瓜叶片中3种酶的活性,表明了保护能力的启动和增强,是甜瓜应激产生的保护作用以降低膜质过氧化程度,清除氧自由基,抵御损伤,对甜瓜抗Cd引起的氧化胁迫有重要作用,其中在30 mg/L CdCl2胁迫中,X-T-G和IVF-28的CAT活性最高,而POD活性在60 mg/L时达到峰值,X-T-G和IVF-28叶片中的SOD活性随着CdCl2浓度的增加而逐渐增强,CAT、POD和SOD活性的变化与前人在玉米[17]、紫苏[18]上的研究结果一致。但是随着胁迫浓度的增强,对X-T-G和IVF-28甜瓜叶片的损伤加重,100 mg/L胁迫时达到或超出了X-T-G和IVF-28甜瓜的耐受性,其自身的防御措施也就相应地减弱,X-T-G和IVF-28叶片中CAT和POD活性也显著降低了,这与Mobin等[19]在芥菜的研究结果一致。
H2O2和MDA的含量可以直观反映出植物细胞在逆境胁迫的损伤程度,以及细胞内因活性氧的积累而引发膜脂过氧化作用和逆境胁迫对植物体内活性氧产生和清除系统受到破坏。郑世英等[20]研究表明,随着Pb2+、Cd2+胁迫浓度的逐渐升高,棉花幼苗植株中的MDA含量呈增加的趋势。谢惠玲等[18]通过对不同浓度Cd胁迫下紫苏酶活性的研究发现,随Cd浓度的升高,其叶片的SOD活性和MDA 含量显著升高,破坏了体内保护酶系统的平衡,从而抑制紫苏的生长。曹红梅等[21]通过对Cd胁迫下香根草和风车草生理生化响应和耐受能力的研究,结果发现风车草MDA含量和细胞膜透性均大于香根草,香根草PRO含量大于风车草,得到香根草耐受Cd害的能力较强的结论。温瑀等[22]研究了几种绿化植物对土壤Pb、Cd胁迫的生理响应,研究结果发现绿化植物叶片中MDA的含量随Pb、Cd胁迫浓度的增加而增加。张凤琴等[23]的研究表明,植物体内脂质过氧化产物 MDA的含量与重金属的胁迫浓度高低密切相关。张廷婷等[24]通过对Cd胁迫下花生生理响应的研究发现,Cd胁迫增加了花生体内MDA含量,与高夕彤等[25]在番茄的研究结果一致。王欣欣等[26]研究结果表明,小桐子幼苗叶片中MDA含量随Cd2+浓度的增加而逐渐升高,孙亚莉等[27]在水稻上也得到了同样的结果。这充分表明植物在重金属金属胁迫下,组织和细胞内MDA含量会增加,表明植物的膜脂过氧化程度加剧,植物细胞膜系统受到损伤,从而导致了细胞内含物被动的发生外渗现象,扰乱了植物细胞正常的代谢活动,加剧了重金属对植物的毒害作用。本试验中X-T-G和IVF-28在Cd胁迫的MDA含量与以上学者的研究结果一致。CdCl2处理下X-T-G和IVF-28叶片中![]() 产生速率加快,导致X-T-G和IVF-28叶片SOD活性增强,H2O2增加。然而由于CAT活性降低,H2O2不能及时有效清除,因此,X-T-G和IVF-28叶片中H2O2含量升高。
产生速率加快,导致X-T-G和IVF-28叶片SOD活性增强,H2O2增加。然而由于CAT活性降低,H2O2不能及时有效清除,因此,X-T-G和IVF-28叶片中H2O2含量升高。
PRO可以调节植物细胞膜和细胞的膨压,保护细胞内的水分,防止水分的过度散失,为细胞内的各种代谢活动的正常进行提供水分。PRO还对植物细胞具有冰冻保护和清除细胞内产生的活性氧的作用。在植物遭受到逆境胁迫时,细胞内的游离PRO可以利用CAT、POD和SOD等保护酶系统来维持细胞进行生理代谢所需的自由水和生理活性物质,从而起到对细胞的保护作用。唐雪东等[28]研究了Cd胁迫下杏树、李树和梨树体内Pro含量随Cd浓度的增加呈逐渐增加趋势,在200×10-6Cd胁迫时3种果树体内的Pro含量达到最大,随后略有下降。吴桂容[29]对Cd胁迫下桐花树幼苗叶中游离Pro含量进行了测定,研究结果发现,30 mg/kg以下的Cd胁迫中桐花树幼苗叶中游离Pro含量随Cd浓度的增大而增加,Cd浓度超过30 mg/kg之后桐花树幼苗叶中游离Pro含量下降,但仍高于对照。本研究中X-T-G和IVF-28在不同浓度Cd胁迫下叶片PRO的含量变化与上述研究结果基本一致。
大量的相关分子生物学的研究已经证明,Cd胁迫可以增加植物体内编码GSH合成酶基因的表达量。棉花幼苗在镉胁迫下根中GSH含量表现为先增后减,茎中则表现为先减后增,均为11-20品种GSH含量高于单16[30]。但有学者的研究结果表明,在重金属胁迫下,有些植物诱导消耗了大量的GSH合成大量植物螯合素(PCs),因此,GSH在某些植物体内会出现暂时的下降。谷胱甘肽还原系统是植物体内抵御重金属胁迫有效防止体内发生过氧化的重要组成部分之一。GSH基因在不同植物中表达的强弱也不尽相同,一般情况是Cd敏感植物中GSH含量比耐Cd植物中低[31]。本试验中,Cd胁迫处理的X-T-G和IVF-28叶片中的GSH含量显著高于对照,随着CdCl2浓度的增加,GSH含量先增加后降低,X-T-G各处理的GSH含量均高于IVF-28,两者GSH的含量在60 mg/L CdCl2处理时达到峰值,随后降低。通过对测定指标的分析,甜瓜幼苗能够抵抗低浓度Cd胁迫造成的损害,高浓度的Cd胁迫超过了甜瓜幼苗的抗性范围,造成幼苗损害程度加大,不同品种的甜瓜幼苗对Cd毒性的响应存在差异。
[1] 鲜靖苹,柴澍杰,王勇,牛奎举,董文科,马晖玲,张然.镉胁迫对草地早熟禾生长与生理代谢的影响[J].核农学报, 2019, 33(1): 176-186. doi:10.11869/j.issn.100-8551.2019.01.0176 .
Xian J P, Chai S J, Wang Y, Niu K J, Dong W K, Ma H L, Zhang R. Effect of cadmium stress on growth and physiological metabolism of kentucky bluegrass[J].Journal of Nuclear Agricultural Sciences,2019,33(1):176-186.
[2] 冯建鹏,史庆华,王秀峰,洪艳艳.镉对黄瓜幼苗光合作用、抗氧化酶和氮代谢的影响[J].植物营养与肥料学报, 2009, 15(4): 970-974.doi:10.3321/j.issn:1008-505X.2009.04.036 .
Feng J P, Shi Q H, Wang X F, Hong Y Y. Effects of cadmium on photosynthesis,antioxidant enzyme and nitrogen metabolism of cucumber seedlings[J].Journal of Plant Nutrition and Fertilizers, 2009, 15(4):970-974.
[3] 王志伟,邹甜,孙波,龚思,陈泽南,孙小武.镉在薄皮甜瓜植株中的分布及低积累品种筛选[J].中国蔬菜, 2018(11): 55-59.
Wang Z W, Zou T, Sun B, Gong S, Chen Z N, Sun X W. Cadmium distribution and screening of low cadmium accumulation oriental melon cultivars[J].China Vegetables, 2018 (11): 55-59.
[4] 吴志超. 高低镉积累油菜品种筛选及其生化机制研究[D].武汉:华中农业大学, 2015.doi: 10.7666/d.Y2803169 .
Wu Z C. Screening of high/low cadmium accumulation Brassica napus cultivars and research on the biochemical mechanisms[D].Wuhan: Huazhong Agricultural University,2015.
[5] 刘灿玉,夏杰,韩敏,曹逼力,徐坤.镉对姜叶片活性氧代谢影响的时间和剂量效应[J].园艺学报, 2016, 43(5):927-934. doi:10.16420/j.issn.0513-353x.2016-0138.
Liu C Y, Xia J, Han M, Cao B L, Xu K. Time and does effects of cadmium on active oxygen metabolism in ginger leaves[J].Acta Horticulturae Sinica, 2016, 43(5):927-934
[6] 沈雪婷,邢雁,卢迪,吴明,包军,于建军.镉污染对烟草的毒害及调控措施研究进展[J]. 江西农业学报, 2014, 26(9): 57-60. doi:10.19386/j.cnki.jxnyxb.2014.09.014.
Shen X T, Xing Y, Lu D, Wu M, Bao J, Yu J J. Research progress in poisoning of cadmium pollution to tobacco and its control measures[J].Acta Agriculturae Jiangxi, 2014, 26(9): 57-60.
[7] 朱志勇,郝玉芬,吴金芝,黄明,刘英杰,李友军.镉胁迫对不同小麦品种幼苗生长以及Cd2+、Zn2+、Mn2+吸收和积累的影响[J].水土保持学报, 2011, 25(2): 209-213.
Zhu Z Y, Hao Y F, Wu J Z, Huang M, Liu Y J, Li Y J. Effects of Cd2+ stress on the seedling growth,Cd2+,Zn2+ and Mn2+ uptake of different wheat cultivars[J].Journal of Soil and Water Conservation, 2011, 25(2): 209-213.
[8] 张永平,沈若刚,姚雪琴,陈幼源. 镉胁迫对甜瓜幼苗抗氧化酶活性和光合作用的影响[J]. 中国农学通报, 2015, 31(34): 82-88.
Zhang Y P, Shen R G, Yao X Q, Chen Y Y. Effects of cadmium stress on antioxidant enzyme activities and photosynthesis in melon seedlings[J].Chinese Agricultural Science Bulletin,2015, 31(34): 82-88.
[9] 周建,张毅川,齐安国,王彩云.镉胁迫对刺槐幼苗的生长、镉离子富集及其细胞分布的影响[J]. 河南科技学院学报(自然科学版),2018, 46(1): 1-7.doi:10.3969/j.issn.1008-7516.2018.01.001.
Zhou J, Zhang Y C, Qi A G, Wang C Y. Effects of cadmium stress on growth,ions accumulation and cellular distribution in Robinia pseudoacacia seedlings[J].Journal of Henan Institute of Science and Technology(Natural Science Edition), 2018, 46(1): 1-7.
[10] 何梨香,黄运湘,黄楚瑜,刘利杉,龙祥,罗琳. 圆叶决明对镉胁迫的生理响应[J]. 草业学报, 2016, 25(2): 198-204.doi:10.11686/cyxb2015158.
He L X, Huang Y X, Huang C Y, Liu L S, Long X, Luo L. Physiological reponse of Chamaecrista rotundifolia to cadmium exposure[J]Acta Prataculturae Sinica,2016,25(2):198-204.
[11] 闫道良,余婷,徐菊芳,黄坚钦.盐胁迫对海滨锦葵生长及Na+、K+离子积累的影响[J]. 生态环境学报, 2013, 22(1): 105-109.doi:10.16258/j.cnki.1674-5906.2013.01.004.
Yan D L, Yu T, Xu J F,Huang J Q.Effect of salt stress on the growth and accumulation of Na+,K+ in seedlings of Kosteletzkya virginica[J].Ecology and Environmental Sciences, 2013, 22(1): 105-109.
[12] 唐晓倩,刘广全. NaCl胁迫对圆柏幼苗生长和离子吸收及分配的影响[J]. 西北植物学报, 2017, 37(7):1372-1380.doi:10.7606/j.issn.1000-4025.2017.07.1372.
Tang X Q, Liu G Q. Effects of NaCl stress on the growth ion absorption and distribution of Juniperus chinensis seedlings[J].Acta Botanica-Occidentalia Sinica,2017,37(7):1372-1380.
[13] 刘正祥,张华新,杨秀艳,刘涛,狄文彬.NaCl胁迫下沙枣幼苗生长和阳离子吸收、运输与分配特性[J]. 生态学报, 2014, 34(2): 326-336.doi:10.5846/stxb201303270530.
Liu Z X, Zhang H X, Yang X Y, Liu T, Di W B. Growth,and cationic absorption,transportation and allocation of Elaeagnus angustifolia seedlings under NaCl stress[J].Atca Ecologica Sinica, 2014, 34(2):326-336.
[14] 王树凤,胡韵雪,孙海菁,施翔,潘红伟,陈益泰.盐胁迫对2种栎树苗期生长和根系生长发育的影响[J].生态学报, 2014, 34(4): 1021-1029.doi:10.5846/stxb201209291363.
Wang S F, Hu Y X, Sun H Q, Shi X, Pan H W, Chen Y T. Effects of salt stress on growth and root development of two oak seedlings[J].Atca Ecologica Sinica, 2014, 34(4): 1021-1029.
[15] 叶亚新,金琎,陈佳佳,徐莉.镉胁迫下萝卜幼苗根、茎、叶保护酶活性的比较[J]. 江苏农业科学, 2008(3): 131-135. doi: 10.3969/j.issn.1002-1302.2008.03.047.
Ye Y X, Jin J, Chen J J, Xu L. Comparison of the protective enzymes activities in root, stem and leaf of radish seedlings under cadmium stress [J].Jiangsu Agricultural Sciences, 2008(3): 131-135.
[16] 铁柏清,袁敏,唐美珍,秦普丰,杨永兴.重金属单一污染对龙须草生长与生理生化特性的影响[J].中国生态农业学报, 2007, 15(2): 99-103.
Tie B Q, Yuan M, Tang M Z, Qin P F, Yang Y X. Effects of single heavy metal pollution on the growth and physiological and biochemical characteristics of Eulaliosis binata[J].Chinese Journal of Eco-Agriculture, 2007, 15(2): 99-103.
[17] 惠俊爱,党志.土壤不同镉浓度对玉米CT38生长及抗氧化酶活性的影响[J].生态环境学报, 2014, 23(5): 884-889. doi:10.16258/j.cnki.1674-5906.2014.05.027.
Hui J A,Dang Z.Effects of different cadmium concentrations in soil on growth and antioxidant enzyme activities of maize CT38[J].Ecology and Environmental Sciences,2014,23(5):884-889.
[18] 谢惠玲,陈爱萍,张凤英,熊颖,陈艳玲,刘杰,周丽英,林瑞余. 紫苏对不同浓度镉胁迫的生理响应[J].中国生态农业学报, 2011, 19(3): 672-675.doi:10.3724/SP.J.1011.2011.00672.
Xie H L, Chen A P, Zhang F Y, Xiong Y, Chen Y L, Liu J, Zhou L Y, Lin R Y. Physiological response of Perilla frutescens (L.)Britt.to cadimium[J]. Chinese Journal of Eco-Agriculture, 2011, 19(3): 672-675.
[19] Mobin M, Khan N A. Photosynthetic activity, pigment composition and antioxidative response of two mustard (Brassica juncea) cultivars differing in photosynthetic capacity subjected to cadmium stress[J]. Journal of Plant Physiology, 2007, 164(5): 601-610.doi: 10.1016/j.jplph.2006.03.003.
[20] 郑世英,张秀玲,王丽燕,商学芳.Pb2+,Cd2+胁迫对棉花保护酶及丙二醛含量的影响[J].河南农业科学, 2007(8): 43-45,63.doi:10.15933/j.cnki.1004-3268.2007.08.016.
Zheng S Y,Zhang X L,Wang L Y,Shang X F. Effects of Pb2+ and Cd2+ stress on the protective enzymes activity and MDA contents of cotton[J]. Journal of Henan Agricultural Sciences,2007(8): 43-45,63.
[21] 曹红梅,闫晓丽. 香根草和风车草对重金属镉胁迫的生理生化反应研究[J].现代农业科技, 2015(11): 226-227.doi: 10.3969/j.issn.1007-5739.2015.11.142 .
Cao H M, Yan X L. Response of physiology and biochemistry of Vetiver zizanioides and Cyperus altemifoliu to heavy metal cadmium stress[J]. Modern Agricultural Science and Technology,2015(11): 226-227.
[22] 温瑀,穆立蔷.土壤铅、镉胁迫对4种绿化植物生长、生理及积累特性的影响[J].水土保持学报, 2013, 27(5): 234-238.doi:10.13870/j.cnki.stbcxb.2013.05.003.
Wen Y, Mu L Q. Effects of soil Pb, Cd stress on the growth, physiologcal and accumulating characteristics of four ornamental trees[J].Journal of Soil and Water Conservation, 2013, 27(5): 234-238.
[23] 张凤琴,王友绍,董俊德,孙翠慈,殷建平. 重金属污水对木榄幼苗几种保护酶及膜脂质过氧化作用的影响[J].热带海洋学报, 2006, 25(2): 66-70. doi:10.3969/j.issn.1009-5470.2006.02.012 .
Zhang F Q, Wang Y S, Dong J D, Sun C C, Yin J P. Effects of wastewater borne heavy metals on some protective enzymes and lipid peroxidation of Bruguiera gymnorrhiza seedling[J].Journal of Tropical Oceanography,2006, 25(2): 66-70.
[24] 张廷婷,闫彩霞,李春娟,单世华,万书波,杨志艺.花生对镉胁迫的生理响应[J].山东农业科学, 2013, 45(12): 48-51, 56. doi:10.14083/j.issn.1001-4942.2013.12.025.
Zhang Y T, Yan C X, Li C J, Shan S H, Wan S B, Yang Z Y. Physiological response of peanut to cadmium stress[J].Shandong Agricultural Sciences, 2013, 45(12): 48-51, 56.
[25] 高夕彤,李硕,贾娟,李岩,杨志新. 不同番茄品种对镉胁迫的耐抗性差异研究[J]. 华北农学报, 2018, 33(2): 169-176. doi:10.7668/hbnxb.2018.02.024.
Gao X T, Li S, Jia J, Li Y, Yang Z X. Study on resistance of different tomato varieties to cadmium stress[J].Acta Agriculturae Boreali-Sinica, 2018, 33(2): 169-176.
[26] 王欣欣,邓明华,龚明,刘颖,陈凯,文锦芬. Cd2+胁迫对小桐子幼苗叶片抗氧化系统的影响[J]. 西北植物学报, 2016, 36(3):527-533.doi:10.7606/j.issn.1000-4025.2016.03.0527.
Wang X X, Deng M H, Gong M, Liu Y, Chen K, Wen J F. Effect of Cd2+ stress on antioxidant system in the leaves of Jatropha curcas seedlings[J]. Acta Botanica Boreali-Occidentalia Sinica, 2016, 36(3):527-533.
[27] 孙亚莉,刘红梅,徐庆国. 镉胁迫对不同水稻品种苗期光合特性与生理生化特性的影响[J]. 华北农学报, 2017, 32(4): 176-181. doi:10.7668/hbnxb.2017.04.028.
Sun Y L, Liu H M, Xu Q G. Effect of cadmium stress on photosynthetic characteristics and physiological and biochemical traits during seedling stage of different rice cultivars[J]. Acta Agriculturae Boreali-Sinica, 2017, 32(4): 176-181.
[28] 唐雪东,刘晓嘉,窦森,李亚东. 3种果树幼苗对镉胁迫的响应[J].东北林业大学学报, 2009, 37(9): 27-28, 32.doi:10.13759/j.cnki.dlxb.2009.09.001.
Tang X D, Liu X J, Dou S, Li Y D. Responses of three species of fruit tree seedlings to cadmium stress[J].Journal of Northeast Forestry University,2009, 37(9): 27-28, 32.
[29] 吴桂容. 重金属Cd对桐花树幼苗生理生态效应及土壤酶的影响研究[D].厦门:厦门大学, 2007.doi:10.7666/d.y1344841.
Wu G R. Effects of heavy metal Cd on physiological ecological effect and soil enzyme of tonghua tree seedlings[D].Xiamen: Xiamen University,2007.
[30] 欧阳燕莎,刘爱玉,李瑞莲,刘浩然.高低镉积累棉花品种生理生化特性研究[J]. 华北农学报, 2017, 32(6): 170-174. doi:10.7668/hbnxb.2017.06.025.
Ouyang Y S, Liu A Y, Li R L, Liu H R. Study on physiological and biochemical characteristics of cotton varieties accumulated by high and low cadmium[J]. Acta Agriculturae Boreali-Sinica, 2017, 32(6):170-174.
[31] Fu X P,Dou C M,Chen Y X,Chen X C,Shi J Y,Yu M G,Xu J. Subcellular distribution and chemical forms of cadmium in Phytolacca americana L.[J]. Journal of Hazardous Materials, 2011, 186(1): 103-107. doi:10.1016/j.jhazmat.2010.10.122.