己糖激酶(HXK)是植物体呼吸代谢过程中的关键酶之一,具有催化己糖磷酸化的作用,在植物的糖感知和糖信号转导过程中扮演重要的角色。HXK基因家族多数成员包括9个外显子,编码氨基酸在492-522 aa。对HXK基因进行亚细胞定位研究发现,该家族成员主要分布于线粒体,少数成员存在细胞质、叶绿体和质体基质中[1-2]。在拟南芥[3]、玉米[4]、番茄[5]和烟草[6]中进行的试验表明,大多数HXK1 蛋白与线粒体外膜结合,在糖酵解中发挥作用[7]。己糖激酶催化己糖的磷酸化,不仅对葡萄糖具有磷酸化作用,而且对果糖也具有磷酸化。在植物中己糖激酶的信号转导功能和催化功能并不偶联,因此可将依赖于己糖激酶的葡萄糖磷酸化从依赖于己糖激酶的葡萄糖信号转导中区分出来[8]。研究发现,失去磷酸化催化活力的转基因植株仍表现出正常的糖信号转导功能[9]。己糖激酶作为细胞内糖传感蛋白,在葡萄糖的信号转导中起着重要的功能,其信号转导途径对植物的生长发育与基因表达具有调节作用,其机制复杂[10]。目前在拟南芥[11]、玉米[12]、水稻[13]、菠菜[14]和番茄[15]等植物中克隆获得了HXK基因,均表明在糖代谢和糖信号转导中发挥着重要的作用。
拟南芥中HXK基因家族有6个成员,其中3个基因编码具有催化活性的蛋白质,包括基质局部的HXK3的蛋白,主要是在库器官中表达。另外3个基因编码的HKL蛋白约有50%与AtHXK1的相同,但是不能使葡萄糖和果糖磷酸化。HKL1与HKL2转录发生在大多数的植物细胞内的线粒体中,并不是全部。HKL3转录只在花中检测到,该蛋白质的缺乏可使其他许多氨基酸发生变化,可能危及其能力甚至葡萄糖或ATP的结合能力[12]。玉米中HXK基因家族有9个成员,多序列比对和结构分析表明,玉米ZmHXK蛋白在3个结构域中共享;研究表明,ZmHXK5在雄穗中高度表达,而ZmHXK6在雄穗和叶子都有表达。ZmHXK5和ZmHXK6表达水平是使得植物激素和非生物胁迫上调[13]。水稻中HXK基因家族除OsHXK1是单外显子外,其他9个具有高度保守的基因组结构,都含有9个外显子和8个内含子。基因表达谱分子显示,OsHXK2~OsHXK9在各种器官中表达,而OsHXK10却在特殊花粉中表达。OsHXK2、OsHXK5和OsHXK6在离体的叶片中表达,而抑制了OsHXK7在离体叶片和未成熟种子中的表达。OsHXK4是质体基质有针对性的己糖激酶,而OsHXK7定位于细胞质中,作为Moonlight蛋白的构象特征参与糖信号和代谢[14]。
目前葡萄基因组测序已完成(http://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/),但是葡萄中HXK基因家族的研究还未见相关的报道,因此,本研究利用生物信息学技术,对得到的葡萄HXK基因家族进行生物信息分析,并通过qRT-PCR实时荧光定量技术对葡萄HXK基因在同一浓度不同糖、同一糖不同浓度处理下的表达进行分析,为葡萄品质改良提供候选基因,并为深入研究葡萄糖代谢机制提供依据。
1 材料和方法
1.1 试验材料
试验材料为红地球葡萄(Vitis vinifera Red Globe)试管苗,来源于甘肃农业大学果树生理生物技术实验室。
1.2 试验方法
1.2.1 植物材料的处理 将健壮、长势一致且无污染的红地球试管苗,剪成单芽茎段(2~3 cm)并留1片叶,转接在MS固体培养基上,试验材料用同一浓度不同糖(葡萄糖、蔗糖和果糖均为20 g/L)和同一糖不同质量浓度(葡萄糖浓度分别为10,20,40 g/L)进行处理,其他成分均相同,不加任何糖的作为对照,处理至第40天后分别取不同处理的叶片提取RNA,做实时荧光定量分析。
1.2.2 葡萄RNA的提取、cDNA的合成及引物设计
1.2.2.1 RNA的提取 参考申鹏[16]方法对红地球试管苗进行RNA的提取,RNA试剂盒购自中科瑞泰(北京)生物科技有限公司。
1.2.2.2 cDNA的合成 采用试剂盒PrimeScriptTMRT reagent Kit with Gdna Eraser(Perfect Real Time),购自宝生物工程(大连)有限公司。
1.2.2.3 引物设计 采用Premier 5.0软件进行引物设计,生工生物工程(上海)股份有限公司合成。
1.2.3 葡萄HXK基因的分离与克隆 从相关文献中查到拟南芥、玉米、水稻、烟草、马铃薯及柑橘等的HXK基因的登录号,将其登录号输入NCBI(http://www.ncbi.nlm.nih.gov/gds)得到各自的CDS、cDNA等,通过Blast server(http://www.genoscope.cns.fr/cgi-bin/blast_server/)得到各自相关序列,然后将得到的各自的序列输入葡萄基因库Grape Genome Browser(http://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/),电子克隆出其相应葡萄HXK基因的序列,并在DNAMAN中将所得的碱基序列逐一的对比并对其进行筛选,最后只得到4个葡萄HXK基因,分别命名为VvHXK1、VvHXK2、 VvHXK3、VvHXK4。
1.2.4 葡萄HXK基因的生物信息学分析 用EXPASY-Translate tool(http://web.expasy.org/translate/)将VvHXK碱基序列翻译为氨基酸序列,将氨基酸序列输入EXPASY-ProtParam tool(http://web.expasy.org/protparam/)中,对VvHXK基因的氨基酸数目、理论等电点和分子质量进行分析。将葡萄HXK的碱基序列和氨基酸序列输入Gene Structure Display Server(http://gsds.cbi.pku.edu.cn/)中对其外显子和内含子进行分析。利用软件Mega 5和ClustalW构建系统进化树,并对VvHXK基因的氨基酸序列的保守性进行预测。利用http://www.genscript.com/psort/wolf_psort.html和https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html对葡萄HXK基因进行亚细胞定位和HXK基因编码的蛋白质的二级结构进行分析。利用PLACE(http://www.dna.affrc.go.jp/PLACE/signalscan),以葡萄HXK基因家族起始密码子上游2 000 bp的碱基为序列,对VvHXK基因家族的启动子顺式作用元件进行预测分析。
1.2.5 引物设计及实时荧光定量PCR 在Premier 5.0中用所得的4个VvHXK基因的CDS序列进行设计引物,如表1。
实时荧光定量PCR(Real-time fluorescent quantitative polymerase chain reaction,qRT-PCR),用Bio-Rad iCycleriQ实时定量PCR仪对设计的引物进行PCR 扩增,以葡萄UBI基因为内参[17],对所得的4个VvHXK基因家族进行特异性表达分析。
表1 VvHXK基因家族表达分析的实时荧光定量引物
Tab.1 qRT-PCR primers for expression on analysis of VvHXK

基因Gene实时荧光定量上游引物(5′-3′)Forward primer for qRT-PCR实时荧光定量下游引物(5′-3′)Reverse primer for qRT-PCRVvUBIGCTCGCTGTTTTGCAGTTCTACAACATAGGTGAGGCCGCACTTVvHXK1GGGGCAACTTTAGGTCATCAGCCCAAATACATGCCAGAAAVvHXK2GGCACAAACTTCCGTGTCTTGCATCTGAACTCCCAACCATVvHXK3AAGATGGTCGTGGAGGTTGCGGTTCTCTTCCCAAAGATGVvHXK4ACTTGGAAGAGGCGTGTGAGGAGGAGCATTTTGAGCTTGG
2 结果与分析
2.1 葡萄HXK基因在染色体上的分布
如图1所示,得到的4条VvHXK基因位于葡萄不同的染色体上,VvHXK1、VvHXK2、VvHXK3、VvHXK4分别位于葡萄的第9,11,18,6号染色体上且它们存在的位置各不相同。
2.2 葡萄HXK 基因外显子的结构
从图2 的基因结构中可看出,4个基因的外显子都分布在其序列的9 kb以内,其中VvHXK3的序列最短;除VvHXK1含有10个外显子(多了最后一个长度仅为48 bp的外显子)外,VvHXK2、VvHXK3和VvHXK4都有9个外显子,4个基因除了个别外显子的长度不一样外其余的长度均一样,比如4个基因都含有151,183,75,156,82 bp大小的外显子。VvHXK1与VvHXK2基因前8个外显子大小相同,VvHXK4基因的第一个外显子长度为272 bp,比其他3个基因第一个外显子都大,且VvHXK4基因含有4个基因中最大的一个外显子结构,长度为426 bp。从基因结构图可以看出葡萄HXK基因的外显子在这个区间的分布是保守的。
图1 葡萄基因HXK在染色体上的分布
Fig.1 The distribution of HXK genes of grape in the chromosome
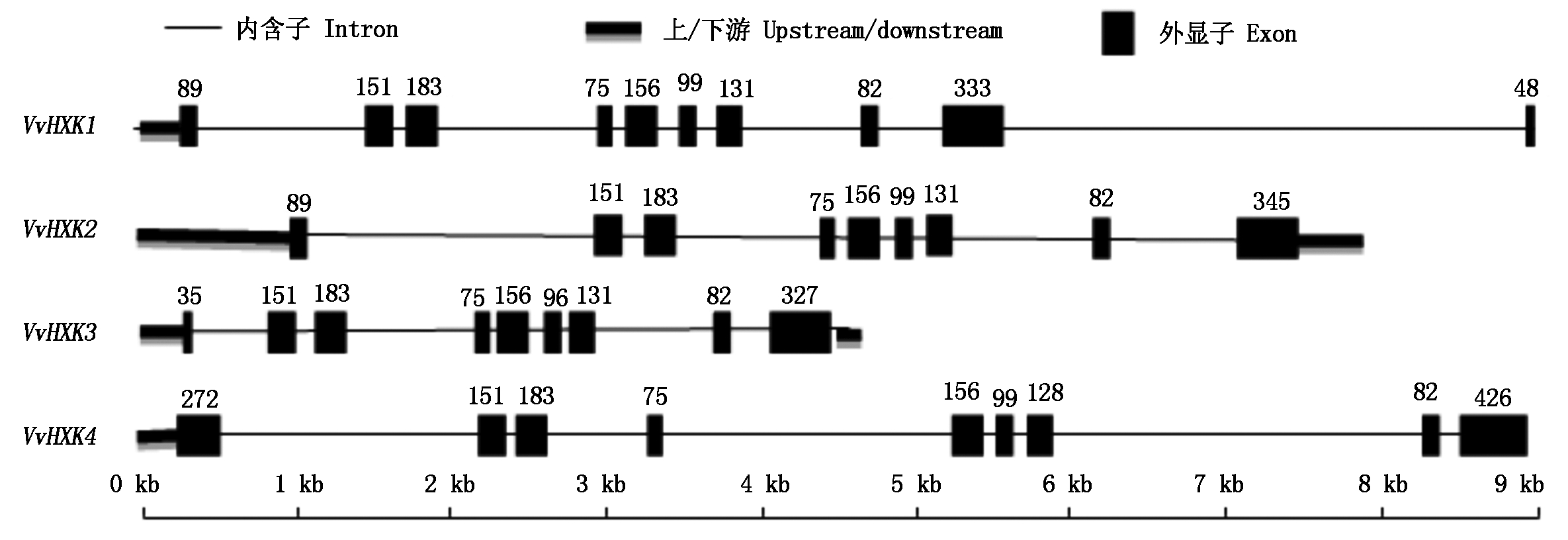
图2 葡萄HXK基因家族的基因结构
Fig.2 Gene structure of grape HXK gene family
2.3 葡萄HXK基因编码蛋白理化性质及二级结构
表2结果表明,除了VvHXK4编码的氨基酸个数为524 aa外,其余3个编码氨基酸较少,都在412-449 aa,每个基因编码的氨基酸数目相差不多;VvHXK基因家族的等电点在5.03~8.27,除了VvHXK4的等电点为8.27是碱性外,其余3个均小于7,即为酸性氨基酸;VvHXK4基因的分子质量最大为56.818 1 ku,而VvHXK3最小,仅为4.490 4 ku,VvHXK1和VvHXK2的分子质量几乎接近。
从表3的蛋白质二级结构分析可看出,4个VvHXK基因编码的蛋白均主要以α-螺旋为主,不规则卷曲次之,VvHXK1的不规则卷曲几乎接近α-螺旋,其他的均相距较大,β-转角占比最少,均在10%左右。
表2 葡萄HXK基因的理化性质
Tab.2 Physicochemical properties of grape HXK gene
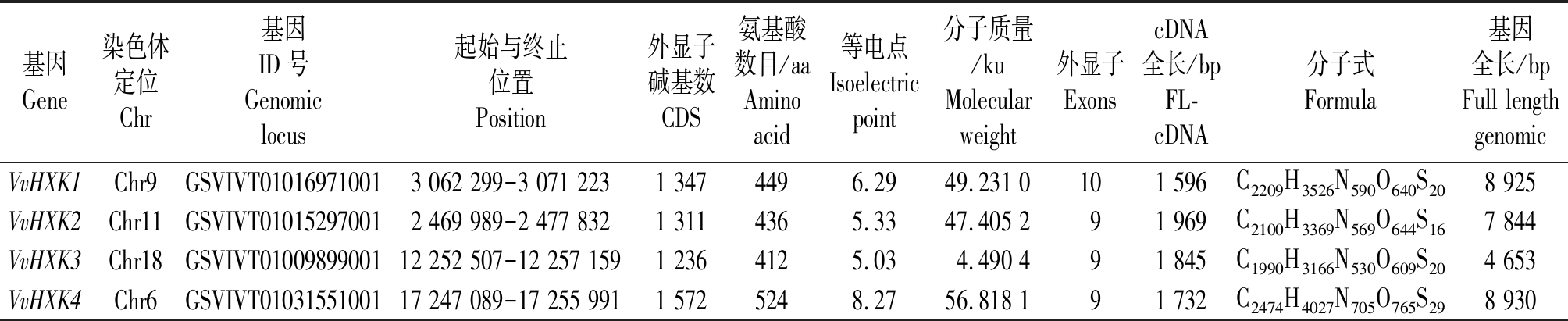
基因Gene染色体定位Chr基因ID号Genomic locus起始与终止位置Position外显子碱基数CDS氨基酸数目/aaAmino acid等电点Isoelectricpoint分子质量/kuMolecularweight 外显子 ExonscDNA全长/bpFL-cDNA分子式Formula基因全长/bpFull lengthgenomicVvHXK1Chr9GSVIVT010169710013 062 299-3 071 2231 3474496.2949.231 0 101 596C2209H3526N590O640S208 925VvHXK2Chr11GSVIVT010152970012 469 989-2 477 8321 3114365.3347.405 2 9 1 969C2100H3369N569O644S167 844VvHXK3Chr18GSVIVT0100989900112 252 507-12 257 1591 2364125.034.490 4 9 1 845C1990H3166N530O609S204 653VvHXK4Chr6GSVIVT0103155100117 247 089-17 255 9911 5725248.2756.818 1 9 1 732C2474H4027N705O765S298 930
表3 葡萄HXK蛋白质二级结构分析
Tab.3 The secondary structure of HXK protein sequence in grape %
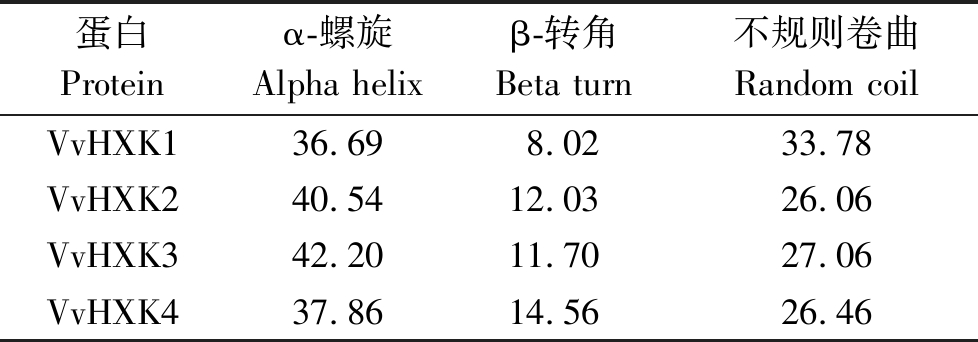
蛋白Protein α-螺旋Alpha helixβ-转角Beta turn不规则卷曲Random coilVvHXK136.698.0233.78VvHXK240.5412.0326.06VvHXK342.2011.7027.06VvHXK437.8614.5626.46
2.4 葡萄HXK亚细胞定位预测
表4表明,这4个VvHXK基因全在细胞质中表达;VvHXK2和VvHXK3不在叶绿体中表达,其余2个均在叶绿体中表达,但VvHXK2在线粒体和细胞核中表达,而其他均在线粒体和细胞核中没有表达;VvHXK1在细胞膜和液泡中表达,其他均不在细胞膜和液泡内表达;VvHXK2和VvHXK3还在细胞骨架中表达,VvHXK4主要定位于叶绿体。
表4 葡萄HXK基因亚细胞定位预测
Tab.4 Subcellular location prediction of HXK gene in grape

基因Gene叶绿体Chloroplast细胞质Cytoplasm细胞膜Plasma membrane液泡Vacuole线粒体Mitochondria细胞骨架Cytoskeleton细胞核NucleusVvHXK11822000VvHXK20700321VvHXK30800040VvHXK412100000
2.5 葡萄HXK基因上游2 kb区域顺式作用元件分析
表5表明,在该基因家族起始密码子上游2 kb碱基序列中每个基因都含有ABA响应元件(ABRE),其中VvHXK3中最多;每个基因中都有MYB转录因子且分布几乎一致;每个基因中WRKY转录因子比MYB因子少,但均有分布;VvHXK1和VvHXK4中没有脱水应答元件(DRE),VvHXK3中DRE比VvXHK2多;VvHXK4中没有低温响应元件(LTRE),VvHXK3中分布的LTRE较其他3个多。
表5 VvHXK基因上游2 kb区域顺式作用元件的分布
Tab.5 Putative Cis-elements existed in the 2 kb upstream region of VvHXK genes
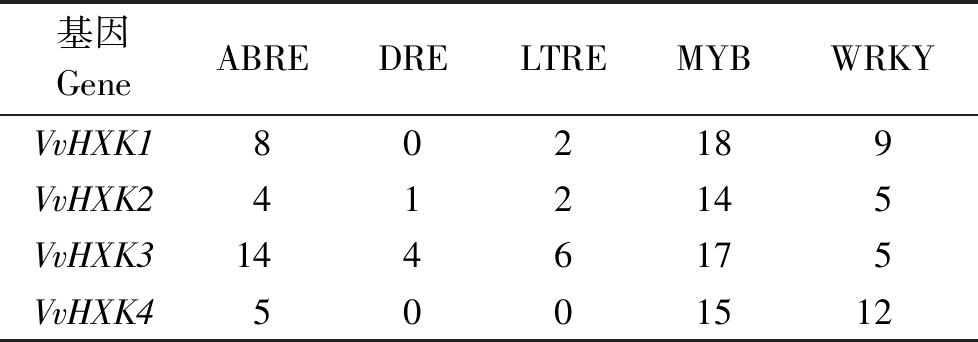
基因GeneABREDRELTREMYBWRKYVvHXK1802189VvHXK2412145VvHXK31446175VvHXK45001512
2.6 葡萄HXK基因编码的氨基酸序列的进化分析
本研究对葡萄4个HXK基因与已经鉴定出的拟南芥、水稻、玉米、马铃薯、菠菜、烟草和柑橘的氨基酸序列的进化关系(图3)进行了分析。从图中可以明显发现它们分为3组,第1组可以分为2个小组,第1组(Group 1)中的Group 1-1中包含VvHXK1,它与拟南芥的同源关系最近,Group 1-2中包含VvHXK2,它与马铃薯的同源关系最近,其次与菠菜的同源关系较近。第2组(Group 2)包含VvHXK3,与马铃薯同源关系最近,其次与烟草较近。第3组(Group 3)包含VvHXK4,同源关系与菠菜最近,其次与柑橘和玉米的同源关系较近。图3表明,只有VvHXK1与拟南芥AtHXK1的同源关系相对较近,VvHXK2和VvHXK3与玉米和水稻的同源关系相对较远,而VvHXK4与玉米和水稻的同源关系相对较近。

图3 拟南芥、水稻、玉米和葡萄HXK基因进化树
Fig.3 Arabidopsis, rice, maize and grape HXK gene phylogenetic tree
2.7 葡萄HXK基因的qRT-PCR分析
在荧光定量表达分析中,只得到了基因VvHXK2、VvHXK3和VvHXK4的表达量。图4-A表明,在同一葡萄糖不同浓度处理下,3个基因均在20 g/L葡萄糖处理下的表达量最高,VvHXK3和VvHXK4的表达量高达70.944 0%和64.641 8%,VvHXK3的表达量比VvHXK2的高达10倍左右;在10 g/L的处理下,VvHXK2和VvHXK4的表达量高于对照,而VvHXK3的表达量低于对照;只有VvHXK2在40 g/L葡萄糖处理下的表达量高于对照,其他2个均低于对照。
图4-B表明,在同一浓度不同糖的处理下,3个基因均在20 g/L葡萄糖处理下的相对表达量最高,VvHXK2的表达量较低些,约为7.5%,VvHXK3的表达量最高,为70.0%,VvHXK4次之;经果糖(F20)与蔗糖(S20)处理,3个基因的相对表达量接近且均低于对照,VvHXK2分别被20 g/L的果糖和蔗糖处理后,其表达量比葡萄糖(G20)处理的低了9倍左右;VvHXK3被20 g/L的果糖与蔗糖处理之后,表达量都在0.5%左右,而葡萄糖处理后表达量高达70%,相差很大;VvHXK4被浓度为20 g/L的葡萄糖处理后,相对表达量为62.0%,果糖、蔗糖处理后,VvHXK4的相对表达量为0.8%,0.5%,差距也是非常显著;在VvHXK2和VvHXK4中,果糖和蔗糖处理的相对表达量虽低于对照,但比VvHXK3的表达量高。从图中可看出,20 g/L葡萄糖处理后的VvHXK3相对表达量最高,VvHXK4次之,VvHXK2最低。

图4 VvHXK基因在不同糖处理中的荧光定量PCR分析
Fig.4 Fluorescence quantitative PCR analysis of VvHXK gene in different sugar treatments
3 讨论与结论
己糖激酶(HXK)与植物糖信号转导有直接的关联。Olsson等[18]根据其N末端氨基酸序列将植物HXK基因分为A型和B型,A型HXK约有30个氨基酸叶绿体转运肽;而B型HXK约有24个氨基酸且有一个共同的N端疏水性膜的锚域,可能与细胞膜相关联。Anders等[19]发现HXK基因除了类型A和B,中欧葫芦藓属中有C型和D型2个新类型,C型由单一基因编码,定位于细胞质和细胞核中。D型由3个基因编码,与线粒体相关联,但它们的序列不同于B型。研究表明,拟南芥AtHXK1和AtHXK2,番茄SlHXK1、SlHXK2、SlHXK3,烟草NtHXK1,水稻OsHXK2、OsHXK3、OsHXK5、OsHXK6 和OsHXK9,高粱SbHXK3,菠菜SoHXK1与线粒体相关联,而单子叶植物水稻中OsHXK1、OsHXK7、OsHXK8和OsHXK10定位于细胞质[20-21],除此之外还定位于叶绿体[22]和液泡[23]中。本研究表明,得到的4个VvHXK基因均在细胞质中有所表达;VvHXK4主要在叶绿体中表达,VvHXK2在线粒体和细胞核中表达;VvHXK1在细胞膜和液泡中表达。
在拟南芥、水稻及玉米中,大部分 HXK同源基因都具有9个外显子,但是成员间内含子长短的差异比较大[11-13]。本研究中的4个VvXHK基因,除了VvHXK1含有10个外显子,其他3个都含有9个外显子,成员间的差异不大。系统进化树分析研究中,赵锦等[24]发现苹果 MdHXK1与葡萄(AEJ95926.1)的同源性较高,高达85%。雍彬等[25]发现甘薯HXK基因与番茄、马铃薯和烟草的亲缘关系最近,与拟南芥相对较远。水稻中OsHXK2与AtHXK1和AtHXK2同源性较高,OsHXK4与NtHXK2亲缘关系较近。帅良等[26]通过对其预测编码的氨基酸序列与其他植物中HXK基因的相似性分析发现,龙眼DlHXK与番茄(NP_00124710)、枇杷(ADZ963781)、烟草(AAS601951)等物种相似性分别达到了71%,74%,71%,DlHXK基因与温州蜜柑(AAG285031)相似性最高,达到了82%。本研究表明,葡萄VvHXK1与拟南芥AtHXK1进化关系最为接近,推测二者功能相近,除了调节生长发育、光合作用和植物生长,VvHXK1也会加速衰老,提高侧芽的外观,影响根系的生长,气孔关闭和控制蒸腾[27-28]。VvHXK2与马铃薯StHXK1的同源关系最近,其次与烟草NtHXK1较近,推测VvHXK2能使叶提取物或叶绿体中的葡萄糖磷酸化活性升高,也可接替葡萄糖传感功能。VvHXK3与马铃薯StHXKRP1的同源关系最近,与OsHXK2的同源关系较近,即VvHXK2也许能够诱导离体叶片中糖的表达。VvHXK4与菠菜SoHXK1的同源关系最近,SoHXK1是B型HXK唯一的例外,即一直定位于叶绿体的外膜,这与VvHXK4定位于叶绿体是一样的[29]。
研究表明,AtHXK1可能是一个保守的葡萄糖结合位点,作为传感器并直接响应葡萄糖存在。马铃薯的StHXK1、StHXK2和水稻OsHXK5、OsHXK6的表达在拟南芥植物缺乏AtHXK1(gin2突变)时补充了葡萄糖敏感,以此推测它们在糖感知中的作用[30]。对拟南芥的研究发现,AtHXK1、AtHXK2和AtHXK3编码的蛋白质有葡萄糖激酶的活性,其中AtHXK1和AtHXK2都显示具有催化活性,而AtHXK3的葡萄糖磷酸化是与众不同的,因为AtHXK3还可以磷酸化果糖[12]。本研究结果表明,在20 g/L葡萄糖处理下3个VvHXK基因的相对表达量最高,其他浓度下均较低,且达到40 g/L时几乎不表达,即当葡萄糖达到20g/L左右时VvHXK基因对葡萄糖的催化活性最高,其他浓度下表达都较低,但VvHXK2的催化活性低于VvHXK3和VvHXK4,这可能与植物体内糖代谢葡萄糖含量有关。在同一浓度不同糖处理下,VvHXK基因只有葡萄糖处理下表达,蔗糖和果糖的表达均低于对照,即此可能与葡萄体内糖代谢时的代谢底物有关。
在同一浓度不同糖处理下,3个VvHXK基因均在20 g/L葡萄糖处理下表达量高,蔗糖和果糖的表达均低于对照,这可能与植物体内糖代谢时的代谢底物有关。由此可知VvHXK2、VvHXK3和VvHXK4磷酸化的均是葡萄糖,而不磷酸化果糖和蔗糖,即对果糖和蔗糖不起催化作用。
由试验可得出结论:分别定位于葡萄19条染色体中9,11,18,6号染色体上的VvHXK1、VvHXK2、VvHXK3、VvHXK4基因,经过不同的试验处理,结果表明,除了VvHXK1基因不表达,VvHXK2、VvHXK3和 VvHXK4均在20 g/L的葡萄糖处理下表达量最高,编码的蛋白质活性最强。
[1] Wang X Q,Li L M,Yang P P,Gong C L. The role of hexokinases from grape berries(Vitis vinifera L.) in regulating the expression of cell wall invertase and sucrose synthase genes[J]. Plant Cell Reports, 2014,33(2):337-347. doi:10.1007/s00299-013-1533-z.
[2] 秦巧平,张上隆,徐昌杰. 己糖激酶与植物生长发育[J]. 植物生理学报,2003,39(1):1-8. doi:10.13592/j.cnki.ppj.2003.01.001.
Qin Q P, Zhang S L, Xu C J. Hexokinase and plant growth and development[J]. Journal of Plant Physiology, 2003, 39(1):1-8.
[3] 徐晓丽. 拟南芥线粒体中交替型NAD(P)H脱氢酶活性复合体的蛋白质相互作用研究[D]. 兰州:兰州大学,2010.
Xu X L. Protein interaction of alternate NAD(P)H dehydrogenase activity complex in mitochondria of Arabidopsis thaliana[D]. Lanzhou:Lanzhou University, 2010.
[4] Chen X Z,Feng F,Qi W W,Xu L M, Yao D S,Wang Q, Song R T. Dek35 encodes a PPR protein that affects cis-Splicing of mitochondrial NAD4 Intron 1 and seed development in maize[J]. Molecular Plant,2017,10(3):427-441. doi:10.1016/j.molp.2016.08.008.
[5] Kandel-Kfir M, Damari-Weissler H, German M A, Gidoni D, Mett A, Belausov E, Petreikov M, Adir N, Granot D. Two newly identified membrane-associated and plastidic tomato HXKs: characteristics, predicted structure and intracellular localization[J]. Planta,2006,224(6):1341-1352. doi:10.1007/s00425-006-0318-9.
[6] 刘岩厚,赵忠芳. RNA沉默手段分析烟草悬浮细胞中线粒体分裂蛋白NtFIS1A/1B功能[J]. 热带亚热带植物学报,2013, 21(4):289-296. doi:10.3969/j.issn.1005-3395.2013.04.001.
Liu Y H, Zhao Z F. Analysis of mitochondrial protein NtFIS1A/1B function in tobacco suspension cells by RNA silencing[J]. Journal of Tropical and Subtropical Botany, 2013,21(4):289-296.
[7] 高鹏,杨明,孙林. 线粒体相关内质网膜(MAM)钙转运及调节蛋白介导线粒体钙稳态[J].中国细胞生物学学报,2018,40(4):585-593. doi:10.11844/cjcb.2018.04.0274.
Gao P, Yang M, Sun L. Mitochondria-associated endoplasmic reticulum membrane(MAM) calcium transport and regulation of protein-mediated mitochondrial calcium homeostasis[J]. Chinese Journal of Cell Biology, 2018,40(4):585-593.
[8] 郑雅楠,陈少云,刘文洪, 郭莹. 基于己糖激酶与葡萄糖-6-磷酸脱氢酶共表达的辅酶NADPH高效再生[J]. 微生物学通报,2016(12):2619-2626. doi:10.13344/j.microbiol.china.160577.
Zheng Y N, Chen S Y, Liu W H, Guo Y. Highly efficient regeneration of coenzyme NADPH based on co-expression of hexokinase and glucose-6-phosphate dehydrogenase[J]. Microbiology Bulletin, 2016(12):2619-2626.
[9] 孙美红. 苹果葡萄糖感受器MdHXK1磷酸化Na~+/H~+交换蛋白MdNHX1调控耐盐性的分子机理[D]. 泰安:山东农业大学,2017.
Sun M H. Molecular mechanism of regulation of salt tolerance by apple glucose receptor MdHXK1 phosphorylated Na~+/H~+ exchange protein MdNHX1[D]. Taian: Shandong Agricultural University, 2017.
[10] 程建徽,谢鸣,蒋桂华,徐凯. 植物己糖激酶的信号转导作用[J]. 中国细胞生物学学报,2004,26(6):594-598. doi:10.3969/j.issn.1674-7666.2004.06.012.
Cheng J H, Xie M, Jiang G H, Xu K. Signal transduction of plant hexokinase[J]. Chinese Journal of Cell Biology, 2004,26(6):594-598.
[11] Karve A,Rauh B L,Xia X X,Kandasamy M, Meagher R B, Sheen J, Moore B D. Expression and evolutionary features of the hexokinase gene family in Arabidopsis[J]. Planta,2008, 228(3):411-425. doi:10.1007/s00425-008-0746-9.
[12] Zhang Z B,Zhang J W,Chen Y J,Li R F, Wang H Z, Ding L P, Wei J H. Isolation, structural analysis, and expression characteristics of the maize(Zea mays L.) hexokinase gene family[J]. Molecular Biology Reports,2014,41(9):6157-6166. doi:10.1007/s11033-014-3495-9.
[13] Cho J I,Ryoo N,Eom J S,Lee D W, Kim H B, Jeong S W, Lee Y H, Kwon Y K, Cho M H, Bhoo S H, Hahn T R, Park Y I, Hwang I, Sheen J, Jeon J S. Role of the rice hexokinases OsHXK5 and OsHXK6 as glucose sensors[J]. Plant Physiology,2008,149(2):745-759. doi:10.1104/pp.108.131227.
[14] 张川芳,赵琪,肖振,蔡晓峰,王全华,戴绍军. 菠菜发育与逆境应答蛋白质组学研究进展[J]. 园艺学报,2016,43(9):1752-1764. doi:10.16420/j.issn.0513-353x.2016-0244.
Zhang C F, Zhao Q, Xiao Z, Cai X F, Wang Q H, Dai S J. Advances in spinach development and stress response proteomics[J]. Journal of Horticulture, 2016,43(9):1752-1764.
[15] 高佩. 吉林人参HXK基因家族生物信息学分析及转化番茄的研究[D]. 长春:吉林农业大学,2016.
Gao P. Bioinformatics analysis of HXK gene family of Jilin ginseng and transformation of tomato[D]. Changchun:Jilin Agricultural University, 2016.
[16] 申鹏. 葡萄不同生育期总RNA提取及SSH建立[D].兰州:甘肃农业大学,2013.
Shen P. Total RNA extraction and SSH establishment in different growth stages of grapes[D]. Lanzhou:Gansu Agricultural University, 2013.
[17] 许明,伊恒杰,赵帅,张玉文,杨志坚,郑金贵. 显齿蛇葡萄实时荧光定量PCR内参基因的筛选与验证[J]. 中草药, 2017(6):1192-1198. doi:10.7501/j.issn.0253-2670.2017.06.023.
Xu M, Yin H J, Zhao S, Zhang Y W, Yang Z J, Zheng J G. Screening and verification of internal reference genes of Real-time fluorescence quantitative PCR[J]. Chinese Herbal Medicine, 2017(6):1192-1198.
[18] Olsson T,Thelander M,Ronne H. A novel type of chloroplast stromal hexokinaseis the major glucose-phosphorylating enzyme in the moss Physcomitrella patens[J]. Journal of Biological Chemistry,2003,278(45):44439-44447. doi:10.1074/jbc.M306265200.
[19] Anders N, Tina O, Mikael U,Mattias T,Hans R. Two novel types of hexokinases in the moss Physcomitrellapatens[J]. BMC Plant Biology,2011,11(1):32. doi:10.1186/1471-2229-11-32.
[20] Karve R,Lauria M,Virnig A,Xia X X, Rauh B L, Moore B D. Evolutionary lineages and functional diversification of plant Hexokinases[J]. Molecular Plant,2010,3(2):334-346. doi:10.1093/mp/ssq003.
[21] Cheng W,Zhang H,Zhou X,Liu H, Liu Y, Li J, Han S, Wang Y. Subcellular localization of rice hexokinase(OsHXK) family members in the mesophyll protoplasts of tobacco[J]. Biologia Plantarum,2011,55(1):173-177. doi:10.1007/s10535-011-0025-7.
[22] Stettler M,Eicke S,Mettler T,Messerli G H, Rtensteiner S, Zeeman S C. Blocking the metabolism of starch breakdown products in Arabidopsis leaves triggers chloroplast degradation[J]. Molecular Plant,2009,2(6):1233-1246. doi:10.1093/mp/ssp093.
[23] Jaquinod M,Villiers F,Kieffer-Jaquinod S,Hugouvieux V, Bruley C, Garin J, Bourguignon J.A proteomics issection of Arabidopsis thaliana vacuoles isolated from cell ulture[J]. Mol Cell Proteomics,2007,6(3):394-412. doi:10.1074/mcp.M600250-MCP200.
[24] 赵锦,孙美红,胡大刚,郝玉金. 苹果己糖激酶基因MdHXK1的克隆与表达分析[J]. 园艺学报,2015,42(8):1437-1447. doi:10.16420/j.issn.0513-353x.2015-0057.
Zhao J, Sun M H, Hu D G, Hao Y J. Cloning and expression analysis of apple Hexokinase gene MdHXK1[J]. Journal of Horticulture, 2015,42(8):1437-1447.
[25] 雍彬,何兵,徐攀,虞传洋,王东. 甘薯HXK基因的克隆、组织表达及生物信息分析[J]. 四川大学学报(自然科学版),2014(2):378-384. doi:10.3969/j.issn.0490-6756.2014.02.029.
Yong B, He B, Xu P, Yu C Y, Wang D. Cloning, tissue expression and bioinformatics analysis of sweet potato HXK gene[J]. Journal of Sichuan University(Natural Science Edition), 2014(2):378-384.
[26] 帅良,李静,韩冬梅,吴振先. 龙眼己糖激酶基因的克隆及原核表达[J]. 华南农业大学学报,2015,36(3):91-97. doi:10.7671/j.issn.1001-411X.2015.03.016.
Shuai L, Li J, Han D M, Wu Z X. Cloning and prokaryotic expression of longan Hexokinase gene[J]. Journal of South China Agricultural University, 2015,36(3):91-97.
[27] Granot D,David-Schwartz R,Kelly G. Hexose kinases and their role in sugar-sensing and plant development[J]. Frontiers in Plant Science,2013,4:44. doi:10.3389/fpls.2013.00044.
[28] Kelly G,Davidschwartz R,Sade N,Moshelion M, Levi A, Alchanatis V, Granot D. The pitfalls of transgenic selection and new roles of AtHXK1: a high level of AtHXK1 expression uncouples hexokinase1-dependent sugar signaling from exogenous sugar[J].Plant Physiology,2012,159(1):47-51. doi:10.1104/pp.112.196105.
[29] Damari-Weissler H,Ginzburg A,Gidoni D,Mett A, Krassovskaya I, Weber A P, Belausov E, Granot D. Spinach SoHXK1 is a mitochondria-associated hexokinase[J]. Planta,2007,226(4):1053-1058. doi:10.1007/s00425-007-0546-7.
[30] 吴蔚蔚,童普国,王鑫, 阎新,李绍波, 欧阳解秀. 水稻OsGPRP家族基因克隆及其对非生物胁迫的响应[J]. 华北农学报,2018,33(1):39-44. doi:10.7668/hbnxb.2018.01.007.
Wu W W, Tong P G, Wang X, Yan X, Li S B, Ouyang X X. Cloning of rice OsGPRP family gene and its response to abiotic stress[J]. Acta Agriculturae Boreali-Sinica, 2018,33(1):39-44.