干旱胁迫对玉米造成的产量损失越来越受到学者们的关注,干旱胁迫已然成为限制玉米生长发育和产量最重要的非生物胁迫之一。早年有研究者报道,在大喇叭口期,玉米受旱1 d可导致减产3%;抽雄吐丝期受旱1 d可减产7%,甚至高达13%[1]。但是植物自身存在一套保护系统,在受到旱胁迫的时候,本能地会从生理、细胞和分子水平上做出反应,诱导许多胁迫相关基因的表达,很大程度上促进一些参与抗旱防御代谢产物的合成,从而调节植物对旱胁迫的耐受性[2-3]。其中早期脱水反应(ERD)基因,在植物逆境胁迫和生长发育中具有功能性作用。
拟南芥ERD最早被鉴定,目前有16个成员,它们分为不同的基因家族,包括热激蛋白、谷胱甘肽转移酶、晚期胚发育蛋白、钙离子调控蛋白等,作用于不同的代谢合成途径,可传递旱胁迫信号,产生功能性蛋白,从而增强拟南芥对水分胁迫的抗性[4-5]。随后与拟南芥ERD4同源的水稻和玉米基因也先后被获得。ZmERD4基因属于组成型表达,其表达量受干旱、高盐和ABA诱导,但是低温胁迫下其表达量无变化,并且过表达ZmERD4基因提高了拟南芥的抗旱能力和耐盐性,因此,ZmERD4基因在植物生长发育中积极响应逆境胁迫[6-7]。拟南芥ERD6基因是在水分胁迫1 h后被鉴定到的,该基因被证实有12个跨膜结构域,且编码1个糖载体蛋白,表达量受旱胁迫影响又受低温干预[8-9]。
关于玉米中ERD6基因,目前只鉴定到2个转录本,存在2个Major facilitator superfamily(MFS)结构域,是蔗糖转运子,且属于ABA合成依赖途径,但是该基因在不同抗旱型材料中的旱胁迫表达量、不同玉米组织中的表达模式以及编码蛋白质的亚细胞定位尚未研究。本研究从前期旱胁迫转录组差异基因簇中,发现5个差异表达的玉米ERD基因,通过分析5个基因与16个拟南芥ERD基因编码蛋白质的关系、基因的时空表达模式及在旱敏感和抗旱性强的2个材料中的表达情况和亚细胞定位,初步验证了ZmERD6基因的潜在功能和表达模式,为培育抗旱型种质提供优质的分子资源,同时为将来进一步研究该基因家族的功能奠定基础。
1 材料和方法
1.1 试验材料
以旱敏感型(B73)和抗旱型(郑58)玉米自交系为试验材料。取大田正常水分下生长B73的幼根、幼叶、成熟根、茎、成熟叶、花药、胚、胚乳和种子作为时空表达分析的样品。温室内B73和郑58植株生长条件为:30 ℃光照培养16 h、26 ℃暗培养8 h,相对湿度为40%~55%;当B73和郑58长至三叶期时,对长势旺盛大小一致的玉米苗进行PEG(Hoagland营养液+20% PEG)处理,分别在胁迫6,12 h时取每个处理材料的叶片。以上试验样品5株相同部位混在一起为1个重复,每个部位3个生物学重复,将采集的样品迅速放入液氮冷冻后,存于-80 ℃超低温冰箱。
1.2 玉米总RNA提取及qRT-PCR分析
利用EasyPure RNA Purification Kit提取以上试验样品的总RNA,然后根据TansScript One-Step gDNA Removal and cDNA Synthesis试剂盒说明书所提供的程序进行反转录,合成cDNA。根据基因序列设计特异荧光引物,并以玉米18S为内参(表1)。利用CFX96实时荧光定量PCR仪(Bio-Rad,USA),参考SYBR Premix Ex TaqTM(TaKaRa,Japan)试剂盒说明书,采用两步法进行荧光定量PCR:95 ℃预变性30 s;95 ℃ 15 s,60 ℃ 30 s,40个循环。根据2-ΔΔCT法(ΔCT=CT目标基因-CT内参基因,ΔΔCT=ΔCT处理后-ΔCT对照)进行数据处理。
1.3 ZmERD基因的生物信息学分析
使用EXPASY中的protparam在线对编码的ZmERD蛋白等电点(pI)、分子质量(MW)等属性进行计算;使用Softberry网站预测蛋白质亚细胞定位;利用MEGA软件中的NJ法构建ZmERD蛋白与AtERD蛋白的系统发育树。
1.4 ZmERD6蛋白的亚细胞定位
对GRMZM2G109201基因设计特异引物,其中划线部分分别为Spe Ⅰ和Asc Ⅰ酶切位点(表1)。将扩增的GRMZM2G109201基因产物,经Spe Ⅰ和Asc Ⅰ双酶切后用T4 DNA连接酶连接到过表达载体pMDC83,转化并进行测序验证。将正确的融合过表达载体通过热激法转至农杆菌EHA105感受态细胞中,将阳性克隆的农杆菌重悬液通过注射法浸染六叶期的本氏烟叶片,48 h后将注射孔部位的叶片表皮组织倒置于共聚焦荧光显微镜下,观察本氏烟表皮细胞内绿色荧光蛋白表达情况,对GRMZM2G109201基因编码的ZmERD6蛋白进行亚细胞定位。
2 结果与分析
2.1 ZmERD基因的结构分析
对旱胁迫转录组水平筛选到的5个ZmERD基因进行分析(表2),发现基因属于2类,一类为SUGAR TRANSPORTER ERD6,一类为EARLY-RESPONSIVE TO DEHYDRATION STRESS(ERD4)。利用phytozome网站发现第一类基因含有超家族结构域,第二类含有钙依赖通道、晚期胞吐作用和胞质结构域。5个基因的氨基酸个数和等电点、分子质量相差较大,但是经预测均定位于质膜。
表1 研究所用的引物及用途
Tab.1 Primers and their use in the experiment

引物名称 Primer name引物序列(5′-3′) Primer sequence引物用途 Primer function18S-FCCTGCGGCTTAATTGACTC内参荧光定量PCR18S-RGTTAGCAGGCTGAGGTCTGG内参荧光定量PCRGRMZM2G109201-FTGGGTATAATGCGAGTCG荧光定量PCRGRMZM2G109201-RAGACAAGGACCATCCGCA荧光定量PCRGRMZM2G181206-FATGGGTTCTCTCACTGAC荧光定量PCRGRMZM2G181206-RCCAGTTTAGAAACCGGAT荧光定量PCRGRMZM2G134192-FATGGAGCGAGAGGGACGAGA荧光定量PCRGRMZM2G134192-RTGGTCAGGATCGAGCCAA荧光定量PCRGRMZM2G128641-FATGGCGACGCTCGAGGAC荧光定量PCRGRMZM2G128641-RACCCAGCTGAGGAAGGTGAC荧光定量PCRZmERD6-83-GFP-FCTAGACTAGTATGGCGACGCTCGAGGAC亚细胞定位ZmERD6-83-GFP-RTTGGCGCGCCCACCCAGCTGAGGAAGGTGAC亚细胞定位
注:ZmERD6对应GRMZM2G109201基因;_.限制性酶位点。
Note:ZmERD6 corresponds to the GRMZM2G109201 gene;_.Restriction enzyme site.
表2 ZmERD基因的结构分析
Tab.2 Structural analysis of ZmERD genes
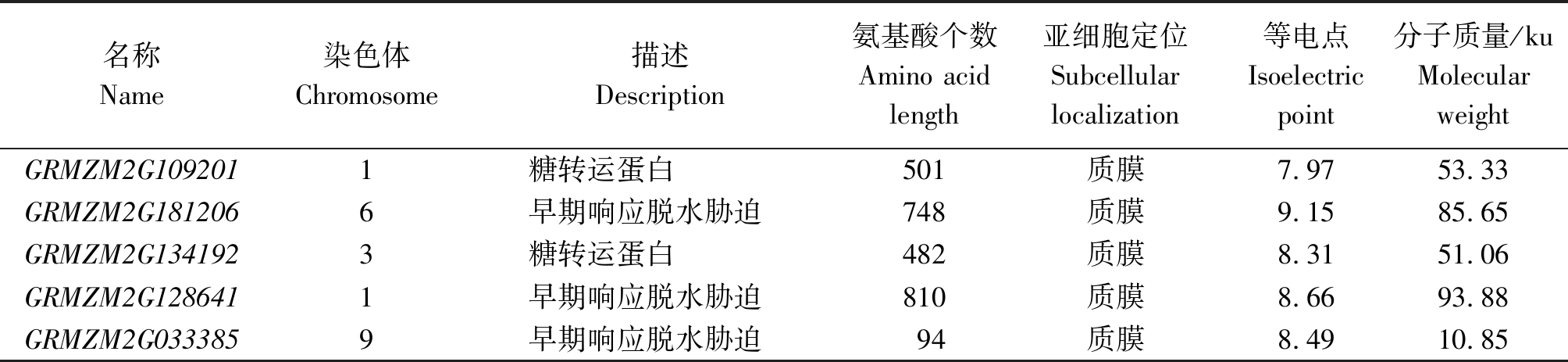
名称Name染色体Chromosome描述Description氨基酸个数Amino acidlength亚细胞定位Subcellularlocalization等电点Isoelectricpoint分子质量/kuMolecularweightGRMZM2G1092011糖转运蛋白501质膜7.9753.33GRMZM2G1812066早期响应脱水胁迫748质膜9.1585.65GRMZM2G1341923糖转运蛋白482质膜8.3151.06GRMZM2G1286411早期响应脱水胁迫810质膜8.6693.88GRMZM2G0333859早期响应脱水胁迫94质膜8.4910.85
2.2 ZmERD编码蛋白的系统进化树分析
为了研究玉米这5个ZmERD基因与拟南芥之间的进化关系,利用NJ法构建ZmERD蛋白与AtERD蛋白的系统发育树。从图1可以看出,GRMZM2G181206-P01(ERD4)蛋白与拟南芥AT4G02900蛋白,GRMZM2G128641-P01(ERD4)蛋白与AT1G32090蛋白序列相似度较高,进化关系较紧密。其他几个ZmERD蛋白与拟南芥的ERD蛋白同源性较低。对与拟南芥AtERD4基因同源的ZmERD4基因在旱、盐、ABA、低温等诱导下的表达情况和抗逆性研究较多,但是关于ZmERD6基因报道较少,值得进一步探究,故本研究对其中1个ZmERD6(GRMZM2G109201)基因进行不同材料、不同时间点的表达分析。
2.3 ZmERD基因的组织表达模式分析
为了解ZmERD基因在玉米不同部位、不同阶段的表达模式,利用qRT-PCR分析其中4个ZmERD基因的表达情况,结果显示(图2),GRMZM2G109201基因在胚和胚乳中不表达,在幼根和幼叶中表达量相对较高;GRMZM2G181206基因在花药中表达量最高,就发育的胚乳而言,基因在授粉30 d的胚乳中表达量最高;GRMZM2G128641基因在各个组织均表达,但随着授粉时间的延长表达量越来越高,在授粉40 d的胚乳中表达量是其他组织的2倍,甚至5倍;而GRMZM2G134192基因只在花药中高表达,其他部位基本不表达。也就是说,前3个基因为组成型表达基因,后者为特异性表达基因。
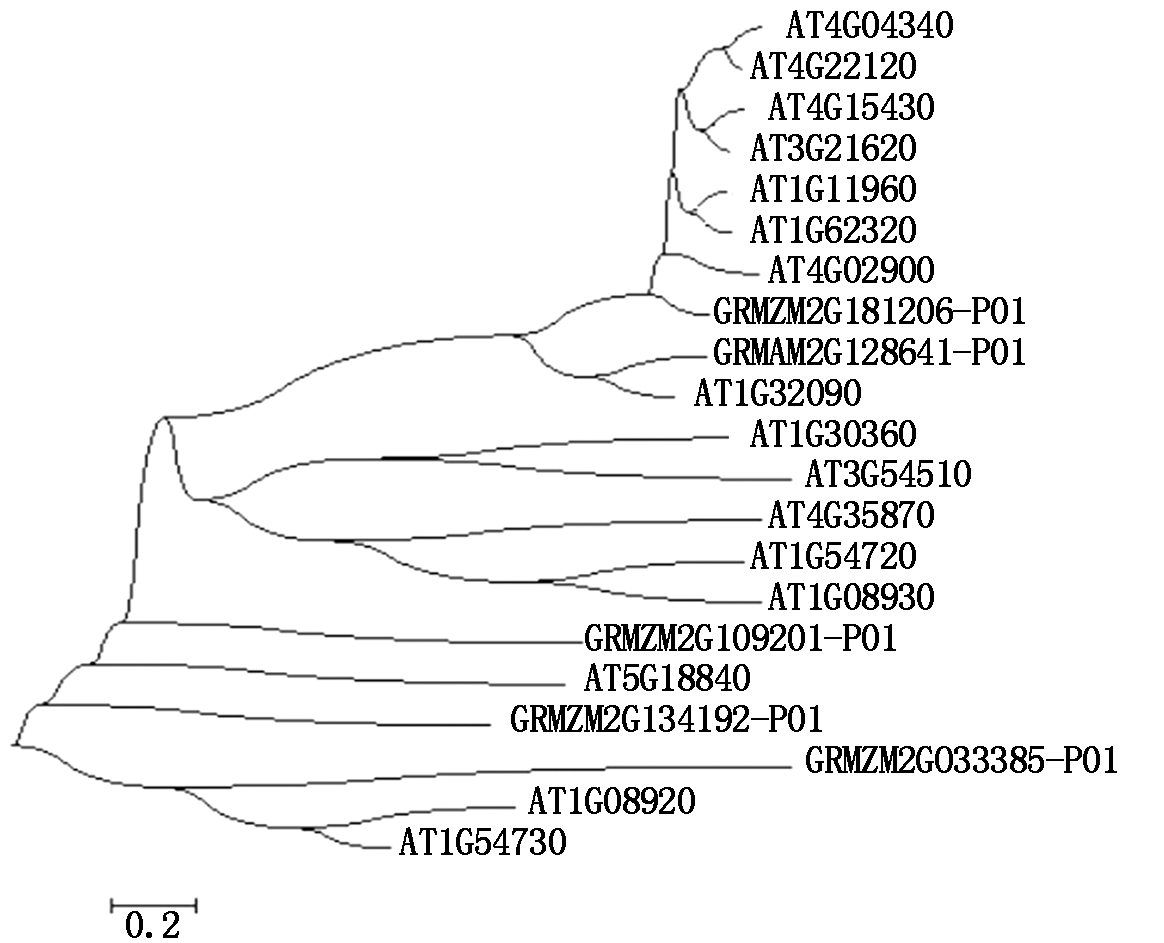
图1 玉米与拟南芥ERD蛋白的进化树
Fig.1 Evolutionary tree of maize and Arabidopsis ERD proteins
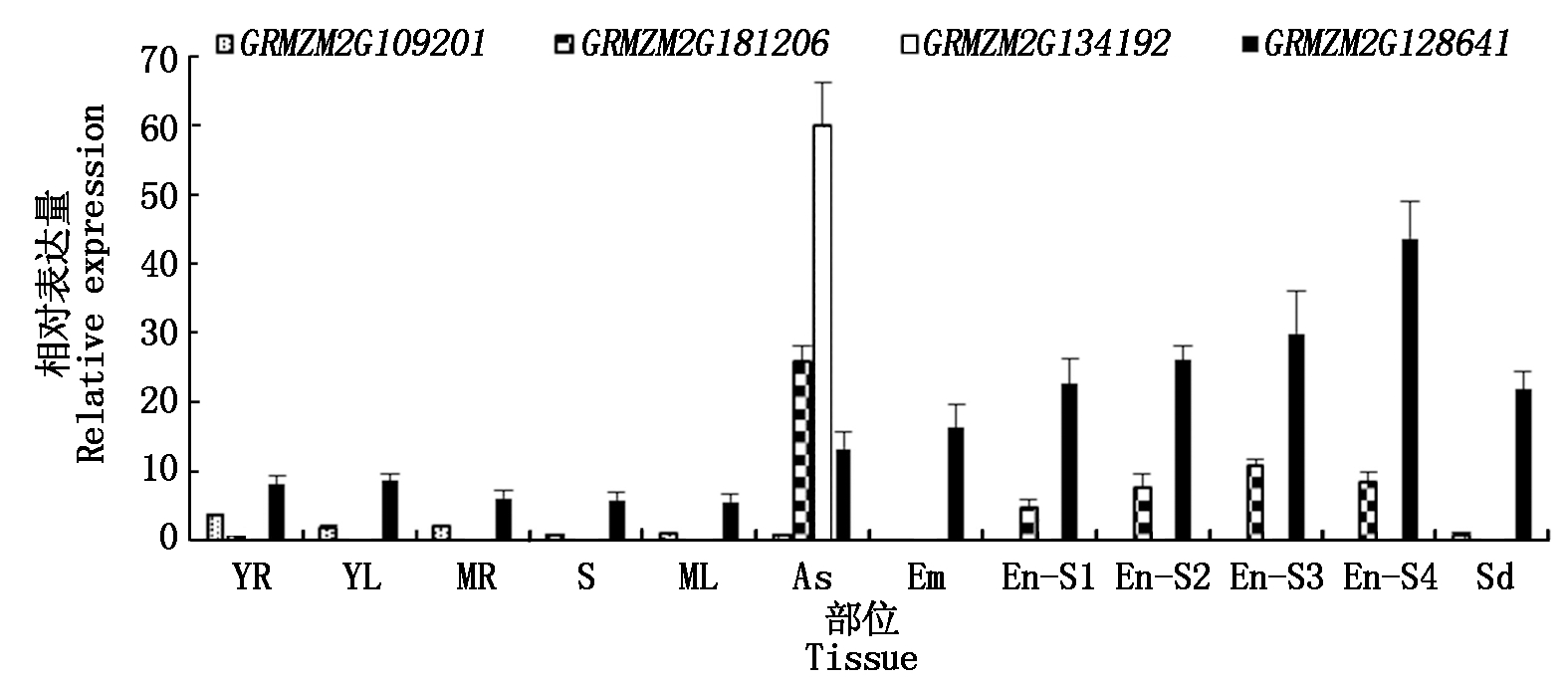
YR.幼根;YL.幼叶;MR.成熟根;S.茎;ML.成熟叶;As.花药;Em.胚;En-S1.授粉10 d的胚乳;En-S2.授粉20 d的胚乳;En-S3.授粉30 d的胚乳;En-S4.授粉40 d的胚乳;Sd.种子。
YR.Young roots;YL.Young leaves;MR.Mature roots;S.Stems;ML.Mature leaves;As.Anthers;Em.Embryos;En-S1.Endosperm after pollination for 10 days;En-S2.Endosperm after pollination for 20 days;En-S3.Endosperm after pollination for 30 days;En-S4.Endosperm after pollination for 40 days;Sd.Seeds.
图2 ZmERD基因的组织表达模式
Fig.2 Tissue expression pattern of ZmERD genes
2.4 GRMZM2G109201基因对旱胁迫的响应分析
为了初步研究GRMZM2G109201基因是否响应旱胁迫,及在不同抗旱型材料中的表达情况,利用B73和郑58为试验材料,进行荧光定量PCR分析。由图3可以看出,该基因在2种材料中均表达。在旱敏感型材料B73中,延长胁迫时间(从6 h到12 h),基因表达量变化不大;但是在抗旱型材料郑58中,随着胁迫时间的增加,基因表达量升高幅度达到了显著差异水平。比较该基因在二者中的表达量发现,2个胁迫点郑58的表达量均显著高于B73(P<0.05)。初步说明GRMZM2G109201基因参与旱胁迫,且被旱胁迫正向诱导。
2.5 ZmERD6蛋白的定位分析
利用农杆菌法将构建好的ZmERD6-pMDC83-GFP载体和pMDC83-GFP空载体瞬时转化烟草叶片(图4),通过激光共聚焦显微镜观察发现,对照空载体pMDC83-GFP在烟草的细胞膜和细胞核中均有绿色的荧光信号表达;但含有ZmERD6-pMDC83-GFP的融合表达载体只在质膜中观察到绿色荧光信号,说明ZmERD6蛋白定位于质膜中,与预测结果一致。

x轴中的6和12分别代表PEG胁迫的时间6 h和12 h;相同字母表示差异不显著;不同字母表示差异显著(P<0.05)。
The numbers 6 and 12 in the x-axis represent the time of PEG stress,6 h and 12 h,respectively;Identical letters indicate no significant difference; Different letters indicate significant difference(P<0.05).
图3 GRMZM2G109201基因对旱胁迫的响应
Fig.3 Response of GRMZM2G109201 gene to drought stress
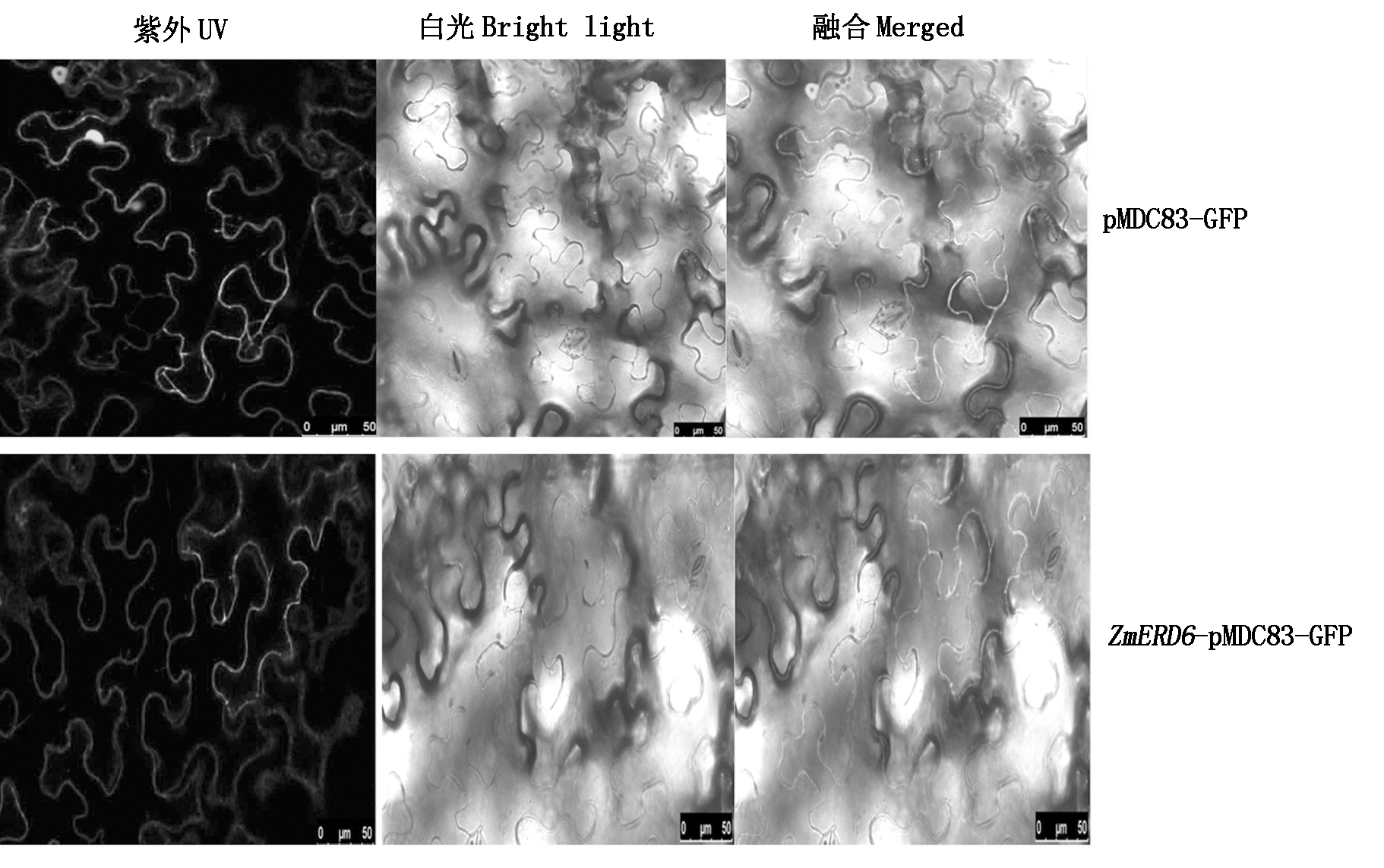
图4 ZmERD6的亚细胞定位
Fig.4 Subcellular localization of ZmERD6
3 结论与讨论
玉米产量的安全问题是国之大事,而旱胁迫又频频严重发生,导致产量下降,要减少或解决这个问题,必须培育出抗旱型新品种。从分子层面来讲,就是挖掘抗旱型基因,通过转基因或者分子辅助育种,将优质的抗旱型基因导入到骨干自交系中[10-11]。拟南芥上早有报道,ERD1基因编码1个Clp蛋白酶,该基因的表达受干旱和自然衰老等信号的诱导[9];ERD4编码1个整合蛋白,其表达受水分胁迫和ABA的诱导[6,12];ERD14编码脱水素蛋白,干旱处理1 h后在叶片中强烈表达,还受ABA诱导的影响[13];ERD15编码1个小的酸性蛋白,该基因表达受干旱、高盐、低温等多种生物和非生物胁迫影响,过表达ERD15基因则降低了植物对干旱、低温等处理的耐性[14-15]。但玉米上对ERD的报道较少,故本研究对ERD基因从进化、表达模式、响应旱胁迫情况、亚细胞定位等方面进行研究,以期初步筛选到潜在的抗旱基因,并为了解玉米ERD基因打下基础。
为了解玉米ERD与拟南芥ERD的进化关系,利用NJ构建进化树,发现GRMZM2G181206-P01蛋白与拟南芥AT4G02900蛋白同源性很高,GRMZM2G128641-P01蛋白与AT1G32090蛋白同源性也很高。AT4G02900和AT1G32090基因属于CSC1家族,CSC1是一类高渗胁迫的感受蛋白,拟南芥、水稻、番茄、小麦等作物中已证实,该家族在渗透胁迫调节方面起重要作用[15-21]。GRMZM2G181206和GRMZM2G128641基因属于早期响应脱水胁迫基因(ERD4),含有钙依赖通道,晚期胞吐作用和胞质结构域。推测玉米的GRMZM2G181206和GRMZM2G128641基因或许也存在潜在的渗透调节功能,值得进一步研究。
时空表达分析发现,GRMZM2G109201、GRMZM2G181206和GRMZM2G128641基因属于组成型表达,但是GRMZM2G109201基因在胚和胚乳中不表达,GRMZM2G181206基因在授粉30 d的胚乳中表达量最高,GRMZM2G128641基因在授粉40 d的胚乳中表达量达到峰值。GRMZM2G109201基因属于编码糖转运蛋白的基因(ERD6),含有超家族结构域。它们同属于ERD基因,但由于结构域不同,所属的大家族不同,基因的表达模式也不尽相同。
对不同抗旱型材料分析旱胁迫下GRMZM2G109201基因的表达情况,发现在旱敏感型材料B73中,延长胁迫时间(6~12 h),基因表达量变化不大;但是在抗旱型材料郑58中,随着胁迫时间的增加,基因表达量升高较多;且2个胁迫点中郑58的表达量均显著高于B73。GRMZM2G109201基因属于编码糖转运蛋白的基因 (ERD6)。推测GRMZM2G109201基因参与旱胁迫过程,且被正向积极诱导;或许其他ERD6基因也存在类似的功能,值得进一步深入研究。
GRMZM2G109201基因编码的ZmERD6蛋白定位于质膜,前人研究发现ZmERD16蛋白定位于细胞质和核中[19],GRMZM2G109201基因编码的ZmERD6蛋白属于蔗糖转运蛋白,而ZmERD16是一个泛素延伸蛋白,推测定位不同的原因或许是蛋白质家族及结构域的不同导致的作用机制不同。
本研究基于旱胁迫转录组数据,筛选出5个ZmERD基因,发现属于ERD4类型的GRMZM2G181206和GRMZM2G128641基因编码的蛋白质分别与拟南芥上2个CSC1感受蛋白高度同源,这2个基因属于组成型表达,且表达量随着授粉时间延长而增高;ERD6类的GRMZM2G134192基因属于特异型表达,只在花药中高表达。旱胁迫分析显示,属于ERD6类的GRMZM2G109201基因在抗旱型自交系中高表达,且亚细胞定位结果显示其编码的蛋白质位于质膜上。以上结果为进一步了解ZmERD基因奠定基础,也为筛选抗旱型基因提供参考。
[1] 吴子恺.玉米抗旱育种[J].玉米科学,1994,2(1):6-9.
Wu Z K.Corn breeding for drought resistance [J].Maize Science,1994,2(1):6-9.
[2] Bray E A. Plant responses to water deficit [J].Trends in Plant Science,1997,2(2):48-54. doi:10.1016/S1360-1385(97)82562-9.
[3] 却志群,於紫蕾,沈春修.水稻膜联蛋白基因OsAnn8干旱和低温条件下表达模式以及CRISPR/Cas9定点编辑[J].华北农学报,2019,34(1):54-60.doi:10.7668/hbnxb.201751053.
Que Z Q,Yu Z L,Shen C X.Expression patterns of annexin OsAnn8 and CRISPR/Cas9-mediated genome editing of rice under drought and low temperature condition[J]. Acta Agriculturae Boreali-Sinica,2019,34(1):54-60.
[4] Alsheikh M K,Heyen B J,Randall S K.Ion binding properties of the dehydrin ERD14 are dependent upon phosphorylation [J].Journal of Biological Chemistry,2003,278(42):40882-40889.doi:10.1074/jbc.M307151200.
[5] Taji T,Seki M,Yamaguchi-Shinozaki K,Kamada H,Giraudat J,Shinozaki K.Mapping of 25 drought-inducible genes,RD and ERD,in Arabidopsis thaliana[J].Plant Cell Physiol,1999,40(1):119-123.doi:10.1093/oxfordjournals.pcp.a029469.
[6] Liu Y H,Li H Y,Shi Y S,Song Y C,Wang T Y,Li Y.A maize early responsive to dehydration gene,ZmERD4,provides enhanced drought and salt tolerance in Arabidopsis[J].Plant Molecular Biology Reporter,2009,27(4):542-548. doi:10.1007/s11105-009-0119-y.
[7] 曹言勇,赵心萍,赵秋勇,张艳,唐保军,刘方方,王利锋,李会勇.玉米ZmERD4基因的分离及转基因株系的获得[J].河南农业科学,2011,40(12):43-47. doi:10.3969/j.issn.1004-3268. 2011.12.011.
Cao Y Y,Zhao X P,Zhao Q Y,Zhang Y,Tang B J,Liu F F,Wang L F,Li H Y.Isolation of ZmERD4 gene and generation of transgenic maize plants[J].Journal of Henan Agricultural Sciences,2011,40(12):43-47.
[8] Kiyosue T,Yamaguchy S K,Shinozaki K. Characterization of a cDNA for a dehydration-inducible gene that encodes a CLP A,B-like protein in Arabidopsis thaliaiana L[J]. Biochem Biophys Res Commun,1993,196(3):1214-1220.doi: 10.1006/bbrc.1993.2381.
[9] 李横江,邵幼岩.玉米ZmCIPK基因的克隆及表达模式分析[J].河南农业科学,2014,43(1):15-18.doi:10.15933/j.cnki.1004-3268.2014.01.013.
Li H J,Shao Y Y.Cloning and expression patter analysis on ZmCIPK genes of maize[J].Journal of Henan Agricultural Sciences,2014,43(1):15-18.
[10] 朱丽萍,于壮,邹翠霞,李秋莉.植物逆境相关启动子及功能[J].遗传,2010,32(3):229-234.doi:10.3724/SP.J.1005.2010.00229.
Zhu L P,Yu Z,Zou C X,Li Q L. Plant stress-inducible promoters and their function[J]. Hereditas,2010,32(3):229-234.
[11] 孟繁君,黄骥,鲍永美,江燕,张红生.水稻TF ⅢA型锌指蛋白基因ZFP207的克隆和表达分析[J].遗传,2010,32(4):387-392.doi:10.3724/SP.J.1005.2010.00387.
Meng F J,Huang J,Bao Y M,Jiang Y,Zhang H S.Cloning and expression analysis of ZFP207 encoding a TF ⅢA-type zinc finger protein in rice[J]. Hereditas,2010,32(4):387-392.
[12] Froehlich J E,Wilkerson C G,Ray W K,Mcandrew R S,Osteryoung K W,Gage D A,Phinney B S. Proteomic study of the Arabidopsis thaliana chloroplastic envelope membrane utilizing alternatives to traditional two-dimensional electrophoresis[J].Jonrnal of Proteome Research,2003,2(4):413-425.doi:10.1021/pr034025j.
[13] Kiyosue T,Yamaguchi S K,Shinozaki K.Characterization of two cDNAs(ERD10)and (ERD14)corresponding to genes that respond rapidly to dehydration stress in Arabidopsis thaliana[J]. Plant and Cell Physiology,1994,35(2):225-231.doi: 10.1093/oxfordjournals.pcp.a078588.
[14] Kariola T,Brader G,Helenius E,Li J,Heino P,Palva E T.EARLY RESPONSIVE TO DEHYDRATION 15,a negative regulator of abscisic acid responses in Arabidopsis[J].Plant Physiol,2006,142(4):1559-1573.doi: 10.1104/pp.106.086223.
[15] Yuan F,Yang H M,Xue Y,Kong D D,Ye R,Li C J,Zhang J Y,Theprungsirikul L, Shrift T, Krichilsky B,Johnson D M, Swift G B, He Y K,Siedow J N,Pei Z M.OSCA1 mediates osmotic-stress-evoked Ca2+ increases vital for osmosensing in Arabidopsis[J].Nature,2014,514(7522):367-371. doi:10.1038/nature13593.
[16] Li Y S,Yuan Y,Wen Z H,Li Y H,Wang F,Zhu T,Zhuo W Q,Jin X,Wang Y D,Zhao H P,Pei Z M,Han S H.Genome-wide survey and expression analysis of the OSCA gene family in rice[J].BMC Plant Biology,2015,15(1): 261.doi: 10.1186/s12870-015-0653-8.
[17] 王傲雪,张可为,张瑶,陈秀玲.番茄OSCA基因家族鉴定及不同胁迫条件下表达分析[J].东北农业大学学报,2019,50(1):19-28.doi:10.19720/j.cnki.issn.1005-9369.2019.01.003.
Wang A X,Zhang K W,Zhang Y,Chen X L.Identification of tomato OSCA gene family and expression analysis under different stress conditions[J]. Journal of Northeast Agricultural University,2019,50(1):19-28.
[18] 吕广德.小麦TaOSCA1.4基因的克隆、标记开发和功能分析[D].泰安:山东农业大学,2015.
Lü G D.Cloning,molecular markers and function of the gene TaOSCA1.4 in common wheat[D].Taian:Shandong Agricultural University,2015.
[19] 陆月赏.玉米泛素延伸蛋白ZmERD16的基因克隆与功能分析[D]. 哈尔滨:东北农业大学,2010.doi: 10.7666/d.y1787367.
Lu Y S.Identification and expression analysis of ZmERD16,a ubiquitin extension protein gene in maize(Zea mays L.)[D].Harbin:Northeast Agricultural University,2010.
[20] 袁珍,张鹏钰,王国瑞,曹丽茹,库丽霞,卫丽.玉米ZmPP2C6-01基因的克隆及表达分析[J].华北农学报,2019,34(2):8-18.doi:10.7668/hbnxb.201751477.
Yuan Z,Zhang P Y,Wang G R,Cao L R,Ku L X,Wei L.Cloning and expression of ZmPP2C6-01 gene in maize[J].Acta Agriculturae Boreali-Sinica,2019,34(2):8-18.
[21] 吕亚楠,余国武,黄玉碧.玉米AGPL2蛋白多克隆抗体制备及时空表达分析[J].华北农学报,2018,33(6):17-23.doi:10.7668/hbnxb.2018.06.003.
Lü Y N,Yu G W,Huang Y B.Preparation of polyclonal antibody of maize AGPL2 protein and analysis of its spatiotemporal expression analysis[J].Acta Agriculturae Boreali-Sinica,2018,33(6):17-23.