植物的生长发育过程受到很多环境因素的影响,在其进化过程中逐渐形成了对环境信号做出敏锐反应的能力[1]。光照是植物生长发育过程中不可或缺的环境信号。植物会通过独特的光合作用(Photosynthesis)与周围环境进行着物质和能量的交换,以维持其正常的生长发育[2]。光周期(Photoperiod)即昼/夜交替周期,在地球上各纬度地带季节性交替循环,植物对这种规律性变化的日照时间长短往往会表现出有规律的生长发育现象,称为光周期现象(Photoperiodism),不同的植物对光周期的敏感性是不同的[3-4]。抽穗开花是植物生长发育过程中非常重要的阶段,主要是由植物的感光性、感温性和基本营养生长性所决定,近些年相关研究者提出了光周期途径、自主调节途径、赤霉素途径和春化途径这4种开花调控途径[5]。其中光周期是植物开花的主要环境决定因素,一些热带种质在长日照条件下可以显著延迟生殖生长的开始,因此,光周期现象也被视为一种重要的生理特征[6-7]。目前对光周期途径的研究较彻底,如通过水稻抽穗期的遗传学分析、QTL定位及相关基因克隆等基础研究发现,抽穗期受多个基因调控,而Hd3a (Heading date 3a)基因是所有调控路径的末端基因,其表达量的高低直接与抽穗期早晚紧密相关,并且受光周期调控,在短日照条件下表达量增加,而在长日照条件下表达量较低,Hd3a基因表现出一定的昼夜节律性表达特点,同时植物的生理过程也表现出昼夜节律,从而能够适应环境的昼夜循环[8-9]。
谷子是短日照喜温作物,其中光周期是影响其生态适应性的关键因素,这种生态适应性主要是通过调节抽穗期来实现的。作为一种C4作物,谷子中关于光周期调控开花的基因极少报道[10],目前谷子全基因组测序已经完成,这为克隆光周期途径抽穗、开花控制基因提供了基础。鉴于成花素基因Hd3a是水稻抽穗期的直接调控者,本研究利用RT-PCR技术克隆谷子成花素基因SiHd3a,在进行生物信息学分析的基础上,研究该基因在长、短日照条件下的昼夜表达规律,揭示其在调控谷子抽穗过程中所起的作用,为进一步深入研究谷子光周期敏感性的分子机制奠定基础。
1 材料和方法
1.1 试验材料
供试材料为谷子地方品种黄毛谷,来源于河北,具有对光周期非常敏感的特性。
1.2 试验方法
1.2.1 谷子的种植和取样 选取籽粒饱满的黄毛谷种子点播于营养土中,置于光照培养箱,昼夜温度30 ℃/25 ℃,待长至四叶期分别进行2种不同光周期处理:短日照处理(9 h光/15 h暗)、长日照处理(15 h光/9 h暗)。统一早上6:00开始光照,分别于15:00和21:00进入黑暗培养。培养21 d,在昼夜24 h内从晚上21:00开始取样,每隔3 h取1次,共取9次样(21:00取样2次),每次均取顶端第1片幼叶,所取叶片均在液氮速冻后置-70 ℃保存,用于总 RNA 的提取。
1.2.2 谷子总RNA的提取与第一链cDNA 的合成 用康为世纪生物技术有限公司的OmniPlant RNA Kit提取叶片总RNA。用宝生物公司(TaKaRa)的DNase 处理各样品总RNA,去除残留的基因组DNA,参照宝生物公司的PrimeScript Ⅱ1st Strand cDNA Synthesis Kit说明书以总RNA为模板,用 Oligo(dT18)及6碱基随机引物(Random hexamers)合成第一链 cDNA,于-20 ℃保存。
1.2.3 引物设计及PCR扩增 利用生物信息学方法以水稻Hd3a基因(登录号:AB052941)编码蛋白质序列为查询序列,对基因组数据库phtozome(https://phytozome.jgi.doe.gov/pz/portal.html)中的谷子基因组数据进行 Blast同源搜索,获得谷子4号染色体的成花素基因序列(Seita.4G067600),命名为SiHd3a。根据此序列,用软件Primer Premier 5.0设计1对特异引物:正向引物为5′-CCAAGCAAGGCTACAGGT-3′,反向引物为5′-GTGGCTAGTGTGTCGTACT-3′;预期扩增片段大小为792 bp,包含完整的CDS区域。
PCR扩增体系为:ddH2O 10.5 μL,2×Taq PCR Green Mix 12.5 μL,上游引物0.5 μL,下游引物0.5 μL,cDNA模板1.0 μL。扩增循环程序为:94 ℃预变性4 min;94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸1 min,共35个循环;最后72 ℃延伸5 min。
1.2.4 扩增产物的回收纯化 PCR扩增产物经l%琼脂糖凝胶电泳分离,使用全式金生物技术有限公司的EasyPure Quick Gel Extraction Kit回收纯化目标片段。
1.2.5 扩增产物的克隆及测序 将回收纯化的基因片段连接到pMD18-T载体(宝生物公司),转化大肠杆菌DH5α感受态细胞(天根生化有限公司)。挑取阳性菌落,移入装有1 mL无菌液体 LB 培养基(含Amp 50 mg/L)的1.5 mL灭菌离心管中,37 ℃、200 r/min 振荡培养8 h后,用M13引物进行菌液PCR检测。菌液PCR扩增体系为20 μL,含2 μL 10×Buffer、1.6 μL 2.5 mmol/L的dNTPs、1.6 μL 25 mmol/L MgCl2、0.6 μL 10 pmol/μL的正反向引物、1 μL菌液、0.4 μL Taq酶、12.2 μL ddH2O。PCR扩增程序为:95 ℃预变性4 min;随后94 ℃ 30 s,56 ℃ 30 s,72 ℃ 90 s,共34个循环;最后72 ℃延伸5 min。菌液PCR扩增产物经1.2% 琼脂糖凝胶电泳检测后拍照,将检测正确的阳性克隆菌液送往生工(上海)有限公司测序部测序。
1.2.6 SiHd3a基因生物信息学分析 用ProtParam在线工具(https://web.expasy.org/protparam/)预测蛋白质的基本物理化学性质;用 SOPMA和Swiss-model在线分析软件(http://www.sopma.org/,https://swissmodel.expasy.org/)预测蛋白质的二级结构;用CELLO在线工具(http://cello.life.nctu.edu.tw/)进行亚细胞定位预测;将SiHd3a蛋白序列作为查询序列,通过Blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi)程序同源搜索NCBI数据库,获得部分物种Hd3a蛋白同源序列,用Mega 5.0软件构建系统进化树。
1.2.7 SiHd3a基因半定量PCR分析 设计SiHd3a基因半定量扩增引物:SiHd3a RT-F为5′-AAGTTGCGACGAGATGGC-3′,SiHd3a RT-R为5′-GCGAAGTCCCTGGTGTTGA-3′;扩增产物459 bp。以谷子SiActin 基因作为对照,引物序列: SiActin-F为5′-GGCAAACAGGGAGAAGATGA-3′,SiActin-R为5′-GAGGTTGTCGGTAAGGTCACG-3′;产物大小为228 bp[11]。
通过摸索得到半定量 PCR 反应最佳循环程序: 94 ℃ 3 min;94 ℃ 30 s,58 ℃ 40 s,72 ℃ 50 s,28 个循环;72 ℃ 5 min。反应产物经1.2%琼脂糖凝胶电泳分离后,采用凝胶成像系统拍照并进行分析。
2 结果与分析
2.1 谷子总RNA的提取
分别在长日照、短日照条件下培养谷苗,取21 d的顶端幼嫩叶片提取总RNA,结果见图1,可以看出,所提取的RNA完整性较好。以总RNA为模板,反转录合成第一链cDNA,并用作模板扩增内参基因,结果扩增出与预期一致的228 bp的条带,证明cDNA合成成功(图2)。
1,2.提取的2管RNA。
1,2.Two tubes of RNA extracted .
图1 谷子总RNA电泳结果
Fig.1 Electrophoretic results of total RNA in millet
M.Marker DL2000;1,2.内参基因扩增产物。
M.Marker DL2000; 1,2.Amplified products of internal reference gene.
图2 内参基因扩增产物检测结果
Fig.2 Detection results of internal reference gene amplification products
2.2 谷子SiHd3a基因扩增与菌液PCR检测
以 cDNA为模板扩增SiHd3a基因,结果见图3,可以看出,在靠近750 bp处扩增出一条特异性条带,与预期的792 bp接近。通过连接、转化得到单克隆,挑取阳性克隆经培养后进行菌液PCR检测,获得了与预期条带一致的目的片段(图4),将检测成功的阳性克隆菌液送生工上海生物技术公司测序。
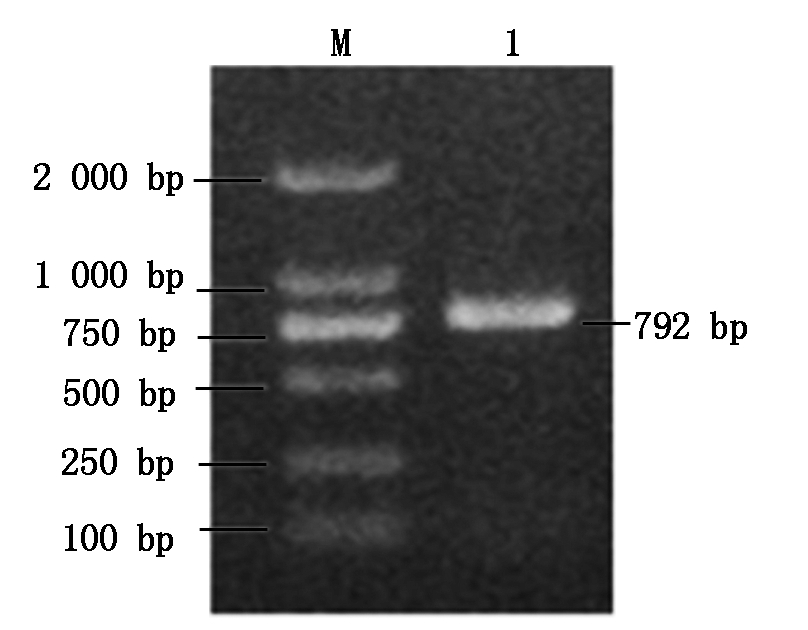
M.Marker DL2000;1.RT-PCR产物。
M.Marker DL2000; 1.RT-PCR product.
图3 SiHd3a基因扩增产物电泳结果
Fig.3 Electrophoresis result of amplified product of SiHd3a gene
M.Marker DL2000;1-3.3管菌液。
M.Marker DL2000; 1-3.Three tubes of bacterial solution.
图4 SiHd3a基因的菌液PCR扩增产物电泳结果
Fig.4 Electrophoresis results of bacteria liquid PCR product of SiHd3a gene
2.3 谷子SiHd3a基因的序列分析
通过测序得到谷子SiHd3a的cDNA序列,如图5所示。序列分析表明,该基因cDNA序列大小为792 bp,包含完整的CDS序列537 bp,编码178个氨基酸。将测序结果与数据库豫谷1号基因序列进行比对,只有3个碱基突变,分别位于豫谷1号SiHd3a基因序列的38,144,218 bp处,对应黄毛谷SiHd3a基因cDNA序列的32,138,212 bp处(图6)。其中第1处突变位于编码区外,第2处突变使豫谷1号SiHd3a蛋白第14位的精氨酸突变为黄毛谷SiHd3a蛋白的甘氨酸,第3处突变为同义突变,未造成所编码氨基酸的改变(图7)。
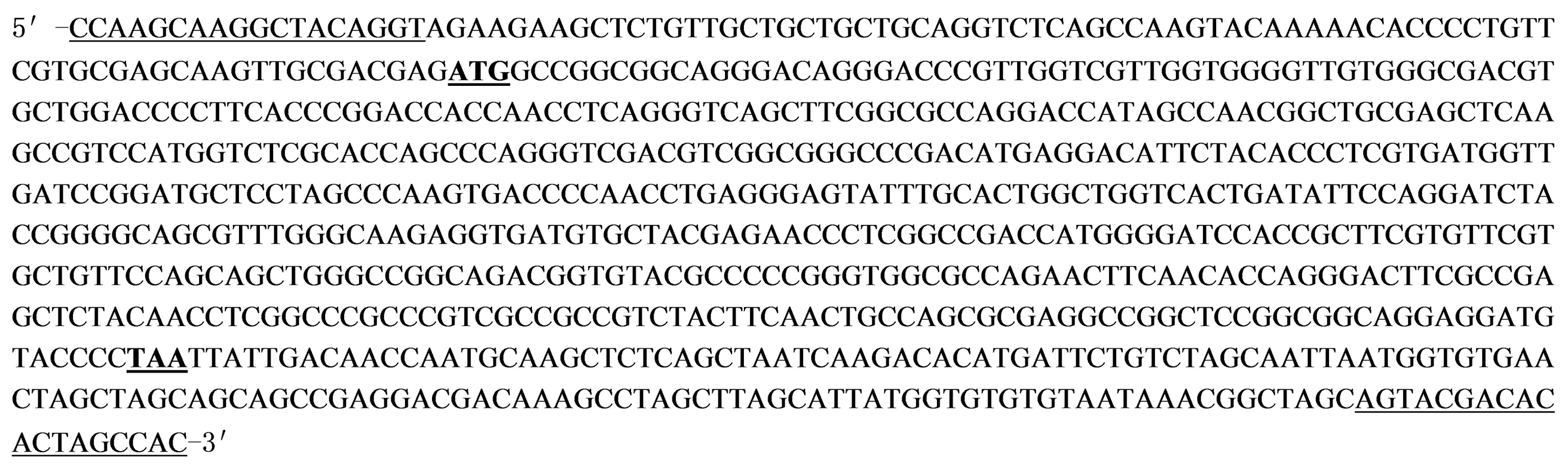
粗体下划线.起始密码子和终止密码子;下划线.引物序列。
The bold underlines.Initial codon and termination codon respectively;The underlines.Primer sequences.
图5 黄毛谷SiHd3a基因cDNA序列
Fig.5 The cDNA sequence of SiHd3a gene from Huangmaogu

图6 黄毛谷与豫谷1号SiHd3a基因序列比对结果
Fig.6 Sequence alignment result of SiHd3a gene between Huangmaogu and Yugu 1

图7 黄毛谷与豫谷1号SiHd3a蛋白序列比对结果
Fig.7 Sequence alignment result of SiHd3a protein between Huangmaogu and Yugu 1
2.4 谷子SiHd3a蛋白的理化性质分析
生物信息学分析发现,SiHd3a蛋白分子质量为19.74 ku,等电点(pI)为6.82。其一级结构中氨基酸丰度依次为甘氨酸(Gly,19个,10.70%)、缬氨酸(Val,18个,10.10%)、脯氨酸(Pro,16个,9.00%)、精氨酸(Arg,16个,9.00%)、亮氨酸(Leu,12个,6.70%)、丙氨酸(Ala,11个,6.02%)、天冬氨酸(Asp,11个,6.02%)、苏氨酸(Thr,11个,6.02%)、苯丙氨酸(Phe,10个,5.60%)、天冬酰胺(Asn,8个,4.50%)、谷氨酰胺(Gln,7个,3.90%)、蛋氨酸(Met,7个,3.90%)、丝氨酸(Ser,7个,3.90%)、络氨酸(Tyr,7个,3.90%)、谷氨酸(Glu,6个,3.40%)、半胱氨酸(Cys,3个,1.70%)、组氨酸(His,3个,1.70%)、异亮氨酸(Ile,3个,1.70%)、色氨酸(Trp,2个,1.10%)、赖氨酸(Lys,1个,0.60%)。带负电荷的氨基酸有Asp、Glu,共17个,带正电荷的氨基酸有Arg、Lys,共17个。对SiHd3a蛋白的亲/疏水性进行分析表明,多肽链的第143位氨基酸分值最低,为-2.422,第13位氨基酸分值最高,为1.978。从整体上看,SiHd3a的亲水氨基酸多于疏水氨基酸,可初步判断SiHd3a为亲水蛋白。
2.5 谷子SiHd3a蛋白的二级结构预测与亚细胞定位
SiHd3a蛋白的二级结构分析结果见表1,可以看出,谷子SiHd3a蛋白的二级结构中α螺旋29个,所占比例为16.29%;延伸链52个,所占比例为29.21%;β转角20个,所占比例为11.24%;无规则卷曲77个,所占比例为43.26%。亚细胞定位分析发现,谷子SiHd3a蛋白定位在细胞质和细胞间质。
表1 SiHd3a蛋白的二级结构组成
Tab.1 Secondary structure composition of Hd3a protein sequence of millet
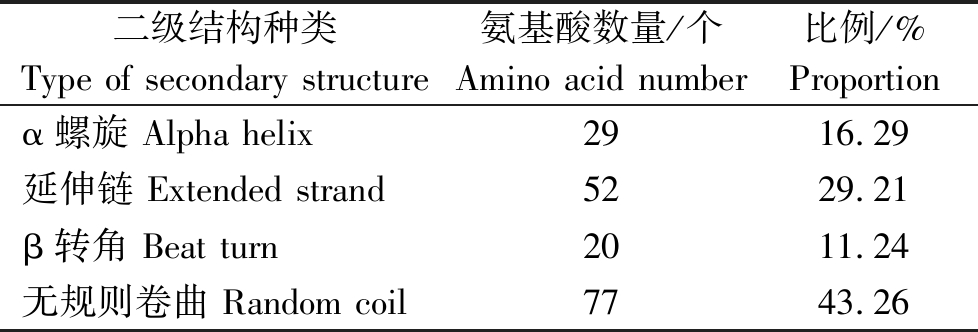
二级结构种类Type of secondary structure氨基酸数量/个Amino acid number比例/%Proportionα螺旋 Alpha helix 2916.29延伸链 Extended strand 5229.21β转角 Beat turn 2011.24无规则卷曲 Random coil7743.26
2.6 谷子SiHd3a蛋白进化树分析
从 NCBI 获取与谷子SiHd3a蛋白相似性高的8种植物Hd3a蛋白氨基酸序列,构建的进化树结果见图8,可以看出,谷子与野生黍(Panicum hallii)、玉米(Zea mays)、高粱(Sorghum bicolor)亲缘关系最近,4个物种聚为一个组,其次与节节麦(Aegilops tauschii)、二穗短柄草(Brachypodium distachyon)亲缘关系较近,与3种稻类亲缘关系最远。
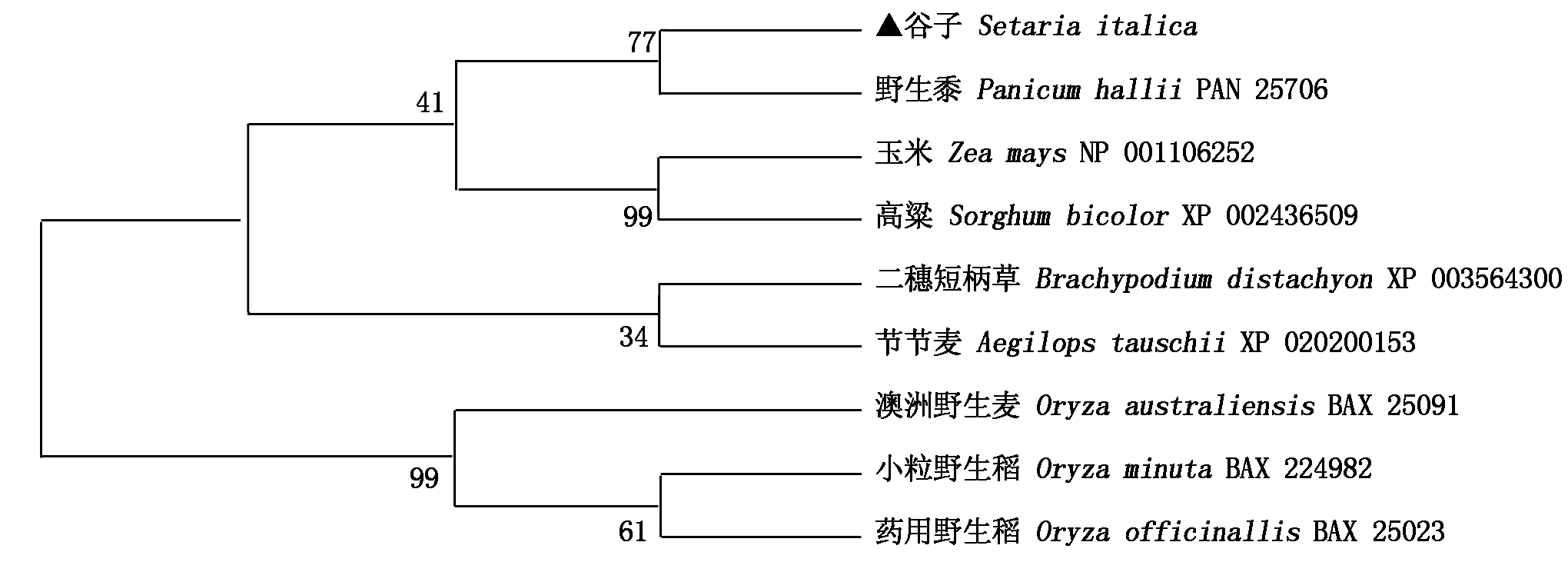
图8 基于Hd3a蛋白氨基酸序列的9个物种进化树
Fig.8 Phylogenetic tree of nine species based on the amino acid sequences of Hd3a protein
2.7 谷子SiHd3a基因表达半定量分析
SiHd3a基因在长、短日照条件下昼夜表达情况见图9。从图9可以看出,在短日照条件下SiHd3a基因呈24 h昼夜节律性表达特点:从下午15:00黑暗开始至凌晨3:00整个暗夜期,除凌晨3:00有少量表达外其余时间基因表达量均较低,早晨6:00开始光照,基因表达量最高,达到第1个峰值,早晨9:00至中午12:00 光照期间SiHd3a基因表达量有所下降,但仍维持较高表达水平,12:00达到1个小高峰。在长日照条件下SiHd3a基因表达并没有出现明显的昼夜节律性,从早晨6:00光照开始至凌晨3:00,无论光照期还是黑暗期SiHd3a基因均具有较强的表达活性,各时间点表达量差异不明显,这与水稻中Hd3a基因长日照下表达规律不同。
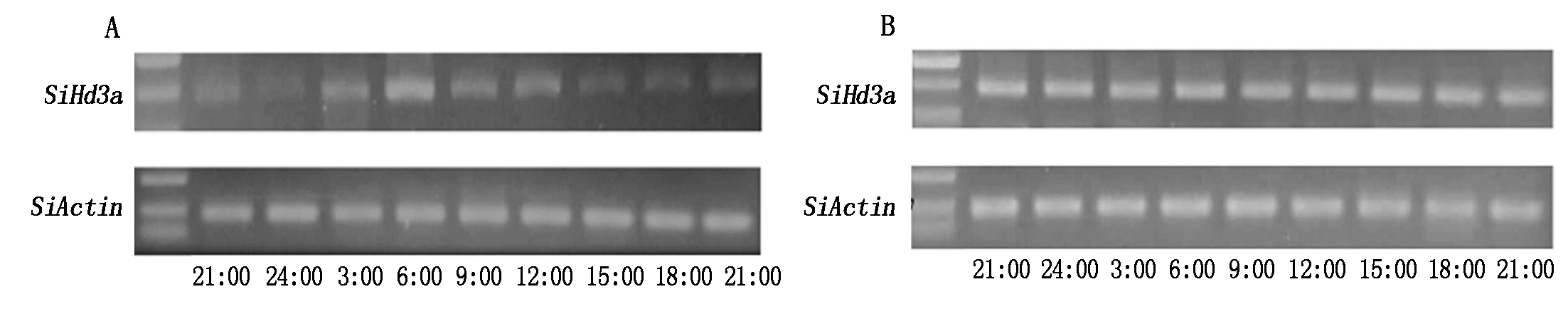
A.短日照条件下;B.长日照条件下。
A.Under short-day condition;B.Under long-day condition.
图9 长、短日照条件下SiHd3a基因在黄毛谷中昼夜表达规律
Fig.9 Circadian expression pattern of SiHd3a gene in Huangmaogu under long-day and short-day conditions
3 结论与讨论
利用RT-PCR技术从黄毛谷克隆得到SiHd3a基因cDNA序列,包含1个537 bp的开放读码框,编码178个氨基酸;生物信息学分析发现,SiHd3a为亲水蛋白,定位在细胞质和细胞间质,谷子与野生黍、玉米、高粱的Hd3a蛋白进化关系较近,而与稻类进化关系较远;SiHd3a基因在短日照条件下呈昼夜节律性表达,早晨6:00见光时达到最高峰,长日照条件下SiHd3a基因在昼夜24 h内表现稳定高表达。
Hd3a属于水稻FT-like基因家族,该家族包括13个成员[12-13],其中Hd3a/FT-L2与RFT1(RICE FLOWERING LOCUS T 1)/FT-L3同源性最高。在不同植物间Hd3a基因具有很高的保守性[14-15]。本研究表明,Hd3a蛋白在谷子、野生黍、玉米、高粱之间的进化关系比较近,而与水稻进化关系较远,说明Hd3a进化过程中在C3与C4作物间可能产生了功能上的分化。
在野生型水稻中引入Hd3a 可以导致早花表型,而利用RNAi(RNA interference)抑制Hd3a的表达会推迟开花,说明Hd3a具有促进水稻开花的功能[16-17]。将在大肠杆菌中表达的Hd3a重组蛋白分离纯化后,对大花蕙兰和蝴蝶兰的叶和叶基部茎进行不同浓度蛋白注射,结果发现,注射的植株和未注射的植株在开花进程中未产生显著差异[18]。事实上,Hd3a蛋白在叶片维管组织中合成,然后通过韧皮部维管组织运输到顶端分生组织,证明Hd3a 蛋白可以长距离运输[19]。Hd3a基因是水稻开花调控途径的信息整合基因,负责将来自各种途径的开花信号汇总起来,继而诱导下游的花器官决定基因表达,从而诱导开花[20]。作为短日照植物,水稻的成花包括短日照促进途径和长日照抑制途径。短日照条件下水稻主要通过2条途径即Hd1(Heading date 1)途径和Ehd1(Early heading date 1)途径促进开花,Hd1和Ehd1基因在短日照条件下表达能够促进Hd3a的表达,从而加速水稻开花[21-22]。Hd1对Hd3a的调控并不像拟南芥CO(CONSTANS)调控FT那样简单,Hd1在长日照、短日照条件下均能正常表达,但是长日照条件下对开花起抑制作用,与短日照相反。Ehd1 仅在短日照条件下诱导表达,且表达具有节律性,在Hd1基因失活的条件下仍能通过促进Hd3a的表达来诱导开花,且表达模式与Hd3a一致[23]。本研究发现,SiHd3a基因在短日照条件下表现昼夜节律表达特性,早晨6:00开始光照表达量最高,这与水稻Hd3a基因短日照条件下在黎明表达量最高是一致的[24],这种节律性表达可能是受Ehd1调控的结果。长日照条件下,水稻Hd3a基因表达量在各个阶段都较低,因为Hd1在长日照条件下抑制Hd3a 的表达,同时Ehd1基因表达量较低[25]。本研究发现,长日照条件下SiHd3a基因昼夜24 h内均有较强的表达活性,与水稻Hd3a长日照条件下低表达相反,产生这种结果的原因可能是本研究获得的SiHd3a基因在长日照条件下对谷子开花没有作用,谷子中可能存在着另一个成花素基因专门负责长日照条件下促进抽穗开花。因为本研究所使用的谷子材料黄毛谷对光周期敏感,长日照条件下抽穗期严重推迟,这与SiHd3a基因长日照条件下的高表达量存在矛盾。
[1] 曾群,赵仲华,赵淑清.植物开花时间调控的信号途径[J].遗传,2006,28(8): 1031-1036. doi: 10.3321/j.issn:0253-9772.2006.08.021.
Zeng Q,Zhao Z H,Zhao S Q. Signal pathways of flowering time regulation in plant[J].Hereditas,2006,28(8):1031-1036.
[2] Lumsden P J. Photoperiodism in plants[M]//Biological rhythms. New Delhi,India:Narosa Publishing House,2002:181-191. doi:10.1007/978-3-662-06085-8-15.
[3] 陈彦惠,张向前,常胜合,吴连成,吴建宇,席章营. 热带玉米光周期敏感相关性状的遗传分析[J].中国农业科学,2003,36(3):248-253.doi: 10.3321/j.issn:0578-1752.2003.03.003.
Chen Y H,Zhang X Q,Chang S H,Wu L C,Wu J Y,Xi Z Y. Studies on the heredity of the traits related to the photoperiod-sensitive phenomenon among the temperate xtropical crosses in maize[J]. Scientia Agricultura Sinica,2003,36(3): 248-253.
[4] Ishikawa R, Tamaki S, Yokoi S, Inagaki N, Shinomura T, Takano M, Shimamoto K. Suppression of the floral activator Hd3a is the principal cause of the night break effect in rice[J]. The Plant Cell,2005,17(12): 3326-3336. doi: 10.1105/tpc.105.037028.
[5] 魏鑫,曹立荣,杨庆文,曾汉来.水稻抽穗期的光周期调控分子基础研究进展[J].生命科学研究,2010,14(5): 456-463.
Wei X,Cao L R,Yang Q W,Zeng H L.Research progress of photoperiodic response controlling heading in rice[J].Life Science Research,2010,14(5):456-463.
[6] 穆彩琴,张瑞娟,屈聪玲,齐晓,米怡,杨致荣.高等植物抽穗开花调控的分子网络[J].山西农业科学,2016,44(8): 1228-1231,1236. doi: 10.3969/j.issn.1002-2481.2016.08.42.
Mu C Q,Zhang R J,Qu C L,Qi X,Mi Y,Yang Z R.Molecular network of heading and flowering regulation in higher plants[J]. Journal of Shanxi Agricultural Sciences,2016,44(8): 1228-1231,1236.
[7] 张体德,杜振伟,梅鸿献,刘艳阳,崔承齐,胡程达,马青荣,郑永战.芝麻开花时间的主基因+多基因遗传分析[J].河南农业科学,2019,48(6):67-72. doi:10.15933/j.cnki.1004-3268.2019.06.010.
Zhang T D,Du Z W,Mei H X,Liu Y Y,Cui C Q,Hu C D,Ma Q R,Zheng Y Z.Genetic analysis of flowering time with the mixed major gene plus polygene inheritance model in sesame[J]. Journal of Hennan Agricultural Sciences,2019,48(6):67-72.
[8] 彭凌涛.控制拟南芥和水稻开花时间光周期途径的分子机制[J].植物生理学通讯,2006,42(6):1021-1031.
Peng L T.Molecular mechanism of flowering time controlling photoperiod pathway in Arabidopsis and rice[J]. Plant Physiology Communications,2006,42(6):1021-1031.
[9] 祁军,顾超,东锐,张坤, 崔百明, 黄先忠.水稻成花素Hd3a及其受体分子机制研究进展[J].安徽农业科学,2012,40(20): 10374-10375.doi:10.3969/j.issn.0517-6611.2012.20.006.
Qi J,Gu C,Dong R,Zhang K,Cui B M,Huang X Z. Research on molecular mechanism of Hd3a florigen and Hd3a receptor in rice[J]. Journal of Anhui Agricultural Sciences,2012,40(20):10374-10375.
[10] 袁玺垒,戴凌峰,张小梅,郁飞燕,贾小平.谷子Hd1-like基因的克隆及其与农艺性状的关联分析[J].河南农业科学,2018,47(6):24-30. doi: 10.15933/j.cnki.1004-3268.2018.06.005.
Yuan X L,Dai L F,Zhang X M,Yu F Y,Jia X P. Putative Hd1-like gene cloning and its preliminary association with agronomic traits in foxtail millet(Setaria italica)[J]. Journal of Hennan Agricultural Sciences,2018,47(6):24-30.
[11] 杨希文,胡银岗.谷子DREB转录因子基因的克隆及其在干旱胁迫下的表达模式分析[J].干旱地区农业研究,2011,29(5): 69-74.
Yang X W,Hu Y G. Cloning of a DREB gene from foxtail millet(Setaria italica L.)and its expression during drought stress[J]. Agricultural Research in the Arid Areas,2011,29(5): 69-74.
[12] Chardon F,Damerval C. Phylogenomic analysis of the PEBP gene family in cereals[J]. Journal of Molecular Evolution,2005,61(5): 579-590. doi: 10.1007/s00239-004-0179-4.
[13] Faure S,Higgins J,Turner A,Laurie D A. The FLOWERING LOCUS T-like gene family in barley(Hordeum vulgare)[J]. Genetics,2007,176(1): 599-609. doi: 10.1534/genetics.106.069500.
[14] 龙卫,艾辛,蒋建雄,朱玉叶, 李莎莎, 支添添.荻MsFT1及MsFT2基因的克隆及序列分析[J].现代农业科技,2015,1(8): 9-12. doi: 10.3969/j.issn.1007-5739.2015.08.001.
Long W,Ai X,Jiang J X,Zhu Y Y,Li S S,Zhi T T.Cloning and sequence analysis of MsFT1 and MsFT2 gene in Miscanthus sacchariflorus[J]. Modern Agricultural Science and Technology,2015,1(8):9-12.
[15] 桑庆亮,黄周英,孙亮先.龙竹和麻竹FT同源序列的扩增与序列分析[J].泉州师范学院学报,2012,30(2): 67-71.
Sang Q L,Huang Z Y,Sun L X.Amplification and sequence analysis of partial FT-like sequences in Dendrocalamus giganteus and Dendrocalamus latiflorus[J].Journal of Quanzhou Normal University,2012,30(2):67-71.
[16] Kojima S,Takahashi Y,Kobayashi Y,Monna L,Sasaki T,Araki T,Yano M. Hd3a, a rice ortholog of the Arabidopsis FT gene,promotes transition to flowering downstream of Hd1 under short-day conditions[J]. Plant & Cell Physiology,2002,43(10): 1096-1105.doi: 10.1093/pcp/pcf156.
[17] Komiya R,Ikegami A,Tamaki S,Yokoi S,Shimamoto K. Hd3a and RFT1 are essential for flowering in rice[J]. Development,2008,135(4): 767-774. doi: 10.1242/dev.008631.
[18] 朱廷恒,方三余,严宏波,张超, 汪琨, 崔志峰.重组蛋白Hd3a在大肠杆菌中的表达、纯化及活性研究[J].浙江工业大学学报,2013,41(6):601-604.
Zhu T H,Fang S Y,Yan H B,Zhang C,Wang K,Cui Z F.The expression,purification and activity of recombinant protein Hd3a in Escherichia coli[J]. Journal of Zhejiang University of Technology,2013,41(6):601-604.
[19] Tamaki S,Matsuo S,Wong H L,Yokoi S,Shimamoto K. Hd3a protein is a mobile flowering signal in rice[J]. Science,2007,316(5827): 1033-1036. doi: 10.1126/science.1141753.
[20] Itoh H,Nonoue Y,Yano M,Izawa T. A pair of floral regulators sets critical day length for Hd3a florigen expression in rice[J]. Nature Genetics,2010,42(7): 635-638. doi: 10.1038/ng.606.
[21] 孔德艳,陈守俊,周立国,高欢, 罗利军, 刘灶长.水稻开花光周期调控相关基因研究进展[J].遗传,2016,38(6): 533-543. doi: 10.16288/j.yczz.15-478.
Kong D Y,Chen S J,Zhou L G,Gao H,Luo L J,Liu Z C.Research progress of photoperiod regulated genes on flowering time in rice[J]. Hereditas,2016,38(6):533-543.
[22] 胡时开,苏岩,叶卫军,郭龙彪.水稻抽穗期遗传与分子调控机理研究进展[J].中国水稻科学,2012,26(3): 373-382.doi:10.3969/j.issn.1001-7216.2012.03.018.
Hu S K,Su Y,Ye W J,Guo L B.Advances in genetic analysis and molecular regulation mechanism of heading date in rice(Oryza sativa L.)[J]. Chinese Journal of Rice Science,2012,26(3):373-382.
[23] Doi K,Izawa T,Fuse T,Yamanouchi U,Kubo T,Shimatani Z,Yano M,Yoshimura A. Ehd1,a B-type response regulator in rice,confers short-day promotion of flowering and controls FT-like gene expression independently of Hd1[J]. Genes & Development,2004,18(8): 926-936. doi: 10.1101/gad.1189604.
[24] Hayama R,Coupland G. The molecular basis of diversity in the photoperiodic flowering responses of Arabidopsis and rice[J]. Plant Physiology,2004,135(2): 677-684. doi: 10.1104/pp.104.042614.
[25] 徐千惠,张大兵,梁婉琪.水稻成花素分子作用机制研究进展[J].上海交通大学学报(农业科学版),2010,28(3): 296-304.doi: 10.3969/j.issn.1671-9964.2010.03.017.
Xu Q H,Zhang D B,Liang W Q.Research on the molecular mechanism of florigen in rice[J]. Journal of Shanghai Jiaotong University(Agricultural Science),2010,28(3): 296-304.