目前,新型除草剂的研发主要依赖于天然除草活性物质[1-2]。在天然源除草剂的研发过程中,以天然除草活性物质为探针发现新靶标已经成为新型除草剂创制的主要途径[3]。但是,至今已经明确的除草作用靶标仅有20多种,且距离最后一种除草作用靶标HPPD被报道已有30多年[4-5]。因此,探究一种新型除草活性物质的除草作用方式具有重要意义[6-7]。
4-羟基-3-甲氧基肉桂酸乙酯是天然除草活性物质4-羟基-3-甲氧基肉桂酸的酯类衍生物之一,因其具有良好的脂溶性与除草活性且易于合成等优点,已经成为待开发的新型除草活性物质之一[8-9]。4-羟基-3-甲氧基肉桂酸乙酯对常见杂草马唐的抑制中浓度(IC50)为129.95 mg/L,对马齿苋芽的IC50为227.05 mg/L,对反枝苋芽的IC50为227.05 mg/L。当用1 000 mg/L的4-羟基-3-甲氧基肉桂酸乙酯茎叶喷施拟南芥24 h后,其叶片表面出现失绿黄化现象[10-13]。
河北农业大学真菌毒素实验室张明月等[10]前期对4-羟基-3-甲氧基肉桂酸乙酯处理后的拟南芥进行了蛋白水平的分析,结果显示1 000 mg/L的4-羟基-3-甲氧基肉桂酸乙酯茎叶喷施后的拟南芥中,共有30个差异倍数大于20的蛋白,其中只有差异蛋白gi|15224205|ref|NP_181831.1|和gi|334183674|ref|NP_001185328.1|表达量上调,因此,这2个蛋白在4-羟基-3-甲氧基肉桂酸乙酯的除草过程中起着重要作用。本试验获得了蛋白gi|15224205|ref|NP_181831.1|和gi|334183674|ref|NP_001185328.1|的相关基因AT2G43030和AT1G66240的T-DNA插入突变体,通过比较突变体株系与野生型株系对4-羟基-3-甲氧基肉桂酸乙酯的敏感程度,确定拟南芥AT2G43030、AT1G66240基因在4-羟基-3-甲氧基肉桂酸乙酯除草过程中的作用,为探索新的除草剂作用方式奠定了基础[14]。
1 材料和方法
1.1 试验材料
拟南芥(Arabidopsis thaliana)哥伦比亚野生型拟南芥(Columbia,Col-0生态型);拟南芥AT2G43030基因的T-DNA插入株系(Columbia,Col-0生态型):SALK_026275、SALK_036415、SALK_027717;拟南芥AT1G66240基因的T-DNA插入株系(Columbia,Col-0生态型):SALK_026221、CS857899、CS856641均由拟南芥信息资源数据库-tair网站购得。
1.2 拟南芥T-DNA插入纯合株系筛选
选取2~3片未抽薹拟南芥植株的莲座叶片,无菌超纯水清洗后放到1.5 mL离心管中,液氮速冻,电钻匀浆,使用 Plant Genomic DNA Kit(TIAN GEN,中国) 试剂盒提取DNA,并用二引物法验证纯合株系。
PCR反应体系为:DNA模板2 μL,2×PCR Mix 10 μL,ddH2O 6 μL,LB与RP引物各1 μL / LP与RP引物各1 μL。PCR反应程序为:95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,42个循环最后72 ℃延伸10 min。
二引物法是利用基因T-DNA插入片段的正向引物(LB)和插入位点两侧的基因序列的特异性正向引物和反向引物(LP和RP)进行PCR扩增,该方法需要2组PCR扩增,一组以LP和RP为引物,另一组以LB和RP为引物。在琼脂糖凝胶电泳检测PCR产物结果图中,野生型拟南芥只有LP和RP扩增出1条目的条带;T-DNA插入杂合株系中,LP和RP、BP和RP共扩增出2条目的条带;T-DNA插入纯和株系只有BP和RP扩增出1条目的条带。本次试验所用突变体株系的T-DNA插入位点及其鉴定所用引物序列见表1。
表1 拟南芥AT2G43030和AT1G66240 基因T-DNA插入株系的插入位点及其引物序列
Tab.1 Insertion sites and their primer sequences of A. thaliana gene AT2G43030 and AT1G66240 T-DNA insertion lines

株系名称Strain name插入位点Insertion site序列(5′-3′) Sequence SALK_026275chr2 17895471LB1: GCGTGGACCGCTTGCTGRP: TGAATTTTGGATACGCTTTCGLP: TGTTGCAAAAGGTAAACCACCSALK_036415chr2 17895423LB1: GCGTGGACCGCTTGCTGLP: CCGAAAGAGGGAAAGATCATCRP: AGTTTCTTCGAAGAAGACGGCSALK_027717chr2 17895423LB1: GCGTGGACCGCTTGCTGRP: TGAATTTTGGATACGCTTTCGLP: TGTTGCAAAAGGTAAACCACCSALK_026221chr1 24687283LB1: GCGTGGACCGCTTGCTGRP: CATGGCCACTCTGAGAACAACLP: TGCCACTTATACTCTCAAACGGCS856641chr1 24687339LB3: TAGCATCTGAATTTCATAACCAATCTCGATACACRP: TGCCACTTATACTCTCAAACGGLP: CAAACACAAGACACCAAACCCCS857899chr1 24687749LB3: TAGCATCTGAATTTCATAACCAATCTCGATACACRP: TTGAGTGTTTGTGGTATTTCTGGLP: CGCGATATCGACAATCTTTTC
1.3 茎叶喷雾法测定不同株系拟南芥对4-羟基-3-甲氧基肉桂酸乙酯的敏感性
药剂配制以丙酮∶(含0.1%吐温80)水=3∶97(V/V)为溶剂,加入化合物4-羟基-3-甲氧基肉桂酸乙酯至终质量浓度为1 000 mg/L(与iTRAQ试验浓度相对应),使用POTTER喷雾塔喷雾处理7种供试拟南芥,使用前用甲醇和水冲洗体系,每盆喷雾量2 mL,之后放回原温室中,24 h后进行性状比对。
1.4 RT-qPCR检测AT2G43030和AT1G66240基因的表达量
按1.3所述茎叶喷雾处理不同株系的拟南芥植株后,分别在15,30,45 min 3个时间段取样,每个处理3个重复,设置空白对照。取样后立即放入液氮中,备用。
将备用样品电钻匀浆,使用UNIQ-10柱式总RNA抽提试剂盒与HiScript Ⅱ Q Select RT Super Mix for qPCR(+gDNA wiper)反转录试剂盒进行RNA的提取和反转录,获得样品的cDNA(具体操作见说明书)。无酶水稀释cDNA浓度至300 ng/μL,使用Trans Start Green qPCR Super Mix试剂盒测定基因的表达水平,本次试验选用持家基因UBQ作为内参基因。
表2 拟南芥AT2G43030和AT1G66240 基因的RT-qPCR引物序列
Tab.2 RT-qPCR primer sequence of AT2G43030 and AT1G66240 genes in A. thaliana
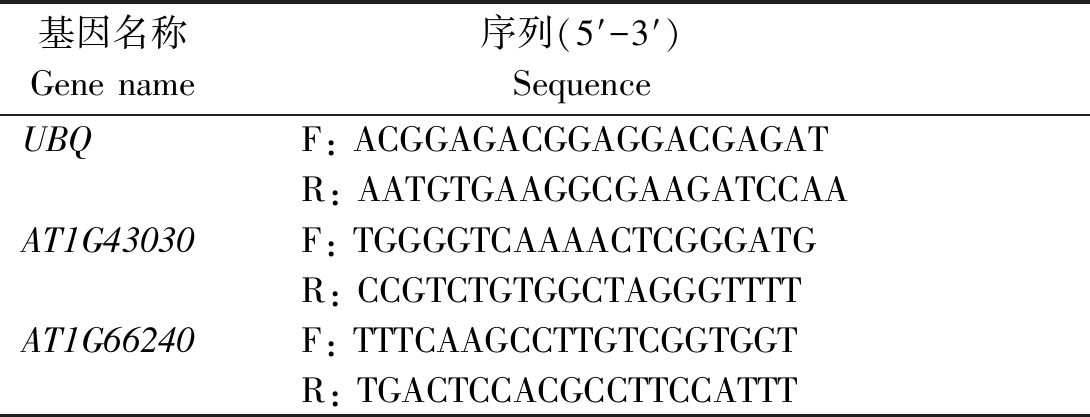
基因名称Gene name序列(5′-3′) Sequence UBQF: ACGGAGACGGAGGACGAGATR: AATGTGAAGGCGAAGATCCAAAT1G43030F: TGGGGTCAAAACTCGGGATGR: CCGTCTGTGGCTAGGGTTTTAT1G66240F: TTTCAAGCCTTGTCGGTGGTR: TGACTCCACGCCTTCCATTT
RT-qPCR反应体系为:cDNA模板1 μL,2×Trans Star®Tip Green qPCR Super Mix 7 μL,ddH2O 1 μL,正向引物(F)和反向引物(R)各0.5 μL。RT-qPCR反应程序:95 ℃预变性30 s;95 ℃变性5 s,55 ℃退火30 s,42个循环。根据NCBI中获得的差异基因CDS序列设计RT-qPCR所需引物,引物序列见表2。
2 结果与分析
2.1 拟南芥AT2G43030和AT1G66240基因的T-DNA插入纯合株系的验证结果
使用二引物法验证6种T-DNA插入株系的T3植株是否为纯合株系,其验证结果如图1所示。在琼脂糖凝胶电泳检测图中,凝胶孔1,3,5,7,9,11表示插入位点两侧的基因序列的特异性引物LP和RP没有PCR扩增产物;凝胶孔2,4,6,8,10,12表示插入片段的正向引物LB和插入位点右侧序列的反向引物RP有PCR扩增产物且大小在400~800 bp,符合插入片段的大小范围。上述结果说明了6种T-DNA插入株系的T3均为纯合株系。
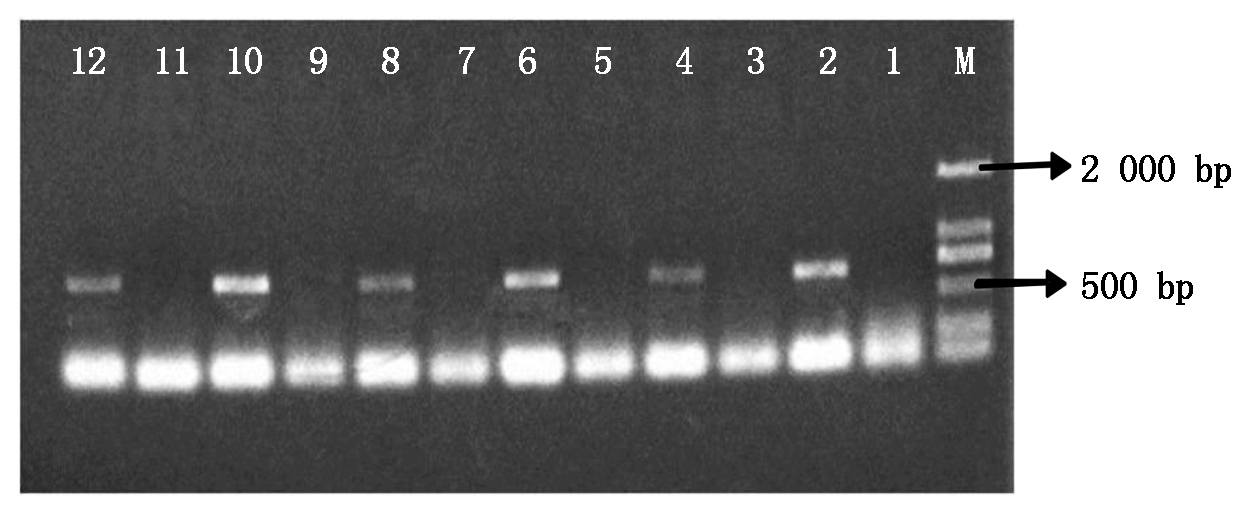
1,2.SALK_026275的纯合株系验证结果;3,4.SALK_036415的纯合株系验证结果;5,6.SALK_027717的纯合株系验证结果;7,8.SALK_026221的纯合株系验证结果;9,10.CS857899的纯合株系验证结果;11,12.CS856641的纯合株系验证结果。凝胶孔下方条带均为引物二聚体。
1, 2. Verification results of homozygous lines of SALK_026275; 3, 4. Verification results of homozygous lines of SALK_036415; 5, 6.Verification results of homozygous lines of SALK_027717; 7, 8.Verification results of homozygous lines of SALK_026221; 9, 10.Verification results of homozygous strains of CS857899; 11, 12.Verification results of homozygous lines of CS856641. The bands below the gel holes were all primers dimers.
图1 6种拟南芥T-DNA插入纯合株系的验证
Fig.1 Validation of six A. thaliana T-DNA insertion homozygous lines
2.2 T-DNA插入纯合株系内基因AT2G43030和AT1G66240表达量测定结果
利用q-PCR测定拟南芥AT2G43030和 AT1G66240基因的T-DNA插入纯合株系中相应基因的表达水平。如图2所示:在AT2G43030的表达水平测定中当野生型拟南芥(WT)表达量为1.00± 0.06时,SALK_026275株系的相对表达量为0.66±0.08,SALK_036415株系的表达量为0.34±0.07,SALK_027717株系的相对表达量为0.34±0.02;在AT1G66240的表达水平测定中当野生型拟南芥(WT)相对表达量为1.00±0.07时,SALK_026221株系的相对表达量为0.30±0.03,CS857899株系的相对表达量为0.57±0.10,CS856641株系的相对表达量为0.66±0.08。结果表明:与野生型拟南芥相比,6种T-DNA插入纯合株系相对应的基因表达量均降低,说明基因上的T-DNA插入会引起基因的失活且6种T-DNA插入纯合株系均可用于下一步试验中对4-羟基-3-甲氧基肉桂酸乙酯敏感性的测定。
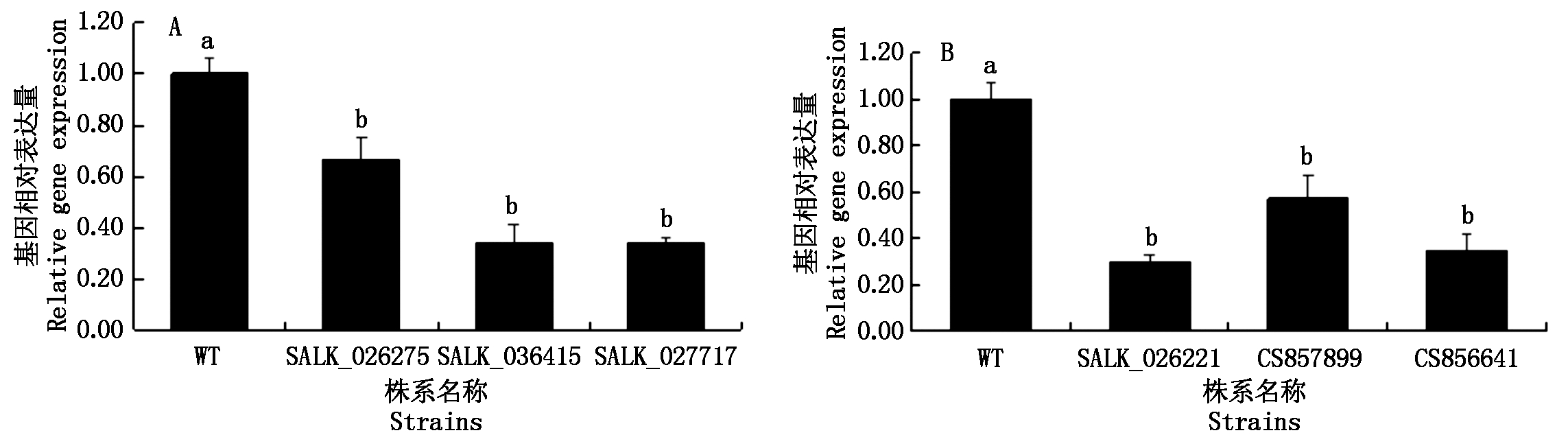
图中小写字母a、b表示P=0.05水平差异显著。
The lowercase letters in the figure mean significant difference at 0.05 level.
图2 AT2G43030和AT1G66240的T-DNA插入纯合株系基因相对表达量
Fig.2 Relative expression levels of T-DNA inserted homozygous lines of AT2G43030 and AT1G66240

Ⅰ.拟南芥的整株受损情况;Ⅱ.拟南芥的第1对真叶受损情况;Ⅲ.拟南芥的莲座叶受损情况;Ⅳ.拟南芥的茎生叶受损情况。
Ⅰ. Damage to the whole plant of A. thaliana; Ⅱ. Damage to the first pair of true leaves of A. thaliana; Ⅲ. Damage to the rosettes of A. thaliana; Ⅳ. Damage to the stems and leaves of A. thaliana.
图3 不同株系的拟南芥对4-羟基-3-甲氧基肉桂酸乙酯的敏感性
Fig.3 Sensitivity of different strains of A. thaliana to 4-hydroxy-3-methoxy cinnamic acid ethyl
2.3 不同株系拟南芥对4-羟基-3-甲氧基肉桂酸乙酯的敏感性
1 000 mg/L的4-羟基-3-甲氧基肉桂酸乙酯茎叶喷雾处理拟南芥24 h后,其均出现黄化、皱缩、萎蔫失水等症状,但不同株系的受损程度不同。选取相同生长时间、不同株系的同一部位的叶片,在显微镜下观察其症状。
如图3所示,整株拟南芥(图3-Ⅰ)中,野生型拟南芥(WT)症状最轻仅出现叶片黄化、顶端干枯现象;SALK_026275、SALK_036415、SALK_027717株系拟南芥(A1、A2、A3)和SALK_026221、CS857899、CS856641株系拟南芥(B1、B2、B3)均出现顶端干枯、叶片皱缩失水且出现水渍状溃烂等现象,其中A1症状较轻,B3症状最严重,其原因可能与其插入位点有关。
拟南芥第1对真叶(图3-Ⅱ)中,WT仅出现皱缩卷曲现象;A1、A2叶尖部分全部干枯,叶片表面失水皱缩,A3的表皮毛明显增多且出现溃烂现象;B1、B2、B3叶表面严重皱缩失水、且出现黄花萎蔫现象。
在拟南芥的莲座叶(图3-Ⅲ)中,WT受损现象较轻,出现轻微黄化现象;A1、A2叶片卷曲,A3叶片出现严重皱缩失水现象;B1、B2、B3叶片失水皱缩,叶面积变小,但并未出现黄化现象。
在拟南芥的茎生叶(图3-Ⅳ)中, WT叶柄部位黄化干枯,但叶片仍有一定生命力;A1、A2、A3均黄化、皱缩变形,且表皮毛大量增多;B1、B2、B3卷曲黄化、失水皱缩,表皮毛大量增多。综合以上现象可知,相比野生型拟南芥(WT),AT2G43030与AT1G66240的T-DNA插入株系(A、B)对4-羟基-3-甲氧基肉桂酸乙酯更为敏感。
2.4 4-羟基-3-甲氧基肉桂酸乙酯处理不同株系的拟南芥后AT2G43030和AT1G66240基因的表达量变化
利用q-PCR测定不同株系的拟南芥体内基因AT2G43030和基因AT1G66240的相对表达量,如图4所示。使用1 000mg/L的4-羟基-3-甲氧基肉桂酸乙酯茎叶喷雾处理不同株系的拟南芥,15,30,45 min后分别取样测定基因AT2G43030和基因AT1G66240的相对表达量。野生型拟南芥体内基因AT2G43030和基因AT1G66240的表达量均表现不同幅度的上调,而6种T-DNA插入纯合株系相关基因的表达量均未发生变化。综合2.3中不同株系的拟南芥叶片受损症状,可以确定拟南芥T-DNA插入株系对4-羟基-3-甲氧基肉桂酸乙酯更为敏感是由于基因AT2G43030和基因AT1G66240的表达量降低引起的,所以拟南芥基因AT2G43030和基因AT1G66240参与拟南芥对4-羟基-3-甲氧基肉桂酸乙酯的抗逆反应。
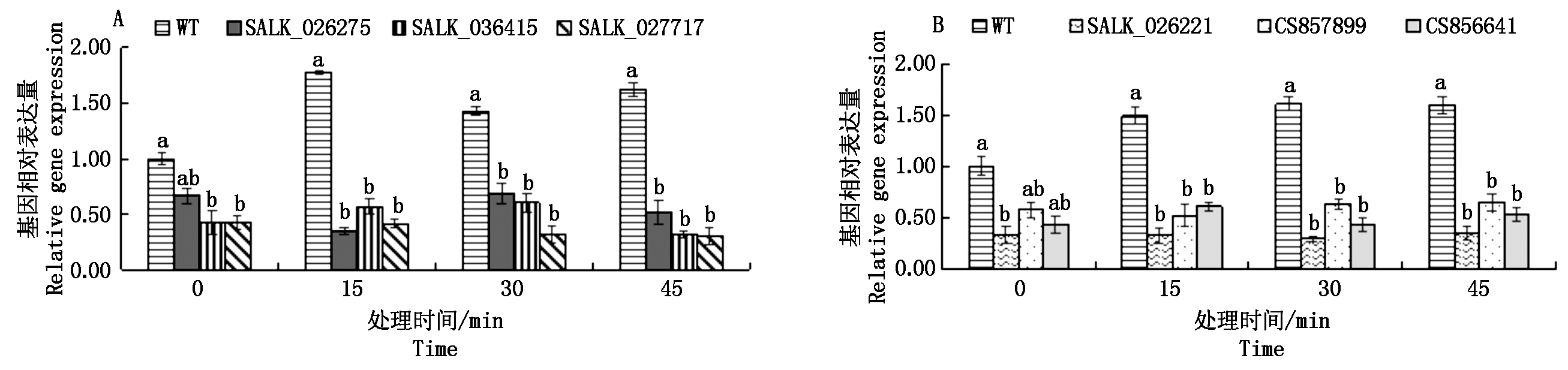
图4 茎叶喷雾后不同株系的拟南芥在不同时间点基因AT2G43030和基因AT1G66240的表达水平比较
Fig.4 The comparison of expression levels of AT2G43030 and AT1G66240 of A. thaliana in different strains at different time points
3 讨论与结论
本研究中,茎叶喷施4-羟基-3-甲氧基肉桂酸乙酯前后基因AT2G43030和AT1G66240在T-DNA插入株系中的表达水平没有发生变化,在野生型株系中这2个基因的表达量均上调;观察茎叶喷施4-羟基-3-甲氧基肉桂酸乙酯24 h后不同株系的叶片损伤程度,与野生型株系相比T-DNA插入株系受损更为严重。因此,可以确定AT2G43030和AT1G66240 2个基因能够抵御4-羟基-3-甲氧基肉桂酸乙酯对植株造成的伤害。同时,基因AT2G43030和AT1G66240的上调可能是为了弥补拟南芥某些受损基因的功能缺失。基因AT2G43030编码50S亚单位质体核糖体蛋白,主要存在于叶绿体包膜、叶绿体基质中,与细胞的增殖有关 [15];AT1G66240编码抗氧化剂同系物1蛋白,该蛋白主要存在于拟南芥的细胞膜上,参与拟南芥的铜离子运输过程 [16],说明4-羟基-3-甲氧基肉桂酸乙酯的除草作用机制与植株的光合作用和细胞膜功能有关。
除草活性物质的作用方式及作用位点研究一直是开发新型除草剂的难点,而近些年来随着蛋白组学、基因组学等技术的进步,以生物信息为指导、从宏观到微观的天然产物的作用靶标发现模式逐渐被人们所关注,该模式极大地推进了新型除草剂的研究[17-18]。唐奕教授课题组等运用以抗性基因为导向的基因组挖掘技术成功发现了一种新型天然产物除草剂aspterric acid(AA),同时,成功构建了具有AA耐受性的转基因作物,为该类型除草剂的开发提供了可能性[19];Wallace 等[20]以DNA回旋酶为药物靶标,靶向筛选了杀菌剂氟喹诺酮环丙沙星1,后又将其应用于除草剂,靶向合成了更具选择性的除草活性衍生物;Wright等[21]利用RNA-sep技术测定了除草剂甲氧咪草烟对棘球藻基因表达水平的影响,为咪唑啉酮类除草剂的进一步研究奠定了基础。本研究以前期蛋白组学的结果为依据,从基因水平解释4-羟基-3-甲氧基肉桂酸乙酯的除草作用机制,该研究方式为精确阐释天然活性产物的作用方式提供了新的策略,结合本研究中的天然活性产物及其作用方式研究,可为后续4-羟基-3-甲氧基肉桂酸类天然产物除草剂的发掘提供新的思路与启示。
[1] Mouncey N J, Otani H, Udwary D, Yoshikuni Y. New voyages to explore the natural product galaxy[J]. Journal of Industrial Microbiology & Biotechnology, 2019, 46(3-4): 273-279. doi:10.1007/s10295-018-02122-w.
[2] Zhou J, Liu K, Xin F X, Ma J F, Xu N, Zhang W M, Fang Y, Jiang M, Dong W L. Recent insights into the microbial catabolism of aryloxyphenoxy-propionate herbicides: microbial resources, metabolic pathways and catabolic enzymes[J]. World Journal of Microbiology and Biotechnology, 2018, 34(8): 117. doi:10.1007/s11274-018-2503-y.
[3] 陈世国, 强胜. 生物除草剂研究与开发的现状及未来的发展趋势[J]. 中国生物防治学报, 2015, 31(5): 770-779.doi:10.16409/j.cnki.2095-039x.2015.05.017.
Chen S G, Qiang S. The status and future directions of bioherbicide study and development[J]. Chinese Journal of Biological Control, 2015, 31(5): 770-779.
[4] Lee D L, Knudsen C G, Michaely W J, Chin H L, Nguyen N H, Carter C G, Cromartie T H, Lake B H, Shribbs J M, Fraser T. The structure activity relationships of the triketone class of HPPD herbicides[J]. Pest Management Science, 1998, 54(4): 377-384. doi:10.1002/(SICI)1096-9063(199812)54:4<377∷AID-PS827>3.0.CO;2-0.
[5] Duke S O. Why have no new herbicide modes of action appeared in recent years?[J]. Pest Management Science, 2012, 68(4): 505-512. doi:10.1002/ps.2333.
[6] Redlick C, Syrovy L D, Duddu H S N, Benaragama D, Johnson E N,Willenborg C J,Shirtiffe S J. Developing an integrated weed management system for herbicide-resistant weeds using lentil(Lens culinaris) as a model crop[J]. Weed Science, 2017, 65(6): 778-786. doi:10.1017/wsc.2017.47.
[7] Fleet B, Malone J, Preston C, Gill G. Target-site point mutation conferring resistance to trifluralin in rigid ryegrass(Lolium rigidum)[J]. Weed Science, 2018, 66(2): 246-253. doi:10.1017/wsc.2017.67.
[8] Fu Y B, Mu Y, Lei H, Wang P,Li X, Leng Q, Han L, Qu X D,Wang Z Y,Huang X S. Design, synthesis and evaluation of novel tacrine-ferulic acid hybrids as multifunctional drug candidates against alzheimer′s disease[J]. Molecules, 2016, 21(10): 1338-1348. doi:10.3390/molecules21101338.
[9] Totani N, Tateishi S, Takimoto T, Shinohara R,Sasaki H. Ferulic acid esters and weight-loss promoting effects in rats[J]. Journal of Oleo Science, 2012, 61(6): 331-336.doi:10.5650/jos.61.331.
[10] 张明月, 刘策, 杨娟, 乔欣, 张利辉, 董金皋. 4-羟基-3-甲氧基肉桂酸乙酯的生物活性及其除草作用机制[J]. 植物保护学报, 2018, 45(3): 543-551.doi:10.13802/j.cnki.zwbhxb.2018.2016210.
Zhang M Y, Liu C, Yang J, Qiao X, Zhang L H, Dong J G.The biological activity of 4-hydroxy-3-methoxycinnamate acid ethyl ester and its herbicidal mechanism[J]. Journal of Plant Protection, 2018, 45(3): 543-551.
[11] 张利辉, 张洋, 司贺龙,董金皋,张金林. 瓜果腐霉毒素除草活性物质的初步分离[J]. 河北农业大学学报, 2008,31(5): 71-74. doi:10.3969/j.issn.1000-1573.2008.05.016.
Zhang L H, Zhang Y, Si H L, Dong J G, Zhang J L. Primary isolation of herbicidal substances in crude toxin produced by Pythium aphanider-matum[J]. Journal of Agricultural University of Hebei, 2008,31(5):71-74.
[12] 杨鹏,杨娟,王伟,张明月,张利辉,董金皋.阿魏酸衍生物的合成及其除草活性测定[J]. 植物保护学报, 2015,42(6): 1050-1056.doi:10.13802/j.cnki.zwbhxb.2015.06.029.
Yang P, Yang J, Wang W, Zhang M Y, Zhang L H,Dong J G. Synthesis and herbicidal activity of the derivatives of ferulis acid[J]. Journal of Plant Protection, 2015,42(6): 1050-1056.
[13] Zhang L H, Zhang J L, Liu Y C,Cao Z Y,Han J M,Yang J,Dong J G. Isolation and structural speculation of herbicide-active compounds from the metabolites of Pythium aphanidermatum[J]. Journal of Integrative Agriculture, 2013, 12(6): 1026-1032.doi:10.1016/S2095-3119(13)60480-3.
[14] Zhang M Y, Liu C, Yang J, Yang P, Zhang L H, Dong J G. Analysis of the herbicidal mechanism of 4-hydroxy-3-methoxy cinnamic acid ethyl ester using iTRAQ and Real-time PCR[J]. Journal of Proteomics, 2017, 159: 47-53. doi:10.1016/j.jprot.2017.02.014.
[15] Schmid M, Davison T S, Henz S R, Pape U J, Demar M, Vingron M, Schölkopf B, Weigel D, Lohmann J U. A gene expression map of Arabidopsis thaliana development[J]. Nature Genetics, 2005, 37(5): 501-506.doi:10.1038/ng1543.
[16] Rutschow H, Ytterberg A J, Friso G F, Nilsson R, Wijk K J V. Quantitative proteomics of a chloroplast SRP54 sorting mutant and its genetic interactions with CLPC1 in Arabidopsis[J]. Plant physiology, 2008, 148(1): 156-175.doi:10.1104/pp.108.124545.
[17] Li M, Wang Q Q, Song X F, Guo J J, Wu J R, Wu R N. iTRAQ-based proteomic analysis of responses of Lactobacillus plantarum fs5-5 to salt tolerance[J]. Annals of Microbiology, 2019, 69(4): 377-394.doi:10.1007/s13213-018-1425-0.
[18] Pan L, Zhang J, Wang J Z, Qin Y, Bai L Y, Dong L Y. iTRAQ-based quantitative proteomic analysis reveals proteomic changes in three fenoxaprop-P-ethyl-resistant Beckmannia syzigachne biotypes with differing ACCase mutations[J]. Journal of Proteomics, 2017, 160: 47-54.doi:10.1016/j.jprot.2017.03.018.
[19] Yan Y, Liu Q K, Zang X, Bat-Erdene U, Nguyen C, Gan J H, Zhou J H, Jacobsen S E, Tang Y. Resistance-gene-directed discovery of a natural-product herbicide with a new mode of action[J]. Nature, 2018, 559: 415-418.doi:10.1038/s41586-018-0319-4.
[20] Wallace M D, Waraich N F, Debowski A W, Corrol M G, Maxwell A, Mylne J S, Stubbs K A. Developing ciprofloxacin analogues against plant DNA gyrase: a novel herbicide mode of action[J]. Chemical communications, 2018, 54(15): 1869-1872. doi:10.1039/C7CC09518J.
[21] Wright A A, Sasidharan R, Koski L, Rodriguez-carres M, Peterson D G, Nandula V K, Ray J D, Bond J A, Shaw D R. Transcriptomic changes in Echinochloa colona in response to treatment with the herbicide imazamox[J]. Planta, 2018, 247(2): 369-379. doi:10.1007/s00425-017-2784-7.