随着人们生活水平的提高,羊肉因为口感极佳,低胆固醇且营养丰富,需求量越来越大,对质量要求也逐渐升高。肌内脂肪(Intramuscular fat,IMF)是山羊肉质的重要影响因素,与肉的嫩度、风味、多汁性等性状紧密相关[1-3]。羊肉IMF的沉积受多种因素影响,其中研究基因调控机理是改善山羊肌内脂肪沉积的重要途径之一[4]。
肉毒碱棕榈酰基转移酶(Carnitine palmitoyltransferase, CPT) 有CPT1和CPT2之分。其中,CPT1是脂肪分解代谢的关键酶,它位于线粒体外膜,催化长链脂肪酸转移到肉毒碱上,继而从胞浆进到线粒体内,并在线粒体内膜上被CPT2催化进行β氧化[5-9],因此,CPT1也是脂肪酸β氧化过程中的限速酶。在哺乳动物中,CPT1一般存在3种亚型基因(CPT1A、CPT1B、CPT1C),编码于不同的染色体上[10]。在真核生物的脂肪酸代谢过程中,CPT1A是长链脂肪酸由胞浆转移到线粒体氧化供能的关键限速酶。Robitaille等[11]发现CPT1与人体脂肪沉积有密切联系。Morash等[12]发现CPT1影响虹鳟鱼体内肌肉和肝脏中的脂肪分布。Olpin等[13]发现CPT1表达水平与人体脂含量相关。除骨骼肌细胞和棕色脂肪细胞外,CPT1A在全身各组织中广泛表达,且高表达于肝脏[14-15],而肝脏是脂肪代谢的重要场所。这些研究说明,CPT1对机体脂质代谢具有重要作用。CPT1A和 CPT1B的基因序列具有高相似性,然而两者在动力学上的差异决定了其功能与组织分布不同[16]。CPT1A比CPT1B对肉毒碱的亲和力更高,且对CPT抑制剂丙二酰CoA的敏感性更低,这种特性受机体调节[10,17-18]。因此,CPT1A在更高水平上调节体内脂肪酸的氧化,并对生命机体的正常活动发挥着重要的作用[19]。
目前,山羊CPT1A仅见于预测序列,于宝莉等[17]系统分析了山羊和绵羊CPT1A组织表达,但未揭示CPT1A基因与山羊IMF含量的关系。此外,目前还没有对山羊CPT1A基因克隆表达模式的相关研究。因此,本研究以我国著名的肉用山羊新品种-简州大耳羊为研究对象,克隆CPT1A基因CDS区序列,并对序列进行生物信息学分析,阐明其在不同组织中的表达情况并构建组织表达谱,同时检测CPT1A在山羊肌内前体脂肪细胞分化过程中的表达模式,分析CPT1A背最长肌、股二头肌、臂三头肌中的表达水平与IMF沉积作用机理。
1 材料和方法
1.1 试验材料
1.1.1 主要试剂 I-5TM2×High-Fidelity Master Mix、pclone007 blunt simple载体购自MCLAB(美国),DH5α感受态细胞、gDNAse购自天根生化科技有限公司(中国北京),TRIzol、RevertAid First Strand cDNA Synthesis Kit购自Thermo公司(美国),Gel Extraction Kit购自QIAGEN公司(德国),QuantiFastTMSYBR Green PCR Kit、LA Taq购自TaKaRa公司(中国大连),质粒提取试剂盒购自Axygen公司(美国),乙醇、氯仿等试剂均为国产生化试剂。
1.1.2 试验动物及取材 选取7只一周岁的健康简州大耳羊。清晨空腹屠宰后,迅速采集心、肝、脾、肺、肾、背最长肌、股二头肌、臂三头肌、皮下脂肪和腹间脂肪组织样品,DEPC水清洗后用锡箔纸包裹,迅速装入冷冻管中置于液氮保存,利用TRIzol法提取组织总RNA,根据Thermo反转录试剂盒说明书进行cDNA合成。
1.2 试验方法
1.2.1 山羊CPT1A基因的克隆 根据GenBank上牛(NM_001304989.1)、山羊(XM_018043311.1)CPT1A基因的保守序列,利用Primer premier 5.0设计克隆引物(表1)。PCR反应体系为:肝cDNA 1 μL,上、下游引物各1 μL,I-5TM2×High-Fidelity Master Mix 12.5 μL,加水补至25 μL。PCR反应条件:98 ℃ 2 min;98 ℃ 10 s,59 ℃ 10 s,72 ℃ 30 s,35个循环;72 ℃ 4 min。PCR反应结束后,将25 μL扩增产物经1%琼脂糖凝胶电泳检测扩增产物,将目的片段切胶回收,用回收产物连接擎科pclone007载体后转化DH5α感受态细胞,挑取阳性菌落经菌液PCR鉴定,提取质粒送成都擎科伟业梓熙公司测序。
1.2.2 测序分析 利用EXpASy在线工具对CPT1A蛋白质理化性质进行分析;利用SignalP 4.1 Server对氨基信号肽进行分析;利用BioXM 2.6对山羊、绵羊(NM_001009414.1)、牛(NM_001304989.1)、人(NM_001031847.2)、小鼠(NM_013495.2)、猪(NM_001129805.1)氨基酸进行同源性比较;利用TMHMM预测跨膜域结构;利用GOR IV在线软件预测蛋白质二级结构;并利用PHYRE2在线工具对氨基酸三级结构进行预测比对;利用LocTree3在线工具对蛋白进行亚细胞定位;利用ScanProsite在线工具分析蛋白结构域;利用STRING交互式数据库分析蛋白互作;利用Mega 5.05软件进行CPT1A基因物种进化树分析。
1.2.3 山羊前体脂肪细胞的培养以及RNA提取 选择3只7日龄的羊羔作为试验动物,根据李倩等[20]的方法进行山羊前体脂肪细胞的提取以及培养,在F3细胞长至80%融合时,在培养基中加入100 μmol/L油酸诱导细胞进行分化。分别收集分化0,1,2,3,4,5,6,9 d的细胞。利用TRIzol法提取细胞总RNA,用Thermo反转录试剂盒得到cDNA。
1.2.4 实时定量PCR检测组织和细胞分化时序表达 根据获得的山羊CPT1A基因(MH345735)序列为模板,使用Primer premier 5.0软件设计目的基因的荧光特异性引物。设计的定量引物先经过PCR扩增,通过琼脂糖凝胶电泳验证其特异性。利用实时荧光定量PCR仪测定mRNA表达水平。RT-qPCR反应体系:上、下游引物各 1 μL,cDNA 1 μL,SYBR 10 μL,水 7 μL。定量程序:95 ℃ 3 min;95 ℃ 10 s,60 ℃ 10 s,72 ℃ 15 s,40个循环。溶解曲线95 ℃ 10 s,然后以0.5 ℃/5 s的速度从65 ℃ 升到95 ℃ 。每个品种设3个生物学重复,每个待测样本设3个技术重复。根据Bonnet等[21]、许晴等[22]的内参基因筛选结果选择泛表达转录子(UXT)作为试验的内参基因。
1.2.5 数据分析 试验数据结果用“平均值±标准差”表示。定量数据采用2-ΔΔCt法进行归一化处理。通过SPSS 22.0软件中显著性对各组织和前体脂肪细胞间的mRNA表达水平进行显著性分析,利用Duncan法进行多重比较。采用双尾检验对IMF含量与CPT1A基因表达量进行相关性分析,计算皮尔逊相关系数。
表1 基因引物序列
Tab.1 Primer for cloning and quantitative Real-time PCR(qRCR)
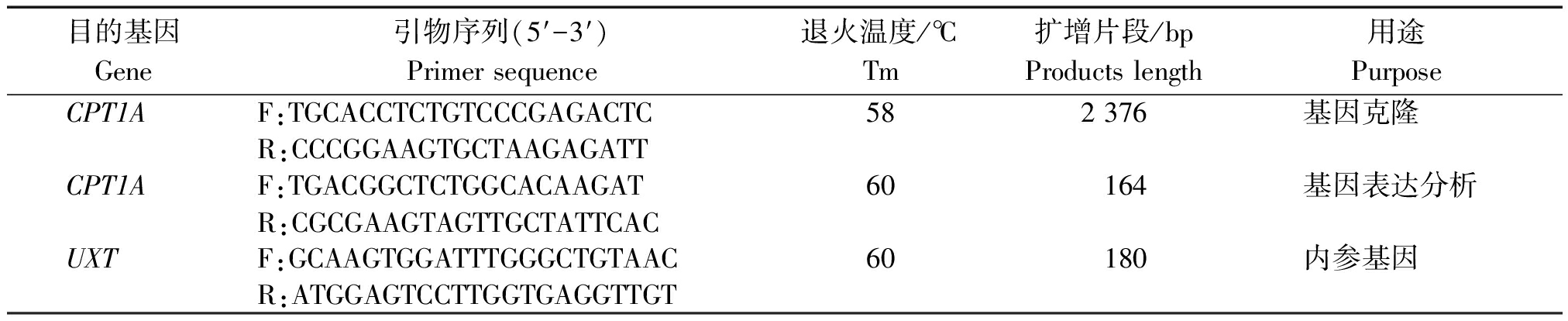
目的基因Gene引物序列(5′-3′)Primer sequence退火温度/℃Tm扩增片段/bpProducts length用途PurposeCPT1AF:TGCACCTCTGTCCCGAGACTC582 376基因克隆R:CCCGGAAGTGCTAAGAGATTCPT1AF:TGACGGCTCTGGCACAAGAT60164基因表达分析R:CGCGAAGTAGTTGCTATTCACUXTF:GCAAGTGGATTTGGGCTGTAAC60180内参基因R:ATGGAGTCCTTGGTGAGGTTGT
注: F.正义链引物; R.反义链引物; UXT.泛表达转录子基因。
Note:F.Sense primer; R.Antisense primer; UXT.Ubiquitously-expressed transcript gene.
2 结果与分析
2.1 山羊CPT1A基因的克隆及序列分析
以简州大耳羊肝组织cDNA为模板通过PCR得到的山羊CPT1A基因2 380 bp,其中CDS区全长2 319 bp,5′UTR 38 bp和3′UTR 23 bp序列,编码氨基酸773个,获得山羊基因登录号为MH345735。
2.2 山羊CPT1A基因生物信息学分析
山羊CPT1A蛋白分子式为C3991H6153N1067O1125S35,分子质量为88.204 33 ku,理论等电点为8.82。CPT1A蛋白含量最高的是亮氨酸和丝氨酸,不稳定系数为34.97,为稳定型蛋白。脂溶系数为81.50,总平均亲水性-0.253,为亲水性蛋白。山羊CPT1A蛋白具有2个跨膜结构区域,为Trp62~Lle84、Val104~Leu126,没有信号肽结构。蛋白质功能域预测显示,Leu171~Tyr186 和Arg451~Ala478存在2个保守性结构域。CPT1A蛋白三级结构预测显示, 氨基酸26.26%可能形成α-螺旋,26.13%可能形成 β-折叠,47.61%可能形成无规则卷曲(图1)。为了研究山羊CPT1A基因的进化过程,本试验对山羊CPT1A基因与绵羊(NM_001009414.1)、牛(NM_001304989.2)、猪(NM_001129805.1)、狗(NM_001286860.1)、人(NM_001031847.2)、小鼠(NM_013495.2)7种动物进行了核苷酸和氨基酸同源性分析。结果显示,核苷酸同源性分别是99%,97%,81%,81%,81%,81%,均大于80%;氨基酸序列同源性分别为99.0%,98.0%,90.0%,90.0%,89.0%和86.0%(图2)。蛋白质结构域预测结果显示,在第171-186位,451-478位氨基酸残基处各有一段CPT家族保守区。利用亚细胞定位软件分析发现CPT1A蛋白主要在线粒体外膜上发挥生物功能。运用STRING数据库搜索CPT1A蛋白潜在互作蛋白,显示该蛋白可能与长链脂酰辅酶A合成酶家族(ACSLs)、长链脂肪酸-辅酶A连接酶家族(ACSBGs)、CPT2以及线粒体肉毒碱/酰基肉碱载体蛋白(SCL25A20)存在相互作用(图3)。同时采用Mega 5.05软件构建系统进化树,结果如图4,绵羊与山羊CPT1A基因亲缘度最高,依次是牛、猪、人,而与小鼠的亲缘关系最低。CPT1A蛋白在山羊、绵羊、牛、人、猪等物种间具有较高的相似度。
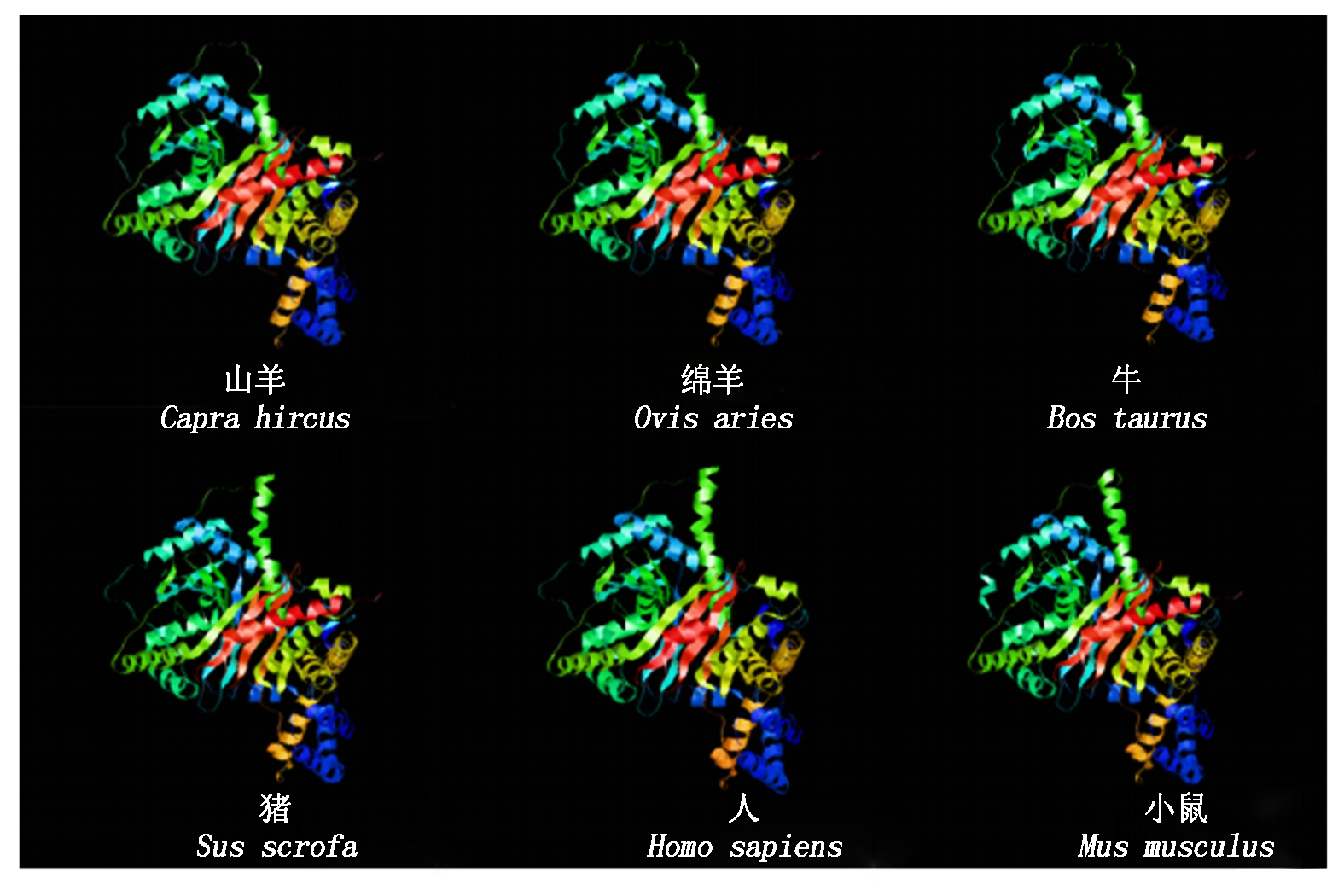
图1 不同物种间CPT1A蛋白三级结构对比
Fig.1 Structure comparison of CPT1A protein among various species

图2 简州大耳羊与绵羊、牛、猪和人CPT1A氨基酸序列同源性比对
Fig.2 Comparison of the CPT1A amino acid sequences among Capra hircus(Jianzhou Big-Eared goat), Ovis aries, Bos taurus, Sus scrofa, Homo sapiens
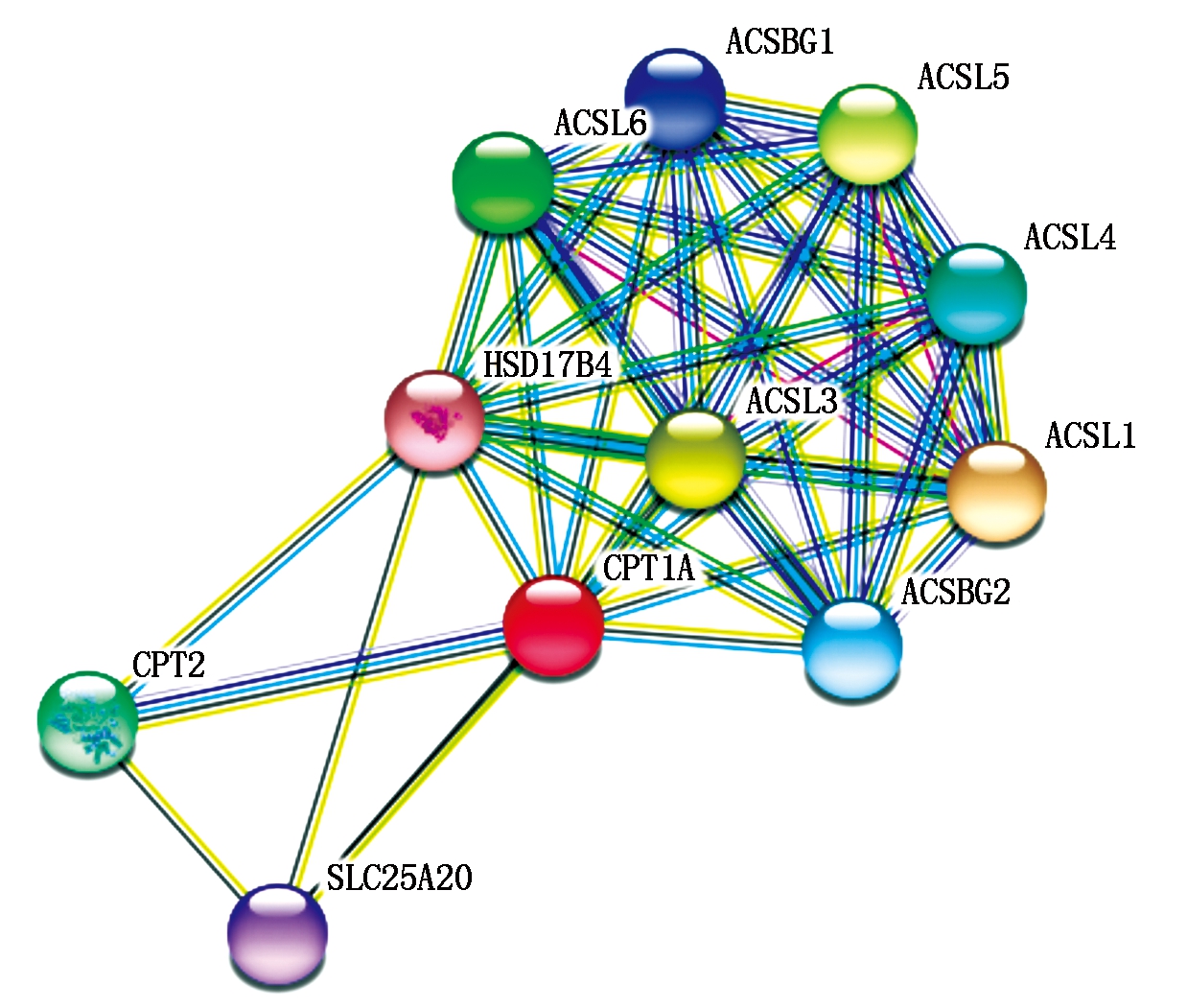
ACSL1.长链脂酰辅酶A连接酶1;ACSL3.长链脂酰辅酶A连接酶3;ACSL4.长链脂酰辅酶A连接酶4;ACSL5.长链脂酰辅酶A连接酶5;ACSL6.长链脂酰辅酶A连接酶6;ACSBG1.长链脂肪酸-辅酶A合成酶1;ACSBG2.长链脂肪酸-辅酶A合成酶2;SLC25A20.线粒体肉毒碱/酰基肉碱载体蛋白;CPT2.肉碱棕榈酸转移酶2;HSD17B4.过氧化物酶体多功能酶2型。
ACSL1.Long-chain-fatty-acid-CoA ligase 1;ACSL3.Long-chain-fatty-acid-CoA ligase 3;ACSL4.Long-chain-fatty-acid-CoA ligase 4;ACSL5.Long-chain-fatty-acid-CoA ligase 5;ACSL6.Long-chain-fatty-acid-CoA ligase 6;ACSBG1.Acyl-CoA synthetase bubblegum family member 1;ACSBG2.Acyl-CoA synthetase bubblegum family member 2;SLC25A20.Carnitine-acylcarnitine translocase;CPT2.Carnitine palmityl transferase 2;HSD17B4.Peroxisomal multifunctional enzyme type 2.
图3 山羊CPT1A蛋白相作的蛋白预测
Fig.3 Prediction of proteins interacting with goat CPT1A protein
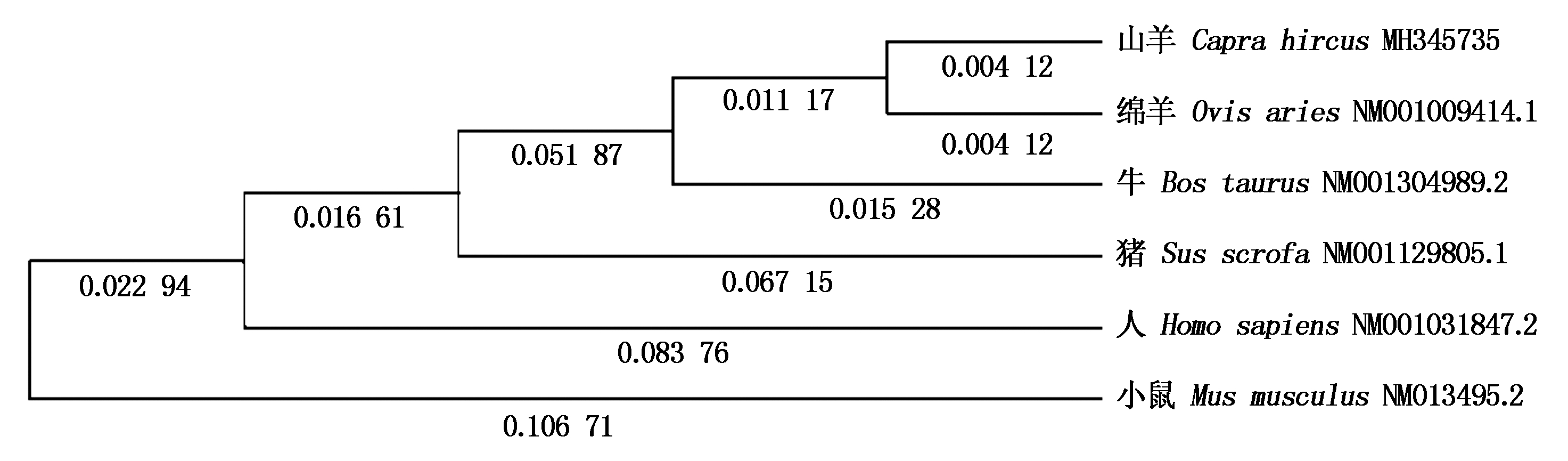
图4 CPT1A氨基酸系统进化树分析
Fig.4 Phylogenetic tree constructed based on CPT1A amino acid
2.3 山羊CPT1A基因组织定量分析
以UXT为内参对照,RT-qPCR检测CPT1A在山羊不同组织中均有表达,mRNA表达水平具有显著差异。CPT1A在肝脏中表达量最高,肾脏次之,两者都极显著高于其他组织(P<0.01),而在其他组织中表达量差异不显著(图5)。
2.4 山羊CPT1A基因在肌内前体脂肪细胞时序表达
以UXT为内参,0 d的表达水平为对照,研究CPT1A基因在山羊肌内前体脂肪细胞分化过程中的表达情况。结果显示(图6),CPT1A基因表达水平在诱导分化0~5 d逐渐升高并在第5天达到最高(P<0.01),随后相对表达量呈逐渐下降趋势。
2.5 山羊CPT1A mRNA基因与IMF相关性
由俞雨阳等[23]测定的IMF数据进行分析,简州大耳羊3种肌肉组织中IMF含量差异不显著,背最长肌和股二头肌的IMF含量略微高于臂三头肌。CPT1A表达量与IMF含量相关性分析结果显示,3种肌肉组织中CPT1A表达量都与IMF沉积呈正相关,股二头肌中CPT1A表达量与IMF沉积呈显著相关(P<0.05),其中背最长肌和臂三头肌中CPT1A表达量与IMF沉积呈极显著相关(P<0.01)(表2)。
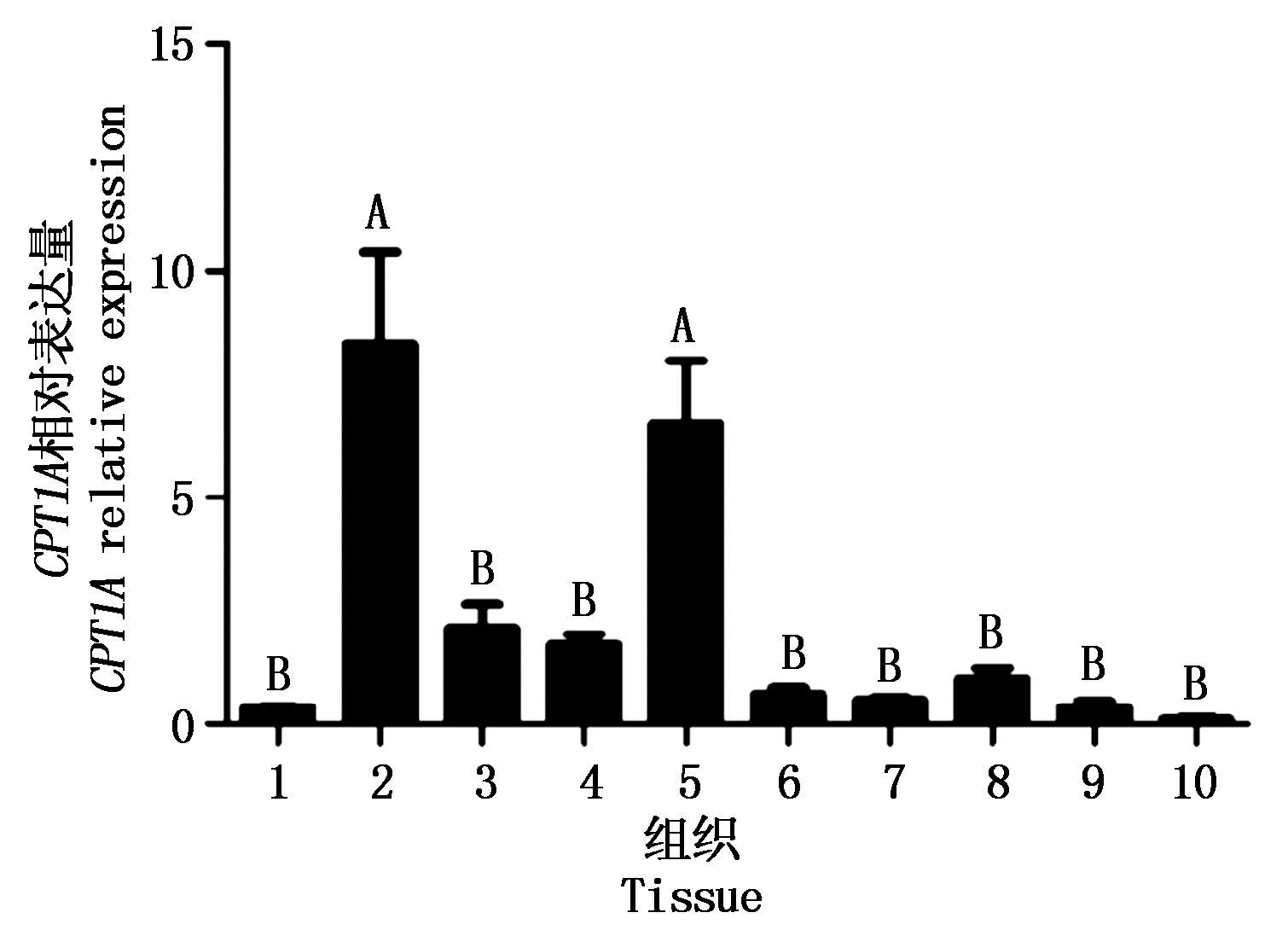
1.心;2.肝;3.脾;4.肺;5.肾;6.背最长肌;7.股二头肌;8.臂三头肌;9.皮下脂肪;10.腹间脂肪。不同大写字母显示表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05)。图6同。
1. Heart; 2.Liver; 3.Spleen; 4.Lung; 5.Kidney; 6.Longissimus dorsi muscle; 7.Biceps femoris; 8.Triceps muscle of arm; 9.Subcutaneous fat; 10.Abdominal fat. Different capitals indicate extremely significant differences (P<0.01), different lowercases indicate significant differences (P<0.05). The same as Fig.6.
图5 简州大耳羊CPT1A基因在不同组织中的表达水平
Fig.5 Expression levels of goat CPT1A gene in different tissues
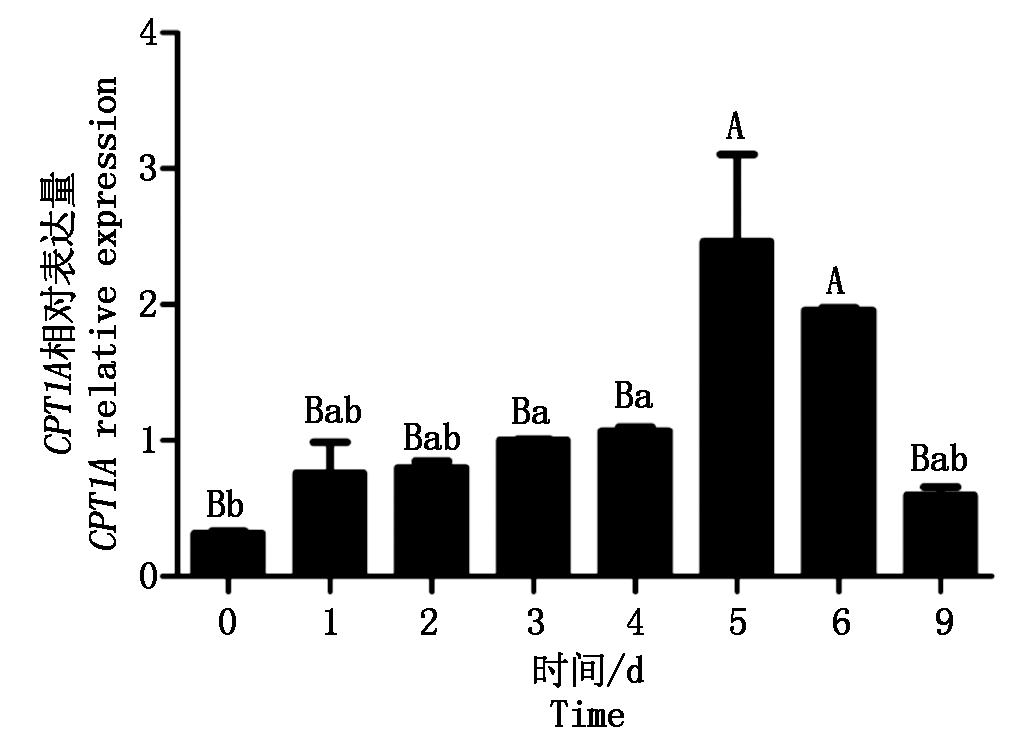
图6 CPT1A基因在山羊前体脂肪细胞分化过程中的表达
Fig.6 The expression levels of CPT1A gene during goat intramuscular preadipocyte differentiation
表2 CPT1A mRNA表达水平与IMF含量相关性分析
Tab.2 Correlation analysis between CPT1A mRNA expression level and IMF content

组织Tissue相关系数Correlation coefficientP值P value背最长肌 Longissimus dorsi muscle0.9340.002股二头肌 Biceps femoris0.8130.049臂三头肌 Triceps muscle of arm0.9350.006
3 结论与讨论
IMF含量是影响肉质的重要指标,研究山羊脂质代谢基因调控机理对IMF含量影响具有重要的现实意义。目前,已经有很多关于脂代谢相关基因的研究报道[24],然而关于山羊CPT1A基因调控IMF沉积的相关研究还未见报道,而基因序列的缺乏和组织表达信息的不完善阻碍了对其功能的进一步研究。简州大耳羊是我国第2个肉用山羊培训新品种,其肌内脂肪含量显著高于其他山羊品种[25],然而关于IMF沉积具体调控机理尚不清楚。
为了确定简州大耳羊CPT1A基因的组织表达谱,采用RT-qPCR对简州大耳羊各组织进行mRNA定量分析。在内参选择上,根据Bonnet等[21]的内参筛选结果,UXT、EIF3K、RPLPO、TBP为稳定的内参基因,许晴等[22]的内参基因筛选结果显示,UXT、PPIB在前体脂肪细胞中表达稳定,综合考虑选用UXT作为本试验的内参基因。组织定量结果显示,CPT1A广泛存在于简州大耳羊各组织中,且在肝脏和肾脏中其表达量显著高于其他组织。杨家大[26]研究发现,在黔北麻羊肾脏中CPT1A mRNA水平表达量最高,而在贵州黑山羊和南江黄羊中肝脏表达量最高,这与试验存在相似之处。于宝莉等[17]在绒山羊的试验结果中,CPT1A在脾脏、肝脏表达量较高与本试验研究结果存在相似之处,而肌肉组织表达量较高也存在着不同之处。余秀锋等[27]的研究发现,CPT1基因在肉质型金华猪背最长肌的表达量高于瘦肉型长白猪,长白猪皮下脂肪的CPT1A mRNA水平相对于金华猪在30 d的最高,随着在日龄升高而降低。可见不同品种间CPT1A的表达水平差异较大,这可能是造成本试验结果与绒山羊表达差异的原因。
本研究细胞诱导分化后的CPT1A表达量都比分化前高,其中从0~5 d呈上升趋势并在第5天达到最高,随后相对表达量开始下降,这与张艳芳[28]的研究结果一致。Bartelds等[29]也发现CPT1A基因表达在羔羊出生后短暂增加,这说明基因的表达可能与机体生长阶段有关,本研究结果为进一步研究CPT1在分化过程中不同阶段的功能研究提供了参考。
简州大耳羊IMF沉积与CPT1A表达量的相关性分析发现3种肌肉组织的IMF沉积量都与CPT1A表达量呈显著正相关,其中背最长肌和臂三头肌IMF含量与CPT1A表达量极显著相关(P<0.01),表明CPT1A可能是IMF沉积的候选基因。而Liu等[30]研究发现,在孵化时快速生长的鸡中,IMF含量与CPT1A呈负相关。Qiu等[31]在鸡中也发现CPT1A负调节IMF含量。在鸡中,较低的脂代谢可能促进IMF沉积。而张艳芳[28]研究发现,在金华猪和长白猪中CPT1的表达与IMF沉积呈正相关。Zhang等[32]发现,CPT1A在金华猪背最长肌内中与肌内脂肪含量呈显著正相关。综上所述,CPT1A表达量在哺乳动物肌肉组织中可能与IMF呈正相关。IMF沉积是一个复杂的机制,需要进行后续的试验探究,且本试验做了7只简州大耳羊分析,样本量不足,IMF测定结果标准差较大,CPT1A在肌肉组织中表达量并不显著。后续试验拟打算扩大山羊样本量,完善IMF数据。设计并合成CPT1A基因干扰SiRNA,干扰体外培养肌内脂肪细胞,进一步深入研究CPT1A基因在山羊IMF沉积中的作用机理。
本研究成功获得简州大耳羊CPT1A基因的cDNA序列,包括CDS区2 319 bp,编码773个氨基酸残基(MH345735)。CPT1A基因序列具有较高的物种保守性,并广泛表达于山羊各组织中,且在山羊肝和肾中具有最高的表达水平,而在肌肉、脂肪组织表达量较低。CPT1A基因的表达水平随着前体脂肪细胞的分化而先升高后下降,3种肌肉组织中mRNA表达水平与IMF含量显著正相关。本试验研究结果表明,CPT1A基因可能参与山羊肌内脂肪沉积和前体脂肪分化,为进一步探究CPT1A基因在山羊肌肉生长中的作用提供基础数据。
[1] Talpur F N, Bhanger M I, Sherazi S T H. Intramuscular fatty acid profile of longissimus dorsi and semitendinosus muscle from Pateri goats fed under traditional feeding system of Sindh, Pakistan[J]. Meat Science, 2008, 80(3):819-822.doi:10.1016/j.meatsci.2008.03.028.
[2] Wood J D, Enser M, Fisher A V, Nute G R, Sheard P R, Richardson R I, Hughes S I, Whittington F M.Fat deposition, fatty acid composition and meat quality:A review[J]. Meat Science, 2008, 78(4):343-358. doi:10.1016/j.meatsci.2007.07.019.
[3] Gondret F, Lebret B. Feeding intensity and dietary protein level affect adipocyte cellularity and lipogenic capacity of muscle homogenates in growing pigs, without modification of the expression of sterol regulatory element binding protein[J]. Journal of Animal Science, 2002, 80(12):3184-3193. doi:10.2527/2002.80123184x.
[4] 朱江江, 林亚秋, 王永, 李倩, 林森. 山羊CC类趋化因子受体(CCR2)基因的克隆及组织表达分析[J]. 畜牧兽医学报, 2016, 47(11):2202-2209. doi:10.11843/j.issn.0366-6964.2016.11.007.
Zhu J J, Lin Y Q, Wang Y, Li Q, Lin S. Molecular cloning and tissue expression of goat chemokine (CC motif) Receptor 2 (CCR 2) gene[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(11):2202-2209.
[5] Sebastián D, Guitart M, García-Martínez C, Mauvezin C, Orellana-Gavalda J M, Serra D,Gómez-Foix A M, Hegardt F G, Asins G. Novel role of FATP1 in mitochondrial fatty acid oxidation in skeletal muscle cells[J]. The Journal of Lipid Research, 2009, 50(9):1789-1799. doi:10.1194/jlr.m800535-jlr200.
[6] Eaton S, Bartlett K, Quant P A. Carnitine palmitoyl transferase I and the control of β-oxidation flux in heart mitochondria[J]. Biochemical and Biophysical Research Communications, 2001, 285(2):537-539. doi:10.1006/bbrc.2001.5201.
[7] Sepa-kishi D M, Wu M V, Uthayakumar A, Mohasses A, Ceddia R B. Anti-lipolytic and anti-lipogenic effects of the CPT-1b inhibitor oxfenicine in the white adipose tissue of rats[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2016, 311(4):779-787. doi:10.1152/ajpregu.00243.2016.
[8] Miljkovic I, Yerges L M, Li H, Gordon C L, Goodpaster B H, Kuller L H, Nestlerode C S, Bunker C H, Patrick  L, Wheeler V W, Zmuda J M. Association of the CPT1B gene, with skeletal muscle fat infiltration in Afro-Caribbean men[J]. Obesity, 2009, 17(7):1396-1401. doi:10.1038/oby.2008.677.
L, Wheeler V W, Zmuda J M. Association of the CPT1B gene, with skeletal muscle fat infiltration in Afro-Caribbean men[J]. Obesity, 2009, 17(7):1396-1401. doi:10.1038/oby.2008.677.
[9] McGarry J D, Bromn N F. The mitochondrial carnitine palmitoyl transferase System-From concept to molecular analysis[J]. Febs Journal, 1997, 244(1):1-14. doi:10.1111/j.1432-1033.1997.00001.x.
[10] Liu L L, Wang Y D, Wu J, Cui J, Chen T S. Carnitine palmitoyltransferase 1A (CPT1A):a transcriptional target of PAX3-fkhr and mediates PAX3-fkhr dependent motility in alveolar rhabdomyosarcoma cells[J]. BMC cancer, 2012, 25(4):12-154. doi:10.1186/1471-2407-12-154.
[11] Robitaille J, Houde A, Lemieux S, Pérusse L, Gaudet D, Vohl M C. Variants within the muscle and liver isoforms of the carnitine palmitoyltransferase I (CPT1) gene interact with fat intake to modulate indices of obesity in French-Canadians[J]. Journal of Molecular Medicine (Berlin), 2007, 85(2):129-137. doi:10.1007/s00109-006-0116-7.
[12] Morash A J, McClelland G B. Regulation of carnitine palmitoyltransferase (CPT) I during fasting in rainbow trout (Oncorhynchus mykiss) promotes increased mitochondrial fatty acid oxidation[J]. Physiological and Biochemical Zoology, 2011, 84(6):625-633. doi:10.1086/662552.
[13] Olpin S E, Allen J, Bonham J R, Clark S, Clayton P T, Calvin J, Downing M, Lves D K, Jones S, Manning N J, Pollitt R J, Standing S J, Tanner M S. Features of carnitine palmitoyltransferase type I deficiency[J]. Journal of Inherited Metabolic Disease, 2001, 24(1):35-42.doi:10.1023/A:1005694320063.
[14] Lee J, Ellis J M, Wolfgang M J. Adipose fatty acid oxidationis is required for thermogenesis and potentiates oxidative stress-induced inflammation[J]. Cell Reports, 2015, 10(2):266-279. doi:10.1016/j.celrep.2014.12.023.
[15] Park E A, Cook G A. Differential regulation in the heart of mitochondrial carnitine palmitoyltransferase-I muscle and liver isoforms[J]. Molecular & Cellular Biochemistry, 1998, 180(1-2):27-32.
[16] Casals N, Zammit V, Herrero L, Fado'R, Rodríguez-Rodríguez R, Serra D. Carnitine palmitoyltransferase 1C:From cognition to cancer[J]. Progress in Lipid Research, 2016, 61:134-148. doi:10.1016/j.plipres.2015.11.004.
[17] 于宝莉, 高爱琴, 李金泉, 张文广. 肉碱棕榈酰转移酶基因在绵羊和山羊不同肌肉组织中的表达分析[J]. 中国畜牧兽医, 2012, 39(10):1-6. doi:10.3969/j.issn.1671-7236.2012.10.001.
Yu B L, Gao A Q, Li J Q, Zhang W G. Expression analysis of CPT gene in different tissues from sheep and goat[J]. China Animal Husbandry & Veterinary Medicin, 2012, 39(10):1-6.
[18] Gobin S, Bonnefont J P, Prip-Buus C, Mugnier C, Ferrec M, Demaugre F, Saudubray J M, Rostane H, Djouadi F, Wilcox W, Cederbaum S, Haas R, Nyhan W L, Green A, Gray G, Girard J, Thuillier L. Organization of the human liver carnitine palmitoyltransferase 1 gene (CPT1A) and identification of novel mutations in hypoketotic hypoglycaemia[J]. Human Genetics, 2002, 111(2):179-189. doi:10.1007/s00439-002-0752-0.
[19] 魏婷, 张永煜, 张庆华. 肉毒碱棕榈酰基转移酶1A的研究进展[J]. 生命科学, 2013, 25(6):614-620. doi:10.13376/j.cbls/2013.06.008.
Wei T, Zhang Y Y, Zhang Q H. Research advances of carnitine palmitoyltransferase 1A[J]. Chinese Bulletin of Life Sciences, 2013, 25(6):614-620.
[20] 李倩,林亚秋,朱江江,林森,张小玉,王永. 山羊FGF21基因克隆及其在肌内脂肪细胞中的表达模式研究[J]. 畜牧兽医学报, 2017, 48(1):31-38. doi:10.11843/j.issn.0366-6964.2017.01.004.
Li Q, Lin Y Q, Zhu J J, Lin S, Zhang X Y, Wang Y. Cloning of goat FGF21 gene and its expression patern in intramuscular adipocyte[J].Acta Veterinaria et Zootechnica Sinica,2017,48(1):31-38.
[21] Bonnet M, Bernard L, Bes S, Leroux C. Selection of reference genes for quantitative Real-time PCR normalisation in adipose tissue, muscle, liver and mammary gland from ruminants[J]. Animal, 2013, 7(8):1344-1353. doi:10.1017/S1751731113000475.
[22] 许晴, 林森, 朱江江, 王永, 林亚秋. 山羊肌内前体脂肪细胞诱导分化过程中内参基因的表达稳定性分析[J]. 畜牧兽医学报, 2018, 49(5):907-918. doi:10.11843/j.issn.0366-6964.2018.05.005.
Xu Q, Lin S, Zhu J J, Wang Y, Lin Y Q. The expression stability analysis of reference genes in the process of goat intramuscular preadipocytes differentiation in goat[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(5):907-918.
[23] 俞雨阳, 林亚秋, 梁计峻, 王永, 朱江江. 山羊CPT1B基因的克隆、表达及其与肌内脂肪含量的相关性分析[J]. 农业生物技术学报, 2019, 27(4):692-702.doi:10.3969/j.issn.1674-7968.2019.04.013.
Yu Y Y, Lin Y Q, Liang J J, Wang Y, Zhu J J. Cloning and expression of goat(Capra hircus) CPT1B gene and its correlation with intramuscular fat content[J]. Journal of Agricultural Biotechnology, 2019, 27(4):692-702.
[24] Mayes P A, Felts J M. Regulation of fat metabolism in the liver[J]. Nature, 1967, 12(8):716-718. doi:10.1038/215716a0.
[25] 朱武政, 林亚秋, 江明锋, 王永, 廖红海, 李倩,朱江江. 肉用山羊脂代谢相关基因与肌内脂肪含量的相关性分析[J]. 畜牧兽医学报, 2016, 47(7):1333-1341. doi:10.11843/j.issn.0366-6964.2016.07.005.
Zhu W Z, Lin Y Q, Jiang M F, Wang Y, Liao H H, Li Q, Zhu J J. Association analysis of intramuscular fat content and the expression of genes related to lipid metabolism in meat goat[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(7):1333-1341.
[26] 杨家大. 贵州地方山羊CPT-1A基因在不同品种和组织中的表达差异[J]. 浙江农业学报, 2015, 27(6):921-926. doi:10.3969/j.issn.1004-1524.2015.06.04.
Yang J D. Analysis on expression differences of CPT-1A gene in different tissues of Guizhou native goat breeds[J]. Acta Agriculturae Zhejiangensis, 2015, 27(6):921-926.
[27] 余秀锋, 任阳, 黄晶, 汪以真. 金华猪和长白猪AMPK基因的表达差异研究[J]. 中国畜牧杂志, 2014, 50(9):10-14. doi:10.3969/j.issn.0258-7033.2014.09.003.
Yu X F, Ren Y, Huang J, Wang Y Z. Comparative studys on AMPK gene expression from Jinhua and landrace pigs[J]. Chinese Journal of Animal Science, 2014, 50(9):10-14.
[28] 张艳芳. CPT1基因对猪脂肪沉积的影响及其调控机制的研究[D]. 杭州:浙江大学, 2010.
Zhang Y F. Effect of CPT1 gene on porcine fat deposition and its molecular mechanism[D]. Hangzhou:Zhejiang University, 2010.
[29] Bartelds B, Takens J, Smid G B, Zammit V A, Pripbuus C, Kuipers J R G, Van der Leij F R. Myocardial carnitine palmitoyl transferase I expression and long-chain fatty acid oxidation in fetal and newborn lambs[J]. Amrican Jouranl of Physiol Heart and Circulatory Physiology, 2004, 286(6):2243-2248. doi:10.1152/ajpheart.00864.2003.
[30] Liu L, Cui H X, Fu R Q, Zheng M Q, Liu R R, Zhao G P, Wen J. The regulation of IMF deposition in pectoralis major of fast-and slow-growing chickens at hatching[J]. Biomed Central, 2017, 1(10):8-77. doi:10.1186/s40104-017-0207-z.
[31] Qiu F F, Xie L, Ma J E, Luo W, Zhang L, Chao Z, Chen S H, Nie Q H, Lin Z M, Zhang X Q. Lower expression of SLC27A1 enhances intramuscular fat deposition in chicken via down-regulated fatty acid oxidation mediated by CPT1A[J]. Frontiers in Physiology, 2017, 29(8):449. doi:10.3389/fphys.2017.00449.
[32] Zhang Y F, Yuan Z Q, Song D G, Zhou X H, Wang Y Z. Effects of Cannabinoid receptor 1 (brain) on lipid accumulation by transcriptional control of CPT1A and CPT1B[J]. Animal Genetics, 2014, 45(1):38-47. doi:10.1111/age.12078.