猪传染性胃肠炎(Transmissible gastroenteritis,TGE)是由猪传染性胃肠炎病毒(Transmissible gastroenteritis virus of swine,TGEV)引起的接触性、传染性肠道疾病[1]。感染后,2 周龄以内仔猪死亡率高达100%,5 周龄以上的猪死亡率较低,成年猪一般无死亡现象[2]。TGEV为巢状病毒目(Nidovirales)冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus)成员,它是仔猪急性病毒性腹泻的重要病原之一,可导致养猪业遭受破坏性的经济损失[3]。1933年,TGEV首次报告于美国。中国在1970年第1次检测到TGEV[4]。
TGEV基因组为不分节段的单股正链RNA,长度约28.5 kb,可分别编码纤突(Spike)蛋白、包膜(E)蛋白、膜(M)蛋白和核衣壳(N)蛋白等4 种结构蛋白以及5种非结构蛋白[5]。TGEV M蛋白高度糖基化,有助于病毒核衣壳与囊膜结合[6]。M蛋白羧基末端暴露于病毒颗粒外表面,具有良好的免疫原性和反应原性[7]。
病毒亲和肽可与病毒特异性结合,在诊断和治疗领域具有良好的应用前景[8]。Zou等[9]曾通过噬菌体展示技术对TGEV病毒亲和肽进行了筛选。其对含有TGEV M蛋白的重组蛋白为靶分子进行了5 轮生物淘选,成功筛选出10 种能与靶分子蛋白结合的十二肽,并通过噬菌体ELISA验证了亲和肽与病毒粒子的亲和性。本研究选取这10 种十二肽中亲和性最强的3 种,通过串联表达方法进行体外表达,并利用Western Blot、Dot-ELISA等方法检测重组蛋白的病毒亲和性。本研究为建立TGEV感染诊断方法和检测技术奠定了一定的物质基础和理论依据。
1 材料和方法
1.1 试验材料
1.1.1 菌种、质粒和抗体 原核表达载体pET-32a、pGEX-6p-1、大肠杆菌DH5α和Rosetta(DE3)由齐齐哈尔大学生命科学与农林学院动物免疫学实验室保存。TGEV阳性血清购自中国兽医药品监察所;辣根过氧化物酶(HRP)标记His标签单克隆抗体和HRP标记GST标签单克隆抗体购自Thermo Fisher公司。HRP标记羊抗猪抗体购自北京中杉金桥生物技术有限公司。TGEV H株(1×105 TCID50/mL)由本实验室保存。
1.1.2 主要试剂 异丙基硫代半乳糖苷(IPTG)、DNA分子质量标准、T4 DNA连接酶、BamHⅠ和XhoⅠ限制性内切酶购自TaKaRa公司。高保真KOF Taq酶、dNTP mix和4氯-1-奈酚(4-CN)购自哈尔滨超峰生物科技发展有限公司。质粒提取试剂、胶回收试剂盒,购自上海近岸科技有限公司。蛋白分子质量标准购自Thermo Fisher公司。其余常规试剂为国产分析纯。
1.2 试验方法
1.2.1 TGEV M蛋白亲和肽基因的设计与合成 根据Zuo等[9]的研究结果,从10 种可与TGEV M蛋白结合的十二肽中选取亲和力最强的3种,每种亲和肽之间用linker(AAAK)连接。根据设计好的重组蛋白序列,对其推导的核苷酸序列依据大肠杆菌偏爱密码子进行优化,并交由哈尔滨博仕生物技术有限公司进行合成,合成基因插入到pUC57质粒中,该质粒命名为pUC57-MQHT。pUC57-MQHT用无菌去离子水进行1∶10 000稀释,作为PCR模板。
1.2.2 M蛋白亲和肽基因的亚克隆 根据合成的基因序列,利用Primer Premier 5.0软件设计合成1对引物。PU:5′-CGCGGATCCGAATGCATCAAGAT CAAT-3′;PL:5′-GGGCCGCTCGAGTTAATCCGATAT TGG-3′。
上游引物PU插入BamHⅠ酶切位点,下游引物PL插入XhoⅠ的酶切位点(下划线表示)。该引物由哈尔滨博仕生物技术有限公司合成。合成后的引物稀释成50 pmol/μL,-20 ℃保存备用。
将2×Taq酶预混液(包含Buffer,dNTP)12.5 μL,PU 0.5 μL(25 pmoL/μL),PL 0.5 μL(25 pmol/μL),模板0.5 μL,ddH2O 10.5 μL,KOF Taq酶0.5 μL,共25 μL。PCR程序设计为,94 ℃ 1 min 30 s;94 ℃ 30 s,40 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 7 min,4 ℃保存。PCR产物经1.2%琼脂糖凝胶电泳检测。
1.2.3 重组表达载体的构建 PCR产物、表达载体pET-32a和pGEX-6p-1分别用BamHⅠ与XhoⅠ双酶切。酶切产物经胶回收。将回收后的PCR产物与pET-32a或pGEX-6p-1连接,转化大肠杆菌DH5α感受态细胞,涂布含氨苄青霉素(Amp)100 μg/mL 的LB平板,37 ℃过夜培养。挑取单菌落接种至含有Amp 100 μg/mL的液体LB中,37 ℃过夜培养,提取质粒。单、双酶切鉴定质粒。将相应克隆菌寄送哈尔滨博仕生物科技有限公司进行序列测定。测序鉴定正确的重组质粒分别命名为pET-32a-MQHT和pGEX-6p-MQHT。
1.2.4 重组蛋白的诱导表达 将重组质粒pET-32a-MQHT和pGEX-6p-MQHT分别转化大肠杆菌Rosetta(DE3),涂布LB平板(Amp,100 μg/mL)。过夜培养,挑取单菌落,获得重组菌株。重组菌首先接种LB液体培养基(Amp,100 μg/mL),37 ℃振荡培养过夜。再以1%比例转接新鲜的LB液体培养基,37 ℃振荡培养2~3 h后,测菌液OD600达0.5~0.6时,加入至终浓度1.0 mmol/L IPTG 37 ℃诱导1~4 h后收获细菌,进行SDS-PAGE电泳分析。重组蛋白分别命名为TRX-MQHT和GST-MQHT。
1.2.5 重组蛋白的纯化及鉴定 重组蛋白经SDS-PAGE电泳后,用0.3 mol/L 4 ℃预冷的KCl溶液预染5 min,切下含目的蛋白的凝胶,碾碎,加入PBS悬起,反复冻融3 次,10 000 r/min离心5 min,取上清液。采用Bradford检测法分别对重组蛋白TRX-MQHT和GST-MQHT的含量进行测定[10]。纯化的重组蛋白经SDS-PAGE后,转印至硝酸纤维素(NC)膜,5%脱脂乳4 ℃封闭过夜,PBST洗3 遍,浸入1∶100稀释的HRP标记的His标签单克隆抗体或HRP标记的GST标签单克隆抗体中,37 ℃作用2 h,PBST洗涤3 次后用4-CN显色。
1.2.6 Western Blot鉴定重组蛋白的病毒亲和性 纯化的重组蛋白TRX-MQHT或GST-MQHT经SDS-PAGE后,转印至NC膜上,5%脱脂乳4 ℃封闭过夜,PBST洗3 遍,3 min/次,浸入TGEV H株(1×105 TCID50)稀释液中,37 ℃作用2 h,PBST洗3 遍,3 min/次,浸入PBS稀释的质量浓度为1 mg/mL的重组蛋白GST-MQHT或TRX-MQHT中,室温作用2 h,PBST洗涤3 遍,3 min/次,浸入1∶1 000稀释的HRP标记GST标签单克隆抗体或His标签单克隆抗体中,室温作用1 h,PBST洗涤3 遍,3 min/次,用4-CN显色。
1.2.7 Dot-ELISA鉴定重组蛋白病毒亲和性 按照以下步骤进行Dot-ELISA操作。在NC膜表面划4 mm×4 mm小方格,先将NC膜在去离子水中浸泡10 min,取出置于室温晾干。用微量移液器吸取1 μL 1 mg/mL的重组蛋白TRX-MQHT或GST-MQHT,点于小方格的正中央,置于室温晾干。将包被的膜片放入5%脱脂乳中,37 ℃封闭作用60 min后取出,PBST洗涤3 次,2 min/次,室温晾干。将膜片裁剪成小片,点样面朝上置于96 孔酶标板孔内,加入100 μL PBS 倍比稀释的TGEV H株中(1∶100,1∶200,1∶400,1∶800),37 ℃ 60 min;每孔加入150 μL PBST泡洗3 次,2 min/次,再用PBS洗涤1 遍,2 min;加入100 μL 1 mg/mL的重组蛋白GST-MQHT或TRX-MQHT中,37 ℃ 60 min;弃去重组蛋白,每孔加入150 μL PBST泡洗3 次,2 min/次,再用无磷酸盐缓冲液洗涤1 遍,2 min;每孔加入100 μL 1∶1 000稀释的GST标签单克隆抗体或His标签单克隆抗体,37 ℃作用30 min;弃去酶标抗体,每孔加入150 μL PBST泡洗2 次,2 min/次,再用PBS洗涤1 遍,2 min;每孔加入100 μL显色液,37 ℃ 避光显色,5 min后观察;弃去显色液,每孔加入150 μL去离子水泡洗3 次,1 min/次,甩干后取出膜片干燥,拍照。
1.2.8 阻断试验 将TGEV H株分别与1∶100,1∶200,1∶400,1∶800稀释的TGEV阳性血清孵育,4 ℃作用过夜,10 000 r/min离心30 min,取上清。Dot-ELISA法检测阻断效果。膜片预处理按前述方法进行。按1.2.7中所述的Dot-ELISA方法进行检测,观察其反应情况。
2 结果与分析
2.1 重组质粒pET-32a-MQHT和pGEX-6p-MQHT的酶切鉴定
构建的重组质粒pET-32a-MQHT、pGEX-6p-MQHT分别采用BamHⅠ单酶切和BamHⅠ/XhoⅠ双酶切,经琼脂糖凝胶电泳检测,结果表明,pET-32a-MQHT经BamHⅠ单酶切获得了6 050 bp的DNA条带,BamHⅠ/XhoⅠ双酶切获得了5 900 bp的载体片段和大小为150 bp的目的条带;pEGX-6p-MQHT经BamHⅠ单酶切获得了5 140 bp的DNA条带, BamH Ⅰ/Xho Ⅰ双酶切获得了4 990 bp的载体片段和大小为150 bp的目的条带(图1)。上述酶切结果与预期一致。测序结果证明插入位置与阅读框均正确。
2.2 重组蛋白的表达
将构建的重组质粒pET-32a-MQHT和pGEX-6p-MQHT分别转化大肠杆菌Rosetta(DE3),经1.0 mmol/L IPTG诱导后1,2,3,4 h取样,SDS-PAGE检测全菌体细胞沉淀,结果表明,获得的重组蛋白TRX-MQHT和GST-MQHT大小分别为25,31 ku,与预期相符(图2,箭头所示)。
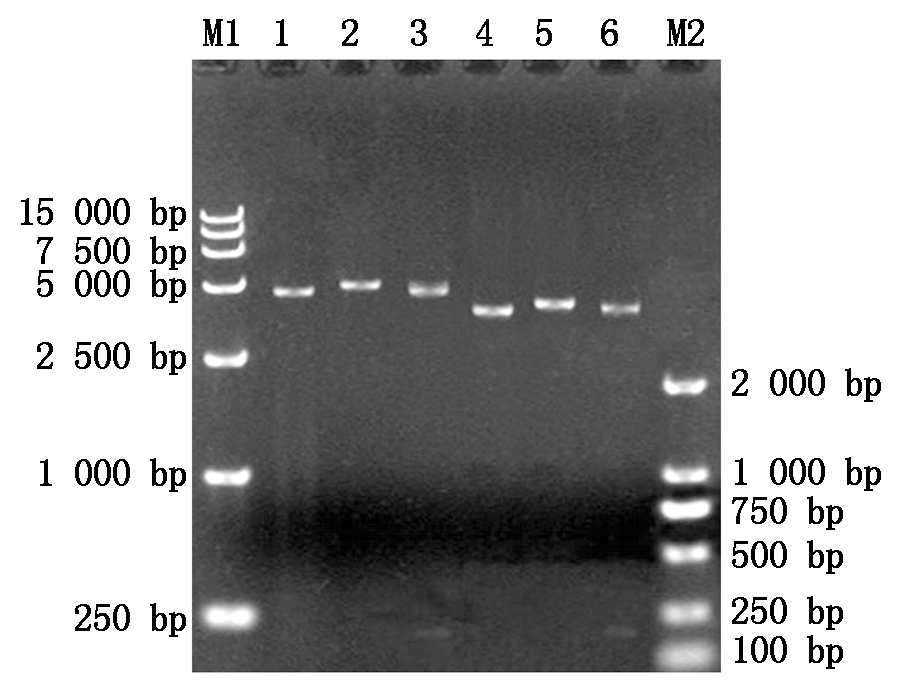
M1.DNA分子质量标准DL15000;1.pET-32a空载体BamHⅠ单酶切;2.pET-32a-MQHT BamHⅠ单酶切;3.pET-32a-MQHT BamHⅠ/XhoⅠ双酶切;4.pGEX-6p-1空载体BamHⅠ单酶切;5.pGEX-6p-MQHT BamHⅠ单酶切;6.pGEX-6p-MQHT BamHⅠ/XhoⅠ双酶切;M2. DNA分子量标准DL2000。
M1.DNA Marker DL15000;1.pET-32a digested by BamHⅠ;2.pET-32a-MQHT digested by BamHⅠ;3.pET-32a-MQHT digested by BamHⅠ/XhoⅠ; 4.pGEX-6p-1 digested by BamHⅠ;5.pGEX-6p-MQHT digested by BamHⅠ;6.pGEX-6p-MQHT digested by BamHⅠ/XhoⅠ;M2. DNA Marker DL2000.
图1 重组表达载体pET-32a-MQHT和pGEX-6p-MQHT的酶切鉴定
Fig.1 Identification of recombinant expression vectors by restriction enzyme digestion
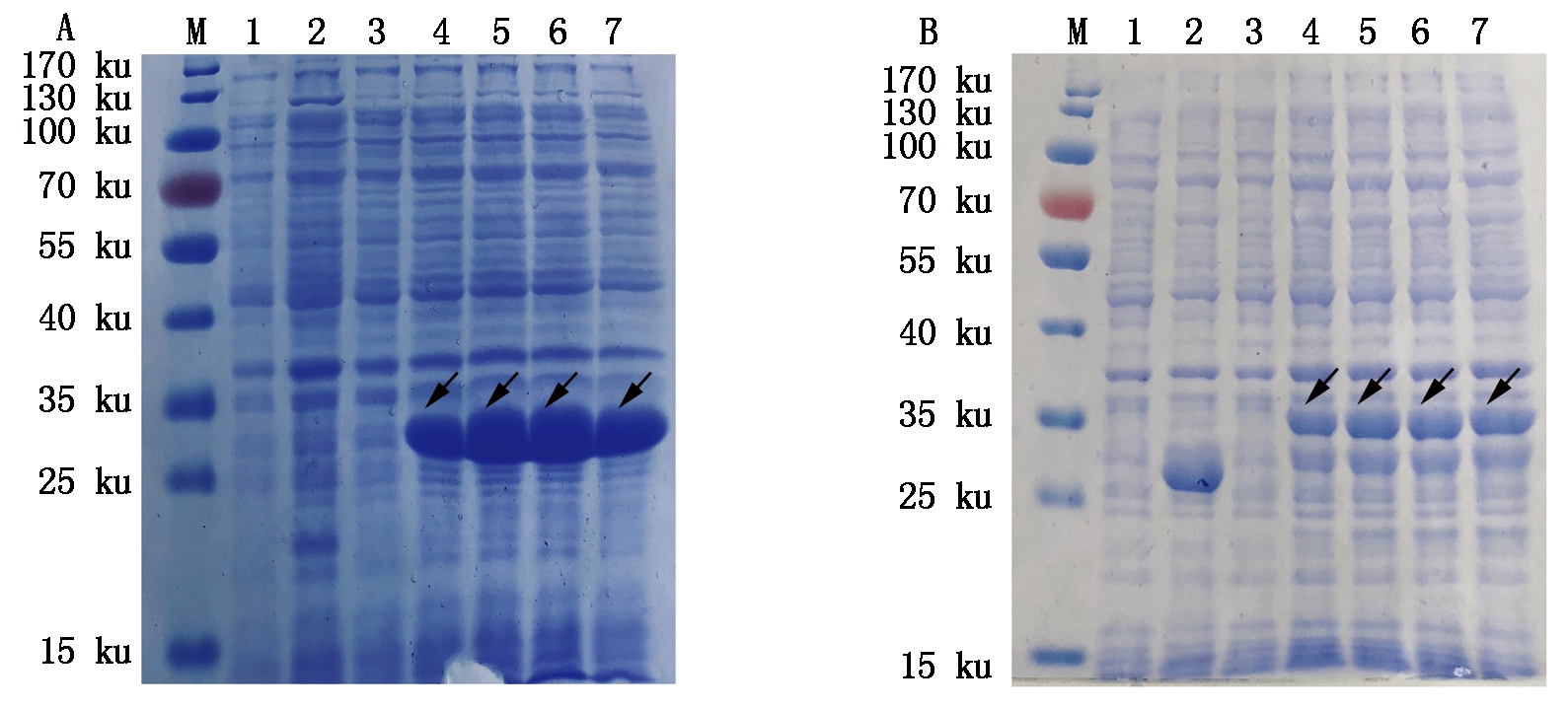
A.SDS-PAGE检测重组蛋白TRX-MQHT的表达: M.蛋白质分子质量标准;1.诱导前的pET-32a空载体;2.诱导后4 h的pET-32a空载体;3.未诱导的pET-32a-MQHT/E.coli Rosetta(DE3)重组菌;4-7.诱导1~4 h的pET-32a-MQHT/E.coli Rosetta(DE3)重组菌。B.SDS-PAGE检测重组蛋白GST-MQHT的表达:M.蛋白质分子质量标准;1.诱导前的pGEX-6p-1空载体;2.诱导后4 h的pGEX-6p-1空载体;3.未诱导的pGEX-6p-MQHT/E.coli Rosetta(DE3)重组菌;4-7.诱导1~4 h的pGEX-6p-MQHT/E.coli Rosetta(DE3)重组菌。
A.Detection of recombinant protein TRX-MQHT by SDS-PAGE:M.Protein Marker; 1.pET-32a/E.coli Rosetta(DE3) before induction; 2.pET-32a/E.coli Rosetta(DE3) induced for 4 h;3.pET-32a-MQHT/E.coli Rosetta(DE3) before induction; 4-7.pET-32a-MQHT/E.coli Rosetta(DE3) induced for 1-4 h. B.Detection of recombinant protein GST-MQHT by SDS-PAGE:M.Protein Marker; 1.pGEX-6p-1/E.coli Rosetta(DE3) before induction; 2.pGEX-6p-1/E.coli Rosetta(DE3) induced for 4 h;3.pGEX-6p-MQHT/E.coli Rosetta(DE3) before induction; 4-7.pGEX-6p-MQHT/E.coli Rosetta(DE3) induced for 1-4 h.
图2 重组蛋白的SDS-PAGE分析
Fig.2 SDS-PAGE analysis of recombinant protein
2.3 重组蛋白的纯化及鉴定
重组蛋白TRX-MQHT和GST-MQHT的切胶纯化结果如图3-A所示。经His标签单克隆抗体和GST标签单克隆抗体鉴定的结果表明,所获得的表达蛋白为重组蛋白(图3-B)。
2.4 Western Blot鉴定重组蛋白的病毒亲和性
纯化的重组蛋白TRX-MQHT或GST-MQHT转印至NC膜上后,与TGEV病毒粒子孵育,再与重组蛋白GST-MQHT或TRX-MQHT孵育,最后用抗GST或His单抗进行检测,如图4所示,2种重组蛋白都显示出阳性印记,而对照TRX或GST标签蛋白无印记。
2.5 Dot-ELISA鉴定重组蛋白病毒亲和性
纯化的重组蛋白TRX-MQHT或GST-MQHT包被至NC膜上后,与TGEV病毒粒子孵育,再与重组蛋白GST-MQHT或TRX-MQHT孵育,最后用抗GST或His单抗进行检测,如图5所示,2 种重组蛋白在1×103,5×102,2.5×102 TCID50/mL 3 个滴度时都显示出阳性印记,而在1.25×102 TCID50/mL滴度时无可见斑点,2 种重组蛋白检测TGEV的最低滴度无明显差异,检测TGEV的敏感性为2.5×102 TCID50/mL。TGEV亲和性良好。
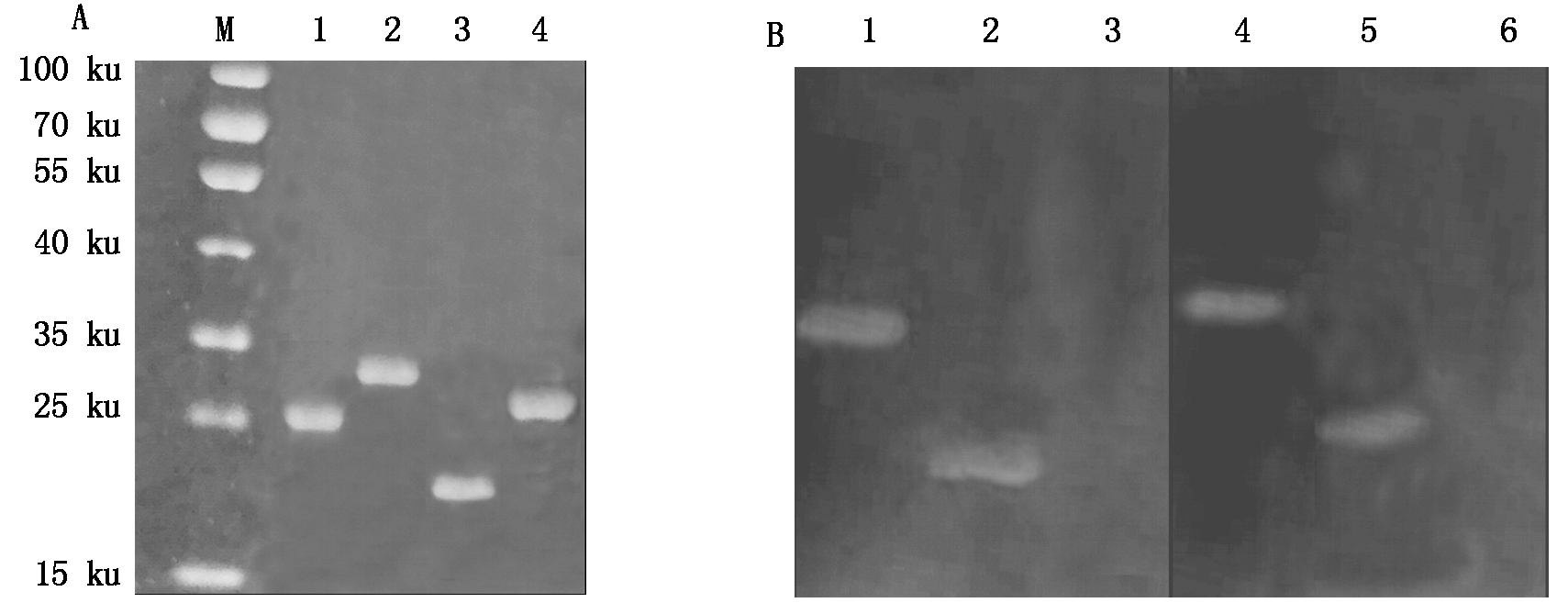
A.重组蛋白TRX-MQHT和GST-MQHT纯化结果:M.蛋白质分子质量标准;1.TRX-MQHT;2.GST-MQHT;3.TRX蛋白;4.GST蛋白。B.重组蛋白TRX-MQHT和GST-SQHT Western Blot鉴定结果:1.TRX-MQHT;2.TRX蛋白;3.GST蛋白;4.GST-MQHT;5.GST蛋白;6.TRX蛋白。
A.Purification results of recombinant protein TRX-MQHT and GST-MQHT: M.Protein Marker; 1.TRX-MQHT;2.GST-MQHT;3.TRX protein;4.GST protein.B.Identification of recombinant protein TRX-MQHT and GST-SQHT by Western Blot:1.TRX-MQHT;2.TRX protein;3.GST protein;4.GST-MQHT; 5.GST protein; 6.TRX protein.
图3 重组蛋白的纯化及鉴定
Fig.3 Purification and identification of recombinant protein
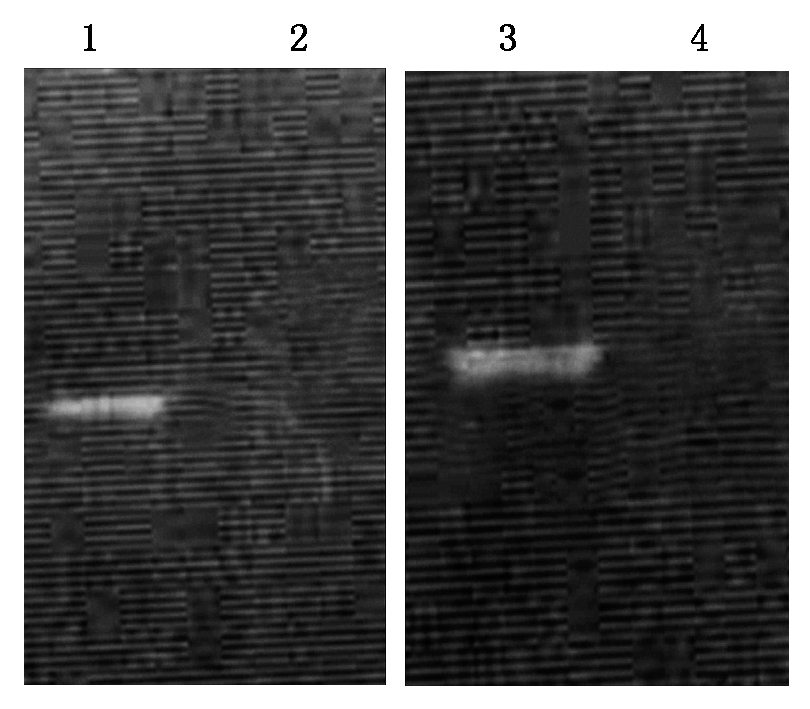
1.TRX-MQHT;2.TRX标签蛋白;3.GST-MQHT;4.GST标签蛋白。
1.TRX-MQHT; 2.TRX;3.GST-MQHT; 4.GST.
图4 Western Blot鉴定重组蛋白的TGEV亲和性
Fig.4 Identification of the affinity of recombinant protein to TGEV by Western Blot

A.TRX-MQHT;B.GST-MQHT:
1.1×103 TCID50/mL;2.5×102 TCID50/mL;
3.2.5×102 TCID50/mL;4.1.25×102 TCID50/mL。
图5 Dot-ELISA鉴定重组蛋白的TGEV亲和性
Fig.5 Identification of the affinity of recombinant protein to TGEV by Dot-ELISA
2.6 阻断试验
以重组蛋白TRX-MQHT或GST-MQHT为包被物,以不同浓度稀释(1∶100,1∶200,1∶400,1∶800)的TGEV阳性血清预先处理的TGEV H株为捕获对象,最后以重组蛋白GST-MQHT或TRX-MQHT为二次亲和物,进行Dot-ELISA检测。检测结果表明(图6),1∶100或1∶200稀释的TGEV阳性血清可完全阻断TGEV H株(1×105 TCID50/mL)与2 种亲和肽的结合。2 种亲和肽检测特异性良好。

A. 包被TRX-MQHT;B. 包被GST-MQHT。1-4. TGEV H株分别与1∶800,1∶400,1∶200,1∶100稀释的TGEV阳性血清作用。
A. TRX-MQHT; B. GST-MQHT.1-4. TGEV H strain co-cultivated with 1∶800, 1∶400, 1∶200, 1∶100 diluted anti-TGEV serum, respectively.
图6 阻断试验
Fig.6 Blocking test
3 结论与讨论
准确的诊断对于TGE的防控至关重要。TGE的初步诊断可根据当地的流行病学以及疑似病猪的临床症状来进行[11]。但由于TGE与猪的其他腹泻性疾病症状相似,因此,TGE的确诊必须进行实验室诊断[12]。目前,已经建立了多种TGEV检测方法,如病毒分离、免疫荧光检测[13]、电镜检测,RT-PCR、纳米颗粒辅助RT-PCR[14]、实时荧光定量RT-PCR[15]、双抗体夹心ELISA[16]、免疫过氧化物酶单层细胞试验(IPMA)[17]和DNA芯片[18]等。用于TGEV检测的RT-LAMP测定法反应时间在60 min以内,较为省时,可通过琼脂糖凝胶电泳直接观察试验结果[19-20]。M蛋白是TGEV囊膜中丰度较高的结构蛋白,保守性高,其也成为建立各种TGEV检测方法的候选蛋白。张小波[21]以原核表达的重组M蛋白作为包被抗原,建立了检测TGEV抗体的间接ELISA方法,并确定了间接ELISA的最佳工作条件。针对M蛋白制备的单克隆抗体和多克隆抗体亦具有良好的应用前景[22-23]。Rodák等[24]制备了针对TGEV N蛋白和M蛋白的单克隆抗体,并建立了竞争-阻断ELISA检测方法,敏感性为1×103 TCID50/mL。
病毒亲和肽在病毒性疾病检测方面也具有良好的应用价值[8]。Zou等[9]以筛选出TGEV M蛋白亲和肽中结合力最高的3 个噬菌体建立了噬菌体ELISA,可以检测到最低的病毒量为0.02 μg。Suo等[25]采用相似的方法筛选TGEV Spike蛋白亲和肽,并以结合力最高的4 个噬菌体建立了噬菌体ELISA,结果显示可以检测到最低的病毒量为0.1 μg,略优于常规ELISA(最低病毒检测量为0.6 μg)。本研究表达的重组M蛋白亲和肽与重组的S蛋白亲和肽的TGEV亲和性是否也有相似的差异,需要进一步的试验来确定。本研究初步建立的Dot-ELISA检测TGEV的敏感性为2.5×102 TCID50/mL,继续优化该Dot-ELISA反应条件后,其敏感性可能会有一定程度的提高。原核表达重组蛋白步骤简单,操作性强,试剂均为实验室常用药品不需要很高的费用[26],以重组表达的M蛋白亲和肽建立的检测方法有望应用到TGEV的临床诊断中。
[1] Xie W T, Ao C J,Yang Y L,Liu Y N,Liang R,Zeng Z,Ye G,Xiao S B,Fu Z F,Dong W Y,Peng G Q. Two critical N-terminal epitopes of the nucleocapsid protein contribute to the cross-reactivity between Porcine epidemic diarrhea virus and Porcine transmissible gastroenteritis virus[J]. J Gen Virol,2019,100(2):206-216. doi:10.1099/jgv.0.001216.
[2] Xia L,Dai L,Yang Q. Transmissible gastroenteritis virus infection decreases arginine uptake by downregulating CAT-1 expression[J]. Vet Res,2018,49(1):95. doi:10.1186/s13567-018-0591-1.
[3] Yang W T,Li Q Y,Ata E B,Jiang Y L,Huang H B,Shi C W,Wang J Z,Wang G,Kang Y H,Liu J,Yang G L,Wang C F. Immune response characterization of mice immunized with Lactobacillus plantarum expressing spike antigen of Transmissible gastroenteritis virus[J]. Appl Microbiol Biotechnol,2018,102(19):8307-8318. doi:10.1007/s00253-018-9238-4.
[4] Wang C B,Chen J F,Shi H Y,Qiu H J,Xue F,Liu S W,Liu C M,Zhu Y M,Almazán F,Enjuanes L,Feng L. Rapid differentiation of vaccine strain and Chinese field strains of Transmissible gastroenteritis virus by restriction fragment length polymorphism of the N gene[J]. Virus Genes,2010,41(1):47-58. doi:10.1007/s11262-010-0481-8.
[5] 张莉,康雪燕,章振华,李永清,盖丽丽,姜世金,张培君. 毕赤酵母表达的猪传染性胃肠炎病毒纤突糖蛋白及其免疫原性分析[J]. 华北农学报,2015,30(6):84-90. doi:10.7668/hbnxb.2015.06.013.
Zhang L,Kang X Y,Zhang Z H,Li Y Q,Gai L L,Jiang S J,Zhang P J. Expression and immunogenicity analysis of spike glycoprotein of Transmissible gastroenteritis virus in yeast Pichia pastoris[J]. Acta Agriculturae Boreali-Sinica,2015,30(6):84-90.
[6] Qing Y,Liu J W,Huang X B,Li Y Q,Zhang Y D,Chen J,Wen X T,Cao S J,Wen Y P,Wu R,Yan Q G,Ma X P. Immunogenicity of Transmissible gastroenteritis virus (TGEV) M gene delivered by attenuated Salmonella typhimurium in mice[J]. Virus Genes,2016,52(2):218-227. doi:10.1007/s11262-016-1296-z.
[7] Song Z H,Yang Y,Wang L,Wang K,Ran L,Xie Y L,Huang L S,Yang Z,Yuan P,Yu Q H. EIF4A2 interacts with the membrane protein of Transmissible gastroenteritis coronavirus and plays a role in virus replication[J]. Res Vet Sci,2018,123:39-46. doi:10.1016/j.rvsc.2018.12.005.
[8] Zhang N N,Lu Q X,Teng M,Yang Y Y,Zhang Y F,Zhang G P. Method and progress of the research on virus affinity peptide [J]. Agricultural Science & Technology,2016,17(12):2713-2716. doi:10.16175/j.cnki.1009-4229.2016.12.009.
[9] Zou H,Zarlenga D S, Sestak K,Suo S,Ren X F. Transmissible gastroenteritis virus:identification of M protein-binding peptide ligands with antiviral and diagnostic potential[J]. Antiviral Res,2013,99(3):383-390. doi:10.1016/j.antiviral.2013.06.015.
[10] 汪家政,范明. 蛋白质技术手册[M]. 北京:科学出版社,2000:42-46.
Wang J Z,Fan M. Protein technical manual[M].Beijing:Science Press, 2000:42-46.
[11] Gerdts V,Zakhartchouk A. Vaccines for Porcine epidemic diarrhea virus and other swine coronaviruses[J]. Vet Microbiol,2017,206:45-51. doi:10.1016/j.vetmic.2016.11.029.
[12] Liu G P,Jiang Y H,Opriessnig T J,Gu K D,Zhang H L,Yang Z Q. Detection and differentiation of five diarrhea related pig viruses utilizing a multiplex PCR assay[J]. J Virol Methods,2019,263:32-37.doi:10.1016/j.jviromet.2018.10.009.
[13] 朱蕴暖,张鑫,朱向东,陈建飞,时洪艳,石达,王鑫,季朝阳,冯力. 猪传染性胃肠炎病毒间接免疫荧光检测方法的建立[J].中国兽医科学,2017,47(1):109-113. doi:10.16656/j.issn.1673-4696.2017.01.016.
Zhu Y N,Zhang X,Zhu X D,Chen J F,Shi H Y,Shi D,Wang X,Ji Z Y,Feng L. Development of an indirect immunofluorescence assay for detection of Transmissible gastroenteritis virus of swine[J]. Chinese Veterinary Science,2017,47(1):109-113.
[14] Zhu Y,Liang L,Luo Y K,Wang G H,Wang C R,Cui Y D,Ai X,Cui S J. A sensitive duplex nanoparticle-assisted PCR assay for identifying Porcine epidemic diarrhea virus and Porcine transmissible gastroenteritis virus from clinical specimens[J]. Virus Genes,2017,53(1):71-76. doi:10.1007/s11262-016-1405-z.
[15] Wang J F,Wang J C,Zhang R X,Liu L B,Shi R H,Han Q G,Yuan W Z. Rapid detection of Transmissible gastroenteritis virus in swine small intestine samples using Real-time reverse transcription recombinase polymerase amplification[J]. J Virol Methods,2018,256:85-88. doi:10.1016/j.jviromet.2018.03.005.
[16] 王赛,苏菲,徐丽华,李军星,袁秀芳. 猪传染性胃肠炎病毒双抗体夹心ELISA检测方法的建立[J].中国兽医科学,2018,48(8):946-952.doi:10.16656/j.issn.1673-4696.2018.0118.
Wang S,Su F,Xu L H,Li J X,Yuan X F. Development of a double antibody sandwich ELISA for the detection of Transmissible gastroenteritis virus[J]. Chinese Veterinary Science,2018,48(8):946-952.
[17] 朱蕴暖,张鑫,朱向东,陈建飞,时洪艳,石达,冯力. 猪传染性胃肠炎病毒免疫过氧化物酶单层细胞试验原位检测方法的建立[J].中国预防兽医学报,2017,39(3):237-239. doi:10.3969/j.issn.1008-0425.2017.03.16.
Zhu Y N,Zhang X,Zhu X D,Chen J F,Shi H Y,Shi D,Feng L. Development of immunoperoxidase monolayer assay detecting Transmissible gastroenteritis virus in situ[J]. Chinese Journal of Preventive Veterinary Medicine,2017,39(3):237-239.
[18] 滑翔,胡中凯,黄小波,文心田,曹三杰,文翼平,伍锐,邓静,赵松,尹人杰,常晓霞,欧阳达,张仙. 检测猪流行性腹泻病毒、猪传染性胃肠炎病毒和猪轮状病毒的cDNA芯片的构建[J]. 畜牧兽医学报,2015,46(12):2235-2242.doi:10.11843/j.issn.0366-6964.2015.12.015.
Hua X,Hu Z K,Huang X B,Wen X T,Cao S J,Wen Y P,Wu R,Deng J,Zhao S,Yin R J,Chang X X,Ouyang D,Zhang X. Construction of cDNA microarray for detecting Porcine epidemic diarrhea virus, Porcine transmissible gastroenteritis virus and Porcine rotavirus[J]. Acta Veterinaria et Zootechnica Sinica,2015,46(12):2235-2242.doi:10.11843/j.issn.0366-6964.2015.12.015.
[19] Chen Q,Li J,Fang X E, Xiong W. Detection of Swine transmissible gastroenteritis coronavirus using loop-mediated isothermal amplification[J]. Virol J,2010,7:206. doi:10.1186/1743-422X-7-206.
[20] Li P C,Ren X F. Reverse transcription loop-mediated isothermal amplification for rapid detection of Transmissible gastroenteritis virus[J]. Curr Microbiol,2011,62(3):1074-1080. doi:10.1007/s00284-010-9825-9.
[21] 张小波. 猪传染性胃肠炎病毒M基因的克隆、表达及ELISA抗体检测方法的建立[D]. 保定:河北农业大学,2010.
Zhang X B. Cloning, expression of M gene of Porcine transmissible gastroenteritis virus and an indirect ELISA for the detection of viral antibodies with the expression produce[D]. Baoding:Hebei Agricultural University,2010.
[22] 乔薪瑗,李桂伟,张冠群,李海滨,李一经. 抗猪传染性胃肠炎M蛋白单克隆抗体的制备及部分特性鉴定[J]. 中国预防兽医学报,2007,29(11):874-878. doi:10.3969/j.issn.1008-0589.2007.11.011.
Qiao X Y,Li G W,Zhang G Q,Li H B,Li Y J. Production and identification of monoclonal antibodies against recombinant TGEV M protein[J]. Chinese Journal of Preventive Veterinary Medicine,2007,29(11):874-878.
[23] 任晓峰,邹昊,孙雪娇. 猪传染性胃肠炎病毒M蛋白的表达与抗体制备[J]. 东北农业大学学报,2014,45(4):83-87. doi:10.19720/j.cnki.issn.1005-9369.2014.04.016.
Ren X F,Zou H,Sun X J. Expression and polyclonal antibodies preparation of Porcine transmissible gastroenteritis virus M protein[J]. Journal of Northeast Agricultural University,2014,45(4):83-87.
[24] Rodák L, míd B,Nevoránková Z,Valícˇek L,Smítalová R. Use of monoclonal antibodies in blocking ELISA detection of Transmissible gastroenteritis virus in faeces of piglets[J]. J Vet Med B Infect Dis Vet Public Health, 2005,52(3):105-111. doi:10.1111/j.1439-0450.2005.00829.x.
míd B,Nevoránková Z,Valícˇek L,Smítalová R. Use of monoclonal antibodies in blocking ELISA detection of Transmissible gastroenteritis virus in faeces of piglets[J]. J Vet Med B Infect Dis Vet Public Health, 2005,52(3):105-111. doi:10.1111/j.1439-0450.2005.00829.x.
[25] Suo S,Wang X,Zarlenga D,Bu R E,Ren Y D,Ren X F. Phage display for identifying peptides that bind the spike protein of Transmissible gastroenteritis virus and possess diagnostic potential[J]. Virus Genes,2015,51(1):51-56. doi:10.1007/s11262-015-1208-7.
[26] Cai Y Q,Song Y L,Cen D W,Zhang C Q,Mao S S,Ye X X,Xiong Y R,Jiang P F,Chen J,Xue X Y,Zhang L F,Zhu G B. Novel ELISA for serodiagnosis of nasopharyngeal carcinoma based on a B cell epitope of Epstein-Barr virus latent membrane protein 2[J]. Oncol Lett,2018,16(4):4372-4378. doi:10.3892/ol.2018.9216.