玉米在我国农业生产中占有重要的地位,2016年我国玉米种植面积达4 805.7万hm2,是我国第一大农作物。玉米穗腐病(Maize ear rot),是世界玉米产区普遍发生的一类真菌病害,在生产上造成较为严重的产量损失,玉米的品质也受到严重影响[1]。玉米穗腐病的发病率一般为5%~10%,重发年份发病率为30%~40%,严重地块产量损失高达30%~40%[2]。玉米穗腐病由多种复杂的病原菌组成,如今已经有40多种致病菌种被鉴定出,该病的发生是由这些致病菌单独或复合侵染引起的[3-4]。目前,已报道的玉米穗腐病病原菌类群主要包括镰孢菌(Fusarium spp.)、青霉菌(Penicillium spp.)、木霉菌(Trichoderma spp.)、蠕孢菌(Helminthosporium spp.)和曲霉菌(Aspergillus spp.)等,其中镰孢菌为主要致病菌[5-6]。
不同国家和地区所报道的优势病原差异较大,Görtz等[7]通过分离2006,2007年所采集德国玉米穗腐病样品,发现不同年度间同一地区病原菌种类及优势病原菌存在差异,2006年分离到13种镰孢菌种,其中以拟轮枝镰孢菌(F. verticillioides)为优势种;2007年共有10种镰孢菌,以禾谷镰孢复合种(F. graminearum species complex)为优势种。在我国许多地区拟轮枝镰孢菌及禾谷镰孢复合种都为当地的优势致病菌,其中禾谷镰孢复合种则主要分布于山西、陕西、甘肃、云南、贵州等地,东北与黄淮也有较多分布,拟轮枝镰孢菌主要分布在黑龙江、吉林、辽宁、内蒙古、北京、河北、河南、山东、安徽、四川、湖南、湖北等地[8]。
山东省(34°22′N~38°23′N,114°19′E~122°43′E)地处东部沿海,黄河下游,东部面临黄海、渤海,西部深入内陆,总面积为15.78万km2,其中南部为山地和丘陵,西部和北部是平原,东部为和缓的丘陵。气候属于温带大陆性季风气候,春冬季降水少,易形成旱灾,夏季降水多,易发生涝灾[9]。山东省的自然条件适宜玉米生长,属黄淮海平原夏玉米区,位于中国玉米带的中心位置,其种植面积和总产均呈现上升趋势[10]。目前,我国主要从全国范围或玉米种植区研究玉米穗腐病,而关于山东省玉米穗腐病的单独报道尚未可见,为掌握山东省玉米穗腐病的优势病原,河北省农林科学院植物保护研究所玉米综防课题组对近3 a山东省不同地区的玉米穗腐病进行采样,对玉米穗腐病病样采用形态学和分子生物学相结合的方式进行分离鉴定,以明确其优势病原菌及年度间差异,为明确山东省拟轮枝镰孢菌在3个年份间的遗传关系及与外界的基因交流情况,以EF-1α基因序列为基础对3个年份间及与河北省间的拟轮枝镰孢菌DNA核苷酸进行系统发育分析,旨在为山东省深入开展对该病害的抗病育种、发生发展规律以及综合防治提供科学依据。
1 材料和方法
1.1 试验材料
玉米病样:在山东省各个地区分别对2015年(27),2016年(26),2017年(85)3 a玉米穗腐病样本进行采集工作,采集样本均为自然发病,总共138份,样品均用透气的纸袋包装后,在实验室进行病原菌的分离鉴定。
根据地理位置,将山东省大致分为5个区域,分别为鲁东(青岛、烟台)、鲁中(潍坊、莱芜、泰安)、鲁西北(东营、滨州、德州、聊城)、鲁西南(菏泽、济宁)、鲁中南(枣庄、临沂)。
马铃薯培养基(Potato dextrose agar,PDA):马铃薯200 g、葡萄糖20 g、琼脂20 g,蒸馏水定容至1 000 mL。
试剂:真菌基因组DNA提取试剂盒,北京艾德莱生物科技有限公司; 引物由生工生物工程(上海)股份有限公司合成;2×Es Taq MasterMix(含染料),北京康为世纪生物科技有限公司;Biowest Agarose G-10,南京生兴生物技术有限公司。
仪器:东胜龙ETC-811 PCR仪,北京中科星宇科技发展有限公司; GelDoc XR+凝胶成像分析系统,美国Bio-Rad公司;DYY-11型电泳仪,北京六一仪器厂。
1.2 试验方法
1.2.1 病原菌的分离鉴定 从每份采集样品中剥取病健交界处3~5粒玉米籽粒,将籽粒放入15 mL离心管中,向离心管中加入75%的酒精处理3 min,在1.5%的NaClO中浸泡表面消毒3 min,再用无菌水仔细冲洗3次,消毒完成后用无菌滤纸将籽粒表面多余的水分吸干,将籽粒置于马铃薯培养基上,放入25 ℃恒温光照培养箱内光照培养,待菌丝长出后及时挑取菌丝,进行纯化培养。观察菌落颜色、形态等性状,根据其在马铃薯培养基上的菌落形态、孢子的有无、大小、形态等特征,参考魏景超[11]和方中达[12]的方法对其进行初步鉴定,并提取纯化培养菌落的DNA,进行分子生物学鉴定,所用引物信息见表1。
PCR反应体系为:DNA模板1 μL、10 μmol/L的上下游引物各0.5 μL、Taq Mix 12.5 μL,再加入ddH2O补足至25 μL。PCR反应程序为:95 ℃预变性10 min;95 ℃变性1 min,56 ℃退火30 s,不同引物退火温度如表1所示,72 ℃延伸45 s,35个循环;72 ℃延伸10 min,4 ℃保存扩增产物。产物在1%的琼脂糖凝胶上电泳,将扩增出条带的PCR产物交由北京生物工程有限公司测序,测序结果在NCBI网站上进行Blast比对。
根据分子鉴定结果对玉米穗腐病病原菌的分离频率进行统计,病原菌分离频率=不同病原菌菌株数/总菌株数×100%。
表1 本研究所用引物
Tab.1 The primers used in this study
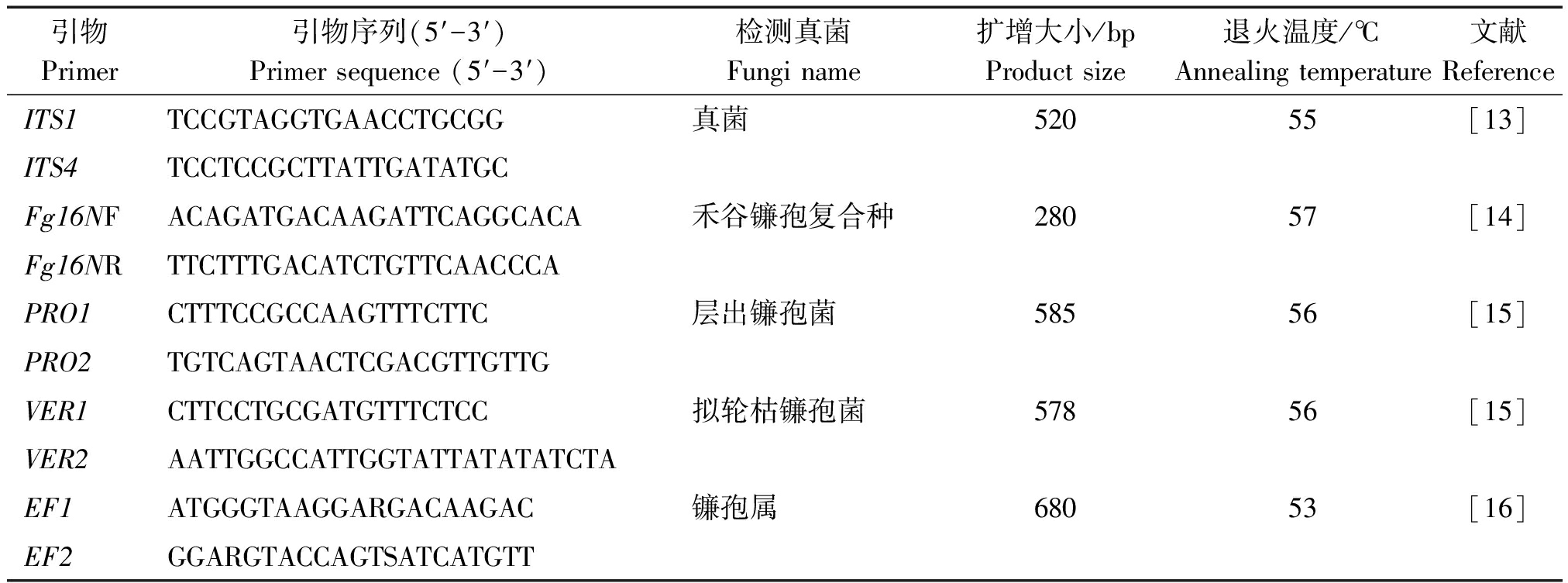
引物Primer引物序列(5′-3′)Primer sequence (5′-3′)检测真菌Fungi name扩增大小/bpProduct size 退火温度/℃Annealing temperature 文献ReferenceITS1TCCGTAGGTGAACCTGCGG真菌52055[13]ITS4TCCTCCGCTTATTGATATGCFg16NFACAGATGACAAGATTCAGGCACA禾谷镰孢复合种28057[14]Fg16NRTTCTTTGACATCTGTTCAACCCAPRO1CTTTCCGCCAAGTTTCTTC层出镰孢菌58556[15]PRO2TGTCAGTAACTCGACGTTGTTGVER1CTTCCTGCGATGTTTCTCC拟轮枯镰孢菌57856[15]VER2AATTGGCCATTGGTATTATATATCTAEF1ATGGGTAAGGARGACAAGAC镰孢属68053[16]EF2GGARGTACCAGTSATCATGTT
1.2.2 拟轮枝镰孢菌系统发育分析 将2015-2017年已鉴定为拟轮枝镰孢菌的84个菌株和2017年河北省的5个拟轮枝镰孢菌菌株基因组DNA进行PCR扩增后,得到了EF-1α大小为700 bp左右的目的片段,利用MEGA 5.2软件采用最大简约法(Maximum parsimony)构建其系统发育树,聚类树中节点处的置信度用1 000次自举法(Bootstrap)来完成[17]。
2 结果与分析
2.1 山东省玉米穗腐病病原菌种类及分离频率
2015-2017年从山东省采集的138份玉米穗腐病样本中共分离到7个属的18种真菌,其中有10种真菌有文献报道能够侵染玉米籽粒,引起穗腐病,而另外8种真菌,包括产紫青霉(P. purpurogenum)、微紫青霉(P. janthinellum)、嗜松青霉(P. pinophilum)、变红镰孢菌(F. incarnatum)、厚垣镰孢菌(F. chlamydosporum)、绳状青霉(P. funiculosum)、玉蜀黍帚枝菌(Sarocladium zeae)和枝状枝孢霉(C. cladosporioides)是否为玉米穗腐病的致病菌有待进行进一步的验证,因其分离频率较低,在此归为其他,在下文中不做进一步讨论。
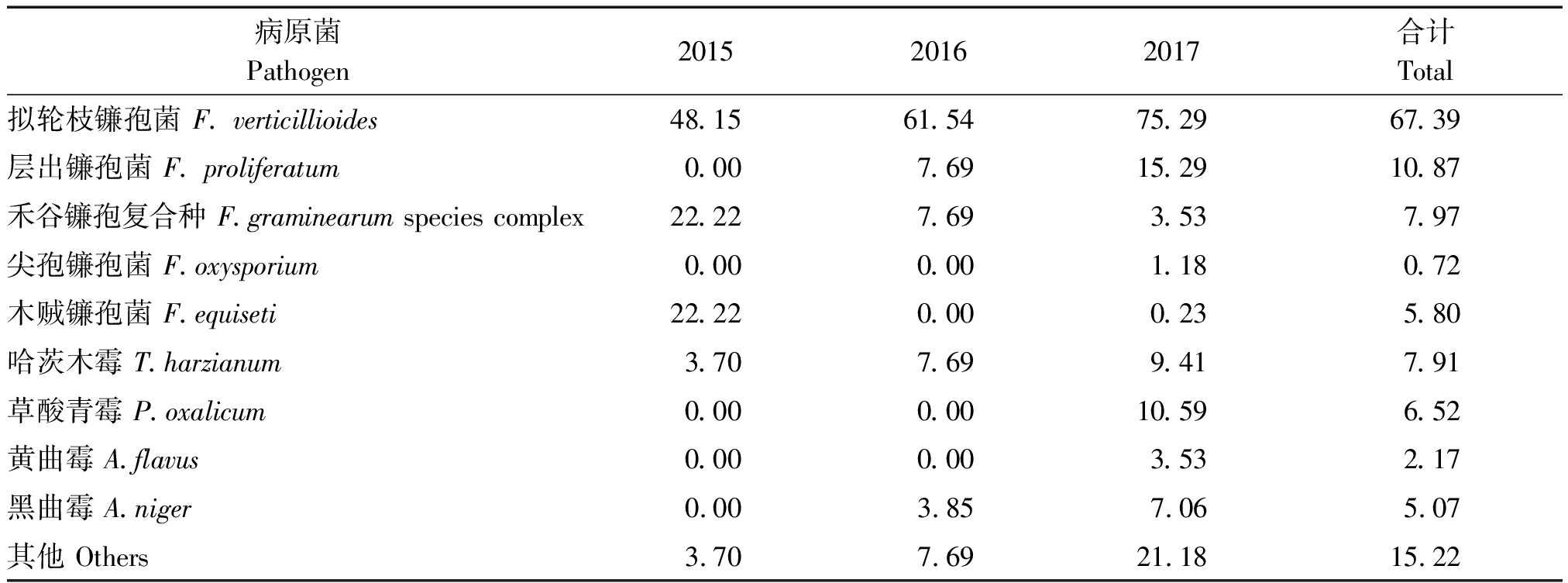
在分离到的病原菌中拟轮枝镰孢菌(F. verticillioides)分离频率最高,为67.39%,是山东省玉米穗腐病优势病原菌;其次为层出镰孢菌(F. proliferatum),分离频率为10.87%;禾谷镰孢复合种(F.graminearum species complex)、尖孢镰孢菌(F.oxysporium)和木贼镰孢菌分别(F.equiseti)为7.97%,0.72%,5.80%;哈茨木霉(T.harzianum)分离频率为7.91%;草酸青霉分离频率为6.52%(P.oxalicum);黄曲霉(A.flavus)和黑曲霉(A.niger)的分离频率分别为2.17%,5.07%(表2)。
2.2 山东省2015-2017年玉米穗腐病病原菌
由表2可知,拟轮枝镰孢菌连续3 a病原菌的分离频率均居于首位,2015-2017年拟轮枝镰孢菌的分离频率分别为48.15%,61.54%,75.29%,其分离频率随时间有所上升;层出镰孢菌2015年未分离到, 2017年分离频率为15.29%,高于2016年的7.69%;禾谷镰孢复合种2015年的分离频率为22.22%,远高于2016年和2017年的7.69%和3.53%;木贼镰孢菌2015年为22.22%,2016年未分离到,2017年为0.23%,存在较大差异;尖孢镰孢菌只在2017年分离到,分离频率为1.18%;哈茨木霉3 a的分离频率依次为3.70%, 7.69%,9.41%;草酸青霉和黄曲霉仅在2017年分离到,分离频率分别为10.59%和3.53%;黑曲霉在2016年和2017年的分离频率分别为3.85%和7.06%。
对于已经报道为玉米穗腐病病原菌的真菌,在2015年仅分离到4种,分别为拟轮枝镰孢菌、禾谷镰孢复合种、木贼镰孢菌和哈茨木霉;2016年分离到5种,分别为拟轮枝镰孢菌、层出镰孢菌、禾谷镰孢复合种、哈茨木霉和黑曲霉;2017年分离到9种,分别为拟轮枝镰孢菌、层出镰孢菌、禾谷镰孢复合种、尖孢镰孢菌、木贼镰孢菌、哈茨木霉、草酸青霉、黄曲霉和黑曲霉,在山东省引起玉米穗腐病病原菌的种类呈逐年上升趋势。
表2 山东省玉米穗腐病病原菌分离频率
Tab.2 Isolation frequency of Maize ear rot pathogen in Shandong Province %
病原菌Pathogen201520162017合计Total拟轮枝镰孢菌 F. verticillioides48.1561.5475.2967.39层出镰孢菌 F. proliferatum0.007.6915.2910.87禾谷镰孢复合种 F.graminearum species complex22.227.693.537.97尖孢镰孢菌 F.oxysporium0.000.001.180.72木贼镰孢菌 F.equiseti22.220.000.235.80哈茨木霉 T.harzianum3.707.699.417.91草酸青霉 P.oxalicum0.000.0010.596.52黄曲霉 A.flavus0.000.003.532.17黑曲霉 A.niger0.003.857.065.07其他 Others3.707.6921.1815.22
2.3 山东省玉米镰孢穗腐病病原菌的分布
由图1可知,在山东省5个区域中的优势病原菌均为拟轮枝镰孢菌,鲁西北、鲁西南、鲁东、鲁中和鲁中南的分离频率依次降低,分别为76.67%,73.08%,65.22%,61.29%,60.71%,西部地区分离频率高于中东部地区,这可能与天气因素有关;层出镰孢菌在鲁中、鲁东、鲁中南和鲁西北的分离频率依次为19.35%,13.04%,10.71%,10.00%;鲁西南地区禾谷镰孢复合种的分离频率高于其他地区,为15.38%;尖孢镰孢菌只在鲁东沿海地区分离到,分离频率为4.35%,木贼镰孢菌在鲁西北地区未分离到。
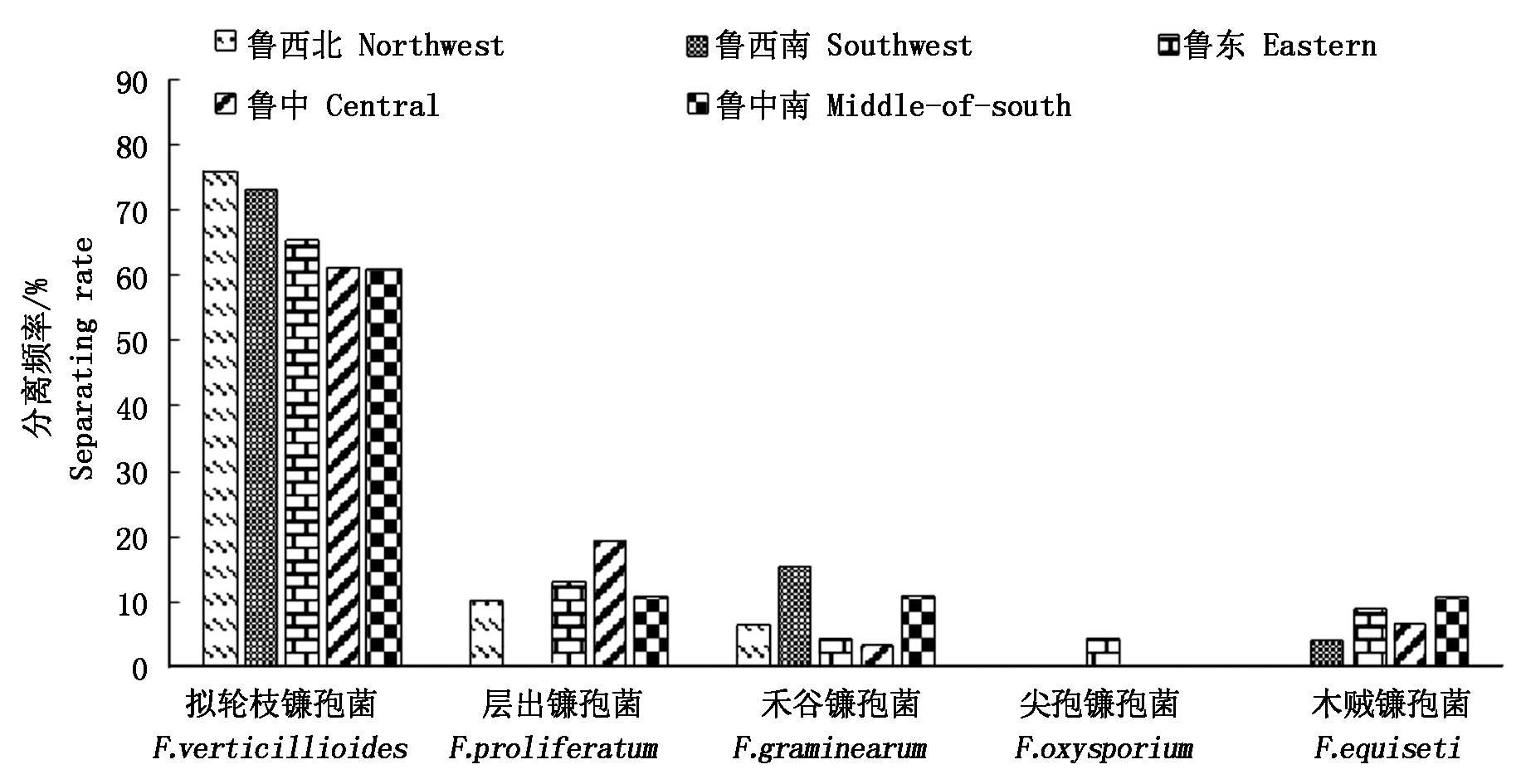
图1 山东省玉米穗腐镰孢菌的分离频率
Fig.1 Isolation frequency of Fusarium in Shandong Province
2.4 不同年度拟轮枝镰孢菌DNA核苷酸系统发育分析
如图2所示,各菌株最前方字母A、B和C分别代表2015,2016,2017年采集的12,13,59个菌株,D代表2017年河北省拟轮枝镰孢菌的5个菌株。将分离鉴定的89个菌株分为2个群,Ⅰ群和Ⅱ群间的遗传距离为0.002~0.016。Ⅰ群包含53个菌株,分别为7个2015年菌株、5个2016年菌株、37个2017年的菌株和4个2017年河北菌株,其菌株间遗传距离为0.000~0.007。Ⅱ群包含36个菌株,分别为5个2015年菌株、8个2016年菌株、22个2017年的菌株和1个2017年河北菌株,其菌株间遗传距离为0.000~0.007。
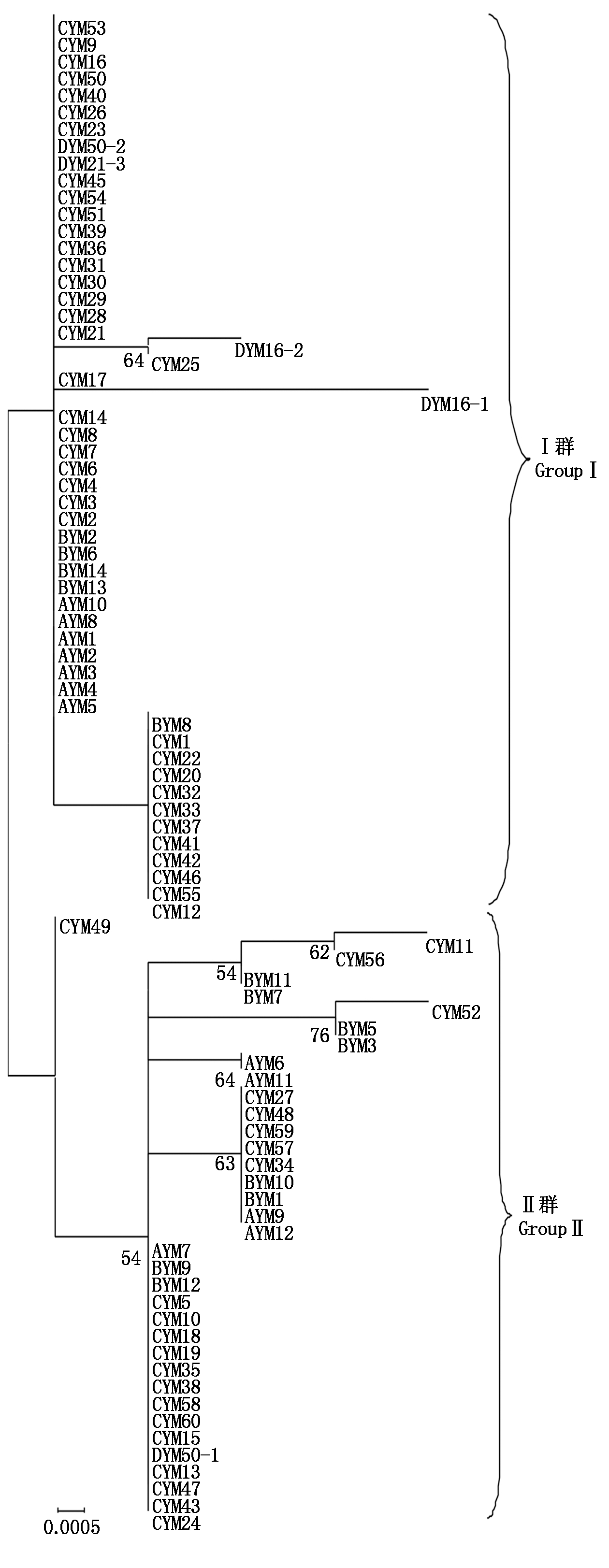
图2 基于EF-1α基因构建系统发育树
Fig.2 Phylogenetic tree of constructed based on EF-1α gene sequences
在Ⅰ群中2017年4个河北菌株DYM50-2、DYM21-3、DYM16-2和DYM16-1与2017年49个山东菌株聚集在一个分支上,在Ⅱ群中1个河北菌株DYM50-1与2017年除CYM49外的34个山东菌株聚集在一个分支上,表明2017年河北和山东省菌株遗传距离较小,亲缘关系较近,2个省份间存在频繁的基因交流。
如表3所示,2015和2016年年度间的遗传距离为0.003 6,2016和2017年为0.003 7,其遗传距离有所增高,但涨幅较低,年度间菌株遗传距离小,相似性较高。
表3 拟轮枝镰孢菌年度间的遗传距离
Tab.3 The annual genetic distance of the Fusarium verticillioides
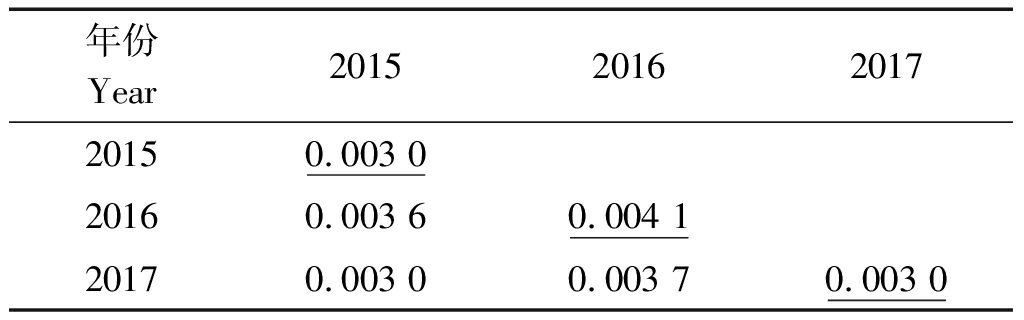
年份Year2015 201620172015 0.003 020160.003 6 0.004 120170.003 0 0.003 7 0.003 0
3 结论与讨论
本试验对山东省2015-2017年的玉米穗腐病病原菌进行了分离鉴定,结果显示,拟轮枝镰孢菌在3 a的分离频率均最高,为山东省玉米穗腐病的优势病原菌,这与孙华等[18]在2013,2015年山东省分离的优势病原菌一致。秦子惠[19]2009-2013年分离了18个省的穗腐样本,山东省的优势病原菌为拟轮枝镰孢菌。该菌同时也是甘肃、重庆、辽宁和河北省等地区的优势病原菌[20-23],而有些区域内镰孢菌种群结构及分布存在较大差异,如安徽凤阳的优势病原菌为禾谷镰孢菌[24],东北地区则为半裸镰孢菌[25],这可能与不同地区间的气候条件、玉米种植品种以及自然环境等因素有关,因此,明确不同生态区玉米穗腐病的优势致病菌,对于有针对性地开展防控相关研究具有重要的指导意义。
试验数据显示2015-2017年拟轮枝镰孢复合种和层出镰孢菌分离频率逐年上升,禾谷镰孢菌分离频率逐年下降,分析原因可能与天气有关,9月份是玉米灌浆至成熟期,玉米生殖器官生长较为旺盛,若此期间遭遇低温阴雨寡照天气,极易导致玉米被霉菌感染,造成穗腐病的发生[26],而禾谷镰孢复合种在温热潮湿的气候条件下容易发生,拟轮枝镰孢菌和层出镰孢菌更喜欢干热的环境[27-28],山东减灾网数据显示,2017年山东省9月降雨量较往年偏少54.0%,而 2015年山东省8月底到9月初连续降雨[29-30],2 a的气温较往年都有所偏高,适宜的外部环境有可能导致拟轮枝、层出和禾谷镰孢复合种的发生。试验发现2015年木贼镰孢菌的分离频率较高,我国对木贼镰孢菌研究相对较少,具体原因有待进一步研究。其他菌株不同年份具有不同的病原菌分离频率,这可能是因为不同年份间的气候状况,如温度、降雨量等是影响病原菌发生的主要因素。另外,该省不同地区镰孢菌的群落结构也存在一定的差异,拟轮枝镰孢菌广泛分布于山东省各个玉米生产区,而层出镰孢菌主要分布于鲁东和鲁中地区,禾谷镰孢复合种主要分布在鲁西南地区,这可能与各个不同地区的栽培制度、气候环境条件及栽培品种等各种不可控因素有关。
由系统发育分析可知,Ⅰ群和Ⅱ群间的遗传距离为0.002~0.016,菌株间的遗传距离较小,随着时间的推移各个菌株间遗传距离有所变化但分化程度较低。Chulze等[31]对轮枝镰孢玉米分离群体的研究表明其同质化趋势较高,分析认为这可能与其试验中所获得的分离物来自单一玉米品种(Pioneer 32K61)有关[32]。以2017年为例,农业部全国农技推广中心统计数据显示,2017年山东省种植面积超过13万hm2的品种有6个,其中“类958”品种(登海605、先玉335)共67万hm2,“类335”品种(郑单958、浚单20、伟科702、隆平206)共117万hm2,目前,“类958”和“类335”品种的选育和推广造成主栽品种同质化严重,遗传基础狭窄,使病原菌保持了一定遗传上的稳定性,这是引起轮枝镰孢遗传距离较小的主要原因。另一方面,本试验将2017年分离的5个河北省拟轮枝镰孢菌株与山东省2015-2017年的菌株进行了分析比较,发现虽然河北省的5个菌株与山东省菌株遗传距离较小,但仍可以获得不同的遗传组群,同一地区分离物不能完全聚为一群,而不同地区的一些分离物又具有极高遗传相似性,这是由于拟轮枝镰孢具有多种传播途径,其中一种传播方式是通过种子携带,随玉米材料在不同育种地域以及从制种基地向生产区域的传播,使得拟轮枝镰孢在不同地域间得到了广泛的种群和基因交流。同时可以以风为媒介传播,从地理位置上分析,河北和山东省接壤,临近渤海和黄海,且我国处在东亚季风气候区,夏季由东南向西北刮东南风,而冬季由西北向东南刮西北风,这有利于拟轮枝镰孢菌的孢子随着季风进行双向传递交流,导致了两省份间存在较频繁的基因交流,使不同地理来源的菌株基因趋于一致,并继而在不同基因类型和不同生态区玉米品种的选择下继续病菌基因的选择变异。
通过对山东省玉米穗腐病的研究,明确了拟轮枝镰孢菌为山东省的优势病原菌,并且在山东省3 a间稳定存在,且山东省和河北省拟轮枝镰孢菌存在基因交流,此后山东省应加强种子检疫工作,积极培育抗病品种,减少病原菌的人为传播,玉米穗腐病的防治重点应以拟轮枝镰孢菌为主,研究其对玉米穗腐病的循环侵染规律,为穗腐病的病害防治提供理论依据。
[1] 任旭. 我国玉米穗腐病主要致病镰孢菌多样性研究[D]. 北京:中国农业科学院,2011.doi:10.7666/d.Y1932401.
Ren X. Diwersitu analyses of Fusarium spp., the main causal agents of maize ear rot in China[D]. Beijing:Chinese Academy of Agricultural Sciences, 2011.
[2] Mesterházy á, Lemmens M, Reid L M. Breeding for resistance to ear rots caused by Fusarium spp. in maize-a review [J]. Plant Breeding, 2012, 131(1):1-19. doi:10.1111/j.1439-0523.2011.01936.x.
[3] 段灿星,王晓鸣,宋凤景,孙素丽,周丹妮,朱振东.玉米抗穗腐病研究进展[J].中国农业科学,2015,48(11):2152-2164. doi:10.3864/j.issn.0578-1752.2015.11.007.
Duan C X, Wang X M, Song F J, Sun S L, Zhou D N, Zhu Z D. Advances in research on maize resistance to ear rot[J].Scientia Agricultura Sinica,2015,48(11):2152-2164.
[4] 胡韬纲.玉米穗腐病研究进展[J].粮食科技与经济,2015,40(3):50-52.doi:10.16465/j.gste.cn431252ts.20150315.
Hu T G. Research progress on maize ear rot[J]. Grain Science and Technology and Economy, 2015, 40(3):50-52.
[5] 席靖豪. 黄淮海夏玉米穗腐病病原多样性分析及玉米新品种抗病性鉴定[D].郑州:河南农业大学,2018.
Xi J H. Pathogen diversity of summer maize ear rot in Huang-Huai-Hai region and resistance identification of new maize cultivars[D]. Zhengzhou:Henan Agricultural University, 2018.
[6] Stumpf R,dos Santos J,Gomes L B,Silva C N,Tessmann D J,Ferreira F D,Junior M M,Del Ponte E M.Fusarium species and fumonisins associated with maize kernels produced in Rio Grande do Sul State for the 2008/09 and 2009/10 growing seasons[J].Brazilian Journal of Microbiology,2013,44(1):89-95. doi:10.1590/S1517-83822013000100012.
[7] Görtz A, Oerke E C, Steiner U, Waalwijk C,Vries I D,Dehne H W. Biodiversity of Fusarium species causing ear rot of maize in Germany[J]. Cereal Research Communications, 2008, 36(S6) :617-622.doi:10.1556/CRC.36.2008.Suppl.B.51.
[8] 秦子惠,任旭,江凯,武小菲,杨知还,王晓鸣.我国玉米穗腐病致病镰孢种群及禾谷镰孢复合种的鉴定[J].植物保护学报,2014,41(5):589-596. doi:10.13802/j.cnki.zwbhxb.2014.05.032.
Qin Z H, Ren X, Jiang K, Wu X F, Yang Z H, Wang X M. Identification of Fusarium species and F.graminearum species complex causing maize ear rot in China[J]. Acta Phytophylacica Sinica,2014,41(5):589-596.
[9] 燕玉超,张福平,刘筱,雷声剑.河南省气候变化特征及其对旱涝的影响[J].中国沙漠,2016,36(3):777-786.doi:10.7522/j.issn.1000-694X.2015.00080.
Yan Y C, Zhang F P, Liu X, Lei S J. Climate change and its influence on drought and flood in Henan, China[J]. Journal of Desert Research, 2016, 36(3):777-786.
[10] 朱峰,孙兆明, 李树超.山东省玉米生产现状与发展对策分析[J].农业科技通讯,2015(3):6-9,12.doi:10.3969/j.issn.1000-6400.2015.03.002.
Zhu F, Sun Z M, Li S C. Analysis of corn production status and development countermeasures in Shandong Province[J]. Bulletin of Agricultural Science and Technology, 2015(3):6-9,12.
[11] 魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社,1979.
Wei J C. Fungal identification manual [M].Shanghai:Shanghai Science and Technology Press, 1979.
[12] 方中达. 植病研究法 [M]. 3版.北京:中国农业出版社,1998.
Fang Z D. Plant disease research method [M].The third edition. Beijing:China Agriculture Press, 1998.
[13] White T J, Bruns T, Lee S, Taylor J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics [J]. PCR Protocols:a Guide to Methods and Applications, 1990, 18:315-322.doi:10.1016/B978-0-12-372180-8.50042-1.
[14] Nicholson P, Simpson D R, Weston G, Rezanoor H N,Lees A K,Parry D W,Joyce D. Detection and quantification of Fusarium culmorum and Fusarium graminearum in cereals using PCR assays [J]. Physiological and Molecular Plant Pathology, 1998, 53(1):17-37.doi:10.1006/pmpp.1998.0170.
[15] Mulè G, Susca A, Stea G, Moretti A. A species-specific PCR assay based on the calmodulin partial gene for identification of Fusarium verticillioides, F. proliferatum and F. subglutinans [J]. European Journal of Plant Pathology, 2004, 110 (5/6):495-502.doi:10.1023/b:ejpp.0000032389.84048.71.
[16] O′Donnell K, Ward T J, Aberra D, Kistlercd H C,Aokie T,Orwiga N,Kimuraf M,Bjørnstadb Å,Klemsdalb S S.Multilocus genotyping and molecular phylogenetics resolve a novel head blight pathogen within the Fusarium graminearum species complex from Ethiopia [J]. Fungal Genetics and Biology, 2008, 45(11):1514-1522.doi:10.1016/j.fgb.2008.09.002.
[17] 石琳,段霞瑜,高洁,周益林,曹世勤,张勃.甘肃南部小麦白粉菌群体的毒性及多基因片段分析[J].植物病理学报,2014,44(4):414-421. doi:10.13926/j.cnki.apps.2014.04.010.
Shi L, Duan X Y, Gao J, Zhou Y L, Cao S Q, Zhang B. Virulence and multigene analyses of the wheat powdery mildew population in Southern Gansu[J]. Acta Phytopathologica Sinica, 2014, 44(4):414-421.
[18] 孙华,张海剑,郭宁,石洁,陈丹,马红霞.黄淮海夏玉米主产区穗腐病病原菌的分离鉴定[J].植物保护学报,2017,44(5):796-802.doi:10.13802/j.cnki.zwbhxb.2017.2016078.
Sun H, Zhang H J, Guo N, Shi J, Chen D, Ma H X. Isolation and identification of pathogens causing maize ear rot in Huang-Huai-Hai summer corn region[J]. Journal of Plant Protection, 2017,44(5):796-802.
[19] 秦子惠. 玉米穗腐病致病镰孢特征及玉米-小麦致病镰孢关系研究[D].北京:中国农业科学院,2014.
Qin Z H. Characterists of Fusarium species causing maize ear rot and relationship of pathogenic Fusarium spp. between maize and wheat[D]. Beijing:Chinese Academy of Agricultural Sciences Dissertation, 2014.
[20] 郭成,魏宏玉,郭满库,何苏琴,金社林,陈红梅,王晓鸣,郭建国.甘肃玉米穗腐病样品中轮枝镰孢菌的分离鉴定及生物学特性[J].植物病理学报,2014,44(1):17-25. doi:10.13926/j.cnki.apps.2014.01.003.
Guo C,Wei H Y,Guo M K,He S Q,Jin S L,Chen H M,Wang X M,Guo J G. Isolation,identification and biological characteristics of Fusarium verticillioides from maize ear rot sam ples in Gansu Province[J].Acta Phytopathologica Sinica, 2014, 44(1):17-25.
[21] 周丹妮,王晓鸣,李丹丹,杨洋,陈国康,段灿星.重庆及周边地区玉米穗腐病致病镰孢菌的分离与鉴定[J].植物保护学报,2016,43(5):782-788. doi:10.13802/j.cnki.zwbhxb.2016.05.011.
Zhou D N,Wang X M, Li D D, Yang Y,Chen G K, Duan C X. Isolation and identification of Fusarium species causing maize ear rot in Chongqing and its vicinity[J].Journal of Plant Protection,2016,43(5):782-788.
[22] 肖淑芹,许佳宁,闫丽斌,隋韵涵,薛春生,陈捷.辽宁省玉米镰孢穗腐病病原菌的鉴定与分布[J].植物保护学报,2017,44(5):803-808. doi:10.13802/j.cnki.zwbhxb.2017.2016056.
Xiao S Q, Xu J N, Yan L B, Sui Y H, Xue C S, Chen J. Identification and distribution of Fusarium species causing maize ear rot in Liaoning Province[J]. Journal of Plant Protection, 2017, 44(5):803-808.
[23] 孙华,丁梦军,张家齐,石洁,郭宁,李坡.河北省穗腐病病原菌鉴定及潜在产伏马毒素镰孢菌系统发育分析[J].植物病理学报, 2019, 49 (2):151-159.doi:10.13926/j.cnki.apps.000284.
Sun H, Ding M J, Zhang J Q, Shi J, Guo N, Li P. Identification of pathogens causing maize ear rot and the phylogenetic analysis of fumonisins-producing Fusarium species in Hebei Province[J]. Acta Phytopathologica Sinica, 2019, 49 (2):151-159.
[24] 许大凤,张海珊,李廷春,齐耀程,姜超强,周本国.安徽凤阳玉米穗腐病病原菌的分离鉴定[J].安徽农业科学,2017,45(25):145-148,150. doi:10.13989/J.cnki.0517-6611.2017.25.046.
Xu D F,Zhang H S,Li T C,Qi Y C,Jiang C Q,Zhou B G. Isolation and identification of the pathogen of maize ear rot in Fengyang,Anhui Province[J]. Journal of Anhui Agricultural Sciences, 2017, 45(25):145-148,150.
[25] 张婷,孙晓东,吕国忠.我国东北地区玉米穗腐镰孢菌的种类及其分离频率[J].菌物研究,2011,9(1):9-14,36. doi:10.13341/j.jfr.2011.01.006.
Zhang T, Sun X D, Lü G Z. Fusarium species and its isolation frequency from rot ears of maize in Northeast China[J]. Journal of Fungal Research, 2011, 9(1):9-14,36.
[26] 高艳,李艳荣,王秀丽. 开封市1980-2009年9月份降雨情况对玉米品质的影响[J]. 河南农业,2011(1):54. doi:10.3969/j.issn.1006-950X.2011.01.047.
Gao Y, Li Y R, Wang Y L. Effects on maize quality of rainfall from 1980 to September 2009 in Kaifeng City [J]. Agriculture of Henan, 2011(1):54.
[27] Bottalico A. Fusarium diseases of cereals:species complex and related mycotoxin profiles, in Europe[J]. Journal of Plant Pathology, 1998, 80(2):85-103. doi:10.2307/41997909.
[28] Logrieco A,Mulè G,Moretti A, Bottalico A. Toxigenic Fusarium species and mycotoxins associated with maize ear rot in Europe[J].European Journal of Plant Pathology, 2002,108(7):597-609. doi:10.1023/A:1020679029993.
[29] 宋嘉佳,王娜,伯忠凯,康桂红.2015年秋季(9-11月)山东天气评述[J].山东气象,2015,35(4):50-52.doi:10.19513/j.cnki.issn1005-0582.2015.04.011.
Song J J, Wang N, Bo Z K, Kang G H. A review of the weather in Shandong during the autumn of 2015 (September-November)[J]. Journal of Shandong Meteorology, 2015, 35(4):50-52.
[30] 王文青,万明波,孟祥新,康桂红,李静.2015年夏季(6-8月)山东天气评述[J].山东气象,2015,35(3):52-55. doi:10.19513/j.cnki.issn1005-0582.2015.03.013.
Wang W Q, Wan M B, Meng X X, Kang G H, Li J. A review of the weather in Shandong during the summer of 2015 (June-August)[J]. Weather of Shandong,2015,35(3):50-52.
[31] Chulze S N, Ramirez M L, Torres A, Leslie J F. Genetic variation in Fusarium section Liseola from no-till maize in Argentina[J]. Applied and Environmental Microbiology, 2000, 66(12):5312-5315. doi:10.1128/AEM.66.12.5312-5315.2000.
[32] 任旭,朱振东,李洪杰,段灿星,王晓鸣.轮枝镰孢SSR标记开发及在玉米分离群体遗传多样性分析中的应用[J].中国农业科学,2012,45(1):52-66. doi:10.3864/j.issn.0578-1752.2012.01.007.
Ren X, Zhu Z D, Li H J, Duan C X, Wang X M. SSR Marker development and analysis of genetic diversity of Fusarium verticillioides isolated from maize in China[J]. Scientia Agricultura Sinica, 2012,45(1):52-66.