烤烟是我国重要的经济作物,连作现象十分普遍[1]。烤烟长期连作产生了一系列的生产问题,特别是造成土壤养分失调、土壤生物化学过程受阻、土壤有害物质逐年积累导致烤烟生长受抑制,烟叶产量品质降低等[2-4],可以看出长期连作的多重负面叠加效应严重影响烤烟生产的可持续发展[5]。在土壤生物区系中土壤微生物群落是最重要的成分之一[6-8],土壤环境条件变化会引起土壤微生物群落组成、结构、数量、生理生化活性的迅速改变[9],常用作土壤质量和土壤生态系统良好的重要指标[10]。现阶段的研究多集中在植烟土壤微生物酶活性、植烟土壤微生物量碳、植烟土壤细菌数量等方面,而对植烟土壤微生物碳代谢的研究则鲜见报道。施用绿肥是农业中重要和较为普遍的增产手段[11]。绿肥作为一种重要的有机肥料,可以改良土壤结构、增强土壤肥力和提高作物产量[12-14]。有研究表明,施入绿肥可对土壤养分的循环和微生物群落多样性起积极作用[15-18]。
本试验通过Biolog技术对牡丹江烟草研究所试验地套作绿肥后的烟草生长团棵期、成熟期的土壤微生物多样性和群落结构进行研究,揭示绿肥对植烟土壤微生物碳代谢的影响,为烟草种植过程中的绿肥套作模式提供理论依据。
1 材料和方法
1.1 研究区概况
试验地在黑龙江省牡丹江市烟草科研所试验田,试验田地处寒带东部,东经 128°02′~131°18′,北纬 43°24′~45°59′ 。全年日照时间约 2 400 h,年平均气温6.1 ℃,无霜期 140 d,年降水量约 580 mm。供试土壤为暗棕土。试验地块土壤肥力均匀一致,土壤质地为黏壤土,土壤类型为河淤土,土壤pH值7.2 ,碳、氮、硫含量分别为 1.37%,0.26%,0.07%,有机质含量为 23.1 g/kg、碱解氮为89.55 mg/kg、有效磷为 21.59 mg/kg、速效钾为 165.45 mg/kg。
1.2 供试材料
供试烟草:龙江911。供试绿肥:黑麦草(Lolium perenne L.)、草木犀(Melilotus officinalis(L.)Pall.)。上述供试材料均由黑龙江省牡丹江市烟草研究所提供。
1.3 试验设计
试验为定位试验,随机区组设计,每个处理 3重复, 9 行小区,6 m行长,垄距 1.1 m,每个小区面积 59.4 m2,共计用地 0.11 hm2。试验地 2016 年烤烟与绿肥套作,烤烟5 月移栽,绿肥 7 月下旬播种。具体处理为:烤烟与黑麦草套种;烤烟与草木犀套种;不种绿肥(CK)。烤烟采收结束后,将烟秆清理, 2016 年 11 月初将绿肥翻耕, 2017 年 4 月起垄, 5 月烤烟移栽。
1.4 土壤样品采集
2017 年6月(团棵期)、10月(成熟期)按五点取样法选取植株,去掉表层土壤,用铁铲垂直向下挖取 0 ~20 cm土壤。剔除土壤样品中的杂物,装入封口袋,将样品置于冰盒内带回实验室。过筛,存放于 4 ℃冰箱,用于Biolog-Eco板测定。
1.5 土壤微生物群落功能多样性分析
应用Biolog微平板(ECO Micro Plate)测定土壤微生物对碳源的利用情况。参考Classen等[19]的方法,现将土壤样品在 25 ℃下活化 24 h,称取相当于 10 g烘干土质量的鲜土加入盛有90 mL灭菌的NaCl溶液中,加无菌封口膜,将样品振荡 1 min,然后冰浴 1 min,反复 3 次。静置 2 min再稀释,逐渐稀释为 10-2和 10-3的悬浮液。向微板每孔中加人 150 μL 的10-3的土壤悬浮液,将微孔板置于 25 ℃培养箱内连续培养 9 d,分别在0,24,48,72,96,120,144,168,192,216,240,264 h用酶标仪(Sunrise remote,TECAN)测定 590 nm处吸光值。
1.6 数据处理
土壤微生物对碳源的利用可以用平均颜色变化率(Average well color development,AWCD,即RAWCD)来描述,即对单一碳源的利用情况,其计算方法[20]中,Bi为所测定的第i个碳源孔的光密度值,A为对照孔的光密度值。采用微平板培养 96 h的数据进行分析,此时大部分的微生物均已参与碳源的代谢过程,能清晰地描述微生物群落的轮廓。采用均匀度指数(H)、Simpson指数(D)和优势度指数(U)来描述土壤微生物群落对碳源的代谢多样性。其中,Ei为第i孔的吸光值与平板吸光值总和的比率,ni是第i孔的吸光值。
1.7 数据分析
对数据统计分析使用Excel 2003,单因素方差分析和主成分分析使用SPASS。
2 结果与分析
2.1 不同绿肥及植烟不同时期根际土壤微生物利用全部碳源的动力学特征
平均颜色变化率可以描述土壤微生物群落对碳源的利用程度,表征土壤中微生物代谢活性。图 1 显示,时间增加,土壤微生物群落对碳源的利用总量逐渐增长直至平缓,但套作不同绿肥土壤微生物群落 AWCD 增长趋势不同。 0~96 h 内,AWCD 值快速增长,说明土壤微生物对碳源的代谢能力极强,且团棵期的处理AWCD值显著高于成熟期处理。培养时间达到96~192 h后AWCD 缓慢增加直至趋于稳定。其中团棵期、成熟期套作草木犀的处理AWCD值增长最快,整个培养过程中土壤微生物碳代谢活性最强。对照处理显著低于套作绿肥处理,说明套作绿肥增强了土壤微生物群落对碳源代谢的能力。
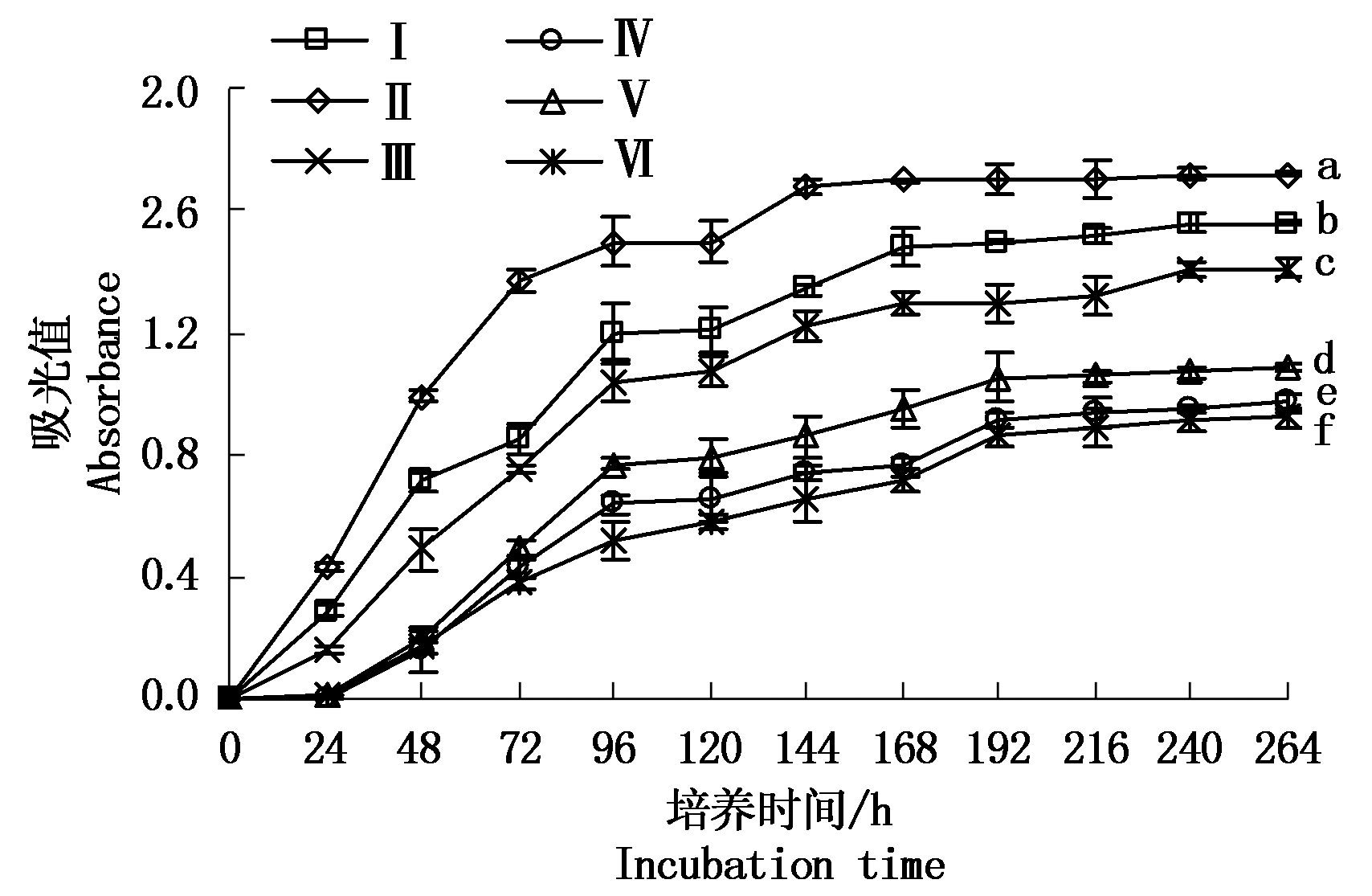
Ⅰ.团棵期黑麦草;Ⅱ.团棵期草木犀;Ⅲ.团棵期对照;Ⅳ.成熟期黑麦草;Ⅴ.成熟期草木犀;Ⅵ.成熟期对照。不同小写字母的表示处理间 5%水平差异。表1、图2-3同。
Ⅰ. Rosettestage Lolium;Ⅱ. Rosettestage Melilotus officinalis;Ⅲ. Rosettestage control;Ⅳ. Maturity stage Lolium;Ⅴ.Maturity stage Melilotus officinalis;Ⅵ.Maturity stage control. Different letters indicate 5% significant difference. The same as Tab.1,Fig.2-3.
图1 土壤微生物群落随着培养时间的变化
Fig.1 AWCD changes of different treatments during different incubation times
2.2 不同绿肥及植烟不同生长时期土壤微生物群落多样性指数分析
多样性指数表征土壤微生物群落对不同碳源的利用程度,可以描述土壤微生物群落整体的变化。Shannon指数可以描述土壤中微生物群落的丰富程度,Simpson指数可以描述土壤微生物群落中常见的物种的优势程度,Mclntosh指数可以描述土壤微生物群落的物种的均一程度。从表 1 可以看出,套作黑麦草、草木犀与对照相比在团棵期Shannon指数、Simpson指数、Mclntosh指数差异均达显著水平(P<0.05),说明套作绿肥后在团棵期土壤微生物群落丰富度、常见物种的优势度和均一性都发生较大的变化。套作黑麦草、草木犀后在成熟期,土壤微生物群落物种丰富度及均一性变化较为明显。套作草木犀Simpson指数与对照差异显著,但套作黑麦草Simpson指数与对照无显著差异,说明套作不同种类的绿肥对土壤微生物群落常见物种的优势度有显著影响。团棵期各处理的Shannon指数、Simpson指数、Mclntosh指数均显著高于成熟期各处理,说明在团棵期土壤微生物群落丰富度、优势度、均一性上与成熟期差异显著。此外结果还显示,套作草木犀各项指数均高于套作黑麦草。此结果与根际土壤微生物AWCD的变化一致。
表1 植烟土壤微生物群落在培养96 h 时AWCD值和多样性指数
Tab.1 AWCD and diversity index of microbial communities in tobacco growing soil at 96 h
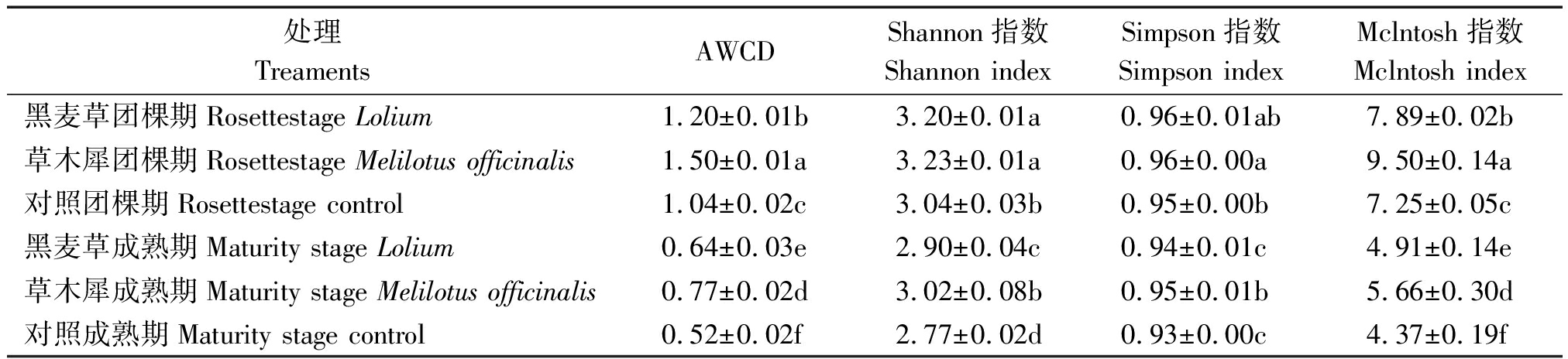
处理TreamentsAWCDShannon指数Shannon indexSimpson指数Simpson indexMclntosh指数Mclntosh index黑麦草团棵期Rosettestage Lolium1.20±0.01b3.20±0.01a0.96±0.01ab7.89±0.02b草木犀团棵期Rosettestage Melilotus officinalis1.50±0.01a3.23±0.01a0.96±0.00a9.50±0.14a对照团棵期Rosettestage control1.04±0.02c3.04±0.03b0.95±0.00b7.25±0.05c黑麦草成熟期Maturity stage Lolium0.64±0.03e2.90±0.04c0.94±0.01c4.91±0.14e草木犀成熟期Maturity stage Melilotus officinalis0.77±0.02d3.02±0.08b0.95±0.01b5.66±0.30d对照成熟期Maturity stage control0.52±0.02f2.77±0.02d0.93±0.00c4.37±0.19f
2.3 不同绿肥及植烟不同时期土壤微生物对6 大类碳源的利用强度
31 种碳源分为6大类,分别为胺类、氨基酸类、羧酸类、其他化合物类、聚合物类和糖类。套作不同绿肥的土壤微生物群落对不同碳源的代谢强度如图 2。从图中可以看出,不同绿肥及不同生长时期土壤微生物对糖类、羧酸类和氨基酸类等碳源的利用程度明显高于其他另 3 类碳源。套作黑麦草和草木犀在团棵期土壤微生物群落对氨/胺类、氨基酸类、羧酸类和糖类的利用程度有显著性差异。团棵期土壤微生物对糖类、其他化合物和氨基酸的利用程度明显高于成熟期。成熟期对照处理土壤微生物群落对其他化合物类和糖类的利用程度最低。
2.4 不同绿肥及植烟不同时期土壤微生物对碳源利用多样性的主成分分析
将不同样本的多元变量重新组合成一组新的互相无关的综合变量,这些综合变量尽可能多的反映原来变量的信息的统计方法叫主成分分析。在空间中,点的位置反映不同生长时期套作不同绿肥的土壤微生物群落的多样性和对碳源利用的代谢程度。应用主成分分析在 31 种因子中提取了3 个主成分因子,其分别解释所有变量43.04 %,15.23%,9.46%,3种主成分的累计贡献率 64.89%,可以解释变量的绝大部分信息(表2)。
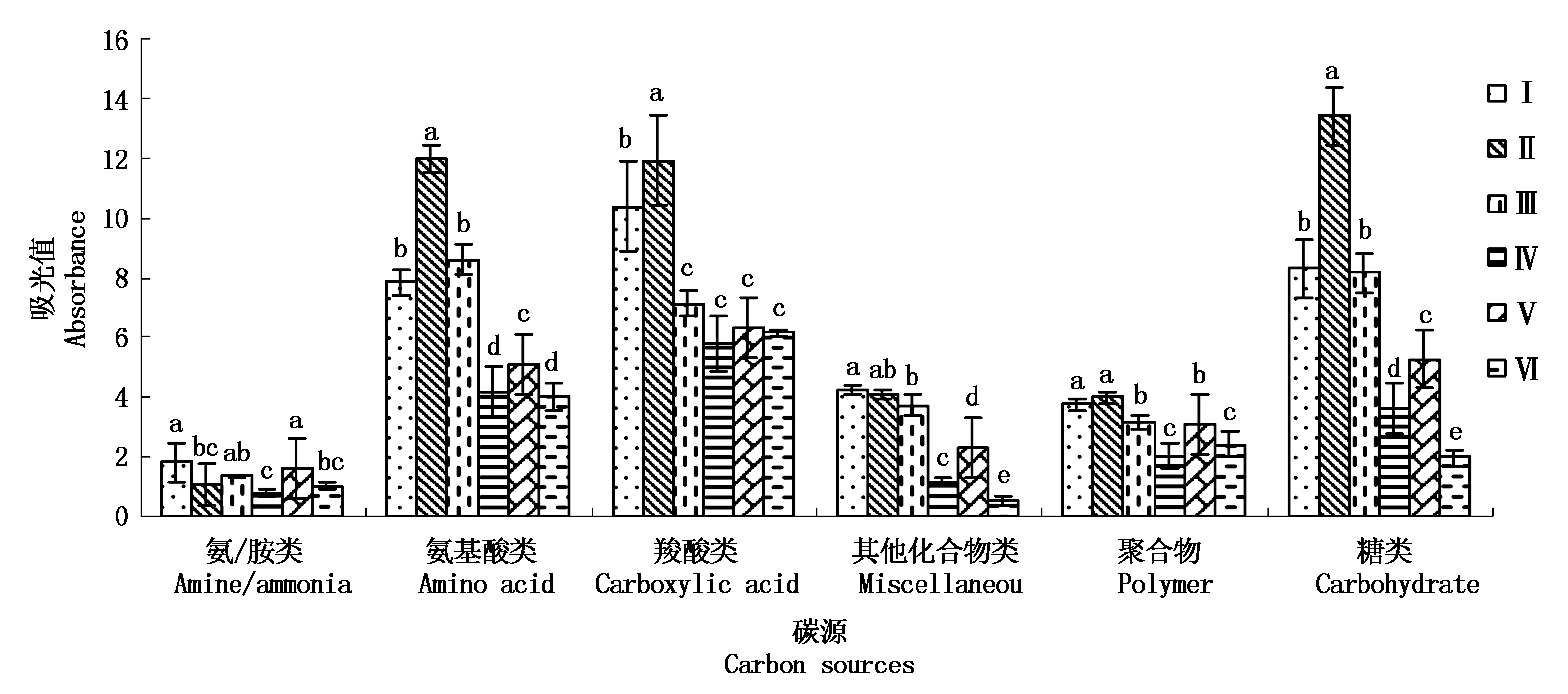
图2 套作不同绿肥土壤微生物对不同碳源的利用水平
Fig.2 Utilization of different carbon sources by soil microorganisms under intercropping with different green fertilizers
表2 主成分的贡献率和累计贡献率
Tab.2 Principal component contribution rate and accumulated contribution rate %
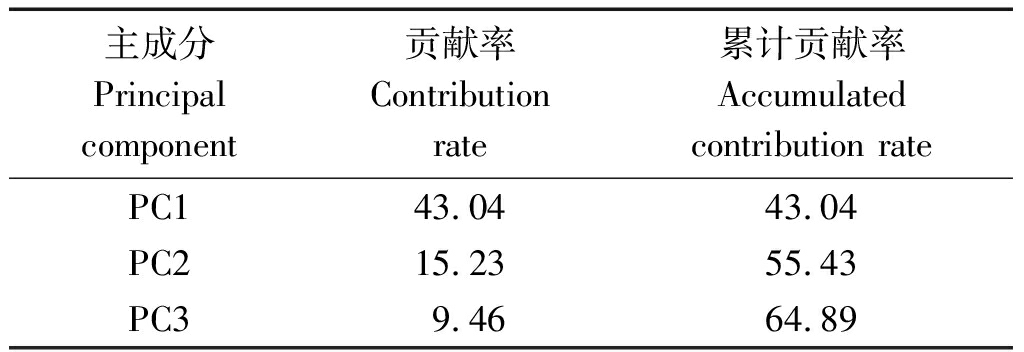
主成分Principal component贡献率Contribution rate累计贡献率Accumulated contribution ratePC143.0443.04PC215.2355.43PC39.4664.89
不同生长时期和套作不同绿肥在PC轴上差异显著如图3。在PC1轴上团棵期在正方向上,黑麦草得分系数为 4.52~6.55 ,草木犀得分系数10.66~11.28,对照得分系数3.89~4.69。成熟期主要分布在负方向上,得分系数为-1.85~0.16。在PC2轴上团棵期套作黑麦草正方向上,得分系数为 2.05~4.78,套作草木犀和空白处理在负方向上,得分系数分别为-3.79~-1.20和-0.75~-0.44,成熟期套作黑麦草和空白集中分布在原点附近。不同生长时期和绿肥在PC轴上呈现不同空间分布,说明不同生长时期和不同绿肥对碳源的利用种类和程度存在差异。
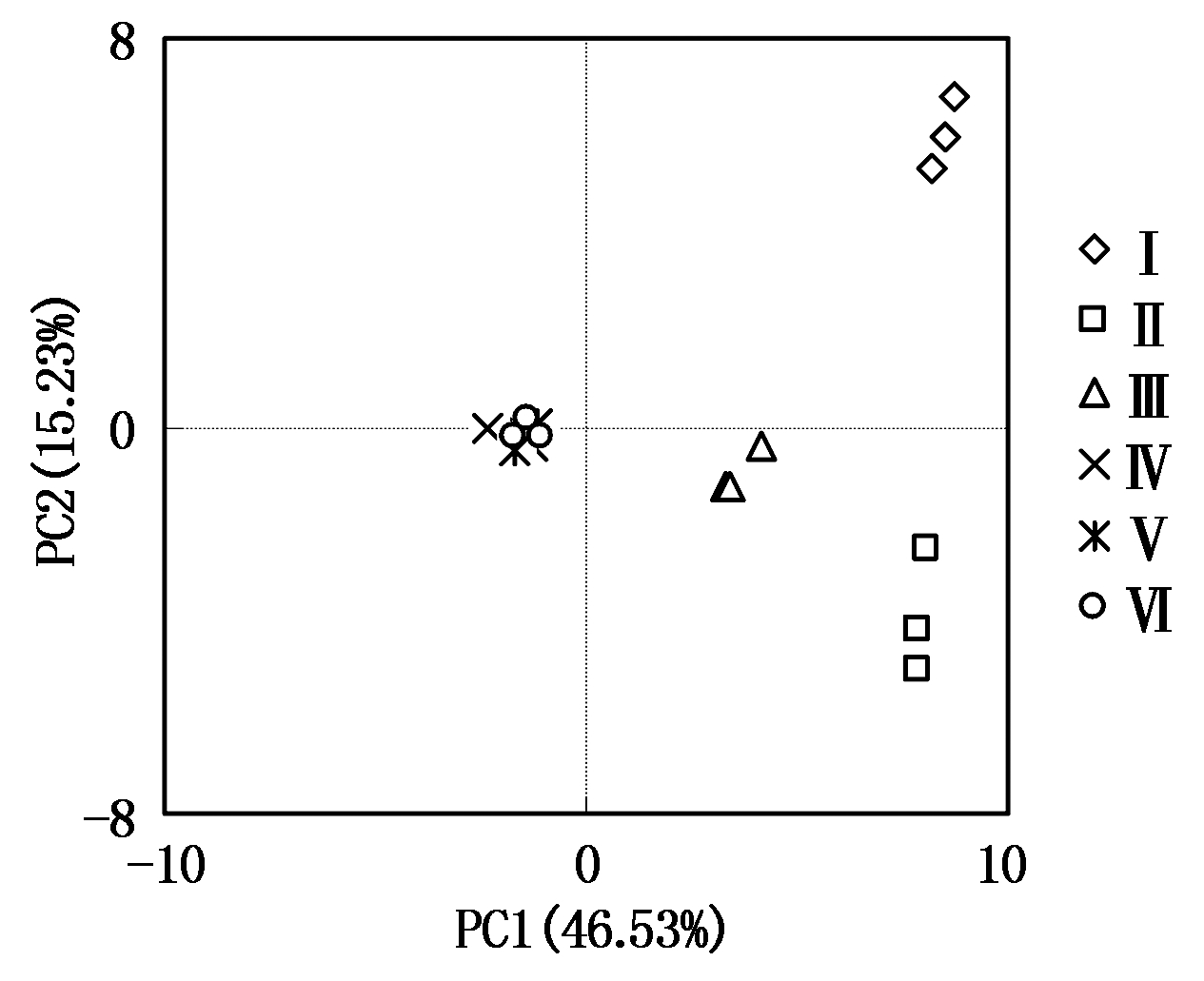
图3 套作不同绿肥的土壤微生物群落对碳源利用的主成分分析
Fig.3 Principal component analysis of carbon source utilization by soil microbial communities under intercropping different green manure
表3 31 种碳源与主成分1和主成分2的载荷因子
Tab.3 Load factors of 31 carbon sources and principal components 1 and 2
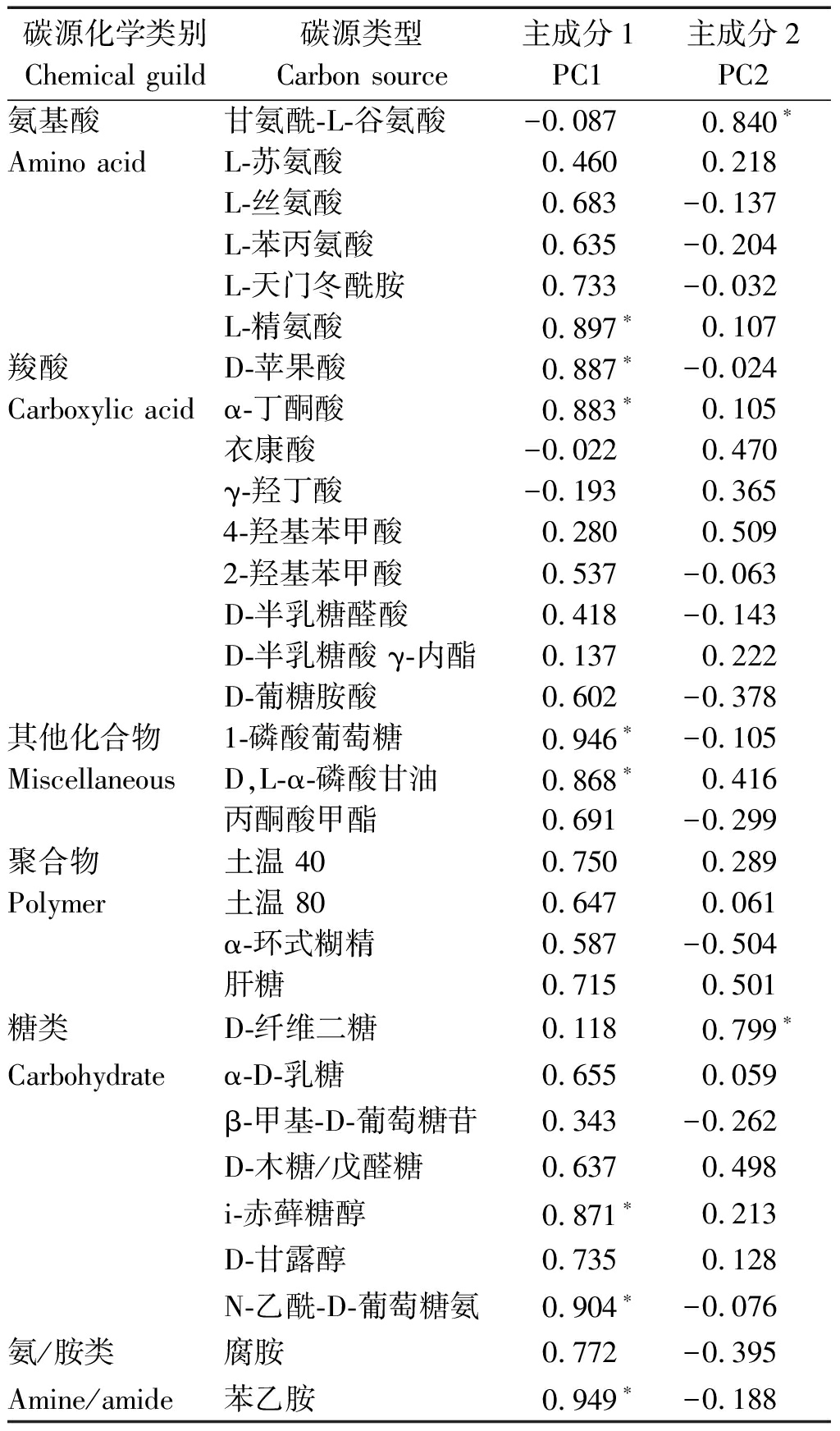
碳源化学类别Chemical guild碳源类型Carbon source主成分1PC1主成分2PC2氨基酸甘氨酰-L-谷氨酸-0.087 0.840∗Amino acidL-苏氨酸0.4600.218L-丝氨酸0.683-0.137L-苯丙氨酸0.635-0.204L-天门冬酰胺0.733-0.032L-精氨酸0.897∗0.107羧酸D-苹果酸0.887∗-0.024Carboxylic acidα-丁酮酸0.883∗0.105衣康酸-0.0220.470γ-羟丁酸-0.1930.3654-羟基苯甲酸0.2800.5092-羟基苯甲酸0.537-0.063D-半乳糖醛酸0.418-0.143D-半乳糖酸 γ-内酯0.1370.222D-葡糖胺酸0.602-0.378其他化合物1-磷酸葡萄糖0.946∗-0.105MiscellaneousD,L-α-磷酸甘油0.868∗0.416丙酮酸甲酯0.691-0.299聚合物土温 400.7500.289Polymer土温 800.6470.061α-环式糊精0.587-0.504肝糖0.7150.501糖类D-纤维二糖0.1180.799∗Carbohydrateα-D-乳糖0.6550.059β-甲基-D-葡萄糖苷0.343-0.262D-木糖/戊醛糖0.6370.498i-赤藓糖醇0.871∗0.213D-甘露醇0.7350.128N-乙酰-D-葡萄糖氨0.904∗-0.076氨/胺类腐胺0.772-0.395Amine/amide苯乙胺0.949∗-0.188
注: *为载荷因子大于0.79与主成分显著相关。
Note:* Load factor greater than 0.79 is significantly correlated with principal component.
载荷因子表示主成分与碳源的正相关性,载荷因子越高表示该种碳源对主成分的影响越大。载荷因子大于0.79表现为与主成分1显著相关的碳源分别为糖类2种、其他化合物类2种、羧酸类2种,氨/胺类1种、氨基酸类1种(表3)。与主成分 2 显著相关的碳主要为氨基酸类1种、糖类1种,由此可知,糖类、其他化合物类和羧酸类碳源是引起土壤微生物群落代谢差异的主要碳源类型,即微生物碳源代谢多样性的差异主要体现在糖类、其他化合物类和羧酸类。
3 讨论与结论
分析结果显示,不同生长时期、套作不同种类绿肥的土壤微生物对碳源的利用包括极速生长阶段、缓慢生长阶段、稳定生长阶段。AWCD 值随时间的变化直观反映了微生物群落对碳源代谢的速度和反应最后到达的程度,平均颜色变化率越大,表示土壤微生物群落代谢活性越高。本研究中,团棵期、成熟期的土壤微生物群落AWCD均为套作绿肥处理高于对照处理,且在整个培养过程中套作草木犀的 AWCD 显著高于其他处理。本试验套作绿肥对植烟根际微生物群落的影响结果显示,套作绿肥后植烟团棵期和成熟期与对照相比,其土壤微生物在微平板上的平均颜色变化率(AWCD)和微生物代谢多样性指数差异较大,说明套作绿肥对土壤微生物有显著影响,这与刘勇军等[21]提出的施用不同种类的有机物料在某一时期能明显提高烟草根际微生物活性和多样性的结果一致。有研究表明,套作绿肥能提高植烟上部烟可用性,并提升植烟土壤供肥能力[22]。空白处理的土壤AWCD和微生物多样性指数低于套作绿肥处理,说明烟草连作对微生物多样性影响较大,不利于土壤养分的可持续性发展,现实生产中应避免烤烟连作。土壤微生物群落丰富程度、优势度和均一性均反映土壤微生物群落多样性情况和土壤微生物结构的差异[23]。此次研究中,套作绿肥显著提高了土壤微生物群落丰富度和优势度,说明绿肥能提高植烟土壤优势菌群。原因可能是土壤不仅受到植烟根系分泌物的影响[24],而且还受到绿肥植物残茬还田对土壤养分的影响。有研究表明,植物根系及其残体向土壤中分泌大量有机物质[25],土壤微生物碳代谢变化可能是由于套作绿肥改变了土壤有机质含量和组成。另外由于根系分泌物的黏附作用,套作还可以改善土壤的理化性质,促进微生物菌群的繁殖[26],从而改变土壤微生物的群落结构。
主成分分析表明,受环境因子影响,对绿肥比较敏感的碳源类型主要为糖类、其他化合物类和羧酸类。有研究表明,土壤微生物群落在烟草栽培过程中会发生变化[27]。有关作物轮作和休耕的研究表明,一般适合轮作[28]的栽培作物包括禾本科和豆科植物的代表[29]。本试验中,黑麦草为禾本科植物,草木犀为豆科植物。草木犀与黑麦草相比对氮的固持能力增强,提高了土壤C/N,微生物会对土壤中过量的氮素进行固定,提高了土壤的氮素供应能力,也为微生物提供更多生长所需氮源的类型,进而影响土壤微生物群落结构。
土地的利用方式对土壤微生物群落组成有重要影响,也会对微生物群落变化产生影响[30]。本试验中团棵期土壤微生物对碳源的利用能力和种类显著高于成熟期,其原因可能是在团棵期与成熟期相比,更加适宜的土壤温度和土壤湿度,是微生物生长和繁殖的优良环境,进而增强了微生物代谢活性。同时绿肥的腐解速度不同,受光照等环境因素影响也不同,可能也影响了土壤微生物群落结构和土壤微生物的多样性。
套作绿肥显著提高微生物群落多样性并增强了植烟土壤微生物对碳源的利用能力,草木犀对土壤微生物的影响高于黑麦草,植烟套作绿肥建议用豆科植物。由于Biolog-Eco微平板技术对微生物群体活性依赖较大,对不能利用Biolog碳源底物的群体无法检测,作者建议可以采用克隆文库和高通量测序技术等研究方法深入阐述套作绿肥对土壤中难培养微生物的影响,为后续绿肥与烟草套作栽培模式的应用提供坚实依据。
[1] 焦永吉,程功,马永健,王伟超,李建华,乔保明,蒋士君.烟草连作对土壤微生物多样性及酶活性的影响[J].土壤与作物, 2014,3(2):56-62.doi:10.11689/j.issn.2095-2961.2014.02.003.
Jiao Y J, Cheng G, Ma Y J, Wang W C, Li J H, Qiao B M, Jiang S J. Effects of continuous tobacco on soil microbial diversity and enzyme activities [J].Soil and Crop,2014,3(2):56-62.
[2] 刘艳霞,李想,蔡刘体,张恒,石俊雄.烟草根系分泌物酚酸类物质的鉴定及其对根际微生物的影响[J].植物营养与肥料学报, 2016, 22(2):418-428. doi:10.11674/zwyf.14493.
Liu Y X, Li X, Cai L T, Zhang H, Shi J X. Identification of phenolic acid in tobacco root exudates and their role in the growth of rhizosphere microorganisms[J].Journal of Plant Nutrition and Fertilizers,2016, 22(2):418-428.
[3] 李艳平,刘国顺,丁松爽,李静静,阎海涛,阎申.混合有机肥用量对烤烟根系活力及根际土壤生物特性的影响[J].中国烟草科学, 2016, 37(1):32-36. doi:10.13496/j.issn.1007-5119.2016.01.006.
Li Y P, Liu G S, Ding S S, Li J J, Yan H T, Yan S. Effects of mixed organic fertilizer amount on root vigor and rhizosphere soil biological characteristics of flue-cured tobacco [J].Chinese Tobacco Science,2016, 37(1):32-36.
[4] 穰中文,朱三荣,田峰,袁谋志,陈武,戴林建.不同种植模式烟田土壤细菌种群特征与青枯病发生的关系[J]. 湖南农业大学学报(自然科学版), 2018, 44(1):33-38. doi:10.13331/j.cnki.jhau.2018.01.007.
Rang Z W, Zhu S R, Tian F, Yuan M Z, Chen W, Dai L J. Relationship between soil bacterial population characteristics and bacterial wilt in tobacco field under different planting patterns[J]. Journal of Hunan Agricultural University (Natural Sciences),2018, 44(1):33-38.
[5] 侯慧,董坤,杨智仙,董艳,汤利,郑毅.连作障碍发生机理研究进展[J].土壤, 2016,48(6):1068-1076. doi:10.13758/j.cnki.tr.2016.06.002.
Hou H, Dong K, Yang Z X, Dong Y, Tang L, Zheng Y. Advance in mechanism of continuous cropping obstacle[J]. Soils,2016,48(6):1068-1076.
[6] Tu C, Ristaino J B, Hu S J. Soil microbial biomass and activity in organic tomato farming systems:Effects of organic inputs and straw mulching[J]. Soil Biology and Biochemistry, 2006, 38(2):247-255. doi:10.1016/j.soilbio.2005.05.002.
[7] Devi N B, Yadava P S. Seasonal dynamics in soil microbial biomass C, N and P in a mixed oak forest ecosystem of Manipur, North east India[J]. Applied Soil Ecology, 2006, 31(3):220-227. doi:10.1016/j.apsoil.2005.05.005.
[8] 田平雅,沈聪,赵辉,张莹,代金霞.银北盐碱区植物根际土壤土壤酶活性及微生物群落特征研究[J].土壤学报, 2019.doi:10.11766/trxb201807050359.
Tian P Y, Shen C,Zhao H,Zhang Y,Dai J X. Enzyme activities and icrobial communities in rhizospheres of plants in salinized soil in North Yinchuan[J]. Acta Pedologica Sinica,2019.
[9] Garbeva P, van Veen J A, van Elsas J D. Microbail diversity in soil:selection of microbial populations by plant and soil type and implications for disease suppressiveness[J]. Annual Review of Phytopathology, 2004, 42:243-270. doi:10.1146/annurev.phyto.42.012604.135455.
[10] 官会林,郭云周,张云峰,孙世中,陈晓波.绿肥轮作对植烟土壤酶活性与微生物量碳和有机碳的影响[J].生态环境学报, 2010, 19(10):2366-2371. doi:10.3969/j.issn.1674.5906.2010.10.018.
Guan H L, Guo Y Z, Zhang Y F, Sun S Z, Chen X B.Effect of green manure rotation soil enzyme activities and soil microbial biomass carbon and soil organic carbon in tobacco field [J]. Ecology and Environmental Sciences,2010, 19(10):2366-2371.
[11] Masto R E, Chhonkar P K, Dhyan Singh, Patra A K. Changes in soil biological and biochemical characteristics in a long term field trial on a sub tropical inceptisol[J]. Soil Biology and Biochemistry, 2006, 38(7):1577-1582.doi:10.1016/j.soilbio.2005.11.012.
[12] 田峰,陆中山,邓小华,赵炯平,江智敏,陈前锋,菅攀锋,张明发.湘西烟区翻压不同绿肥品种的生态和烤烟效应[J].中国烟草学报, 2015, 21(4):56-62.doi:10.16472/j.chinatobacco.2014.291.
Tian F, Lu Z S, Deng X H, Zhao J P, Jiang Z M, Chen Q F, Jian P F, Zhang M F. Effects of ploughing back different green manures on ecology in Xiangxi tobacco-planting areas and flue-cured tobacco[J]. Acta Tabacaria Sinica,2015, 21(4):56-62.
[13] 敬海霞,曹安全,张登荣,李正,朱凌燕,帅红,刘国顺,叶协锋.翻压绿肥对烤烟大田生长及烤后烟产值效益的影响[J].中国农学通报, 2013, 29(1):155-159.doi:10.3969/j.issn.1000-6850.2013.01.032.
Jing H X, Cao A Q, Zhang D R, Li Z, Zhu L Y, Shuai H, Liu G S, Ye X F. Effects of green manure application on growth and development,yield and output value of flue-cured tobacco [J].Chinese Agricultural Science Bulletin, 2013, 29(1):155-159.
[14] 丁怡飞,曹永庆,姚小华,傅松玲,张平安,楼新良.油茶间作不同绿肥对土壤养分流失的影响[J].水土保持学报, 2018, 32(2):179-183. doi:1013870/j.cnki.stbcxb.2018.02.026.
Ding Y F, Cao Y Q, Yao X H, Fu S L, Zhang P A, Lou X L. Effects of intercropping with different green manures on soil nutrient loss in Camellia oleifera field[J].Journal of Soil and Water Conservation, 2018, 32(2):179-183.
[15] 江智敏,田峰,邓小华,赵炯平,菅攀锋,郑宏斌,张仲文.多年定位翻压绿肥对烤烟大田生长及经济性状的影响[J].中国烟草科学, 2015,36(3):35-39.doi:10.13496/j.issn.1007-5119.2015.03.007.
Jiang Z M, Tian F, Deng X H, Zhao J P, Jian P F, Zheng H B, Zhang Z W. Effects of long-term green manures application on growth and economic traits of flue-cured tobacco [J]. Chinese Tobacco Science, 2015,36(3):35-39.
[16] 邓小华,罗伟,周米良,田峰,张明发,江智敏,郑宏斌,张仲文.绿肥在湘西烟田中的腐解和养分释放动态[J].烟草科技, 2015,48(6):13-18. doi:10.16135/j.issn1002-0861.20150603.
Deng X H, Luo W, Zhou M L, Tian F, Zhang M F, Jiang Z M, Zheng H B, Zhang Z W. Dynamics of decomposition and nutrient release of green manures in tobacco fields in xiangxi [J].Tobacco Science & Technology, 2015,48(6):13-18.
[17] 张黎明,邓小华,周米良,田峰,赵炯平,江智敏,菅攀锋,张明发.不同种类绿肥翻压还田对植烟土壤微生物量及酶活性的影响[J].中国烟草科学, 2016, 37(4):13-18.doi:10.13496/j.issn.1007-5119.2016.04.003.
Zhang L M, Deng X H, Zhou M L, Tian F, Zhao J P, Jiang Z M, Jian P F, Zhang M F. Effects of different green manures on microbial biomass and enzyme activities of tobacco-planting soil [J]. Chinese Tobacco Science, 2016, 37(4):13-18.
[18] 刘国,王树林,沙富云,任文清,杨云高,张琼芬,杜如万.长期绿肥还田对烤烟产质量及土壤改良的影响[J].中国农学通报, 2013, 29(4):173-177.doi:10.3969/j.issn.1000-6850.2013.04.033.
Liu G, Wang S L, Sha F Y, Ren W Q, Yang Y G, Zhang Q F, Du R W. Effects of long-term green manure return to field on the yield, quality of flue cured tobacco and soil improvement [J]. Chinese Agricultural Science Bulletin, 2013, 29(4):173-177.
[19] Classen A T, Boyle S I, Haskins K E, Overby S T,Hart S C. Community-level physiological profiles of bacteria and fungi:Plate type and incubation temperature influences on contrasting soils[J]. Fems Microbiology Ecology, 2010, 44(3):319-328. doi:10.1016/S0168-6496(03)00068-0.
[20] Choi K H, Dobbs F C. Comparison of two kinds of biolog microplates (GN and ECO) in their ability to distinguish among aquatic microbial communities[J] Journal of Microbiological Methods, 1999, 36(3):203-213. doi:10.1016/S0167-7012(99)00034-2.
[21] 刘勇军,周羽,靳志丽,彭曙光,周志高,陈长青,王兴祥,李孝刚.有机物料类型对烟草根际微生物及烟叶产质量的影响[J].土壤, 2018, 50(2):312-318.
doi:10.13758/j.cnki.tr.2018.02.013.
Liu Y J, Zhou Y, Jin Z L, Peng S G, Zhou Z G, Chen C Q, Wang X X, Li X G. Effects of different organic materials on rhizosphere microbes, yield and quality of tobacco leaves[J].Soil, 2018, 50(2):312-318.
[22] 王修忠,彭宇,周曙光,刘万峰.烤烟套作绿肥对土壤养分和上部烟叶品质的影响[J].贵州农业科学, 2017, 45(2):52-55. doi:10.3969/j.issn.1001-3601.2017.02.013.
Wang X Z, Peng Y, Zhou S G, Liu W F. Influence of intercropping grenn manure on soils nutrients and quality of upper tobacco leaves[J].Guizhou Agricultural Sciences, 2017, 45(2):52-55.
[23] 周泉,王龙昌,邢毅,马淑敏,张小短,陈娇,石超.间作紫云英下油菜根际土壤微生物群落功能特征[J]. 应用生态学报, 2018, 29(3):909-914. doi:10.13287/j.1001-9332.201803.031.
Zhou Q, Wang L C, Xing Y, Ma S M, Zhang X D, Chen J, Shi C. Effects of intercropping Chinese milk vetch on functional characteristics of soil microbialcommunity in rape rhizosphere [J].Chinese Journal of Applied Ecology, 2018, 29(3):909-914.
[24] 周泉,张小短,马淑敏,邢毅,陈娇,石超,王龙昌.间作绿肥对油菜根际土壤碳氮及根际微生物的影响[J].生态学报, 2017, 37(23) :7965-7971. doi:10.5846/stxb201610072007.
Zhou Q, Zhang X D, Ma S M, Xing Y, Chen J, Shi C, Wang L C. Effects of intercropping green manure on soil carbon,nitrogen and soil microbialin rapeseed rhizosphere [J]. Acta Ecologica Sinica,2017, 37(23) :7965-7971.
[25] 孔维栋,刘可星,廖宗文.有机物料种类及腐熟水平对土壤微生物群落的影响[J].应用生态学报, 2004, 15(3):487-492.doi:10.13287/j.1001-9332.2004.0106.
Kong W D, Liu K X, Liao Z W. Effects of different organic materials and their composting levels on soil microbial community [J]. Chinese Journal of Applied Ecology, 2004, 15(3):487-492.
[26] 谢英荷,洪坚平,卜玉山,刘卫星,高树杰,唐润林. 枣麦间作对土壤肥力的影响[J]. 山西农业大学学报(自然科学版), 2002, 22(3):203-205.doi:10.13842/j.cnki.issn1671-8151.2002.03.005.
Xie Y H, Hong J P, Bu Y S, Liu W X, Gao S J,Tang R L. The effect of intercropping chinese date with winter wheat on soil fertility[J]. Journal of Shanxi Agricultural University(Natural Science Edition), 2002, 22(3):203-205.
[27] Niu J J, Rang Z W, Zhang C, Chen W, Tian F, Yin H Q, Dai L J. The succession pattern of soil microbial communities and its relationship with tobacco bacterial wilt[J]. BMC Microbiology, 2016, 16(1):1-10. doi:10.1186/s12866-016-0845 x.
[28] Boehm M, Wu T Y, Stone A, Kraakman B, Iannotti D A, Wilson G E, Madden L V, Hoitink H A J. Cross polarized magic angle spinning (sup13)C nuclear magnetic resonance spectroscopic characterization of soil organic matter relative to culturable bacterial species composition and sustained biological control of Pythium root rot[J]. Applied & Environmental Microbiology, 1997, 63(1):162-168.
[29] Kincaid R R. Crop rotation and fallowing in relation to tobacco disease control[J]. The Botanical Review, 1960, 26(2):261-276. doi:10.1007/BF02860531.
[30] Lauber C L, Ramirez K S, Aanderud Z,Lennon L,Fierer N. Temporal variability in soil microbial communities across land-use types[J]. The Isme Journal, 2013, 7(8):1641-1650.doi:10.1038/ismej.2013.50.