土壤盐渍化是植物在自然界中遭受的非生物胁迫之一,它影响植物的分布、生长和发育[1]。据联合国粮食与农业组织评估,世界上约有6%的盐渍土壤,盐胁迫是植物生长的主要限制因子之一。土壤盐分过高影响植物生长的原因有两方面,一是土壤中的盐分降低了植物根系的吸水能力,导致植物体内水分亏缺;二是通过蒸腾作用,过多的盐离子进入植物体内,引起细胞离子毒害[2]。植物体可通过改变自身的形态结构、细胞结构及一系列生理变化来适应盐胁迫[3],如产生脯氨酸、可溶性糖及可溶性蛋白质等渗透调节物质,以保证植物逆境条件下的正常水分供应[4]。叶绿素是一类与光合作用有关的最重要色素,盐胁迫下叶绿体是最敏感的细胞器之一,适度盐胁迫叶绿素含量升高,高盐胁迫叶绿体片层结构逐渐降解,光合反应效率下降,叶绿素含量下降[5],叶绿素含量的高低成为衡量植物耐盐性的一个重要指标。盐分能够增加膜的透性,加强膜质过氧化,丙二醛是其产物之一,丙二醛的多少常作为衡量膜损伤程度的指标。超氧化物歧化酶(SOD)和过氧化物酶(POD)是植物体内重要的抗氧化酶,具有清除活性氧自由基、保护膜系统的功能,常被作为判断植物抗逆性强弱的指标[6]。
甜菜是藜科甜菜属二年生草本植物,是世界两大糖料作物之一,具有耐旱、耐寒、耐盐碱等特性,是一种适应性广、抗逆性强、经济价值较高的作物[7]。糖是关系到国民经济发展的大事,近十多年统计分析,全球食糖供需趋势为:丰年略有余,灾年略不足,基本为紧平衡。我国对糖的需求是逐年递增的,由于甘蔗受到立地条件差、机械化程度低和劳动力紧缺的制约,发展空间有限,为甜菜产业发展提供了广阔的空间。甜菜耐盐性强,主要表现为比其他作物有更强的吸收或容纳Na+和Cl-的能力[8]。尽管甜菜能够耐受一定浓度的盐分,但土壤中含盐量超过一定限度,也不利于甜菜的生长[9]。盐胁迫对甜菜伤害的最初位点便是细胞膜,它影响膜的正常透性及其结合酶类的活性,从而影响细胞膜的正常生理功能,使甜菜正常的生长代谢失调,产质量下降[10-11]。
随着制糖产业整体的提升,甜菜种植面积逐年增加,2017年播种面积为8.5万hm2,2018年已增加至14.0万hm2,由于种植业结构的调整,盐碱地将为甜菜的产地转移提供巨大的空间。盐碱地甜菜生产中保苗是首要问题,植物能否在盐渍化环境下生长主要取决于早期幼苗生长的状况[12-13]。因此,针对甜菜苗期是耐盐性敏感期且盐碱地甜菜保苗率低的现象,本研究采用外源施加NaCl的盆栽试验,模拟田间盐胁迫环境,研究NaCl胁迫对不同苗龄甜菜苗期各项生理生化指标的变化,为进一步明确甜菜的耐盐机理、盐胁迫下甜菜的生理响应及进行盐碱地甜菜生产提供理论依据。
1 材料和方法
1.1 试验材料
选择甜菜品种IM1162为试验材料。供试土壤基本理化性质:有机质24.10 g/kg,全氮1.12 g/kg,全磷0.58 g/kg,全钾24.63 g/kg,碱解氮110.40 mg/kg,有效磷15.60 mg/kg,速效钾144.86 mg/kg,pH值7.23,含盐量0.89%。
1.2 试验设计
试验于2017年4-6月在内蒙古农牧业科学院温室内进行,播种于同批次、同规格的塑料盆中。土壤为内蒙古农牧业科学院试验地0~20 cm耕层土壤,装盆前过筛,筛孔直径≤1 cm。每200 kg土壤加2 kg甜菜纸筒育苗苗床专用肥,混匀后每盆装土10 kg,每盆播种20粒,于1对真叶小米粒大小时定苗至10株。按混合后在土壤中的质量百分比设计,NaCl(分析纯)浓度梯度:0(CK),0.2%,0.4%,0.6%,0.8%,分别于1对真叶(OPL)、2对真叶(TPL)、3对真叶(TRPL)和4对真叶(FPL)小米粒大小时(间隔时间7 d)以2 L溶液形式一次性浇入土壤进行盐胁迫,另每3 d浇去离子水1次,每处理4次重复。于第4对真叶盐胁迫第7天测定所有处理各项指标。
1.3 测定项目与方法
利用保苗株数计算保苗率。株高利用0.5 mm精度直尺测量最长叶片高度。将植株清洗干净后,在105 ℃杀青30 min,60 ℃烘干至恒质量,称量干质量。利用SPAD-502叶绿素仪进行叶绿素含量测定。叶片质膜透性采用相对电导率(REC)法测定[14]。丙二醛(MDA)含量和超氧化物歧化酶(SOD)、过氧化物酶(POD)活性利用南京建成生物工程研究所植物试剂盒测定,分别采用硫代巴比妥酸(TBA)法、WST-1法和比色法测定。
1.4 数据处理与分析
用Microsoft Excel 2007进行数据处理与作图,用SAS 9.0进行数据统计分析。
2 结果与分析
2.1 NaCl胁迫对不同苗龄甜菜保苗率的影响
由表1可见,不同苗龄低盐胁迫(CK、0.2%和0.4%)甜菜保苗率均为100%,高盐胁迫甜菜保苗率不同程度的下降。其中,OPL胁迫NaCl质量分数0.6%和0.8%显著低于其他处理,二者较CK降低40百分点。TPL、TRPL和FPL胁迫NaCl浓度0.8%显著低于其他处理,较CK分别降低22.50百分点,20.00百分点,15.00百分点,且随着苗龄的增加,0.8%NaCl处理的保苗率增加。
表1 NaCl胁迫对甜菜保苗率的影响
Tab.1 Effect of NaCl stress on seedling reservation rate %
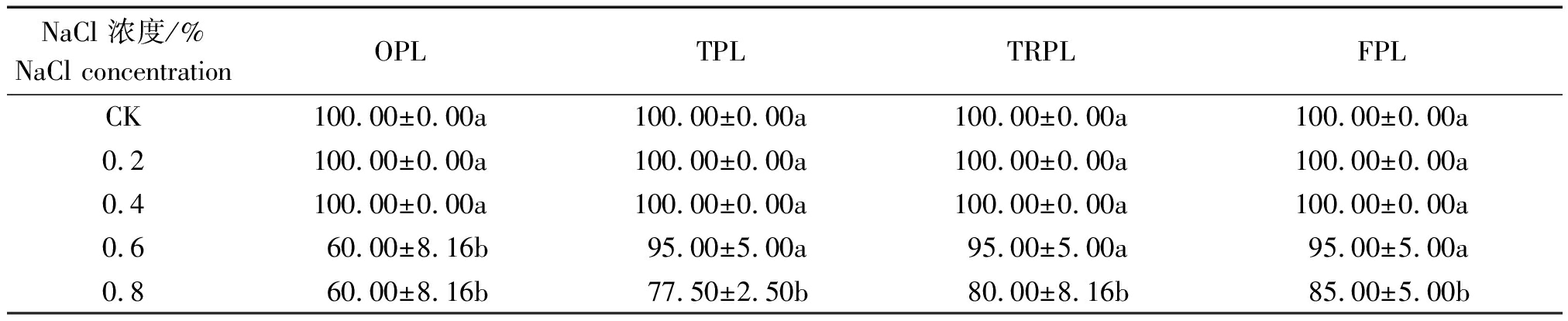
NaCl 浓度/%NaCl concentrationOPLTPLTRPLFPLCK100.00±0.00a100.00±0.00a100.00±0.00a100.00±0.00a0.2100.00±0.00a100.00±0.00a100.00±0.00a100.00±0.00a0.4100.00±0.00a100.00±0.00a100.00±0.00a100.00±0.00a0.660.00±8.16b95.00±5.00a95.00±5.00a95.00±5.00a0.860.00±8.16b77.50±2.50b80.00±8.16b85.00±5.00b
注: 均值±SE,同列数据后不同字母表示不同处理间差异达到0.05的显著性水平。表2-4同。
Note:Data are mean ± SE, values followed by different letters in a column are significant difference among treatment at the 0.05 level. The same as Tab.2-4 .
2.2 NaCl胁迫对不同苗龄甜菜株高的影响
由表2可见,随着苗龄的增加,相同NaCl质量分数甜菜的株高增加;随着NaCl质量分数的提高,同一苗龄甜菜的株高降低,各处理均显著低于对照。OPL不同NaCl浓度处理甜菜株高均显著低于CK,NaCl质量分数0.2%,0.4%,0.6%,0.8%时,较CK分别降低9.75%,34.28%,40.25%,55.75%;TPL各NaCl质量分数0.2%,0.4%,0.6%,0.8%时较CK株高分别降低21.92%,33.02%,33.90%,43.37%;TRPL各NaCl质量分数0.2%,0.4%,0.6%,0.8%时较CK株高分别降低15.50%,27.98%,43.98%,45.09%;FPL各NaCl质量分数0.2%,0.4%,0.6%,0.8%时较CK株高分别降低14.06%,37.46%,60.00%,66.88%。
表2 NaCl胁迫对甜菜株高的影响
Tab.2 Effect of NaCl stress on plant height cm
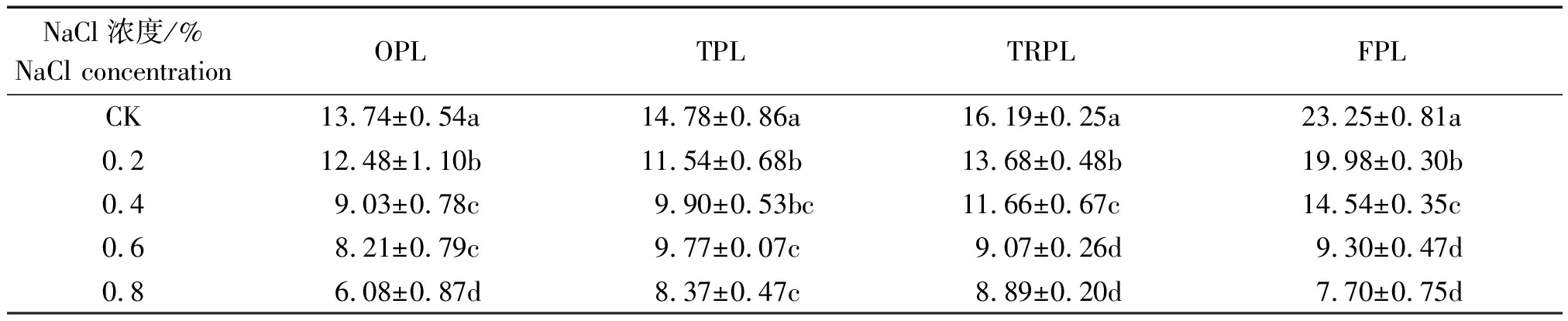
NaCl浓度/%NaCl concentrationOPLTPLTRPLFPLCK13.74±0.54a14.78±0.86a16.19±0.25a23.25±0.81a0.212.48±1.10b11.54±0.68b13.68±0.48b19.98±0.30b0.49.03±0.78c9.90±0.53bc11.66±0.67c14.54±0.35c0.68.21±0.79c9.77±0.07c9.07±0.26d9.30±0.47d0.86.08±0.87d8.37±0.47c8.89±0.20d7.70±0.75d
2.3 NaCl胁迫对不同苗龄甜菜干质量的影响
由表3可见,随着盐胁迫苗龄的增加,相同NaCl浓度甜菜的干质量增加;随着NaCl质量分数的提高,同一苗龄甜菜的干质量呈“低-高-低”的变化趋势,处理间差异达显著水平。OPL、TRPL不同盐胁迫处理甜菜干质量在NaCl质量分数0.2%时最大,且与CK差异不显著,但显著高于同一苗龄其他盐胁迫处理;TPL、FPL不同盐胁迫处理甜菜干质量也是NaCl质量分数0.2%时最大,且均显著高于同一苗龄其他处理,分别较CK提高25.71%,52.17%。随着苗龄的增加,各处理间干质量表现为差异缩小的变化趋势。
表3 NaCl胁迫对甜菜干质量的影响
Tab.3 Effect of NaCl stress on dry weight g/株
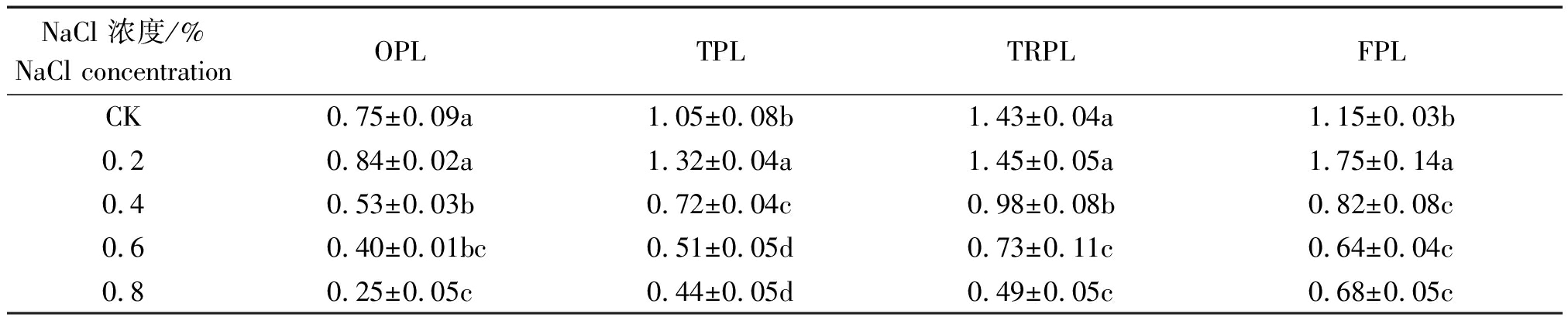
NaCl 浓度/%NaCl concentrationOPLTPLTRPLFPLCK0.75±0.09a1.05±0.08b1.43±0.04a1.15±0.03b0.20.84±0.02a1.32±0.04a1.45±0.05a1.75±0.14a0.40.53±0.03b0.72±0.04c0.98±0.08b0.82±0.08c0.60.40±0.01bc0.51±0.05d0.73±0.11c0.64±0.04c0.80.25±0.05c0.44±0.05d0.49±0.05c0.68±0.05c
2.4 NaCl胁迫对不同苗龄甜菜叶绿素含量的影响
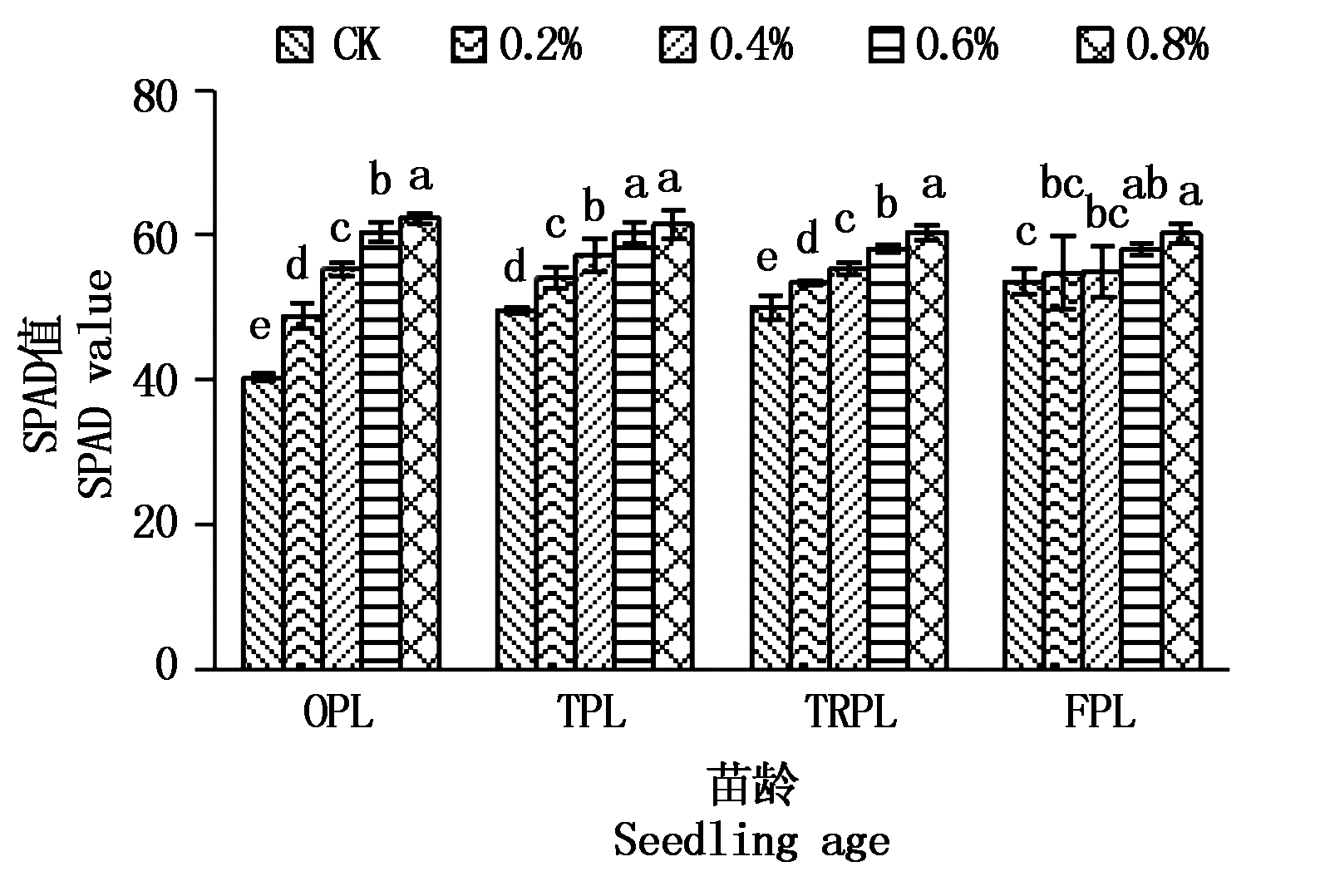
由于叶片SPAD值与叶绿素含量具有显著相关性[15-16],因而SPAD值常被用来表征植物体叶片叶绿素含量。由图1可见,同一苗龄随着NaCl浓度的增加,甜菜叶绿素含量呈逐渐增加的趋势,处理间差异显著。OPL不同盐胁迫处理叶绿素含量均显著高于CK,随NaCl浓度的增加,NaCl质量分数0.2%,0.4%,0.6%,0.8%时较CK分别提高21.00%,36.99%,49.58%,54.48%;TPL不同盐胁迫处理也均显著高于CK,NaCl质量分数0.2%,0.4%,0.6%,0.8%时较CK分别提高9.19%,15.30%,21.55%,24.08%;TRPL不同盐胁迫处理也均显著高于CK,NaCl质量分数0.2%,0.4%,0.6%,0.8%时较CK分别提高7.01%,10.72%,16.38%,20.84%;FPL在NaCl质量分数0.6%和0.8%处理时显著高于CK,二者较CK分别提高8.31%,12.37%。
图中不同字母表示不同处理间差异达到0.05的显著性水平。图2-3同。
Values followed by different letters are significant difference among treatment at the 0.05 level. The same as Fig.2-3.
图1 NaCl胁迫对甜菜叶绿素含量的影响
Fig.1 Effect of NaCl stress on chlorophyll content
2.5 NaCl胁迫对不同苗龄甜菜叶片质膜透性和丙二醛含量的影响
由图2可见,随着盐胁迫苗龄的增加,相同NaCl质量分数甜菜的叶片质膜透性基本表现为降低的趋势;同一苗龄随着NaCl质量分数的增加,甜菜叶片质膜透性表现为增加的趋势,处理间存在显著差异。OPL和TPL不同盐胁迫处理叶片质膜透性均显著高于CK,依NaCl质量分数递增,OPL各NaCl质量分数0.2%,0.4%,0.6%,0.8%时较CK分别提高15.69%,55.07%,113.84%,197.12%,TPL分别提高24.37%,53.89%,75.16%,98.28%;TRPL和FPL在NaCl质量分数0.4%,0.6%,0.8%处理时显著高于CK,其中TRPL较CK分别提高77.62%,95.14%,105.00%,FPL分别提高31.47%,47.43%,78.98%。
丙二醛是细胞膜脂过氧化的终产物,其含量的高低是反映膜损伤程度的重要指标。随着盐胁迫和苗龄的增加丙二醛含量变化与叶片质膜透性基本一致,同一苗龄随着NaCl浓度的增加丙二醛含量变化也与叶片质膜透性一致(图2)。OPL、TRPL和FPL不同盐胁迫处理丙二醛含量均显著高于CK,依NaCl浓度递增,OPL各NaCl浓度0.2%,0.4%,0.6%,0.8%时较CK分别提高15.64%,27.79%,30.48%,95.80%,TRPL分别提高22.81%,34.35%,49.27%,65.72%,FPL分别提高27.17%,40.33%,47.38%,78.19%;TPL NaCl浓度0.4%,0.6%,0.8%处理显著高于CK,较CK分别提高27.15%,34.71%,58.56%,FPL分别提高31.47%,47.43%,78.98%。
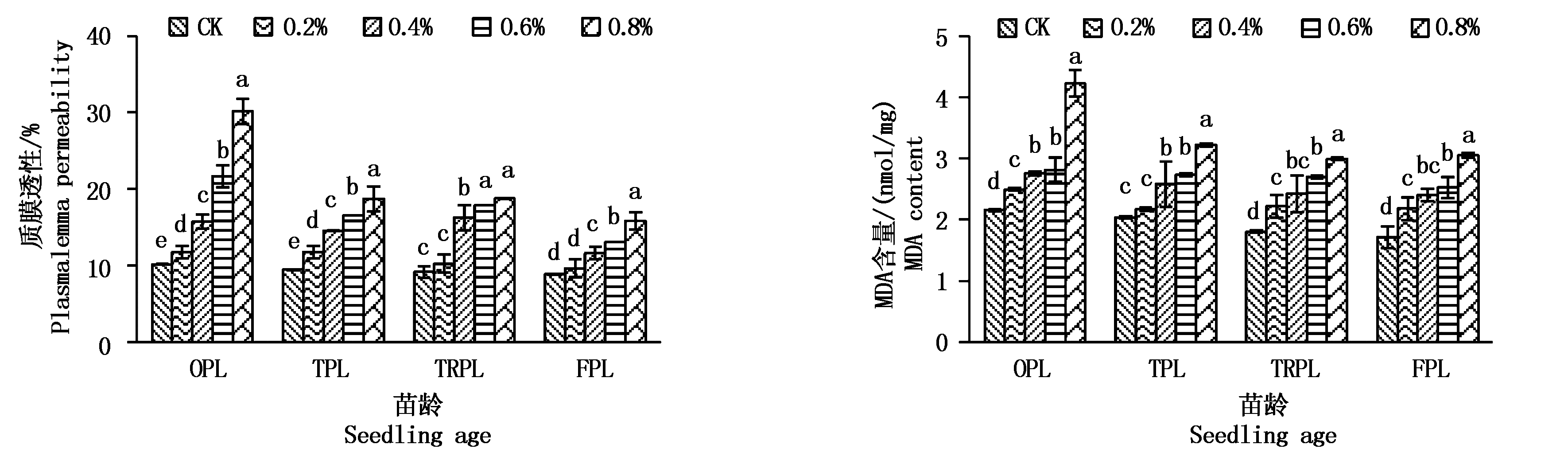
图2 NaCl胁迫对甜菜叶片质膜透性和丙二醛含量的影响
Fig.2 Effect of NaCl stress on plasmalemma permeability and MDA content
2.6 NaCl胁迫对不同苗龄甜菜超氧化物歧化酶活性和过氧化物酶活性的影响
由图3可见,随着NaCl浓度的增加,不同苗龄甜菜SOD活性变化规律不同。OPL盐胁迫处理,随NaCl浓度增加,SOD活性呈单峰曲线变化,NaCl浓度0.6%处理SOD活性最高,显著高于其他处理,较CK提高43.73%;TPL和FPL随NaCl浓度增加SOD酶活性呈升高的趋势,各NaCl质量分数0.2%,0.4%,0.6%,0.8%时处理均显著高于CK,TPL较CK分别提高19.51%,29.69%,28.80%,110.51%,FPL较CK分别提高26.61%,45.96%,86.02%,99.87%;TRPL随NaCl浓度增加,SOD酶活性也呈升高的趋势,NaCl质量分数0.4%,0.6%,0.8%均显著高于CK,分别较CK提高49.69%,79.94%,96.71%。
随NaCl质量分数增加,甜菜POD活性不同苗龄变化规律不同。OPL和TPL依NaCl质量分数递增,POD活性呈单峰曲线变化, 0.6% NaCl处理最高,显著高于CK、0.2%和0.4%处理,OPL和TPL盐胁迫处理分别较CK提高38.56%,29.99%;TRPL和FPL依NaCl质量分数递增,POD活性均呈逐渐升高的规律,高盐胁迫(NaCl质量分数0.6%和0.8%)显著高于低盐胁迫和CK,TRPL高盐胁迫较CK分别提高42.87%,52.58%,FPL较CK分别提高58.77%,59.33%。

图3 NaCl胁迫对甜菜抗氧化酶活性的影响
Fig.3 Effect of NaCl stress on antioxidant enzymes activity
3 讨论与结论
植物在逆境下会发生一系列的生理生化反应来提高植株抗逆性。已有研究表明,盐胁迫对植物的危害主要通过离子胁迫和渗透胁迫[17-18]。盐胁迫下,土壤水势下降,植物通过增加小分子溶质降低植株水势,发挥渗透保护和渗透适应的作用,从而提高叶片保水能力和根系吸水能力,但随着胁迫程度的增加或时间的持续,其调节能力超过阈值,植物吸水困难,细胞失水,自由基增多,过氧化产物大量积累,激活抗氧化酶系统产生作用[19]。本研究中,TPL、TRPL和FPL盐胁迫,依NaCl浓度递增,甜菜SOD活性和POD活性呈升高的趋势,说明盐胁迫能够诱导SOD、POD活性的升高以保护其细胞自身结构不被破坏。而OPL在0.8%NaCl SOD活性降低,OPL和TPL在0.8%NaCl POD活性也降低,这说明由于胁迫苗龄小、苗势弱、时间长叶片内氧自由基含量的增加导致膜脂过氧化加剧,酶活力下降,膜脂氧化作用的防御能力降低,从而降低了对细胞的保护作用[20]。
丙二醛是膜脂过氧化产物之一,其含量水平代表膜受损害程度,它又可与细胞膜上的蛋白质、酶等结合,引起蛋白质分子内和分子之间的交联,从而使蛋白失活,破坏了生物膜的结构与功能[21]。叶片质膜透性和丙二醛含量的高低通常能够反映植物细胞膜脂过氧化强弱和细胞质膜破坏程度[22]。膜系统是植物盐害的主要敏感部位,盐胁迫下植物细胞结构和功能受到伤害,表现为质膜透性增大[23],本研究中,同一苗龄甜菜叶片质膜透性随着NaCl浓度的升高而升高,丙二醛含量升高,OPL盐胁迫处理较其他苗龄叶片质膜透性和丙二醛含量上升快,可能是OPL时甜菜幼苗耐盐胁迫能力弱,盐离子对幼苗的伤害较大,细胞膜损伤严重,造成丙二醛大量积累。
盐胁迫主要通过影响植株碳同化,进而影响植株的正常生长发育,降低植株生长量和干物质积累量,甚至导致植物死亡[24]。本研究中,0~0.4% NaCl甜菜保苗率为100%,后逐渐降低,说明高盐胁迫影响了甜菜的出苗,在农业生产中保苗率是影响作物产量的重要因素。同一苗龄随着盐胁迫的加重,甜菜的株高逐渐降低,干质量呈单峰曲线变化,至NaCl 0.2%最大,说明低盐胁迫有利于甜菜的生长,适度的盐分不但不会抑制植物生长反而会促进其生长和生物量积累[25-26];而叶绿素含量增加,可能原因是植株体内抗氧化酶活性增强,修复损伤,缓解了对叶绿素的降解及叶绿素合成的抑制作用,造成叶绿素的积累[27]。随着盐胁迫苗龄的变大,甜菜干质量、叶绿素含量和叶片质膜透性、丙二醛含量不同盐胁迫处理间的差异逐渐减小,说明随着苗龄的增加,甜菜的耐盐能力增强。
综上所述,NaCl胁迫诱导甜菜SOD活性和POD活性的增高,降低了细胞质膜的稳定性,叶片质膜通透性提高,丙二醛含量增加,进而抑制了甜菜保苗率、株高、干质量的提高,叶绿素含量增加,但随着NaCl胁迫苗龄的推后,对甜菜生长的抑制作用减弱,而纸筒育苗移栽可以很好地避开早期盐胁迫环境,建议在盐碱地甜菜生产中采用纸筒育苗移栽的种植方式较直播好。
[1] Asish K P, Das A B. Salt tolerance and salinity effects on plants:a review [J]. Ecotoxicology and Environmental Safety, 2005, 60(3):324-349.doi:10.1016/j.ecoenv.2004.06.010.
[2] 史淑芝, 程大友, 马凤鸣, 崔杰. 生物质能源作物-能源甜菜的开发利用[J]. 中国农学通报, 2007, 23(11):416-419.
Shi S Z, Chen D Y, Ma F M, Cui J. Exploration and utilization of biomass energy crop-energy beet [J]. Chinese Agricultural Science Bulletin,2007,23(11):416-419.
[3] Rengasamy P. Soil processes affecting crop production in salt-affected soils[J].Functional Plant Biology,2010,37(7):613-620.doi:10.1071/FP09249.
[4] Ashraf M. Some important physiological selection criteria for salt tolerance in plants[J].Flora, 2004,199(5):361-376.doi:10.1078/0367-2530-00165.
[5] Yuan Y H, Shu S, Li Shu H, He L Z, Li H, Du N, Sun J, Cuo S R. Effects of exogenous putrescine on chlorophyll fluorescence imaging and heat dissipation capacity in cucumber (Cucumis sativus L.) under salt stress[J].Journal of Plant Growth Regulation, 2014,33(44):798-808.doi:10.1007/s00344-014-9427-z.
[6] 陈建波, 王全喜, 章洁. 绿豆芽超氧化物歧化酶在胁迫条件下的活性变化[J]. 上海师范大学学报(自然科学版), 2007, 36(1):49-53.doi:10.3969/j.issn.1000-5137.2007.01.010.
Chen J B, Wang Q X, Zhang J. The change of superoxide dismutase′s activity in bean sprout under stress circumstance [J]. Journal of Shanghai Normal University (Nature Science), 2007, 36(1):49-53.
[7] 黄春燕, 苏文斌, 张少英,樊福义, 郭晓霞, 李智, 菅彩媛, 任霄云, 宫前恒. 施钾量对膜下滴灌甜菜光合性能以及对产量和品质的影响[J]. 作物学报, 2018,44(10):1496-1505. doi:10.3724/SP.J.1006.2018.01496.
Huang C Y, Su W B, Zhang S Y, Fan F Y, Guo X X, Li Z, Jian C Y, Ren X Y, Gong Q H. Effects of potassium application on photosynthetic performance, yield, and quality of sugar beet with mulching-drip irrigation[J]. Acta Agronomica Sinica,2018,44(10):1496-1505.
[8] 吴晓雷, 田自华, 张家骅, 邵金旺. 甜菜抗盐生理研究进展[J].中国甜菜, 1991(2):46-49.
Wu X L, Tian Z H, Zhang J H, Shao J W.Advances in salt resistance physiology of sugarbeet [J].Sugar Crops China, 1991(2):46-49.
[9] 李志全.甜菜幼苗的耐盐限度[J].新疆农业科学, 1981(2):17-19.
Li Z Q.Salt tolerance limits of sugarbeet seedlings [J].Xinjiang Agricultural Science, 1981(2):17-19.
[10] 惠菲. 盐胁迫下甜菜蛋白质含量测定及特异蛋白的分离与鉴定[D].哈尔滨:黑龙江大学, 2012.doi:10.7666/d.y2122454.
Hui F. Determination of protein content and isolation and identification of specific protein in sugarbeet under salt stress[D]. Harbin:Heilongjiang University,2012.
[11] Parida A K, Das A B. Salt tolerance and salityeffects on plants:a review[J]. Ecotoxicology and Environment Safety, 2005,60(3):324-349.doi:10.1016/j.ecoenv.2004.06.010.
[12] 彭云玲,保杰, 叶龙山, 王永健, 燕利斌. NaCl胁迫对不同耐盐型玉米自交系萌动种子和幼苗离子稳态的影响[J]. 生态学报,2014,34(24):7320-7328.doi:10.5846/stxb201303150431.
Peng Y L, Bao J, Ye L S, Wang Y J, Yan L B. Ion homeostasis in germinating seeds and seedlings of three maize inbred lines under salt stress [J].Acta Ecologica Sinica, 2014,34(24):7320-7328.
[13] 刘文瑜, 杨发荣, 黄杰,魏玉明, 金茜. NaCl胁迫对藜麦幼苗生长和抗氧化酶活性的影响[J]. 西北植物学报, 2017,37(9):1797-1804.doi:10.7606/j.issn.1000-4025.2017.09.1797.
Liu W Y, Yang F R, Huang J, Wei Y M, Jin Q. Response of seedling growth and the activities of antioxidant enzymes of Chenopodium quinoa to salt stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2017,37(9):1797-1804.
[14] 李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社, 2002:65.
Li H S. Principles and techniques of plant physiological and biochemical experiments [M]. Beijing:Higher Education Press, 2002:65.
[15] 钟全林, 程栋梁, 胡松竹, 贺利中, 唐承财,文雅香, 邱剑飞, 李秀花. 刨花楠和华东润楠叶绿素含量分异特征及与净光合速率的关系[J]. 应用生态学报, 2009,20(2):271-276.doi:10.13287/j.1001-9332.2009.0066.
Zhong Q L, Cheng D L, Hu S Z, He L Z, Tang C C, Weng Y X, Qiu J F, Li X H. Chlorophyll content and net photosynthetic rate of Machiluspauhoi and M.leptophylla[J]. Chinese Journal of Applied Ecology,2009,20(2):271-276.
[16] Bielinis E, Józ'wiak W, Robakowski P.Modelling of the relationship between the SPAD values and photosynthetic pigments content in Quercus petraea and Prunuss erotina leaves [J].Dendrobiology, 2015, 73:125-134.doi:10.12657/denbio.073.013.
[17] 刘爱荣, 张远兵, 钟泽华, 吴夏, 张明. 盐胁迫对彩叶草生长和渗透调节物质积累的影响[J].草业学报, 2013,22(2):211-218.
Liu A R, Zhang Y B, Zhong Z H, Wu X, Zhang M. Effects of salt stress on the growth and osmotic accumulation of Coleus blumei[J]. Acta Prataculturae Sinica, 2013,22(2):211-218.
[18] Gill S S, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010,48(12):909-930.doi:10.1016/j.plaphy.2010.08.016.
[19] 张冠初, 张智猛, 慈敦伟, 丁红, 杨吉顺, 史晓龙, 田家明, 戴良香.干旱和盐胁迫对花生渗透调节和抗氧化酶活性的影响[J].华北农学报, 2018,33(3):176-181.doi:10.7668/hbnxb.2018.03.026.
Zhang G C, Zhang Z M, Ci D W, Ding H, Yang J S, Shi X L, Tian J M, Dai L X. Effects of drought and salt stress on osmotic and regulator and antioxidase activities[J]. Acta Abriculturae Boreali-Simica, 2018,33(3):176-181.
[20] 王永慧, 陈建平, 张培通, 高进, 周春霖, 施庆华, 周汝琴.盐胁迫对不同基因型黄秋葵苗期生长及生理生态特征的影响[J]. 华北农学报, 2016,31(6):105-110.doi:10.7668/hbnxb.2016.06.017.
Wang Y H, Chen J P, Zhang P T, Gao J, Zhou P T, Shi Q H, Zhou R Q. Effects of NaCl stress on growth and eco-physiological characteristics of different okra genotype in seedlings[J]. Acta Abriculturae Boreali-Simica, 2016,31(6):105-110.
[21] 刘延吉, 张珊珊, 田晓艳, 任大明. 盐胁迫对NHC牧草叶片保护酶系统、MDA含量及膜透性的影响[J]. 草原与草坪, 2008(2):30-34. doi:10.3969/j.issn.1009-5500.2008.02.007.
Liu Y J, Zhang S S, Tian X Y, Ren D M. Effects of salt stress on protective enzyme system,MDA content and membrane permeability of NHC foliar [J]. Grassland and Turf, 2008(2):30-34.
[22] 单长卷, 付远志, 彭贝贝.盐胁迫下谷胱甘肽对玉米幼苗根系抗氧化能力的影响[J].灌溉排水学报, 2015,34(10):56-59.doi:10.13522/j.cnki.ggps.2015.10.012.
Shan C J, Fu Z Y, Peng B B. Effects of glutathione on antioxidant properties of maize seedling roots under salt stress[J]. Journal of Irrigation and Drainage, 2015,34(10):56-59.
[23] Zhao F G, Sun C, Liu Y L, Liu Z P. Effects of salinity stress on the levels of covalently and noncovalently conjugated polyamines in plasma membrane and tonoplast isolated from barley seedlings[J]. Acta Botanica Sinica, 2000,42(9):920-926.
[24] 王素平, 李娟, 郭世荣, 胡晓辉, 李璟, 汪天.NaCl胁迫对黄瓜幼苗植株生长和光合特性的影响[J].西北植物学报, 2006,26(3):455-461.
Wang S P, Li J, Guo S R, Hu X H, Li J, Wang T. Effects of NaCl stress on growth and photosynthetic characteristics of cucumber (Cucumber sativus L. )seedlings[J].Acta Botanica Boreali-Occidentalia Sinica, 2006,26(3):455-461.
[25] 郑青松, 刘玲, 刘友良, 刘兆普. 盐分和水分胁迫对芦荟幼苗渗透调节和渗调物质积累的影响[J]. 植物生理与分子生物学学报,2003,29(6):585-588.doi:10.3321/j.issn:1671-3877.2003.06.017.
Zheng Q S, Liu L, Liu Y L, Liu Z P. Effects of salt and water stresses on osmotic adjustment and osmotica accumulation in Aloe vera seedlings[J]. Journal of Plant Physiology and Molecular Biology, 2003,29(6):585-588.
[26] 杨秀艳, 张华新, 张丽, 刘正祥, 杨升, 武香. NaCl胁迫对唐古特白刺幼苗生长及离子吸收、运输与分配的影响[J]. 林业科学, 2013, 49(9):165-171. doi:10.11707/j.1001-7488.20130924.
Yang X Y, Zhang H X, Zhang L, Liu Z X, Yang S, Wu X. Effects of NaCl stress on growth and absorption, transportation and distribution of ions in Nitraria tangutorum[J]. Scientia Silvae Sinicae, 2013, 49(9):165-171.
[27] 于玮玮, 曹波, 龙鸿, 李慧, 李爱, 阎国荣. 新疆野苹果幼苗对盐胁迫的生理响应[J]. 华北农学报, 2016,31(1):170-174.doi:10.7668/hbnxb.2016.01.027.
Yu W W, Cao B, Long H, Li H, Li A, Yan G R. Physiological response of Malus ieversii seedling under sality stress[J]. Acta Agriculturae Boreali-Sinica,2016,31(1):170-174.