土壤产生并释放的 N2O 约占生物圈排放到大气中 N2O 总量的 53%,农业土壤是N2O 的主要排放源[1]。施用氮肥排放的 N2O 占土壤 N2O 总排放量的 25%~82%[2]。增加氮肥用量,N2O 排放随之增加[3-5]。长期大量施用氮肥及其所导致的土壤酸化均会促进 N2O 的释放[6],但氮肥施用量水平较低时对 N2O 排放的影响并不显著[7-8]。而且,作物及其氮素利用对土壤N2O 排放也有重要影响。研究指出,作物生长能显著降低土壤N2O 排放量[9-15],但也有植物生长会大幅增加土壤N2O 排放的研究报道[16-19]。另外,植物本身也能产生和排放 N2O[20-23],随着施氮量增加,植物排放N2O明显增加[16],且植物排放N2O还受光强和土壤N、P供给水平等因素影响[24]。
多点代面的尺度扩展结果显示,2008 年中国稻田水稻生长季 N2O 排放量均值为 22.48 Gg[25],稻田 N2O 排放随施氮量增加而增加[5,26-27]。但在稻田淹水造成厌氧环境的条件下,N2O 进一步被还原为 N2,此时氮肥对 N2O 排放的影响并不明显[28]。在N 0~180 kg/hm2,增施尿素对稻田N2O 排放的影响不显著,只有施用尿素量达到N 270,360 kg/hm2时,N2O 排放通量才会明显升高[29]。研究表明,水稻植株也会影响稻田N2O 的排放,据测定,华南丘陵地区稻田的 N2O 季节平均排放量为(42.33±20.00)μg/(m2·h),但当稻田没有种植水稻时N2O 季节平均排放量则为(51.69±15.87)μg/(m2·h) [14]。 王重阳等[15]研究证实,稻田植株能使土壤 N2O 排放减少 81%。但是也有相反研究结果的报道,如邹建文等[30]通过研究表明,水稻田中土壤 N2O 排放量比相同条件下裸土的 N2O 排放量增加37%。
从前人的研究成果看,无论是土壤还是植物 N2O 排放均与施氮量、农田水分状况等因素密切相关,但相关研究结果差异较大,其原因可能与土壤介质不均匀性、影响因素多且难以控制有关。此外,植物根际N2O 排放也会影响到叶际N2O 排放,光照、氮源对农田N2O 排放作用应与其对作物根、叶界面N2O 排放的效应密切相关。但迄今为止,对光照和施氮量调控水稻根际、叶际界面 N2O 排放的作用及其机制尚不清楚。因此,本研究在水培控氮、同步测定条件下,探讨了光照和施氮量对水稻叶际及根际N2O 排放的影响及机制,以为稻田 N2O 减排提供科学依据。
1 材料和方法
1.1 试验装置设计和工作原理
试验用小型光控培养箱装置(图 1)的制备材料、设计规格、工作原理、使用方法与徐胜光等[31-33]介绍的方法完全一致,试验时将水稻地上部和地下部严密分隔在试验装置的内室和外室,并通过内、外室抽气管采集气样的 N2O 检测与数据分析,了解水稻根、叶界面 N2O 排放状况。试验装置最大优点可同步精确定量研究水稻叶际和根际 N2O 排放。
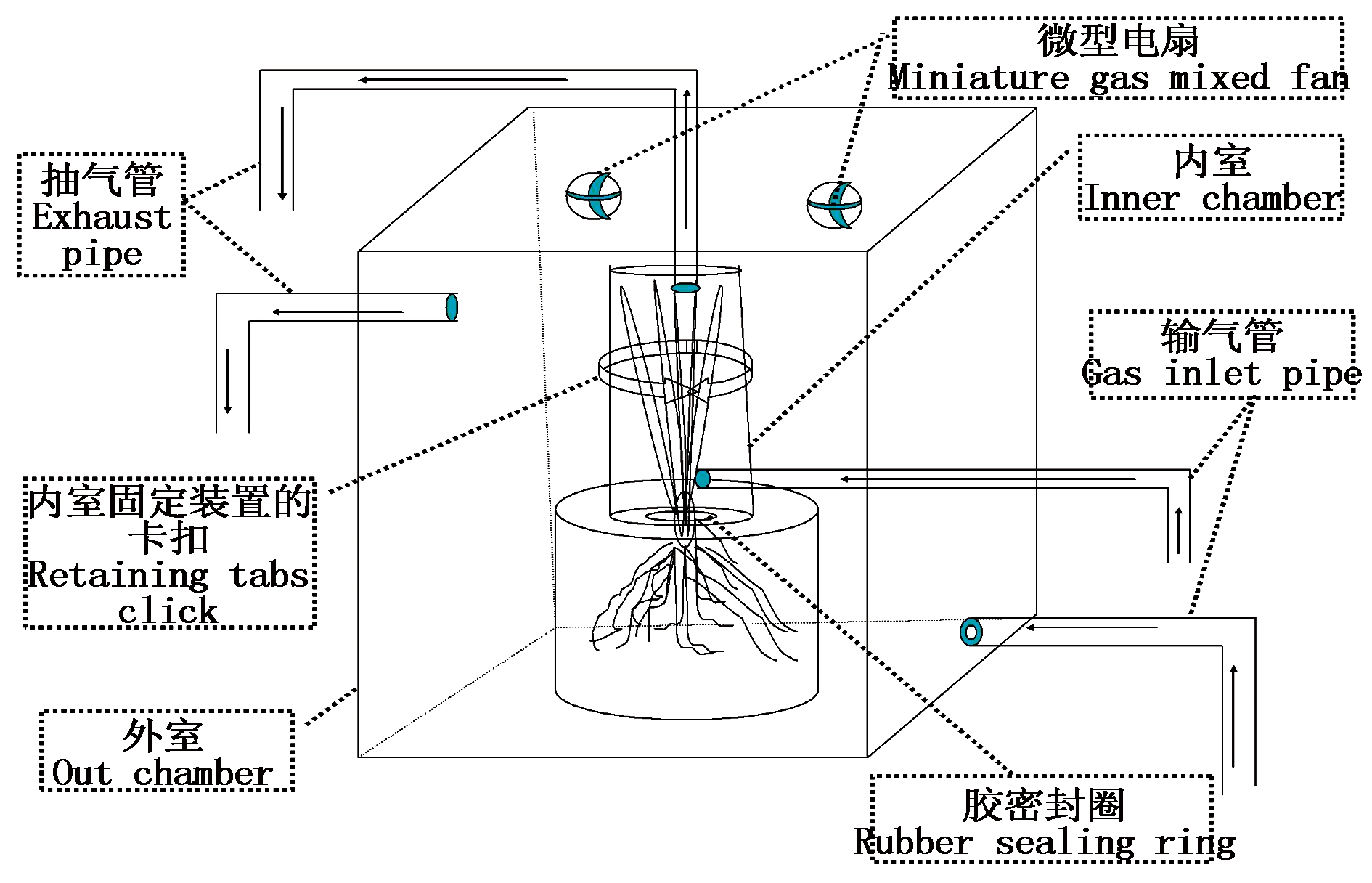
图1 设计的N2O挥发试验装置
Fig.1 Self-designed integrated N2O monitoring box
1.2 试验方法
1.2.1 室内弱光试验 水稻叶际及根际N2O排放通量试验供试水稻 (Oryza sativa L.) 品种培杂泰丰来自华南农业大学。试验用苗培养方法及试验期间试验装置光强的调控方法,均采用徐胜光等[31-33]介绍的方法实施。前期通过测定[33],不同类型水稻土有效氮(碱解氮)平均含量33.06 mg/kg (标准差±8.07),高有效氮含量的水稻土可达 60.79 mg/kg。本试验设低氮 (1N, 30 mg/L)、中氮 (2N, 60 mg/L)、高氮 (3N, 90 mg/L)的不同施氮量处理,每处理重复 3 次。培养液氮浓度用 NH4NO3 (分析纯) 控制,同时做试验装置的空白试验,空白试验重复 3次。试验用 GLZ-C 型光量子计录仪测定离外室罩内壁 5 cm 处的光强。在日间 8:00-18:00 时段,日间光照设置为 4 000 lx;晚上 18:00-8:00 为暗处理时段,所有处理光强均为 0 lx。
试验水稻植株的处理:均采用徐胜光等[31-33]介绍的方法实施,采用该种方法,能够在对水稻植株基本不造成伤害的情况下,使水稻地上部和地下部能够严密分隔开来。水稻根际界面产生的 N2O,被分隔集聚在外室空气中;而水稻地上部排放的 N2O 却被分隔集聚在内室空气中。
气样 N2O 检测:试验气样采集、分析均参照徐胜光等[31-33]介绍的方法实施,该试验方法在正式实施试验前先用气泵快速置换试验装置空气 ,然后立即封箱 3 h,封箱时间为每天上午9:30-12:30,下午14:00-17:00,晚上18:30-21:30。封箱时即刻采样测定初始空气 N2O 浓度,封箱 3 h 内每隔 1 h采样测定一次,具体封箱时间为每天上午9:30-12:30,下午14:00-17:00,晚上18:30-21:30。采用 Agilent Technologies公司生产的 7890A GC system 气相色谱仪测定N2O的排放。
试验播种日期为 2013 年 6 月 20 日。分蘖期、开花结实期、成熟衰老期试验分别于 2013 年 8 月 24-29 日、9 月23-29日和 11月10-16日实施,实施试验时,分蘖期、开花结实期、成熟衰老期水稻生育期分别为 64,93,136 d,平均水稻植株鲜质量分别为 140,346,290 g。
1.2.2 不同光照条件下不同施氮量对水稻叶际及根际N2O排放通量试验 前期研究表明,开花结实期是植物叶际 N2O 排放的关键时期。2014年试验,于水稻开花结实期实施脱氮 (0N, 0 mg/L)、低氮 (1N, 30 mg/L)、高氮 (3N, 90 mg/L) 3个处理,每个处理重复3次,实施时的光照条件分别是:室内弱光 (8:00-18:00, 4 000 lx; 18:00-22:00, 0 lx)、室内强光(8:00-18:00, 8 000 lx; 18:00-22:00, 0 lx) 和室外自然光。试验氮源用NH4NO3 (分析纯) 控制。室内弱光控试验的光源均参照徐胜光等[31-33]介绍的方法调控,试验于2014年5月10日播种育苗,实施试验时间为2014年8月25-30日。试验进行时,水稻的生育期为 95 d,平均鲜质量为 380 g,水稻生长处于开花结实期。这时水稻 N2O 排放试验及观测方法同1.2.1。
1.3 水稻叶际及根际N2O排放通量的计算方法
N2O 排放通量计算主要采用王艳群等[4]的方法进行:
F=ρ×V/A×dc/dt×273/(273+T)
式中:F 表示 N2O 排放通量 (μg/(m2·h));ρ 是标准状态下气体密度 (N2O, 1.98 kg/m3);V 为内、外室有效体积 (m3);A 为静态箱底面积 (m2) ;dc/dt 为封箱单位时间 (1 h) 采样箱内气体N2O浓度的变化 (μL/(m3·h));T 为采样箱气温 (℃)。
按照上述公式计算所得数据资料经 Excel 2003 初步整理、作图,用 SPSS 19.0 进行方差统计分析,处理间差异显著性检验用 Duncan 多重比较法。
2 结果与分析
2.1 室内弱光下不同施氮量对水稻分蘖期叶际及根际产生N2O 排放的影响
从表1可见,在上午 (8:00-12:00)、下午 (13:00-17:00) 和晚上 (18:00-22:00) 不同时间均观测到水稻分蘖期叶际及根际 N2O 净排放效应 (2013 年试验),处理间 N2O 排放差异达显著水平 (P<0.05)。室内严密光氮控制条件下,高氮 (3N, NH4NO3-N, 90 mg/L)处理的水稻分蘖期叶际及根际平均 N2O 排放通量为 98.3,246.1 μg/(m2·h)(上午、下午、晚上平均),分别相当于低氮(1N, NH4NO3-N, 30 mg/L)、中氮处理 (2N, NH4NO3-N, 60 mg/L)的2.82,2.32 倍和 8.31,3.09倍,具有促进水稻根、叶界面 N2O 排放的显著作用 (P<0.05)。试验供氮范围内随着施氮量增加,水稻根、叶界面 N2O 排放均明显增加,但低氮与中氮处理间水稻叶际 N2O 排放差异不显著。因此,室内弱光条件下,控制施氮量才能有效抑制分蘖期水稻根、叶界面N2O 排放。
表1 室内弱光下不同施氮量处理的分蘖期水稻叶际及根际 N2O 的排放通量
Tab.1 N2O emission flux of rice phyllosphere and rhizosphere in different nitrogen concentration at tillering stage
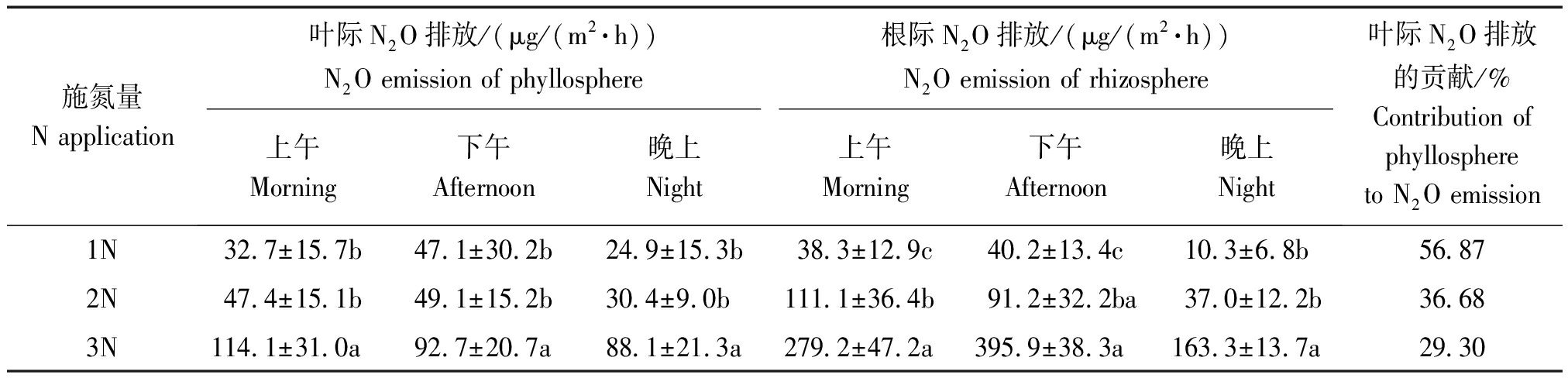
施氮量N application 叶际N2O排放/(μg/(m2·h))N2O emission of phyllosphere根际N2O排放/(μg/(m2·h))N2O emission of rhizosphere上午Morning下午Afternoon晚上Night上午Morning下午Afternoon晚上Night叶际N2O排放的贡献/%Contribution of phyllosphere to N2O emission1N32.7±15.7b47.1±30.2b24.9±15.3b38.3±12.9c40.2±13.4c10.3±6.8b56.87 2N47.4±15.1b49.1±15.2b30.4±9.0b111.1±36.4b91.2±32.2ba37.0±12.2b36.68 3N114.1±31.0a92.7±20.7a88.1±21.3a279.2±47.2a395.9±38.3a163.3±13.7a29.30
注: 1N、2N和3N表示不同施氮量处理的培养液供氮质量浓度分别为30,60,90 mg/L (NH4NO3-N);同一列中标明数据的不同小写字母表示不同施氮量处理间差异达显著水平 (Duncan 多重比较, P<0.05 )。表2-3、图2-3同。
Note:Nitrogen concentration of liquid culture in treatment of 1N, 2N and 3N was 30, 60 and 90 mg/L (NH4NO3-N), respectively; Values followed by a different small letter within a column is significantly different at 0.05 (Duncan test, P<0.05 ) levels. The same as Tab.2-3,Fig.2-3.
2.2 室内弱光下不同施氮量对水稻开花结实期叶际及根际产生 N2O 排放的影响
由表2可以看出,开花结实期水稻根、叶界面 N2O 的排放对施氮量的响应大致表现和分蘖期相似的规律。但在弱光控试验条件下,中氮 (2N)、高氮 (3N) 处理的水稻叶际及根际N2O 排放通量分别为87.6,105.6 μg/(m2·h) 和 273.5,256.7 μg/(m2·h) (上午、下午、晚上平均),分别相当于分蘖期中氮(2N)、高氮 (3N) 处理的207.09%,107.4% 和 342.7%,104.3%。其中,高氮水平叶际N2O排放占水稻根、叶界面N2O总排放的30.16%。显然,对比分蘖期,室内弱光(4 000 lx)条件下,中氮水平(2N)处理的开花结实期水稻根、叶界面N2O 排放成倍增加,但高氮(3N)处理的开花结实期水稻根、叶界面N2O 排放增加比例不大。而且,同期中 (2N)、高氮 (3N) 处理间水稻根、叶界面N2O 排放差异均不显著 (P>0.05),水稻根、叶界面N2O 排放对中、高氮 (3N) 水平的响应基本一致,弱光控试验条件下进一步提高施氮量并未有显著提升同期水稻根、叶界面 N2O 排放的效果。
表2 室内弱光下不同施氮量处理对开花结实期水稻叶际及根际 N2O 的排放通量
Tab.2 N2O emission flux of rice phyllosphere and rhizosphere in different nitrogen concentration at flowering and seed setting stage
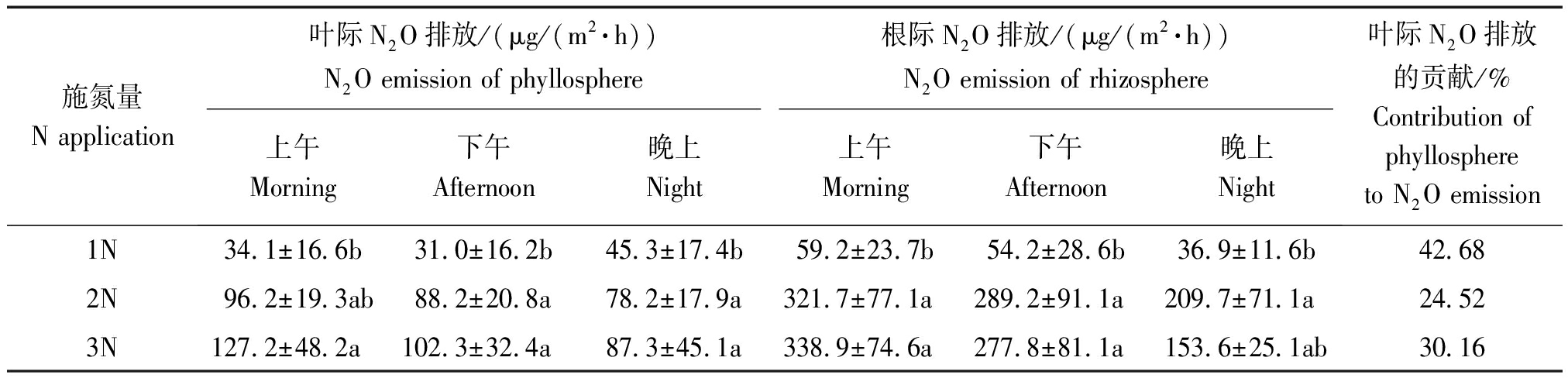
施氮量N application 叶际N2O排放/(μg/(m2·h))N2O emission of phyllosphere根际N2O排放/(μg/(m2·h))N2O emission of rhizosphere上午Morning下午Afternoon晚上Night上午Morning下午Afternoon晚上Night叶际N2O排放的贡献/%Contribution of phyllosphere to N2O emission 1N34.1±16.6b31.0±16.2b45.3±17.4b59.2±23.7b54.2±28.6b36.9±11.6b42.68 2N96.2±19.3ab88.2±20.8a78.2±17.9a321.7±77.1a289.2±91.1a209.7±71.1a24.52 3N127.2±48.2a102.3±32.4a87.3±45.1a338.9±74.6a277.8±81.1a153.6±25.1ab30.16
2.3 室内弱光下不同施氮量对水稻成熟衰老期叶际及根际产生 N2O 排放的影响
由表3可知,在水稻成熟衰老期,施氮量对水稻根、叶界面 N2O 排放的作用大致表现和中前期相似的规律。这一时期,弱光控试验条件下中氮 (2N)、高氮 (3N) 处理的水稻叶际及根际平均 N2O 排放通量分别为83.3,121.3 μg/(m2·h) 和 270.9,279.2 μg/(m2·h) (上午、下午、晚上平均)。其中,高氮水平叶际N2O排放占水稻根、叶界面N2O总排放的31.33%与水稻开花结实期对比(表2),中、高氮条件下水稻成熟衰老期根、叶界面 N2O 排放均无明显下降的趋势。而且在低氮 (1N) 条件下,水稻成熟衰老期叶际及根际平均N2O 排放通量分别相当于开花结实期的134.78% 和 191.02%,这一时期低氮水平下水稻根、叶界面仍有较大量的N2O 排放。可见,水稻成熟衰老期仍有较大量的N2O 排放,进一步控制施氮量对控制成熟衰老期水稻根、叶界面 N2O 排放仍然重要。
表3 室内弱光下不同施氮量处理的成熟衰老期水稻叶际及根际 N2O 的排放通量
Tab.3 N2O emission flux of rice phyllosphere and rhizosphere in different nitrogen concentration at mature aging stage
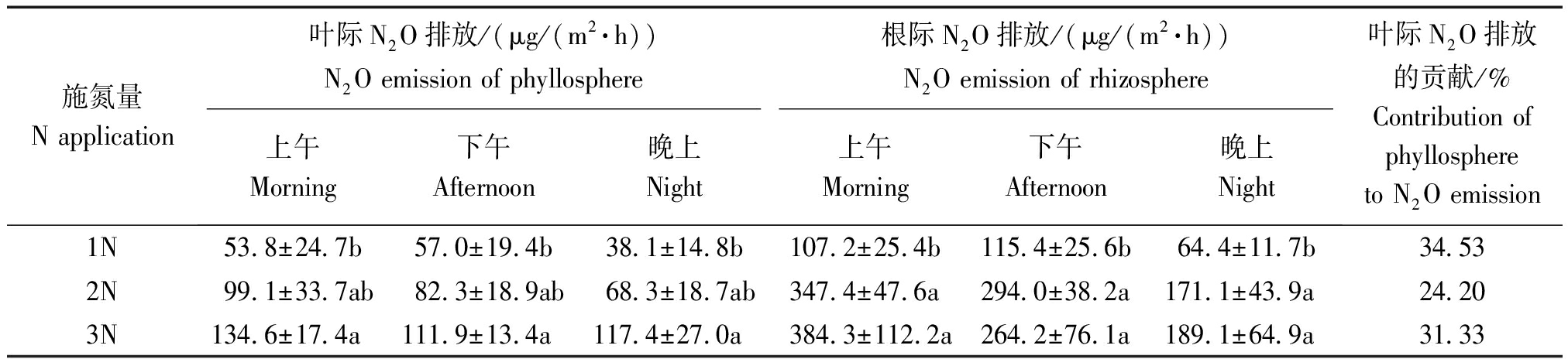
施氮量N application 叶际N2O排放/(μg/(m2·h))N2O emission of phyllosphere根际N2O排放/(μg/(m2·h))N2O emission of rhizosphere上午Morning下午Afternoon晚上Night上午Morning下午Afternoon晚上Night叶际N2O排放的贡献/%Contribution of phyllosphere to N2O emission 1N53.8±24.7b57.0±19.4b38.1±14.8b107.2±25.4b115.4±25.6b64.4±11.7b34.53 2N99.1±33.7ab82.3±18.9ab68.3±18.7ab347.4±47.6a294.0±38.2a171.1±43.9a24.20 3N134.6±17.4a111.9±13.4a117.4±27.0a384.3±112.2a264.2±76.1a189.1±64.9a31.33
2.4 不同光照下不同施氮量对水稻开花结实期叶际产生 N2O 排放的影响
弱光 (4 000 lx)、强光 (8 000 lx) 和自然光条件下(图 2),试验结果表明,脱氮 (0 mg/L)、低氮 (30 mg/L)、高氮 (90 mg/L) 处理的水稻开花结实期叶际 N2O 排放通量分别为 2.9,29.1,116.3 μg/(m2·h),23.6,40.1,120.1 μg/(m2·h) 和 10.9,26.2,131.3 μg/(m2·h)。与2013年度试验比较,弱光控试验条件下低氮、高氮处理叶际N2O排放通量差别不大(2013年分别为36.8,105.6 μg/(m2·h))。随着施氮量增加,水稻叶际 N2O 排放亦明显增加,不同时间段处理间水稻开花结实期叶际 N2O 排放通量有显著性差异(P<0.05)。但在高氮水平条件下,室内弱光、室内强光、自然强光(平均26 500 lx)处理的水稻叶际 N2O 排放通量依次上升,随着日间光照增强,水稻叶际 N2O 排放明显增强,表明自然强光、高氮的协同作用,有增强水稻叶际 N2O 排放的作用效果。另外,总体而言,试验表明,随着光照增强,不同施氮处理的水稻叶际N2O 排放亦呈明显增强趋势,但脱氮、低氮处理间水稻叶际 N2O 排放差异明显缩小,自然强光处理条件下脱氮、低氮处理间N2O 排放差异不显著(P>0.05)。显然,强光、低氮的协同作用,具有明显抑制水稻叶际N2O 排放的作用效果。
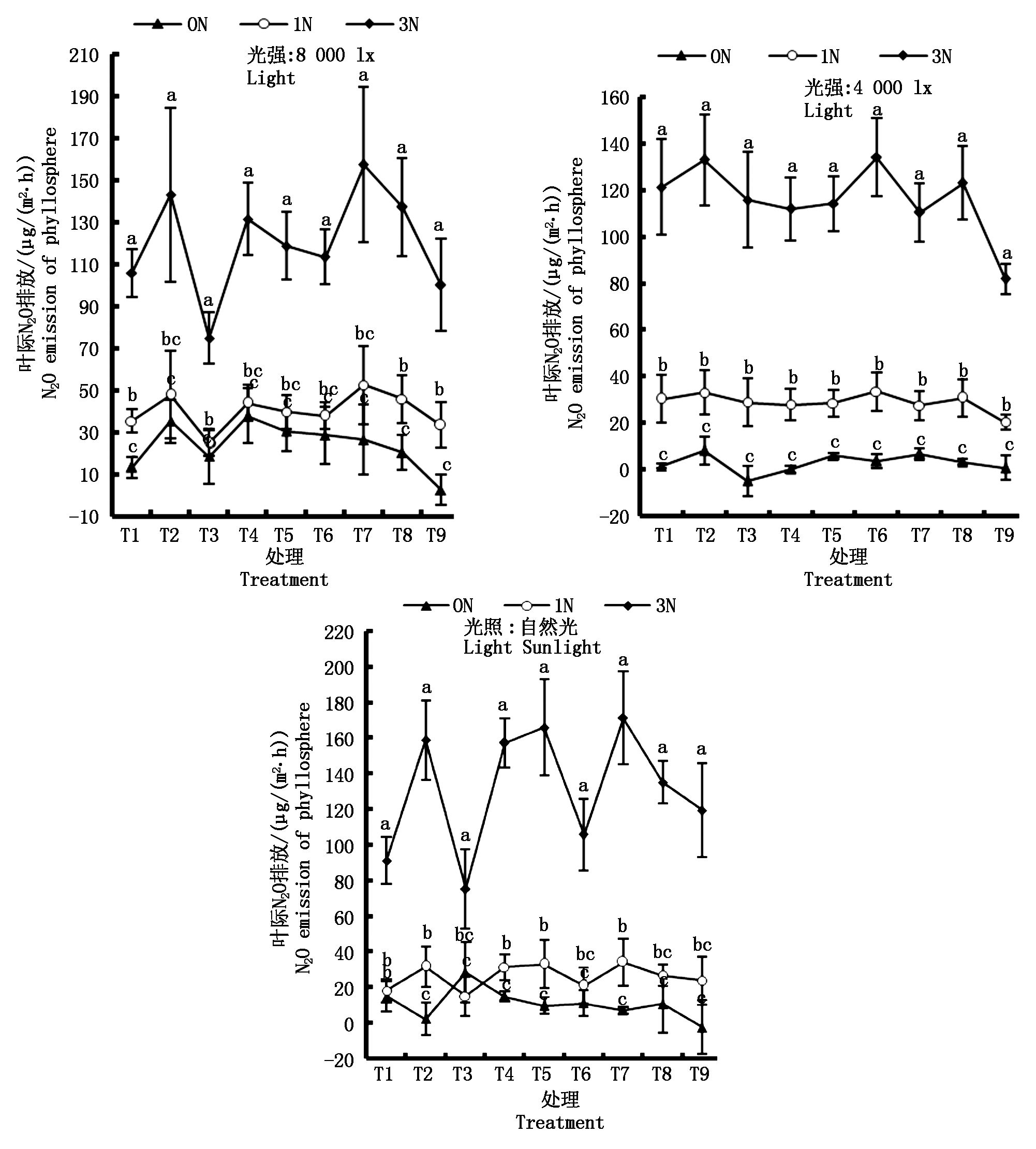
T1.9:30-10:30; T2.10:30-11:30; T3.11:30-12:30; T4.14:00-15:00; T5.15:00-16:00;
T6.16:00-17:00; T7.18:30-19:30; T8.19:30-20:30; T9. 20:30-21:30。
图2 不同光照下不同施氮量处理的开花结实期水稻叶际N2O排放通量
Fig.2 N2O emission flux of rice phyllosphere in different nitrogen concentration at flowering and seed setting stage under various light illumination
2.5 不同光照下不同施氮量对水稻开花结实期根际产生 N2O 排放的影响
由图3可以看出,在弱、强光及自然光下,脱氮(0N)、低氮(1N)、高氮(3N)处理的水稻开花结实期根际 N2O排放通量分别为 3.3,77.1,308.4 μg/(m2·h),14.1,45.6,182.4 μg/(m2·h) 和 19.3,44.9,224.6 μg/(m2·h),不同光照条件下高氮水平较低氮、脱氮处理均有增强水稻根际 N2O 排放的显著作用(P<0.05,图3)。但水稻根际 N2O 排放亦与光照密切相关。在低氮、高氮不同水平条件下,室内强光、自然光处理的水稻根际平均 N2O 排放通量分别相当于弱光处理的59.14%,58.24% 和 59.1%,72.8%,结果表明,在不同的供氮水平(1N、3N)下,与弱光处理比较,强光、自然光处理兼有抑制水稻根际 N2O 排放的效果。另外,弱光、强光及自然光不同条件下,低氮处理 (1N) 的水稻根际N2O 排放分别相当于脱氮处理的23.21,3.23,2.33倍,但自然光下低氮、脱氮处理间水稻根际 N2O 排放差异并不显著 (P>0.05)。显然,弱光条件下,与脱氮比,低氮施肥有效增强了水稻根际N2O 排放。但强光下低氮供肥对促进水稻根际N2O 排放不明显,强光、低氮协同作用有同步抑制水稻根际N2O 排放的作用效果。
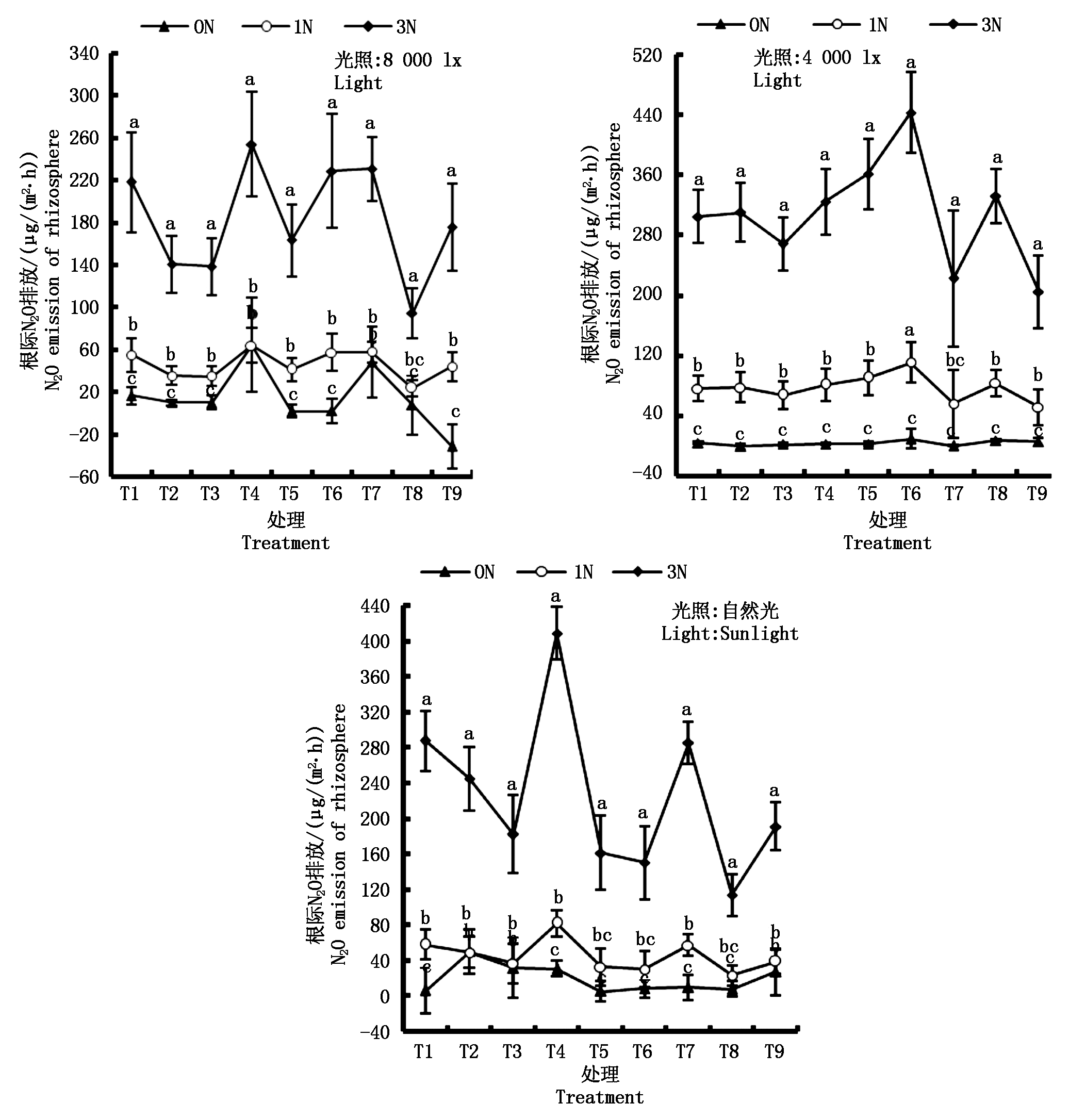
图3 不同光照条件下不同施氮量处理的开花结实期水稻根际N2O排放通量
Fig.3 N2O emission flux of rice rhizosphere in different nitrogen concentration at flowering and seed setting stage under various light illumination
此外,试验结果还表明,弱、强及自然光条件下脱氮、低氮、高氮处理叶际N2O排放占N2O总排放的比例分别为:脱氮,46.84%,62.61%,36.12%;低氮,27.39%,46.75%,36.90%;高氮,27.61%,39.71%,36.90%,进一步验证了水稻叶际N2O排放是稻田N2O 的重要排放源。
3 讨论与结论
3.1 水稻叶际 N2O 排放通量及其与光照、施氮量的关系
据统计,在全球范围内,农作物的 N2O 排放量占人类活动导致 N2O 排放总量的 60%[34-35]。玉米、大豆植物对土壤(砂)-植物系统N2O 排放的贡献率为 79.1%~100%[36]。林木排放的 N2O 约为林下土壤排放 N2O 的 86.7%[37]。有学者研究发现,水稻植株通气组织对稻田 N2O 排放的贡献率为 75%~86%[32]。但是,由于土壤介质存在不均匀性且很难控制,因此,对水稻叶际 N2O 的排放及其贡献进行定量评估现在还非常困难。
本试验设计的装置可以在非离体试验条件而且基本上不伤害水稻植株的情况下,对水稻叶际及根际 N2O的排放进行同步精确定量测定。同时,培养液的均匀一致性使试验结果会更加准确。试验结果表明,高氮水平、弱光处理的水稻分蘖期、开花结实期、成熟衰老期平均叶际 N2O 排放通量分别为 98.3,105.6, 121.3 μg/(m2·h),分别占水稻根、叶界面 N2O 总排放的 29.30%,30.16% 和 31.33%,且控氮施肥未降低水稻叶际对 N2O 排放的贡献。在弱光 (4 000 lx)、强光 (8 000 lx) 和自然光(平均 26 500 lx)不同条件下,水稻开花结实期叶际 N2O 排放贡献比例分别为:脱氮,46.84%,62.61%,36.12%;低氮,27.39%,46.75%,36.90%;高氮,27.61%,39.71%,36.90%。显然,不同生育期水稻叶际确有较大量的 N2O 排放损失,损失比例约30%~60%。强光、自然光下水稻叶际 N2O 排放贡献比例更高,而减少施氮虽然有效降低叶际 N2O排放通量,但未有相应降低水稻叶际 N2O 排放贡献的效果,而提高日间光强会相应提高水稻叶际的 N2O 排放贡献的作用。
3.2 光照和施氮量对水稻根际 N2O 排放的调控机制
农田土壤 N2O 的排放源目前研究得比较清楚,其产生机制主要是土壤微生物的硝化和反硝化过程[38]。从本试验结果看,NH4NO3 为氮源条件下,随着施氮量增加,水稻根际 N2O 排放明显增加。但高 ![]() 的培养液仅观测到极微量的水稻根际 N2O 净排放效应,故水稻根际 N2O 排放应主要源自以
的培养液仅观测到极微量的水稻根际 N2O 净排放效应,故水稻根际 N2O 排放应主要源自以 ![]() 为底物的生物反硝化过程。硝化细菌的反硝化作用在土壤有机质较低时就能发生[1]。本试验表明,水培时, O2 分压相对较低,作物根系分泌物及其残留物的降解能够为土壤微生物(尤其是根际微生物)提供充足的碳源和能源,从而进一步消耗培养液中的 O2[39],这就为水稻根际生物进行反硝化提供了最基本的条件。很显然,这是增施 NH4NO3能够有效促进水稻根际 N2O 排放的主要缘故。
为底物的生物反硝化过程。硝化细菌的反硝化作用在土壤有机质较低时就能发生[1]。本试验表明,水培时, O2 分压相对较低,作物根系分泌物及其残留物的降解能够为土壤微生物(尤其是根际微生物)提供充足的碳源和能源,从而进一步消耗培养液中的 O2[39],这就为水稻根际生物进行反硝化提供了最基本的条件。很显然,这是增施 NH4NO3能够有效促进水稻根际 N2O 排放的主要缘故。
其次,作物通过根系吸收与硝化反硝化作用能够竞争利用有效氮,从而减少 N2O 的生成[40]。与弱光比较,强光、自然光在不同供氮水平(1N、3N)下兼有抑制水稻根际 N2O 排放效应,其原因显然与适度范围内高光强有利于水稻吸收有效氮而抑制根际 N2O 排放效应密切向关。另外,试验表明弱光条件下低氮 (1N) 处理的水稻根际 N2O 排放相当于脱氮处理的 23.21 倍 (P<0.05),而强光、自然光照下脱氮与低氮处理间水稻根际 N2O 排放差异不显著 (P>0.05)。由此可见,高光强促进水稻植物氮吸收而抑制根际 N2O 排放作用,在低氮供应条件下表现得尤为突出,强光、低氮的协同作用有明显抑制水稻 N2O 排放重要作用。相反,弱光不利于水稻根系对氮素的吸收利用,而与之对比,弱光、低氮的协同作用有明显促进水稻根际 N2O排放的作用效果。
3.3 光照和施氮量对水稻叶际 N2O 排放的调控原理
对于植物地上部 N2O 挥发的主要机制,陈冠雄等[23]认为,当光合作用强度降低时植物体内的 C、N 不平衡,会造成 ![]() 的累积,然后,植物通过异化还原
的累积,然后,植物通过异化还原 ![]() 内源形成 N2O。但试验表明,即使在弱光、高
内源形成 N2O。但试验表明,即使在弱光、高 ![]() 供应水平下水稻叶际仅能挥发极微量的 N2O,而在本试验培养液氮源为
供应水平下水稻叶际仅能挥发极微量的 N2O,而在本试验培养液氮源为 ![]() 条件下,水稻叶际 N2O 排放才明显受光、氮作用的调节,C、N 不平衡显然不是影响水稻叶际 N2O 排放的唯一要素。有学者将水稻叶际 N2O 排放归结为水稻植株通气组织通道效应机制[31-32,41]。从本试验结果看,不同光控试验条件下增施 NH4NO3 兼有促进水稻根、叶界面 N2O 排放的明显作用,水稻叶际 N2O 排放的应确与根际 N2O 排放密切相关,通道效应应该就是水稻叶际 N2O 排放的主要来源。但也应指出,试验在强光、自然强光有效抑制根际 N2O 排放条件下,水稻叶际 N2O 排放反而明显增强,这和按照通道效应机制,N2O 排放应按比例增减机制不完全吻合,通道效应机制显然不能完全合理地解释水稻根、叶际 N2O 排放对光、氮的不同响应机制,将水稻叶际 N2O 排放完全归结为通道效应是一个值得商榷的问题。
条件下,水稻叶际 N2O 排放才明显受光、氮作用的调节,C、N 不平衡显然不是影响水稻叶际 N2O 排放的唯一要素。有学者将水稻叶际 N2O 排放归结为水稻植株通气组织通道效应机制[31-32,41]。从本试验结果看,不同光控试验条件下增施 NH4NO3 兼有促进水稻根、叶界面 N2O 排放的明显作用,水稻叶际 N2O 排放的应确与根际 N2O 排放密切相关,通道效应应该就是水稻叶际 N2O 排放的主要来源。但也应指出,试验在强光、自然强光有效抑制根际 N2O 排放条件下,水稻叶际 N2O 排放反而明显增强,这和按照通道效应机制,N2O 排放应按比例增减机制不完全吻合,通道效应机制显然不能完全合理地解释水稻根、叶际 N2O 排放对光、氮的不同响应机制,将水稻叶际 N2O 排放完全归结为通道效应是一个值得商榷的问题。
植物体N2O 排放来源的另一种方式是植物体内源形成和释放的 N2O。Smart和Bloom[21]用15N 标记研究表明,亚硝酸还原酶 (NiR) 催化还原 ![]() 内源形成 N2O。按照这一理论,弱光照、低 CO2浓度,有利于植物内源
内源形成 N2O。按照这一理论,弱光照、低 CO2浓度,有利于植物内源 ![]() 形成和积累,N2O排放增多;相反则N2O 排放减少,甚至吸收更多的 N2O[42],但植物体内 N2O的排放量与光合作用强度并不一定就存在相关关系[43]。王肖娟等[24]证实燕麦草(Lolium perenne L.) N2O 释放与其叶片
形成和积累,N2O排放增多;相反则N2O 排放减少,甚至吸收更多的 N2O[42],但植物体内 N2O的排放量与光合作用强度并不一定就存在相关关系[43]。王肖娟等[24]证实燕麦草(Lolium perenne L.) N2O 释放与其叶片![]() 含量呈正相关。从本研究结果看,强光在不同供氮水平(1N、3N)甚至脱氮(0N)条件下均有促进水稻叶际 N2O 释放效应,显示强光诱导水稻 NR 活性增强的效应,一定程度上也有利于水稻内源 N2O 形成和排放。综合前人与本研究结果可以看出,绝大部分水稻叶际 N2O 排放应主要源于通道效应机制,但水稻植物体
含量呈正相关。从本研究结果看,强光在不同供氮水平(1N、3N)甚至脱氮(0N)条件下均有促进水稻叶际 N2O 释放效应,显示强光诱导水稻 NR 活性增强的效应,一定程度上也有利于水稻内源 N2O 形成和排放。综合前人与本研究结果可以看出,绝大部分水稻叶际 N2O 排放应主要源于通道效应机制,但水稻植物体 ![]() 还原转化过程亦内源产生和排放一定数量N2O,对水稻叶际N2O 的排放也有重要影响。显然,这是在不同供氮水平(1N、3N)条件下,强光在抑制水稻根际 N2O排放的同时,同步促进水稻叶际 N2O 排放的重要原因。
还原转化过程亦内源产生和排放一定数量N2O,对水稻叶际N2O 的排放也有重要影响。显然,这是在不同供氮水平(1N、3N)条件下,强光在抑制水稻根际 N2O排放的同时,同步促进水稻叶际 N2O 排放的重要原因。
从本试验结果看,低氮供应水平(30 mg/L,NH4NO3)、高光强处理的水稻根、叶界面 N2O 排放与脱氮处理间差异均不显著,这证明通过施氮调控水稻氮素形态供应组成,在控制施氮量的同时适度增加铵态氮比例(本研究1∶1)来降低培养介质 ![]() 底物供应,并结合改善水稻植物光照条件进一步控制水稻根际N2O 排放,是控制水稻根、叶界面 N2O 减排的技术关键,这有待今后进一步研究证实。
底物供应,并结合改善水稻植物光照条件进一步控制水稻根际N2O 排放,是控制水稻根、叶界面 N2O 减排的技术关键,这有待今后进一步研究证实。
从本试验结果看,试验供氮范围内随着施氮量的增加,水稻根、叶界面N2O 排放通量随之增加;弱光下控制施氮量对控制水稻根、叶界面N2O 排放作用明显减弱;强光、高氮的协同作用,在抑制根际N2O 排放同时,有同步增强水稻叶际N2O 排放作用,而强光、低氮的协同作用,具有同步抑制水稻根、叶界面N2O 排放的作用效果。
[1] 夏仕明,陈洁,蒋玉兰,陈璐,刘贺,刘立军.稻田 N2O 排放影响因素与减排研究进展[J].中国稻米,2017,23(2):5-9. doi:10.3969/j.issn.1006-8082.2017.02.002.
Xia S M, Chen J, Jiang Y L, Chen L, Liu H, Liu L J. Advances in nitrous oxide emission and its reduction in rice field[J]. China Rice, 2017,23(2):5-9.
[2] 尹释玉.农田 N2O 排放研究进展[J].绿色科技,2016(12):152-154. doi:10.16663/j.cnki.lskj.2016.12.058.
Yin S Y. The progress of study on N2O emissions in crop land [J].Journal of Green Science and Technology, 2016(12):152-154.
[3] 李燕青,唐继伟,车升国, 温延臣,孙文彦,赵秉强.长期施用有机肥与化肥氮对华北夏玉米 N2O 和 CO2排放的影响[J].中国农业科学,2015,48(21):4381-4389. doi:10.3864/j.issn.0578-1752.2015.21.018.
Li Y Q, Tang J W, Che S G, Wen Y C, Sun W Y, Zhao B Q. Effect of organic and inorganic fertilizer on the emission of CO2 and N2O from the summer maize field in the north china plain[J]. Scientia Agricultura Sinica, 2015,48(21):4381-4389.
[4] 王艳群, 李迎春, 彭正萍, 王朝东, 刘亚男. 氮素配施双氰胺对冬小麦-夏玉米轮作系统N2O 排放的影响及效益分析[J]. 应用生态学报, 2015, 26 (7) :1999-2006. doi:10.13287/j.1001-9332.2015.0048.
Wang Y Q,Li Y C,Peng Z P,Wang C D,Liu Y N.Effects of dicyandiamide combined with nitrogen fertilizer on N2O emission and economic benefit in winter wheat and summer maize rotation system[J].Chinese Journal of Applied Ecology, 2015, 26 (7) :1999-2006.
[5] Ma J A, Li X L, Xu H, Han Y, Cai Z C, Yagi K.Effects of nitrogen fertilizer and wheat straw application on CH4 and N2O emissions from a paddy rice field[J]. Australian Journal of Soil Research, 2007, 45(5):359-367. doi:10.1071/SR07039.
[6] Tokuda S, Hayatsu M. Nitrous oxides emission potential of 21 acidic tea field soils in Japan[J]. Soil Science and Plant Nutrition, 2001, 47 (3) :637-642.doi:10.1080/00380768.2001.10408427.
[7] Barton L, Kiese R, Gatter D, Butterbach-Bahl K, Buck R, Hinz C, Murphy D V.Nitrous oxide emissions from a cropped soil in a semi-arid climate[J]. Global Change Biology, 2008, 14 (1):177-192.doi:10.1111/j.1365-2486.2007.01474x.
[8] Snyder C S, Bruulsema T W, Jensen T L, Fixen P E. Review of greenhouse gas emissions from crop production systems and fertilizer management effects[J]. Agriculture, Ecosystems and Environment, 2009, 133(3-4):247-266. doi.10.1016/j.agee.2009.04.021.
[9] 舒晓晓, 王艳群, 李迎春, 彭正萍, 魏珊珊, 石新丽, 赵延伟.不同氮肥管理方式对华北粮田 N2O 排放和作物产量的影响分析[J]. 农业资源与环境学报,2016,33(4):340-348. doi:10.13254/j.jare.2016.0037.
Shu X X, Wang Y Q, Li Y C, Peng Z P, Wei S S, Shi X L, Zhao Y W.Effect of different nitrogen management methods on soil N2O emission and crop yield of grain field in North China[J]. Journal of Agricultural Resoures and Environment, 2016, 33(4):340-348.
[10] López-fernánde S, Díez J A, Hernáiz P,Arce A, García-torres L, Vallejo A. Effects of fertilizer type and the presence or absence of plants on nitrous oxide emissions from irrigated soils[J]. Nutrient Cycling in Agroecosystems, 2007, 78 (3):279-289. doi:10.1007/s10705-007-9091-9.
[11] Ni W Z, Zhu Z L. Evidence of N2O emission and gaseous nitrogen losses through nitrification-denitrification induced by rice plants(Oryza sativa L.) [J]. Biology and Fertility of Soils, 2004, 40(3):211-214.doi:10.1007/s00374-004-0758-y.
[12] Chen N C, Inanaga S. Nitrogen losses in relation to rice varieties, growth stages, and nitrogen forms determined with the 15N technique[A]//Hatch D J, Chadwick D R, Jarvis S C, Roker J A. Controlling nitrogen technique flows and losses[M]. New-Haven:Wageningen Academic Publishers, 2004:496 497.doi 10.3920/978-90-8686-765-3.
[13] 纪洋,张晓艳,马静,李小平, 徐华, 蔡祖聪.控释肥及其与尿素配合施用对水稻生长期N2O 排放的影响[J].应用生态学报,2011,22(8) :2031-2037. doi:10.13287/j.1001-9332.2011.0279.
Ji Y,Zhang X Y,Ma J,Li X P,Xu H,Cai Z C. Effects of applying controlled-release fertilizer and its combination with urea on nitrous oxide emission during rice growth period[J].Chinese Journal of Applied Ecology, 2011,22(8) :2031-2037.
[14] 徐驰,谢海宽,丁武汉, 戴震, 张婧, 王立刚, 李虎.油菜-水稻复种系统一次性施肥对 CH4和 N2O 净排放的影响[J].中国农业科学,2018,51(20):3972-3984. doi:10.3864/j.issn.0578-1752.2018.20.015.
Xu C, Xie H K, Ding W H, Dai Z, Zhang J, Wang L G, Li H. The impacts of CH4 and N2O net emission under one-off fertilization of rape-paddy replanting system[J].Scientia Agricultura Sinica, 2018,51(20):3972-3984.
[15] 王重阳, 郑靖, 顾江新, 史奕, 陈欣. 下辽河平原几种旱作农田 N2O 排放通量及相关影响因素的研究[J]. 农业环境科学学报, 2006, 25 (3):143-150. doi:10.11654/jaes.2017-0768.
Wang C Y, Zheng J, Gu J X, Shi Y, Chen X. Emission and affecting factors of major greenhouse gases (GHGs) from single-season paddy field in the lower reaches of liaohe plain[J].Journal of Agro-Environment Science, 2006, 25 (3):143-150.
[16] 席瑞泽,付庆灵,杨永强,尤锦伟, 朱俊, 胡红青, 叶磊.氮肥品种和含水量对水稻土 N2O 排放速率及排放过程的影响[J].农业环境科学学报,2017,36(12):2553-2560. doi:10.11654/jaes.2017-0768.
Xi R Z, Fu Q L, Yang Y Q, You J W, Zhu J, Hu H Q, Ye L. Effects of nitrogen fertilization and water content on the process and rate of N2O emission in paddy soils[J].Journal of Agro-Environment Science, 2017,36(12):2553-2560.
[17] Ni K, Ding W X, Zaman M, Cai Z C, Wang Y F, Zhang X L, Zhou B K. Nitrous oxide emissions from a rained cultivated black soil in Northeast China:effect of fertilization and maize crop[J]. Biology and Fertility of Soils, 2012, 48(8):973-979. doi:10.1007/s00374-012-0709-y.
[18] Sehy U, Ruser R, Munch J C. Nitrous oxide fluxes from maize fields:relationship to yield, site-specific fertilization, and soil conditions[J]. Agriculture, Ecosystems and Environment, 2003, 99(1-3):97-111. doi:10.1016/s0167-8809(03)00139-7.
[19] Han X, Fan J W, Bai J H,Ren H Y, Li Y C, Diao T T, Guo L P. Effects of reduced nitrogen fertilization and biochar application on CO2 and N2O emissions from a summer maize-winter wheat rotation field in North China[J]. Agricultural Science & Technology, 2016, 17(12):2800-2808.
[20] 苏荣瑞,刘凯文,王斌, 金涛, 李健陵, 蔡威威, 尤慧, 周守华.江汉平原施氮水平对稻田 CH4 和 N2O 排放及水稻产量的影响[J].中国农业科技导报,2016,18(5) :118-125. doi:10.13304/j.nykjdb.2016.060.
Su R R, Liu K W,Wang B,Jin T, Li J L,Cai W W,You H,Zhou S H.Effect of different nitrogen fertilizer level on CH4 and N2O emission from single cropping rice field in jianghan plain[J].Journal of Agricultural Science and Technology, 2016,18(5) :118-125.
[21] Smart D R, Bloom A J. Wheat leaves emit nitrous oxide during nitrate assimilation[J]. Proceedings of the National Academy of Science of the United States of America, 2001, 98(14):7875-7878. doi:10.1073/pnas.131572798.
[22] 吕小红,黄河,陈温福, 宋玉婷.施氮水平对不同株型水稻品种N2O 排放通量的影响[J].北方水稻,2015,45(6): 16-19. doi:10.16170/j.cnki.1673-6737.2015.06.004
Lü X H, Huang H, Chen W F, Song Y T. Effect on N2O flux of different plant type riceunder several nitrogen levels[J].North Rice, 2015,45(6):16-19.
[23] 陈冠雄, 徐慧, 张颖, 张秀君,李玥莹,史荣久,于克伟,张旭东. 植物——大气N2O 的一个潜在排放源[J]. 第四纪研究, 2003, 23(5):504-511. doi:10.3321/j.issn.1001-7410.2003.05.005.
Chen G X, Xu H, Zhang Y, Zhang X J, Li Y Y, Shi R J, Yu K W, Zhang X D. Plant:a potential source of the atmospheric N2O[J].Quaternary Sciences, 2003,23(5):504-511.
[24] 王肖娟,王永强,赵双玲, 李丽, 苏天潮, 刘小武.不同灌溉方式及施肥量对稻田土壤 N2O 排放的影响[J].大麦与谷类科学,2018,35(3):1-4,21. doi:10.14069/j.cnki.32-1769/s.2018.03.001.
Wang X J, Wang Y Q, Zhao S L, Li L, Su T C, Liu X W. Effects of drip irrigation and flood irrigation under different application rates of nitrogen fertilizer on N2O emission in rice field[J].Barley and Cereal Sciences, 2018,35(3):1-4,21.
[25] 方泽涛,李伏生,刘靖雯, 王楷, 董艳芳, 黄忠华, 罗维钢.不同灌溉模式和施氮处理下稻田N2O排放与反硝化酶活性的关系[J].应用与环境生物学报,2017,23(6):1059-1066.doi:10.3724/SP.J.1145.2016.12040.
Fang Z T, Li F S, Liu J W, Wang K, Dong Y F, Huang Z H, Luo W G. Relationship between N2O emission and denitrification enzyme activity in paddy soil under different irrigation modes and nitrogen treatments[J].Chinese Journal of Applied and Environmental Biology, 2017,23 (6) :1059-1066.
[26] 裴自伟,陈意超,李伏生, 黄忠华, 罗维刚.不同灌水模式和施氮处理下稻田 N2O 排放通量及其与硝化-反硝化细菌数量的关系[J].农业环境科学学报,2017,36(12):2561-2568. doi:10.11654/jaes.2017-0749.
Pei Z W, Chen Y C, Li F S, Huang Z H, Luo W G. The relationship between N2O emission flux from paddy fields and nitrifying-denitrifying bacteria under different irrigation methods and nitrogen treatments[J].Journal of Agro-Environment Science, 2017,36(12):2561-2568.
[27] Li Y, Lin E D, Rao M J. The effect of agricultural practices on methane and nitrous oxide emissions from rice field and pot experiment[J]. Nutrient Cycling in Agroecosystems, 1997,49(1-3):47-50.doi:10.1023/a:1009799216797.
[28] 朱金霞, 张源沛, 郑国保, 孔德杰. 氮肥对宁夏地区水稻田N2O排放的影响[J]. 西北农业学报, 2014,23 (1):98-102.doi:10.7606/j.issn.1004-1389.2014.01.018
Zhu J X, Zhang Y P, Zheng G B, Kong D J. Effect of nitrogen fertilizer on the emission of N2O from paddy field in Ningxia, China[J].Acta Agriculturae Boreali-Occidentalis Sinica, 2014,23 (1):98-102.
[29] 宋亚娜,林艳, 陈子强.氮肥水平对稻田细菌群落及 N2O 排放的影响[J].中国生态农业学报,2017, 25(9):1266-1275. doi:10.13930/j.cnki.cjea.170146.
Song Y N, Lin Y, Chen Z Q. Effect of nitrogen fertilizer level on bacterial community and N2O emission in paddy soil[J].Chinese Journal of Eco-Agriculture, 2017, 25(9):1266-1275.
[30] 邹建文, 黄耀, 宗良纲, 郑循华,王跃思.稻田CO2、CH4 和 N2O排放及其影响因素[J]. 环境科学学报, 2003, 23 (6):758-764. doi:10.13671/j.hjkxxb.2003.06.011.
Zou J W, Huang Y, Zong L G, Zheng X H, Wang Y S.A field study on CO2, CH4 and N2O emissions from rice paddy andimpact factors[J].Acta Scientiae Circumstantiae, 2003, 23 (6):758-764.
[31] 徐胜光 ,陈泽斌 ,余磊, 刘佳妮, 陈武荣, 李冰, 王定康, 耿开友.光照对开花结实期水稻根叶氮氧化物排放的影响[J]. 农业工程学报,2016,32(7):206-214. doi:10.11975/j.issn.1002-6819.2016.07.029.
Xu S G, Chen Z B, Yu L, Liu J N, Chen W R, Li B, Wang D K, Geng K Y. Effects of light quality and intensity on nitrogen oxide gas emissions of rice phyllosphere and rhizosphere at flowering and seed setting stage[J].Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(7):206-214.
[32] 徐胜光,林丽,余磊, 陈泽斌, 刘佳妮, 王定康, 耿开友.水稻成熟衰老期叶际及根际氮氧化物排放的光控机制[J]. 环境科学研究,2016,29(7):963-971. doi:10.13198/j.issn.1001-6929.2016.07.03.
Xu S G,Lin L,Yu L,Chen Z B, Liu J N, Wang D K, Geng K Y. Impacts of light quality and intensity on nitrogen oxide gas emissions of rice phyllosphere and rhizosphere at mature aging stage[J].Research of Environmental Sciences,2016,29(7):963-971.
[33] 徐胜光,高召华,林丽, 陈泽斌,陈武荣,李冰,余磊.氮素形态和光照强度对水稻表土及根际 N2O 排放的影响[J]. 植物营养与肥料学报,2016, 22(5):1319-1328. doi:10.11674/zwyf.15402.
Xu S G, Gao Z H, Lin L, Chen Z B, Chen W R, Li B, Yu L. N2O emissions from rice phyllosphere and rhizosphere when supplied with different nitrogen forms and light intensities[J]. Journal of Plant Nutrition and Fertilizer, 2016, 22(5):1319-1328.
[34] 陈诺, 廖婷婷, 王睿, 郑循华, 胡荣桂, Klaus Butterbach-Bahl. 碳底物含量对厌氧条件下水稻土 N2、N2O、NO、CO2和 CH4排放的影[J]. 环境科学, 2014, 35 (9):3595-3604. doi:10.13227/j.hjkx.2014.09.048.
Chen N,Liao T T,Wang R,Zheng X H,Hu R G,Klaus B B. Effect of carbon substrate concentration on N2,N2O,NO,CO2 and CH4 emissions from a paddy soil in anaerobic condition[J]. Environmental Science, 2014, 35 (9):3595-3604.
[35] IPCC. Contribution of working group III to the fourth assessment report of the intergovernmental panel on climate change[M]. UK:Cambridge University Press, 2007:63-67.
[36] 姜珊珊,庞炳坤,张敬沙, 蒋静艳.减氮及不同肥料配施对稻田 CH4和 N2O 排放的影响[J].中国环境科学,2017,37(5):1741-1750. doi:10.3969/j.issn.1000-6923.2017.05.017.
Jiang S S, Pang B K, Zhang J S, Jiang J Y. Effects of reduced nitrogen and combined application of different fertilizers on CH4 and N2O emissions in paddy fields[J]. China Environmental Science, 2017,37(5):1741-1750.
[37] 刘红江,郭智,张丽萍, 朱兴连, 孙国峰, 陈留根, 郑建初.有机-无机肥不同配施比例对稻季 CH4和 N2O 排放的影响[J].生态环境学报,2016, 25(5):808-814. doi:10.16258/j.cnki.1674-5906.2016.05.012.
Liu H J, Guo Z, Zhang L P, Zhu X L, Sun G F, Chen L G, Zheng J C. Effects of different combined application ratio of organic-inorganic fertilization on CH4 and N2O emissions in paddy season [J]. Ecology and Environmental Sciences, 2016, 25(5):808-814.
[38] 韦至激,方泽涛,李伏生, 黄忠华, 谭文艳,罗维钢.不同灌溉模式和施氮量下稻田 N2O 排放与有机氮组分的关系[J]. 江苏农业科学,2018,46(9): 246-251. doi:10.15889/j.issn.1002-1302.2018.09.059.
Wei Z J, Fang Z T, Li F S, Huang Z H, Tan W Y, Luo W G.Relationship between N2O emission and organic nitrogen fraction in paddy fields under different irrigation modes and nitrogen application rates[J].Jiangsu Agricultural Sciences, 2018,46(9):246-251.
[39] Philippot L, Hallin S, Börjesson G, Baggs E M. Biochemical cycling in the rhizosphere having an impact on global change[J]. Plant and Soil, 2009, 321(1-2):61-81. doi:10.1007/S11104-008-9796-9.
[40] Jarecki M K, Parkin T B, Chan A S K, Kaspar T C, Moorman T B,Singer J W, Kerr B J, Hatfield J L,Jones R.Cover crop effects on nitrous oxide emission from a manure-treated Mollisol [J]. Agriculture Ecosystems and Environment, 2009,134(1-2):29-35. doi.10.1016/j.agee.2009.05.008.
[41] Yan X, Shi S, Du L, Xing G. Pathways of N2O emission from rice paddy soil[J]. Soil Biology and Biochemistry, 2000, 32(3):437-440. doi:10.1016/S0038-0717(99)00175-3.
[42] 陈欣, 沈善敏, 张璐, 吴杰.交叉培养法研究养分对作物幼苗释放N2O的影响[J]. 应用生态学报, 1997, 8 (2):177-180. doi:10.13287/j.1001-9332.1997.0034.
Chen X, Shen S M, Zhang L, Wu J. Effect of nutritional condition on N2O emissionby crop seedlings-a sand-liguid cross culture study[J].Chinese Journal of Applied Ecology, 1997, 8 (2):177-180.
[43] 黄国宏, 陈冠雄, 徐慧, 吴杰,王玉杰,于克伟. 无菌大豆植株释放N2O的研究[J].植物学报, 1992, 34 (11):835-839.
Huang G H, Chen G X, Xu H, Wu J, Wang Y J, Yu K W. Investigation on emission of nitrousoxide by aseptic soybean plant [J]. Journal of Integrative Plant Biology, 1992, 34 (11):835-839.