在植物生长发育过程中,往往会利用一套复杂而精致的防卫机理来识别和应答环境逆境,包括各种生物和非生物胁迫。这里所述的植物防卫机理主要是指通过抗逆基因的转录激活和抑制来发挥抗性作用[1],在此过程中,转录因子通过与靶基因的顺式作用元件特异性结合来调控其表达,从而在植物受到胁迫时发挥作用。转录因子主要包括:NAC、MYB、bZIP、WRKY等;其中WRKY转录因子是植物所特有的一类转录因子,其功能涉及生物和非生物胁迫中的抗性响应。
Ishiguro和Nakamura[2]从白薯(Ipomoea batatas L.)中克隆得到第1个WRKY转录因子SPFl。此后,人们从不同植物中克隆到相应的WRKY基因。WRKY转录因子家族通常含有1个或2个WRKY保守结构域,其N末端含有WRKYGQK保守结构域,C末端有C2H2或C2HC型锌指结构[3]。根据所含WRKY结构域的数量及锌指结构的不同将WRKY转录因子分为Ⅰ、Ⅱ和Ⅲ类;其中,第Ⅱ类根据其保守结构域的差异,进一步被分为:Ⅱa、Ⅱb、Ⅱc、Ⅱd和Ⅱe[4]。目前,许多研究报道植物WRKY转录因子参与生物和非生物逆境响应。烟草WRKY基因的表达受到烟草花叶病毒(TMV)、细菌、真菌、水杨酸和H2O2的诱导[5-7]。在拟南芥中,有很多WRKY转录因子参与植株的抗病反应,如AtWRKY33[8]、AtWRKY40[9]、AtWRKY3[10]、AtWRKY22[11]、AtWRKY48[12]、AtWRKY7[13]等。棉花GhWRKY22表达受到大丽轮枝菌、水杨酸和茉莉酸诱导,参与棉花的抗病反应[14]。然而,新的棉花抗病相关WRKY转录因子仍需进一步分离和功能鉴定,为棉花抗病育种提供丰富的候选基因。
棉花黄萎病被称为棉花的癌症,每年因黄萎病危害造成棉花产量大幅下降,然而,化学农药和栽培措施很难达到理想的防治效果。近年来,利用基因工程技术培育植物抗病品种成为一个研究方向。本研究从陆地棉(Gossypium hirsutum L.)中分离出1个与抗病相关的转录因子WRKY基因,命名为GhWRKY48。利用基因沉默技术获得GhWRKY48沉默植株,对其进行大丽轮枝菌接种试验表明, GhWRKY48基因沉默提高了植株对大丽轮枝菌的抗性。因此,GhWRKY48是一个负调控抗病的转录因子,可以作为棉花抗黄萎病育种的候选基因。
1 材料和方法
1.1 试验材料
棉花材料为中棉所35,购自山西农业科学院棉花研究所种苗公司。大肠杆菌感受态细胞DH5α、根癌农杆菌菌株GV3101和阳性对照载体pYL-156-PDS均由植物基因组学国家重点实验室保存。黄萎病菌菌株(大丽轮枝菌,V. dahliae)V991,由中国农业科学院植物保护研究所简桂良研究员馈赠。VIGS技术所需的病毒表达载体pYL-156和辅助载体pYL-192由清华大学刘玉乐教授惠增。
各种限制性内切酶、RNA提取试剂盒和质粒提取试剂盒分别购自大连宝生物公司、上海生工公司和上海捷瑞公司。PCR反应所需要的各种试剂、PCR 纯化回收试剂盒、PCR 切胶回收试剂盒、T4DNA连接酶、EasyScript One-Step gDNARemovel and cDNA Synthesis SuperMix试剂盒、克隆载体pEASY-T1试剂盒和TransStart Top Green qPCR SuperMix试剂盒均购自北京全式金生物技术有限公司。
1.2 试验方法
1.2.1 植物材料的种植 将棉花种子用水浸泡,置于37 ℃浸泡过夜,然后移置到培养盒中,置于25 ℃光照12 h黑暗8 h的光照培养箱中处理48 h,等种子发芽后移置到含1/8MS营养液的培养盒中或种植到营养土中,放置到培养箱中进行培养。
1.2.2 RNA的提取和cDNA第一链的合成 棉花不同样品RNA的提取参照RNA提取试剂盒说明书进行。cDNA第一链的合成参照EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒说明进行。
1.2.3 GhWRKY48基因的克隆及系统进化树构建 根据拟南芥AtWRKY48氨基酸序列在棉花基因组数据库(https://www.cottongen.org/)进行直系同源比对,获得与AtWRKY48高保守性的直系同源基因,命名为GhWRKY48。根据GhWRKY48基因序列设计引物:GhWRKY48-F:5′-ATGAGATTTTCCGATG AGAATTCGAC-3′;GhWRKY48-R:5′-CACTTGTTCA TTAGCCTCGTTCCTC-3′。以棉株根的cDNA为模板进行PCR扩增,将扩增产物纯化后连接到T载体上进行测序。
在NCBI中选取不同植物WRKY48的氨基酸序列,利用MEGA 5.2进行系统进化树构建。
1.2.4 病毒沉默载体pYL-156-GhWRKY48的构建 首先克隆GhWRKY48基因的目的片段,扩增所用引物为VGhWRKY48-F:5′-CGGGATCCGCGATGATG AAGAACAAGACAAG-3′;VGhWRKY48-R:5′-GGGG TACCGAGACAATGAAGCATACATATAGGG-3′(下划线分别表示BamH Ⅰ和Kpn Ⅰ酶切位点)。通过PCR获得该片段,用限制性内切酶BamH Ⅰ和Kpn Ⅰ酶切pYL-156载体和扩增产物,然后进行连接反应,将片段插入到pYL-156 载体的BamH Ⅰ和Kpn Ⅰ位点之间构建成病毒沉默载体pYL-156-GhWRKY48。将载体pYL-156-GhWRKY48转化大肠杆菌DH5α后,挑选阳性克隆,进行测序鉴定,结果表明,所获得的片段是所要克隆的GhWRKY48基因的目的片段。
1.2.5 工程农杆菌的培养 用电击法将已经构建正确的病毒沉默载体pYL-156-GhWRKY48、辅助载体pYL-192、阳性对照载体pYL-156-PDS和阴性对照载体pYL-156转化到农杆菌GV3101中,经卡那霉素(50 mg/mL)、庆大霉素(50 mg/mL)和利福平(25 mg/mL)筛选,挑选阳性克隆,进行PCR和测序验证,结果表明,病毒沉默载体pYL-156-GhWRKY48、辅助载体pYL-192、阳性对照载体pYL-156-PDS和阴性对照载体pYL-156均已经转入农杆菌GV3101。
1.2.6 GhWRKY48基因沉默植株的培育 上述验证正确的工程农杆菌加到含有卡那霉素(50 mg/mL)、庆大霉素(50 mg/mL)和利福平(25 mg/mL)的液体LB 培养基中,于28 ℃,200 r/min培养过夜,培养液经离心后收集菌体,用MMA(10 mmol/L MES,10 mmol/L MgCl2,200 mmol/L AS)溶液重悬菌体,调节至终浓度OD600为1.2,放到黑暗处静置2~3 h,然后将含有pYL-156-GhWRKY48、pYL-156-PDS、pYL-156的农杆菌悬浮液分别与含pYL-192的农杆菌悬浮液等比例混合均匀备用。当棉花两片子叶完全展开后,可用于农杆菌注射侵染;先用针头在子叶背面轻轻划1个小的伤口,然后用1 mL去掉针头的无菌注射器将菌液从子叶背面的伤口处注射进去,尽量使整片子叶全部被侵染,将注射后的植株放到黑暗处处理12 h后,放到培养箱中继续培养。
1.2.7 大丽轮枝菌接种棉花 取适量保存于-80 ℃冰箱的大丽轮枝菌涂布于PDA培养基上[15],25 ℃培养箱黑暗培养4 d,挑取菌块于查式培养液[16],28 ℃ 200 r/min 摇床上培养4~5 d后用8层医用纱布过滤除去菌丝,然后通过血球计数板计算大丽轮枝菌孢子数(Spores),用无菌水将孢子液的浓度调整为106spores/mL 待用。
接种方法根据雷煜[14]所述进行,对14 d的棉株主根进行统一伤根处理,然后将其根部浸泡到大丽轮枝菌孢子液中50 min,转移到水培盒中继续培养,按照相应的时间点取棉株根样(0,6,12,24,36,48 h),保存于-80 ℃冰箱待用。
为了验证WRKY48的抗病功能,对GhWRKY48沉默植株和对照植株接种大丽轮枝菌,方法如上所述,接菌23 d后,观察植株抗病表型、统计抗病指数和发病率。
1.2.8 激素处理 激素处理方法按照先前报道的进行[17]。简单地说就是将配置好的茉莉酸(JA)和水杨酸(SA)母液分别加到含有Hoaglangs营养液的培养盒中,使其终浓度分别为0.1,2.0 mmol/L,按照相应的时间点取棉株根样(0,6,12,24,36,48 h),保存于-80 ℃冰箱待用。
1.2.9 Quantitative Real-time RT-PCR (qPCR)方法 以cDNA为模板,具体配置参照试剂盒说明进行。设计特异性引物(qGhWRKY48-F:5′-GAAGGCAAA CACACGCATC-3′;qGhWRKY48-R:5′-CATTAGCCT CGTTCCTCGTCT-3′),以棉花UBQ7作为内参基因(UBQ7-F:5′-GAAGGCATTCCACCTGACCAAC-3′;UBQ7-R:5′-CTTGACCTTCTTCTTCTTGTGCTTG-3′),生物学试验重复3次,基因的相对表达量通过2-ΔΔCT方法计算。
2 结果与分析
2.1 GhWRKY48基因克隆及序列分析
先前已经对棉花抗病相关WRKY的功能进行初步鉴定和分析,其中GhWRKY48是一个负调控转录因子[14],本研究中对其抗病功能进行进一步探讨和分析。根据棉花基因组数据库(https://www.cottongen.org/)已公布的GhWRKY48序列,设计特异引物,以棉花根的cDNA为模板进行PCR扩增,将PCR产物连接到T载体上进行测序。结果表明,获得的片段大小与预期的大小一致,该片段全长882 bp,包含了从ATG到TAG完整的ORF阅读框,编码了293个氨基酸残基(图1-A),DNAMAN分析软件预测分子质量为32.68 ku,等电点pI=6.10。
在NCBI中,针对WRKY48蛋白进行搜索,主要获得5种植物WRKY48的氨基酸序列:拟南芥AtWRKY48 (Arabidopsis thaliana,NP_199763.1)、白菜BrWRKY48(Brassica rapa,NP_001288867.1)、大豆GmWRKY48(Glycine max,NP_001237221.2)、烟草NaWRKY48(Nicotiana attenuata,XP_019262610.1)。并将其与棉花GhWRKY48构建系统进化树,由图1-B可以看出,GhWRKY48与烟草WRKY48蛋白具有较近的亲缘关系。
2.2 GhWRKY48基因组织和激素处理表达分析
提取棉花根、茎和叶的总RNA,反转录成cDNA,用qPCR方法检测GhWRKY48在这些组织中的表达情况,结果表明,其在根、茎和叶中均表达,茎中为优势表达(图2-A)。
利用qPCR方法分析 SA和JA对GhWRKY48转录水平的影响,结果表明,SA和JA均能诱导GhWRKY48表达。JA处理后,在1.5 h GhWRKY48表达量达到最大,但在3.0 h表达量为最低,12.0 h表达量达到第2个高峰值,总体说呈现双峰趋势(图2-B)。SA处理后,也是在1.5 h GhWRKY48表达量达到最大值,此后逐渐下降,除了12.0 h表达量小于对照,其他时间点的表达量均显著高于对照(图2-C)。结果说明,GhWRKY48基因对这2种激素都存在着应答响应。

A.GhWRKY48编码序列及推导的氨基酸序列;翻译起始密码子(ATG)与翻译终止密码子(TAG)
分别用位于序列的开始和末尾;B.GhWRKY48蛋白与其他植物WRKY48蛋白的系统进化树分析。
A.Coding sequence and deduced amino acids of GhWRKY48; The translation start codon (ATG) and stop codon (TAG) were located at the beginning and end of the sequence, respectively; B.Phylogenetic tree analysis on GhWRKY48 protein and WRKY48 protein of other plants.
图1 棉花GhWRKY48编码序列、推导的氨基酸序列及与其他物种的系统进化树分析
Fig.1 Coding sequence and deduced amino acids of GhWRKY48 and phylogenetic tree analysis of WRKY48 from cotton and other plant species

A.GhWRKY48在棉花不同组织中的表达分析;B和C. JA 和SA处理后GhWRKY48的表达分析。不同字母表示差异显著(P<0.05)。图3-5同。
A. The expression analysis of GhWRKY48 in different tissues of cotton; B and C.The expression analysis of GhWRKY48 under the treatment of JA or SA.The different alphabets stand for significant difference(P<0.05).The same as Fig.3-5.
图2 GhWRKY48组织特异表达分析和激素诱导表达分析
Fig.2 The expression analysis of GhWRKY48 in cotton different tissues and that under the treatments of different hormones
2.3 大丽轮枝菌入侵对棉花GhWRKY48诱导表达分析
为了分析GhWRKY48基因是否参与棉花的抗病性,利用qPCR方法分析GhWRKY48基因对大丽轮枝菌的响应。结果发现,其表达量呈现出先降低后增加的趋势,接菌诱导后6 h其表达量显著下降,但在12 h后又呈现大幅度的上升,接菌36 h表达量与对照相似,然而在48 h时GhWRKY48表达量显著上升(图3),结果表明,该GhWRKY48基因受到大丽轮枝菌的强烈诱导,暗示GhWRKY48参与棉花对病原菌的抗性。
2.4 GhWRKY48基因沉默植株的培育
为了进一步分析 GhWRKY48基因的抗病功能,先利用VIGS技术培育GhWRKY48基因沉默植株,进而对其抗病功能进行鉴定。首先利用PCR技术克隆GhWRKY48基因的特异片段,该片段大小为423 bp(图4-A),将片段插入到pYL-156 载体中构建成病毒沉默载体pYL-156-GhWRKY48(图4-B)。将含pYL-156-PDS、pYL-156和pYL-156-GhWRKY48的农杆菌与含pYL-192的农杆菌1∶1混合注射到棉花子叶中。农杆菌侵染植株12 d后,阳性对照PDS基因被沉默的植株叶片出现失绿表型,表明TRV病毒在棉花植株中已经成功地进行系统感染,暗示目的基因已经被沉默;而注射空载体(pYL-156)阴性对照植株的叶片仍为绿色(图4-C)。此时,利用qPCR技术检测GhWRKY48基因在沉默植株和对照植株中的表达情况,结果表明,沉默植株中该基因的表达水平下降了约90%(图4-D)。
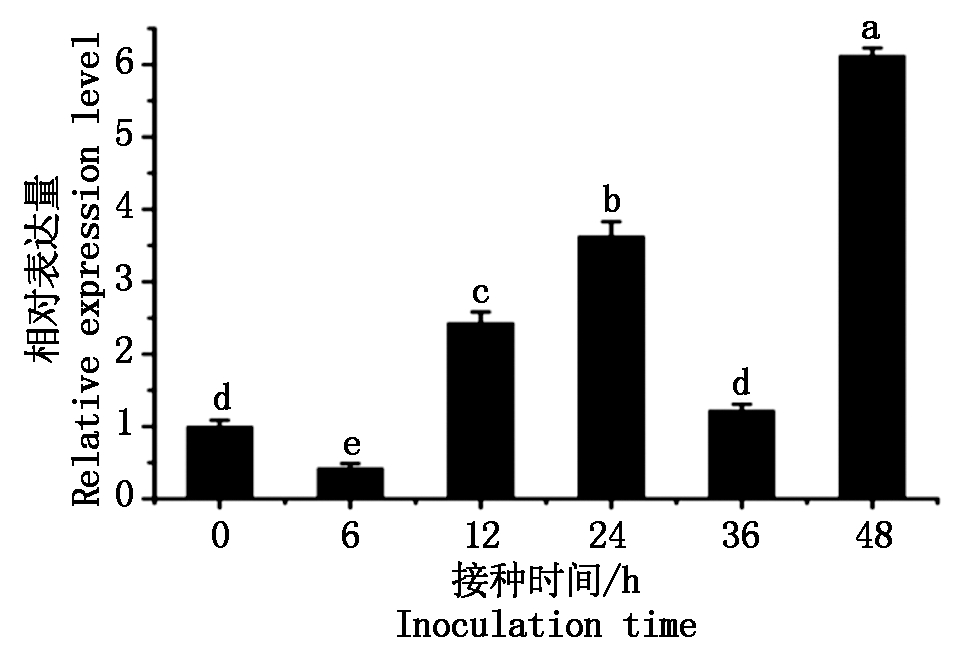
图3 大丽轮枝菌对GhWRKY48的诱导表达分析
Fig.3 The expression analysis of GhWRKY48 under V. dahliae infection
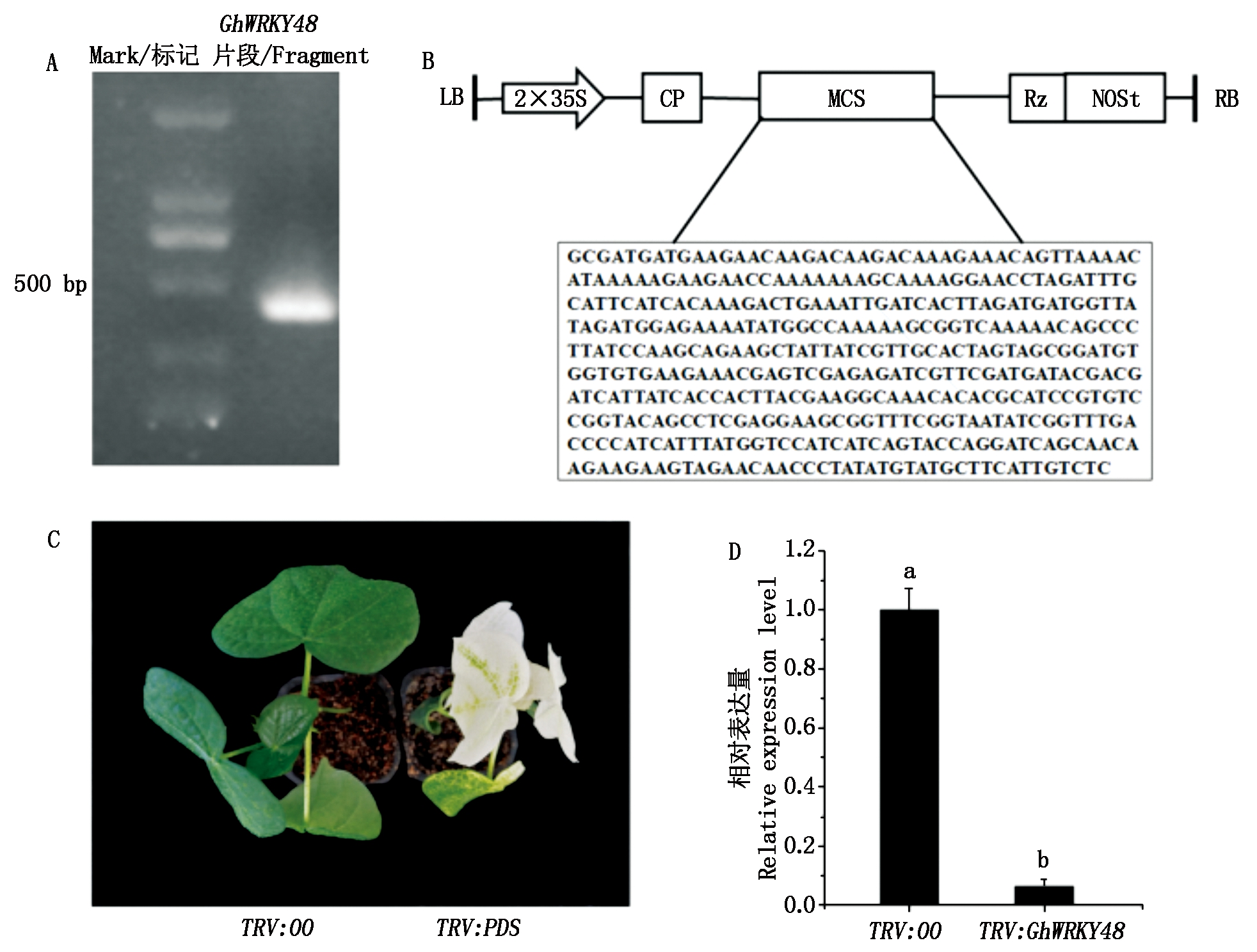
A.PCR扩增的GhWRKY48目的片段;B. pYL-156-GhWRKY48载体的构建示意图;
C.GhPDS沉默植株的叶片白化表型;D.沉默植株中GhWRKY48表达量分析。
A.GhWRKY48 fragment by PCR amplification; B.Sketch map of pYL-156-GhWRKY48 vector;
C.Blenching leaves of GhPDS-silenced plants; D.The expression analysis of GhWRKY48 in silenced plants.
图4 GhWRKY48沉默植株的获得
Fig.4 The development of GhWRKY48-silenced plants
2.5 GhWRKY48沉默提高棉花植株对大丽轮枝菌的抗性
选取沉默效果较好的植株进行大丽轮枝菌接菌处理,接菌23 d后,对照植株表现出明显的叶片黄化,萎蔫脱落等发病症状,而GhWRKY48沉默植株表现出更强的抗病性,与对照植株相比叶片黄化和落叶等发病症状较轻(图5-A)。GhWRKY48沉默植株的发病率和病情指数分别与对照植株大约低18百分点(图5-B-左)和17(图5-B-右),结果表明,GhWRKY48沉默植株对大丽轮枝菌具有更强的抗性。说明GhWRKY48负调控棉花对大丽轮枝菌的抗病性。
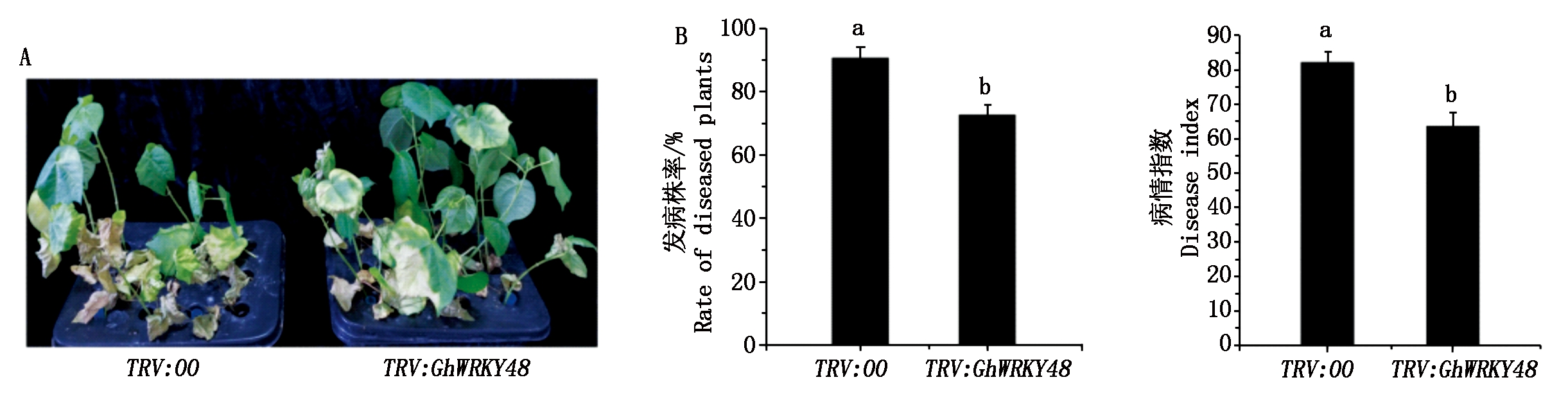
A. GhWRKY48沉默植株发病情况分析;B.GhWRKY48沉默植株发病率(左)和病情指数(右)分析。
A. The disease symptom analysis of GhWRKY48-silenced plants under the treatment of V. dahliae;
B. The analyses of rate of diseased plants (left panel) and disease index (right panel) on GhWRKY48-silenced plants.
图5 GhWRKY48沉默植株的抗病性分析
Fig.5 The disease-resistant analysis of GhWRKY48-silenced plants
3 结论与讨论
棉花是一种人类种植的重要经济作物,是人们美好生活的重要物质保证。然而,棉花的生产受到各种生物和非生物逆境的胁迫,其中棉花黄萎病严重制约着棉花的产量和品质。目前,缺少棉花黄萎病抗病种质资源,所以常规棉花抗病育种停滞不前[18]。为了解决当前这个棘手的问题,利用基因工程技术培育抗病新品种是一个经济有效的方法。本研究从陆地棉中分离了1个棉花抗病相关基因GhWRKY48,沉默该基因后植株的抗病性增强,暗示其为负调控抗病基因。
WRKY转录因子在植物防卫反应中起着重要作用。在水稻中,OsWRKY13和OsWRKY45的过表达提高了植株对病原菌的抗性[19-20]。在棉花中,GbWRKY1的过表达降低了植株对灰霉菌和大丽轮枝菌的抗性,结果表明,GbWRKY1对灰霉菌和大丽轮枝菌起负调控作用[21]。在拟南芥中,WRKY48的突变体通过增加PR1基因的表达增强了对细菌病原体的抗性;同时过表达WRKY48能够降低PR基因的表达,从而降低了植株对细菌病原体的抗性,表明WRKY48是一个负调控因子[12]。由此可见,WRKY转录因子可以作为正调控因子或负调控因子参与植物的防卫反应。本研究中,通过VIGS反向遗传学方法证明GhWRKY48负调控棉花对大丽轮枝菌的抗病性,是一个负调控因子,与上述的研究结果一致。
本研究表明,GhWRKY48基因的表达受到大丽轮枝菌及JA和SA的诱导,是植物防卫途径中一个重要的负调控蛋白,可能调控下游抗病基因(如抗病相关基因,PR)表达,参与棉花对大丽轮枝菌的抗性。先前研究表明,WRKY转录因子通过调节PR基因的表达参与植物防卫反应。如AtWRKY62超表达植株通过降低PR1的表达量,降低了植株对丁香假单胞菌的抗性[22]。AtWRKY33过表达株系通过降低PR1基因的表达量增强了植株对细菌病原体的易感性[8]。GhWRKY40过表达植株对细菌病原体敏感性的增强与PRa、PR2和PR4的表达量有关[23]。因此,GhWRKY48可能和上述的WRKY蛋白一样通过调节抗病相关基因表达,参与棉花对大丽轮枝菌的抗性。
[1] 李静, 刘思敏, 蔡丽静, 王昭玉, 董丽君, 刘建凤, 张书玲. 海岛棉GbWRKY53基因的克隆与表达分析[J].中国农业科技导报, 2017, 19(11):15-21.doi:10.13304/j.nykjdb.2017.0200.
Li J, Liu S M, Cai L J, Wang Z Y, Dong L J, Liu J F, Zhang S L. Cloning and expression analysis of GbWRKY53 in G. barbadense[J]. Journal of Agricultural Science and Technology, 2017, 19(11):15-21.
[2] Ishiguro S, Nakamura K. Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recognizes SP8 sequences in the 5′ upstream regions of genes coding for sporamin and β-amylase from sweet potato[J]. Molecular & General Genetics, 1994, 244(6):563-571. doi:10.1007/BF00282746.
[3] Yan Y, Jia H H, Wang F, Wang C, Liu S C, Guo X Q. Overexpression of GhWRKY27a reduces tolerance to drought stress and resistance to Rhizoctonia solani infection in transgenic Nicotiana benthamiana[J]. Frontiers in Physiology, 2015, 6:265.doi:10.3389/fphys.2015.00265.
[4] Rinerson C I, Rabara R C, Tripathi P, Shen Q J, Rushton P J. The evolution of WRKY transcription factors[J]. BMC Plant Biology, 2015, 15:66. doi:10.1186/s12870-015-0456-y.
[5] 向小华,吴新儒,晁江涛,杨明磊,杨帆,陈果,刘贯山,王元英.普通烟草WRKY基因家族的鉴定及表达分析[J].遗传,2016, 38(9):840-856.doi:10.16288/j.yczz.16-016.
Xiang X H, Wu X R, Chao J T, Yang M L, Yang F, Chen G, Liu G S, Wang Y Y. Genome-wide identification and expression analysis of the WRKY gene family in common tobacco(Nicotiana tabacum L.)[J]. Hereditas, 2016, 38(9):840-856.
[6] Liu Q P, Liu Y, Tang Y M, Chen J N, Ding W. Overexpression of NtWRKY50 increases resistance to Ralstoniasolanacearum and alters salicylic acid and jasmonic acid production in tobacco[J]. Frontiers in Plant Science, 2017, 8:1710. doi:10.3389/fpls.2017.01710.
[7] Adachi H, Ishihama N, Nakano T, Yoshioka M, Yoshioka H. Nicotiana benthamiana MAPK-WRKY pathway confers resistance to a necrotrophic pathogen Botrytis cinerea[J]. Plant Signaling & Behavior, 2016, 11(6):e1183085. doi:10.1080/15592324.2016.1183085.
[8] Birkenbihl R P, Diezel C, Somssich I E. Arabidopsis WRKY33 is a key transcriptional regulator of hormonal and metabolic responses toward Botrytis cinerea infection[J].Plant Physiology,2012, 159(1):266-285.doi:10.1104/pp.111.192641.
[9] Geilen K, Böhmer M. Dynamic subnuclear relocalisation of WRKY40 in response to abscisic acid in Arabidopsis thaliana[J]. Sci Rep, 2015, 5:13369. doi:10.1038/srep13369.
[10] Lai Z B, Vinod K M, Zheng Z Y, Fan B F, Chen Z X.Roles of Arabidopsis WRKY3 and WRKY4 transcription factors in plant responses to pathogens[J]. BMC Plant Biology, 2008, 8(1):68.doi:10.1186/1471-2229-8-68.
[11] Kloth K J, Wiegers G L, Busscher-Lange J,Van Haarst J C, Kruijer W, Bouwmeester H J, Dicke M, Jongsma M A. AtWRKY22 promotes susceptibility to aphids and modulates salicylic acid and jasmonic acid signalling [J]. Journal of Experimental Botany, 2016, 67(11):3383-3396. doi:10.1093/jxb/erw159.
[12] Xing D H, Lai Z B, Zheng Z Y, Vinod K M, Fan B F, Chen Z X. Stress-and pathogen-induced Arabidopsis WRKY48 is a transcriptional activator that represses plant basal defense [J]. Molecular Plant, 2008, 1(3):459-470.doi:10.1093/mp/ssn020.
[13] Kim K C, Fan B F, Chen Z X. Pathogen-induced Arabidopsis WRKY7 is a transcriptional repressor and enhances plant susceptibility to Pseudomonas syringae [J]. Plant Physiology, 2006, 142(3):1180-1192.doi:10.1104/pp.106.082487.
[14] 雷煜. miR164-GhNAC100和GhWRKY22参与棉花抗黄萎病的机制分析[D]. 兰州:甘肃农业大学, 2018:19-36.
Lei Y. The mechanisms analysis of miR164-GhNAC100 and GhWRKY22 participating in cotton resistance to Verticillium wilt [D]. Lanzhou:Gansu Agricultural University, 2018:19-36.
[15] Xu Y Y, Hall Ⅲ C,Wolf-Hall C, Manthey F. Fungistatic activity of flaxseed in potato dextrose agar and a fresh noodle system [J]. International Journal of Food Microbiology, 2008, 121(3):262-267. doi:10.1016/j.ijfoodmicro.2007.11.005.
[16] Zhang Z N, Ge X Y, Luo X L, Wang P, Fan Q, Hu G, Xiao J L, Li F G, Wu J H. Simultaneous editing of two copies of Gh14-3-3d, confers enhanced transgene-clean plant defense against Verticillium dahliae, in allotetraploid upland cotton [J]. Frontiers in Plant Science, 2018, 9:842.doi:10.3389/fpls.2018.00842.
[17] Yang Y W, Chen T Z, Ling X T, Ma Z Q. Gbvdr6, a gene encoding a receptor-like protein of cotton (Gossypium barbadense), confers resistance to Verticillium Wilt in Arabidopsis and Upland cotton[J]. Frontiers in Plant Science,2018,8:2272.doi:10.3389/fpls.2017.02272.
[18] Gong Q, Yang Z E, Wang X Q, Butt H I, Chen E Y, He S P, Zhang C J, Zhang X Y, Li F G. Salicylic acid-related cotton (Gossypium arboreum) ribosomal protein GaRPL18 contributes to resistance to Verticillium dahliae[J]. BMC Plant Biology, 2017, 17(1):59. doi:10.1186/s12870-017-1007-5.
[19] Qiu D Y, Xiao J, Ding X H, Xiong M, Cai M, Cao Y L, Li X H, Xu C G, Wang S P. OsWRKY13 mediates rice disease resistance by regulating defense-related genes in salicylate-and jasmonate-dependent signaling[J]. Molecular Plant-Microbe Interactions, 2007, 20(5):492-499. doi:10.1094/MPMI-20-5-0492.
[20] Shimono M, Sugano S, Nakayama A, Jiang C J, Ono K, Toki S, Takatsuji H. Rice WRKY45 plays a crucial role in benzothiadiazole-inducible blast resistance [J]. Plant Cell, 2007, 19(6):2064-2076. doi:10.1105/tpc.106.046250.
[21] Li C, He X, Luo X Y, Xu L, Liu L L, Min L, Jin L, Zhu L F, Zhang X L. Cotton WRKY1 mediates the plant defense-to-development transition during infection of cotton by Verticillium dahliae by activating jasmonatezim-domain1 expression [J]. Plant Physiology, 2014, 166(4):2179-2194.doi:10.1104/pp.114.246694.
[22] Kim K C, Lai Z B, Fan B F, Chen Z X. Arabidopsis WRKY38 and WRKY62 transcription factors interact with histone deacetylase 19 in basal defense [J]. The Plant Cell, 2008, 20(9):2357-2371. doi:10.1105/tpc.107.055566.
[23] Wang X L, Yan Y, Li Y Z, Chu X Q, Wu C G, Guo X Q. GhWRKY40, a multiple stress-responsive cotton WRKY gene, plays an important role in the wounding response and enhances susceptibility to Ralstonia solanacearum infection in transgenic Nicotiana benthamiana [J]. PLoS One, 2014, 9(4):e93577.doi:10.1371/journal.pone.0093577.