LBD(Lateral organ boundaries domain)是一类植物所特有的转录因子,具有保守的LOB(Lateral organ boundary)结构域。LOB结构域的特征是有具DNA结合活性的CX2CX6CX3C锌指结构域和Gly-Ala-Ser(GAS)域及具蛋白结合活性的LX6LX3LX6L亮氨酸拉链结构域组成[1]。LBD蛋白家族可以分为2个亚家族:Class Ⅰ和Class Ⅱ[2-3]。Class Ⅰ主要参与了植物侧生器官的发育和生长素信号的级联传递[4-6]。而Class Ⅱ主要参与了花青素的合成和氮代谢[7]。
AS2/AtLBD6通过与AtAS1的相互作用抑制叶中KNOX Ⅰ家族基因的表达,进而调节叶片的极性发育[8]。拟南芥基因AtLBD16、AtLBD18、AtLBD29和AtLBD33控制拟南芥侧根起始及发育,但表现出不同的调控模式:异源AtLBD18/AtLBD33二聚体可以直接结合到E2Fa启动子激活其表达,进而促进侧根的起始,而AtLBD16和AtLBD29结合经由AtARF7和AtARF19途径直接调控根发育[5-6]。最近研究发现,在侧根形成过程中AtLBD18直接结合到EXP14启动子上激活其表达而促进侧根的形成[9]。进一步研究发现,AtLBD18与GBF INTERACTING PROTEIN 1(GIP1)结合形成二聚物增强对EXP14的激活作用[10]。菊花(Chrysanthemum spp.)CmLBD1基因表达受生长素调节,并且已被证明参与不定根原基形成的过程[11]。在拟南芥中,编码小孢子的SCP基因,特异性LOB/AS2结构域蛋白对雄性配子体模式化期间不对称小孢子分裂的正确时间和方向是必不可少的。DDA1/LBD25在生长素信号传导和光形态发生途径中均表现出可能的功能。Ⅱ类LBD蛋白缺乏亮氨酸拉链样基序,因此,它们的功能可能不同于Ⅰ类蛋白的功能。AtLBD37、AtLBD38和AtLBD39参与花青素合成和硝酸盐代谢,过表达这3个基因中的任何一个都强烈抑制PAP1和PAP2的表达,而atlbd37、atlbd38和atlbd39 3个突变体在![]() 充足的生长条件下,花青素明显大量积累,这说明这3个基因是花青素合成的负调控基因[7]。
充足的生长条件下,花青素明显大量积累,这说明这3个基因是花青素合成的负调控基因[7]。
AtLBD15是拟南芥LBD家族的一个成员,在拟南芥叶柄细胞脱分化研究中发现,AtLBD15可能参与了拟南芥叶柄细胞的脱分化过程,进一步研究发现AtLBD15表达可能受细胞分裂素的调控[12]。并且LBD15参与调控维管组织分化的调控[13]。Mangeon等[14]研究发现,LBD基因家族功能具有多样性,其多样性可能与启动子区调控域和编码区功能域的不同相关,调控区域和功能域的多样性能够导致重复基因的亚功能化或者新功能[15-16]。本研究通过酵母双杂技术筛选到一批与LBD15互作的调控蛋白,为进一步解析拟南芥LBD15的分子机理奠定基础。
1 材料和方法
1.1 试验材料
试验用拟南芥为哥伦比亚(Columbia Col-0),种植于云南省昆明市中国科学院昆明植物研究所,酵母菌株Y2HGold、Y187,大肠杆菌(Escherichia coli)都是云南省昆明市中国科学院昆明植物研究所种质库保藏的;酵母双杂交载体的质粒为pDEST-GADT7(pGADT7,AD)、pDEST-GBKT7(pGBKT7,BD),质粒购置自ABRC。
1.2 拟南芥RNA提取及反转录
利用EastepTM Universal RNA Extraction Kit (Promega,中国上海)试剂盒提取拟南芥总RNA,用ND-1000分光光度计检测RNA浓度和质量。利用GoScriptTM®Reverse Transcription System试剂盒以提取的总RNA为模板反转录合成cDNA。以反转录的cDNA为模板用LBD15基因特异引物(ENTR-L15F:caccATGTCAAGAGAAAGGGAGAG;ENTR-L15R:ACCGAAGTAGTTGTTCTCAC)扩增得到LBD15的基因序列。利用Gateway技术将LBD15重组到质粒pGADT7、pGBKT7,PCR检测阳性克隆,阳性克隆送硕擎测序验证。
1.3 酵母转化、重组质粒细胞毒性和自激活检测
将构建好的BD-LBD15重组质粒转入到用LiAC法制备的Y2HGold酵母菌株的感受态细胞中,用SD/-T选择性平板进行筛选,将筛选到的单菌落在SD/-T液体培养基中培养,并且用作酵母杂交的种子液。
1.4 通过酵母cDNA文库筛选结合蛋白
将上述转化到酵母Y2HGold菌株中的重组质粒BD-LBD15,通过选择性平板(SD/-T)筛选后,在28 ℃摇床中培养到OD260=0.8,然后将其与含有cDNA文库的酵母Y187菌株混合培养24 h,将混合培养后的酵母细胞离心,弃多余的上清,剩下100 μL重悬沉淀后,涂到TDO(SD/-Trp/-Leu/-Ade)的平板上,放入28 ℃培养箱中黑暗培养2~3 d取出,在超净台里用灭过菌的枪头将平板上的菌落转移到QDO(SD/-Trp/-Leu/-Ade/-His)平板上,菌落的编号不变, 28 ℃培养箱中继续培养,挑选QDO平板上的菌落,28 ℃摇床上进行培养,用酵母质粒提取试剂盒提取质粒,然后转化大肠杆菌,在37 ℃过夜培养,挑选单菌落按编号送到公司测序,对测序后的结果进行分析。
2 结果与分析
2.1 含LBD15基因的pGBKT7载体的重组
RT-PCR克隆LBD15基因获得大小为675 bp的片段(图1-A),与预期条带相符;用Gateway技术将LBD15重组到质粒pGBKT7后转化大肠杆菌。挑选单菌落进行PCR鉴定有带,提取PCR鉴定有带的重组表达载体的质粒然后进行双酶切验证(图1-B),阳性克隆的菌送到硕擎测序公司进行测序鉴定。
2.2 重组质粒pGBKT7-LBD15的自激活检测
将构建得到的BD-LBD15和AD质粒转入到酵母Y2HGold菌株中,在选择性的二缺平板(SD/-Leu/-Trp)上进行筛选,并且将长出来的酵母菌落点滴到四缺板上(SD/-Trp/-Leu/-Ade/-His),同时共转pGADT7(AD)和BD到Y2HGold菌株中,作为负对照,放入28 ℃培养箱中黑暗培养2~3 d后观察结果,试验组和负对照没有菌落长出,说明重组质粒BD-LBD15没有自激活现象,即LBD15蛋白在酵母菌株Y2H中没有自激活的现象,适合用作互作蛋白文库的筛选(图2)。
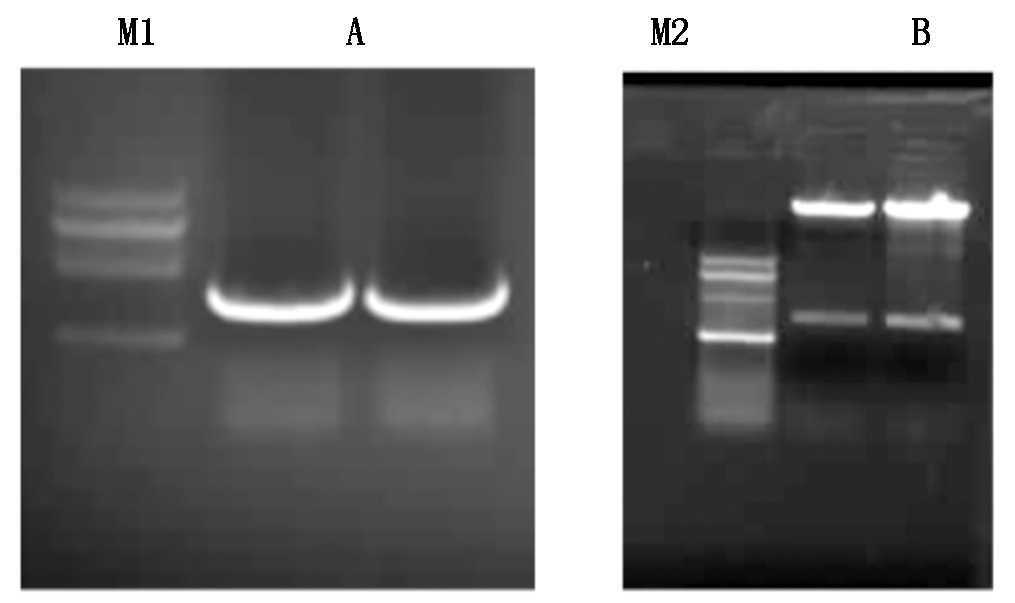
A.LBD15基因PCR扩增;B.酵母表达载体pGBKT7-LBD15双酶切鉴定;M1.DNA分子量标准500~2 000 bp; M2.DNA分子质量标准500~2 000 bp。
A.PCR amplification of LBD15 gene; B.Identification of yeast expression vector pGKT7-LBD15 by double enzyme digestion; M1. DNA Marker DL2000; M2.DNA Marker DL2000.
图1 含LBD15基因的酵母表达载体构建
Fig.1 Construction of yeast expression vectorcontaining LBD15 gene
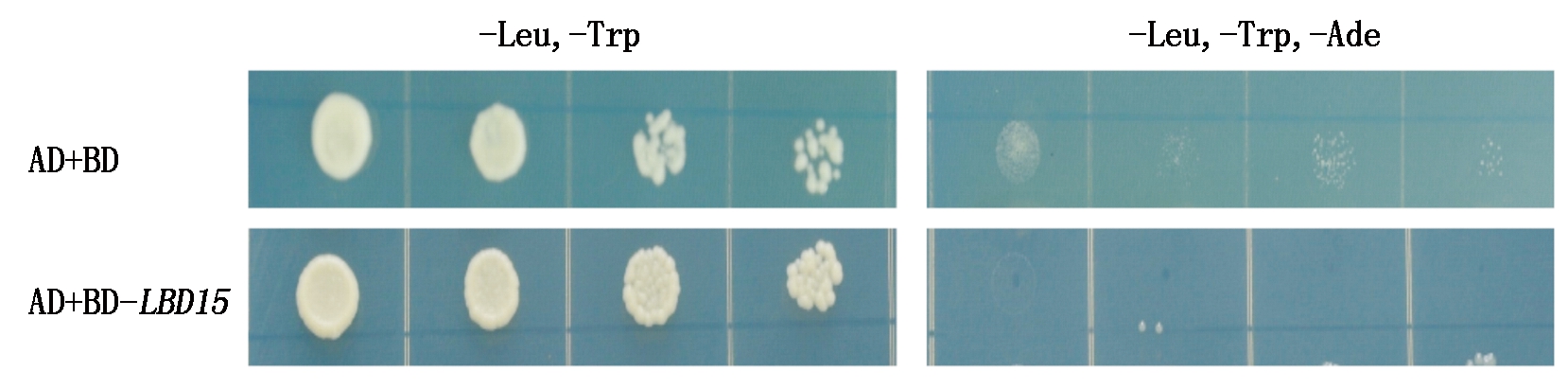
图2 pGBKT7-LBD15自激活检测
Fig.2 Identification of pGBKT7-LBD15 for auto-activation
2.3 互作蛋白的筛选与分离
将共转化酵母菌株Y2H感受态细胞中的BD-LBD15质粒和拟南芥cDNA文库均匀的涂布于DDO/X/A的固体培养基上进行培养;挑选阳性的单克隆进一步接种到QDO/X/A固体培养基上进行培养。将候选的阳性单克隆转接到DDO/X固体培养基进行培养,然后筛选分离出蓝色阳性单克隆(图3)。
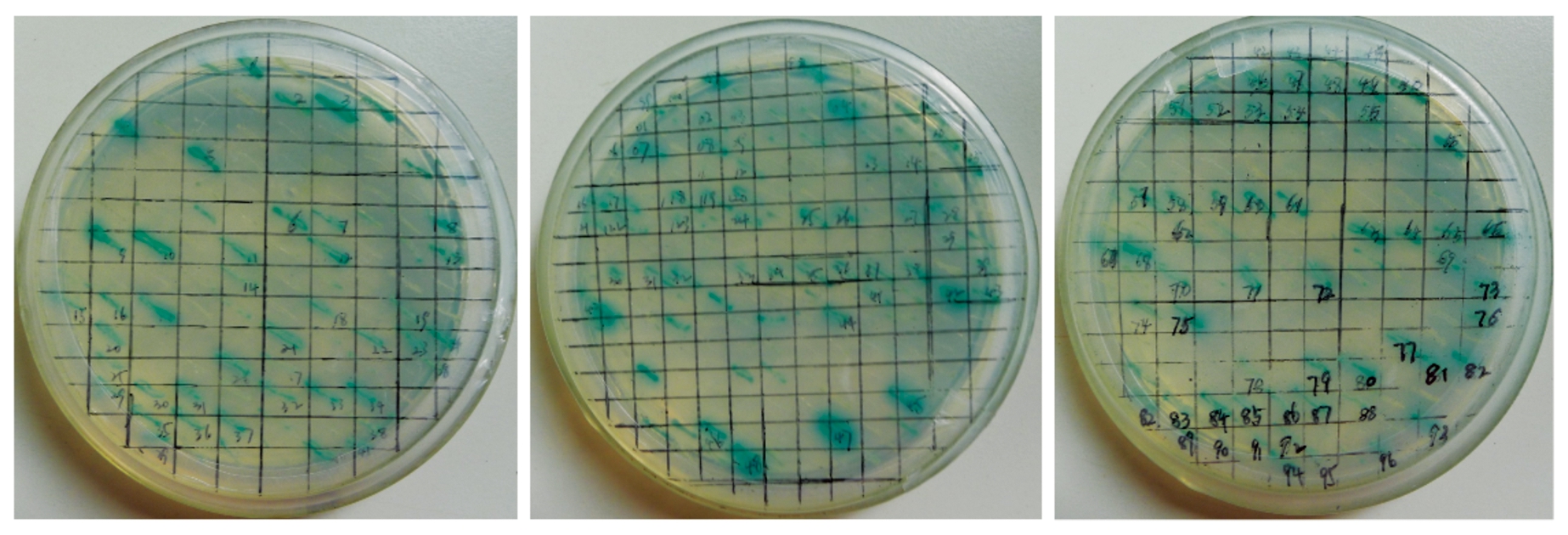
图3 候选蛋白在DDO/X固体培养基中的筛选
Fig.3 Screening of candidate proteins in DDO/X solid medium
2.4 LBD15 cDNA文库的筛选结果
把在TDO板上得到的酵母菌落,在转移到新的TDO平板上保存并给予唯一编号,然后挑选单菌落,摇菌提质粒,再转化大肠杆菌,37 ℃培养箱过夜培养,挑选单菌落,摇菌后送到公司进行测序。
在本次筛库试验中,146个样送测序有107个测出序列,通过NCBI Blast分析,其中有96个获得了基因号,占总数的87.9%。根据基因号进行分类,得到了48个蛋白。然后把基因号通过网站TAIR(www.arabidopsis.org/index.jsp)查找其蛋白序列,通过http://cello.life.nctu.edu.tw/分析其亚细胞定位。每个蛋白在筛选文库中重复的次数以及功能的描述如表1所示。在筛选到的这48个蛋白中有59%的蛋白都有重复。
表1 LBD15结合蛋白及功能分析
Tab.1 The functional analysis of LBD15 binding proteins

编号Number基因座位Gene locus重复次数Repeat times亚细胞定位Subcellular localization基因描述Gene description1At5g147803细胞质拟南芥甲酸脱氢酶(FDH)基因2At1g109503等离子体膜拟南芥TMN1基因3At1g201102细胞外拟南芥 RING/FYVE/PHD 锌指蛋白基因4At1g322201细胞质NAD(P)结合Rossmann折叠蛋白基因5At1g510604线粒体拟南芥组蛋白(HTA10)基因6At1g628501外膜拟南芥Ⅰ类肽链释放因子基因7At1g742101细胞外拟南芥甘油磷酸二酯酶基因8At1g742406细胞外线粒体底物载体家族蛋白基因9At1g799001内膜线粒体底物载体家族蛋白基因10At2g173801叶绿体拟南芥AP19蛋白基因11At2g180001细胞质拟南芥TBP相关因子14基因12At2g213851细胞质未知功能基因13At2g238001细胞质拟南芥香叶基香叶基焦磷酸合成酶4(GGPS2) 基因14At2g250703细胞核蛋白质磷酸酶基因15At2g302001外膜酰基载体蛋白S-丙二酰转移酶基因16At2g357901细胞外拟南芥未知功能蛋白基因17At2g392503线粒体拟南芥类ap2乙烯响应转录因子SNZ基因18At2g460301细胞质拟南芥泛素结合酶E6-UBC6基因19At2g471801周质拟南芥半乳醇合酶1 (GolS1) 基因20At3g125301细胞核拟南芥DNA复制复合物PSF2蛋白基因21At3g156101周质拟南芥表达蛋白基因22At3g165301叶绿体拟南芥类豆科凝集素样蛋白基因23At3g194001细胞质拟南芥类半胱氨酸蛋白酶基因24At3g208203线粒体拟南芥富含亮氨酸重复序列蛋白质基因25At3g229504细胞质拟南芥ADP核糖基化因子C1 (ARFC1) 基因26At3g245701等离子体膜拟南芥过氧化物酶体膜22 ku(MPV17/PMP22)蛋白基因27At3g459705周质拟南芥类扩展蛋白A1 (EXLA1) 基因28At3g531801细胞质类谷氨酸氨连接酶蛋白基因29At3g543001细胞质囊泡相关膜蛋白727基因30At4g040401细胞质焦磷酸果糖-6-磷酸-1-磷酸转移酶基因31At4g040786线粒体未知功能蛋白基因32At4g083903细胞质拟南芥L-抗坏血酸过氧化物酶(SAPX)基因33At4g148901细胞质铁氧还蛋白基因34At4g175301细胞核拟南芥RAB GTPASE同源基因1C (RAB1C) 35At4g247501叶绿体拟南芥含硫酸盐同源域蛋白基因36At4g267501细胞核拟南芥空泡蛋白分选蛋白VTA1基因37At4g340502细胞质拟南芥假定咖啡酰辅酶A O-甲基转移酶(CCAOMT1)基因38AT4g354501细胞质拟南芥锚蛋白重复域蛋白2(AKR2)基因39At5g041401细胞质拟南芥对铁氧还蛋白依赖性谷氨酸合成酶基因40At5g062701周质未知功能蛋白基因41At5g069802细胞核拟南芥非特异性蛋白基因42At5g168301细胞质拟南芥突出结合蛋白21(SYP21)基因43At5g207204细胞质拟南芥伴侣蛋白(CPN20) 基因44At5g234605线粒体未知功能蛋白基因45At5g456704细胞外拟南芥GDSL酯酶/脂肪酶基因46At5g461802叶绿体鸟氨酸转氨酶DELTA-OAT基因47At5g568701周质拟南芥β-半乳糖苷酶4BGAL4基因48At5g670701周质拟南芥RALFL34蛋白基因
利用Blast2GO对候选的48个基因进行了Gene Ontology(GO)注释(图4),结果表明,AtLBD15候选互作蛋白参与了14个生物过程,包括细胞过程、代谢过程、刺激响应、生物过程的调控、单组织和多组织过程及发育进程调控等。
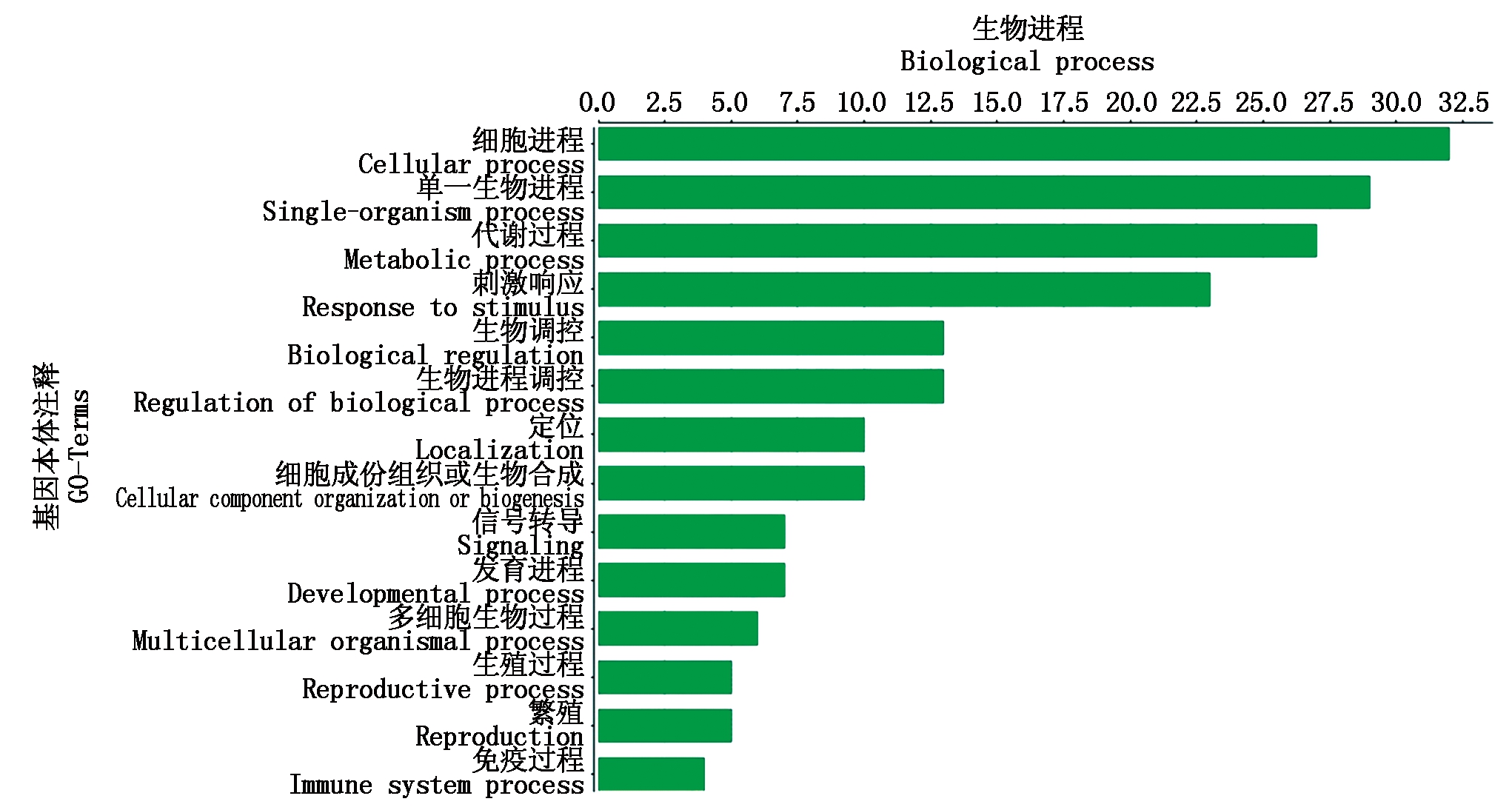
图4 AtLBD15候选互作蛋白Go Ontology注释
Fig.4 Go Ontology annotation of AtLBD15 candidate interaction proteins
2.5 互作蛋白的分离和回复验证
将BD-LBD15诱饵质粒和筛选出的互作蛋白的质粒共转化酵母感受态细胞,在SD/-Trp/-Leu营养缺陷型平板上培养,挑选单菌落于1 mL YPDA液体培养基培养,吸取1 μL培养浑浊的菌液点至SD/-Trp/-Leu/-Ade/-His营养缺陷型平板上培养,结果发现,AP19蛋白及其他一些蛋白的菌落能够在营养缺陷型的平板上正常生长(图5),初步证实,AP19等候选蛋白与LBD15蛋白在酵母细胞中互作。
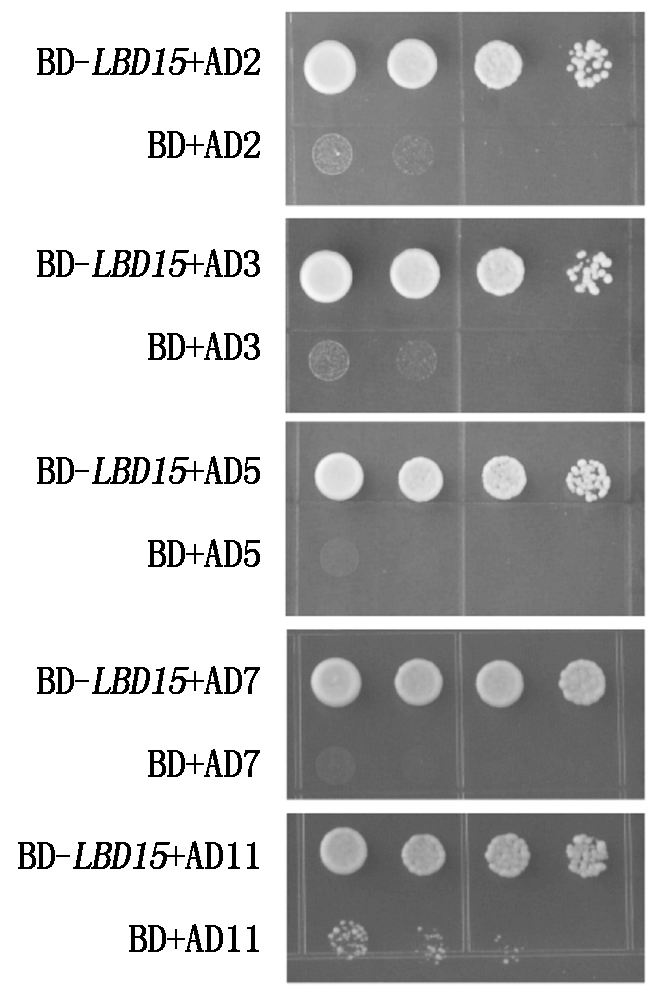
图5 酵母双杂交回复验证
Fig.5 Confirmation of positive interaction by yeast two-hybrid
3 讨论
LBD是植物特有的一个转录因子家族,在植物生长发育进程中起着重要的作用。拟南芥基因组中存在42个LBD基因,分为2个亚家族,亚家族Ⅰ比亚家族Ⅱ多了一个卷曲螺旋结构,这一结构可能在蛋白互作中起作用[2]。LBD调控了大量的生长发育和代谢进程,像叶片发育、花发育、胚形成、侧根形成及氮和花青素代谢[17-18]。最近的研究发现,LBD还参与调控了花粉发育、植物再生、感病性、光形态建成、次生生长及叶柄发育[1, 19]。由植物激素诱导植物再生过程的第一步便是愈伤组织的形成, 该过程与侧根发育过程极其相似[20]。
前期工作发现,LBD15参与了植物再生、茎顶端分生组织调控及次生细胞壁的形成[12, 21-22]。最近又有研究组发现,LBD15能够直接结合到VND7启动子上激活其表达,进而促进导管的形成[23]。利用LBD5筛选酵母文库,获得了48个互作的蛋白,这些蛋白参与了多个调控网络,涉及多个方面的功能,如细胞过程、代谢过程、刺激响应、生物过程的调控和发育过程等,证实了LBD功能多样性的作用机制。在筛选的48个互作蛋白种有1个Expansin-LikeA1(EXPLA)蛋白,但是AtLBD15和EXPLA作用机理还不了解。LBD18通过结合到EXP14和EXP17启动子上激活其表达,进而参与到生长素调控的侧根原基起始过程中[9]。而LBD15与EXPLA发生互作可能与茎顶端分生细胞伸展生长有关。二者之间的互作关系的机理研究对LBD15调控茎顶端分生组织发育的调控具有一定的意义。维管形成层细胞的表面受体是PXY(Phloem intercalated withxylem), 其通过与亮氨酸的结合作用来介导维管组织的形成。近期有文章研究发现, PXY同WOX14、LBD4及TMO6(Target of monopteros 6)形成了一个复杂的转录调控网络, 协同调控维管组织的形成过程[24-25]。
近年来,泛素化过程受到越来越广泛的关注,其是植物蛋白最常见的修饰方式之一,在细胞生命活动的许多进程中发挥着重要的作用。泛素化的蛋白质会被蛋白酶体(Proteasome)识别进而被降解。3种泛素酶即:活化酶E1(Ubiquitin activating enzyme)、结合酶E2(Ubiquitin conjugating enzyme)和连接酶E3(Ubiquuitin-protein ligase)共同介导了泛素化这一过程。本试验筛到1个与AtLBD15互作的泛素结合酶E2-UBC6。推测AtLBD15和UBC6互作可能参与了刺激响应及免疫反应等。
LBD 家族蛋白在高等植物中分布广泛,在高等植物的生长发育过程中起着十分重要的作用,然而其功能的分子机制并不清楚。后续工作将主要获得拟南芥LBD15互作蛋白的遗传材料,利用遗传学和分子生物学深入研究LBD15蛋白的功能,以期更好地阐明其工作机理。
[1] Xu C Z, Luo F, Hochholdinger F.LOB domain proteins:beyond lateral organ boundaries[J].Trends in Plant Science,2016,21(2):159-167.doi:10.1016/j.tplants.2015.10.010.
[2] Shuai B, Reynaga-Pe a C G, Springer P S.The lateral organ boundaries gene defines a novel, plant-specific gene family[J].Plant Physiology,2002,129(2):747-761.doi:10.1104/pp.010926.
a C G, Springer P S.The lateral organ boundaries gene defines a novel, plant-specific gene family[J].Plant Physiology,2002,129(2):747-761.doi:10.1104/pp.010926.
[3] Iwakawa H, Ueno Y, Semiarti E, Onouchi H, Kojima S, Tsukaya H, Hasebe M, Soma T, Ikezaki M, Machida C, Machida Y.The ASYMMETRIC LEAVES2 gene of Arabidopsis thaliana, required for formation of a symmetric flat leaf lamina, encodes a member of a novel family of proteins characterized by cysteine repeats and a leucine zipper[J].Plant & Cell Physiology,2002,43(5):467-478.doi:10.1093/pcp/pcf077.
[4] Xu C Y,Cao H F,Zhang Q Q,Wang H Z,Xin W,Xu E J,Zhang S Q,Yu R X,Yu D X,Hu Y X. Control of auxin-induced callus formation by bZIP59-LBD complex in Arabidopsis regeneration[J]. Nature Plant,2018,4(2):108-115. doi:10.1038/s41477-017-0095-4.
[5] Okushima Y, Fukaki H, Onoda M, Theologis A, Tasaka M.ARF7 and ARF19 regulate lateral root formation via direct activation of LBD/ASL genes in Arabidopsis[J].The Plant Cell,2007,19(1):118-130.doi:10.1105/tpc.106.047761.
[6] Feng Z H, Sun X D, Wang G C, Liu H L, Zhu J.LBD29 regulates the cell cycle progression in response to auxin during lateral root formation in Arabidopsis thaliana[J].Annals of Botany,2012,110(1):1-10.doi:10.1093/aob/mcs019.
[7] Rubin G, Tohge T, Matsuda F, Saito K, Scheible W R.Members of the LBD family of transcription factors repress anthocyanin synthesis and affect additional nitrogen responses in Arabidopsis[J].The Plant Cell,2009,21(11):3567-3584.doi:10.1105/tpc.109.067041.
[8] Iwakawa H, Iwasaki M, Kojima S, Ueno Y, Soma T, Tanaka H, Semiarti E, Machida Y, Machida C.Expression of the ASYMMETRIC LEAVES2 gene in the adaxial domain of Arabidopsis leaves represses cell proliferation in this domain and is critical for the development of properly expanded leaves[J].The Plant Journal,2007,51(2):173-184.doi:10.1111/j.1365-313X.2007.03132.x.
[9] Lee H W, Kim M J, Kim N Y, Lee S H, Kim J.LBD18 acts as a transcriptional activator that directly binds to the EXPANSIN14 promoter in promoting lateral root emergence of Arabidopsis[J].Plant Journal,2013,73(2):212-224.doi:10.1111/tpj.12013.
[10] Lee H W, Park J H, Park M Y, Kim J.GIP1 may act as a coactivator that enhances transcriptional activity of LBD18 in Arabidopsis[J].Journal of Plant Physiology,2014,171(5):14-18.doi:10.1016/j.jplph.2013.11.003.
[11] Zhu L, Zheng C, Liu R X, Song A P, Zhang Z H, Xin J J, Jiang J F, Chen S M, Zhang F, Fang W M,Chen F D. Chrysanthemum transcription factor CmLBD1 direct lateral root formation in Arabidopsis thaliana[J]. Scientific Reports,2016,6:20009. doi:10.1038/srep20009.
[12] Liu H L, Wang G C, Feng Z H, Zhu J.Screening of genes associated with dedifferentiation and effect of LBD29 on pericycle cells in Arabidopsis thaliana[J].Plant Growth Regulation,2010,62(2):127-136.doi:10.1007/s10725-010-9495-4.
[13] Sun X D, Feng Z H, Meng L S.Ectopic expression of the Arabidopsis ASYMMETRIC LEAVES2-LIKE5 (ASL5) gene in cockscomb (Celosia cristata) generates vascular-pattern modifications in lateral organs[J].Plant Cell Tissue and Organ Culture,2012,110(1):163-169.doi:10.1007/s11240-012-0140-y.
[14] Mangeon A, Lin W C, Springer P S. Functional divergence in the Arabidopsis LOB-domain gene family[J]. Plant Signal Behav,2012,7(12):1544-1547. doi:10.4161/psb.22320.
[15] Chen K N, Zhang Y B, Tang T, Shi S H.Cis-regulatory change and expression divergence between duplicate genes formed by genome duplication of Arabidopsis thaliana[J].Chinese Science Bulletin,2010,55(22):2359-2365.doi:10.1007/s11434-010-3027-5.
[16] Hanada K, Tezuka A, Nozawa M, Suzuki Y, Sugano S, Nagano A J, Ito M A, Morinaga S I.Functional divergence of duplicate genes several million years after gene duplication in Arabidopsis[J].DNA Research,2018,25(3):327-339.doi:10.1093/dnares/dsy005.
[17] Lu Q,Shao F J,Macmillan C,Wilson I W,van der Merwe K, Hussey S G,Myburg A A,Dong X M,Qiu D Y. Genomewide analysis of the lateral organ boundaries domain gene family in Eucalyptus grandis reveals members that differentially impact secondary growth[J]. Plant Biotechnol J,2018,16(1):124-136. doi:10.1111/pbi.12754.
[18] Jeon E, Kang N Y, Cho C, Seo P J, Suh M C,Kim J.LBD14/ASL17 positively regulates lateral root formation and is involved in ABA response for root architecture in Arabidopsis[J].Plant and Cell Physiology,2017,58(12):2190-2201.doi:10.1093/pcp/pcx153.
[19] Ma W W, Wu F Q, Sheng P K, Wang X L, Zhang Z, Zhou K N, Zhang H, Hu J L, Lin Q B, Cheng Z J, Wang J L, Zhu S S, Zhang X, Guo X P, Wang H Y, Wu C Y, Zhai H Q, Wan J M.The LBD12-1 transcription factor suppresses apical meristem size by repressing argonaute 10 expression[J].Plant Physiology,2017,173(1):801-811.doi:10.1104/pp.16.01699.
[20] 孙贝贝, 刘杰, 葛亚超, 盛李宏, 陈吕琴, 胡小梅, 杨仲南, 黄海, 徐麟. 植物再生的研究进展[J]. 科学通报, 2016, 61(36):3887-3902.
Sun B B, Liu J, Ge Y C, Sheng L H, Chen L Q, Hu X M, Yang Z N, Huang H, Xu L. Recent progress on plant regeneration [J]. Chinese Science Bulletin, 2016, 61(36):3887-3902.
[21] Zhu L, Guo J S, Zhou C, Zhu J.Ectopic expression of LBD15 affects lateral branch development and secondary cell wall synthesis in Arabidopsis thaliana[J].Plant Growth Regulation,2014,73(2):111-120.doi:10.1007/s10725-013-9873-9.
[22] Sun X D, Feng Z H, Meng L S, Zhu J A,Geitmann A.Arabidopsis ASL11/LBD15 is involved in shoot apical meristem development and regulates WUS expression[J].Planta,2013,237(5):1367-1378.doi:10.1007/s00425-013-1844-x.
[23] Ohashi-Ito K, Iwamoto K, Fukuda H.LOB DOMAIN-CONTAINING PROTEIN 15 positively regulates expression of VND7,a master regulator of tracheary elements[J].Plant and Cell Physiology,2018,59(5):989-996.doi:10.1093/pcp/pcy036.
[24] 石玉, 沈诗雅, 张倩茹, 孙振美, 邬荣领, 郭允倩.LBD基因家族研究进展[J].中国细胞生物学学报,2019,41(4):738-745. doi:10.11844/cjcb.2019.04.0025.
Shi Y, Shen S Y, Zhang Q R, Sun Z M, Wu R L, Guo Y Q. The research progress of LBD gene family[J]. Chinese Journal of Cell Biology,2019,41(4):738-745.
[25] Shauni M.Investigating a feed-forward loop of transcription factors that acts in plant vascular development[D].Durham:Durham University,2018.