果锈(Russeting,RUS)是苹果[1]、梨[2]、葡萄[3]、马铃薯[4-5]等作物的重要性状之一。马铃薯的锈变品种Russet Burbank因综合了高产、低糖、吸油少、耐贮藏、适宜加工等特性,在美国、加拿大、法国、英国、新西兰等多地广泛种植[4,6]。梨的果锈与果皮色泽密切相关,并对生物、非生物胁迫起到一定的保护作用[2,7]。苹果多锈品种金冠、Elstar、桔苹因果锈的频繁发生使其果实的商品价值锐减[8-11],成为限制该类品种持续发展的一大障碍。
苹果、梨等树种幼嫩果实(或块茎)受到气候、病菌、药剂等因子的作用时,它的表皮细胞异常分裂、增殖而开裂,其下层细胞膨大木栓化产生木栓形成层,进而形成木栓组织,此时表皮外层的角质层不断龟裂剥落,在果实(或块茎)表面形成了黄褐色、赤褐色周皮组织即果锈[8-9,12-17]。果锈的发生,在幼果期(金冠苹果,花后2周)即开始,此后的2~6周是果锈形成的关键时期[9,17]。从生理学角度分析,苯丙烷类代谢、乙烯代谢及次生代谢等多种途径都与果锈的形成有关,并且木质素生物合成、多胺及过氧化氢的信号传递可对果锈的形成进行调控[18-19]。
果锈基因主要包括表皮物质合成基因和胁迫应答基因2大类,根据功能的不同表皮物质合成基因可进一步分为表皮生物合成基因、木栓质沉积基因。在梨果锈形成过程中,表皮生物合成基因随着胁迫应答基因、木栓质沉积基因的急剧增加而受到抑制[11,20]。在苹果多锈品种中,一些编码纤维素合成酶6、木聚糖合成酶、果胶甲基酯酶的基因表现出了上调表达,与木栓质相关的苯丙烷类代谢调控基因的差异表达,其中的转录因子MdMYB93在木栓质的累积过程中发挥主要作用[11,21]。在砀山酥梨的锈变单株中检测到10个ABC家族的锈变差异表达基因,这些基因参与了锈变果实木栓化的形成[22]。
果锈基因的遗传机制极为复杂。在梨上,果锈基因是受2对基因控制,其中的R1/r1基因的SSR标记CH01c06和Hi20b03,遗传距离分别为 4.8,12.0 cM,推测该基因可能位于梨的LG8上[7],也有学者认为,果锈属于质量性状,而果锈含量则为数量性状,两者分别受不同的遗传位点控制[20]。在苹果上,果锈的遗传力中等,通常在0.34~0.54[23-24];近年来获得了1个控制Renetta Grigia di Torriana锈变的主效基因,它位于苹果的LG12染色体上[25],然而,关于果锈基因的分子遗传机制尚不清楚。2015年在宫崎短枝富士(MYS)×坂田津轻(SKT)的杂种分离群体中发现了全锈的子代单株,通过3 a观察该株子代表现稳定。本研究以该群体的子代植株为试材,采用SLAF技术开发标签并构建图谱,结合表型数据分析,对苹果果锈基因进行遗传定位,以期找到控制苹果果锈的遗传位点,为无锈苹果或免套袋苹果品种的选育及利用提供理论依据。
1 材料和方法
1.1 试验材料
2003年以宫崎短枝富士为母本,坂田津轻为父本杂交,2004年播种杂交种子,2010年转接于SH6中间砧砧木上,进行常规的果园管理。进入结果期后,在该分离群体中发现了全锈苹果变异株(图1)。

1.全果锈苹果(成熟期);2.全果锈苹果(幼果期);3.对照。
1. Full russeting apple at ripen stage;
2.Russeting in young fruits;3.Control.
图1 苹果全果锈植株及幼果期表现
Fig.1 Russeting variant in Malus domestica Borkh.
1.2 试验方法
采集宫崎短枝富士×坂田津轻杂种分离群体中的150株子代及双亲的苹果叶片,采用CTAB法分别提取基因组DNA后,运用SLAF-seq 技术(Specific-locus amplified fragment sequencing)和HighMap 软件进行高密度分子标签开发,构建高密度遗传图谱,然后对果锈基因进行QTL定位。
1.2.1 表型调查 参照Durel等[23]的方法,稍有改进,设4级:0级无或没有见到;1级果面有少量果锈(少于1/3),2级果面有大量果锈(介于1/3和1/2之间);3级果面锈量1/2以上。2015-2017年连续3 a对杂种分离后代果面果锈情况进行调查。
1.2.2 酶切方案设计及测序 根据苹果(Malus domestica Borkh.)基因组大小以及 GC 含量等信息进行酶切预测。选择 Rsa Ⅰ 和 Hae Ⅲ 酶切组合,酶切片段长度在 364~464 bp 的序列定义为 SLAF标签,预测可得到 123 512 个 SLAF 标签。根据最适酶切方案,对检测合格的各样品基因组 DNA 分别进行酶切。得到的酶切片段(SLAF 标签)进行 3′端加 A 处理、连接 Dual-index[26]测序接头、PCR 扩增、纯化、混样、切胶选取目的片段,文库质检合格后用IlluminaHiSeqTM 进行 PE125bp 测序。
1.2.3 SNP开发及编码 根据 Clean Reads 在参考基因组的定位结果,使用 Picard 进行去重复、GATK 进行局部重比对、碱基质量值校正等预处理,以保证检测得到的单核苷酸多态性(SNP)准确性,再使用 GATK 进行SNP的检测,过滤,并得到最终的 SNP 位点集。根据遗传学通用的等位编码规则对多态性标签进行基因型编码。
1.2.4 图谱构建 为保证遗传图谱质量,将多态性 SLAF 标签进行过滤:过滤掉父母本测序深度 4×以下的标签;对于单一多态性标记位点,选择100 个子代中至少有 70 个个体有确定基因型的标记;用偏分离标记处理方法过滤严重偏分离(卡方检验 P<0.001)的多态性标记。
将筛选获得的标记,通过计算两两标签之间MLOD 值[27],过滤掉与其中SLAF标签的MLOD值低于 3 的标签,将标签分到 17 个群。以连锁群为单位,采用 HighMap 软件分析将获得连锁群内 Marker 的线性排列,并估算相邻 Marker间的遗传距离。
1.2.5 QTL分析 基于表型数据值,采用mapqtl方法对果锈基因进行QTL分析,LOD阈值为3.0。
2 结果与分析
2.1 测序数据统计与评估
利用Hiseq2500平台进行SLAF-seq文库的测序分析。结果表明,测序获得了 110 321 714 552 bp数据,测序平均 Q30 为 95.07%,平均 GC 含量为 40.11%,样本 GC 分布正常。宫崎短枝富士和坂田津轻分别获得29 944 687 reads (8 972 246 842 bp)、29 251 169 reads(8 763 175 910 bp)数据,测序平均Q30为 93.68%,93.86%,平均GC含量为 38.36%,38.30%;子代群体获得了3 086 176 reads,617 235 279 bp数据,测序平均Q30为 95.09%,平均GC含量为 40.14%;各样本GC分布正常(表1)。
表1 样品测序数量
Tab.1 Quantity of sequencing sample
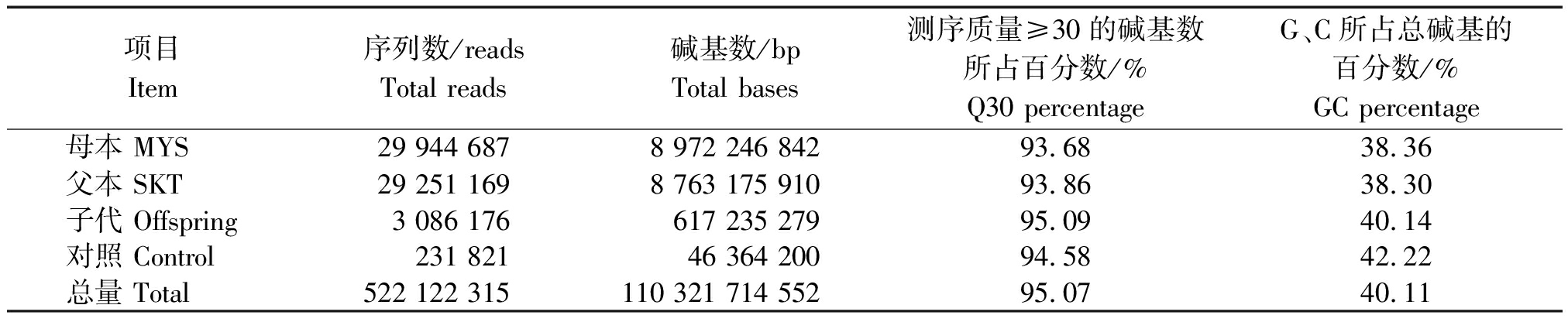
项目Item序列数/readsTotal reads碱基数/bpTotal bases测序质量≥30的碱基数所占百分数/%Q30 percentageG、C所占总碱基的百分数/%GC percentage 母本 MYS29 944 6878 972 246 84293.6838.36父本 SKT29 251 1698 763 175 91093.8638.30子代 Offspring3 086 176617 235 27995.0940.14对照 Control231 82146 364 20094.5842.22总量 Total522 122 315110 321 714 55295.0740.11
2.2 建库评估
将测序获得的231 821 reads,通过 SOAP软件[28]对 Control 的测序 reads 与参考基因组进行比对。结果表明,Control数据的建库双端比对效率在89.17%,酶切效率为88.41%,SLAF建库正常。
2.3 标记开发
使用 GATK 软件工具包分别对亲本和子代的数据进行比对和SNP开发。结果显示,宫崎短枝富士和坂田津轻分别开发了4 669 811,4 951 676个SNP标签,杂合比率为69.35%和81.65%。子代群体开发了1 116 418个标签,杂合比率为10.83%(表2)。同时,还开发了SLAF 20 440个,平均测序总深度为2 538 482 cM,平均测序深度为12.01 cM。
表2 测序数据比对和SNP统计
Tab.2 Comparison of sequencing data and SNP
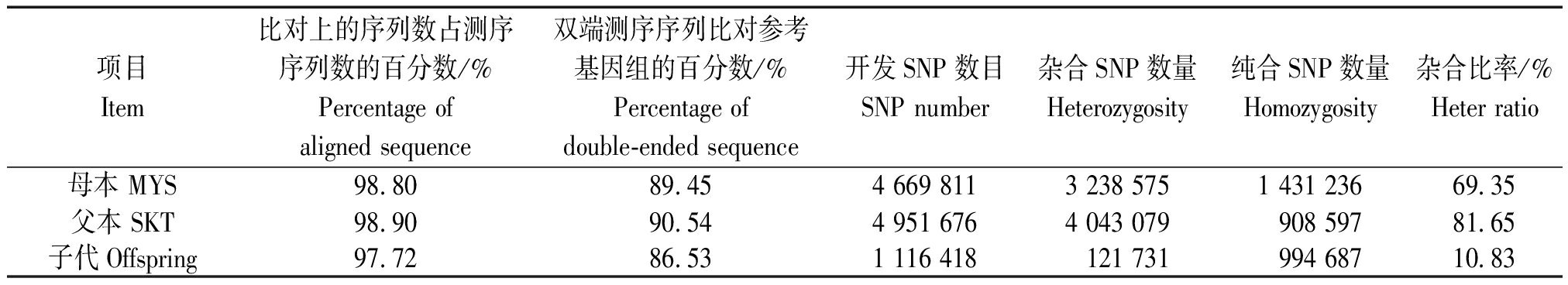
项目Item比对上的序列数占测序序列数的百分数/%Percentage of aligned sequence双端测序序列比对参考基因组的百分数/%Percentage of double-ended sequence开发SNP数目SNP number杂合SNP数量Heterozygosity纯合SNP数量Homozygosity杂合比率/%Heter ratio母本 MYS98.8089.454 669 8113 238 5751 431 23669.35父本 SKT98.9090.544 951 6764 043 079908 59781.65子代Offspring97.7286.531 116 418121 731994 68710.83
开发的SNP标记中非 aa×bb 标签的数目为 3 989 143个,占总开发的 SNP 数目的 54.50%(表3)。
2.4 遗传图谱构建
过滤筛选后的标记根据MLOD值进行连锁群的划分,所有标签分别归为17个群绘制连锁群。然后以连锁群为单位,采用Highmap将群内标记进行线性排列,共获得上图标记4 075个,总图距为2 235.23 cM(图2)。
表3 SNP的分类统计
Tab.3 Statistic of SNP Marker
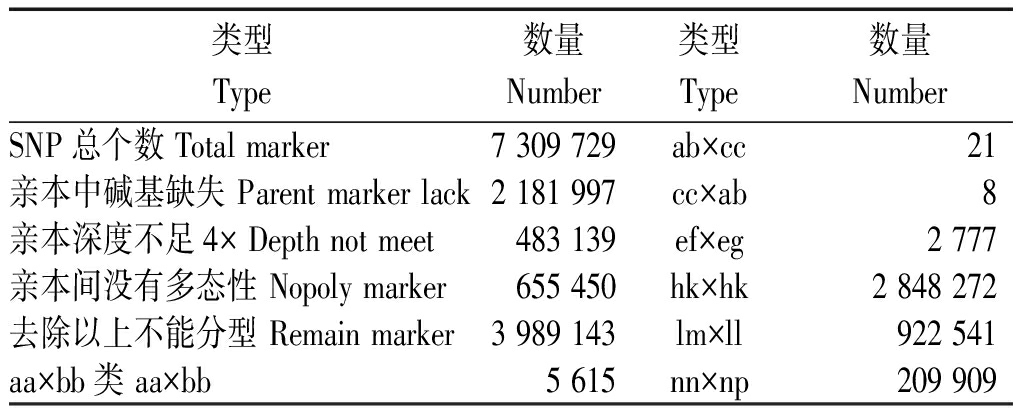
类型Type数量Number类型Type数量NumberSNP总个数 Total marker7 309 729ab×cc21亲本中碱基缺失 Parent marker lack2 181 997cc×ab8亲本深度不足4× Depth not meet483 139ef×eg2 777亲本间没有多态性 Nopoly marker655 450hk×hk2 848 272去除以上不能分型 Remain marker3 989 143lm×ll922 541aa×bb类 aa×bb5 615nn×np209 909
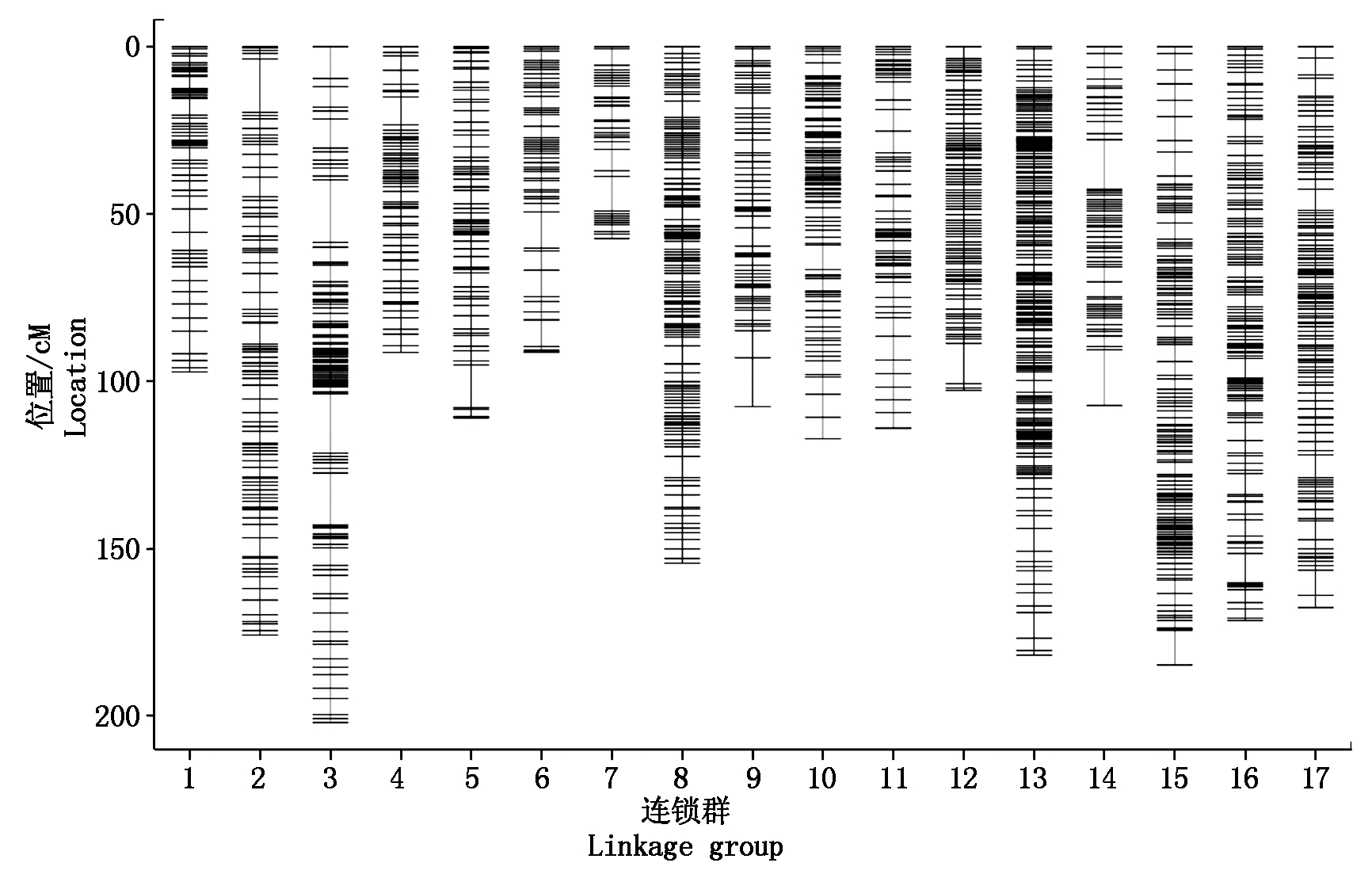
图2 宫崎短枝富士×坂田津轻杂种分离群体的遗传图谱
Fig.2 Genetic map constructed with a population derived from Miyazaki Spur×Sakata Tsugaru
2.5 遗传图谱评估
构建的中性遗传图谱,将4 075个标记定位在17个连锁群上,每个连锁群平均包括240个标记,2个标记的平均图距在0.55 cM(表4)。上图标记中包含了256个偏分离标记,占标记总数的比例为6.28%。
表4 分子标记及偏分离标记位点在连锁群上的分布
Tab.4 Basic characteristics of Malus linkage groups in the cross of between Miyazaki Spur and Sakata Tsugaru
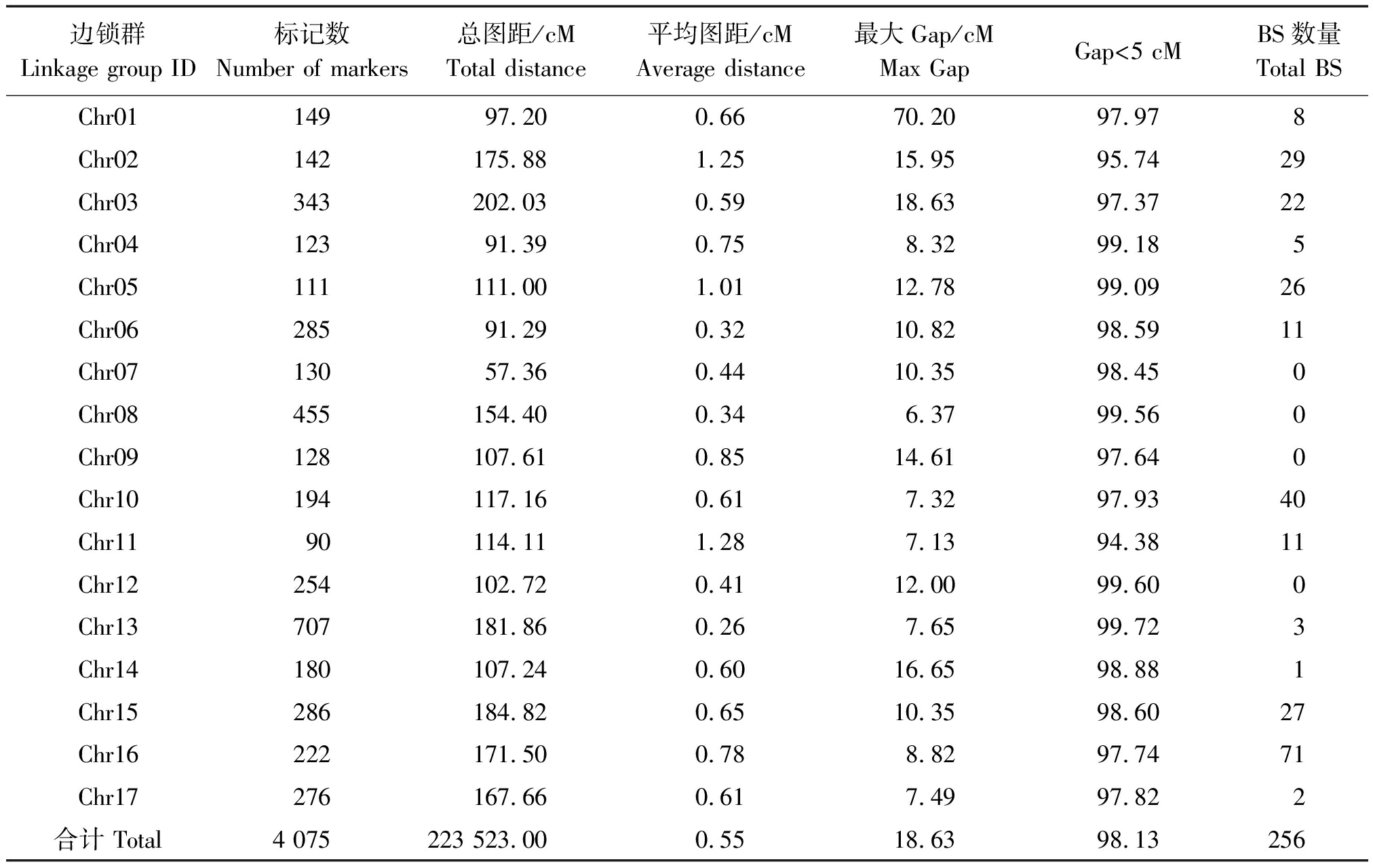
边锁群Linkage group ID标记数Number of markers总图距/cMTotal distance 平均图距/cMAverage distance 最大Gap/cMMax GapGap<5 cMBS数量Total BSChr0114997.200.6670.2097.978Chr02142175.881.2515.9595.7429Chr03343202.030.5918.6397.3722Chr0412391.390.758.3299.185Chr05111111.001.0112.7899.0926Chr0628591.290.3210.8298.5911Chr0713057.360.4410.3598.450Chr08455154.400.346.3799.560Chr09128107.610.8514.6197.640Chr10194117.160.617.3297.9340Chr1190114.111.287.1394.3811Chr12254102.720.4112.0099.600Chr13707181.860.267.6599.723Chr14180107.240.6016.6598.881Chr15286184.820.6510.3598.6027Chr16222171.500.788.8297.7471Chr17276167.660.617.4997.822合计 Total4 075223 523.000.5518.6398.13256
对作图群体每个个体上图标记完整性分析发现,上图标记的完整度平均为 99.92%,图谱基因分型准确。将上图标记在基因组上的位置和遗传图谱进行共线性分析发现,各个连锁群上大部分标记的顺序与基因组保持一致,说明共线性较好,遗传重组率的计算准确度高。
2.6 QTL分析
连续3 a的田间调查发现,在调查的150株中,8株无明显果锈,占调查数的5.3%,22株果锈量为1级,占调查数的14.7%,44株果锈量为2级,占调查数的29.3%,还有76株的锈含量在年份间差异较大。经mapqtl分析,共检测到控制苹果果锈的9个QTL,分布在Chr3、Chr9、Chr11和Chr15染色体上(图3),标记距离为0~4.9 cM,分别将这些QTL命名为Qru-3、Qru-9、Qru-11和Qru-15(图4),单个QTL的贡献率为18.0%~85.5%(表5)。其中,Qru-9、Qru-15和Qru-3的贡献率较高(分别为85.5%,24.3%~47.8%和46.1%),可能是控制苹果果锈的关键作用位点。
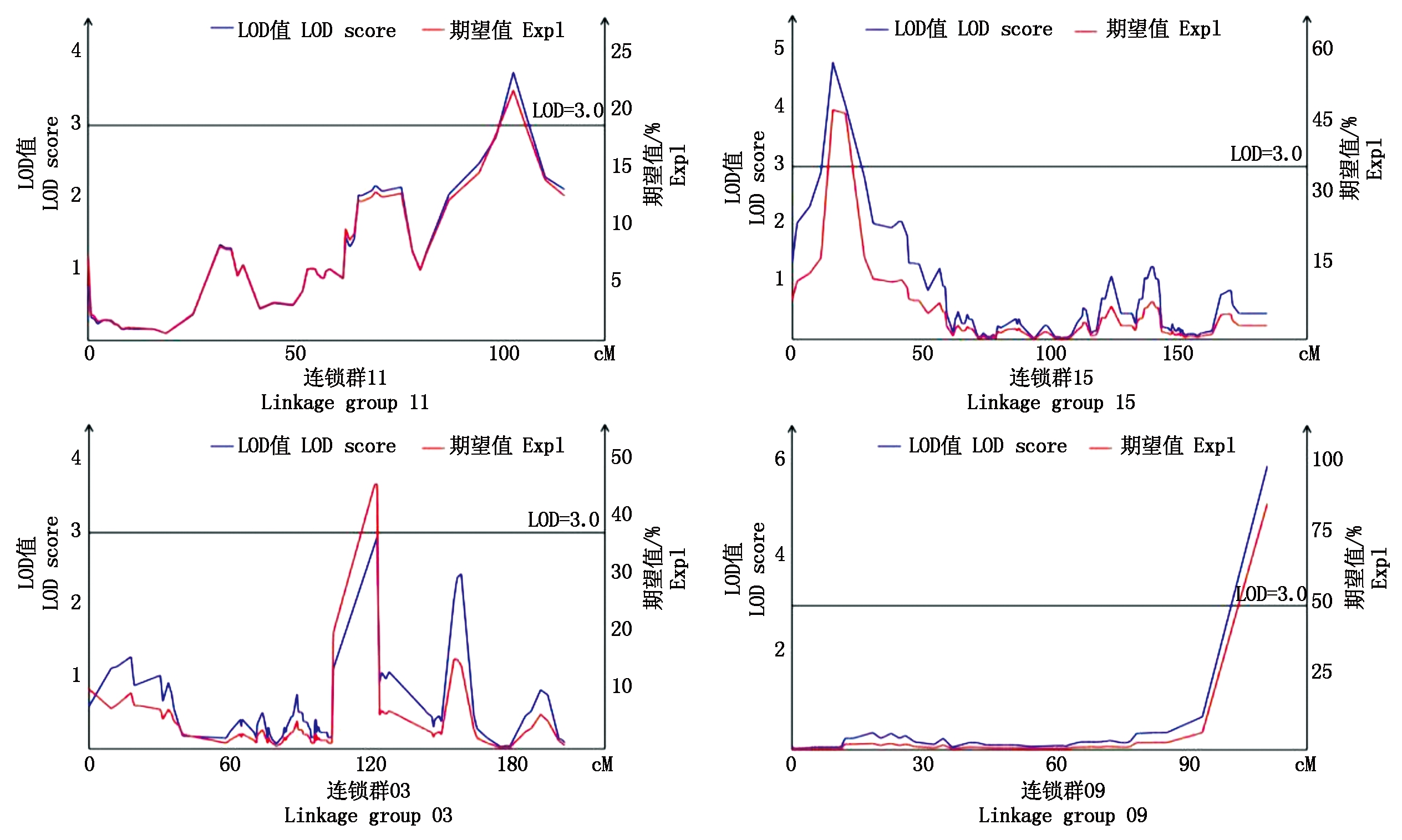
图3 果锈基因的QTL检测
Fig.3 QTL analysis of apple russeting gene

图4 利用宫崎短枝富士和坂田津轻杂种分离群体检测到果锈基因的QTL
Fig.4 QTL for apple russeting in a population derived from a cross between Miyazaki Spur and Sakata Tsugaru
表5 F1群体苹果果锈的QTL位置及贡献率
Tab.5 The distribution and contribution of QTLs for apple russeting in the population of Miyazaki Spur×Sakata Tsugaru
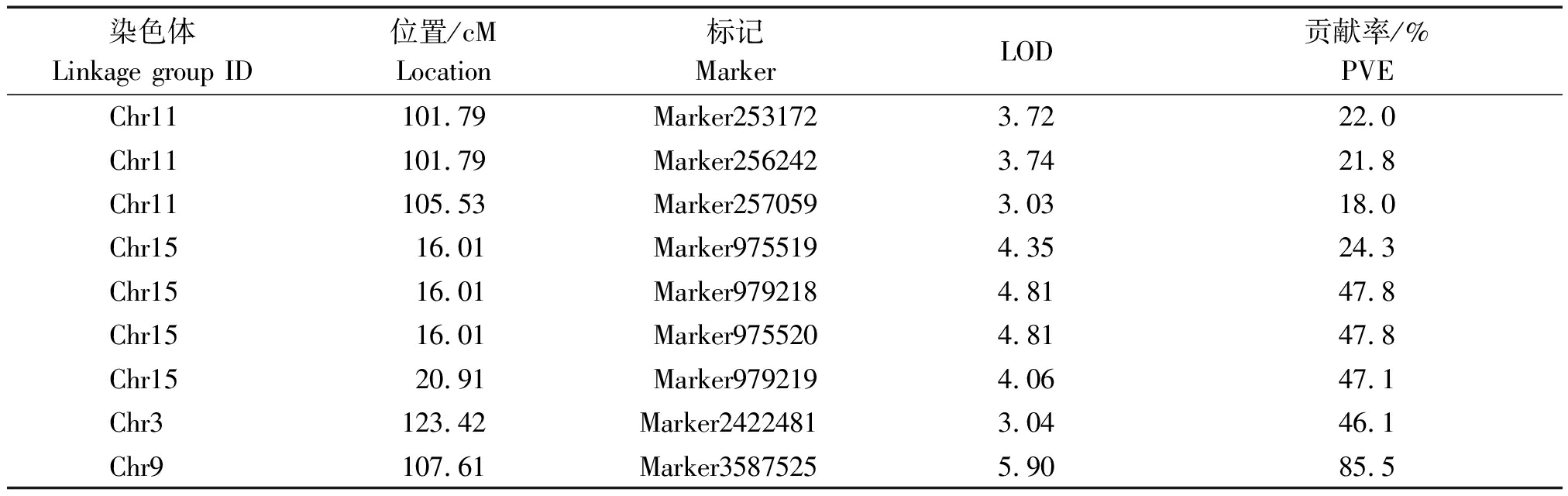
染色体Linkage group ID位置/cMLocation标记MarkerLOD贡献率/%PVE Chr11101.79Marker2531723.7222.0Chr11101.79Marker2562423.7421.8Chr11105.53Marker2570593.0318.0Chr1516.01Marker9755194.3524.3Chr1516.01Marker9792184.8147.8Chr1516.01Marker9755204.8147.8Chr1520.91Marker9792194.0647.1Chr3123.42Marker24224813.0446.1Chr9107.61Marker35875255.9085.5
对标记区域进行进一步基因注释,注释到127个基因,该4个染色体各包括61,64,1,1个基因。GO注释结果可知,它们在细胞组分、分子功能及生理代谢方面发挥作用,其中Qru-11、 Qru-15所携带信息更多一些,是今后研究的重点(表6)。
表6 标记区域的基因注释
Tab.6 Annotation of the marked regions of apple russeting gene
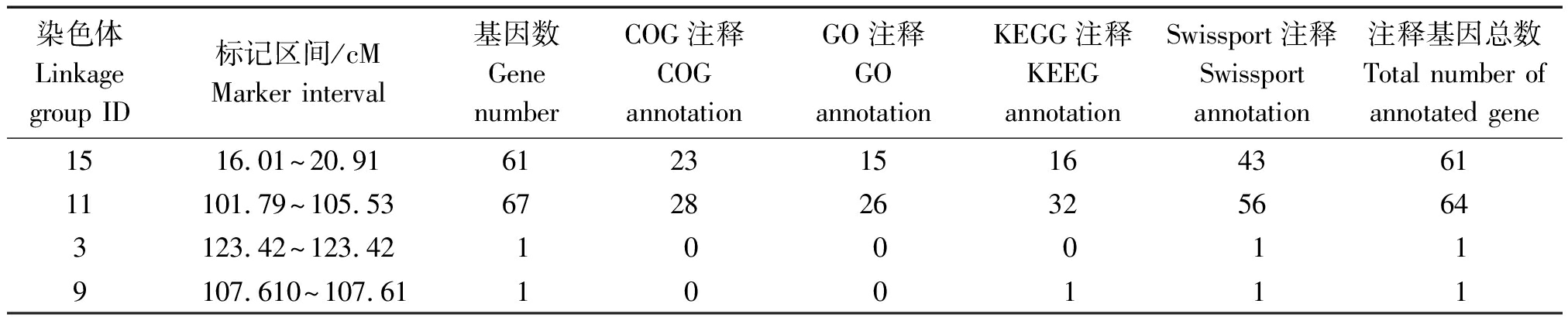
染色体 Linkage group ID标记区间/cMMarker interval基因数Gene numberCOG注释COG annotationGO注释GO annotationKEGG注释KEEG annotationSwissport注释Swissport annotation注释基因总数Total number of annotated gene1516.01~20.9161231516436111101.79~105.536728263256643123.42~123.421000119107.610~107.61100111
3 结论与讨论
SLAF-seq技术是利用二代高通量测序发展而来的一套简化基因组测序技术。根据参考基因组信息,通过特定内切酶酶切基因组并筛选特定大小的片段建库测序,从而选择性地得到目标基因组的片段序列。目前,基于 SLAF-seq 的分子标记技术已经在黄瓜[29]、葡萄[30]、木薯[31]、石槲兰[32]、玉米[33-34]等植物中得到应用。本研究利用该技术开发SLAF标签20 440个,SNP标记位点7 309 729个,这些信息位点为苹果相关基因的定位和分子辅助育种研究奠定了基础。
以往研究表明,苹果果锈受气候、病菌等因素的影响,苹果果锈的遗传力中等[23-24],而该基因的大小及所在的位置尚不清楚。近年来,随着高通量测序技术的发展,为性状的遗传分析提供了强大的技术支持[35]。Falginella等[25]将Ru-RGT定位在LG12上400 bp的基因片段上,进一步分析还发现,嘎拉苹果上也拥有该基因位点,但是桔苹等一些多锈品种没有检测到。因此,果锈基因的遗传机制更为复杂,为进一步发掘新的果锈基因,本研究在开发标记的基础上,进行遗传图谱的构建并结合3 a的表型数据,新获得了9个果锈相关QTL,分布于Chr3、Chr9、Chr11和 Chr15上,在这些区段内共注释到127个基因,它们在细胞组分、分子功能及生理代谢方面发挥作用。参照RNA混池重测序技术发现的206个参与细胞构建、生物代谢等过程的差异表达基因[2],进行对比分析、验证,有助于果锈基因的分子调控机制深入揭示。
一直以来,苹果果锈基因被作为不利性状来看待[8-14],不过最近在默顿和皇家嘎拉苹果的果锈组织上检测到桦木酸-3-反式-咖啡酸酯等3种三萜烯-咖啡酸酯,它们都具有独特的免疫调节活性[1],为果锈基因的开发利用提供了新思路。多年来的观察发现,果面锈含量多的果肉更脆,本研究群体中发现的全锈株即是如此,但是果实肉质是与果锈基因连锁,还是因受果锈相关代谢活动的直接影响所致,具体原因有待进一步研究。
[1] Andre C M, Larsen L, Burgess E J,Jensen D J,Cooney J M,Evers D,Zhang J L,Perry N B,Laing W A.Unusual immuno-modulatory triterpene-caffeates in the skins of russeted varieties of apples and pears[J].Journal of Agricultural and Food Chemistry,2013,61(11):2773-2779. doi:10.1021/jf305190e.
[2] Wang Y Z, Dai M S, Zhang S J, Shi Z B.Exploring candidate genes for pericarp russet pigmentation of sand pear(Pyrus pyrifolia)via RNA-Seq data in two genotypes contrasting for pericarp color[J].PLoS One,2014,9(1):e83675. doi:10.1371/journal.pone.0083675.
[3] Hou X D, Wei L L, Xu Y S,Khalil-Ur-Rehman M,Feng J,Zeng J J,Tao J M.Study on russet-related enzymatic activity and gene expression in′shine Muscat′grape treated with GA3 and CPPU[J].Journal of Plant Interaction,2017,13(1):195-202.doi:10.1080/17429145.2018.1455904.
[4] Bethke P C, Nassar A M K, Kubow S, Leclerc Y N, Li X Q, Haroon M, Molen T,Bamberg J, Martin M, Donnelly D J. History and origin of russet burbank (Netted Gem) a sport of Burbank[J]. American Journal of Potato Research, 2014, 91(6):594-609. doi:10.1007/s12230-014-9397-5.
[5] Massa A N, Manrique-Carpintero N C, Coombs J, Haynes K G, Bethke P C, Brandt T L, Cupta S K, Yencho G C, Novy R G, Douches D S.Linkage analysis and QTL mapping in a tetraploid russet mapping population of potato[J].BMC Genetics,2018,19(1):87.doi:10.1186/s12863-018-0672-1.
[6] Thangavel T, Tegg R S, Wilson C R.Resistance to multiple tuber diseases expressed in somaclonal variants of the potato cultivar russet burbank[J].The Scientific World Journal,2014:417697.doi:10.1155/2014/417697.
[7] 宋伟, 王彩虹, 田义轲, 田伟, 殷豪. 梨果实褐皮性状的SSR标记[J]. 园艺学报, 2010, 37(8):1325-1328.
Song W, Wang C H, Tian Y K, Tian W, Yan H. SSR molecular markers linked to the fruit russet skin of pear [J]. Acta Horticulturae Sinica, 2010,37(8):1325-1328.
[8] 吴厚玖, 陈荣柱, 李育农. 金冠苹果果锈发生时期与锈化过程的研究[J]. 园艺学报, 1984, 11(1):51-54.
Wu H J, Chen Y Z, Li Y N. Studies on the date of occurrence and histological development of russeting in Golden delicious apples[J]. Acta Horticulturae Sinica, 1984, 11(1):51-54.
[9] 夏春森, 周萍. 影响‘金冠’苹果果锈形成的因子[J]. 园艺学报, 1988, 15(2):139-142.
Xian C S, Zhou P. Factors influencing the formation of russet on the fruit of ′Golden Delicious′apple[J]. Acta Horticulturae Sinica, 1988, 15(2):139-142.
[10] Gildemacher P R, Heijne B, Houbraken J, Vromans T, Hoekstra E S, Boekhout T.Can phyllosphere yeasts explain the effect of scab fungicides on russeting of Elstar apples?[J].European Journal of Plant Pathology,2004,110(9):929-937.doi:10.1007/S10658-004-8948-x.
[11] Legay S, Guerriero G, Deleruelle A, Lateur M, Evers D, Andre C M, Hausman J F.Apple russeting as seen through the RNA-seq lens:strong alterations in the exocarp cell wall[J].Plant Molecular Biology,2015,88(1-2):21-40.doi:10.1007/s11103-015-0303-4.
[12] Bell H P.The origin of russeting in the Golden russet apple[J].Canadian Journal of Research,1937,15c(12):560-566. doi:10.1139/cjr37c-042.
[13] Verner L.Histology of apple fruit tissue in relation to cracking[J].Journal of Agricultural Research,1938,57(11):813-824.
[14] Noè N, Eccher T. ′Golden Delicious′ apple fruit shape and russeting are affected by light conditions[J]. Scientia Horticulturae, 1996, 65(2-3):209-213. doi: 10.1016/0304-4238(95)00850-0.
[15] Dillard H R, Cobb A C, Shah D A, Straight K E.Identification and characterization of russet on snap beans caused by Plectosporium tabacinum[J].Plant Disease,2005,89(7):700-704.doi:10.1094/PD-89-0700.
[16] Gildemacher P, Heijne B, Silvestri M, Hoekstra J, Hoekstra E, Theelen B, Boekhout T.Interactions between yeasts, fungicides and apple fruit russeting[J].FEMS Yeast Research,2006,6(8):1149-1156.doi:10.1111/j.1567-1364.2006.00109.x.
[17] 李健花,高晶晶,冯新新, 师忠轩, 高付永, 徐秀丽, 杨丽媛, 汪良驹. ‘金冠’苹果与其无锈芽变的果皮性状比较和防锈技术研究[J]. 园艺学报, 2014, 41(1):35-43.doi:10.3969/j.issn.0513-353x.2014.01.005.
Li J H, Gao J J, Feng X X, Shi Z X, Gao F Y, Xu X L, Yang L Y, Wang L J. Comparison of peel characteristics between ′Golden Delicious′ and its Non-russet sport ′Fengshuai′ apples to explore a method to prevent fruit russeting[J]. Acta Horticulturae Sinica, 2014, 41(1):35-43.
[18] Heng W, Wang M D, Yang J Y, Wang Z T, Jiang X H, Zhu L W.Relationship between H2O2 in polyamine metabolism and lignin in the exocarp of a russet mutant of ′Dangshansuli′ Pear (Pyrus bretschneideri Rehd.)[J].Plant Molecular Biology Reporter,2016,34(6):1056-1063.doi:10.1007/s11105-016-0985-z.
[19] Heng W, Wang Z T, Jiang X H, Jia B, Liu P, Liu L, Ye Z F, Zhu L W.The role of polyamines during exocarp formation in a russet mutant of ′Dangshansuli′ pear (Pyrus bretschneideri Rehd.)[J].Plant Cell Reports,2016,35(9):1841-1852.doi:10.1007/s00299-016-1998-7.
[20] Wang Y Z, Dai M S, Cai D Y, Zhang S A, Shi Z B.A review for the molecular research of russet/semi-russet of sand pear exocarp and their genetic characters[J].Scientia Horticulturae,2016,210:138-142.doi:10.1016/j.scienta.2016.07.019.
[21] Legay S, Guerriero G, André C, Guignard C, Cocco E, Charton S, Boutry M,Rowland O,Hausman J F.MdMyb93 is a regulator of suberin deposition in russeted apple fruit skins[J].New Phytologist,2016,212(4):977-991. doi:10.1111/nph.14170.
[22] Hou Z Q, Jia B, Li F, Liu P, Liu L, Ye Z F, Zhu L W, Wang Q, Heng W . Characterization and expression of the ABC family (G group) in ′Dangshansuli′ pear (Pyrus bretschneideri Rehd.) and its russet mutant[J].Genetics and Molecular Biology,2018,41(1):137-144. doi:10.1590/1678-4685-gmb-2017-0109.
[23] Durel C E, Laurens F, Fouillet A, Lespinasse Y.Utilization of pedigree information to estimate genetic parameters from large unbalanced data sets in apple[J].Theoretical and Applied Genetics,1998,96(8):1077-1085.doi:10.1007/s001220050842.
[24] 刘志, 伊凯, 王冬梅, 杨巍, 杨锋, 张景娥. 富士苹果果实外观品质性状的遗传[J]. 果树学报, 2004, 21(6):505-511.doi:10.3969/j.issn.1009-9980.2004.06.001.
Liu Z, Yi K, Wang D M, Yang W, Yang F, Zhang J E. Study on the inheritance of external characteristics of Fuji apple fruit [J]. Journal of Fruit Science, 2004,21(6):505-511.
[25] Falginella L, Cipriani G, Monte C, Gregori R, Testolin R, Velasco R, Troggio M, Tartarini S.A major QTL controlling apple skin russeting maps on the linkage group 12 of ′Renetta Grigia di Torriana′[J].BMC Plant Biology,2015,15:150.doi:10.1186/s12870-015-0507-04.
[26] Kozich J J, Westcott S L, Baxter N T, Highlander S K, Schloss P D.Development of a dual-index sequencing strategy and curation pipeline for analyzing amplicon sequence data on the MiSeq illumina sequencing platform[J].Applied and Environmental Microbiology,2013,79(17):5112-5120.doi:10.1128/AEM.01043-13.
[27] Stam P.Construction of integrated genetic linkage maps by means of a new computer package:JoinMap[J].The Plant Journal,1993,3(5):739-744. doi:10.1111/j.1365-313x.1993.00739.x.
[28] Li R Q, Li Y R, Kristiansen K, Wang J.SOAP:short oligonucleotide alignment program[J].Bioinformatics,2008,24(5):713-714.doi:10.1093/bioinformatics/btn025.
[29] Xu X W, Xu R X, Zhu B Y, Yu T, Qu W Q, Lu L, Xu Q, Qi X H, Chen X H. A high-density genetic map of cucumber derived from specific length amplified fragment sequencing (SLAF-seq)[J]. Frontiers in Plant Science, 2014, 5:768. doi:10.3389/fpls.2014.00768.
[30] Guo Y S, Shi G L, Liu Z D, Zhao Y H, Yang X X, Zhu J C, Li K, Guo X W.Using specific length amplified fragment sequencing to construct the high-density genetic map for Vitis (Vitis vinifera L. × Vitis amurensis Rupr.)[J].Frontiers in Plant Science,2015,6:393.doi:10.3389/fpls.2015.00393.
[31] 俞奔驰, 韦丽君, 雷开文, 宋恩亮, 马崇熙. 基于SLAF-seq技术的木薯SNP标记开发[J]. 植物生理学报, 2018, 54 (6):1029-1037. doi:10.13592/j.cnki.ppj.2018.0029.
Yu B C, Wei L J, Lei K W, Song E L, Ma C X. Development of SNP markers in cassava (Manihot esculenta Crantz) based on SLAF-seq technology[J]. Plant Physiology Journal, 2018, 54 (6):1029-1037.
[32] Lu J J, Liu Y Y, Xu J, Mei Z W, Shi Y J, Liu P L, He J B, Wang X T, Meng Y J, Feng S G, Shen C J, Wang H Z. High-density genetic map construction and stem total polysaccharide content-related QTL exploration for Chinese Endemic Dendrobium (Orchidaceae)[J]. Frontier in Plant Science, 2018,9:398. doi:10.3389/fpls.2018.00398.
[33] Xia C, Chen L L, Rong T Z, Li R, Xiang Y, Wang P, Liu C H, Dong X Q, Liu B, Zhao D, Wei R J, Lan H.Identification of a new maize inflorescence meristem mutant and association analysis using SLAF-seq method[J].Euphytica,2015,202(1):35-44.doi:10.1007/s10681-014-1202-5.
[34] 杜龙岗,王美兴. 玉米 SLAF 标记的开发及其在玉米果皮纤维素含量BSA 分析中的应用[J]. 中国农业科学, 2018, 51(8):1421-1430. doi:10.3864/j.issn.0578-1752.2018.08.001.
Du L G, Wang M X. SLAF-marker development and its application in BSA analysis of cellulose content in pericarp of maize kernel[J]. Scientia Agricultura Sinica, 2018, 51(8):1421-1430.
[35] Kumar S, Bink M C A M, Volz R K, Bus V G M, Chagné D.Towards genomic selection in apple (Malus domestica Borkh.) breeding programmes:Prospects, challenges and strategies[J].Tree Genetics & Genomes,2012,8(1):1-14.doi:10.1007/s11295-011-0425-z.