植物的生长和发育离不开水分的运输,将体内水势维持在一个合适的水平尤为重要。水通道蛋白(Aquaporin,AQP)是一种定位于细胞膜上的蛋白质,可以调节水分高效快速、可逆地跨膜转运,从而调控植物体内水分的平衡。AQP为主要内在的膜镶嵌蛋白超基因家族(Major Intrinsic proteins,MIPs)中的一员,广泛存在于动植物和微生物中。植物中AQP的类型丰富多样且表达丰度极高[1],如拟南芥(Arabidopsis thaliana)中有35个水通道蛋白成员[2],玉米(Zea mays)中有36个[3],水稻(Oryza sativa)中有33个[4],葡萄(Vitis vinifera)中有33个[5],番茄(Solanum lycopersicum)中有37个[6],陆地棉(Gossypium hirsutum)中有71个[7],大豆(Glycine max)中有66个[8],芝麻(Sesamum indicum)中有35个[9]。根据序列相似性和亚细胞定位,AQP被分为7类,分别是质膜内在蛋白(Plasma membrane intrinsic proteins, PIPs),液泡膜内在蛋白(Tonoplast intrinsic proteins, TIPs),类Nodulin26内在蛋白(Nodulin26-like intrinsic proteins, NIPs),小分子碱性膜内在蛋白(Small basic intrinsic proteins, SIPs),类GlpF内在蛋白(Glycerol facilitator intrinsic proteins, GIPs),混合类内在蛋白(Hybrid intrinsic proteins, HIPs)和未知类X内在蛋白(Uncategorized X basic intrinsic proteins, XIPs)[2, 10-12]。其中,GIPs 发现于小立碗藓(Physcomitrella patens)中,HIPs发现于球蒴藓(Sphaerotheciella sphaerocarpa)中,XIPs在马铃薯(Solanum tuberosum)、烟草(Nicotiana tabacum)和小立碗藓中被发现,并不常见,相关研究较少。
PIPs是MIPs中最大的亚家族,分为PIP1s和PIP2s 2个亚类,是一类多功能蛋白质,对运输机制有高度选择性[13]。PIPs分子质量约24~30 ku,有6个跨膜结构域,5个亲水环(loop A~E)。其中A、C、E环位于细胞膜外,B、D环及氨基端和羧基末端均位于细胞质一侧;在B、E环上各有一个高度保守的天门冬氨酸-脯氨酸-丙氨酸(NPA)小结构域[14-15]。PIP1s与PIP2s的主要区别在于N端和C端的不同,PIP1s有较长的N端和较短的C端,PIP2s则相反[16-17]。PIP2s具有较高的水分渗透性,PIP1s水分运输能力弱,说明PIP2s在胁迫条件下受到异位蛋白影响比PIP1s大,但二者均能参与植物的生长和发育[14]。许多研究表明,植物能够通过调节PIPs的活性响应各种非生物胁迫,如干旱、高温、盐害、渗透胁迫等[18-19]。例如,在拟南芥中过表达巴西香蕉(Musa acuminata)中的MaPIP1;1基因,在干旱和高盐胁迫条件下,转基因植株的抗性显著提高,且转基因株系的根系增长,根毛增多[20]。马尾松(Pinus massoniana)的PmPIP1基因可受干旱胁迫诱导表达,推测可能参与了干旱胁迫过程[21]。高羊茅(Festuca arundinacea)基因FaPIP2;1在拟南芥中过表达,转基因植株的抗旱性明显增强[22]。灰毛滨藜(Atriplex canescens)中AcPIP2基因过表达拟南芥,能够调控转基因植株对干旱、高盐和低温等胁迫的抵抗力[23]。由此可见,PIPs 在植物抵御非生物胁迫过程中具有非常重要的作用。目前,砂藓(Racomitium canescens)水通道蛋白PIPs基因克隆和功能分析的相关研究未见报道。因此,为更好地了解苔藓植物的抗干旱机理,本研究对砂藓水通道蛋白PIPs基因进行克隆,对其编码蛋白进行结构预测,为苔藓植物抗旱基因工程研究提供理论依据。
1 材料和方法
1.1 试验材料
砂藓采于黑龙江省五大连池风景区石龙。选取生长旺盛的材料,用无菌水清洗后,于室温中培养,取茎尖部分放于液氮中速冻,于-80 ℃冰箱中保存备用。
1.2 试验方法
1.2.1 总RNA的提取 采用沙伟等[24]的改良SDS法进行砂藓总RNA的提取。
1.2.2 RcPIP2的克隆 从砂藓干旱转录组测序数据库中筛选得到1个PIPs家族基因PIP2的转录本序列,根据其序列设计1对引物R1(5′-GAGGCGG CTTCGTAGGTTA-3′)和R2(5′-GCACAGCGACCTA CATACAAGA-3′),扩增基因PIP2全长序列,并命名为RcPIP2基因。将PCR扩增产物进行回收、连接、转化和双酶切鉴定。对已鉴定的阳性克隆送至北京华大基因进行测序。
1.2.3 生物信息学分析 运用ProtParam软件预测该基因的基本理化性质;通过ProtScale和TMHMM软件预测基因RcPIP2编码的氨基酸序列的亲疏水性、跨膜结构域;利用SignalP 4.1和SOPMA软件对氨基酸序列的信号肽和二级结构进行预测;氨基酸序列立体结构预测由SWISS-MODEL软件完成。将氨基酸序列在NCBI数据库中的BlastX进行同源性搜索和比对,利用MEGA 5.0软件分析RcPIP2蛋白质与其他植物的PIP2蛋白质的进化关系,构建系统进化树。
2 结果与分析
2.1 RcPIP2基因 cDNA 全长的克隆
以砂藓反转录cDNA为模板,以干旱转录组数据为基础,对PIP2进行扩增,得到的目的片段长度约1 200 bp(图1-A)。回收目的片段与克隆载体相连,得到重组质粒pMD19 simple T-PIP2,将其转化到大肠杆菌感受态细胞中。经蓝白斑筛选出阳性克隆菌落,提取质粒DNA进行双酶切鉴定,结果与目的片段大小相吻合,说明重组质粒构建成功(图1-B)。测序结果显示,PIP2基因全长为1 267 bp,ORF长807 bp,共编码含有268个氨基酸的蛋白质序列,与转录组测序结果一致(图2)。对该片段的测序结果表明,这是首次从砂藓中克隆获得的PIP2基因家族成员,因此,命名为RcPIP2基因。
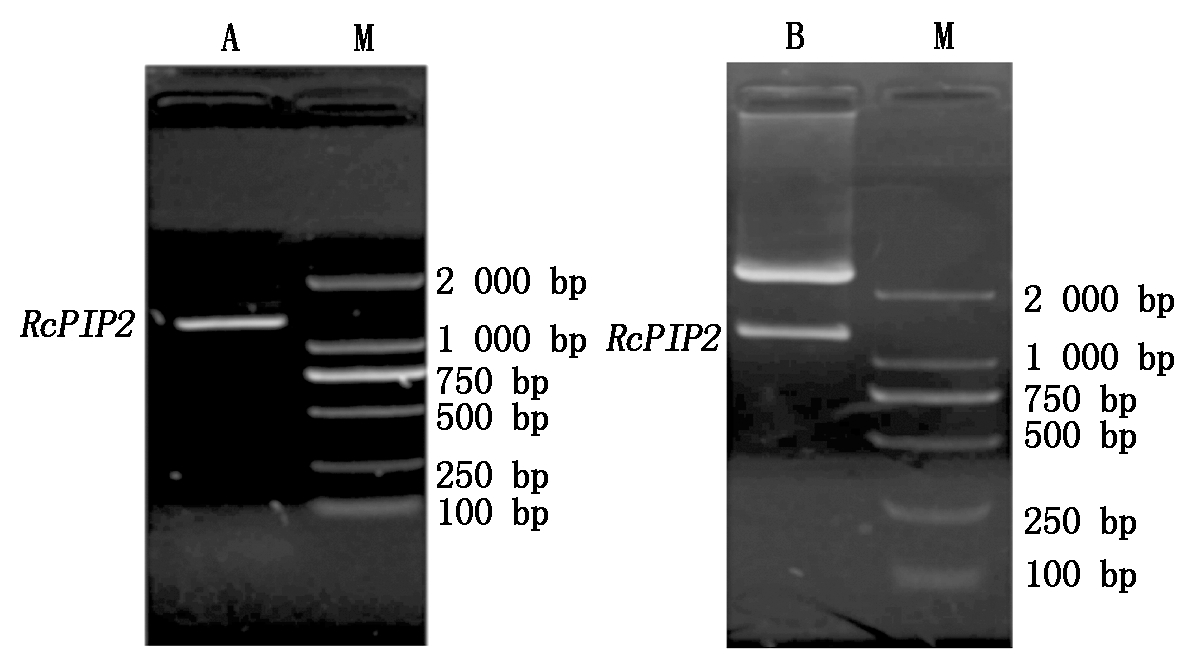
M.DL2000 DNA Marker。
图1 RcPIP2基因PCR产物(A)及重组质粒酶切鉴定(B)
Fig.1 PCR product (A) and recombinant plasmid digested by restriction endonuclease of RcPIP2 (B)

ATG.起始密码子;TAG.终止密码子;单下划线. 高度保守序列;黑框. 高度保守天门冬酰胺-脯氨酸-丙氨酸Asn-Pro-Ala (NPA)。
ATG.Initiator codon; TAG.Terminator codon; Single underline.Highly conserved sequence; Black box.Conserved Asn-Pro-Ala (NPA).
图2 RcPIP2基因核苷酸序列及预测编码的氨基酸序列
Fig.2 Nucleotide sequence of RcPIP2 and predicted coded amino acid sequence
2.2 生物信息学分析
2.2.1 RcPIP2蛋白质理化性质及亲疏水性分析 RcPIP2基因编码的氨基酸序列中,相对含量比较多的氨基酸是丙氨酸Ala(A)和甘氨酸Gly(G),分别为12.9%,9.3%,氨基酸组成见表1。
通过ProtParam软件预测RcPIP2蛋白质的分子质量(Mr)为28.3 ku,理论等电点(pI)为6.64,其中负电荷残基数(Asp+Glu)为15,正电荷残基数(Arg+Lys)为14,为中性蛋白质;不稳定系数为21.61<40,表示该蛋白质为稳定性蛋白质;脂肪系数为102.39,表示该蛋白质中脂肪侧链所占的比值较大,推测疏水性较强。ProtScale软件可分析蛋白质疏水曲线,其中正值表示疏水,负值表示亲水,疏水性较高的肽段位于蛋白质的内部,亲水性较高的肽段位于蛋白质分子的表面(图3)。图3结果显示,RcPIP2蛋白质符合膜蛋白的特征,具有较强的疏水性。
表1 RcPIP2蛋白质的氨基酸组成
Tab.1 The amino acid composition of RcPIP2 protein %
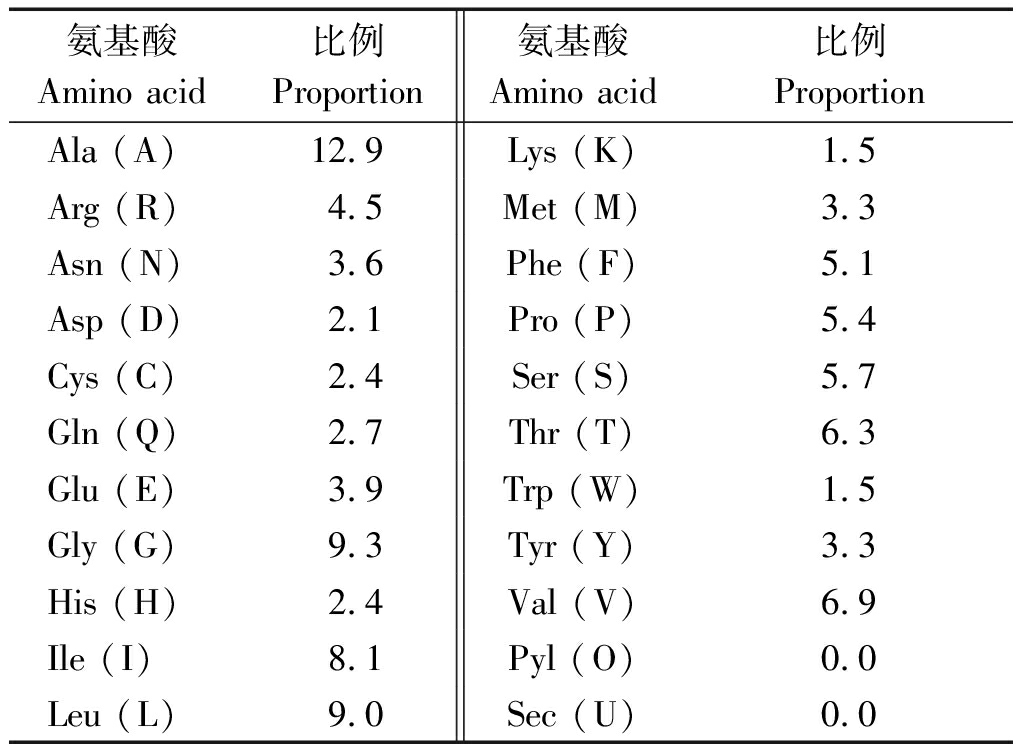
氨基酸Amino acid比例Proportion 氨基酸Amino acid比例Proportion Ala (A)12.9Lys (K)1.5Arg (R)4.5Met (M)3.3Asn (N)3.6Phe (F)5.1Asp (D)2.1Pro (P)5.4Cys (C)2.4Ser (S)5.7Gln (Q)2.7Thr (T)6.3Glu (E)3.9Trp (W)1.5Gly (G)9.3Tyr (Y)3.3His (H)2.4Val (V)6.9Ile (I)8.1Pyl (O)0.0Leu (L)9.0Sec (U)0.0
2.2.2 RcPIP2蛋白质结构域分析 利用NCBI中Conserved Domains在线软件分析保守结构域发现,RcPIP2具有膜内在蛋白(MIP)家族信号序列,属于MIP超家族成员(图4)。该结构域具有高等植物高度保守序列HINPAVTFG,且在氨基酸的C端和N端包含2个特有的高度保守的天门冬酰胺-脯氨酸-丙氨酸Asn-Pro-Ala (NPA)结构单元(图2)。
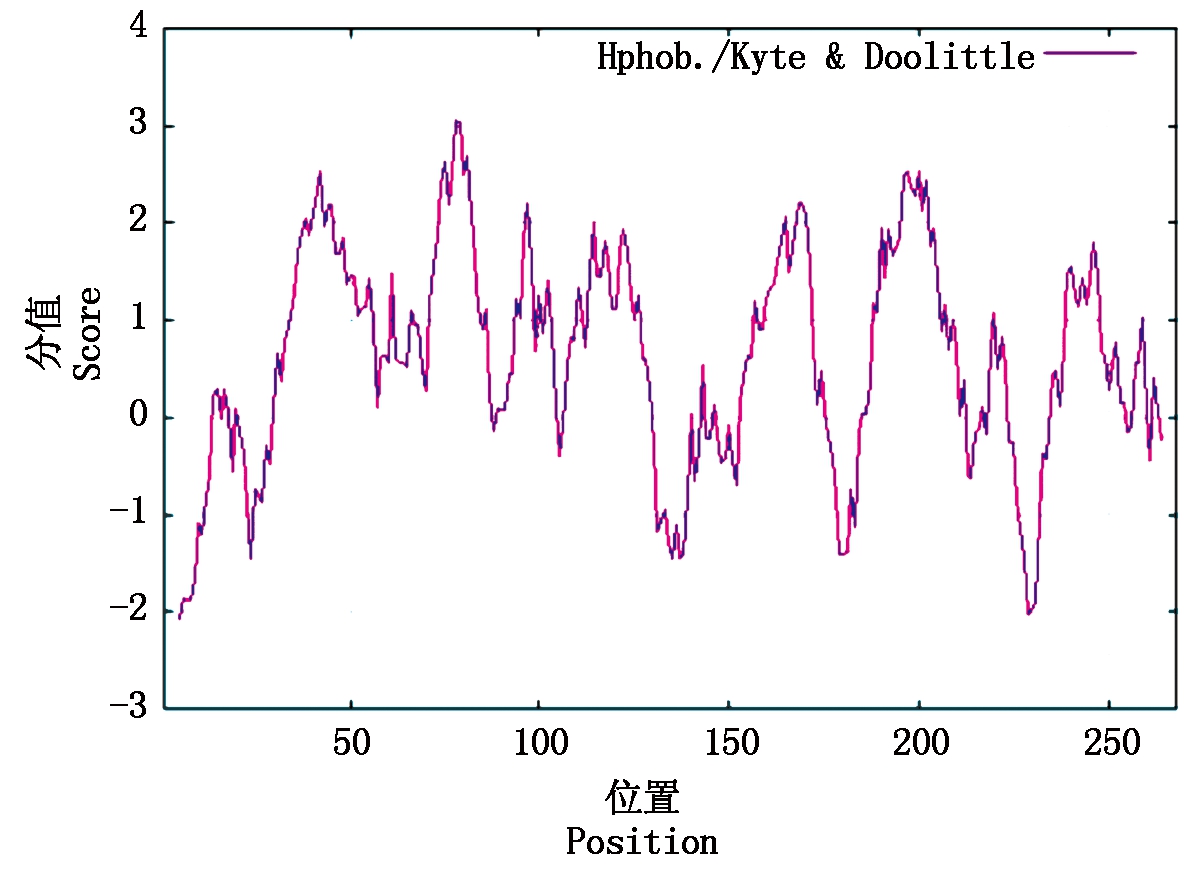
图3 RcPIP2蛋白质疏水性分析
Fig.3 Hydrophobicity analysis of RcPIP2

图4 RcPIP2蛋白质的保守结构域
Fig.4 Conserved domains of RcPIP2 protein
2.2.3 RcPIP2蛋白质信号肽和和跨膜结构域分析 利用SignalP 4.1软件进行信号肽预测发现,RcPIP2不存在信号肽,推测为非分泌蛋白质。利用TMHMM软件对RcPIP2跨膜区分析显示,膜螺旋中氨基酸期望值高达134.158 97,存在6个可能的跨膜区域(TM1-TM6),其中37-59,110-132,86-208位氨基酸均是由内向外跨膜;69-91,152-174,234-256位氨基酸均是由外向内跨膜,且N端和C端都位于膜的内侧(图 5)。
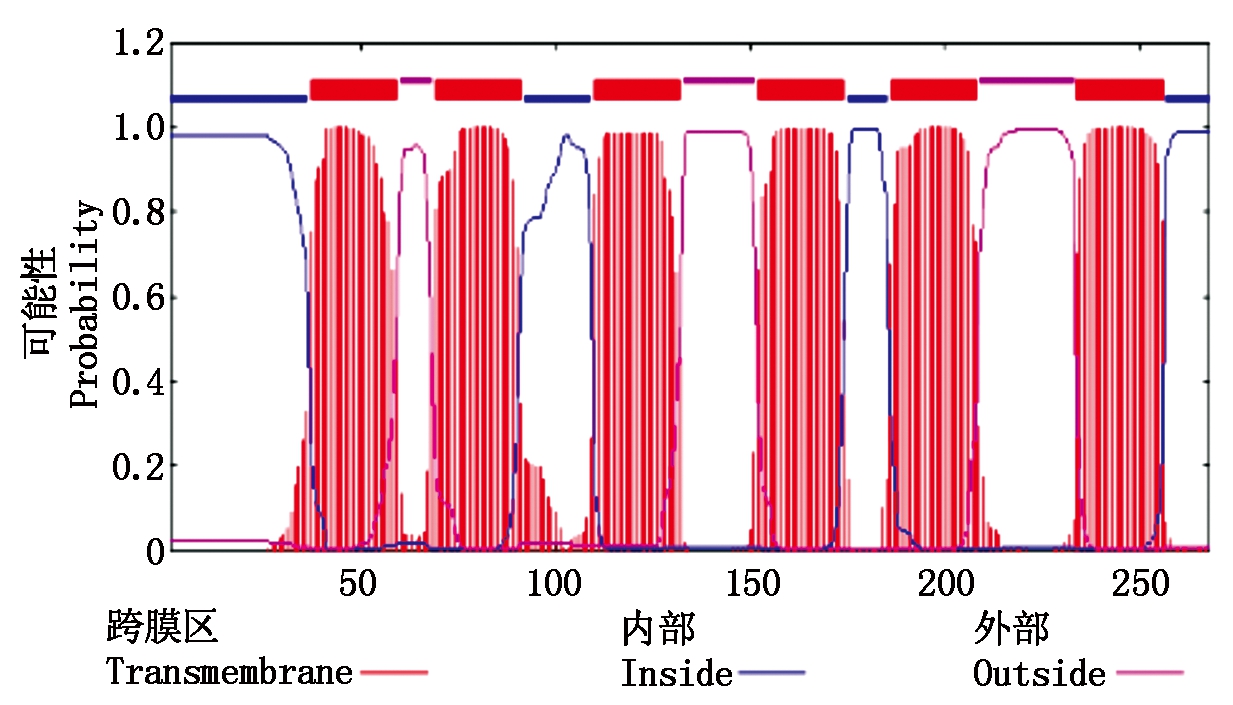
图5 RcPIP2蛋白质跨膜区预测
Fig.5 Prediction of transmembrane domains of RcPIP2 protein
2.2.4 RcPIP2蛋白质二级和三级结构预测 采用SOMPA预测二级结构显示,RcPIP2蛋白质拥有α螺旋(h)80个,占总数的37.31%;β折叠(e)64个,占总数的20.9%;无规则卷曲(c)148个,占总数的38.43%(图 6)。
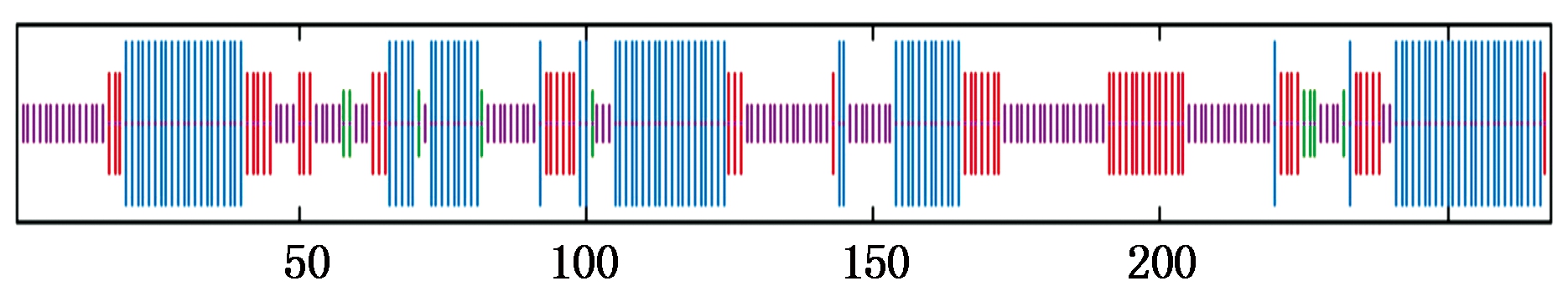
蓝. α-螺旋;紫. 无规则卷曲;红. 延伸链;绿. β-转角。
Blue.Alpha helix; Purple.Random coil;
Red.Extended strand; Green.Beta turn.
图6 RcPIP2蛋白质二级结构预测
Fig.6 Predicted secondary structure of RcPIP2 protein
利用SWISS-MODEL对RcPIP2氨基酸三级结构进行在线预测发现,RcPIP2蛋白质的立体结构与水通道蛋白的高级结构基本一致,由水通道蛋白分子组成四聚体,其中每一个亚基都有一个通道,这4个亚基平行分布,在四聚体中间形成第5个通道(图 7)。
2.2.5 RcPIP2蛋白质一致性比对及系统进化树分析 利用NCBI的Blast软件进行RcPIP2基因编码氨基酸序列的同源性查找,结果发现,RcPIP2蛋白质与其他物种的PIP2蛋白质相似性较高,与拟南芥(NP_191042.1)、小立碗藓(AAS65964.1)、玉米(NP_001105616.1)、烟草(NP_001312276.1)、陆地棉(NP_001314334.1)、地钱(PTQ40096.1)、高粱(XP_002446796.1)、大豆(XP_003556232.1)、二穗短柄草(XP_003580150.1)、谷子(XP_004953172.1)和水稻(XP_015645289.1)等物种中的PIP2蛋白质的相似性均在66%以上。其中,与小立碗藓的一致性最高,为67%,这说明在长期的进化中,PIP2基因的结构也在进化,但是相对保守。
利用MEGA 5.0软件构建系统进化树,结果表明,以上物种被聚为两大支,其中砂藓、小立碗藓和地钱亲缘关系最近,聚为一支(图8)。
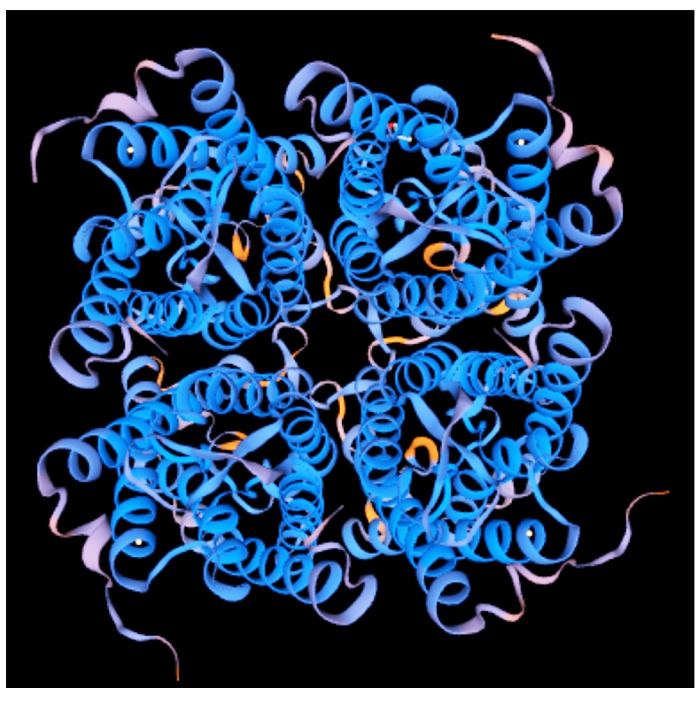
图7 RcPIP2蛋白质三级结构预测
Fig.7 Predicted tertiary structure of RcPIP2 protein

分支上的数字表示Bootstrap验证中基于1 000次重复该节点可信度。
The numbers on the branches represent the reliability percent of bootstraps values based on 1 000 replications.
图8 RcPIP2蛋白质与其他植物PIP2蛋白质的系统进化树
Fig.8 Phylogenetic tree of RcPIP2 protein and other plants PIP2 proteins
3 结论与讨论
植物中的水分经过长距离运输,利用扩展和渗透调节的方式进入单个细胞,在整个过程中都离不开水分的跨膜运输。而植物水通道蛋白介导的自由水快速被动地跨生物膜转运便构成了植物体水进出细胞的主要途径。砂藓可以经历长期的干旱胁迫,复水后仍能快速地恢复正常生长,说明其具有独特的耐旱、抗旱机制[25]。本研究成功扩增出砂藓水通道蛋白RcPIP2基因序列。研究发现,RcPIP2蛋白属于MIP超家族,具有保守的HINPAVTFG氨基酸序列,6个跨膜结构域,存在2个特异保守区(NPA),分别深入到脂质双层的内部,呈中心反向相对排列,可在膜双脂层中间重叠成2个半孔,形成一个狭窄的水通道,允许水分子通过。NPA是水通道蛋白的特异性保守序列,几乎所有的MIP均具有此结构域。因此,本研究所获得的RcPIP2基因基本可确定为水通道蛋白家族成员。
利用生物信息学相关软件对砂藓水通道蛋白RcPIP2编码氨基酸的特性进行分析可知,该蛋白质为中性蛋白质,无信号肽区域,说明为非分泌性蛋白质,且并不缺乏结构区域。RcPIP2蛋白质共由80个α螺旋、64个β折叠和148个无规则卷曲构成。通过其立体结构可以看出,该蛋白质为四聚体形式,中间为高度保守的NPA基序组成的水通道,与水通道蛋白质的基本结构相吻合。系统进化树分析表明,砂藓、小立碗藓和地钱均为苔藓植物中的成员,而RcPIP2与二者的亲缘关系最近,处于同一进化枝,进一步推测本研究中所得的RcPIP2是PIP2蛋白质家族中的一员,研究结果可为后续进一步研究其功能提供重要的基础数据,并最终为苔藓植物的耐旱机制研究提供理论依据。
目前对植物水通道蛋白的结构、功能及其调节机制还知之甚少,真正揭开植物水通道蛋白在植物生命活动的分子机理中的作用所面临的任务还十分艰巨[26]。对抗旱植物水通道蛋白分子水平的研究还需要进一步的深入探索。
[1] Grondin A, Mauleon R, Vadez V, Henry A. Root aquaporins contribute to whole plant water fluxes under drought stress in rice (Oryza sativa L.)[J]. Plant Cell and Environment,2016, 39(2):347-365. doi:10.1111/pce.12616.
[2] Johanson U, Karlsson M, Johansson I, Gustavsson S, Sjövall S, Fraysse L, Weig A R, Kjellbom P. The complex set of genes encoding major intrinsic proteins in Arabidopsis provides a framework for a new nomenclature for major intrinsic proteins in plants[J]. Plant Physiology, 2001, 126(4):1358-1369. doi:10.1104/pp.126.4.1358.
[3] Chaumont F, Barrieu F, Wojcik E, Chrispeels M J, Jung R. Aquaporins constitute a large and highly divergent protein family in maize[J]. Plant Physiology, 2001, 125(3):1206-1215.doi:10.1104/pp.125.3.1206.
[4] Sakurai J, Ishikawa F, Yamaguchi T, Uemura M, Maeshima M. Identification of 33 rice aquaporin genes and analysis of their expression and function[J]. Plant Cell Physiology, 2005, 46(9):1568-1577. doi:10.1093/pcp/pci172.
[5] Fouquet R, Léon C, Ollat N, Barrieu F. Identification of grapevine aquaporins and expression analysis in developing berries[J]. Plant Cell Reports, 2008, 27(9):1541-1550. doi:10.1007/s00299-008-0566-1.
[6] Sade N, Vinocur B J, Diber A, Shatil A, Ronen G, Nissan H, Wallach R, Karchi H, Moshelion M. Improving plant stress tolerance and yield production:is the tonoplast aquaporin SlTIP2;2 a key to isohydric to anisohydric conversion?[J]. New Phytologist Trust, 2009, 181(3):651-661. doi:10.1111/j.1469-8137.2008.02689.x.
[7] Park W, Scheffler B E, Bauer P J, Campbell B T. Identification of the family of aquaporin genes and their expression in upland cotton (Gossypium hirsutum L.)[J]. BMC Plant Biology, 2010, 10(1):142.doi:10.1186/1471-2229-10-142.
[8] Zhang D Y, Ali Z, Wang C B, Xu L, Yi J X, Xu Z L, Liu X Q, He X L, Huang Y H, Khan I A, Trethowan R M, Ma H X. Genome-wide sequence characterization and expression analysis of major intrinsic proteins in soybean (Glycine max L.)[J]. PLoS One, 2013, 8(2):e56312.doi:10.1371/journal.pone.0056312.
[9] 吴向阳, 程朝泽, 吕高强, 王心宇. 芝麻AQP家族的全基因组序列鉴定及其特征分析[J]. 中国农业科学, 2016, 49(10):1844-1858. doi:10.3864/j.issn.0578-1752.2016.10.002.
Wu X Y, Cheng C Z, Lǘ G Q, Wang X Y. Identification and characterization of the AQP gene family in sesame[J]. Scientia Agricultura Sinica, 2016, 49(10):1844-1858.
[10] Zardoya R. Phylogeny and evolution of the major intrinsic protein family[J]. Biology of the Cell, 2005, 97(6):397-414. doi:10.1042/BC20040134.
[11] Gustavsson S, Lebrun A S, Nordén K, Chaumont F, Johanson U. A novel plant major intrinsic protein in Physcomitrella patens most similar to bacterial glycerol channels[J]. Plant Physiology, 2005, 139(1):287-295. doi:10.1104/pp.105.063198.
[12] Danielson J Å, Johanson U. Unexpected complexity of the aquaporin gene family in the moss Physcomitrella patens[J]. BMC Plant Biology, 2008, 8(1):45. doi:10.1186/1471-2229-8-45.
[13] 王星, 张纪龙, 冯秀秀, 李洪杰, 张根发. 植物质膜水通道蛋白转运及逆境胁迫响应的分子调控机制[J]. 遗传, 2017, 39(4):293-301. doi:10.16288/j.yczz.16-290.
Wang X, Zhang J L, Feng X X, Li H J, Zhang G F. The molecular mechanisms of plant plasma membrane intrinsic proteins trafficking and stress response[J].Hereditas,2017, 39(4):293-301.
[14] 江林娟, 陈春华, 颜旭, 杨世民. 植物水通道蛋白的干旱应答机制研究进展 [J]. 广西植物, 2018, 38(5):672-680. doi:10. 11931/guihaia. gxzw201705032.
Jiang L J, Chen C H, Yan X, Yang S M. Research progress on responsive mechanism of aquaporins to drought stress in plants[J]. Guihaia, 2018, 38(5):672-680.
[15] 包珠拉太, 高丽, 王锁民. 植物水通道蛋白及其生理功能[J]. 植物生理学报, 2017, 53 (7):1117-1178. doi:10.13592/j.cnki.ppj.2017.0076.
Bao Z L T, Gao L, Wang S M. Physiological functions of plant aquaporin[J]. Plant Physiology Journal, 2017, 53 (7):1171-1178.
[16] 何勇清, 方佳, 余敏芬, 方仲相, 江波, 潘寅辉, 郑炳松. 植物质膜内在水通道蛋白PIPs的分子生物学研究进展[J]. 浙江农林大学学报, 2012, 29(3):446-452.doi:10.3969/j.issn.2095-0756.2012.03.020.
He Y Q, Fang J, Yu M F, Fang Z X, Jiang B, Pan Y H, Zheng B S. Advances in molecular biology for plasma membrane intrinsic proteins (PIPs):a review[J]. Journal of Zhejiang Agriculture and Forestry University, 2012, 29(3):446-452.
[17] 李菲, 颜培玲, 张文娥, 潘学军. 野生毛葡萄水通道蛋白基因VhPIPs的克隆与组织特异性表达研究[J]. 园艺学报, 2016, 43(12):2304-2314. doi:10.16420/j.issn.0513-353x.2016-0265.
Li F, Yan P L, Zhang W E, Pan X J. Cloning and tissue specificity expression of the aquaporin genes from wild Vitis quinquangularis[J].Acta Horticulturae Sinica, 2016, 43(12):2304-2314.
[18] Ding L, Gao C M, Li Y R, Li Y, Zhu Y Y, Xu G H, Shen Q R, Kaldenhoff R, Kai L, Guo S W. The enhanced drought tolerance of rice plants under ammonium is related to aquaporin (AQP)[J]. Plant Science, 2015, 234:14-21. doi:10.1016/j.plantsci.2015.01.016.
[19] 周菲, 程晨晨, 王然, 杨英杰, 宋健坤. 杜梨干旱胁迫相关水通道蛋白基因的筛选与克隆[J]. 北方园艺, 2019,43(2):48-54. doi:10.11937/bfyy.20182123.
Zhou F, Cheng C C, Wang R, Yang Y J, Song J K. Screening and cloing of drought stress related aquaporin genes in Pyrus betulifolia Bunge[J]. Northern Horticultur, 2019,43(2):48-54.
[20] Xu Y, Hu W, Liu J H, Zhang J B, Jia C H, Miao H X, Xu B Y, Jin Z Q. A banana aquaporin gene, MaPIP1;1, is involved in tolerance to drought and salt stresses[J]. BMC Plant Biology, 2014, 14(1):59. doi:10.1186/1471-2229-14-59.
[21] 蔡琼, 丁贵杰, 文晓鹏. 马尾松水通道蛋白PmPIP1基因克隆及在干旱胁迫下的表达分析[J]. 浙江农林大学学报, 2016, 33(2):191-200. doi:10.11833/j.issn.2095-0756.2016.02.002.
Cai Q, Ding G J, Wen X P. Cloning of the PmPIP1 gene from Pinus massoniana and its expression with drought stress[J]. Journal of Zhejiang Agriculture and Forestry University, 2016, 33(2):191-200.
[22] Zhuang L L,Liu M X,Yuan X Y,Yang Z M, Huang B R. Physiological effects of aquaporin in regulating drought tolerance through overexpressing of Festuca arundinacea aquaporin gene FaPIP2;1[J]. Journal of the American Society for Horticultural Science, 2015, 140(5):404-412.doi:10.21273/JASHS.140.5.404.
[23] Li J T, Yu G, Sun X H, Liu Y Z, Liu J L, Zhang X H, Jia C G, Pan H Y. AcPIP2, a plasma membrane intrinsic protein from halophyte Atriplex canescens, enhances plant growth rate and abiotic stress tolerance when overexpressed in Arabidopsis thaliana[J]. Plant Cell Reports, 2015, 34(8):1401-1415. doi:10.1007/s00299-015-1796-7.
[24] 沙伟, 张梅娟, 刘博, 徐红红. 东亚砂藓bZIP转录因子RjbZIP基因的克隆及表达分析[J]. 华北农学报, 2015, 30(4):13-20. doi:10.7668/hbnxb.2015.04.003.
Sha W, Zhang M J, Liu B, Xu H H. Cloning and expression analysis of a bZIP transcription factor gene, RjbZIP, from Racomitrium japonicum[J]. Acta Agriculturae Boreali-Sinica, 2015, 30(4):13-20.
[25] 张萍, 白学良, 钟秀丽. 苔藓植物耐旱机制研究进展[J]. 植物学通报, 2005, 22(1):107-114.doi:10.3969/j.issn.1674-3466.2005.01.017.
Zhang P, Bai X L, Zhong X L. Advances in the desiccation tolerance of mosses[J]. Chinese Bulletin Botany, 2005, 22(1):107-114.
[26] 王彦梅, 张正斌, 柴团耀, 徐萍, 赵鸿彬.植物水通道蛋白研究进展[J].西北农林科技大学学报(自然科学报), 2005, 33(11):106-112. doi:10.3321/j.issn:1671-9387.2005.11.021.
Wang Y M, Zhang Z B, Chai T Y, Xu P, Zhao H B. Advances in the studies on plant aquaporins[J]. Journal of Northwest Science-Technology University of Agriculture and Foresty(Natural Science Edition), 2005, 33(11):106-112.