菘蓝(Isatis indigotica Fort.)是十字花科两年生草本植物,其干燥的根和叶为历版《中国药典》所收录,分别为“板蓝根”和“大青叶”,其化学成分主要包括靛玉红、靛蓝、表告依春、芥子油苷、腺苷、色胺酮、棕榈酸等[1-2],具有抗病毒、抗菌、抗癌和抗内毒素等作用[3-5]。
芥子油苷(Glucosinolate,GS),又称硫代葡萄糖苷,主要存在于白菜(Brassica pekinensis)、花椰菜(Brassica oleracea)、菘蓝(Isatis indigotica)等十字花科植物中,参与植物的防卫反应,具有抗癌作用,是一类重要的含氮、硫的植物次生代谢产物[6-8]。芥子油苷(以氨基酸为前体物)根据氨基酸种类的不同可以分为脂肪族(源于甲硫氨酸等)、吲哚族(源于色氨酸)和芳香族芥子油苷(源于苯丙氨酸等),目前已有200余种不同结构的芥子油苷被确认[9-10]。CYP79酶类在芥子油苷合成通路上发挥重要作用,且具有较强的专一性,CYP79B1、CYP79B2和CYP79B3能够催化色氨酸进入吲哚族芥子油苷合成途径[11-13];CYP79F1和CYP79F2能够催化甲硫氨酸(Methionine)、丙氨酸(Alanine)、缬氨酸(Valine)、亮氨酸(Leucine)和异亮氨酸(Isoleucine)并进入脂肪族芥子油苷合成途径[14];CYP79A2则能够催化丙氨酸或酪氨酸进入芳香族芥子油苷合成途径[15]。Banerjee等[16]用2 kGy γ射线处理白菜后发现MYB28和CYP79F1的表达量分别为对照组的3,2倍,脂肪族芥子油苷含量也表现出不同程度的升高;而影响芥子油苷积累的JA信号分子的含量却没有显著变化。Chen等[12]通过敲除拟南芥CYP79F1和CYP79F2获得相应突变体,发现在CYP79F1缺失突变体中,短链脂肪族芥子油苷含量几乎为零,长链脂肪族芥子油苷含量增加;而在CYP79F2缺失突变体中,长链脂肪族芥子油苷含量显著降低,长链脂肪族芥子油苷含量水平不受影响。
CYP79酶类在十字花科植物芥子油苷合成过程中具有重要作用,但其在菘蓝芥子油苷的合成过程中是否发挥相应功能目前还未有报道。本研究首次克隆了菘蓝IiCYP79B2基因,综合运用多种生物学软件对其序列特征进行分析,并对其表达模式进行了初步的探究,这些结果也为下一步其功能研究(特别是在芥子油苷生物合成过程的功能)奠定了基础。
1 材料和方法
1.1 试验材料
菘蓝种子为西北濒危药材资源开发国家工程实验室留存,种植于温室中。培养条件:温度(25±2)℃;光照(16 h/d);湿度(60%~80%)。
1.2 试验方法
1.2.1 菘蓝RNA和DNA的提取 取菘蓝嫩叶,置于液氮中速冻。按照植物RNA提取试剂盒说明提取总RNA,用反转录试剂盒获得cDNA第一链;按照植物DNA提取试剂盒说明提取genomic DNA(gDNA)。将菘蓝cDNA和gDNA置-20 ℃保存。
1.2.2 引物设计 根据本实验室的菘蓝转录组数据库信息,采用ORF finder在线软件查找菘蓝CYP79B2序列的ORF,并用Primer 5.0软件设计特异性酶切引物序列:F:5′-ATGAATACTTTTACCT CAAAC-3′,R:5′-TCACTTCACCGTCGGGTAAA-3′,引物合成和序列测定由公司完成。
1.2.3 基因克隆 分别以cDNA和gDNA为模板,进行PCR扩增,反应程序为:95 ℃预变性3 min;95 ℃变性30 s, 60 ℃退火30 s,72 ℃延伸2 min,第2~4步33次循环; 72 ℃终延伸10 min;4 ℃保存。回收纯化扩增产物片段,用平末端克隆试剂盒说明书方法对已经纯化的目的片段进行连接,而后用E.coli DH5α感受态细胞转化,将阳性克隆送至公司测序。
1.2.4 蛋白质序列分析 利用ExPASy预测蛋白的理化性质、跨膜结构域和功能结构域等序列基本特征信息;运用SOPMA和Swiss Model预测蛋白的二、三级结构特征信息;用Psort预测蛋白可能作用位置;NCBI搜索亲缘关系较近物种的蛋白序列并比对,MEGA 5.1构建系统进化树。
1.2.5 基因表达模式分析 分别选取种子萌发后10 d(萌芽期)、30 d(幼苗期)和90 d(营养生长期)龄以及花期植株进行取样,考察目的基因在菘蓝中不同发育时期的表达情况;选取花期植株的根、茎、叶、花和果进行取样,检测目的基因在不同组织器官中的表达情况;为检测不同胁迫条件对目的基因表达的影响,选取培养至60 d的植株分组分别喷施茉莉酸甲酯(MJ,500 μmol/L)、水杨酸(SA,300 μmol/L)和葡萄糖(Glu,9.0% m/V)溶液于整个叶面,并于0,1,3,6,12,24,48,72 h进行取材;低温样本为4 ℃处理相同时间后同法取材。各条件取材样本均于液氮速冻后置-80 ℃,备用。
按照1.2.1项的方法分别获得上述材料的cDNA,并设计目的基因的qRT-PCR引物:F:5′-TGGGCCG TAACCCGAAAGTTTGG-3′,R:5′-ATCGTGGTCAAC GCCGTACCTAGGG-3′。以IiActin(AY870652.1)为内参基因,其引序列物为:F3:5′-AGGAATCGCTGA CCGTATG-3′,R3:5′-TGGACCCGACTCATCGTATT-3′。qRT-PCR法分析目的基因的表达模式。扩增条件为: 95 ℃预变性30 s;95 ℃ 变性10 s,58 ℃退火10 s,72 ℃ 延伸10 s,45次循环;72 ℃终延伸10 min,4 ℃保存,每次循环第3步进行荧光信号采集,采用2-ΔΔCT法对数据进行分析。
2 结果与分析
2.1 IiCYP79B2基因的克隆
以菘蓝的cDNA和gDNA为模板进行PCR扩增,经电泳检测在1 500~2 000 bp分别获得1个片段(图1)。测序结果显示:基因组序列全长1 827 bp,只有1个内含子(剪切位点为GT-AG,图2)。去除后ORF全长1 629 bp,编码542个氨基酸,将其命名为IiCYP79B2,GenBank登录号为KY774688(图3)。
2.2 IiCYP79B2蛋白的分析
2.2.1 IiCYP79B2蛋白的理化性质分析 结果表明,IiCYP79B2蛋白的理论分子质量61.41 ku,分子结构式为C2748H4371N739O781S36,理论等电点(pI)8.80,偏碱性;不稳定系数33.29,相对稳定;总平均亲水性(GRAVY)-0.188,亲水性蛋白;存在2个跨膜结构,在氨基酸序列第20-42位和55-74位;预测亚细胞定位于叶绿体类囊体膜上(可信度:0.821),无信号肽结构;N-端氨基酸为蛋氨酸(Met);IiCYP79B2含有46个蛋白激酶磷酸化位点,包括22个Ser位点、22个Thr位点和2个Tyr位点,可能受蛋白磷酸激酶的调控。
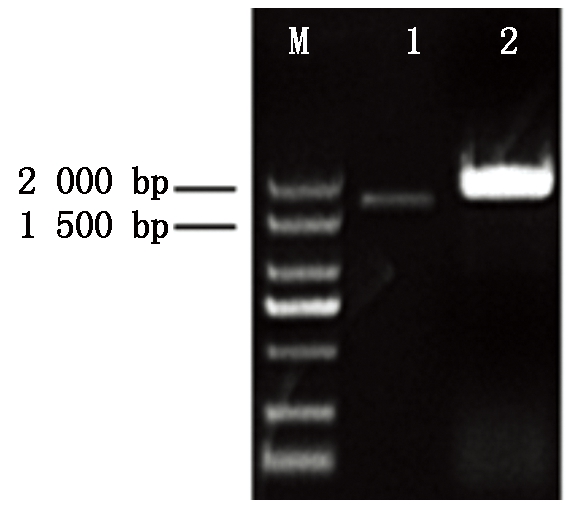
M.DNA分子质量标准(DL2000);1.cDNA;2.gDNA。
M.DL2000 Marker; 1.cDNA; 2.gDNA.
图1 IiCYP79B2基因的扩增结果
Fig.1 PCR amplification results of IiCYP79B2

图2 IiCYP79B2的内含子
Fig.2 The intron of IiCYP79B2

图3 IiCYP79B2核酸及推导氨基酸序列
Fig.3 Nucleotide and deduced amino acid sequences of IiCYP79B2
2.2.2 IiCYP79B2蛋白的结构预测 结果表明,IiCYP79B2蛋白在471-480位氨基酸之间有一高度保守的血红素结合域:FStGKRGCAA(图4),具有CYP450基因家族酶系的典型特征。IiCYP79B2蛋白的二级结构α-螺旋(Alphha helix)、无规则卷曲螺旋(Coiled coils)、延伸链(Extended strand)和β-转角(β-turn)分别占比44.28%,31.18%,17.34%和7.20%,以前两者为主。IiCYP79B2蛋白的三维结构模型与二级结构分析结果吻合(图5)。
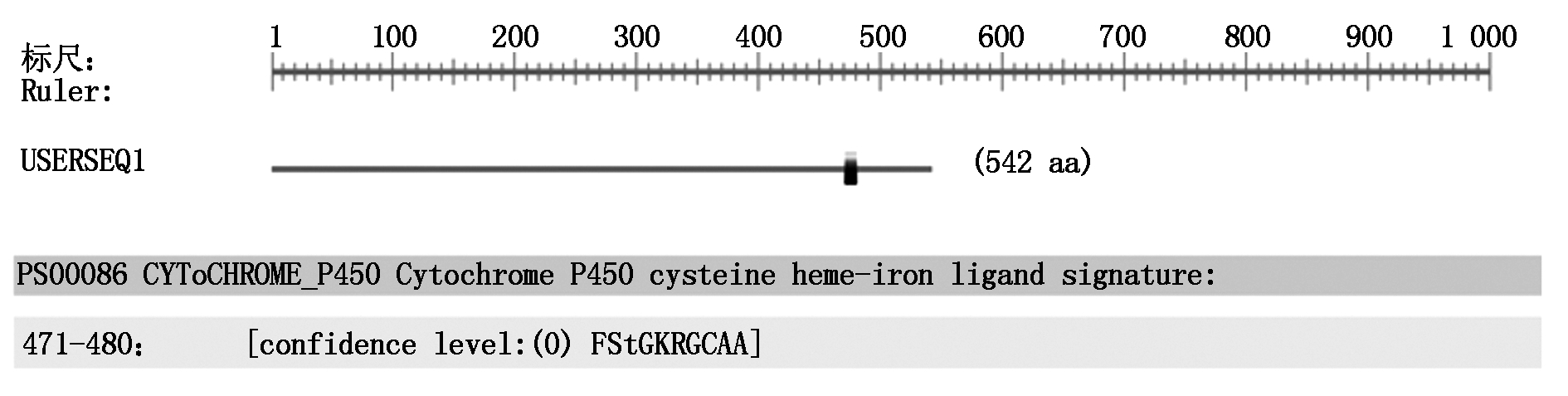
图4 IiCYP79B2的蛋白结构域
Fig.4 Functional domain of IiCYP79B2
图5 IiCYP79B2的三级结构
Fig.5 Three-dimensional structure model of IiCYP79B2
IiCYP79B2蛋白的同源性及系统进化分析 各植物CYP79B2同源序列比对结果表明:菘蓝IiCYP79B2与其他物种的CYP79B2序列相似,高度同源,都具有Heme-binding motif、PERF motif和K-helix 3种CYP450家族典型结构域或基序,如图6所示。菘蓝IiCYP79B2的氨基酸序列与芝麻菜(Eruca sativa, AGM16417.1)、深山南芥(Arabidopsis lyrata, EFH43155.1)和拟南芥(Arabidopsis thaliana, OAO99245.1)CYP79B2序列的相似性分别为96%,95%和95%;系统进化分析结果表明,菘蓝IiCYP79B2与白芥(Sinapis alba, O81345.1)的亲缘关系最近(图7)。

黑色方框.CYP450保守的基序、区域和结构域;黄色.相同的氨基酸;粉色和蓝色.同源的氨基酸残基。
Black box.CYP450s conserved motifs, regions and domains; The identical amino acid was highlighted in yellow box;
The indicate homologous amino acid residues were highlighted in pink and blue box.
图6 IiCYP79B2与其他植物同源氨基酸序列的比对
Fig.6 Alignment of amino acid sequences of IiCYP79B2 and those from other plants
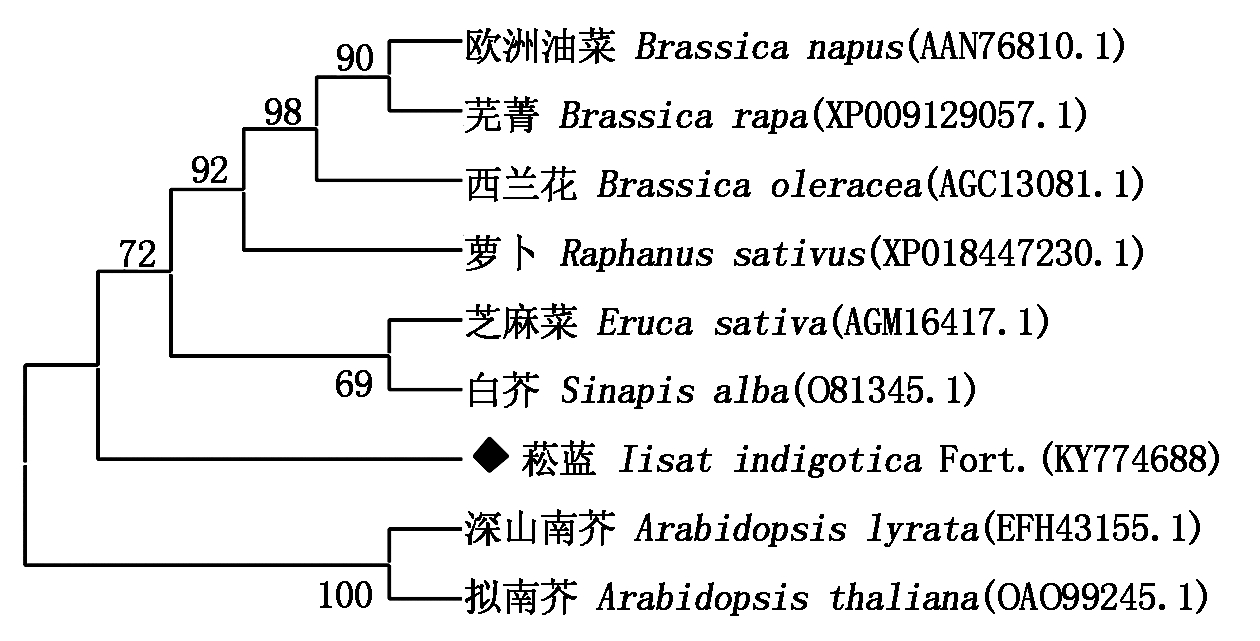
图7 IiCYP79B2系统进化树
Fig.7 Phylogenetic tree of IiCYP79B2
2.3 IiCYP79B2基因的表达模式分析
2.3.1 IiCYP79B2在不同发育时期和组织部位的表达特性 IiCYP79B2基因在菘蓝不同发育时期均有表达(图8-A),各发育时期表达量依次为生长期>花期>幼苗期>萌芽期,其中生长期表达量最高,为萌芽期的14.78倍;此外,该基因在菘蓝的根、茎、叶、花和果中均有表达(图8-B),在叶和茎中的表达量相对较高,其在叶中的表达量达到根中的25.21倍,推测该基因可能主要在菘蓝的叶和茎中发挥表达调控作用。
2.3.2 IiCYP79B2在不同诱导子处理条件下的表达特性 分别考察IiCYP79B2基因在MJ、Glu、SA和低温胁迫处理条件下的表达情况,结果如图8-C所示,IiCYP79B2的表达显著响应MJ和 Glu信号的诱导,分别在处理6,48 h后达到峰值,为对照的14.48,7.52倍。同时,IiCYP79B2的表达受到SA和低温的明显抑制,分别在低温处理1,48 h后下降至对照水平的4.80%和8.32%。此外,IiCYP79B2基因对SA和MJ信号的响应更为迅速和明显。持续的低温可能会对植株造成一定程度的损害,低温胁迫处理后,IiCYP79B2基因的表达水平始终低于对照的表达水平;而MJ、Glu和SA处理72 h后,IiCYP79B2基因的表达量则基本都能够恢复至与对照水平相当。
3 结论与讨论
芥子油苷参与十字花科植物与环境相互作用的过程,辅助植物适应各种复杂环境,抵御各种生物与非生物胁迫,是该科植物中十分重要的一类次生代谢产物[8]。在芥子油苷的生物合成过程中,CYP79和CYP83家族发挥了重要的生物学功能[12,17]。本研究首次克隆得到了菘蓝IiCYP79B2基因,其编码蛋白含有1个高度保守的血红素结合域:FStGKRGCAA,属于细胞色素P450家族;与芝麻菜(Eruca sativa, AGM16417.1)、深山拟南芥(Arabidopsis lyrata, EFH43155.1)和拟南芥(Arabidopsis thaliana, OAO99245.1)的氨基酸序列较为相似。IiCYP79B2在菘蓝各组织部位中均有表达,且在叶中表达量最高,表现出一定的组织特异性。与拟南芥的CYP79B2基因在根中表达最高[18],荠菜BjuCYP83A1基因在茎中表达量最高等研究结果存在不同[19]。此外,IiCYP79B2在萌芽期表达量较低,而后明显上升,并在生长期表达量达到最高,提示该基因的表达与菘蓝的生长发育过程存在一定的相关性,可能在菘蓝的生长期发挥重要的生物学功能。由此可见,IiCYP79B2基因具有时空特异性,在不同的发育时期和组织部位的表达水平存在不同。
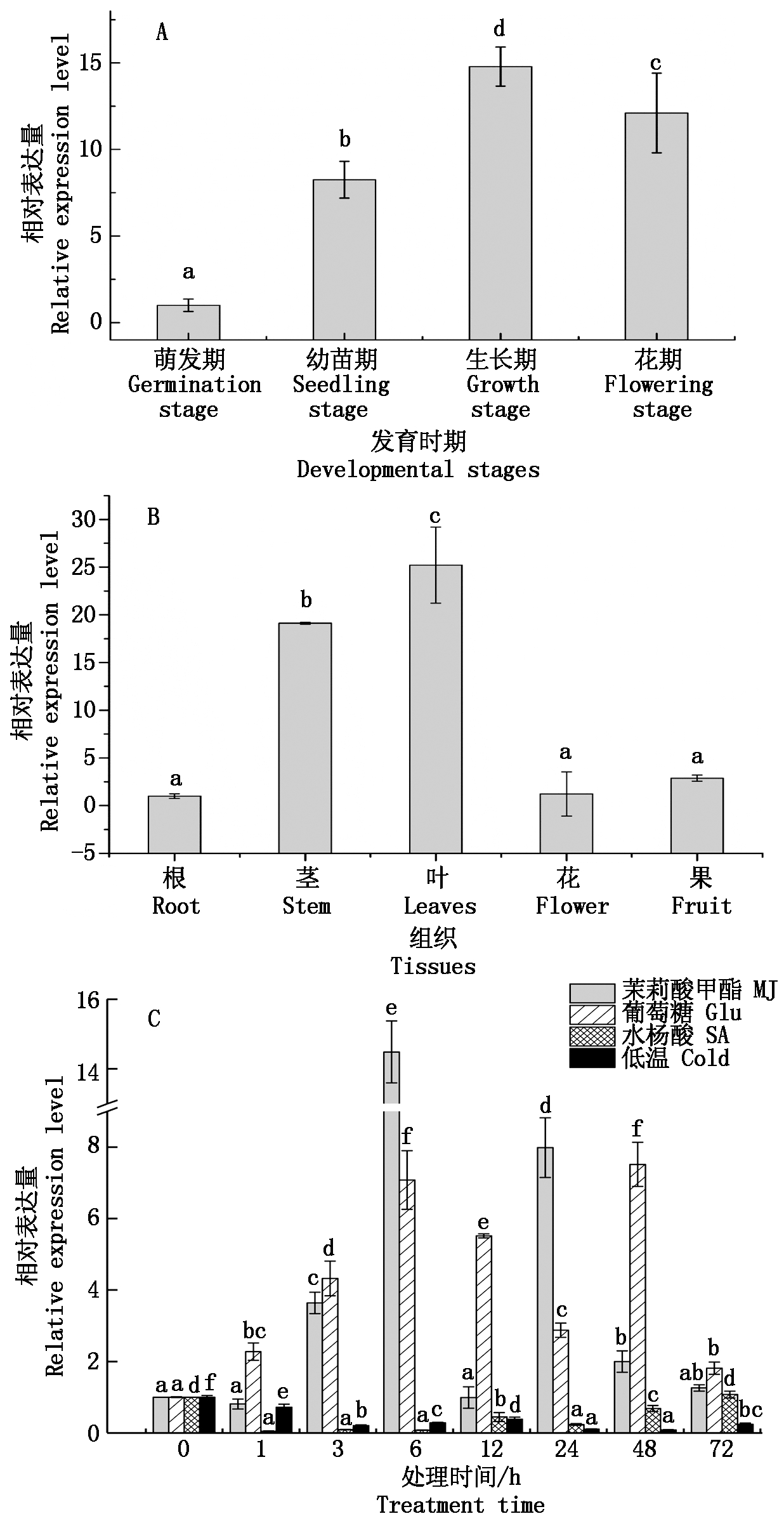
A.不同发育时期;B.不同组织部位;C.不同诱导子处理。不同小写字母代表相对表达量在0.05水平上差异显著。
A.Different developmental stages;B.Different tissues; C.Different elicitors treatments.Different lowercase letters indicate significant differences for the relative expression at 0.05 levels.
图8 IiCYP79B2基因表达模式的研究
Fig.8 Study on expression pattern of IiCYP79B2 gene
本研究还进一步探讨了IiCYP79B2基因受不同胁迫处理后表达模式的变化情况,研究结果显示,该基因的表达显著响应茉莉酸甲酯(MJ)和葡萄糖(Glu)信号的诱导,而受到水杨酸(SA)和低温(4 ℃)胁迫的抑制。Mikkelsen等[20]用MJ处理拟南芥叶片后发现CYP79B2和CYP79B3的表达量分别增高了1.5,3.5倍,吲哚族芥子油苷的含量提高到原来的3~4倍,其中N-甲氧基吲哚-3-甲基芥子油苷的积累量更是达到对照组的10倍之多;同时还发现MJ和SA在此过程中存在一定的拮抗作用。类似地,西兰花中萝卜硫素合成相关基因BoCYP83A1经MJ处理后表达量升高了1.9倍,而SA处理后表达量则下降至对照的10%[21]。在本研究中MJ和SA同样对菘蓝IiCYP79B2基因的表达具有极为显著的影响作用,且二者的作用也截然相反,这也与拟南芥中的研究结果较为一致[20],二者之间是否存在拮抗作用还有待进一步探讨。此外,本研究还发现低温处理能够明显降低IiCYP79B2的表达量,这也与杜海等[22]研究发现拟南芥在低温处理后芥子油苷合成相关基因CYP79B2、CYP79B3、CYP83B1的表达量显著降低的研究结果较为一致。由此可知,菘蓝IiCYP79B2基因的表达显著响应MJ、Glu信号的诱导,而受到SA和低温处理的抑制,相关研究结果与拟南芥、西兰花中相应基因的表达模式存在一定的相似之处,但也存在具体响应模式的不同。
综上,本研究首次克隆了菘蓝IiCYP79B2基因,运用各种在线软件进行了生物信息学分析,并对其表达模式进行了初步的探究。这些结果为进一步探究该基因的生物学功能,深入解析菘蓝中芥子油苷的合成和调控机理奠定了基础。
[1] 国家药典委员会. 中华人民共和国药典[M]. 2015版.一部.北京:中国医药科技出版社,2015.
State pharmacopoeia commission. Pharmacopoeia of the People′s Republic of China [M]. 2015 Edition. Part I. Beijing:China Pharmacopoeia Science and Technology Press, 2015.
[2] 刘倩倩, 王康才, 罗春红, 邹立思. 不同品种类型菘蓝根中表告依春累积规律研究[J]. 中药材, 2013, 36(2):199-201. doi:10.13863/j.issn1001-4454.2013.02.003.
Liu Q Q, Wang K C, Luo C H, Zou L S. Accumulation law of epigoitrin in roots of Isatis indigotica of different breed type [J]. Journal of Chinese Medicinal Materials, 2013,36(2):199-201.
[3] 周孟清, 张慧茹, 贾峰, 赵银丽, 黄进, 齐仁立, 罗宇. 黄芪和板蓝根多糖的抗菌抗病毒作用研究[J]. 饲料工业, 2014, 35(21):58-64.doi:10.13302/j.cnki.fi.2014.21.015.
Zhou M Q, Zhang H R, Jia F, Zhao Y L, Huang J, Qi R L, Luo Y. The effects of anti-bacterial and anti-viral and the impactions on immune system of astragalus polysaccharide and radix isatidis polysaccharide [J]. Feed Industry, 2014,35(21):58-64.
[4] 袁高峰, 陈思学, 汪俏梅. 芥子油苷及其代谢产物的生物学效应研究与应用[J]. 核农学报, 2009, 23(4):664-668, 716.
Yuan G F, Chen S X, Wang Q M. Biological functions and application of glucosinolates and their degradation products [J]. Acta Agriculturae Nucleatae Sinica, 2009,23(4):664-668, 716.
[5] 李友, 马莉, 沈芃, 龚慕辛. 板蓝根三氯甲烷提取部位抗内毒素作用的“谱效”关系研究[J]. 中国药学杂志, 2011, 46(10):741-744.
Li Y, Ma L, Shen P, Gong M X. Spectrum-effect relationships between HPLC fingerprints and anti-endotoxin activity of chloroform from Isatidis radix[J]. Chinese Pharmaceutical Journal, 2011,46(10):741-744.
[6] Halkier B A, Gershenzon J. Biology and biochemistry of glucosinolates [J].Annual Review of Plant Biology,2006,57(1):303-333.doi:10.1146/annurev.arplant.57.032905.105228.
[7] Hu K L, Zhu Z J, Zang Y X, Hussain S A. Accumulation of glucosinolates and nutrients in pakchoi (Brassica campestris L. ssp.chinensis var.communis) two cultivar plants exposed to sulfur deficiency[J]. Horticulture Environment and Biotechnology, 2011, 52(2):121-127. doi:10.1007/s13580-011-0097-5.
[8] 陈亚州, 阎秀峰. 芥子油苷在植物-生物环境关系中的作用[J]. 生态学报, 2007, 27(6):2584-2593. doi:10.3321/j.issn:1000-0933.2007.06.053.
Chen Y Z, Yan X F. The role of glucosinolates in plant biotic environment interaction [J]. Acta Ecologica Sinica, 2007,27(6):2584-2593.
[9] Hopkins R H,van Dam N M,van Loon J J A. Role of glucosinolates in Insect-plant relationships and multitrophic interactions[J].Annual Review of Entomology, 2009,54(1):57-83. doi:10.1146/annurev.ento.54.110807.090623.
[10] Clarke D B. Glucosinolates, structures and analysis in food[J]. Analytical Methods, 2010,2(4):310-325. doi:10.1039/b9ay00280d.
[11] 宋傲男, 程文财, 刘彩霞, 赵云, 王茂林. 甘蓝型油菜BnCYP79B1基因的克隆与表达[J]. 西北植物学报, 2013, 33(6):1085-1090. doi:10.3969/j.issn.1000-4025.2013.06.003.
Song A N, Cheng W C, Liu C X, Zhao Y, Wang M L. Molecular cloning and expression analysis of BnCYP79B1 gene from Brassica napus L.[J]. Acta Botanica Boreali-Occidentalia Sinica, 2013,33(6):1085-1090.
[12] Chen S X, Glawischnig E, Jørgensen K, Naur P, Jørgensen B, Olsen C E, Hansen C H, Rasmussen H, Pickett J A, Halkier B A. CYP79F1 and CYP79F2 have distinct functions in the biosynthesis of aliphatic glucosinolates in Arabidopsis[J]. Plant Journal, 2003,33(5):923-937. doi:10.1046/j.1365-313X.2003.01679.x.
[13] Mostafa I, Zhu N, Yoo M J, Balmant K M, Misra B B,Dufresne C, Abou-Hashem M, Chen S X, El-Domiaty M. New nodes and edges in the glucosinolate molecular network revealed by proteomics and metabolomics of Arabidopsis myb28/29 and cyp79B2/B3 glucosinolate mutants[J]. Journal of Proteomics,2016,138(1):1-19. doi:10.1016/j.jprot.2016.02.012.
[14] Mikkelsen M D, Petersen B L, Olsen C E, Halkier B A. Biosynthesis and metabolic engineering of glucosinolates [J]. Amino Acids, 2002, 22(3):279-295. doi:10.1007/s007260200014.
[15] Wittstock U, Halkier B A. Cytochrome P450 CYP79A2 from Arabidopsis thaliana L.catalyzes the conversion of L-phenylalanine to phenylacetaldoxime in the biosynthesis of benzylglucosinolate [J]. Journal of Biological Chemistry, 2000, 275(19):14659. doi:10.1074/jbc.275.19.14659.
[16] Banerjee A, Rai A N, Penna S A,Variyar P S. Aliphatic glucosinolate synthesis and gene expression changes in gamma-irradiated cabbage[J]. Food Chemistry,2016,209:99-103. doi:10.1016/j.foodchem.2016.04.022.
[17] Hemm M R, Ruegger M O, Chapple C. The Arabidopsis ref2 mutant is defective in the gene encoding CYP83A1 and shows both phenylpropanoid and glucosinolate phenotypes[J].The Plant Cell,2003,15(1):179-194. doi:10.1105/tpc.006544.
[18] Mikkelsen M D, Hansen C H, Wittstock U, Halkier B A. Cytochrome P450 CYP79B2 from Arabidopsis catalyzes the conversion of tryptophan to indole-3-acetaldoxime,a precursor of indole glucosinolates and indole-3-acetic acid[J]. Journal of Biological Chemistry, 2000, 275 (43):33712-33717. doi:10.1074/jbc.M001667200.
[19] Meenu, Augustine R, Majee M, Pradhan A K,Bisht N C. Erratum to:Genomic origin, expression differentiation and regulation of multiple genes encoding CYP83A1, a key enzyme for core glucosinolate biosynthesis, from the allotetraploid Brassica juncea [J].Planta,2015,241(3):667.doi:10.1007/s00425-014-2210-3.
[20] Mikkelsen M D, Peter B L, Glawischnig E, Jensen A B, Andreasson E, Halkier B A. Modulation of CYP79 genes and glucosinolate profiles in Arabidopsis by defense signaling pathways[J]. Plant Physiology,2003,131(1):298-308. doi:10.1104/pp.011015.
[21] 高灿红,董丽丽,关晓弯,赵良侠,林俊城,徐福乐,张水明.青花菜萝卜硫素合成相关基因BoCYP83A1的克隆与表达分析[J].西北植物学报,2016,36(7):1302-1307.doi:10.7606/j.issn.1000-4025.2016.07.1302.
Gao C H, Dong L L, Guan X W, Zhao L X, Lin J C, Xu F L, Zhang S M. Cloning and expression analysis of sulforaphane synthesis related gene BoCYP83A1 in Broccoli[J]. Acta Botanica Boreali-Occidentalia Sinica, 2016,36(7):1302-1307.
[22] 杜海, 冉凤, 刘静, 文婧, 马珊珊, 柯蕴倬, 孙丽萍, 李加纳. 拟南芥硫苷生物合成相关基因的组织和胁迫诱导表达谱的全基因组分析[J]. 中国农业科学, 2016,49(15):2879-2897. doi:10.3864/j.issn.0578-1752.2016.15.003.
Du H, Ran F, Liu J, Wen J, Ma S S, Ke Y Z, Sun L P, Li J N. Genome-wide expression analysis of glucosinolate biosynthetic genes in Arabidopsis across diverse tissues and stresses induction [J]. Scientia Agricultura Sinica, 2016,49(15):2879-2897.