油菜素内酯 (Brassinolide, BL) 被认为是第六大植物激素,是植物生长发育必不可少的生理活性物质。油菜素甾醇 (Brassinosteroids, BRs) 是植物中发现最早的甾醇类激素[1]。BRs对植物的生长发育具有多种生理功能,如促进细胞伸长与分裂、提高植物的抗逆性、调控果实发育等[2-3]。BRs与生长素、赤霉素及乙烯等多种激素都具有协同作用[4],共同调控植物体的生理活动。油菜素内酯的合成途径中,鲨烯 (Squalenne-2,3-oxide) 是合成的起始底物。鲨烯经还原反应后生成菜油甾醇 (Campesterol,CR),之后菜油甾醇又经过早期的C-22 氧化途径和2条菜油甾醇依赖途径 (早期C-6 氧化途径和后期C-6 氧化途径)等一系列酶联反应最终合成BRs[5-6]。
DWF基因家族与BRs的生理活动密切相关,很多成员都参与了BRs的合成途径[7-8],如DWF3 (即CPD) 编码一个C-3脱氢酶,参与早期22-羟化菜油甾醇到22-羟基-4-烯-3-酮等过程[9];DWF4 编码C-22羟化酶催化BRs合成途径中多重的C-22 羟基化途径,维持着BRs内环境稳定[10];DWF6 (即DET2) 编码1个类固醇-5α-还原酶,催化菜油甾醇转化为菜油甾烷醇[11]。DWF家族成员基因发生突变时,大多会导致植株矮小、育性降低等表型[12-14]。
拟南芥DWF1是DWF基因家族成员,它编码C-24还原酶,在油菜素内酯生物合成中的早期步骤,将24-亚甲基胆固醇转化为菜油甾醇,是油菜素内酯合成的重要限速步骤[15]。此外,DWF1基因也受到BRs转录因子BES1的反馈调控,进而影响内源BRs的合成[16]。因此,研究DWF1基因功能有助于系统了解BRs的合成调控机理以及相应功能。拟南芥中,dwf1突变体的植株矮小,生长速度非常缓慢,根系繁多且细,叶片数量也较少,总木质素和纤维素均比野生型有一定的减少[17]。在玉米中,DWF1基因表达量下调同样会导致植株矮小的表型,维管束分化出现异常,DWF1的功能缺失会导致突变体内下游BRs代谢的减少[18-19]。
甜瓜 (Cucumis melo L.) 是重要的经济园艺植物,在全世界各地广泛种植[20-21]。外源施加油菜素内酯可以减缓高温对甜瓜光合作用的抑制,提高甜瓜幼苗的耐热性,并且对甜瓜的坐果率以及果实形状等都有一定的影响,目前油菜素内酯已作为植物生长调节剂应用于甜瓜的生产上[22-23],但甜瓜中BRs及其相关基因作用的具体分子机理还并不清楚。本研究以甜瓜品种河套蜜瓜为研究材料,分析鉴定甜瓜CmDWF1基因并分析其表达特性,为解释CmDWF1基因的生理功能提供理论基础。
1 材料和方法
1.1 试验材料
材料为甜瓜品种河套蜜瓜,原种由内蒙古大学内蒙古自治区牧草与特色作物生物技术重点实验室保存。克隆载体pEASY®-T1和大肠杆菌 (E.coli)Trans1-T1感受态细胞购自北京全氏金生物技术有限公司。
PrimeSTAR®GXL DNA Polymerase、dNTP Mixture、DNA Marker、rTap DNA聚合酶、反转录试剂盒Prime ScriptTMⅡ 1st Strand cDNA Synthesis Kit购自TaKaRa公司;SanPrep柱式PCR产物纯化试剂盒购自上海生工生物工程有限公司。
1.2 试验方法
1.2.1 引物设计与合成 以拟南芥的DWF1(基因序列号为:AT3G19820) 基因序列为探针对甜瓜全基因组数据库MELONOMICS (http://melonomics.net/) 进行本地BlastN搜索获得CmDWF1序列 (ID:MELO3C022613)。使用Primer Premier 5.0设计目的基因的特异性引物。上游引物序列P1:5′-TT TCCCGGGATGGACCTTGAGGCCTC-3′(SmaⅠ),下游引物序列P2:5′-GGTACCTTACTCACTTGCCTGCT CTAC-3′(KpnⅠ)。引物由华大基因有限公司合成。
1.2.2 基因克隆 CmDWF1基因克隆以甜瓜果实cDNA为模板,PCR程序为:98 ℃ 预变性5 min;98 ℃ 变性30 s,57 ℃ 退火90 s,68 ℃ 延伸60 s,共30个循环;68 ℃终延伸10 min。产物经1.0% 琼脂糖凝胶电泳检测后,进行切胶回收,连接pMD19-T载体。融合载体转化DH5α感受态细胞。PCR鉴定后,挑选阳性菌落送至上海生工生物工程股份有限公司进行测序。
1.2.3 生物信息学分析 使用DNAMAN软件对CmDWF1基因序列和测序结果进行比对分析,并用ORF finder在线工具分析序列的开放阅读框 (ORF)。使用EXPASY的ProtParam分析CmDWF1蛋白的理化性质;通过ProtScale在线软件分析CmDWF1蛋白的亲疏水性氨基酸;通过在线网站CDD 分析Cm-DWF1的保守域;使用SignalP 4.1 Server 软件预测Cm-DWF1蛋白质的信号肽。使用WOLF PSORT软件预测CmDWF1蛋白的亚细胞定位。通过在线软件Pole Bioinformatique Lyonnais Network Protein Sequence Analysis预测CmDWF1蛋白的二级结构。通过SWISS MODEL软件预测CmDWF1蛋白的三级结构。采用MEGA 软件分析CmDWF1与其他物种DWF1之间的进化关系。
1.2.4 基因表达特性分析 取甜瓜河套蜜瓜的真叶、茎、根、生长期和呼吸跃变期果实分别提取RNA。以甜瓜甘油醛-3-磷酸脱氢酶 (GAPDH) 基因为内参基因,使用DNAMAN软件设计合成定量PCR特异引物。PCR反应体系:95 ℃ 预变性30 s;95 ℃ 5 s, 60 ℃ 延伸30 s,共40个循环,3个技术重复。使用2-ΔΔCT法分析数据,基因表达量设为1,设置3个独立生物学重复计算标准误差 (SE)。
2 结果与分析
2.1 CmDWF1基因克隆和序列分析
提取甜瓜河套蜜瓜果实总RNA,反转录合成cDNA并以此为模板进行RT-PCR。扩增得到的CmDWF1基因的特异性产物长度约1 700 bp (图1)。测序结果显示,该片段与甜瓜全基因组数据库MELONOMICS(http://melonomics.net/)中MELO3C022613序列相似度为100%。序列分析表明,甜瓜DWF1基因cDNA序列全长2 282 bp,开放阅读框 (ORF) 为1 701 bp,起始于393 bp处,终止于2 093 bp处,共编码566个氨基酸 (图2)。
2.2 CmDWF1蛋白理化性质和结构分析
使用Protparam分析CmDWF1编码的氨基酸序列,结果显示CmDWF1蛋白分子式是C3014H4613N787O838S26,其中Glu含量最高 (8.5%),Cys含量最低 (0.9%)。 CmDWF1蛋白的相对分子量为66.115 11 ku,理论等电点为6.96,不稳定指数为48.18,脂肪系数为80.94;总平均亲水性为-0.402,属于亲水性蛋白。通过ProtScale在线软件分析,CmDWF1蛋白的亲疏水性氨基酸均匀分布。
对CmDWF1蛋白的保守结构域进行预测,发现在108-198位氨基酸之间含有FAD-binding-4结构域(图3),该位点是FAD结合位点,推测CmDWF1蛋白可能具有FAD氧化还原酶特性。
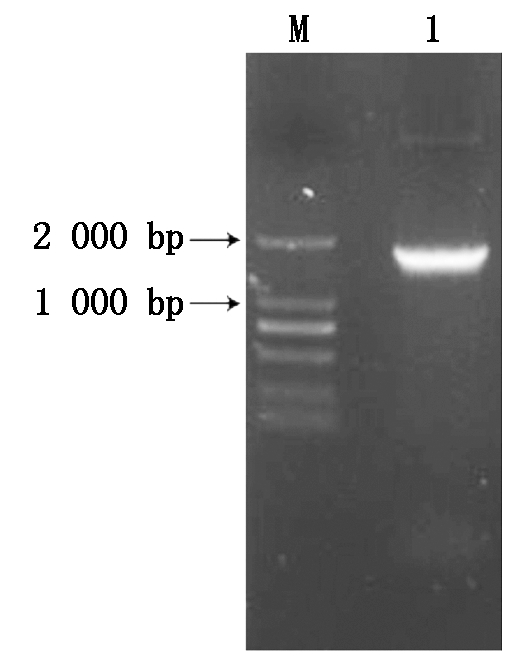
M.DL2000 DNA 分子量标记; 1.CmDWF1基因的cDNA扩增产物。
M.DL2000 DNA Marker;1. Amplification product of CmDWF1 gene.
图1 CmDWF1基因扩增的PCR产物
Fig.1 PCR product of CmDWF1 gene amplification


图2 CmDWF1基因的全长序列及本其编码的氨基酸序列
Fig.2 Full-length cDNA of CmDWF1 gene and amino acid sequences translated
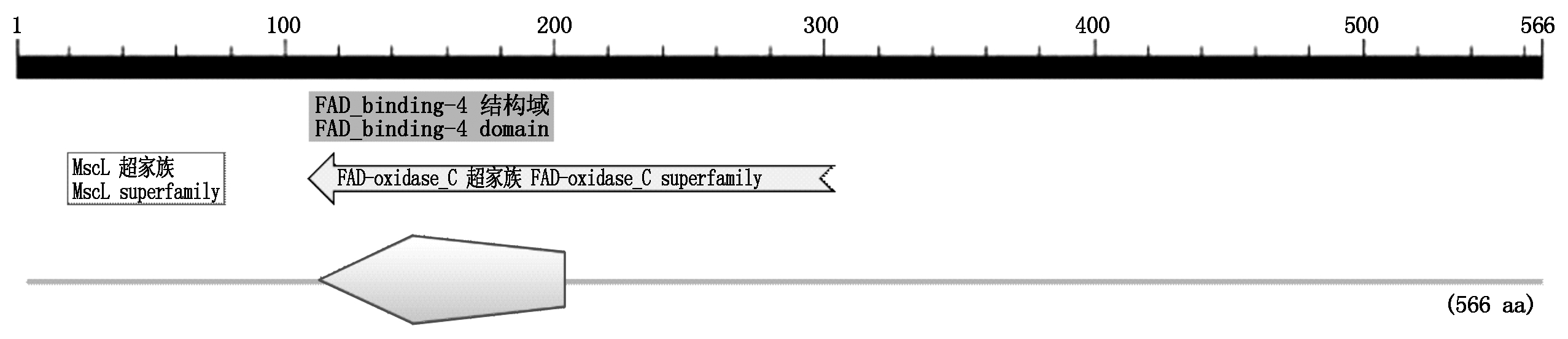
图3 CmDWF1蛋白的保守结构域预测
Fig.3 Predicted conserved domain of CmDWF1 protein
SignalP 4.1 Server在线软件分析显示CmDWF1蛋白无信号肽(图4)。进一步使用WOLF PSORT软件对CmDWF1蛋白的亚细胞定位情况进行预测,该蛋白的细胞质定位系数为9 (cyto:9.0),内质网定位系数为2 (E.R.:2.0),核定位系数为1 (nucl:1.0),质膜定位系数为1 (plas:1.0)。根据结果推测CmDWF1蛋白可能定位于细胞质,这一结果与信号肽预测结果相吻合。
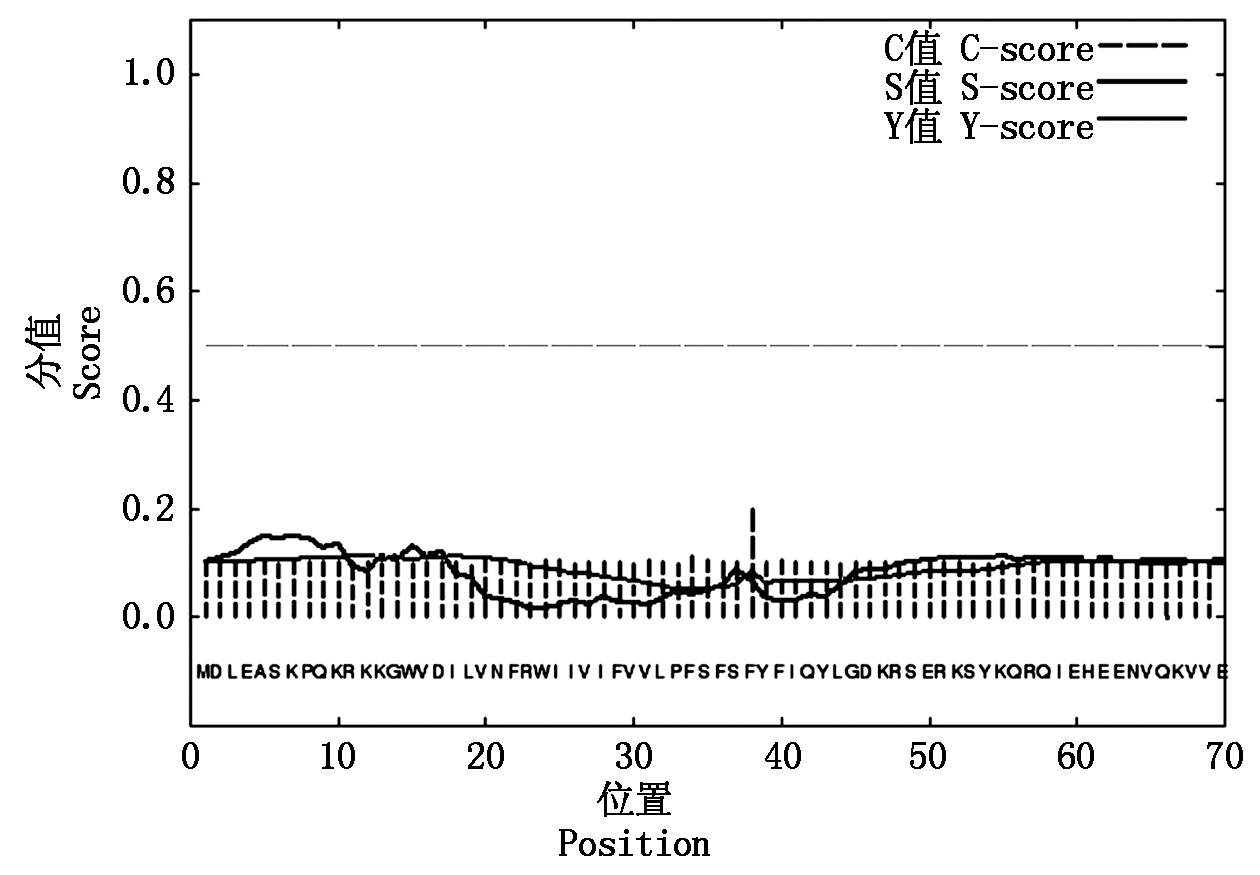
图4 CmDWF1蛋白信号肽预测
Fig.4 Predicted signal peptide of CmDWF1 protein
使用Pole Bioinformatique Lyonnais Network Protein Sequence Analysis软件预测CmDWF1蛋白的二级结构,该蛋白二级结构中α-螺旋 (Hh) 占37.81%,延伸蛋白占 (Ee) 24.20%,β转角 (Tt) 占8.48%,无规则卷曲(Cc)占29.51%。SWISS MODEL软件预测CmDWF1蛋白的三级结构见图5。
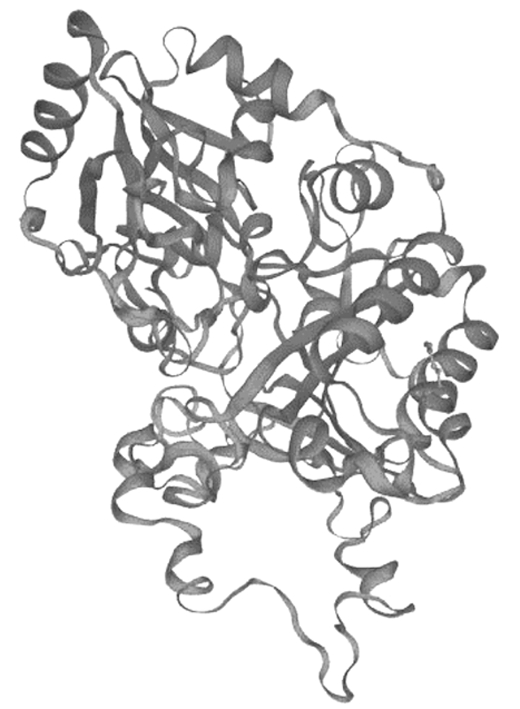
图5 CmDWF1蛋白的三级结构
Fig.5 Tertiary structure prediction of CmDWF1 protein
使用MEGA 5.1软件将甜瓜 (Cucumis melo) 与黄瓜 (Cucumis sativus)、南瓜 (Cucurbita moschata)、胡杨 (Populus euphratica)、荷花 (Nelumbo nucifera)、黄胡萝卜 (Daucus carota subsp. sativus)、巨桉 (Eucalyptus grandis)、赤豆 (Vigna angularis)、芝麻 (Sesamum indicum)、花生 (Arachis ipaensis)、梅花 (Prunus mume)、苹果 (Malus domestica)、葡萄 (Vitisvinifera)、番茄 (Lycopersicon esculentum Mill.)、柑橘(Citrus reticulata Blanco)等物种的DWF1氨基酸序列进行比对并构建系统进化树 (图6),结果显示,甜瓜与黄瓜、南瓜亲缘关系较近,与黄胡萝卜、花生以及葡萄等亲缘关系较远。

图6 CmDWF1与不同物种DWF1蛋白的系统进化树
Fig.6 Phylogenetic tree of CmDWF1 and DWF1 protein in different species
2.3 CmDWF1基因的表达特性分析
为了了解CmDWF1基因在甜瓜中的表达特性,使用实时定量PCR检测甜瓜幼苗的根、茎、叶以及不同发育时期的果实中该基因的表达情况。由图7所示,CmDWF1基因在根、茎、叶中均有一定的表达,但在根中的表达量最高。此外,CmDWF1基因在不同时期的果实中的表达量有明显的变化:前期表达量升高,在检测的样品中授粉后25 d时表达量最高,但在35~45 d内表现为下降趋势。表达特性分析说明,DWF1基因对甜瓜根和果实等组织器官的生长发育可能都具有一定的作用,尤其该基因在果实发育过程中表达量的显著升高,进一步说明DWF1基因对甜瓜果实的发育可能具有重要调控功能。
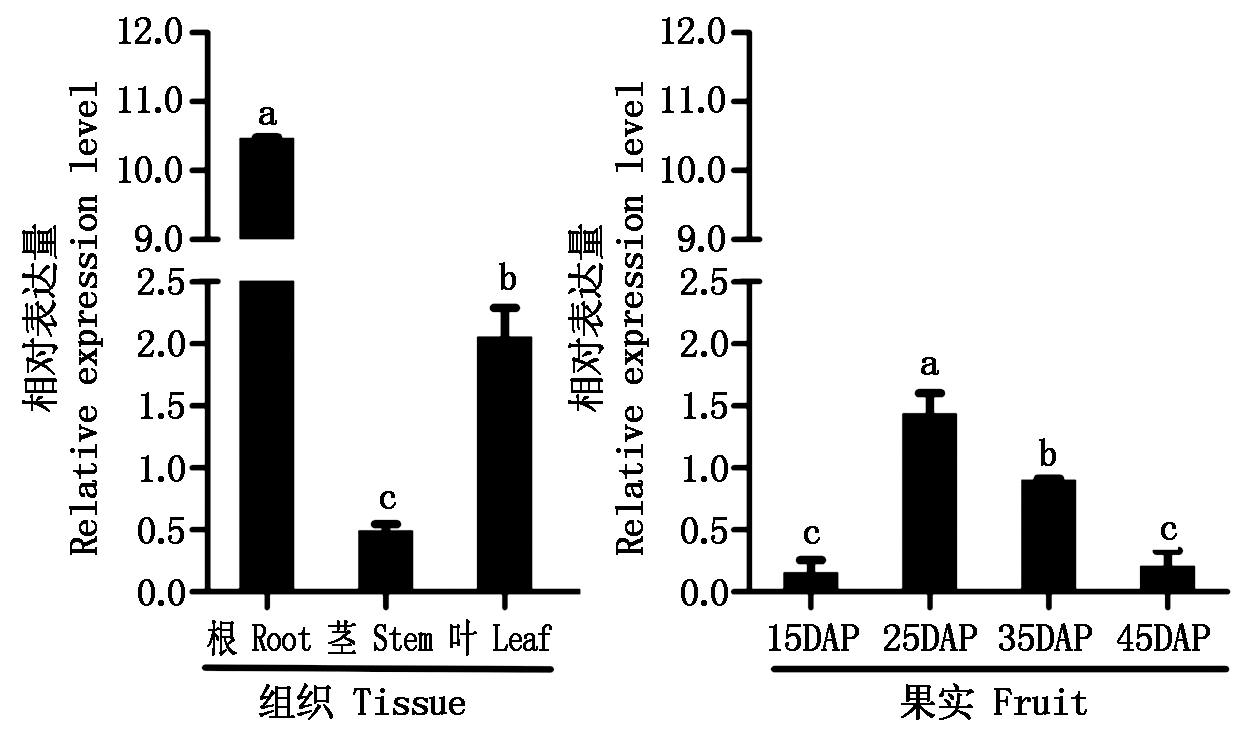
DAP.授粉后天数。不同字母标识的值之间根据邓肯多重范围检验具有显著性差异 (P<0.05)。
DAP. Days after pollination. Means marked with the different letters indicate significant difference according to Duncan′s multiple range test (P<0.05).
图7 CmDWF1基因在甜瓜不同组织和不同时期的表达特性分析
Fig.7 Relative expression analysis of CmDWF1 gene in different tissue and different period
3 结论与讨论
本研究从甜瓜河套蜜瓜品种中首次克隆得到DWF1基因,cDNA序列全长2 282 bp,与甜瓜基因库中的预测序列 (MELO3C022613) 完全一致。通过生物信息学预测:CmDWF1基因编码蛋白为亲水性蛋白,具有FAD氧化还原酶特性,并且定位于细胞质中。在已报道的拟南芥、玉米以及豌豆等物种中,DWF1主要都是作为BRs合成过程中的关键还原酶发挥功能,本研究预测的甜瓜DWF1的蛋白性质与已报道的其他物种中的DWF1蛋白性质相吻合,因此推测CmDWF1在甜瓜中也具有相似的功能,其与甜瓜内源BRs的合成相关。
BRs可以促进植物细胞的伸长和分裂,尤其对植物根和叶等组织的生长有很重要的正调控作用。在拟南芥中,DWF1及其等位基因发生突变都会产生根和叶发育异常,植株矮小等典型的BRs缺失突变体相关表型[24]。因此,DWF1作为BRs合成的还原酶,对植物根、叶等组织的营养生长具有促进作用。甜瓜中,CmDWF1基因在根、茎以及叶中均有一定量的表达,尤其在根中表达量极高,推测CmDWF1基因可能通过BRs激素来参与甜瓜的根系生长。
此外,BRs同样也参与肉果类果实发育成熟的过程。Lisso等[25]发现BRs处理可以促进葡萄成熟,而用BRs合成抑制剂BRZ (Brassinazole) 处理后可以延迟果实成熟过程。番茄的BRs缺失突变体 (dx-fruits) 果实的成熟过程推迟,干质量下降,产量减少,氨基酸含量上调,碳水化合物含量明显下降,酸转化酶活性降低[26]。而CmDWF1基因在甜瓜授粉后25 d内表达量显著升高,在45 d时表达量下降到初始水平。这一结果预示着CmDWF1基因可能调控甜瓜果实发育过程中内源BRs的水平,并最终影响甜瓜果实发育的生理活动。
[1] 储昭庆,李李,宋丽,薛红卫.油菜素内酯生物合成与功能的研究进展[J].植物学通报, 2006, 23(5):543-555.doi:10.3969/j.issn.1674-3466.2006.05.010.
Chu Z Q, Li L, Song L, Xue H W. Advances on brassinosteroid biosynthesis and functions [J]. Chinese Bulletin of Botany, 2006, 23(5):543-555.
[2] Chen J N, Nolan T M, Ye H X, Zhang M C, Tong H N, Xin P Y,Chu J F, Chu C C, Li Z H, Yin Y H.Arabidopsis WRKY46, WRKY54 and WRKY70 transcription factors are involved in brassinosteroid-regulated plant growth and drought response [J]. The Plant Cell, 2017, 29(6):1425.doi:10.1105/tpc.17.00364.
[3] Lü B S, Tian H Y, Zhang F, Liu J J, Lu S C, Bai M Y, Li C Y, Ding Z J. Brassinosteroids regulate root growth by controlling reactive oxygen species homeostasis and dual effect on ethylene synthesis in Arabidopsis [J]. Plos Genetics, 2018, 14(1):e1007144.doi:10.1371/journal.pgen.1007144.
[4] Foo E, Mcadam E L, Weller J L, Reid J B. Interactions between ethylene, gibberellins, and brassinosteroids in the development of rhizobial and mycorrhizal symbioses of pea[J]. Journal of Experimental Botany, 2016, 67(8):2413-2424.doi:10.1093/jxb/erw047.
[5] Joo S H, Kim T W, Son S H, Lee W S, Yokota T, Kim S K. Biosynthesis of a cholesterol-derived brassinosteroid, 28-norcastasterone, in Arabidopsis thaliana[J]. Journal of Experimental Botany, 2011, 63(5):1823-1833. doi:10.1093/jxb/err354.
[6] 李辉,左钦月,涂升斌.油菜素内酯生物合成和代谢研究进展[J].植物生理学报, 2015, 51 (11):1787-1798.doi:10.13592/j.cnki.ppj.2015.0377.
Li H, Zuo Q Y, Tu S B. Advances in brassinosteroid biosynthesis and metabolism [J]. Plant Physiology Journal, 2015, 51 (11):1787-1798.
[7] Wang Z Y, Bai M Y, Oh E, Zhu J Y. Brassinosteroid signaling network and regulation of photomorphogenesis [J]. Annual Review of Genetics, 2012, 46(1):701-724.doi:10.1146/annurev-genet-102209-163450.
[8] Zhu J Y,Sae-Seaw J,Wang Z Y.Brassinosteroid signalling[J].Development,2013,140(8):1615-1620.doi:10.1242/dev.060590.
[9] Ohnishi T, Szatmari A M, Watanabe B,Fujita S, Bancos S, Koncz C, Lafos M, Shibata K, Yokota T, Sakata K, Szekeres M, Mizutani M. C-23 hydroxylation by Arabidopsis CYP90C1 and CYP90D1 reveals a novel shortcut in brassinosteroid biosynthesis [J].The Plant Cell, 2006, 18(11):3275-3288.doi:10.1105/tpc.106.045443.
[10] Yoshimitsu Y, Tanaka K, Fukuda W, Asami T, Yoshida S, Hayashi K, Kamiya Y, Jikumaru Y, Shigeta T, Nakamura Y, Matsuo T, Okamoto S. Transcription of DWARF4 plays a crucial role in auxin-regulated root elongation in addition to brassinosteroid homeostasis in Arabidopsis thaliana [J]. PLoS One, 2011, 6(8):e23851.doi:10.1371/journal.pone.0023851.
[11] 王凤茹, 王志勇. 油菜素内酯信号转导的研究进展[J]. 华北农学报, 2008, 23(S2):29-39.doi:10.7668/hbnxb.2008.S2.007.
Wang F R, Wang Z Y. The research of brassinosteroids signal transduction [J].Acta Agriculturae Boreali-Sinica, 2008, 23(S2):29-39.
[12] Ohnishi T, Godza B, Watanabe B, Fujioka S, Hategan L, Ide K, Shibata K, Yokota T, Szekeres M, Mizutani M. CYP90A1/CPD, a brassinosteroid biosynthetic cytochrome P450 of Arabidopsis, catalyzes C-3 oxidation [J]. Journal of Biological Chemistry, 2012, 287(37):31551-31560.doi:10.1074/jbc.m112.392720.
[13] Choe S W, Dilkes B P, Fujioka S, Takatsuto S, Sakurai A, Feldmann K A. The DWF4 gene of Arabidopsis encodes a cytochrome P450 that mediates multiple 22a-hydroxylation steps in brassinosteroid biosynthesis[J]. The Plant Cell, 1998, 10(2):231-243.doi:10.2307/3870701.
[14] Kwon M, Choe S. Brassinosteroid biosynthesis and dwarf mutants [J]. Journal of Plant Biology, 2005, 48(1):1.doi:10.1007/bf03030559.
[15] Choe S W, Dilkes B P, Gregory B D, Ross A S, Yuan H, Noguchi T, Fujioka S, Takatsuto S, Tanaka A, Yoshida S, Tax F E, Feldmann K A. The Arabidopsisdwarf1 mutant is defective in the conversion of 24-methylenecholesterol to campesterol in brassinosteroid biosynthesis [J]. Plant Physiology, 1999, 119(3):897-907.doi:10.1104/pp.119.3.897.
[16] Youn J H, Kim T W, Joo S H, Son S H, Roh J, Kim S, Kim T W, Kim S K. Function and molecular regulation of DWARF1 as a C-24 reductase in brassinosteroid biosynthesis in Arabidopsis thaliana[J]. Journal of Experimental Botany, 2018, 69(8):1873-1886.doi:10.1093/jxb/ery038.
[17] Hossain Z, Mcgarvey B, Amyot L, Gruber M, Jung J, Hannoufa A. DIMINUTO 1 affects the lignin profile and secondary cell wall formation in Arabidopsis [J]. Planta, 2012, 235(3):485-498.doi:10.1007/s00425-011-1519-4.
[18] Tao Y Z, Zheng J, Xu Z M, Zhang X H, Zhang K, Wang G Y. Functional analysis of ZmDWF1, a maize homolog of the Arabidopsis brassinosteroids biosynthetic DWF1/DIM gene [J]. Plant Science, 2004, 167(4):743-751.doi:10.1016/j.plantsci.2004.05.012.
[19] Best N B, Hartwig T, Budka J, Fujioka S, Johal G, Schulz B, Dilkes B P. nana plant2 encodes a maize ortholog of the Arabidopsis brassinosteroid biosynthesis gene DWARF1, identifying developmental interactions between brassinosteroids and gibberellins [J]. Plant Physiology, 2016, 171(4):2633-2647.doi:10.1104/pp.16.00399.
[20] Ezura H, Owino W O. Melon, an alternative model plant for elucidating fruit ripening [J]. Plant Science, 2008, 175(1-2):121-129.doi:10.1016/j.plantsci.2008.02.004.
[21] 王永行, 白立华,杜瑞霞,郭宏强,杨钦方,王鹏,徐广祥. 甜瓜主要产量性状的回归与通径分析[J]. 北方农业学报, 2016, 44(3):37-39. doi:10.3969/j.issn.1007-0907.2016.03.010.
Wang Y X, Bai L H, Du R X, Guo H Q, Yang Q F, Wang P, Xu G X. Analysis of regression and path of main yield traits of melon [J]. Journal of Northern Agriculture, 2016, 44(3):37-39.
[22] Zhang Y P, Zhu X H, Ding H D, Yang S J, Chen Y Y. Foliar application of 24-epibrassinolide alleviates high-temperature-induced inhibition of photosynthesis in seedlings of two melon cultivars[J]. Photosynthetica, 2013, 51(3):341-349. doi:10.1007/s11099-013-0031-4.
[23] 何子顺, 李劲松, 张衍云. 植物生长调节剂在甜瓜生产上的应用技术[J]. 云南农业科技, 2009(2):37-38.doi:10.3969/j.issn.1000-0488.2009.02.018.
He Z S, Li J S, Zhang Y Y. Application of plant growth regulators in melon production [J]. Yunnan Agricultural science and Technology, 2009(2):37-38.
[24] Klahre U, Noguchi T, Fujioka S, Takatsuto S, Yokota T, Nomura T, Yoshida S, Chua N H. The ArabidopsisDIMINUTO/DWARF1 gene encodes a protein involved in steroid synthesis [J]. The Plant Cell, 1998, 10(10):1677-1690.doi:10.2307/3870765.
[25] Lisso J, Altmann T, Müssig C. Metabolic changes in fruits of the tomato dx mutant [J]. Phytochemistry, 2006, 67(20):2232-2238.doi:10.1016/j.phytochem.2006.07.008.
[26] 高原. 番茄果实发育的激素调节 [J]. 吉林蔬菜, 2009(4):77-80.doi:10.3969/j.issn.1672-0180.2009.04.051.
Gao Y. Hormone regulation of tomato fruit development [J]. Jilin Vegetable, 2009(4):77-80.