小麦(Triticum aestivum L.)是人类主要粮食作物之一,种植面积在谷物中占首位[1]。随着全球水资源的短缺和气候的变化,小麦的生长环境面临着巨大的挑战[2],所以提高小麦的耐旱耐盐性,对维持其可持续供应有重大意义。因此,了解小麦的抗逆分子机制并应用于实践生产对于提高小麦的产量有重要的指导意义。水通道蛋白(Aquaporins, AQPs)又叫水孔蛋白,以转运水分子而得名,是一种位于细胞膜上的内在膜蛋白,通过对气体、水、小分子溶质和重金属的转运来提高植物的抗逆性[3]。小麦水通道蛋白的克隆及表达分析将会为小麦抗逆性研究提供理论基础。
水通道蛋白分布十分广泛,几乎存在于动植物各个组织器官以及生长发育的各个时期[4],介导水分的运输并维持水分平衡[5],参与细胞的渗透调节、生长分化及籽粒和根部的水分运输等生理过程[6-8]。
根据水通道蛋白的序列同源性和结构特征可以将其分为5个家族,即存在于质膜上的质膜内在蛋白(Plasma membrane intrinsic proteins, PIPs)、存在于共生根瘤菌体膜上的类似根瘤素26膜内在蛋白(Nodulin 26-like intrinsic proteins,NIPs)、位于液胞膜上的液胞膜内在蛋白(Tonoplast intrinsic proteins, TIPs)、 小分子碱性膜内在蛋白(Small and basic intrinsic proteins, SIPs)以及未鉴定的膜内在蛋白(Unclassified X intrinsic proteins, XIPs)[9]。而TIP1.1基因较高水平的转录能够促进小麦的线性蒸腾,利于水分和养分的吸收、运输[10]。
自从1992年分离出第一个水通道蛋白开始[11],已经在马铃薯[12]、水稻[13]、小麦[14]等多种植物中克隆并研究了AQPs的功能。液泡膜内在水通道蛋白(TIPs)具有高效的透水性,透水效率达到质膜水通道蛋白的100倍以上,能够控制细胞的膨胀或紧缩,维持细胞内的稳态环境[15],对植物非生物胁迫有着很高的耐受性。在拟南芥中过表达PIP1基因增强了其耐旱和耐盐性[16]。
目前TaAQP7、TaNIP4-1和TaTIP2[17-19]等水通道蛋白已经在小麦非生物胁迫中报道过,而TaTIP1-4DL基因未见报道。本研究借助分子克隆及表达分析等手段分析该基因的生物学特征,研究其表达模式,以了解其作用机制,为小麦抗逆分子育种提供理论基础。
1 材料和方法
1.1 试验材料及试剂
供试材料中国春由西北农林科技大学农学院518实验室提供。选取抽穗期小麦的旗叶置于-80 ℃冰箱备用,用于总RNA的提取。
反转录试剂盒购自德国Roche生物公司;Taq DNA聚合酶来自TaKaRa公司;大肠杆菌DH-5α感受态细胞购自天根生物公司;TRIzol总RNA提取试剂、质粒抽提试剂盒、DNA胶回收纯化试剂盒和T4DNA连接酶均购自上海生工生物工程技术公司;引物合成及测序由北京奥科鼎盛生物公司完成。
1.2 总RNA的提取与cDNA的合成
用TRNzol总RNA提取试剂提取小麦旗叶中的总RNA,1%琼脂糖凝胶电泳检测提取的RNA质量,用罗氏反转录试剂盒反转录出cDNA的第一链。
1.3 TaTIP1-4DL基因的克隆
以二穗短柄草TIP1 (XP_003558815.1)的序列为探针搜索六倍体小麦数据库Ensembl Plants中相似序列,得到4D、4A、4B 3条相似度90%以上的拷贝,分别为TraesCS4D02G308800、TraesCS4A02G410800.1和TraesCS4B02G310900.1。用小麦表达量在线分析软件Wheat Expression Browser(http://www.wheat-expression.com/)比较3条不同拷贝的表达量水平,选择在小麦根、叶、籽粒中的表达量较高的4D染色体上的拷贝设计特异性引物(F-0:5′-CTTGGAGGTG ACCGAAAATG-3′;R-0:5′-GGAGACGATGACGAGAC GC-3′)进行PCR扩增。以小麦旗叶的cDNA为模板扩增基因全长,PCR扩增体系包括Taq DNA聚合酶0.25 μL,10×Buffer缓冲液5 μL,4 μL的dNTPs,1 μL的cDNA(100 ng/μL)模板,上下游引物(5 μmol/L)各1 μL,最后用水补足到50 μL终体积。反应程序为:95 ℃预变性3 min;95 ℃变性3 min,60 ℃退火30 s,72 ℃延伸60 s,35个循环;72 ℃充分延伸10 min。之后PCR产物1%琼脂糖凝胶电泳,胶回收电泳片段后连接于T载体,挑阳性克隆送杨凌奥科公司测序,重复3次,获得基因序列。
1.4 生物信息学分析
将所得的TaTIP1-4DL基因的编码蛋白用在线软件ExPASy-ProtParam(https://web.expasy.org/protparam/)进行理化性质的预测;运用SignaIP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)和TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)在线软件分别对蛋白的信号肽及跨膜结构进行预测;为了解TaTIP1-4DL蛋白的结构性质,运用SPOMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=np%20sa_sopma.html)和Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)分别对蛋白进行二级结构和3D模型的预测;运用Plant CARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析TaTIP1-4DL基因的启动子;以TaTIP1-4DL蛋白质序列为模板,在NCBI(https://www.ncbi.nlm.nih.gov/)比对得到不同物种的同源蛋白,使用DNAMAN软件进行TaTIP1氨基酸多序列比对和保守域分析,并使用MEGA 7.0软件构建基于Neighbor-joining(Bootstrap值为1 000)的系统发育进化树。
1.5 TaTIP1-4DL基因表达分析
为进一步研究TaTIP1-4DL基因在小麦不同组织中的表达情况,分别提取抽穗期小麦根、茎、叶、颍壳、籽粒的总RNA,1%的琼脂糖凝胶电泳检测其完整性,并用紫外分光光度仪检测其浓度质量,反转录为cDNA,用于该基因的组织特异性表达分析。选取小麦对水分最敏感的灌浆期对小麦进行非生物胁迫[20]。将灌浆期的小麦分别置于含有100 μmol/L的ABA,20%的PEG和200 mmol/L的NaCl的水溶液中,并在0,3,6,9,12,24 h时分别取样品的叶片和籽粒,提取RNA并反转录为cDNA,用于ABA,干旱和盐胁迫下的表达分析。设计特异性引物(F-1:5′-TACCAGTGGGTGTACTGGGT-3′;R-1:5′-TTAGT AGTCGGTGGTGGGGA-3′)为TaTIP1-4DL基因的定量引物,小麦Actin作为内参,引物为Actin-F:5′-TA GATGCAGTAAAGAACCTGAC-3′;Actin-R:5′-GCCGT GGAGAAGAAGGATC-3′。RT-PCR反应体系为:SYBR Mixture 10 μL, cDNA模板(100 ng/μL)1 μL,上下游引物(10 μmol/L)各0.8 μL,最后用水补足到20 μL。用Roche LightCycler 480仪器进行RT-PCR试验,反应程序为95 ℃ 15 s,60 ℃ 30 s,72 ℃ 1 min,反应重复40个循环,每个样品3次生物学重复。用公式2-ΔΔCT计算基因表达量,用SPSS对数据进行显著性分析,用Excel 2013作图。
2 结果与分析
2.1 小麦TaTIP1-4DL基因的克隆
利用特异性引物F-0和R-0对中国春旗叶的cDNA进行PCR扩增,50 μL的PCR产物分2个胶孔进行1%琼脂糖凝胶电泳,得到大概760 bp的特异性条带(图1)。经过胶回收、连接、转化、蓝白斑筛选等分子试验,选取阳性克隆进行摇菌、测序。测序结果与Ensembl Plants数据库进行比对,结果显示与4DL上的序列相似度达到100%,序列全长771 bp,将其命名为TaTIP1-4DL基因。
2.2 TaTIP1-4DL蛋白生物信息学分析
2.2.1 TaTIP1-4DL蛋白的理化性质分析 利用ExPASy-ProtParam分析得到小麦TaTIP1-4DL蛋白的分子式为C1229H1889N299O329S;分子质量为26.3 ku;理论等电点(PI)为6.82;不稳定指数(Ⅱ)计算为25.48,为稳定性蛋白;总亲水性平均数为0.865,可以推测为疏水性蛋白。TaTIP1-4DL蛋白包括257个氨基酸,其中丙氨酸(Ala)占 13.2%,甘氨酸(Gly)占14.0%,缬氨酸(Val)占10.5%。
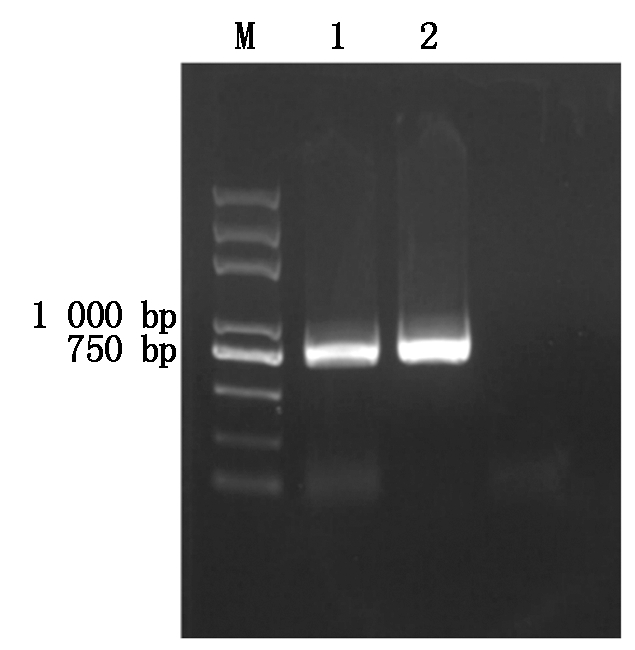
M.D2000plus DNA分子质量标准;1-2.PCR产物。
M.D2000plus DNA ladder;1-2.PCR products.
图1 小麦TaTIP1-4DL基因的扩增结果
Fig.1 Amplified products of TaTIP1-4DL gene
2.2.2 TaTIP1-4DL蛋白的信号肽和跨膜结构域预测 利用SignalP 4.1 Server在线软件分析表明,TaTIP1-4DL蛋白不存在信号肽结构。TMHMM的跨膜区预测表明:TaTIP1-4DL蛋白含有6个可能的跨膜区域, 为水通道蛋白的典型跨膜结构。其中由内向外跨膜的有17-39位,101-123位和173-195位氨基酸,由外向内跨膜的有59-81位,138-160位和215-237位氨基酸(图2)。
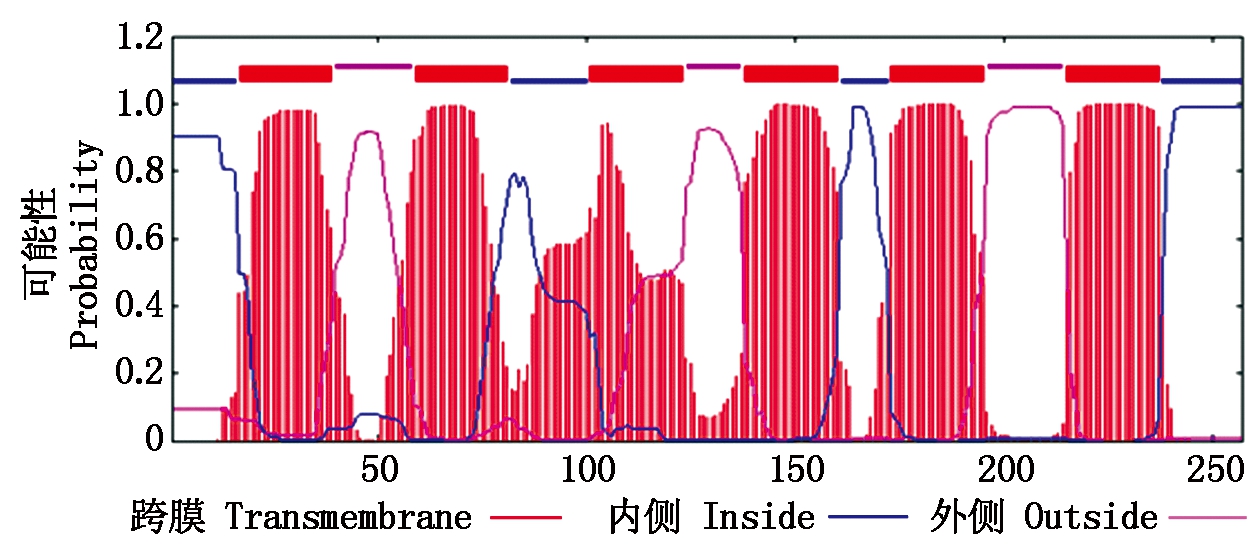
图2 TaTIP1-4DL蛋白的跨膜结构域预测
Fig.2 Prediction of transmembrane domains of TaTIP1-4DL
2.2.3 TaTIP1-4DL蛋白的结构预测 SOPMA在线预测蛋白的二级结构表明,α-螺旋和无规卷曲结构含量较多,都占到36.96%,其次是β-片层占到20.23%,β-转角结构所占最少为5.84%。Phyre2进行3D模型预测如图3,模型的置信度达到100%,氨基酸序列的覆盖度达到90%,因此,可以认为该蛋白结构的预测是可靠的。从模型中可以看出该蛋白结构为沙漏模型,包括6个贯穿两面的长α螺旋和2个几乎顶对顶放置的短α螺旋。
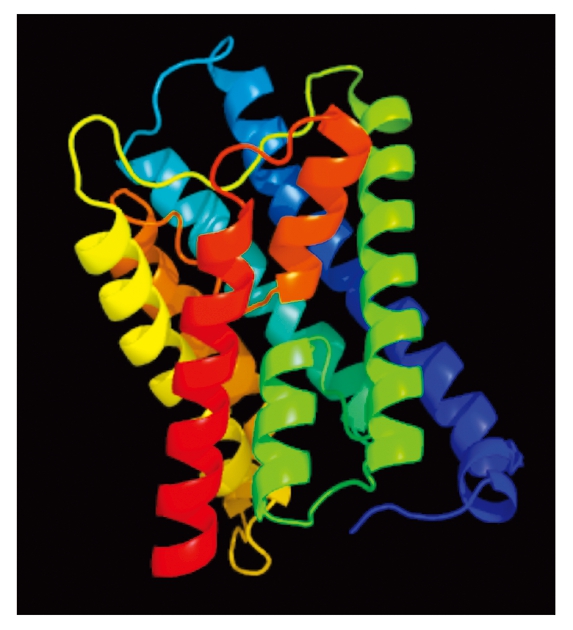
图3 TaTIP1蛋白的三级结构预测
Fig.3 Prediction of three dimensional structure of TaTIP1 protein
2.2.4 TaTIP1-4DL基因的启动子顺式作用元件分析 启动子可以控制基因表达的起始和表达程度,是基因的重要组成部分,对启动子的元件进行分析可以为更深入了解TaTIP1-4DL基因的功能奠定基础。Plant CARE软件对该基因启动子序列进行分析,结果表明:该基因启动子区包含激素响应元件例如脱落酸响应元件(ABRE、ABRE3a、ABRE40)、茉莉酸甲酯响应元件(CGTCA-motif、 TGACG-motif)。胁迫响应元件包括与干旱和盐胁迫都相关的DRE元件和光响应元件(G-Box、G-box、I-box、GF1-motif)。另外还包括胚乳特异性表达元件(GCN4-motif)。上述顺式作用元件分析表明,植物激素与非生物胁迫可能影响TaTIP1-4DL基因的表达。
2.2.5 TaTIP1-4DL基因氨基酸序列比对及进化分析 通过DNAMAN软件分析TaTIP1-4DL基因氨基酸序列与来自高粱(XP_002465859.1)、玉米(NP_001104896.1)、二穗短柄草(XP_003558815.1)和山羊草(XP_020178611.1)的TIP1氨基酸序列进行多重比对,分析其保守区氨基酸序列。结果如图4所示,所有参比物种的TIP1蛋白氨基酸序列相似度达到91.83%,其中小麦与山羊草的氨基酸序列最相似,可以达到93.0%。说明小麦中TIP1基因的氨基酸序列与其他物种的氨基酸序列具有高度同源性。另外,参比物种的氨基酸序列中都含有6个保守跨膜区和2个保守的NPA基序,这也是液泡膜内在蛋白家族的典型特征[21]。

TM 1-6 代表6个跨膜区域;2个方框表示2个保守的NPA基序。
TM 1-6 represented transmembrane domains;Two boxes respresent the two conserved NPA motifs.
图4 TaTIP1与其他物种同源蛋白的多序列比对
Fig.4 Multialignment of TaTIP1 amio acid sequence with other TIP1s
利用MEGA 7.0绘制系统进化树,结果显示(图5),所有参比物种可以分为两大类,木薯、番茄等双子叶植物一类,小麦、玉米等单子叶植物一类。其中TaTIP1-4DL蛋白与山羊草的亲缘关系最近,其次是黑麦草,二穗短柄草将三者聚类在一起。该进化结果也与氨基酸比对的结果相符。
2.3 TaTIP1-4DL基因表达分析
对小麦根、茎、叶、籽粒、颍壳的表达分析显示:TaTIP1-4DL基因在这5个组织中都有表达,但是表达水平存在差异。其中,在叶中的表达量最高,可以达到茎中的9.5倍,而根、颍壳、籽粒中的表达量没有明显的差别,可以得出该基因为组成型表达,且在叶中表达量较高。ABA、PEG和的NaCl的胁迫表达分析表明:小麦叶片和根组织中TaTIP1-4DL基因在脱落酸、干旱和盐胁迫处理下的表达量的变化趋势相似,都是先上升后下调。另外,叶子中TaTIP1-4DL基因的表达量变化比籽粒的明显。脱落酸胁迫表明,在处理的第6小时叶和籽粒中基因的表达量都达到最高,之后随着胁迫时间的增加逐渐下调。干旱胁迫结果表明,籽粒中TaTIP1-4DL基因的表达量也呈现先上升后下调的趋势,但是叶中在处理后的第6小时表达量达到最高,为处理前的14倍,之后迅速下降,而后又有上升的趋势。盐胁迫的结果和ABA相似,表达量都是先上调后下调,且叶中的表达量在第6小时时达到最高(图6)。以上分析表明,TaTIP1-4DL基因在ABA、干旱和盐的胁迫下被诱导表达,这对提高小麦的抗逆性有重要作用。
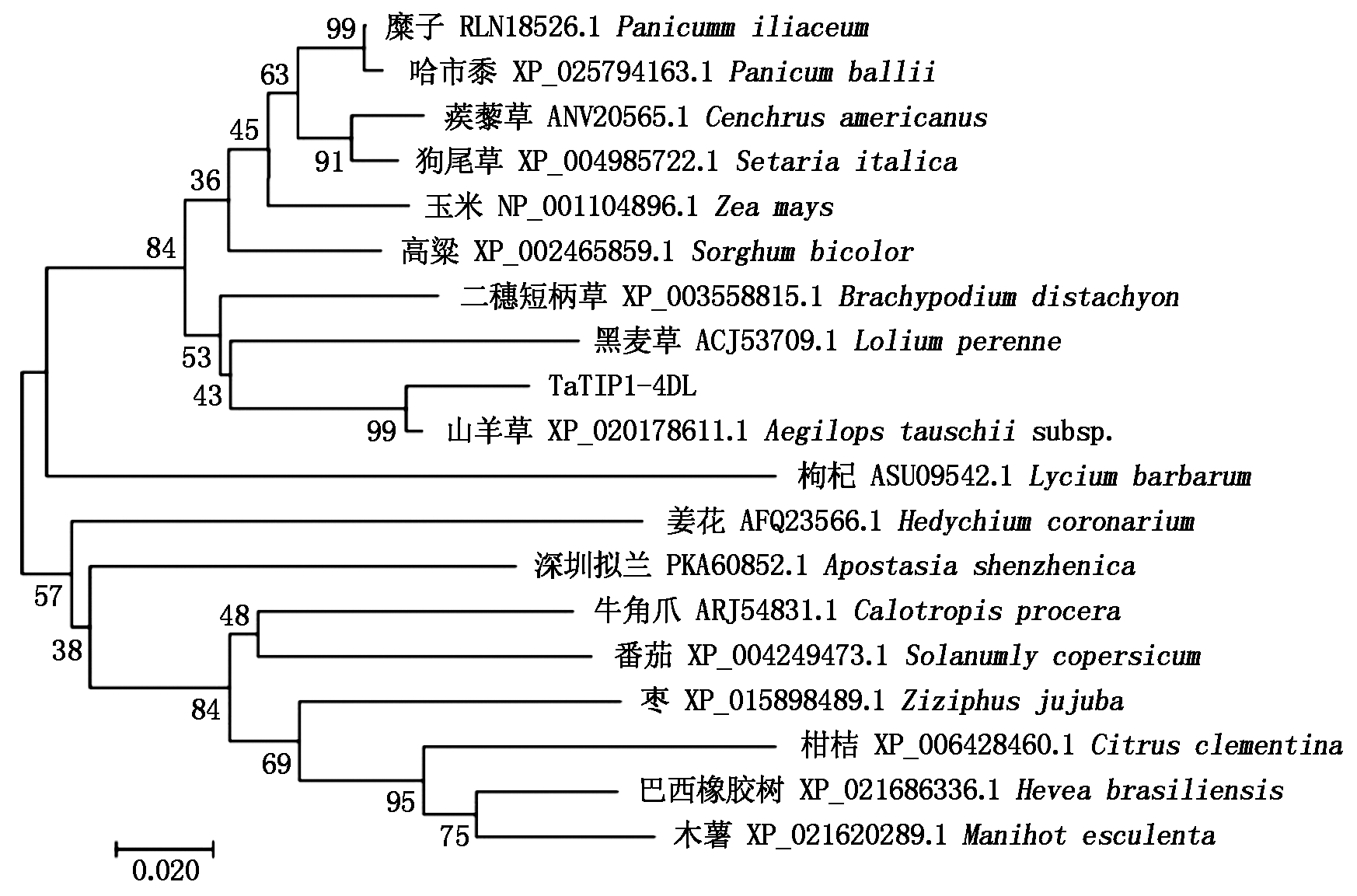
图5 小麦与其他物种TIP1蛋白的进化分析
Fig.5 Phylogene tree of TIP1 proteins from wheat and other species
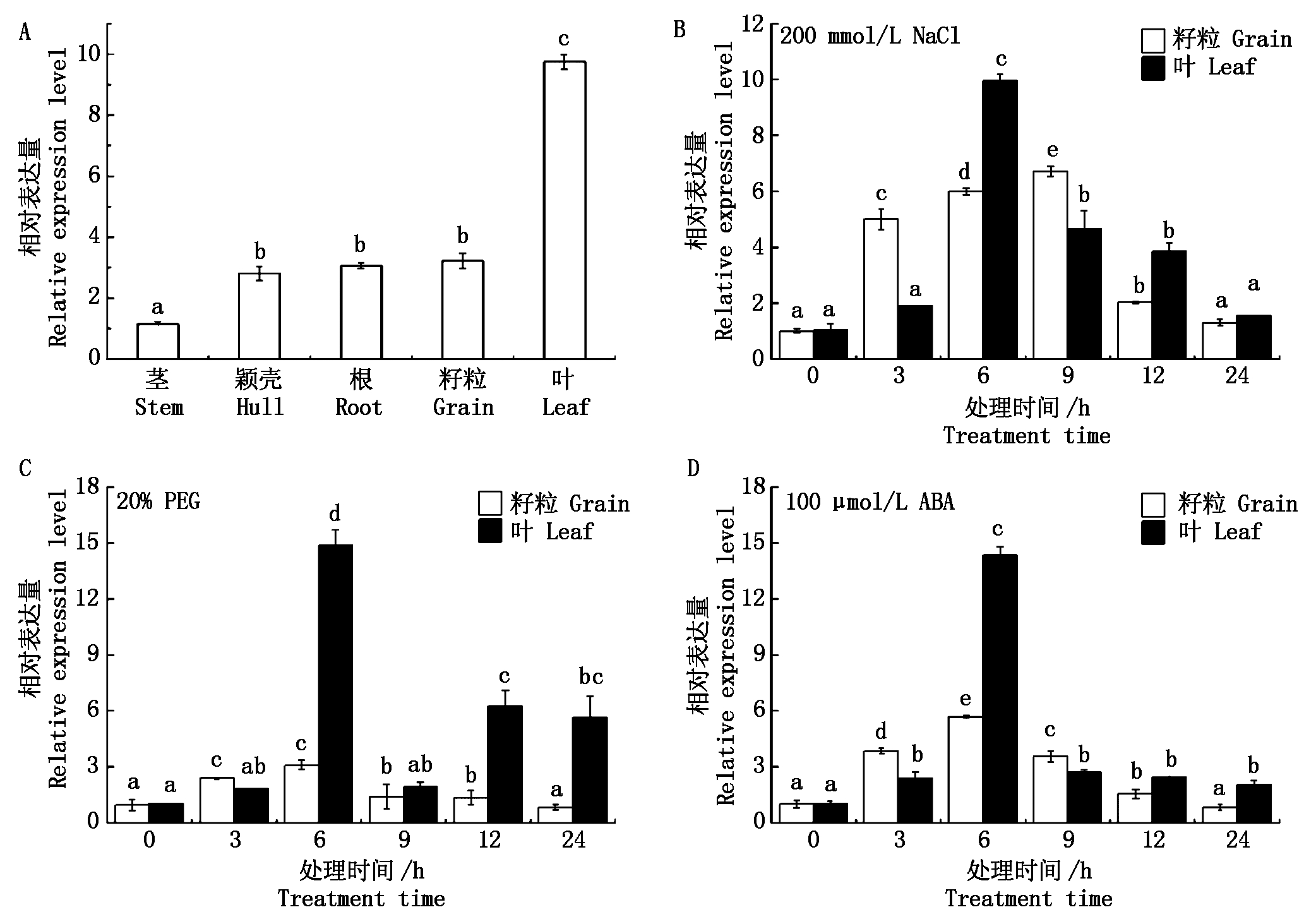
不同小写字母显著差异(P<0.05 )。
Significant difference in different lowercase letters (P<0.05).
图6 TaTIP1-4DL基因的表达分析
Fig.6 Expression analyses of TaTIP1-4DL gene
3 结论与讨论
水通道蛋白对水分子有高度选择性,在促进水分吸收和远距离运输中发挥重要作用。蛋白质的功能是通过其结构来实现的,AQPs也不例外。本试验基于小麦数据库克隆到TaTIP1-4DL基因,结构预测显示TaTIP1-4DL蛋白也具有APQs典型的沙漏结构,符合APQs的经典结构模型[22]。氨基酸比对结果显示,TaTIP1-4DL蛋白也具有2个保守的NPA基序,6个典型的跨膜结构域,说明水通道蛋白在进化和结构功能上具有一定的保守性。小麦和其他几种植物TIP1相似蛋白的进化树分析表明,小麦的TIP1蛋白与山羊草、黑麦草、二穗短柄草具有高度同源性,表明该蛋白氨基酸序列可以作为植物分类的依据。
水通道蛋白的一个特征是在各个组织中普遍表达[23],但在各个组织中的表达量会有差异。本试验对克隆出的TaTIP1-4DL基因做RT-PCR分析得出,TaTIP1-4DL基因为组成型表达,在小麦的各个组织中都有表达,这与前人在毛竹[24]、大麦[25]中对TIP1基因的表达分析结果一致。而TaTIP1-4DL基因在抽穗期的不同组织中叶子的表达量最高,这与TIP1在杨树中的试验结果一致[26]。猜测这与TaTIP1基因对水分的转运有关,抽穗期的小麦,叶片细胞需要保持足够的细胞膨压用于孕育籽粒,相似的情况出现在玉米中[27]。现已有研究表明,水通道蛋白与正在生长或分裂的组织或器官的细胞扩增呈正相关[10]。
植物应对非生物胁迫时会通过细胞膨压来维持体内渗透平衡和离子平衡,降低外界因素带来的伤害[28],而TIP类蛋白负责调节细胞膨压,维持细胞结构的完整性。Plant CARE软件预测TaTIP1-4DL基因的启动子内含有与胁迫响应相关的应答元件,暗示该基因可能参与小麦的逆境胁迫。对小麦做进一步的逆境胁迫表达分析,结果显示:高浓度脱落酸、干旱、高盐几种胁迫方式都对TaTIP1-4DL基因在籽粒和叶片中的表达有不同程度的诱导,普遍遵循先上调后下降的趋势。在叶片中的诱导程度普遍高于籽粒,并且脱落酸和干旱对TaTIP1-4DL基因表达的诱导较大。其他物种包括烟草[29]、水稻[30]、菜用大豆[31]等中都有关于对TIP1基因的相似胁迫研究。
本研究克隆出小麦TaTIP1-4DL基因,该基因编码257个氨基酸,其蛋白结构符合水通道蛋白的经典结构模型。组织特异性表达显示该基因在各个组织中都有表达,为组成型表达。非生物胁迫表达分析显示,脱落酸、干旱、高盐都对TaTIP1-4DL基因有不同程度的诱导。该试验为TaTIP1-4DL基因在小麦非生物胁迫中的抗逆功能研究有一定实际意义,而其中的分子机制还需进一步研究。
[1] 栗聪,雒景吾,张磊,田增荣,刘新伦,吉万全. 小麦成熟胚再生体系优化及优良受体基因型筛选[J]. 麦类作物学报, 2014, 34(5):583-590. doi:10.7606/j.issn.1009-1041.2014.05.02.
Li C, Luo J W, Zhang L, Tian Z R, Liu X L, Ji W Q. Optimizing the regeneration system from mature embryo and screening of elite wheat genotypes[J]. Journal of Triticeae Crops, 2014, 34(5):583-590.
[2] Ali S, Liu Y, Ishaq M, Shah T, Abdullah, Ilyas A, Din I U. Climate change and its impact on the yield of major food crops:evidence from pakistan[J]. Foods, 2017, 6(6):39. doi:10.3390/foods6060039.
[3] Srivastava A K, Penna S, Nguyen D V, Tran L S. Multifaceted roles of aquaporins as molecular conduits in plant responses to abiotic stresses[J]. Critical Reviews in Biotechnology, 2016, 36(3):389-398. doi:10.3109/07388551.2014.973367.
[4] Agathocleous M, Meacham C E, Burgess R J, Piskounova E, Zhao Z Y, Crane G M, Cowin B L, Bruner E, Murphy M M, Chen W N, Spangrude G J, Hu Z P, DeBerardinis R J,Morrison S J. Ascorbate regulates haematopoietic stem cell function and leukaemogenesis[J]. Nature, 2017,549(7673):476-481. doi:10.1038/nature23876.
[5] 马林,郭绍霞,庞冉琦. 芍药切花预处理液研究[J]. 安徽农业科学,2009, 37(11):5110-5112.doi:10.3969/j.issn.0517-6611.2009.11.115.
Ma L, Guo S X, Pang R Q. Research on the pretreament liquid of Chinese Peony cutting[J]. Journal of Anhui Agricultural Sciences, 2009, 37(11):5110-5112.
[6] 杨淑慎,山仑,郭蔼光,高梅,孙达权,邵艳军. 水通道蛋白与植物的抗旱性[J]. 干旱地区农业研究,2005, 23(6):214-218. doi:10.3321/j.issn:1000-7601.2005.06.044.
Yang S S, Shan L, Guo A G, Gao M, Sun D Q, Shao Y J. Aquaporins and drought resistance of plants[J]. Agricultural Research in the Arid Areas, 2005, 23(6):214-218.
[7] Chen W, Yin X, Wang L, Tian J, Yang R Y, Liu D F, Yu Z H, Ma N, Gao J P. Involvement of rose aquaporin RhPIP1; 1 in ethylene-regulated petal expansion through interaction with RhPIP2; 1[J]. Plant Molecular Biology, 2013, 83(3):219-233. doi:10.1007/s11103-013-0084-6.
[8] Ludewig U, Dynowski M. Plant aquaporin selectivity:where transport assays, computer simulations and physiology meet[J]. Cellular and Molecular Life Sciences, 2009, 66(19):3161-3175. doi:10.1007/s00018-009-0075-6.
[9] Gustavsson S, Lebrun A S, Nordén K, Chaumont F, Johanson U. A novel plant major intrinsic protein in Physcomitrella patens most similar to bacterial glycerol channels[J]. Plant Physiology, 2005, 139(1):287-295. doi:10.1104/pp.105.063198.
[10] Medina S, Vicente R, Nieto-Taladriz M T, Aparicio N, Chairi F, Vergara-Diaz O, Araus J L. The plant-transpiration response to vapor pressure deficit (VPD) in durum wheat is associated with differential yield performance and specific expression of genes involved in primary metabolism and water transport[J]. Front Plant Sci, 2018, 15(9):1994-2013. doi:10.3389/fpls.2018.01994.
[11] Preston G M, Carroll T P, Guggino W B, Agre P. Appearance of water channels in Xenopus oocytes expressing red cell CHIP28 protein[J]. Science, 1992, 256(5055):385-387. doi:10.1126/science.256.5055.385.
[12] Ibanez F, Hancock J, Tamborindeguy C. Identification and expression analysis of aquaporins in the potato psyllid, Bactericera cockerelli[J]. PLoS One, 2014, 9(10):e111745. doi:10.1371/journal.pone.0111745.
[13] Ahamed A, Murai-Hatano M, Ishikawa-Sakurai J, Hayashi H, Kawamura Y, Uemura M. Cold stress-induced acclimation in rice is mediated by root-specific aquaporins[J].Plant and Cell Physiology, 2012, 53(8):1445-1456. doi:10.1093/pcp/pcs089.
[14] Pandey B, Sharma P, Pandey D M, Sharma I, Chatrath R. Identification of new aquaporin genes and single nucleotide polymorphism in bread wheat[J]. Evolutionary Bioinformatics, 2013, 9(9):437-452.doi:10.4137/EBO.S12568.
[15] Regon P, Panda P, Kshetrimayum E, Panda S K. Genome-wide comparative analysis of tonoplast intrinsic protein (TIP) genes in plants[J]. Functional & Integrative Genomics, 2014, 14(4):617-629. doi:10.1007/s10142-014-0389-9.
[16] Wang X, Gao F, Bing J, Sun W M, Feng X X, Ma X F, Zhou Y J, Zhang G F. Overexpression of the jojoba aquaporin gene, ScPIP1, enhances drought and salt tolerance in transgenic Arabidopsis[J]. International Jornal of Molecular Sciences, 2019, 20(1):153-166. doi:10.3390/ijms20010153.
[17] Huang C, Zhou S Y, Hu W, Deng X M, Wei S Y, Yang G X, He G Y. The wheat aquaporin gene TaAQP7 confers tolerance to cold stress in transgenic tobacco[J]. Zeitschrift für Naturforschung C, 2014, 69(3-4):142-148. doi:10.5560/znc.2013-0079.
[18] 曹荣珍, 闻珊珊. 小麦TaNIP4-1基因的克隆及生物信息学分析[J]. 麦类作物学报, 2017,37(10):1285-1293. doi:10.7606/j.issn.1009-1041.2017.10.03.
Cao R Z, Wen S S. Cloning and bioinformatics analysis of TaNIP4-1 in wheat [J]. Journal of Triticeae Crops, 2017,37(10):1285-1293.
[19] Pandey B, Sharma P, Pandey D M, Sharma I, Chatrath R. Identification of new aquaporin genes and single nucleotide polymorphism in bread wheat[J]. Evolutionary Bioinformatics, 2013, 9:437-452. doi:10.4137/EBO.S12568.
[20] Huseynova I M, Rustamova S M, Suleymanov S Y, Aliyeva D R, Mammadov A C, Aliyev J A. Drought-induced changes in photosynthetic apparatus and antioxidant components of wheat (Triticum durum Desf.) varieties[J]. Photosynthesis Research, 2016, 130(1-3):215-223. doi:10.1007/s11120-016-0244-z.
[21] Johansson I, Karlsson M, Johanson U, Larsson C, Kjellbom P. The role of aquaporins in cellular and whole plant water balance[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2000, 1465(1-2):324-342.doi:10.1016/S0005-2736(00)00147-4.
[22] 隋海心,任罡.水分子通道蛋白的结构与功能[J].化学进展,2004, 16(2):145-152.doi:10.3321/j.issn:1005-281X.2004.02.001.
Sui H X, Ren G. Structure and mechanism of water channels[J]. Progress in Chemisry, 2004, 16(2):145-152.
[23] Wudick M M, Luu D T, Maurel C. A look inside:localization patterns and functions of intracellular plant aquaporins[J]. New Phytologist, 2009, 184(2):289-302.doi:10.1111/j.1469-8137.2009.02985.x.
[24] 孙化雨,娄永峰,李利超,赵韩生,高志民. 毛竹 TIPs 基因家族成员组织表达模式研究[J]. 林业科学研究,2016, 29(4):521-528. doi:10.3969/j.issn.1001-1498.2016.04.008.
Sun H Y, Lou Y F, Li L C, Zhao H S, Gao Z M. Tissue expression pattern analysis of TIPS genes in Phyllostachys edulis[J]. Forest Resarch, 2016, 29(4):521-528.
[25] Hove R M, Ziemann M, Bhave M. Identification and expression analysis of the barley (Hordeum vulgare L.) aquaporin gene family[J]. PLoS One, 2015, 10(6):e0128025. doi:10.1371/journal.pone.0128025.
[26] 唐海. 胡杨中液泡膜水通道蛋白PeTIP1;2基因功能及其启动子研究[D].四川:西南科技大学,2018.
Tang H, Study on the function of the vacuolar aquaporin PeTIP1;2 gene and its promoter in Populus euphratica[D]. Sichuan:Southwest University of Science and Technology, 2018.
[27] 刘迪秋,王继磊,葛锋,李文娴. 植物水通道蛋白生理功能的研究进展[J]. 生物学杂志,2009, 26(5):63-66. doi:10.3969/j.issn.1008-9632.2009.05.063.
Liu D Q, Wang J L, Ge F, Li W X. Advances in physiological functions of plant aquaporins[J]. Journal of Biology, 2009, 26(5):63-66.
[28] Ruiz-Lozano J M, Porcel R, Azcón C, Aroca R. Regulation by arbuscular mycorrhizae of the integrated physiological response to salinity in plants:new challenges in physiological and molecular studies[J]. Journal of Experimental Botany, 2012, 63(11):4033-4044. doi:10.1093/jxb/ers126.
[29] 夏宗良,李军旗,刘剑君,苏新宏,张小全. 烟草水通道蛋白NtTIP1基因的克隆及其在干旱胁迫下的表达分析[J]. 河南农业大学学报,2013,47(5):509-513. doi:10.3969/j.issn.1000-2340.2013.05.001.
Xia Z L, Li J Q, Liu J J, Su X H, Zhang X Q. Cloning of an aquaporin gene NtTIP1 from tobacco and its expression under drought stress[J]. Journal of Henan Agricultural University,2013,47(5):509-513.
[30] 李伟,韩娇,黄升财,何蕊,王冰,程宪国.小盐芥TsPIP1;1与TsTIP1;1基因增强转基因水稻耐盐性[J]. 植物营养与肥料学报, 2017,23(4):957-963.doi:10.11674/zwyf.17063.
Li W, Han J, Huang S C, He R, Wang B, Cheng X G. Thellungiella salsuginea TsPIP1;1 and TsTIP;1 enhanced the salt tolerance of transgenic rice[J]. Plant Nutrition and Fertilizer Science, 2017,23(4):957-963.
[31] 冯志娟, 徐盛春, 刘娜, 张古文, 胡齐赞, 龚亚明. 菜用大豆液泡膜内在蛋白(TIPs)基因鉴定及表达分析[J]. 植物遗传资源学报, 2018,19(4):713-721. doi:10.13430/j.cnki.jpgr.20180102003.
Feng Z J, Xu S C, Liu N, Zhang G W, Hu Q Z, Gong Y M. Identification and expression analysis of intrinsic proteins (tips) in soybean membrane of vegetable[J]. Journal of Plant Genetic Resources, 2018, 19(4):713-721.