核桃是世界四大干果之一,也是中国主要干果出口品种,主要分布在新疆、河北、陕西等省。腐烂病严重危害核桃生长、发育和繁殖[1],降低了核桃产量及品质。腐烂病病害程度受寄主抗性、侵染性真菌与外部环境共同影响,但目前对不同腐烂病程度与植株叶片、韧皮部酶活变化和长势作用关系的研究较少。张志华等[2]研究了核桃根与叶中过氧化物酶(POD)活性与长势之间的关系,发现根POD与植株茎粗之间呈显著负相关,周斌等[3]、相昆等[4]分析了冻害与核桃植株抗寒性之间的关系,表明超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、脯氨酸(Pro)等酶参与了低温对核桃的胁迫,而大多数腐烂病的调查研究表明,冻害是腐烂病暴发的重要诱导因素。目前,仍未见腐烂病病害程度与核桃生化代谢之间关系的研究。本研究通过分析4种程度腐烂病与核桃长势(基茎)、POD、Pro、苯丙氨酸转氨酶(PAL)活性,以期为核桃腐烂病侵染程度的预判提供支持。
1 材料和方法
1.1 试验材料
试验样地位于新疆温宿县核桃林场3队12年生核桃园。2016年4月25日-5月7日,在园区随机选取发病程度为健康(J)、轻度(Q)、中度(Z)和重度(B)病害的核桃树各7株,测定每株基茎,分别在每株的东、南、西、北4个方向各截取3年生枝条,获得枝条混合样品28个;同时在每一方向采集健康叶片5~7片,获得混合叶片样品28袋,样品置于-70 ℃超低温冰箱中待测。
1.2 试验方法
核桃腐烂病发病程度参照Biggs等[5]和孙广宇等[6]在桃和苹果树标准上加以修改。健康:无病疤或 1~2 年生小枝有少量病疤;轻度:2~4年生侧枝有较轻的病疤;中度:主枝上有 1 个病疤,宽度占枝干周长的 50% 以上;重度:主干或主枝上有 3 个病疤,宽度均占枝干周长的50%以上,并测量病斑面积(SCA)。
叶片和韧皮部POD活性的测定参照文献[7]。叶片和韧皮部Pro含量的测定参照张殿忠等[8]的磺基水杨酸法。PAL的提取参照王敬文等[9]所述的方法,材料在-15 ℃冷冻固定,加适量(1∶5,m/V)预冷的硼酸缓冲液<0.2 mol/L,pH值8.8(内含5 mmol/L巯基乙醇),冰浴匀浆,4层滤纸抽滤得粗提液。粗提液按照Koukol等[10]法检测。
1.3 统计分析
首先,通过Duncan′s单因素方差分析不同病害程度植株叶片和3年生分枝韧皮部POD、Pro、PAL活性的差异显著性。其次,对腐烂病病斑面积、POD、Pro、PAL活性和基茎周长对数标准化,Pearson相关分析检验植株叶片与病斑面积之间的相关性(P < 0.05),然后将标准化后的病斑面积分别与标准后的叶片POD、Pro、PAL活性和植株基茎进行线性拟合。图中数据是平均值±标准误。
2 结果与分析
2.1 腐烂病发病程度对PAL活性的影响
由图1可知,不同程度腐烂病植株叶片PAL活性差异显著(P < 0.05)。轻度腐烂病植株(Q)叶片PAL活性最高,平均达到6 680.55 U/(g·h),健康植株(J)叶片PAL活性最低,平均为2 995.83 U/(g·h),不同病害植株叶片PAL活性排序为:轻度(Q)>中度(Z)>重度(B)>健康(J)。
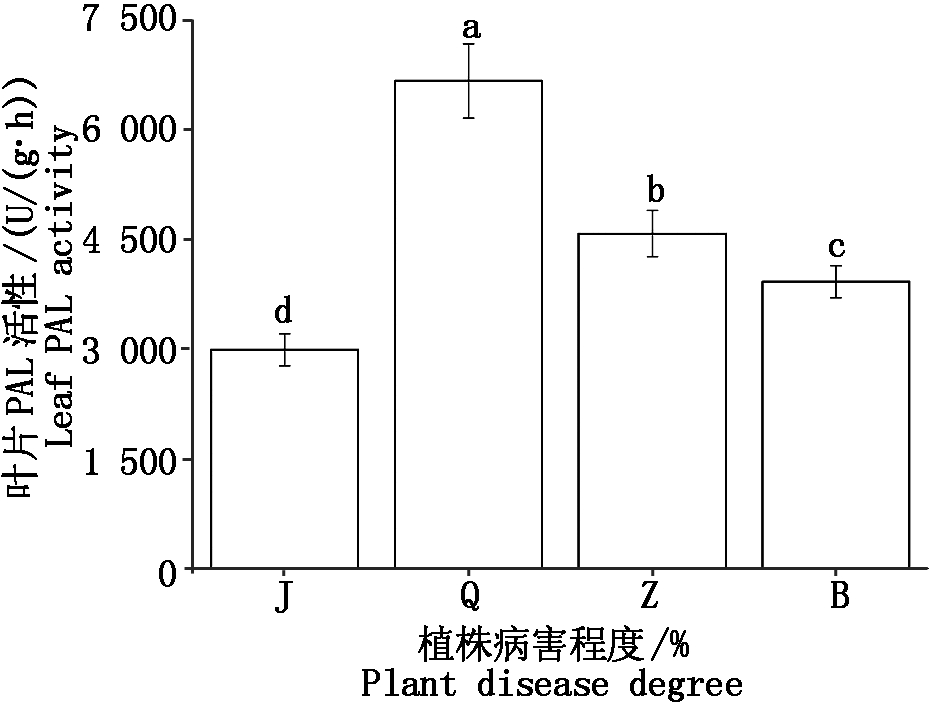
不同小写字母表示差异显著(P<0.05)。图2,4,5,7,8同。
Different lowercase shows a significant difference
(P<0.05).The same as Fig.2,4,5,7,8.
图1 不同程度腐烂病核桃植株叶片PAL活性比较
Fig.1 Comparative with PAL activity of leaf at different levels of Jugladis canker
如图2,与叶片相比,随着病害程度增加,核桃植株茎PAL活性增加略显缓慢,相同病害程度,轻度腐烂病叶片PAL活性已达到最高值,茎韧皮部PAL活性仅为次高值,病害进一步加强至中度腐烂病PAL活性最高。不同腐烂病程度核桃植株茎韧皮部PAL活性差异显著(P<0.05),其中,中度腐烂病PAL活性平均为9 069.59 U/(g·h),是健康植株的3倍,轻度腐烂病的1.3倍,重度腐烂病的1.7倍。图3线性回归分析表明,SCA与PAL活性之间没有明显线性关系(P>0.60)。
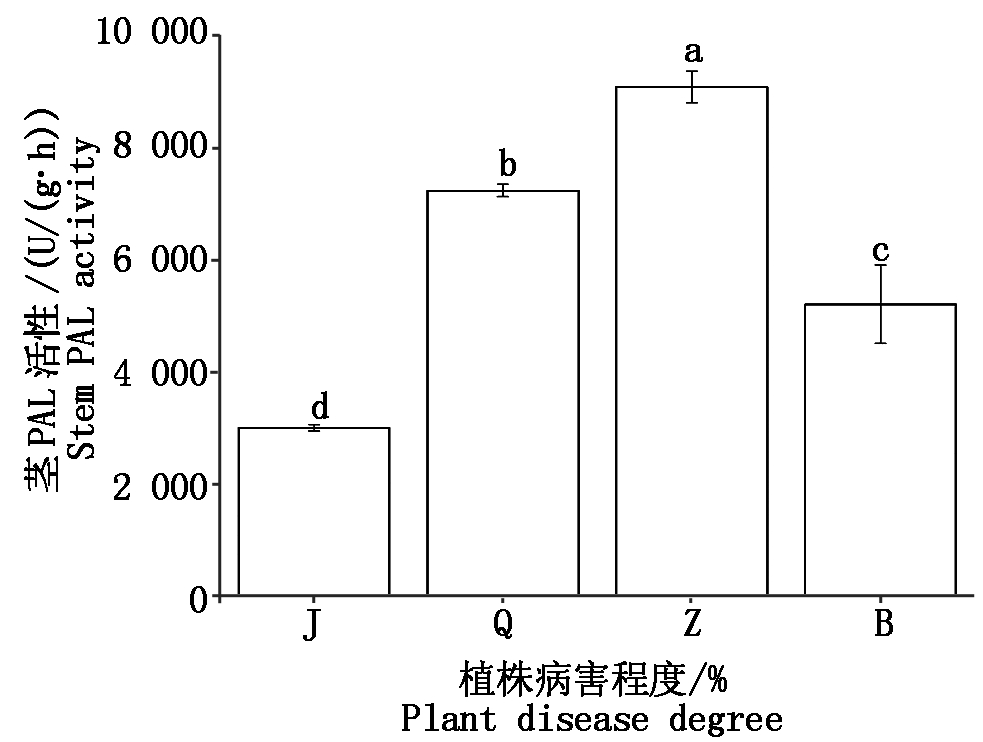
图2 不同程度腐烂病核桃植株茎PAL活性比较
Fig.2 Comparative with PAL activity of stem at different levels of Jugladis canker
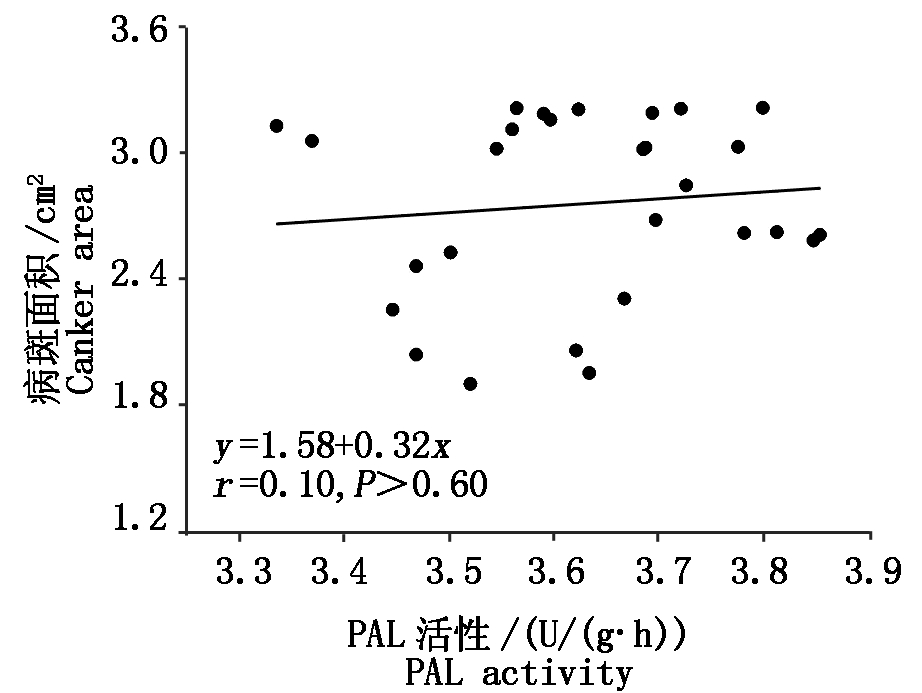
图3 核桃植株病斑面积与叶PAL活性回归分析
Fig.3 Linear regression analysis with Jugladis canker area and PAL activity of leaf
2.2 腐烂病发病程度对POD活性的影响
如图4,除中度腐烂病与重度病害叶片POD活性差异不显著(P>0.05),其他病害程度植株叶片POD活性之间存在显著差异(P<0.05)。其中,健康植株叶片POD活性最高,平均为128.26 U/(g·h),重度病害叶片POD活性最低,平均为8.29 U/(g·h),不同病害植株叶片POD活性排序为:健康(J)>轻度(Q)>中度(Z)>重度(B)。
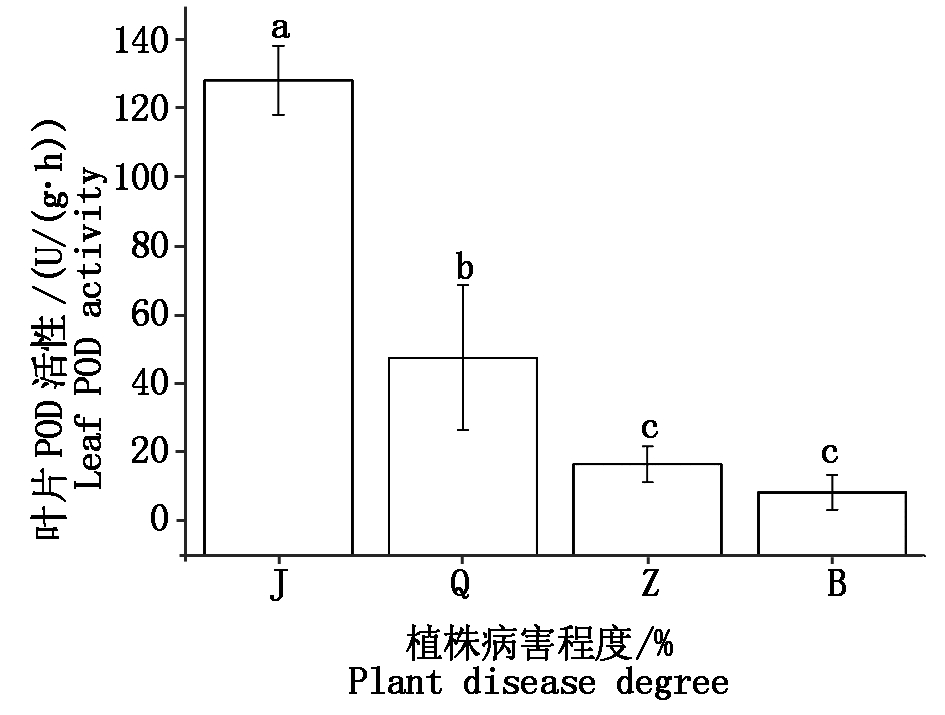
图4 不同程度腐烂病核桃植株叶片POD活性比较
Fig.4 Comparative with POD activity of leaf at different levels of Jugladis canker
不同病害程度植株茎韧皮部POD活性有一定差异,其中中度腐烂病茎韧皮部POD活性最高,平均为4.72 U/(g·h),与健康植株、轻度和重度腐烂病差异显著(P<0.05)。分别是后三者的3.0,1.7,2.0倍,如图5。
由图6可知,SCA与叶片POD活性线性回归方程y=3.66-0.66x,r=-0.76,P<0.001。同时,可看出POD活性<2.4,病斑面积与之呈超显著负相关。由此说明,当叶片POD活性增加,腐烂病病斑面积随之减小。
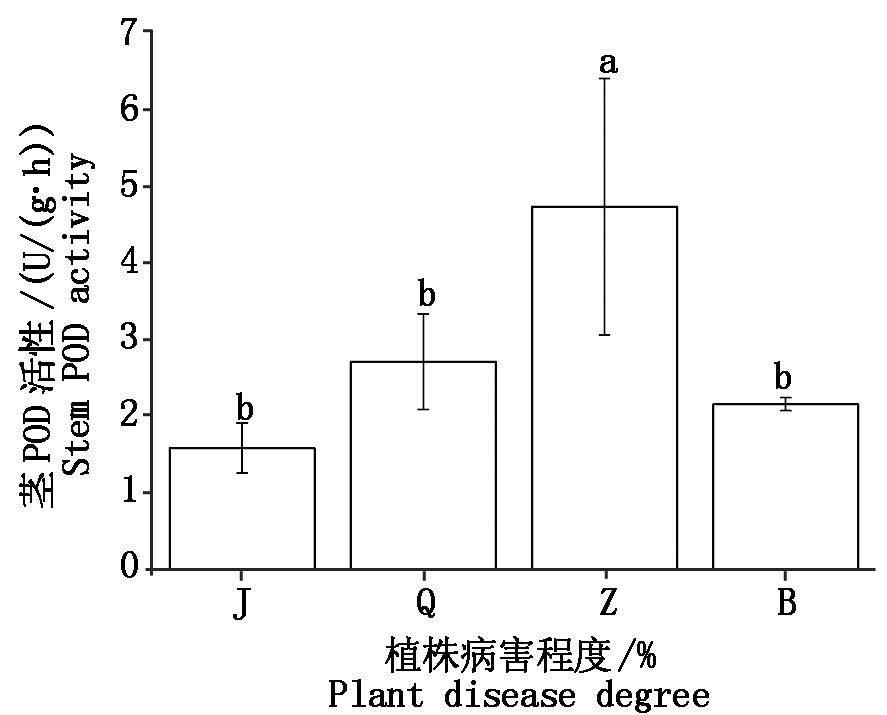
图5 不同程度腐烂病核桃植株茎POD活性比较
Fig.5 Comparative with POD activity of stem at different levels of Jugladis canker
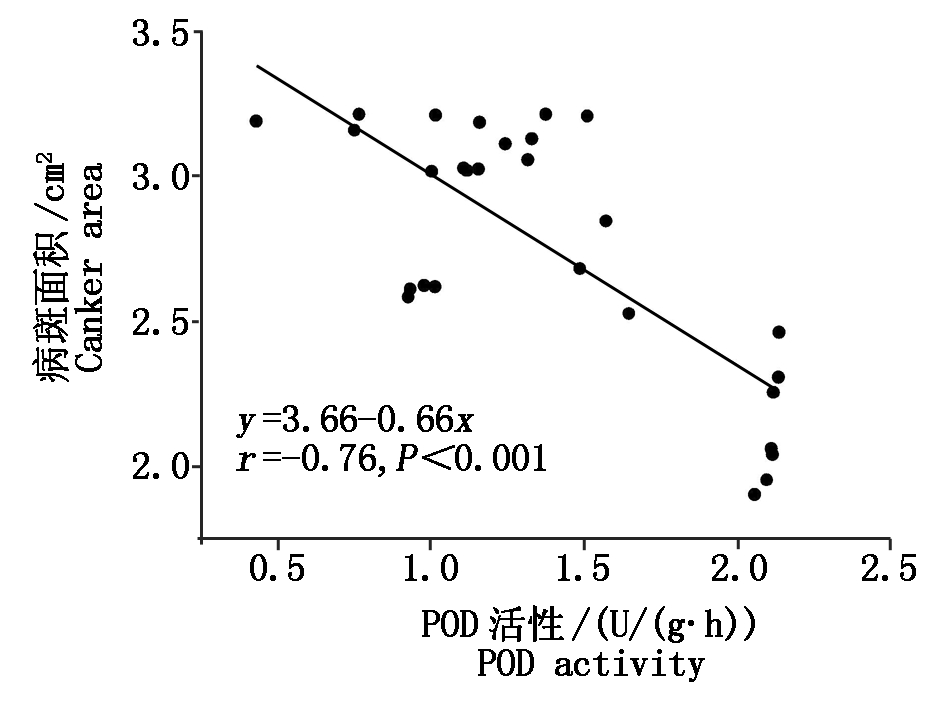
图6 核桃植株病斑面积与叶POD活性回归分析
Fig.6 Linear regression analysis with Jugladis canker area and POD activity of leaf
2.3 腐烂病程度对Pro活性的影响
如图7,核桃中度腐烂病植株叶片Pro活性与其他病害程度叶片差异显著,其他腐烂病病害程度叶片间Pro活性差异不显著(P>0.05)。中度腐烂病植株叶片Pro活性最高,平均为308.57 U/(g·h),是轻度腐烂病植株叶片Pro活性15.7倍。不同病害植株叶片Pro活性排序为:中度(Z)>重度(B)>健康(J)>轻度(Q)。
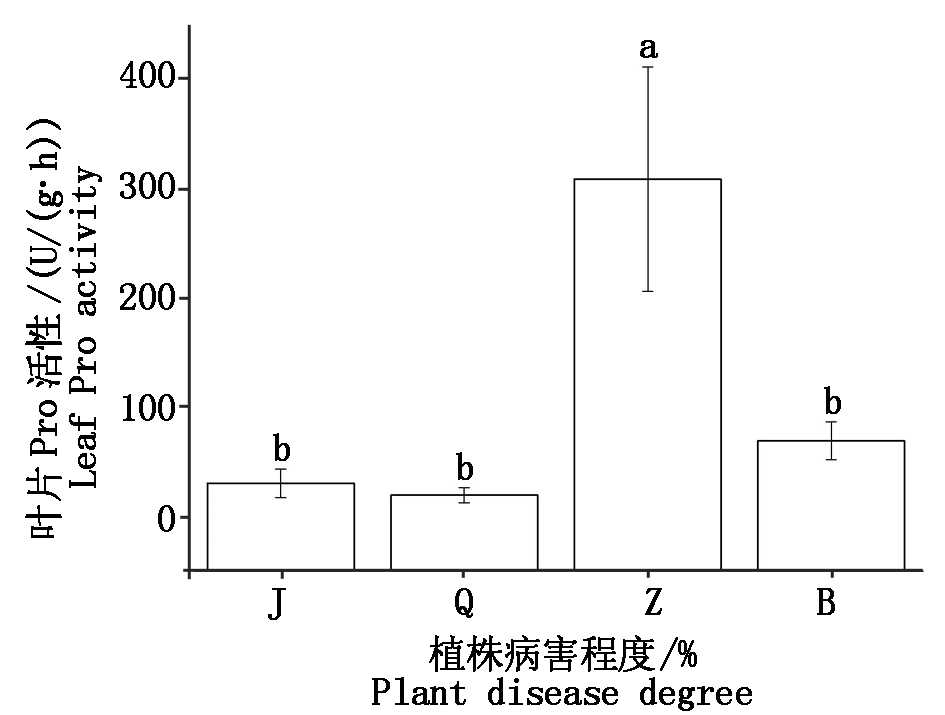
图7 不同程度腐烂病核桃植株叶片Pro活性比较
Fig.7 Comparative with Pro activity of leaf at different levels of Jugladis canker
茎Pro活性与其他组织差异较大,表现为轻度腐烂与健康植株差异显著(P<0.05),中度腐烂病和重度腐烂病差异显著(P<0.05);健康植株与中度腐烂病差异不显著(P>0.05),轻度与重度差异不显著(P>0.05),如图8。
由图9可知,SCA 与叶片Pro活性线性回归方程:y=0.56x+1.77,r = 0.52,P<0.004。同时,可看出2.4 由表1相关分析可知,SCA与POD活性和植株基茎周长呈极显著负相关,与Pro活性呈极显著正相关(P<0.01),与PAL活性相关性不显著(P>0.05)。PAL活性与POD活性呈极显著负相关,与Pro活性呈极显著正相关( P<0.01)。表1显示腐烂病致病菌侵染程度受POD、Pro、植株基茎极显著影响,上述因子影响腐烂病致病菌侵染程度的强弱依次是:核桃基茎>POD活性>Pro活性。 图8 不同程度腐烂病核桃植株茎Pro活性比较 图9 核桃植株病斑面积与叶Pro活性回归分析 表1 腐烂病病斑面积与PAL、POD、Pro、基茎周长的相关性分析(P<0.05) 因子Factors腐烂病病斑面积Canker areaPAL活性PAL activityPOD活性POD activityPro活性Pro activity基茎周长Stem circumference腐烂病病斑面积 Canker area 1.000.10-0.76∗∗0.52∗∗-0.85∗∗PAL活性PAL activity1.00-0.50∗∗0.53∗∗-0.25POD活性POD activity1.00-0.140.87∗∗Pro活性Pro activity1.00-0.32基茎周长 Stem circumference 1.00 PAL 是次生代谢物质合成过程中的关键酶,能促使植物体产生次生代谢物质抵抗病原菌的侵染,从而起到抗病作用,被认为是植物的防御酶之一。研究认为 PAL 活性与植物的抗病性呈正相关[11]。而刘佳[12]在研究南瓜时发现,随着病害程度增加,PAL活性降低,并未显示出相关性,且染病比抗病植株活性高。本试验表明,4种病害程度核桃植株叶片和韧皮部PAL活性存在显著差异,与前人研究结果一致[13]。但轻度病害程度核桃植株叶片和中度病害程度茎韧皮部PAL活性分别达到最高,这与前人研究不同,可能是因为叶片对于腐烂病病菌侵染更为敏感,叶片缺少合成PAL前体物质,而茎的韧皮部截留或富集一定量合成PAL前体的物质,如木质素、黄酮、异黄酮、生物碱。另外一方面,植物为抵抗外界生物胁迫,优先将抗性物质输送至病害或者潜在病害处。 POD作为一种植物抗性酶,其活性一定程度可以反映植物的抗病性[14]。陈臻等[15]研究了黄腐酸对苹果腐烂病防御酶POD活性影响,试验结果表明,其活性先上升后降低。但也有研究认为二者没有显著线性或负相关关系:如刘普等[16]认为,梨树腐烂病病害程度与枝条韧皮部POD酶活性无显著关系;张新慧等[17]发现,连作后当归叶片POD酶活性降低。本试验表明,POD酶活性与核桃腐烂病病斑面积呈极显著负相关,这与张新慧等[17]研究结果相同。Pro含量及活性的变化能够表征植物抗逆性。湛蔚等[18]发现,菌根诱导下杨树病害部位Pro含量显著降低,表明病害程度可能与Pro含量存在正相关关系。本试验也发现随着病害程度增加,Pro活性显著提高。 本研究显示,腐烂病与核桃生长势呈极显著负相关,与多数研究结果一致。吴玉霞等[19]研究发现,梨树生长势增强,腐烂病发病率显著降低。樊祥伦[20]通过调查指出:减轻枝干伤疤从而增强树势可以降低病害发生。亦有研究显示:苹果腐烂病发生程度与树势相关[21]。冯雷等[22]研究了核桃腐烂病发病程度与核桃体内元素比例关系,矿质元素P/K<0.28,核桃植株长势更好,未见病菌进一步侵染。李美美等[23]通过修剪方式控制树势,降低了腐烂病发病率。因此说明,增强树势可显著降低植物病害发病程度。 通过分析不同病害程度植株叶片,病害部位抗氧化酶,结果显示,叶片POD和Pro活性均可指示腐烂病侵染过程,叶片POD活性能更好反映核桃腐烂病发生过程。通过增强核桃植株长势可以降低腐烂病侵染程度。 [1] 张天勇. 核桃腐烂病发生规律及防治技术[J]. 陕西林业科技,2012(3):78-79,82.doi:10.3969/j.issn.1001-2117.2012.03.024. Zhang T Y. Techniques to control and prevent rot in walnut[J]. Shaanxi Forest Science and Technology,2012(3):78-79,82. [2] 张志华,刘新彩,王红霞,高仪,赵悦平. 核桃IOD和POD酶活性与生长势的关系[J]. 园艺学报,2006,33(2):229-232.doi:10.3321/j.issn:0513-353X.2006.02.002. Zhang Z H,Liu X C,Wang H X,Gao Y,Zhao Y P. Studies on the relationship between the POD and IOD activity and the growth vigor of walnut[J]. Acta Horticulturae Sinica,2006,33(2):229-232. [3] 周斌,张金龙,冯纪年,王敦. 短期低温胁迫对核桃抗氧化酶活性的影响[J]. 西北林学院学报,2015,30(3):51-53,65. doi:10.3969/j.issn.1001-7461.2015.03.09. Zhou B,Zhang J L,Feng J N,Wang D. Antioxidant enzymes activities of walnut tree under short term cold stress[J]. Journal of Northwest Forestry University,2015,30(3):51-53,65. [4] 相昆,张美勇,徐颖,王晓芳,岳林旭. 不同核桃品种耐寒特性综合评价[J]. 应用生态学报,2011,22(9):2325-2330. doi:10.13287/j.1001-9332.2011.0328. Xiang K,Zhang M Y,Xu Y,Wang X F,Yue L X.Cold-tolerance of walnut cultivars:A comprehensive evaluation[J]. Chinese Journal of Applied Ecology,2011,22(9):2325-2330. [5] Biggs A R,Miles N W. Association of suberin formation in uninoculated wounds with susceptibility to Leucostoma cincta and L. persoonii in various peach cultivars[J]. Phytopathology,1988,78(8):1070-1074. doi:10.1094/Phyto-78-1070. [6] 孙广宇,卫小勇,孙悦,肖云学,商圣平,朱明旗,郭云忠.苹果树腐烂病发生与叶片营养成分的关系[J]. 西北农林科技大学学报(自然科学版),2014,42(7):107-112,121. doi:10.13207/j.cnki.jnwafu.2014.07.008. Sun G Y,Wei X Y,Sun Y,Xiao Y X,Shang S P,Zhu M Q,Gho Y Z. Relationship between occurrence of apple Valsa canker and leaf nutrients[J]. Journal of Northwest A&F University(Natural Science Edition),2014,42(7):107-112,121. [7] 袁朝兴,丁静. 水分胁迫对棉花叶片中IAA从含量、IAA氧化酶和过氧化物酶活性的影响[J]. 植物生理学报,1990,16(2):179-180. Yuan C X,Ding J. Effects of water stress on the content of IAA and the activities of IAA oxidase and peroxidase in cotton leaves[J].ACTA Phytophysiologia Sinica,1990,16(2):179-180. [8] 张殿忠,汪沛洪,席连喜.干物质累积和脯氨酸累积的水势阈值与小麦抗旱性的关系[J]. 干旱地区农业研究,1990(2):66-71. Zhang D Z,Wang P H,Xi L X. Relationship between dry matter accmulication and water potential threshold of free proline accmulication and wheat resistance to drought[J]. Agricultural Research in the Arid Areas,1990(2):66-71. [9] 王敬文,薛应龙. 植物苯丙氨酸解氨酶的研究 Ⅰ.植物激素对甘薯块根苯丙氨酸解氨酶和肉桂酸4-羟化酶活性变化及其伴随性的影响[J]. 植物生理学报,1981,7(4):373-380. Wang J W,Xue Y L. Studies on plant phenylalanine ammonia-lyase Ⅰ.the effect of phytohormone on the increase in phenylalanine ammonia-lyase(PAL)and cinnamic acid 4-hydroxylase(CA4H)activity and the sequence of concomitant changes of enzyme activities in sweet potato root tuber discs[J]. ACTA Phytophysiologia Sinica,1981,7(4):373-380. [10] Koukol J,Conn E E. The metabolism of aromatic compounds in higher plants. IV. Purification and properties of the phenylalanine deaminase of Hordeum vulgare[J]. Journal of Biological Chemistry,1961,236(10):2692-2698. [11] 徐建华,利容千,王建波. 黄瓜不同抗病品种感染镰刀菌枯萎病菌后几种酶活性的变化[J]. 植物病理学报,1995,25(3):239-242. doi:10.1007/BF02007173. Xu J H,Li R Q,Wang J B. Some changes of enzyme activities from susceptible and resistance cucumber cultivars after inoculation with cucumber Fusarium wilt[J]. Acta Phytopathologica Sinica,1995,25(3):239-242. [12] 刘佳. 美洲南瓜苯丙氨酸解氨酶(PAL)基因克隆、表达分析及品种抗灰霉病研究[D].兰州:甘肃农业大学,2013. Liu J. Cloning and expression analysis of phenylalanine ammonia-lyase(PAL)gene in American pumpkin and study on its resistance to grey mould[D].Lanzhou:Gansu Agricultural University,2013. [13] 马静芳,李敏权,张自和,柴兆祥. 苯丙氨酸解氨酶与苜蓿种质根和根颈腐烂病抗病性研究[J]. 草业学报,2003,12(4):35-39. doi:10.3321/j.issn:1004-5759.2003.04.007. Ma J F,Li M Q,Zhang Z H,Chai Z X. Study on relationship between phenylalanine ammonia-lyase(PAL)and resistance to crown and root rot in alfalfa cultivars [J]. Acta Prataculturae Sinica,2003,12(4):35-39. [14] 程鹏,徐鹏飞,范素杰,靳立梅,吴俊江,王金生,张淑珍. 野生大豆接种大豆疫霉根腐病菌后过氧化物酶(POD)活性变化[J]. 大豆科学,2013,32(2):197-201. doi:10.3969/j.issn.1000-9841.2013.02.013. Cheng P,Xu P F,Fan S J,Jin L M,Wu J J,Wang J S,Zhang S Z. Response of POD activity in glycine soja inoculated by phytophthora sojae[J]. Soybean Science,2013,32(2):197-201. [15] 陈臻,侯宝宏,王卫雄,徐秉良. 黄腐酸处理对苹果树腐烂病菌的抑制作用及对苹果树防御酶活性的影响[J]. 植物保护,2016,42(3):81-86,103. doi:10.3969/j.issn.0529-1542.2016.03.013. Chen Z,Hou B H,Wang W X,Xu B L. Inhibition of fulvic acid to Valsa mali and its effect on the activity of defense enzyme in apple tree[J]. Plant Protection,2016,42(3):81-86,103. [16] 刘普,施圆圆,叶振风,衡伟,贾兵,刘莉,张水明,朱立武. 梨树腐烂病研究进展[J]. 安徽农业大学学报,2014,41(4):695-700.doi:10.13610/j.cnki.1672-352x.20140620.027. Liu P,Shi Y Y,Ye Z F,He W,Jia B,Liu L,Zhang S M,Zhu L W. Research progress in pear Valsa canker [J]. Journal of Anhui Agricultural University,2014,41(4):695-700. [17] 张新慧,张恩和,王惠珍,郎多勇. 连作对当归生长的障碍效应及机制研究[J]. 中国中药杂志,2010,35(10):1231-1234.doi:10.4268/cjcmm20101003. Zhang X H,Zhang E H,Wang H Z,Lang D Y. Effects of continuous cropping obstacle on growth of Angelica sinensis and its mechanism[J]. China Journal of Chinese Materiamedica,2010,35(10):1231-1234. [18] 湛蔚,刘洪光,唐明. 菌根真菌提高杨树抗溃疡病生理生化机制的研究[J]. 西北植物学报,2010,30(12):2437-2443. Zhan W,Liu H G,Tang M. Physiological and biochemical mechanism of mycorrhizal fungi improving the resistance of poplar to canker disease[J]. Acta Botanica Boreali-occidentalia Sinica,2010,30(12):2437-2443. [19] 吴玉霞,何天明,李疆,刘博,马少兴,周梦新,李芳芳. 高位嫁接提高库尔勒香梨越冬性的初步研究[J].西北农业学报,2012,21(6):129-133.doi:10.7606/j.issn.1004-1389.2012.6.025. Wu Y X,He T M,Li J,Liu B,Ma S X,Zhou M X,Li F F. Increasing cold hardiness of kuerle fragrant pear(Pyrus bretschneideri) by Top-grafting[J]. Acta Agriculturae Boreali-occidentalis Sinica,2012,21(6):129-133. [20] 樊祥伦. 果树除萌和摘心减轻腐烂病发生[J].北方园艺,1990(8):24. Fan X L. Fruit tree desprout and heart pick reduce the occurrence of putrefaction[J]. Northern Horticulture,1990(8):24. [21] 肖云学. 苹果树腐烂病发生影响因素及防治研究[D].杨凌:西北农林科技大学,2013. Xiao Y X. Study on the influencing factors and prevention of apple tree rot[D].Yangling:Northwest A&F University,2013. [22] 冯雷,徐万里,薛权宏,唐光木,孙宁川,顾玉忠. 矿质元素对核桃腐烂病病害程度的影响[J].经济林研究,2017,35(4):49-56. doi:10.14067/j.cnki.1003-8981.2017.04.008. Feng L,Xu W L,Xue Q H,Tang G M,Sun N C,Gu Y Z.Effects of mineral elements on harm degree of Juglans regia canker[J].Nonwood Forest Research,2017,35(4):49-56. [23] 李美美,马华冰,宋新英,齐国辉,李保国. 不同修剪措施对成龄‘绿岭’核桃抗腐烂病能力及树势的影响[J]. 经济林研究,2014(3):61-67.doi:10.3969/j.issn.1003-8981.2014.03.010. Li M M,Ma H B,Song X Y,Qi G H,Li B G. Effects of different pruning methods on rot disease resistant and tree vigor of adult ′Lvling′ walnut[J]. Nonwood Forest Research,2014(3):61-67.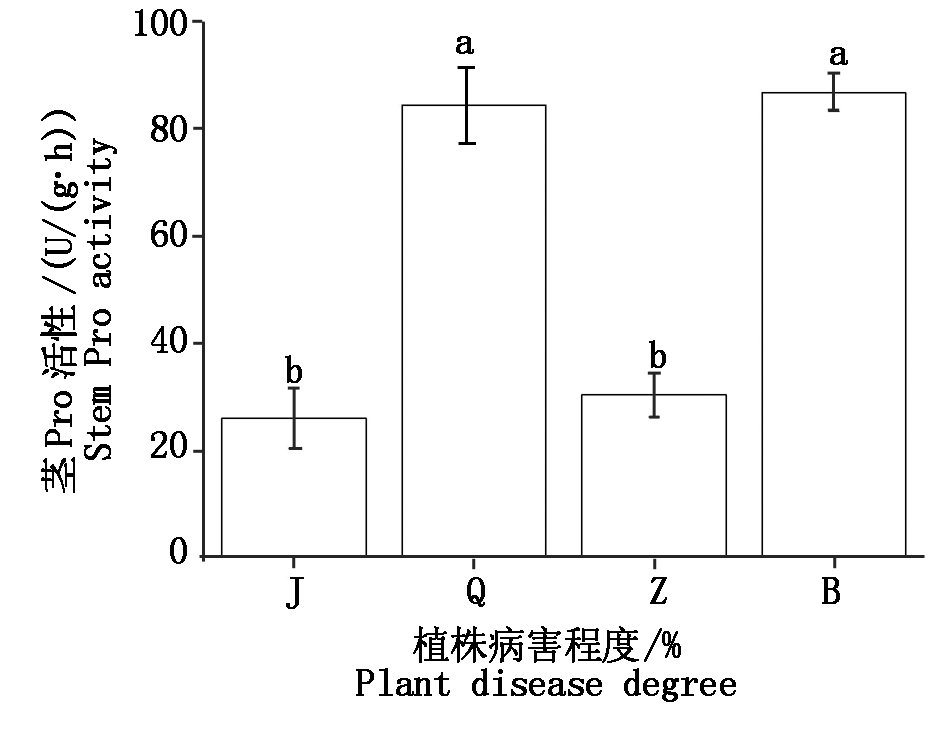
Fig.8 Comparative with Pro activity of stem at different levels of Jugladis canker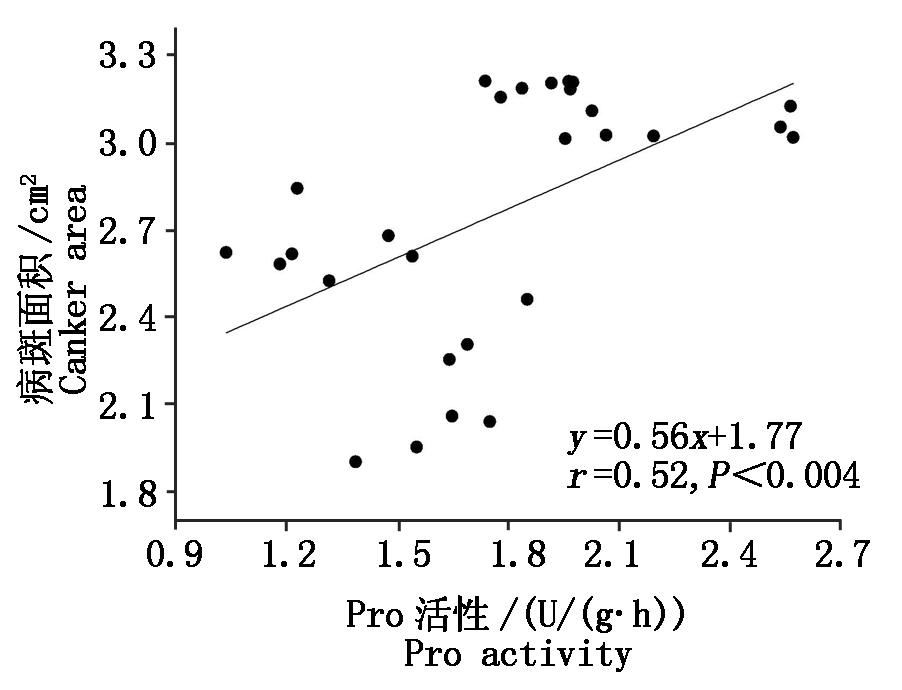
Fig.9 Linear regression analysis with Jugladis canker area and Pro activity of leaf
Fig.1 Pearson correlation Jugladis canker with PAL,POD,Pro activity and stem circumference
3 结论与讨论