谷子(Setaria italica)起源于中国,具有悠久的种植历史。谷子是一种抗旱耐瘠、粮草兼用、富含营养的特色杂粮作物,可用于提升干旱地区粮食产量、发展畜牧业和改善人们膳食结构[1-2]。谷子线虫病是华北谷子产区的重要病害,在河北中南部、山东、河南等夏谷区普遍发生,严重地块可减产50%~80%,是当前谷子高产稳产的主要障碍之一[3]。由于谷子种子调运频繁、抗病品种培育困难、主要栽培品种均为感病品种等因素影响,在我国谷子产区谷子线虫病蔓延的趋势日益加剧[4]。谷子线虫病又称紫穗病或者倒青,病原菌为贝西滑刃线虫(Aphelenchoides besseyi Christie, 1942),是一种迁移性植物寄生线虫[5]。谷子线虫病的传播主要依赖于带病种子,线虫会伴随着植株的生长逐渐由植株的地下部分转移到地上部分,主要为害花器、子房,影响穗的发育,造成谷子大量减产[3, 6]。
谷子线虫为种传病害,应从选种初期进行筛选与防控,切断传播病害的源头,因此对种子进行带线虫检测尤为重要。崔丽丽等[7]采用马铃薯葡萄糖琼脂培养基(PDA)平板法和纸培养法,检测到吉林省北五味子种子携带有青霉属、曲霉属和根霉属病菌;赵芝等[8]对采自云南省的15份三七种子样品,采用PDA平板法检测到种子表面和内部携带多种真菌;胡晓芬等[9]采用盆栽幼苗症状观察法和PDA培养基法,对7个玉米品种进行了种子表面带菌检测,结果检测到供试种子表面携带有4种真菌;高苇等[10]用洗涤法和PDA平板法,对12个黄瓜栽培品种进行种子外部和内部带菌检测,结果显示供试种子外部带菌量高于种子内部寄藏真菌;金柳艳等[11]对黄淮海夏玉米区720个玉米籽粒样品带菌量进行检测,采用洗涤检测法和PDA平板检测法,发现表面无症状的玉米籽粒在成熟期均携带大量病原菌。目前,关于种子带菌检测的报道中很多试验者都采用PDA平板法[12]对籽粒的带菌率与分离到菌属的分离频率进行统计,且对分离得到的菌属进行分类鉴定。此检测方法在平板培养过程中易受杂菌的干扰,且鉴定结果还需要进行再接种的生物学试验进一步确定,如有大量的样品需要检测时,耗时费力[13]。
由于滑刃属线虫种类繁多,形态特征复杂多变,且与其近似种十分相似,利用传统方法对贝西滑刃线虫进行形态学鉴定,需要扎实的分类鉴定功底,因此,传统检测方法有一定的局限性。随着分子生物学技术的快速的发展,基于PCR技术的分子检测技术以其特异性强、灵敏度高、检测快速、简捷且鉴定结果准确等优势,已被用于种子中植物病原菌的检测[13-21]。宋顺华等[13]通过优化PCR模板的方法,利用传统的PCR技术,检测出西瓜种子带有细菌性果腐病菌;任毓忠等[22]采用特异性引物PCR技术检测出8个市售哈密瓜品种的种子携带有瓜类果斑病菌;曾丹丹等[23]采用环介导等温扩增技术对黄淮地区29个大豆主栽品种种子进行带菌检测,检测出多种病原菌;张贵等[24]利用巢氏聚合酶链式反应,检测出向日葵种皮中携带有黄萎病菌。在种子带菌检测中PCR的方法呈现出快速、简捷且鉴定结果可靠的优点,因此可用于谷子种子带菌的检测。在谷子中利用PCR技术检测种子携带线虫的报道还极少。因此,本研究以来自黑龙江、吉林、辽宁、内蒙古、河北、山东、山西和陕西等谷子主产区的99份谷子种子DNA为模板,使用已报道的1对贝西滑刃线虫PCR特异性引物进行PCR扩增[21],快速检测谷子种子是否带有贝西滑刃线虫,并分析线虫种群的单倍型数目和变异位点,旨在为谷子种子携带线虫进行快速鉴定提供技术支持,为谷子线虫病的早期诊断与防控奠定理论基础。
1 材料和方法
试验于2018年4-8月在河北省农林科学院谷子研究所河北省杂粮重点实验室完成。
1.1 试验材料
供试的谷子线虫病穗,由河北省农林科学院谷子研究所植保室保存;99份谷子种子来自黑龙江、吉林、辽宁、内蒙古、河北、山东、山西和陕西等国家谷子高粱产业体系育种岗位、试验站和种子公司,具体信息详见表1。
表1 99份供试谷子品种编号及来源
Tab.1 Numbers and origins of the 99 tested foxtail millet varieties

省(自治区、直辖市)Province(Autonomous region,municipality)市/县City/county品种编号 Cultivar number山东 Shandong章丘 C1济南 C2, C3, C4, C5内蒙古Inner Mongolia呼和浩特C6, C7, C65松山C13, C14, C15, C16, C17, C18, C19, C20, C21, C22, C25, C26, C27, C28, C29, C30, C31敖汉旗 C32, C63, C64喀喇沁旗 C23, C24, C33巴林左旗C34, C35, C36黑龙江 Heilongjiang宾县 C37道外C38, C39, C40, C41, C42, C43, C44, C45陕西 Shaanxi 宝塔C55, C56, C57甘泉 C58神木C66榆阳 C67山西 Shanxi 石楼 C59兴县 C62平遥 C60榆社 C80汾阳 C61榆次C81, C82吉林 Jilin通榆C95, C98吉林C96, C97九台C99河北 Hebei邢台 C80深州C9, C11枣强C10桃城 C12邯郸C46, C47, C48, C49, C50, C51, C52, C53, C54张家口C68, C69, C70, C71, C72, C73, C74, C75, C76, C77, C78辽宁 Liaoning朝阳C87, C88, C89, C90, C91, C92, C93, C94海南 Hainan三亚 C79, C83, C84, C85, C86
1.2 试验方法
1.2.1 谷子种子基因组DNA的提取 使用植物基因组DNA提取试剂盒(北京天根生化科技有限公司,DP321-03)提取谷子种子基因组DNA,试验步骤参照试剂盒说明书。分别采用琼脂糖凝胶电泳、Nanodrop方法检测DNA样品的完整性、纯度和浓度,选择合格的DNA样品进行PCR扩增。
1.2.2 引物的特异性检测 采用已报道的根据贝西滑刃线虫核糖体28S rRNA-D2/D3片段设计的特异性引物[21]:GU-F(GACACTGCAATCGCTTCGAC)/GU-R(ATCCGCAACCACAACTCACA),以谷子贝西滑刃线虫和其他4种谷子籽粒上常见的病原菌:谷子锈菌(Uromyces setariae-italicae)、谷瘟病菌(Pyricularia setariae)、白发病菌(Sclerospora graminicola)和粟粒黑穗病菌(Ustilago crameri)DNA为模板进行PCR扩增,检测引物的特异性。PCR反应体系为25 μL,2 × Es Taq Master Mix 12.5 μL(北京康为世纪生物科技有限公司,CW0690)、模板DNA 2.0 μL、上下游引物各1 μL(浓度10 μmol/L)、超纯水补足。PCR扩增程序:94 ℃预变性 2 min;35个循环反应(94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s),72 ℃延伸5 min。PCR产物用1.2%琼脂糖凝胶进行电泳检测。电泳缓冲液为1×TAE,恒定电压160 V,电泳20 min,用EB染色并在紫外凝胶成像仪上观察电泳条带并且拍照。
1.2.3 引物的灵敏度检测 将谷子线虫DNA用灭菌超纯水稀释为初始质量浓度10 ng/μL,按(1,1/10,1/20, 1/40,1/80,1/160)共6个浓度梯度,分别稀释成10.0,1.0,0.5,0.25,0.125,0.062 5 ng/μL。以不同浓度的DNA为模板,采用PCR检测体系进行扩增,检测特异性引物的灵敏度。
1.2.4 28S核糖体RNA序列PCR扩增和测序 利用贝西滑刃线虫特异性引物GU-F/GU-R对谷子种子基因组DNA进行PCR扩增,总反应体系为25 μL,反应程序:94 ℃预变性 2 min;35个循环反应(94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸20 s),72 ℃延伸5 min。用1.2%的琼脂糖凝胶电泳检测,并回收目的条带。按照凝胶DNA小量回收试剂盒(美基生物科技有限公司,D2111-03)的步骤将切胶回收的目的片段与pMD19-T载体连接,将连接产物转化大肠杆菌感受态细胞(DH5α),把经菌落PCR筛选的阳性克隆菌液送至上海生工测序。每个样品测序3次,3次测序结果吻合的样品进行数据分析。利用Sequencher_v4.1.4 软件读取测序的序列,观察峰值进行反复校对,利用DNAMAN_v6、ClustalX1.81[25]软件对测得的序列进行分析,并与从GenBank上下载贝西滑刃线虫28S核糖体RNA序列进行多序列同源比对,分析单倍型数目和变异位点。
2 结果与分析
2.1 引物的特异性检测
利用谷子贝西滑刃线虫的特异性引物GU-F/GU-R,以谷子贝西滑刃线虫和4种谷子籽粒上常见的病原菌(谷锈菌、谷瘟病菌、白发病菌和粟粒黑穗病菌)DNA为模板进行PCR扩增,以验证引物的特异性。结果如图1所示,该引物仅能对谷子贝西滑刃线虫DNA扩增出约245 bp的特异性片段,其他病原菌DNA与阴性对照(ddH2O)则无条带出现。将特异性片段进行回收纯化和测序,与GenBank数据库中贝西滑刃线虫的28S核糖体RNA序列(登录号:KX622689.1)进行比对分析,可知245 bp特异性片段的序列与贝西滑刃线虫序列完全匹配,说明引物GU-F/GU-R能够特异的检测出谷子贝西滑刃线虫。
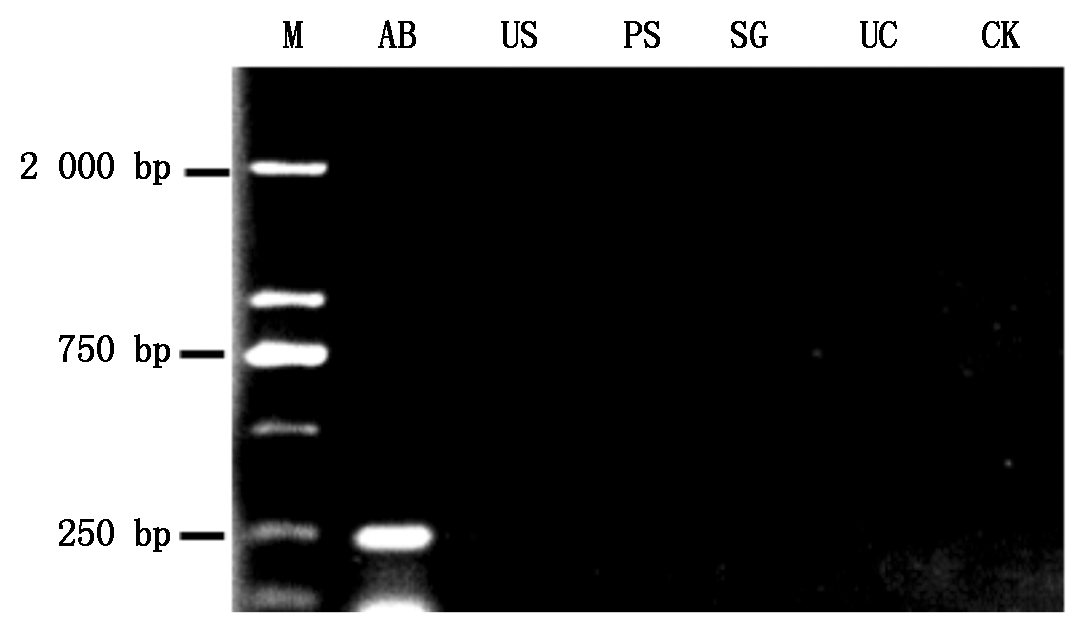
M.Marker;AB.谷子贝西滑刃线虫;US.谷锈菌;PS.谷瘟病菌;SG.白发病菌;UC.粟粒黑穗病菌;CK.阴性对照(ddH2O)。
M.Marker;AB.Aphelenchoides besseyi;US.Uromyces setariae-italicae;PS.Pyricularia setariae;SG.Sclerospora graminicola;UC.Ustilago crameri;CK.Negative control(ddH2O).
图1 贝西滑刃线虫特异性引物GU-F/R的检测结果
Fig.1 Detection results of Aphelenchoides besseyi specific primer GU-F/R
2.2 引物的灵敏度检测
利用谷子贝西滑刃线虫的特异性引物,以谷子线虫DNA稀释后不同质量浓度的DNA(10.0, 1.0, 0.5, 0.25, 0.125, 0.0625ng/μL)为模板进行PCR扩增,以检测特异性引物的灵敏度。结果如图2,模板浓度为10 ng/μL时,扩增条带清晰且明亮。质量浓度为1 ng/μL(1/10×)和0.5 ng/μL(1/20×)时,扩增条带依然清晰可见。稀释至0.125 ng/μL(1/80×)时,条带亮度下降,但仍可判别。质量浓度为0.062 5 ng/μL(1/160×)时,特异性条带基本消失。表明贝西滑刃线虫特异性引物对线虫DNA检测灵敏度较高,即使DNA浓度较低时,仍保持较高的检测效率。线虫DNA模板量为0.125 ng/μL是引物的最低检测浓度。
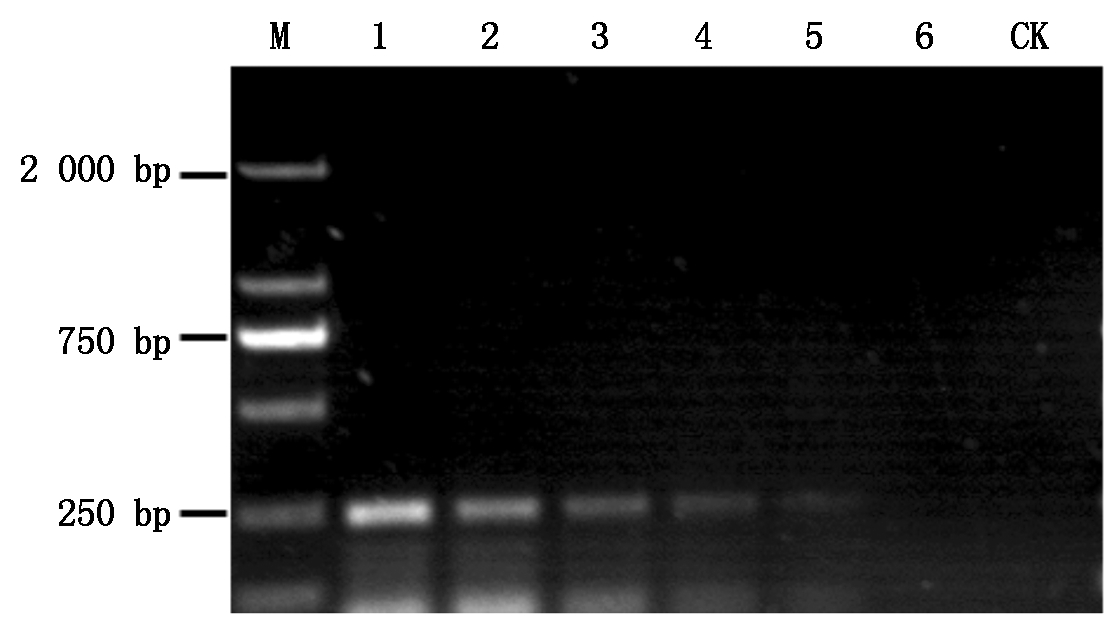
M.Marker;1-6.(1×,1/10×,1/20×,1/40×,1/80×,1/160×);CK.阴性对照(ddH2O)。
M.Marker;1-6.(1×,1/10×,1/20×,1/40×,1/80×,1/160×);CK. Negative control(ddH2O).
图2 谷子贝西滑刃线虫PCR引物灵敏度检测结果
Fig.2 Sensitivity of PCR for detection of Aphelenchoides besseyi

M.Marker;CK+.贝西滑刃线虫;CK-.ddH2O;C1~C99.品种编号。
M.Marker;CK+. Aphelenchoides besseyi;CK-.ddH2O;C1-C99.Cultivar numbers.
图3 不同品种谷子种子DNA GU-F/R引物的PCR扩增
Fig.3 PCR products of seed DNA from different foxtail millet varieties using primer GU-F/R
2.3 谷子种子携带贝西滑刃线虫及其频率的检测
将采自黑龙江、吉林、辽宁、内蒙古、河北、山东、山西和陕西等地的99份谷子种子样本进行基因组DNA提取,利用PCR技术,对籽粒上的贝西滑刃线虫进行扩增检测。结果如图3所示,99份种子样品中有33份扩增出特异性条带,阴性对照(ddH2O)无条带。对扩增条带进行TA克隆并选择阳性克隆进行测序。将测序结果与贝西滑刃线虫28S核糖体RNA序列(KX622689.1)进行比对,除C40样品的序列为97%以外,其他所有序列与其相似性为99%及以上。结果表明,本研究建立的PCR体系具有良好的准确性与稳定性,可用于谷子种子中贝西滑刃线虫的检测。
表2 不同地区谷子品种种子带病频率的检测结果
Tab.2 Contamination rate of different foxtail millet cultivars detected
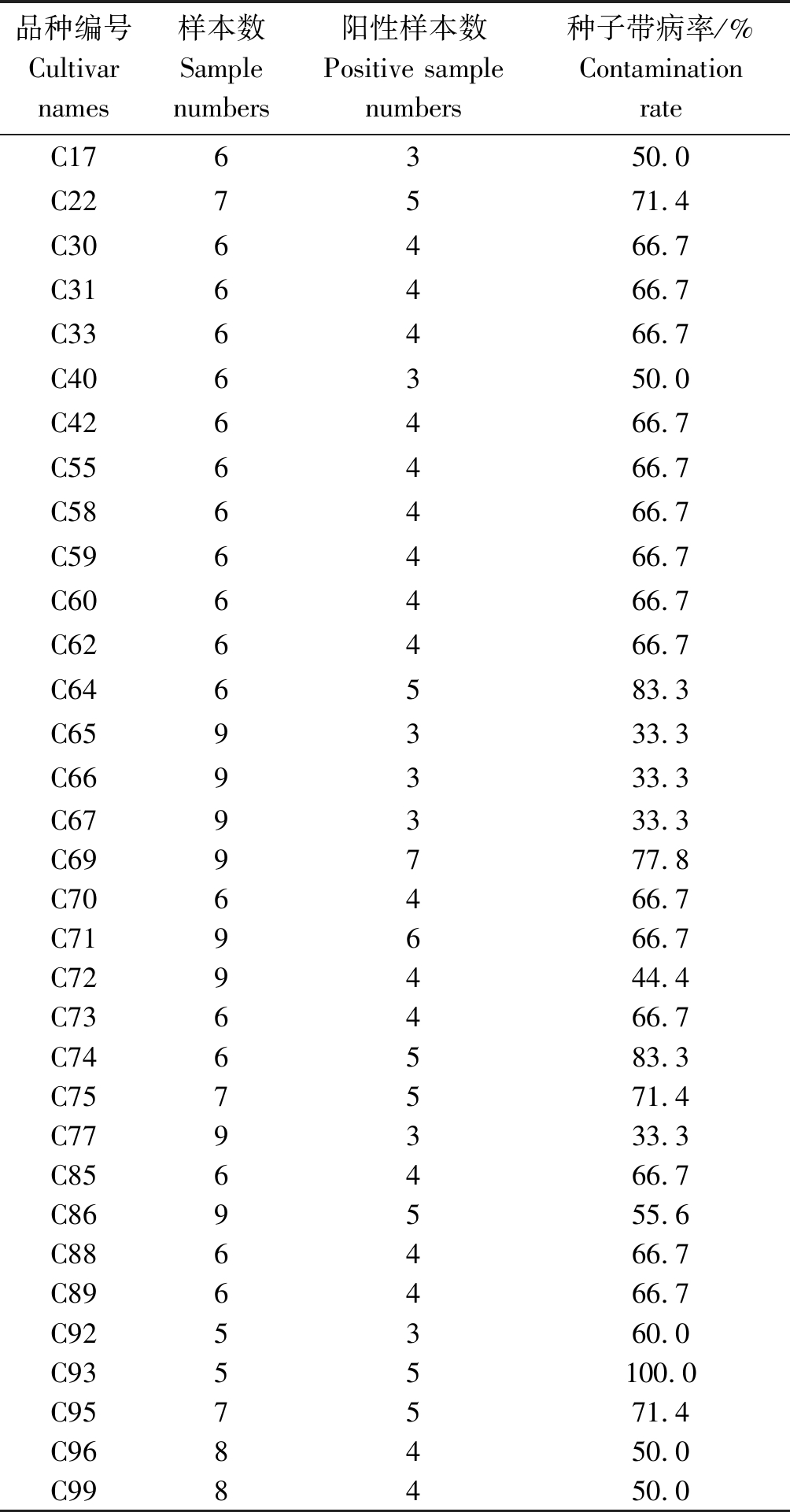
品种编号Cultivar names样本数Sample numbers阳性样本数Positive sample numbers种子带病率/%Contamination rateC176350.0C227571.4C306466.7C316466.7C336466.7C406350.0C426466.7C556466.7C586466.7C596466.7C606466.7C626466.7C646583.3C659333.3C669333.3C679333.3C699777.8C706466.7C719666.7C729444.4C736466.7C746583.3C757571.4C779333.3C856466.7C869555.6C886466.7C896466.7C925360.0C9355100.0C957571.4C968450.0C998450.0
为了确定谷子不同品种籽粒携带贝西滑刃线虫的频率,对99份谷子种子的带病率进行了重复检测。结果显示,33份谷子种子带有贝西滑刃线虫,与之前检测结果一致,阳性重复率100%。将33份阳性谷子带贝西滑刃线虫频率进行了统计,其中,C93带病率最高,为100%;C65、C66、C67和C77共4份谷子品种带病率最低,仅为33.3%;其余供试的谷子种子带病率介于二者之间(表2)。33份带贝西滑刃线虫的谷子品种大部分来自春谷区(图4),在黑龙江、吉林、辽宁、内蒙古、陕西、山西、河北张家口这些地区均检测到,而来自海南的5份种子中检测到2份带贝西滑刃线虫。
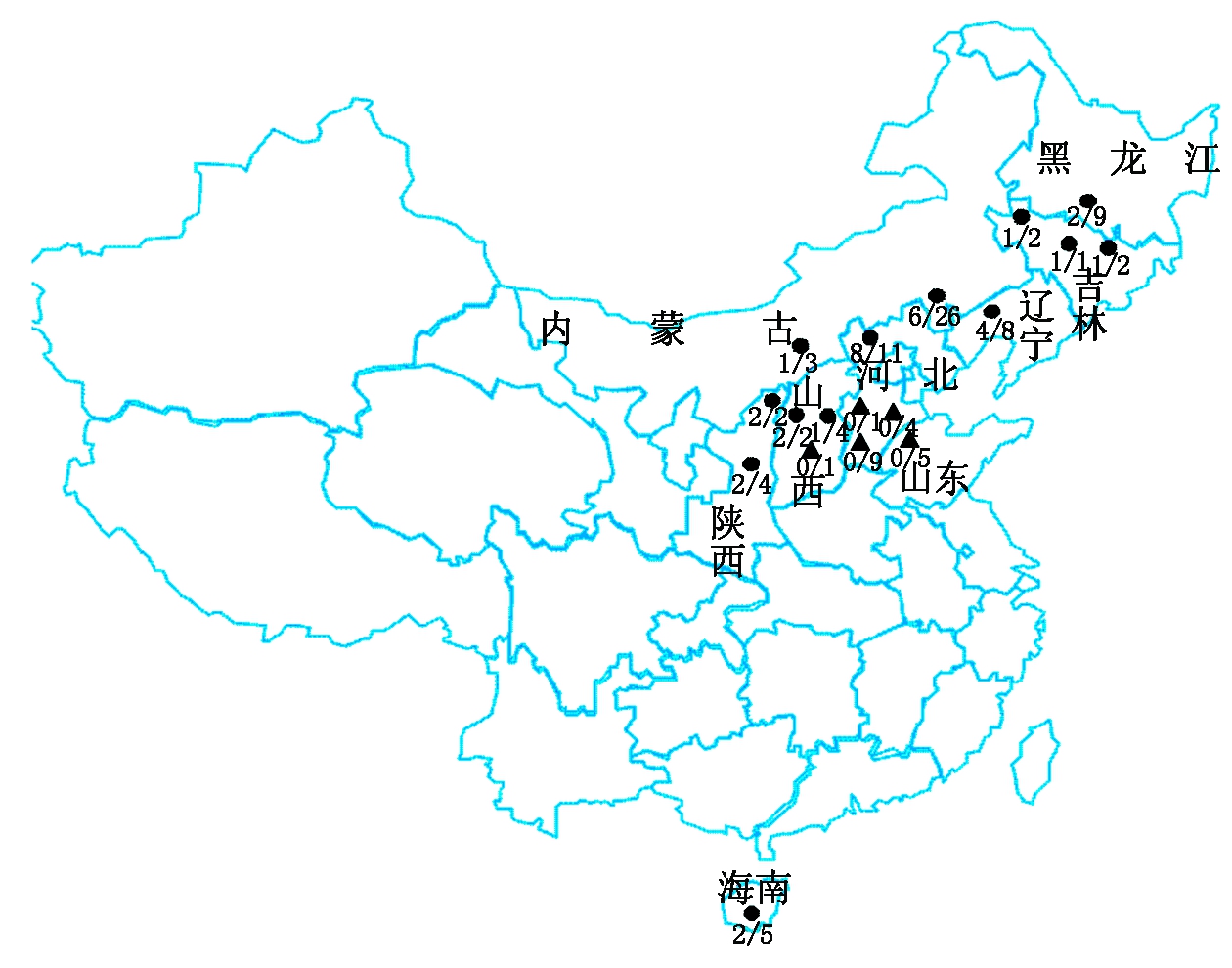
三角形和圆形表示样本所在地区,圆形表示具有阳性样本的地区;分数表示该地区阳性样本数占样本数的比值。
The triangle and round indicate the location of the sample, and the round indicates positive samples;The score represents the ratio of positive samples to the total samples in the area.
图4 带贝西滑刃线虫的谷子品种地理分布图
Fig.4 Geographical distribution map of foxtail millet varieties with Aphelenchoides besseyi
2.4 贝西滑刃线虫28S核糖体RNA序列的分析
对33份阳性种子携带的贝西滑刃线虫28S核糖体RNA序列进行多态性分析,结果如表3所示。贝西滑刃线虫基因种内多态性位点有29个,其中多变异位点3个,这些突变以A-G/T-C之间的转换为主。贝西滑刃线虫种内变异率为11.8%,基因中的GC含量为56.3%~57.1%,平均为56.7%,无明显的碱基偏向性。
对33份贝西滑刃线虫样本序列进行分析,共检测出22种单倍型,分别命名为AB1-AB22,并进行单倍型的多样性分析,结果如表4。其中单倍型AB1出现的频率最高,在具有阳性样品的各省份中均可检测到该单倍型。其余的单倍型仅出现过一次,属于稀有单倍型。河北张家口和内蒙古松山区两地的遗传多样性最为丰富。
表3 贝西滑刃线虫样本单倍型的变异位点
Tab.3 Variation sites in haplotypes of Aphelenchoides besseyi
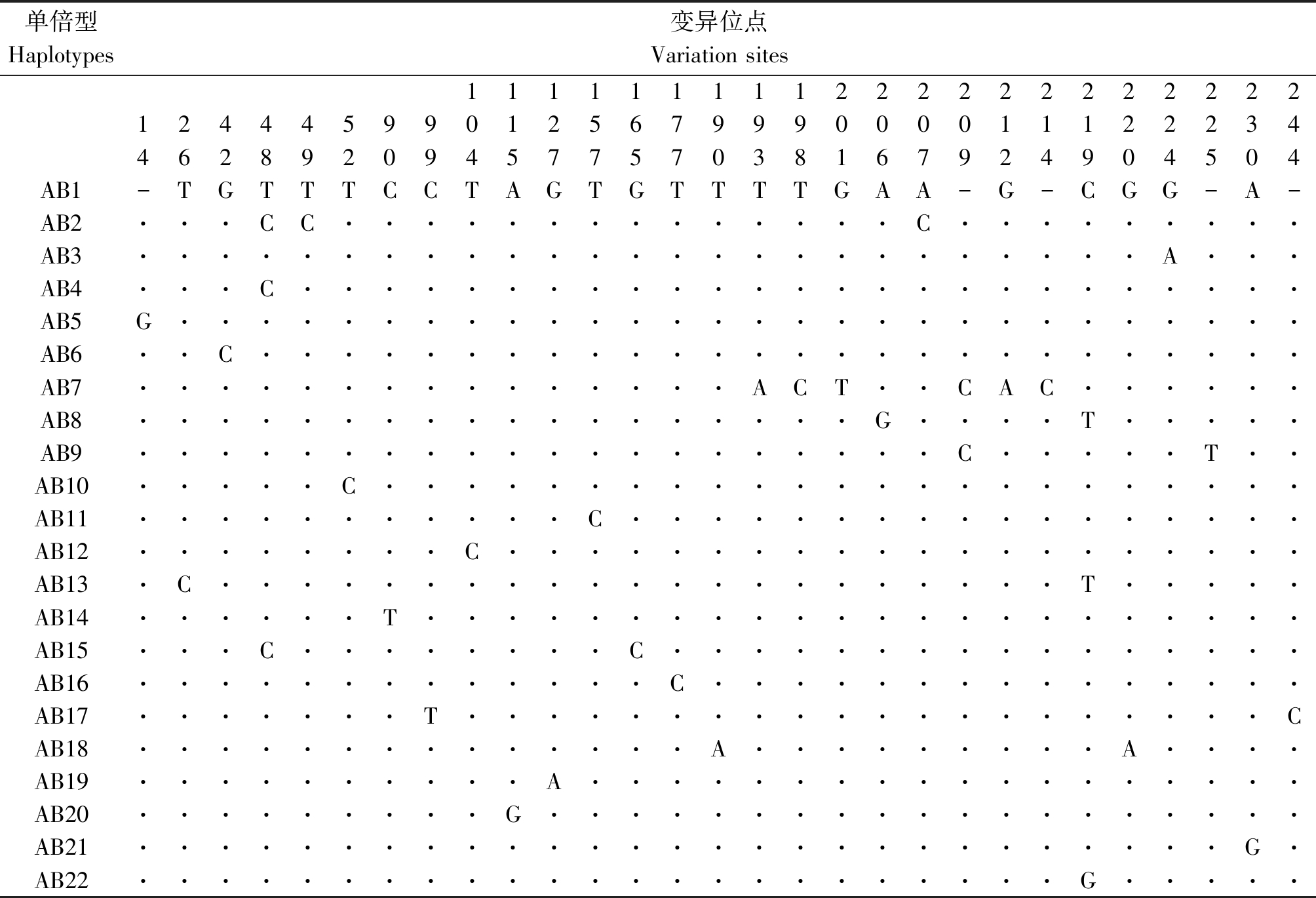
单倍型Haplotypes变异位点Variation sites1111111112222222222221244459901256799900001112223446289209457757038167924904504AB1-TGTTTCCTAGTGTTTTGAA-G-CGG-A-AB2···CC··············C·········AB3·························A···AB4···C·························AB5G····························AB6··C··························AB7···············ACT··CAC······AB8··················G····T·····AB9····················C·····T··AB10·····C·······················AB11···········C·················AB12········C····················AB13·C·····················T·····AB14······T······················AB15···C········C················AB16·············C···············AB17·······T····················CAB18··············A·········A····AB19··········A··················AB20·········G···················AB21···························G·AB22·······················G·····
注:AB1-AB22.贝西滑刃线虫单倍型(AB1 GenBank 登录号:KX622689.1;AB2-AB22 GenBank 登录号:MK204592-MK204612)。
Note: AB1-AB22.Haplotypes of Aphelenchoides besseyi(GenBank accession number of AB1: KX622689.1; GenBank accession number of AB2 to AB22: MK204592-MK204612).
表4 贝西滑刃线虫各地理种群单倍型统计
Tab.4 Phenotypic statistics in different geographical populations of Aphelenchoides besseyi
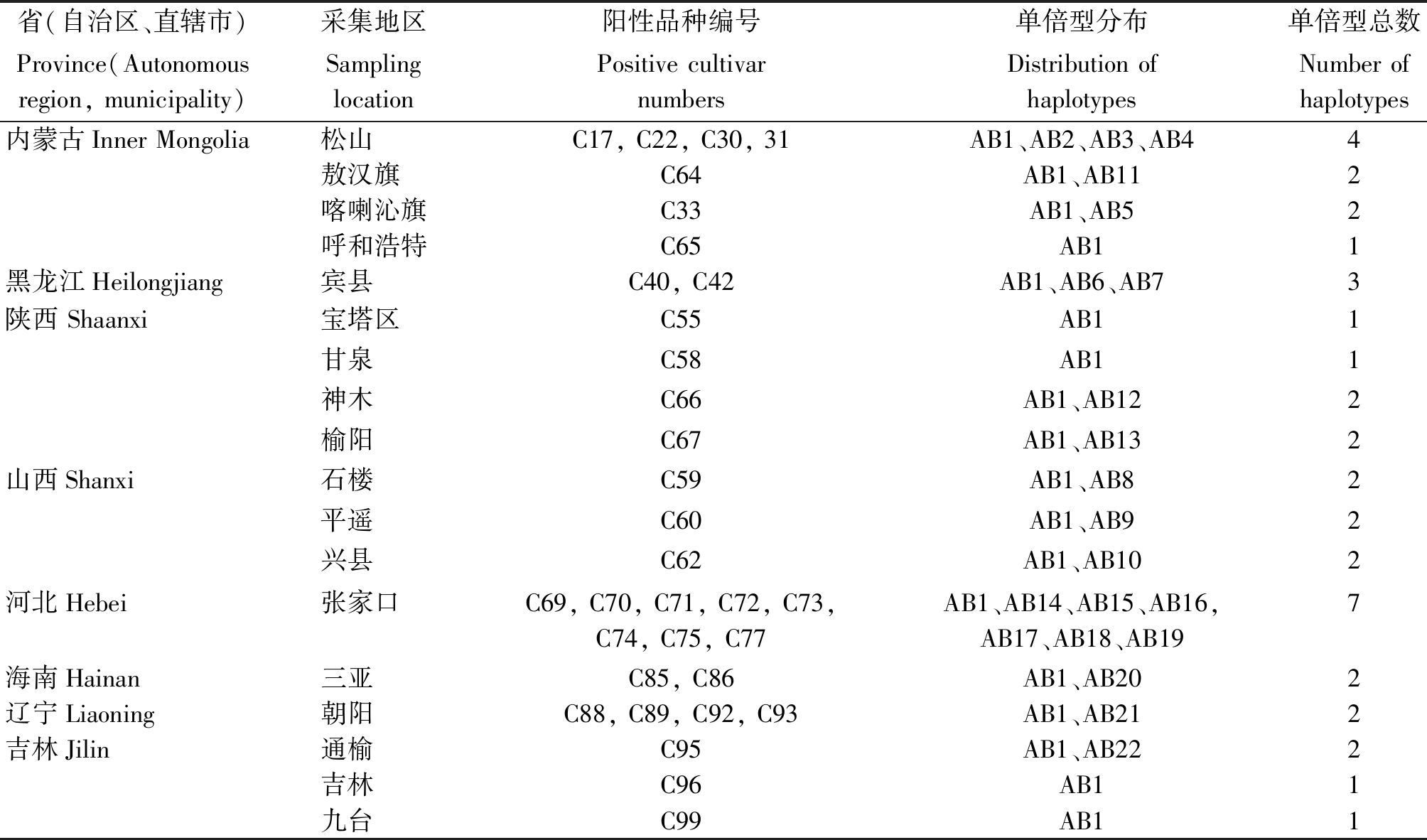
省(自治区、直辖市)采集地区阳性品种编号单倍型分布单倍型总数Province(Autonomous region, municipality)Sampling locationPositive cultivar numbersDistribution of haplotypesNumber of haplotypes内蒙古Inner Mongolia松山C17, C22, C30, 31AB1、AB2、AB3、AB44敖汉旗C64AB1、AB112喀喇沁旗C33AB1、AB52呼和浩特C65AB11黑龙江Heilongjiang宾县C40, C42AB1、AB6、AB73陕西 Shaanxi宝塔区C55AB11甘泉C58AB11神木C66AB1、AB122榆阳C67AB1、AB132山西Shanxi石楼C59AB1、AB82平遥C60AB1、AB92兴县C62AB1、AB102河北Hebei张家口C69, C70, C71, C72, C73, C74, C75, C77AB1、AB14、AB15、AB16, AB17、AB18、AB197海南Hainan三亚C85, C86AB1、AB202辽宁Liaoning朝阳C88, C89, C92, C93AB1、AB212吉林Jilin通榆C95AB1、AB222吉林C96AB11九台C99AB11
3 结论与讨论
本研究利用PCR技术对谷子种子是否携带贝西滑刃线虫进行了检测,这种快速检测方法来自贝西滑刃线虫双重PCR检测体系[21],该方法共设计2对引物:内标引物F194/AB28以及特异性引物GU-F/GU-R,同时进行扩增,能快速准确鉴定出贝西滑刃线虫。本研究中,选择其特异性引物GU-F/GU-R对谷子种子DNA进行检测,可准确扩增出阳性条带,经测序验证与贝西滑刃线虫序列完全匹配;同时也选择内标引物F194/AB28对种子DNA进行PCR扩增,扩增结果有2条大小不同的条带:其中750 bp条带匹配谷子序列,780 bp条带匹配假单胞菌属序列,测序比对结果均不匹配线虫序列,这一结果与双重PCR检测体系结果并不一致。
传统的PCR技术所使用的PCR模板,是采用CTAB方法从带菌种子上分离的病菌DNA,此方法比较繁琐, 也降低了PCR的灵敏度[13]。本试验初期,曾使用试剂盒和CTAB 2种方法提取种子DNA,经PCR扩增结果比对发现,使用CTAB法提取的种子DNA扩增出的阳性条带数量低于使用试剂盒提取的种子DNA扩增出的阳性条带数量,且结果重复性不稳定,因此,选择使用试剂盒来提取种子DNA。但种子中线虫DNA提取与检测效率容易受到线虫虫口数量和种子中杂质的影响,还需要对带病种子中线虫DNA的提取方法进行优化和改进。
董立等[4]对64份涵盖东北春谷区、西北春谷区和华北夏谷区的谷子品种进行线虫病抗性鉴定,发现大部分品种为感病品种。本试验利用PCR方法检测了99份谷子种子,33份种子检测到携带谷子贝西滑刃线虫,该样品主要来自春谷区,这与其研究结果是一致的;此外,董立等[4]研究中的晋谷21号是高感品种。在本研究中有来自4个不同地区的晋谷21号(C59、C60、C61、C62),除了C61未检测到贝西滑刃线虫外,其余3个地区的晋谷21检测结果呈阳性;对于晋谷21号的2种检测结果基本一致。
一些研究表明,谷子线虫病是夏谷区重要的病害[4,26-28],本研究结果发现除来自海南的C85(66.7%)和C86(55.6%)2个品种检测到贝西滑刃线虫外,在夏谷区(河北中南部和山东)并未检测到贝西滑刃线虫的存在。分析原因可能是,夏谷区线虫病发生严重的谷穗会呈现紫色,肉眼容易分辨,在收获时会舍弃病穗、留存健康穗的籽粒。这样会导致本试验来自夏谷区的样品大部分是健康籽粒,样品不携带线虫或携带的线虫虫口数量极少,线虫DNA相对于种子DNA浓度太低未检测到。今后要继续对夏谷区主推谷子品种种子进行线虫的检测,以了解夏谷区线虫初侵染来源及发生规律。
本研究初步分析了33份阳性样本的遗传多样性,从试验结果可以看出28S rRNA片段适合用于研究贝西滑刃线虫种群的遗传多样性。从研究结果可以看出,贝西滑刃线虫AB1出现频率最高,是优势单倍型。其他单倍型仅出现过一次,属于稀有单倍型。河北张家口和内蒙古松山区分别具有7,4种单倍型,说明两地贝西滑刃线虫的遗传多样性最为丰富。
种传病害是一类以种子带菌进行传播和扩散的病害,号称作物的“癌症”,均为系统性侵染病害。被侵染植株携带大量的病原菌,使种子带病为其远距离传播病害提供条件[4]。因此,种子带线虫的检测是防止该病害扩散的重要环节。本试验采用的PCR检测技术方法简单、快捷,只需要简单的PCR仪器即可完成;使用特异性引物GU-F/GU-R对贝西滑刃线虫的检测具有较高的特异性和准确性。该方法的推广可以加快线虫检测的进度,为种子线虫检测提供技术支持,有利于对谷子线虫病害的发生与传播进行防控,促进谷子产业的健康发展。
[1] 李顺国, 刘斐, 刘猛, 赵宇, 王慧军. 我国谷子产业现状、发展趋势及对策建议[J]. 农业现代化研究, 2014, 35(5):531-535. doi:10.13872/j.1000-0275.2014.000051.
Li S G, Liu F, Liu M, Zhao Y, Wang H J. The current industry situation, development trend, and suggestions for the future of foxtail millet in China[J]. Research of Agricultural Modernization, 2014, 35(5):531-535.
[2] 柴岩, 万福世. 中国小杂粮产业发展报告[M]. 北京:中国农业出版社, 2007:32-43.
Chai Y, Wan S F. China minor cereal industry development report[M]. Beijing:China Agriculture Press, 2007:32-43.
[3] 李明哲, 张爱岭. 谷子线虫病防控技术[J]. 农药市场信息, 2015(16):47.
Li M Z, Zhang A L. Nematode disease prevention and control technology[J]. Pesticide Market News, 2015(16):47.
[4] 董立, 马继芳, 郑直, 李志勇, 全建章, 刘磊, 甘耀进, 董志平. 谷子线虫病品种抗性鉴定及拌种药剂筛选[J]. 河北农业科学, 2010, 14(11):54-55,95. doi:10.16318/j.cnki.hbnykx.2010.11.009.
Dong L, Ma J F, Zheng Z, Li Z Y, Quan J Z, Liu L, Gan Y J, Dong Z P. Identification of millet cultivars resistant to nematode and screening of chemicals for seed dressing[J]. Journal of Hebei Agricultural Sciences, 2010, 14(11):54-55,95.
[5] Bridge J, Ploweight R A, Peng D L. Nematode parasites of rice[M]. London:CABI Publising, 1990:69-76. doi: 10.1079/9780851997278.0000.
[6] 陈善铭, 郑家兰, 陈品三, 李丽丽. 栗线虫病防治研究[J]. 植物保护学报, 1962, 1(3): 222-230. doi:10.13802/j.cnki.zwbhxb.1962.03.001.
Chen S M, Zheng J L, Chen P S, Li L L. Millet nematode prevention and treatment research[J]. Journal of Plant Protection, 1962, 1(3):222-230.
[7] 崔丽丽, 闫梅霞, 冯志伟, 金银萍, 许陪磊, 王英平. 吉林省北五味子种子种苗带菌检验初步研究[J]. 特产研究, 2018,40(3):6-9. doi:10.16720/j.cnki.tcyj.2018.03.002.
Cui L L, Yan M X, Feng Z W, Jin Y P, Xu P L, Wang Y P. Schisandra chinensis seed and seedling health testing in Jilin[J]. Special Wild Economic Animal and Plant Research, 2018,40(3):6-9.
[8] 赵芝, 罗丽芬, 郑建芬, 何霞红, 刘西莉, 朱书生, 杨敏. 三七种子带菌检测及致病菌鉴定研究[J]. 云南农业大学学报(自然科学), 2017, 32(6):1012-1021. doi:10.16211/j.issn.1004-390X(n).2017.06.008.
Zhao Z, Luo L F, Zheng J F, He X H, Liu X L, Zhu S S, Yang M. Testing of seed borne fungi of Panax notoginseng and identification of seed pathogens[J]. Journal of Yunnan Agricultural University(Natural Science), 2017, 32(6):1012-1021.
[9] 胡晓芬, 蒋孟多. 玉米种子表面带菌检测的初步研究[J]. 甘肃科技, 2017, 33(16):139-140.doi:10.3969/j.issn.1000-0952.2017.16.056.
Hu X F, Jiang M D. Preliminary study of the detection of bacteria on the surface of corn seeds[J]. Gansu Science and Technology, 2017, 33(16):139-140.
[10] 高苇, 王勇, 张春祥. 黄瓜种子携带真菌的检测研究[J]. 种子, 2016, 35(9):91-93. doi:10.16590/j.cnki.1001-4705.2016.09.091.
Gao W, Wang Y, Zhang C X. Testing of seed-associated fungi of cucumber seed[J]. Seed, 2016, 35(9):91-93.
[11] 金柳艳, 郭宁, 石洁, 张海剑, 刘树森, 张家齐. 黄淮海夏玉米区玉米籽粒带菌检测分析[J]. 中国农业学, 2018,51(18):3508-3519. doi: 10.3864/j.issn.0578-1752.2018.18.007.
Jin L Y, Guo N, Shi J, Zhang H J, Liu S S, Zhang J Q. Detection and analysis of fungi carried by maize grain in Huang-Huai-Hai summer maize region[J]. Scientia Agricultura Sinica, 2018,51(18):3508-3519.
[12] Gullino M L, Munkvold G. Global perspectives on the health of seeds and plant propagation material[J]. Springer Netherlands, 2014, 6:17-28. doi:10.1007/978-94-017-9389-6.
[13] 宋顺华, 郑晓鹰, 李丽. 西瓜果腐病种子带菌的PCR检测研究[J]. 种子, 2007, 26(12):24-26. doi:10.16590/j.cnki.1001-4705.2007.12.086.
Song S H, Zheng X Y, Li L. Detection of Acidovorax avenae subsp. Citrulli in watermelon seed using ploymerase Chain Reaction[J]. Seed, 2007, 26(12):24-26.
[14] Boer S H D. PCR detection of Erwinia carotovora subsp.atroseptica association with potato tissue[J]. Phytopathology, 1995(85):854-858. doi:10.1094/Phyto-85-854.
[15] Walcott R R, Gitaitis R D. Detect ion of Acidovorax avenae subsp.citrulli in watermelon seed using immunomagnetic sparation and the polymerase chain reaction[J]. Plant Disease, 2000, 84(4):470-474. doi:10.1094/PDIS.2000.84.4.470.
[16] Mbofung G C Y, Pryor B M. A PCR-based assay for detection of Fusarium oxysporum f. sp. lactucae in lettuce seed[J]. Plant Disease, 2015, 94(7):860-866. doi:10.1094/PDIS-94-7-0860.
[17] 张卉. IMS-PCR检测番茄细菌性斑点病种子带菌研究[D]. 哈尔滨:东北农业大学, 2003. doi:10.7666/d.y506366.
Zhang H. Studies on detection of Pseudomnas syringae pv. Tomato in tomato seed using immunomagnetic separation and the polumerase chain reaction[D]. Harbin: Northeast Agricultural University, 2003.
[18] Duressa D, Rauscher G, Koike S T, Mou B, Hayes R J, Maruthachalam K, Subbarao K V, Klosterman S J. A Real-time PCR assay for detection and quantification of Verticillium dahliae in spinach seed[J]. Phytopathology, 2012, 102: 443-451. doi:10.1094/PHYTO-10-11-0280.
[19] 田晓燕, 张庆萍, 王燕春, 席先梅, 白海. 内蒙古地区番茄溃疡病菌PCR快速检测技术及22个番茄品种种子表面带菌检测[J]. 华北农学报, 2015, 30(1): 150-153. doi:10.7668/hbnxb.2015.01.024.
Tian X Y, Zhang Q P, Wang Y C, Xi X M, Bai H. Rapid detection of Clavibacter michiganensis subsp. Michiganensis in Inner Mongolia Area using PCR and testing of seed surface borne bacteria of 22 tomato varieties[J]. Acta Agriculturae Boreali-sinica, 2015, 30(1): 150-153.
[20] 王琼, 耿丽凤, 张东升, 彭德良. 香蕉穿孔线虫特异性分子检测技术研究[J]. 植物病理学报, 2011, 41(2):171-177. doi:10.13926/j.cnki.apps.2011.02.009.
Wang Q, Geng L F, Zhang D S, Peng D L. Study on specific molecular detection technology of banana Radopholus similis[J]. Acta Phytopathologica Sinica, 2011, 41(2):171-177.
[21] 林宇, 王金成, 张宇含, 董立, 顾建峰, 李志勇. 贝西滑刃线虫双重PCR检测方法研究[J]. 河北农业大学学报, 2016, 39(1):80-83. doi:10.13320/j.cnki.jauh.2016.0013.
Lin Y, Wang J C, Zhang Y H, Dong L, Gu J F, Li Z Y. Development of duplex PCR assay for detection of Aphelenchoides besseyi[J]. Journal of Agricultural University of Hebei, 2016, 39(1):80-83.
[22] 任毓忠, 李晖, 李国英, 王晓东, 万刚, 方蕾. 哈密瓜细菌性果斑病种子带菌PCR检测[J]. 新疆农业科学, 2004, 41(5):329-332. doi:10.3969/j.issn.1001-4330.2004.05.020.
Ren Y Z, Li H, Li G Y, Wang X D, Wan G, Fang L. Detection of Acidovorax avenae subsp. Citrulli in melon seed using the polymerase chain reaction[J]. Xinjiang Agricultural Sciences, 2004, 41(5):329-332.
[23] 曾丹丹, 张海峰, 田擎, 许苗, 王源超, 郑小波. 基于环介导等温扩增技术检测黄淮地区大豆主栽品种种子携带的病原菌[J]. 南京农业大学学报, 2016, 39(6):947-953. doi:10.7685/jnau.201512038.
Zeng D D, Zhang H F, Tian Q, Xu M, Wang Y C, Zheng X B. Detection of soybean seed-borne pathogens in Huang-huai area using LAMP assays[J]. Journal of Nanjing Agricultural University, 2016, 39(6):947-953.
[24] 张贵, 张园园, 田永伟, 赵晓军, 张光, 周洪友, 景岚, 赵君. 向日葵黄萎病种子带菌研究[J]. 浙江大学学报(农业与生命科学版), 2018,44(1):41-48. doi:10.3785/j.issn.1008-9209.2017.03.121.
Zhang G, Zhang Y Y, Tian Y W, Zhao X J, Zhang G, Zhou G Y, Jing L, Zhao J. Detection of contamination of sunflower seed coats with Verticillium dahliae[J]. Journal of Zhejiang University(Agriculture and Life Sciences), 2018, 44(1): 41-48.
[25] Thompson J D, Gibson T J, Plewniak F, Jeanmougin F, Higgins D G. The CLUSTAL _X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research, 1997, 25(4): 4876-4882. doi:10.1093/nar/25.24.4876.
[26] 张景昆, 程桂霞, 黄克珍, 古希昕. 谷子线虫病发生情况及防治方法[J]. 植物保护, 1985(1):11-12.
Zhang J K, Cheng G X, Huang K Z, Gu X X. Occurrence and control of millet nematode[J]. Journal of plant protection, 1985(1):11-12.
[27] 丁汝坤. 谷子线虫病的田间识别与防治[J]. 河南农业科学, 1987(8):36-37.
Ding R K. Field identification and control of millet nematode[J]. Journal of Henan Arricultural Sciences, 1987(8):36-37.
[28] 白峰, 李建华, 张红艳. 华北夏谷区谷子线虫病发生原因及防治方法[J]. 农业科技通讯, 2016(9):233-234. doi:10.3969/j.issn.1000-6400.2016.09.090.
Bai F, Li J H, Zhang H Y. Occurrence causes and control methods of millet nematode in summer millet areas, North China[J]. Bulletin of Agricultural Science and Technology, 2016(9):233-234.