近年来,土地盐碱化严重限制了农业的发展。目前,我国土地盐碱化的情况不容乐观,盐碱化土地的总面积约为0.99×108 hm2,而且分布广泛[1]。我国东北地区的松嫩平原土地盐碱化较为严重,该地区盐碱土面积达到 373万hm2,占该平原面积的21%,是世界上三大苏打盐碱化土壤集中分布的区域之一[2]。该地区的盐碱化土壤已经严重影响着作物的品质和产量,因此,对盐碱地的改良势在必行,目前,我国改良利用现有盐碱地的最为有效的方式之一是开发盐生植物及选育耐盐碱植物资源。
芸豆(Phaseolus vulgaris L.),学名普通菜豆,是豆科蝶形花亚科菜豆属一年生草本植物[3]。芸豆籽粒中富含营养,除供人们食用之外,在药用以及保健等方面也具有重要的价值[4]。芸豆具有较高的经济价值,是我国出口量最多的农副产品。我国的芸豆种植面积约达1×106 hm2,其栽培范围主要集中在我国的华北、西南、西北和东北的高寒、冷凉地区,其中黑龙江省的芸豆产量和出口量位居全国首位[5]。芸豆耐盐碱性较弱,黑龙江省特别是松嫩平原地区土壤盐碱化程度的逐年增加,土壤盐碱化将对芸豆的生产力和营养品质形成较大的威胁,从而限制我国东北地区特别是松嫩平原芸豆的播种面积和产品质量的进一步提高。因此,选育耐盐碱芸豆品种以及探究其响应盐碱的作用机制显得尤为重要。
土壤中的特殊微域之一是土壤根际微环境,而土壤根际微环境是植物获取养分的主要区域。在这块区域里植物、微生物和土壤以及环境进行接触,相互作用[6]。土壤的盐碱化不仅可以改变土壤的部分理化性质,直接对微生物的生存产生影响[7],而且还会间接影响土壤微生物的生存环境,并对微生物种群、数量、活性及土壤酶活性等方面产生毒害作用,使得土壤微生态区系失衡,影响作物生产[8]。研究发现,土壤生态系统中的微生物和土壤酶是土壤中较为活跃的组分,共同推动影响着土壤代谢的过程,对自然和人为因素造成变化的响应较为敏锐[9]。张旭龙等[10]研究发现,种植不同耐盐碱能力的品种对根际土壤pH值、土壤速效养分含量和土壤酶活性产生不同程度的影响。万忠梅等[11]研究指出土壤pH值会对土壤酶参与的土壤生化反应产生直接的影响。所以,弄清楚逆境胁迫与作物、土壤微生物及土壤酶之间的联系,对改善土壤的微环境,缓解作物所遭受的胁迫以及治理盐碱土壤有重要意义,有利于提高作物在逆境胁迫下的耐受能力[12]。因此,研究植物根系微生态环境有益于明确盐碱胁迫下植株根际土壤微生态区系的响应机制。
目前,国内外研究芸豆耐盐碱机制大多从植物对环境的反馈作用和植物对环境的适应性的角度探讨芸豆的耐盐碱机制,主要围绕着盐碱胁迫后芸豆种子萌发、幼苗生物量积累、光合特性、渗透调节、离子平衡、抗氧化系统等方面的变化进行研究,并且报道较少[13-14]。而对于盐碱胁迫下芸豆根际土壤微生物数量和酶活性变化的研究更是鲜有报道。因此,本试验从耐盐碱根际环境出发,通过对盐碱胁迫处理下的芸豆幼苗根际土壤微生物群落和酶活性的变化趋势的研究,探讨盐碱胁迫对芸豆幼苗根际土壤微生物数量和酶活性的影响,为进一步研究芸豆根际效应奠定理论基础,并为研究芸豆的耐盐碱机制、选育耐盐碱芸豆品种资源提供理论依据。
1 材料和方法
1.1 试验材料
供试材料为芸豆品种HYD和JW。
供试基础土壤为自然草甸土,土壤理化性质:碱解氮113.17 mg/kg、速效磷16.21 mg/kg、速效钾101.47 mg/kg、全氮1.15 g/kg、全磷0.14 g/kg、有机质23.12 g/kg、pH 值7.84。
1.2 试验设计
本试验在黑龙江八一农垦大学黑龙江省现代农业栽培技术与作物种质改良重点实验室进行。
试验采用盆栽法,每盆(PVC材料,直径16 cm,高14 cm)装土2 kg(以风干土计)。选用籽粒饱满且大小一致的自然风干的芸豆种子,用1% NaClO分别将两品种芸豆种子浸泡消毒5 min,再用蒸馏水漂洗3次。将消毒过的种子放置于铺有2层滤纸的发芽盒内,用蒸馏水打湿后放入30~40粒种子,上面盖1层打湿的滤纸,放入25 ℃恒温箱中,培养1 d。将2种碱性盐Na2CO3、NaHCO3 按照摩尔比1∶9混合(Na2CO3及 NaHCO3均为分析纯),按照混合后占土壤中的质量分数0(对照,CK),0.4%,0.8%,1.2%设计4个梯度,分别记作S0、S1、S2、S3。每个处理6盆,共48盆,随机摆放。将Na2CO3、NaHCO3按表1比例称量后,均匀拌于每个处理的盆栽土壤中,每盆均匀播种,出苗后定植至5株。同时,所有的处理土壤均不施用任何肥料,每次浇水至土壤持水量的70%,其他如常规管理。浇水后静止1 d测定 CK,0.4%,0.8%,1.2%处理对应的pH值和电导率值如表2所示。
采用抖落法收集各处理的根际土壤,每个处理抖落30株。将获取的植株进行清洗,且保证植株与根部的完整,供生长特性的测定。将获取的根际土壤分成两部分处理:一部分新鲜土样过2 mm尼龙网筛,迅速装入无菌塑料袋,置于4 ℃冰箱保存,供可培养微生物计数分析;其余部分新鲜土样置于无特殊气体、无灰尘污染的室内自然风干,研磨并过1 mm尼龙网筛供土壤酶活性的测定。
表1 试验设计
Tab.1 Experimental design
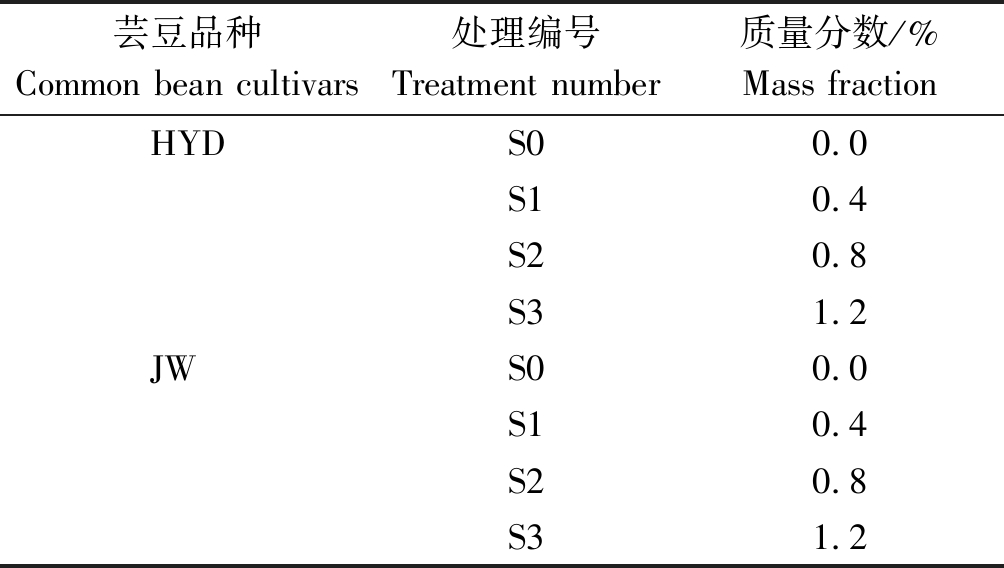
芸豆品种Common bean cultivars处理编号Treatment number质量分数/%Mass fractionHYDS0 0.0S1 0.4S2 0.8S31.2JWS0 0.0S1 0.4S2 0.8S31.2
表2 各处理土壤pH和电导率值
Tab.2 Each treatment of soil pH and conductivity values
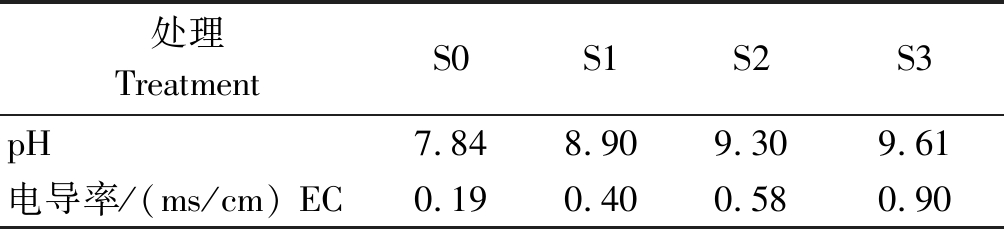
处理TreatmentS0S1S2S3pH7.848.909.309.61电导率/(ms/cm) EC0.190.400.580.90
1.3 测定项目与方法
芸豆幼苗形态指标的测定,在每个处理中选定 5 株长势一致且具有代表性的植株进行株高、根长等形态指标的测定,并将其分为地上部和地下部,用烘箱105 ℃杀青30 min,80 ℃烘干至恒质量后进行称质量,测定其地上部和地下部生物量并计算根冠比。
土壤微生物数量和土壤酶活性的测定均参照林先贵[15]的方法。
采用稀释平板测数法对细菌、放线菌、真菌数量的进行测定,细菌采用牛肉膏蛋白胨琼脂培养基,真菌采用马丁(Mar-tin)培养基,放线菌采用改良高氏Ⅰ号培养基。
采用苯酚钠-次氯酸钠比色法测定脲酶活性,以每单位土中![]() 的毫克数表示;采用磷酸苯二钠比色法测定磷酸酶活性,以单位土质量单位时间内形成的酚的质量(μg)表示;采用高锰酸钾滴定法测定过氧化氢酶活性,以每克土消耗0.1 mol/L高锰酸钾的毫升数表示。
的毫克数表示;采用磷酸苯二钠比色法测定磷酸酶活性,以单位土质量单位时间内形成的酚的质量(μg)表示;采用高锰酸钾滴定法测定过氧化氢酶活性,以每克土消耗0.1 mol/L高锰酸钾的毫升数表示。
1.4 数据处理与分析
采用Excel 2016软件处理数据和绘图,SPSS 20.0软件进行差异显著性检验,检验水平α=0.05。
2 结果与分析
2.1 盐碱胁迫对芸豆幼苗生长特性的影响
由表3可以看出,随着盐碱浓度的不断增加,品种HYD和JW的株高呈现先增高后降低的趋势。与S0处理相比,在S1处理最高,但是不显著;S3处理最低,分别降低了7.25%,6.48%。根长呈现相同的趋势,S1处理最高,品种HYD和JW分别增加了3.98%,10.06%;S3处理最低,分别降低了14.18%,8.79%。同样,HYD和JW的单株地上部生物量在S1处理下均达到最高值,分别为 0.55,0.53 g;且单株地下部生物量在S1处理下均达到最高值,分别为0.25,0.21 g。但是,随着盐碱胁迫的浓度增加,地上部生物量与地下部生物量呈现降低的趋势。当芸豆幼苗受到盐碱浓度胁迫处理时,根部的生长受到抑制,影响其对水分和各类营养元素的吸收,导致植株的地上部物质代谢受到抑制,幼苗出现萎蔫现象,同时叶片也会出现枯斑。从表3可知,芸豆幼苗的根冠比在受到高浓度盐碱胁迫时,芸豆幼苗根部吸收大量的盐碱离子,影响植株对水分和营养物质的吸收,导致地上部存在萎蔫现象,最终根冠比呈增高现象。由此可见,在低浓度S1处理下,盐碱胁迫对两品种的生长影响较小,但随着盐碱浓度的增加,两品种的地上、下部生长均受到了不同程度的抑制。同时,HYD对盐碱胁迫的耐受性要优于JW。
2.2 盐碱胁迫对芸豆幼苗根际土壤微生物数量的影响
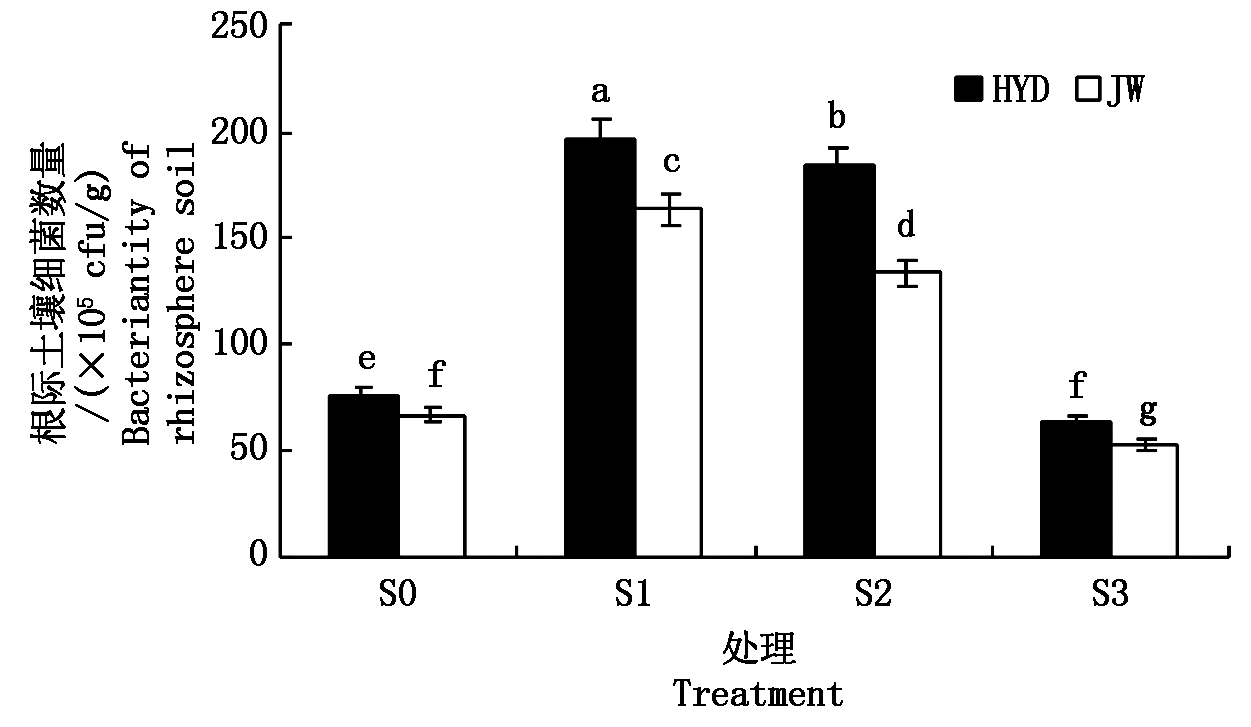
2.2.1 盐碱胁迫对芸豆幼苗根际土壤细菌数量的影响 由图1可知,随着盐碱浓度的不断增加,品种HYD和JW根际土壤的细菌数量总体呈现先升高后降低的变化趋势,且均在低浓度S1处理下达到最大值,较S0增长幅度分别为156.52%,45.00%,品种间存在显著差异;在高浓度S3胁迫处理下显著下降,并且显著低于S0胁迫处理,相对于S0处理下降幅度分别为17.39%,20.00%,且品种差异显著。这说明,低浓度盐碱胁迫处理可能会促进细菌数量的增加,提高其活性,而高浓度的盐碱胁迫处理则会减少细菌数量。在不同盐碱浓度胁迫下,HYD的根际土壤细菌数量均显著高于品种JW,根际土壤细菌活性有显著优势。
表3 盐碱胁迫对芸豆幼苗生长特性的影响
Tab.3 Effects of salinity-alkalinity stress on growth characteristics of common bean
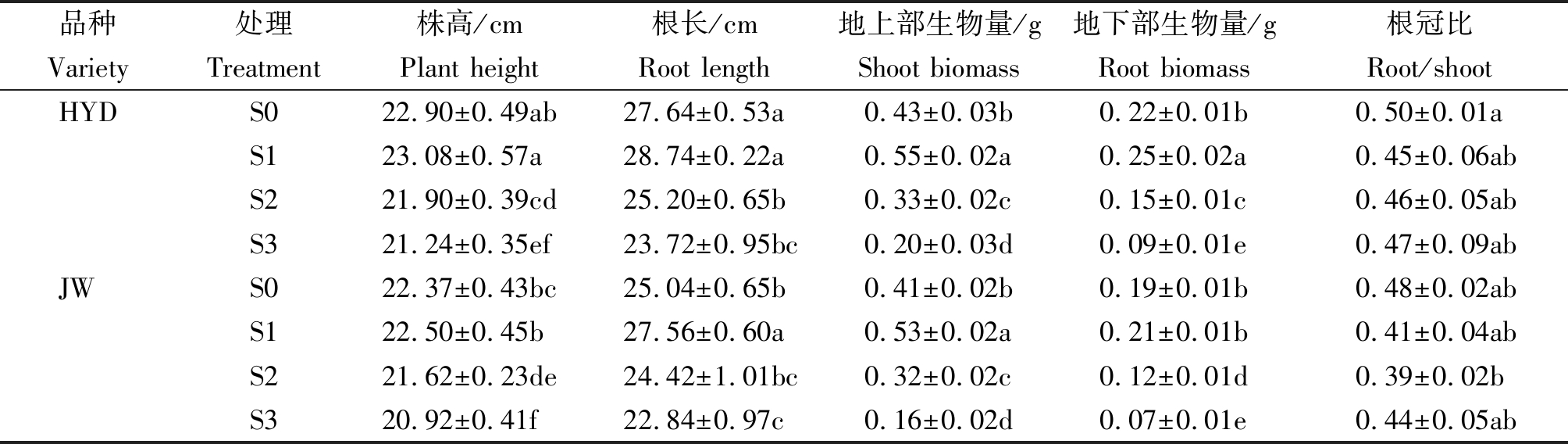
品种处理株高/cm根长/cm地上部生物量/g地下部生物量/g根冠比VarietyTreatmentPlant heightRoot lengthShoot biomassRoot biomassRoot/shootHYDS0 22.90±0.49ab27.64±0.53a0.43±0.03b0.22±0.01b 0.50±0.01aS123.08±0.57a28.74±0.22a0.55±0.02a0.25±0.02a0.45±0.06abS2 21.90±0.39cd25.20±0.65b0.33±0.02c0.15±0.01c0.46±0.05abS3 21.24±0.35ef23.72±0.95bc0.20±0.03d0.09±0.01e0.47±0.09abJWS0 22.37±0.43bc25.04±0.65b0.41±0.02b0.19±0.01b0.48±0.02abS122.50±0.45b27.56±0.60a0.53±0.02a0.21±0.01b0.41±0.04abS221.62±0.23de24.42±1.01bc0.32±0.02c0.12±0.01d0.39±0.02bS320.92±0.41f22.84±0.97c0.16±0.02d0.07±0.01e0.44±0.05ab
注:同列数据不同小写字母表示在 5%水平差异显著。表4同。
Note:Different lowercase letters in each column mean significant difference at 0. 05 level. The same as Tab.4.
不同小写字母表示差异显著(P<0.05)。图2-7同。
Different small letters indicate significant difference at 0.05 level. The same as Tab.2-7.
图1 盐碱胁迫对芸豆根际土壤细菌数量的影响
Fig.1 Effects of salinity-alkalinity stress on bacterial quantity in the rhizosphere soil of common bean
2.2.2 盐碱胁迫对芸豆幼苗根际土壤真菌数量的影响 从图2可以看出,随着盐碱处理浓度的升高,两芸豆品种根际土壤真菌数量的变化总体表现为先上升后下降的规律,各处理间差异显著。HYD和JW根际土壤真菌数量均在低浓度S1处理下达到最高,相对于S0处理显著增加,分别增加了88.37%,91.18%;但是在高浓度S3处理下显著低于对照S0,降幅分别为18.61%,38.24%。HYD与JW 2个品种之间根际土壤真菌数量有显著性差异,且HYD的根际土壤真菌数量均显著高于JW,说明HYD对盐碱胁迫的适应力比JW较好。
2.2.3 盐碱胁迫对芸豆幼苗根际土壤放线菌数量的影响 从图3可知,在S0、S1、S2、S3这4个不同盐碱处理下,HYD和JW 2个芸豆品种根际土壤放线菌数量总体呈现先升高后降低的趋势。在低浓度S1处理下,根际土壤放线菌数量达到最大,并且显著高于其他3个浓度处理,相比于S0处理,HYD和JW根际土壤放线菌数量的增加幅度分别达到72.86%,92.97%,且JW增长幅度比HYD品种高20.11百分点;在高浓度S3处理下的根际土壤放线菌数量下降明显,并且显著低于S0处理,HYD和JW根际土壤放线菌数量分别比S0处理下降幅度达到20.00%,30.27%。这说明在同一浓度处理下,JW比HYD的根际土壤中的放线菌数量增长迅速而降低速度慢,但是JW的根际土壤中的放线菌数量却低于HYD。两品种间比较,在各个不同处理下,HYD的根际土壤放线菌数量均高于JW,且差异显著。
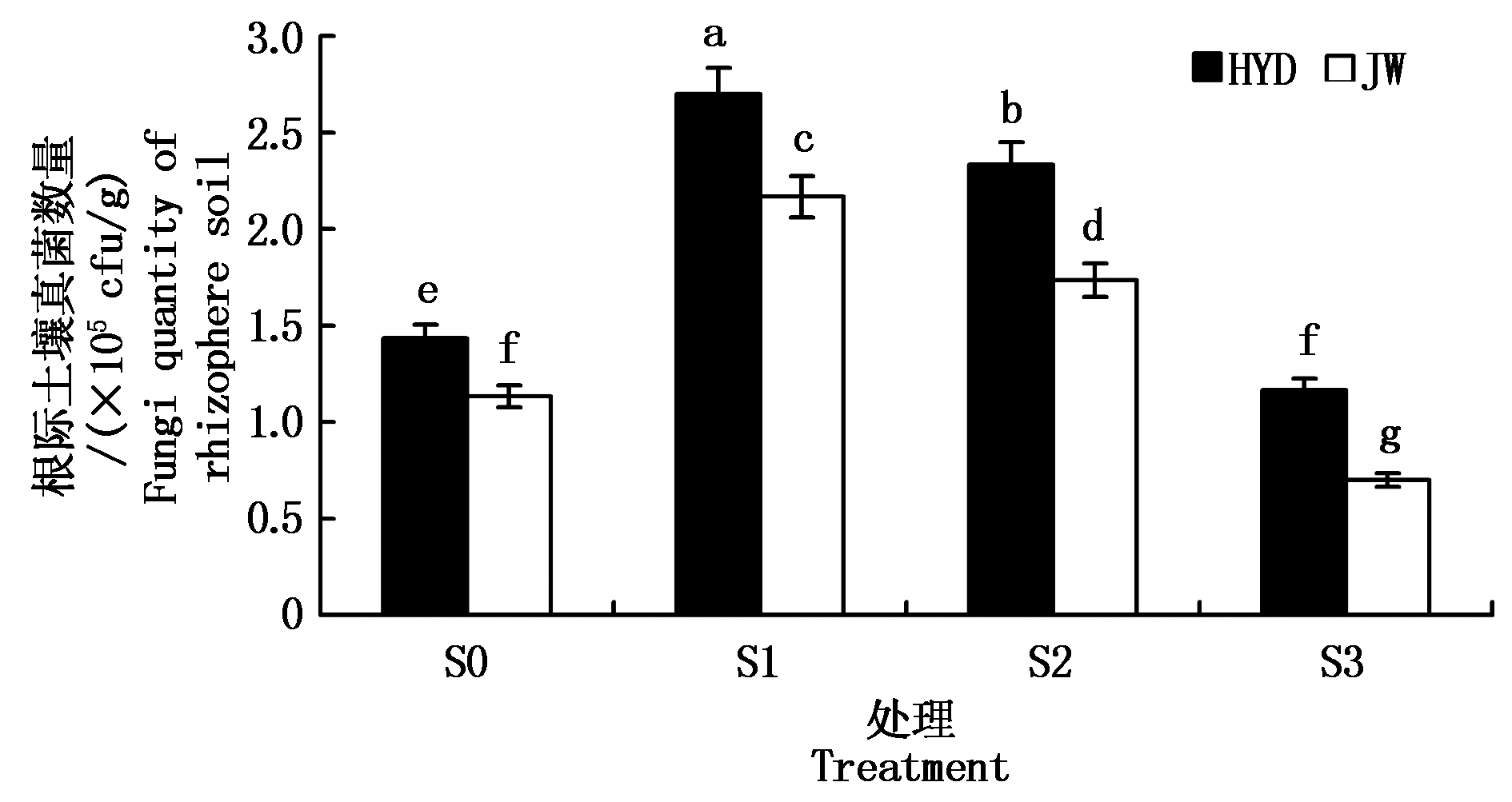
图2 盐碱胁迫对芸豆根际土壤真菌数量的影响
Fig.2 Effects of salinity-alkalinity stress on the number of fungi in the rhizosphere soil of common bean
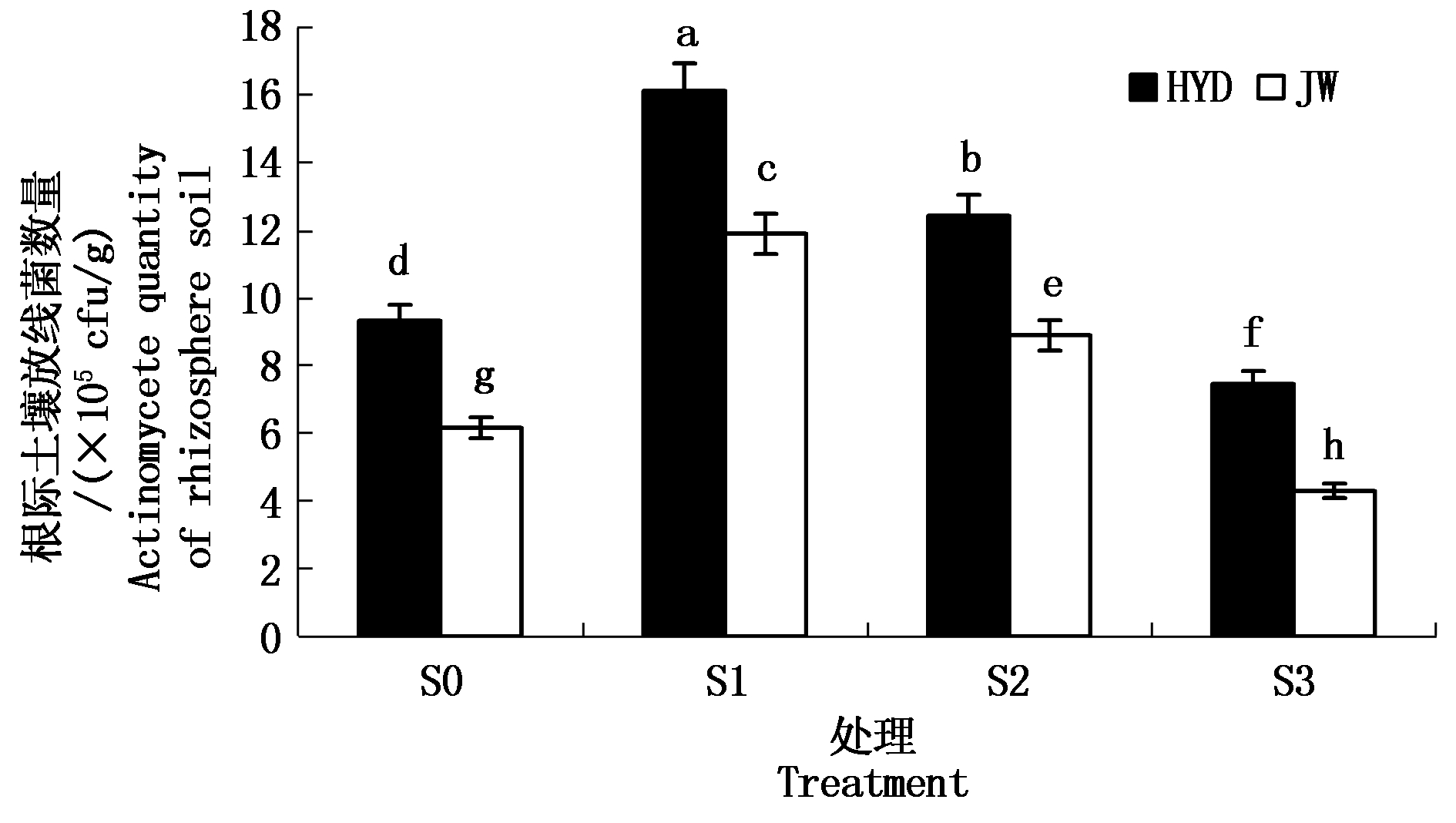
图3 盐碱胁迫对芸豆根际土壤放线菌数量的影响
Fig.3 Effect of salinity-alkalinity stress on actinomycete number in the rhizosphere soil of common bean
2.2.4 盐碱胁迫对芸豆幼苗根际土壤微生物总数量的影响 由图4可知,土壤微生物总数量变化趋势与细菌、真菌、放线菌数量一致,均随着盐碱胁迫浓度的增加呈现出先升高后降低的趋势。HYD与JW 2个品种的根际土壤微生物总数均在低浓度S1处达到最大值。在高浓度S3盐碱胁迫处理下显著下降,并与对照S0处理相比差异显著。对2个芸豆品种进行比较,HYD的根际土壤微生物总量显著高于JW。
不同盐碱胁迫浓度下芸豆根际土壤微生物各生物类群数量差异显著(P<0.05),两品种根际土壤中的微生物群落数目均以细菌居优势(53.33×105~196.67×105 cfu/g),放线菌次之(4.3×105~16.13×105 cfu/g),真菌最少(0.7×105 ~ 2.7×105 cfu/g)。
低浓度S1处理下的微生物数量最高,高浓度S3处理下的微生物数量最低。其中,如表4所示,随着盐碱胁迫浓度的增加,微生物不同类型所占的比重差异不显著,HYD和JW根际土壤细菌占微生物的比重在S2处理时达到最高值分别为92.54%,92.61%,低浓度盐碱胁迫从一定程度上会促进细菌所占比重,但是会抑制真菌的比重,而放线菌的比重则呈现出先降低后增高的趋势。
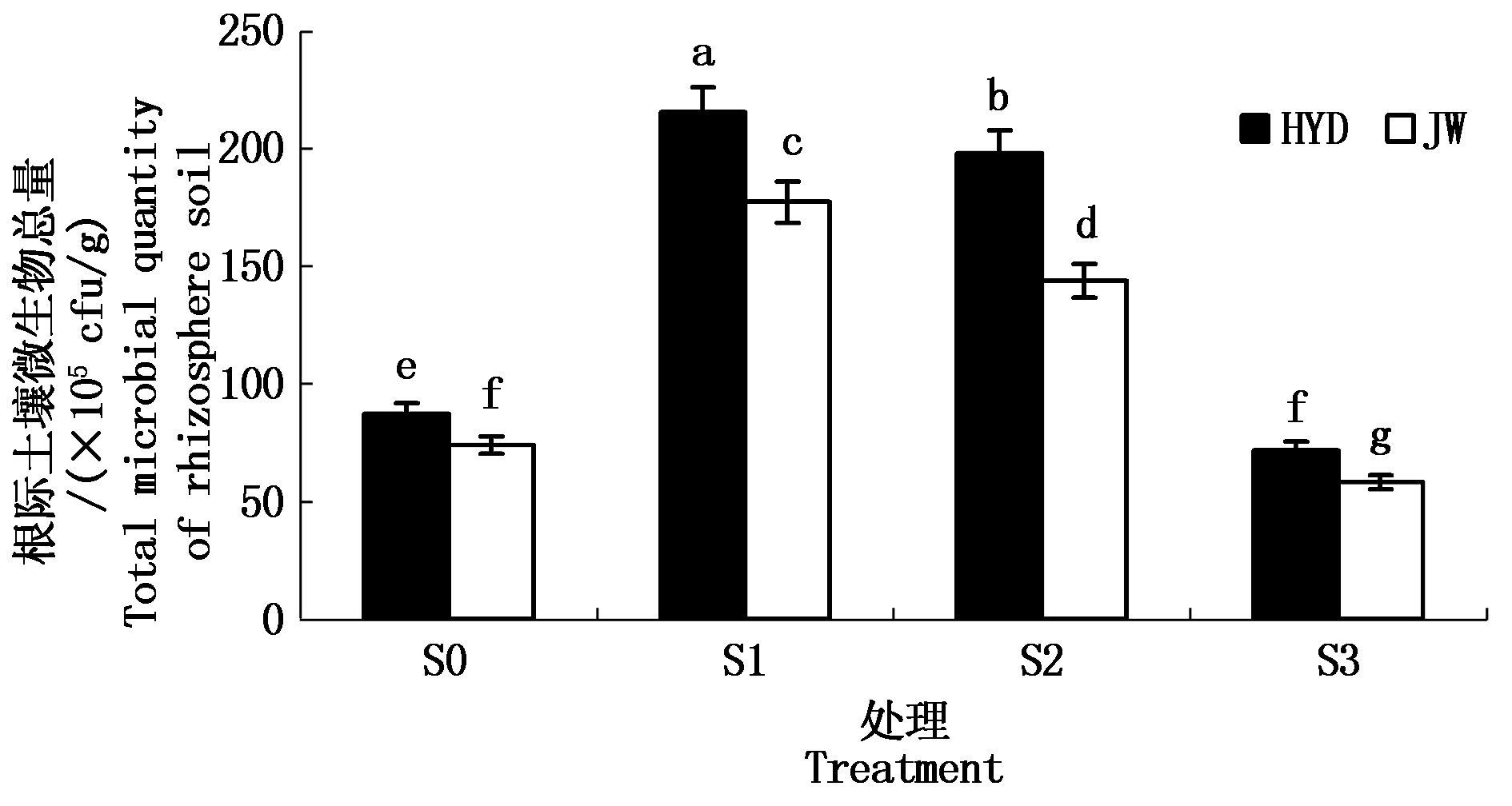
图4 盐碱胁迫对芸豆根际土壤微生物总量的影响
Fig.4 Effect of salinity-alkalinity stress on the total microbial population in the rhizosphere soil of common bean
表4 不同盐碱胁迫处理下细菌、真菌、放线菌占微生物总量的百分比
Tab.4 The percentage of bacteria, fungi and actinomycete under different
salinity-alkalinity stress treatments in total microbial population %
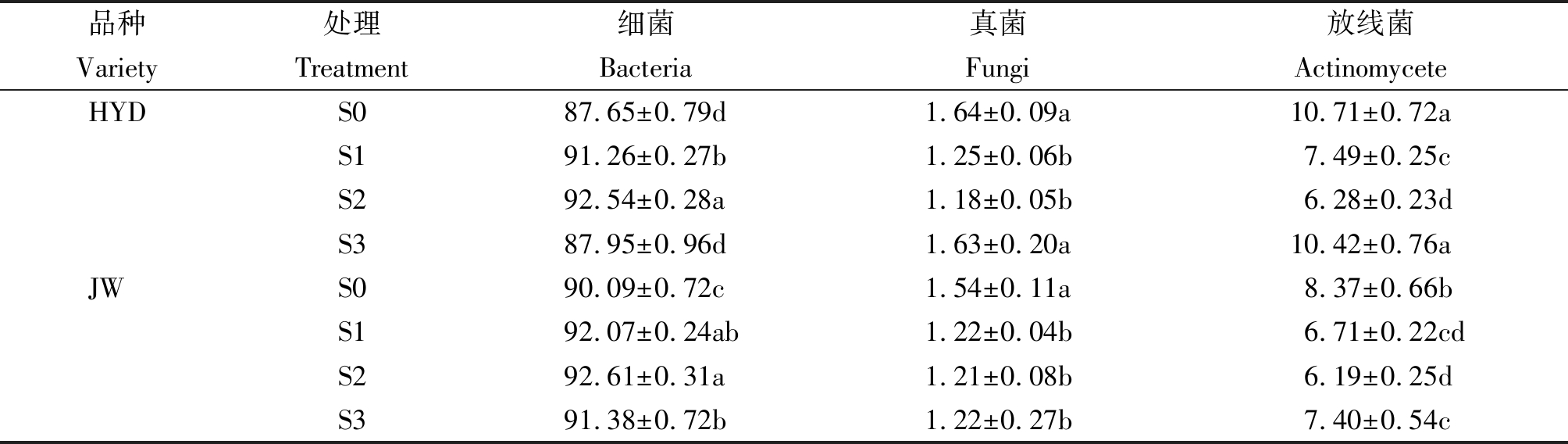
品种处理细菌真菌放线菌VarietyTreatmentBacteriaFungiActinomyceteHYDS087.65±0.79d1.64±0.09a10.71±0.72aS191.26±0.27b1.25±0.06b7.49±0.25cS292.54±0.28a1.18±0.05b6.28±0.23dS387.95±0.96d1.63±0.20a10.42±0.76aJWS090.09±0.72c1.54±0.11a8.37±0.66bS192.07±0.24ab1.22±0.04b6.71±0.22cdS292.61±0.31a1.21±0.08b6.19±0.25dS391.38±0.72b1.22±0.27b7.40±0.54c
2.3 盐碱胁迫对芸豆幼苗根际土壤酶活性的影响
2.3.1 盐碱胁迫对芸豆幼苗根际土壤脲酶活性的影响 由图5可以看出,在S0处理下,HYD的根际土壤脲酶的活性显著高于JW。而随着盐碱浓度的增加,HYD和JW根际土壤脲酶的活性均呈现先升高后降低的趋势,说明低浓度处理促进根际土壤脲酶的活性,高浓度处理抑制根际土壤脲酶的活性。在低浓度S1处理下,两品种根际土壤脲酶的活性较S0处理下的增长幅度分别为40.24%,34.47%;在高浓度S3处理下根际土壤脲酶活性比S0处理分别降低11.79%,8.74%。2个品种间比较,随着盐碱浓度的增加,HYD土壤根际脲酶活性显著高于JW,且差异显著,说明HYD比JW更能适应盐碱胁迫。
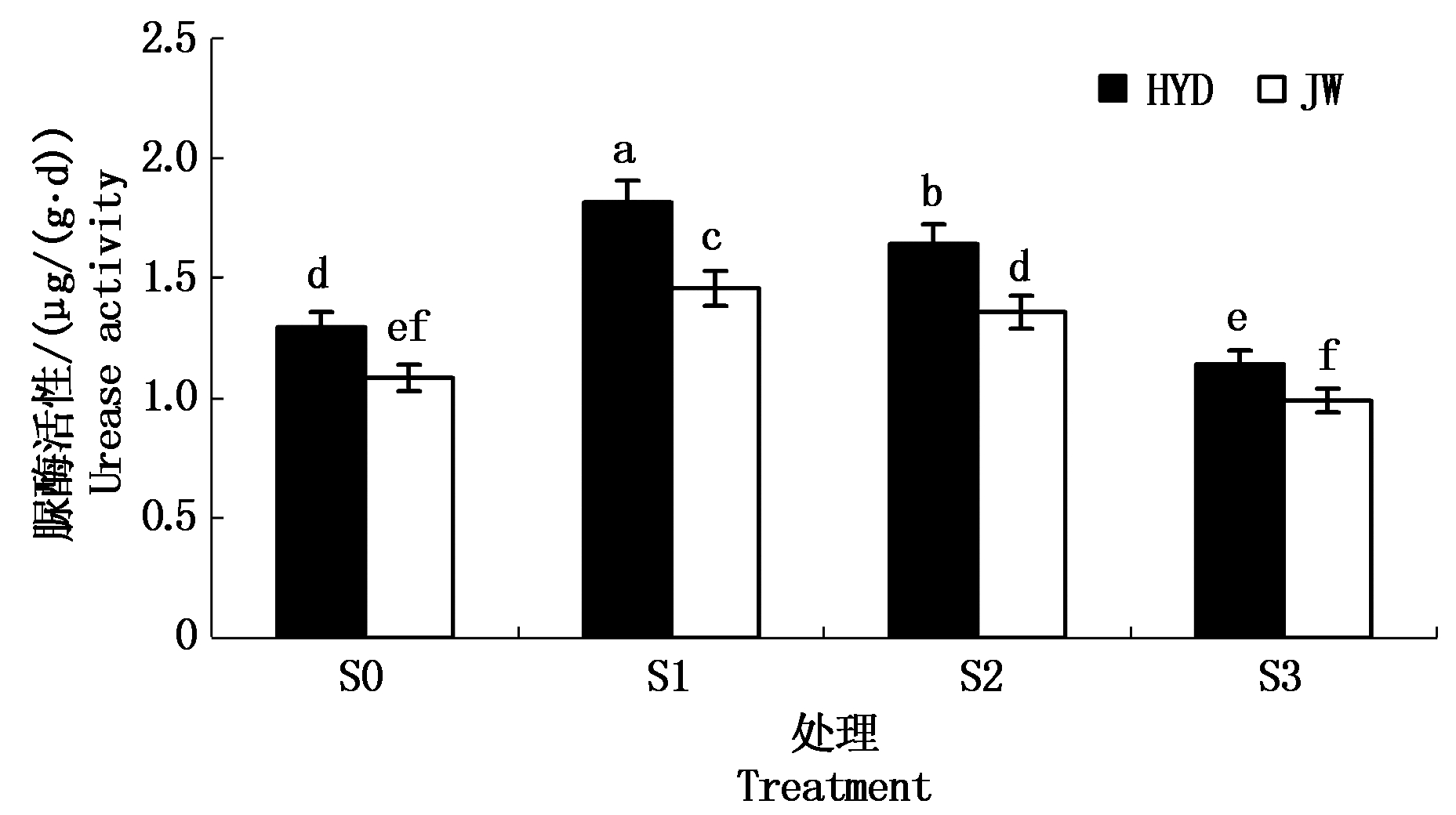
图5 盐碱胁迫对芸豆根际土壤脲酶活性的影响
Fig.5 Effects of salinity-alkalinity stress on urease activity in the rhizosphere soil of common bean
2.3.2 盐碱胁迫对芸豆幼苗根际碱性磷酸酶活性的影响 从图6可以看出,两芸豆根际土壤碱性磷酸酶活性随着盐碱浓度的升高而呈现先增高后显著下降的趋势。在低浓度S1处理下,HYD和JW根际土壤磷酸酶活性较S0处理增幅为45.22%,41.68%;而在高浓度S3处理下根际土壤碱性磷酸酶活性显著下降,且分别比S0处理下降了26.34%,42.46%。与对照S0相比,低浓度S1处理下2个芸豆品种的根际土壤碱性磷酸酶活性显著上升,但随着盐碱胁迫处理浓度的升高,芸豆根际土壤碱性磷酸酶活性显著下降,且高浓度S3处理下根际土壤碱性磷酸酶活性显著低于对照S0。另外,在低浓度S1处理下,HYD根际碱性土壤酶活性的增幅程度高于JW,而HYD在高浓度下的降幅程度要低于JW,说明HYD比JW对于盐碱胁迫的适应能力更好。
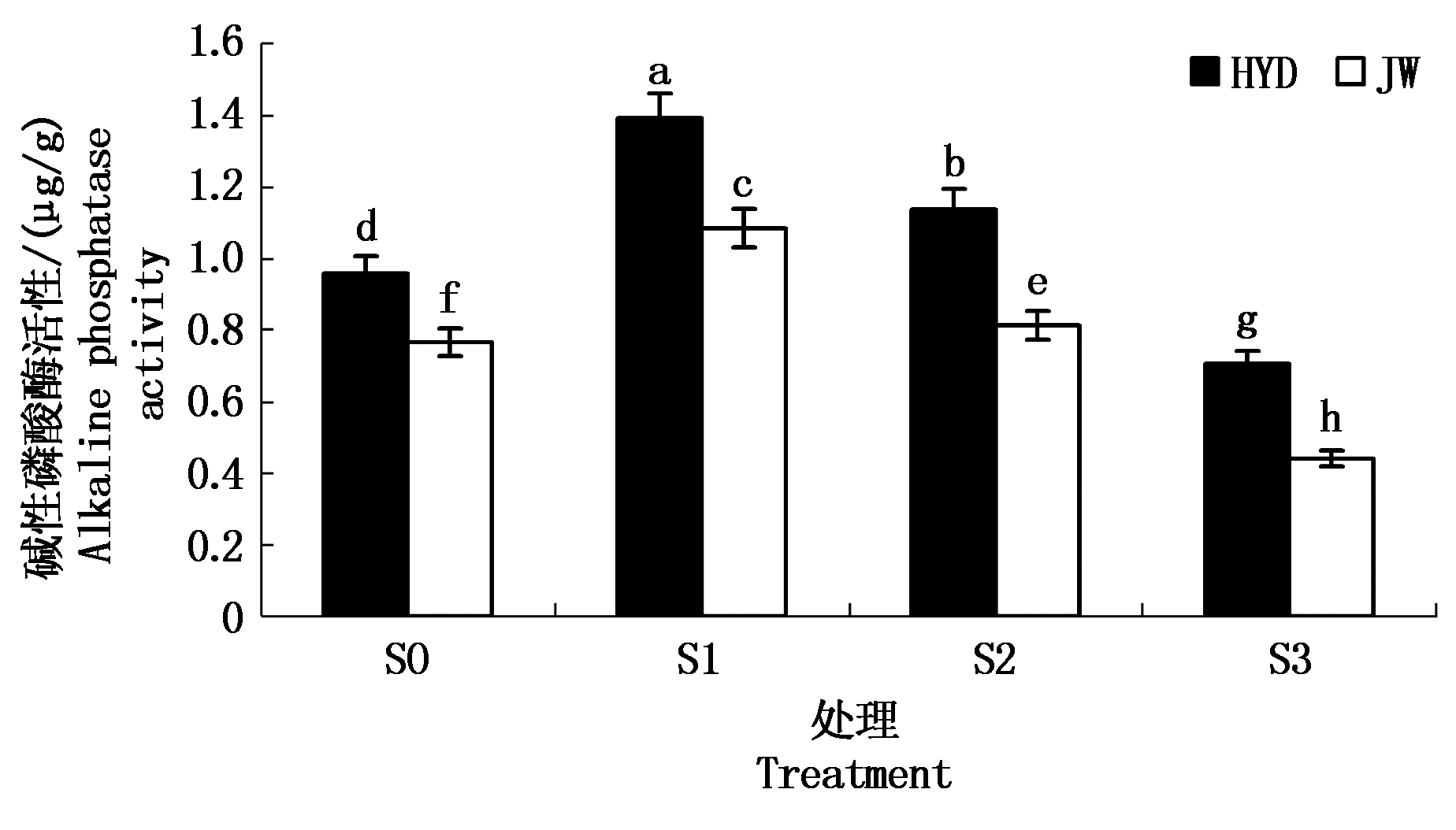
图6 盐碱胁迫对芸豆根际土壤磷酸酶活性的影响
Fig.6 Effects of salinity-alkalinity stress on the phosphatase activity in the rhizosphere soil of common bean
2.3.3 盐碱胁迫对芸豆幼苗根际土壤过氧化氢酶活性的影响 由图7可以看出,随着盐碱胁迫溶液浓度的增加,芸豆根际土壤过氧化氢酶的活性均呈现出先上升后下降的趋势。HYD和JW根际土壤过氧化氢酶均在低浓度S1处理下达到最大值,且分别比S0处理下的增加48.94%,40.51%;在高浓度S3处理下达到最小值,且显著低于S0处理下的根际土壤过氧化氢酶活性,降低幅度分别为32.98%,41.77%。这一结果说明,低浓度S1处理能够促进过氧化氢酶的活性,而高浓度S3处理抑制过氧化氢酶活性。对2个芸豆品种间进行比较,HYD根际土壤过氧化氢酶酶活性显著高于JW。
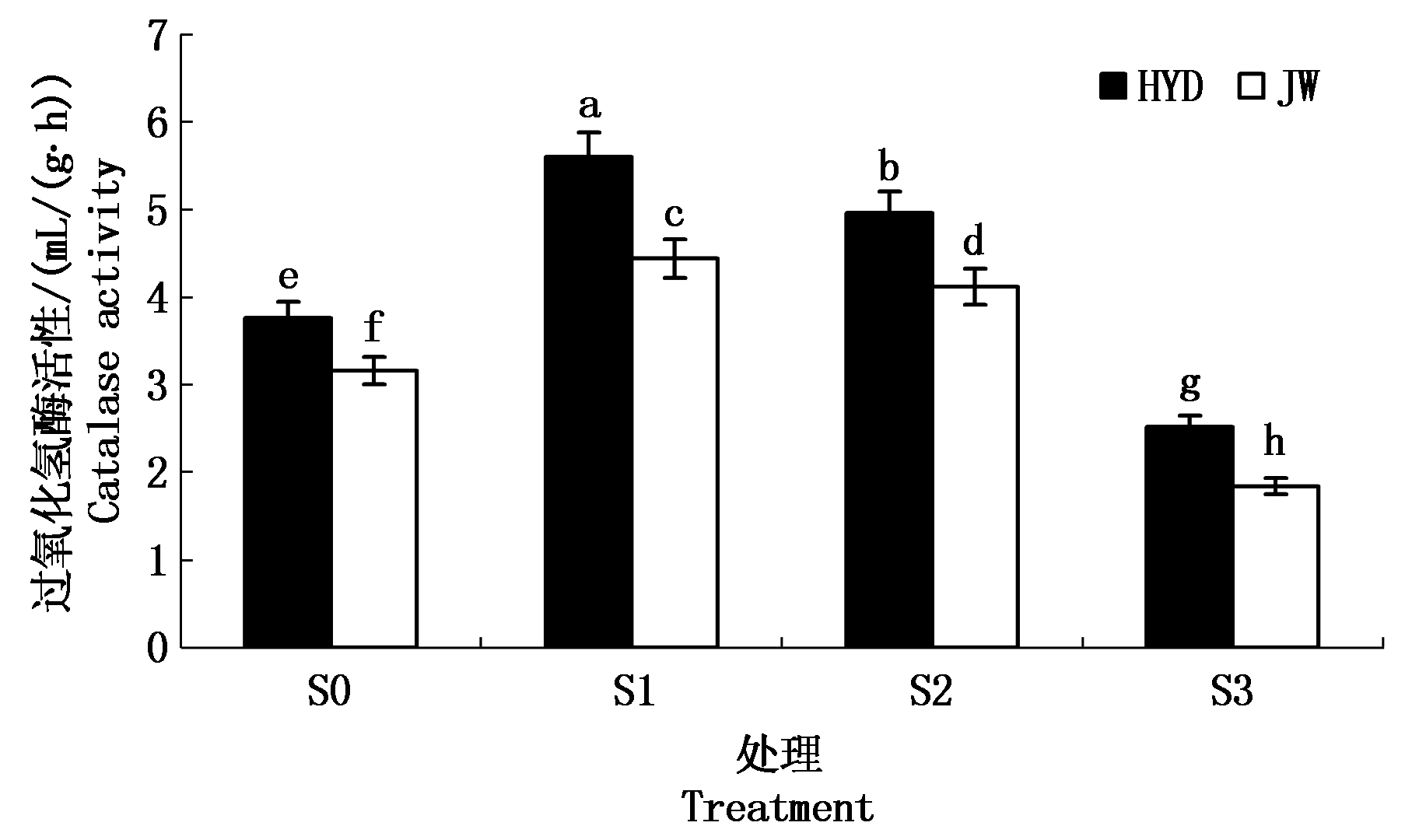
图7 盐碱胁迫对芸豆根际土壤过氧化氢酶活性的影响
Fig.7 Effects of salinity-alkalinity stress on catalase activity in the rhizosphere soil of common bean
2.4 盐碱胁迫下芸豆幼苗根际土壤微生物数量与土壤酶活性相关分析
盐碱胁迫下芸豆根际土壤细菌、真菌、放线菌(X1、X2、X3)种群数量、微生物总量(X4)和土壤脲酶、磷酸酶、过氧化氢酶(X5、X6、X7)活性间的相关性分析结果见表5所示。从表5可以看出,在盐碱胁迫下,两芸豆品种根际土壤细菌、真菌、放线菌数量之间,土壤脲酶、碱性磷酸酶、过氧化氢酶活性之间,土壤细菌、真菌、放线菌数量与土壤脲酶、碱性磷酸酶、过氧化氢酶活性之间均呈正相关关系。其中,2个品种根际土壤脲酶活性与细菌、真菌、放线菌数量呈显著或极显著的正相关。根际土壤碱性磷酸酶活性与放线菌数量呈显著正相关关系,与细菌、真菌数量呈正相关关系。根际土壤过氧化氢酶活性与真菌数量呈显著正相关,与细菌、放线菌数量呈正相关关系。根际土壤脲酶活性与土壤微生物总量呈显著或极显著正相关关系。
表5 盐碱胁迫下芸豆幼苗根际土壤微生物数量、土壤酶活性的相关系数
Tab.5 Correlation coefficient of soil enzyme activity and soil microbial biomass in rhizosphere of common bean seedlings under salinity-alkalinity stress
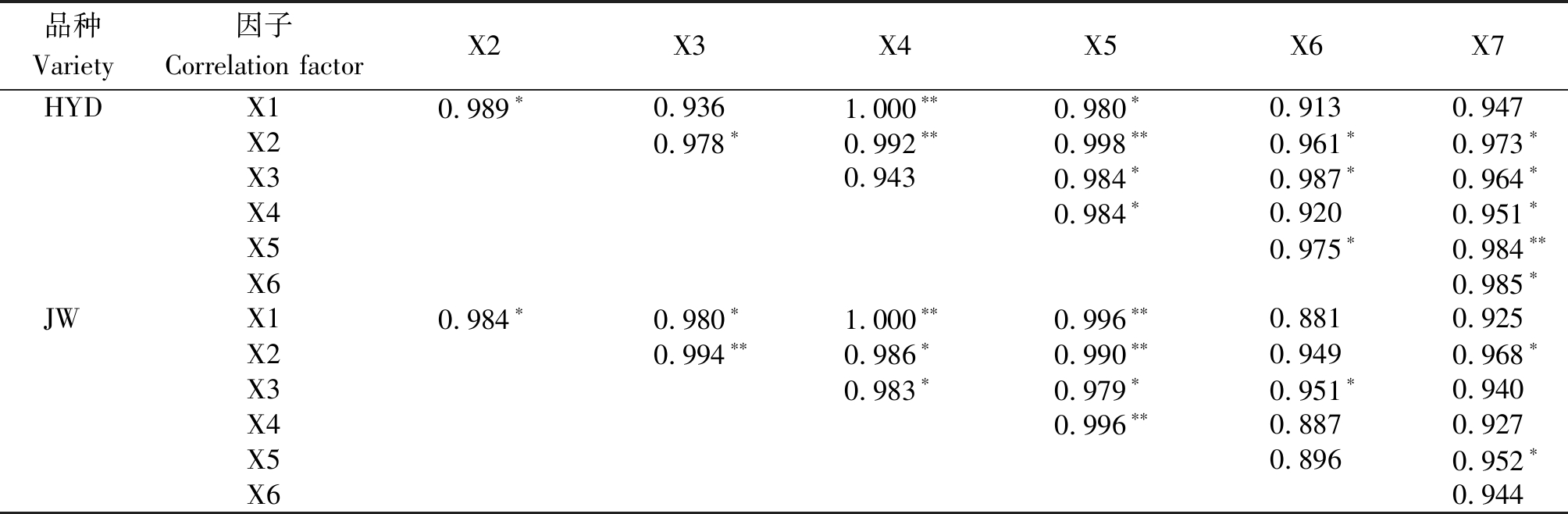
品种Variety因子Correlation factorX2X3X4X5X6X7HYDX1 0.989∗0.9361.000∗∗0.980∗0.9130.947X2 0.978∗0.992∗∗0.998∗∗0.961∗0.973∗X30.9430.984∗0.987∗0.964∗X40.984∗0.9200.951∗X50.975∗0.984∗∗X60.985∗JWX1 0.984∗0.980∗1.000∗∗0.996∗∗0.8810.925X2 0.994∗∗0.986∗0.990∗∗0.9490.968∗X30.983∗0.979∗0.951∗0.940X40.996∗∗0.8870.927X50.8960.952∗X60.944
注:*.P<0.05;**.P<0.01。
Note: *.P<0.05;**.P<0.01.
3 讨论与结论
土壤盐碱化会影响土壤的理化性质,导致植株的生长受到抑制。本试验结果表明,HYD和JW地上、下部在高浓度处理下均表现出不同程度的萎蔫现象,这可能是由于土壤中存在大量盐碱离子,由于土壤中的理化性质发生变化,营养离子无法被植株根系吸收和利用,植株根系吸收大量和盐碱离子,影响根系对水分。但是,两品种芸豆幼苗的地上、下部在低浓度S1(0.4%)处理下表现均优于S0处理,这可能由于盐碱胁迫影响了土壤生态环境中的微生物和土壤酶的活性,影响了芸豆幼苗根部对于水分和养分的吸收,促进了芸豆幼苗的生长。除此之外,HYD对盐碱胁迫的耐受性要优于JW。
在土壤生态系统中,土壤微生物是重要组成部分之一,它直接参与到土壤养分循环和作物获取养分这2个过程中,能够很好地反映土壤肥力[16]。细菌、真菌和放线菌作为土壤微生物的主要生物量,它们的数量会对土壤的生化活性以及土壤养分产生直接的影响,其数量变化和种类组成能够准确地反映出土壤中物质代谢的旺盛程度。因此,土壤微生物数量是表征土壤肥力的重要参数之一[17]。目前,关于盐碱胁迫对根际土壤微生物数量影响的研究已有大量报道,孙慧等[18]报道,盐碱胁迫使土壤中微生物多样性降低,微生物种类改变;白晶芝等[19]研究证实,随着盐碱胁迫的加大,各处理根际土壤细菌群落的丰富度出现了较为明显的差异。本试验研究结果表明,在不同的盐碱胁迫浓度水平下,芸豆根际土壤中的细菌、真菌和放线菌的数量随着盐碱胁迫强度增加而呈现出先升高后降低的趋势,在低浓度 S1(0.4%)处理下达到最大值,且高浓度 S3(1.2%)处理下微生物数量显著低于S0。对根际土壤微生物群落数量进行比较发现,两芸豆品种根际土壤中的微生物群落数目均以细菌居优势,放线菌次之,真菌最少。这说明了一定浓度的盐碱胁迫处理能够促进芸豆根际微生物数量的生长,但高浓度盐碱胁迫处理则会抑制微生物生长。两品种间进行比较,在相同盐碱处理浓度下,HYD根际土壤微生物的数量显著高于JW。产生这些结果的原因可能是因为在一定的盐碱胁迫处理下,芸豆根系通过分泌一些物质来缓解一定的盐碱胁迫,从而来适应环境的变化[20]。即在一定的低浓度盐碱胁迫处理下,芸豆可能通过分泌一定量的根系分泌物来促进根际土壤微生物数量的增加,提高土壤的生化活性,提高土壤养分,促进芸豆的生长,以此来适应盐碱胁迫;但是高浓度的盐碱胁迫处理会直接导致根际土壤微生物的逃离或者死亡,可能是由于在强度较大的盐碱胁迫处理下根系分泌物会加快根际微环境的恶化,进而对根际土壤微生物的生长和繁殖产生制约[21],需要进一步的研究证实。此外,随着盐碱浓度的增大,细菌在微生物数量中的比重呈现先增高后降低的趋势,而真菌在微生物数量中的比重则呈现出相反的趋势,说明一定浓度的盐碱胁迫下,促进有益菌的增多,可能会对植株的抗病性产生影响,导致植物的生长受到抑制,具体原因需要进一步研究证明。
土壤酶活性可以反映出土壤中的有机物质转化速度以及土壤腐殖质化的强度[22]。脲酶是水解酶,在土壤中很活跃,可以直接参与到土壤中有机氮的转化过程。土壤磷酸酶活性高低直接影响着土壤中有机磷的分解转化,过氧化氢酶属于氧化还原酶类,可以分解土壤中的H2O2 ,从而保护植物以免遭受到毒害[23] 。在盐碱胁迫对植物根际土壤酶活性的影响方面,已经有不少学者进行了研究,但是研究结果并不一致,颜路明等[24]研究发现,不同浓度盐碱胁迫处理对脲酶和碱性磷酸酶活性影响呈现先升高后降低的趋势;曹帮华等[25]研究发现,土壤pH值与土壤脲酶、蔗糖酶活性间均呈负相关关系,但与过氧化氢酶活性呈不显著相关关系。本试验结果表明,在不同浓度盐碱胁迫处理下,随着盐碱处理浓度的升高,两芸豆品种根际土壤脲酶、碱性磷酸酶、过氧化氢酶活性均呈现出先升高后降低的趋势,在低浓度S1(0.4%)处理下的芸豆幼苗根际土壤脲酶、碱性磷酸酶、过氧化氢酶活性均呈现出不同程度的增高,且与S0处理差异显著(P<0.05)。究其原因可能是在低浓度盐碱胁迫下,细菌、真菌、放线菌等微生物数量的增加活化了其他的微生物,而土壤微生物具有较大的生物量、较高的代谢活性及短暂的生命周期的特点,使得大量的胞外酶能够产生和释放,进而促进了土壤酶活性的升高,继而提高了土壤中物质能量代谢的速度,导致土壤养分升高,提高植株对于养分的吸收,有益于植株的生产与产量;或者是低浓度盐碱胁迫下,植物根系分泌物导致土壤微生物胞内酶、胞外酶比例失调或酶构象发生改变,增强酶活性[26]。但是,高浓度盐碱胁迫严重的抑制了土壤酶的活性,与S0处理相比差异达到显著水平(P<0.05)。产生这一结果的原因可能是高盐碱胁迫环境抑制了大多数微生物生长受到威胁,导致土壤中微生物的数量减少,抑制微生物释放具有酶促作用的有机物,进而降低土壤酶活性,影响和减弱了植株的抵抗能力,导致植株的生长受到影响;或者可能与土壤 pH 值和土壤理化性质的改变有关,在高浓度盐碱胁迫处理下,土壤 pH 升高,H+ 浓度会影响土壤吸附的酶的稳定性以及改变酶的反应基点,从而增强 pH 变化对一些酶促反应的影响,使这些反应甚至只能在较窄的 pH 范围内进行[27]。有研究表明,土壤磷酸酶与 pH 值均呈不同程度的负相关关系,pH值的降低有利于磷酸酶活性的上升[28]。另外,较高pH会导致土壤中的有机质含量普遍较低,不利于土壤微生物的生长并对土壤酶活性物质的吸附产生影响,并且高浓度处理下土壤中含盐量较高,盐析效应以及特殊离子的毒害也可能导致酶活性物质脱水失活,对土壤酶活性产生抑制作用。
土壤的生物活性与土壤酶活性呈正相关,随着土壤酶活性的升高,土壤的生物活性上升[29]。相关分析进一步表明,土壤酶与土壤微生物之间密切相关。本试验结果表明,芸豆根际土壤中细菌数量与脲酶、磷酸酶和过氧化氢酶活性均呈不同程度的正相关,其中细菌数量与脲酶活性呈显著或极显著相关,这说明细菌数量的增多会促进土壤酶的活性,进而可能会活化土壤中的被盐碱胁迫而固化的营养元素,影响植株对于养分的吸收,促进植株的生长;真菌数量与脲酶、磷酸酶和过氧化氢酶也呈现出不同程度的正相关关系,其中真菌数量与脲酶活性、过氧化氢酶活性呈显著或极显著相关;放线菌数量与脲酶、磷酸酶活性均呈不同程度的正相关,其中放线菌与脲酶呈显著相关。产生这一结果的原因可能是芸豆对盐碱胁迫处理的响应不同,根系分泌物的组成成分和含量不同,对根际土壤中微生物数量和土壤酶活性都会产生不同的影响。此外,刘磊等[30]研究证实,不同耐盐能力的品种之间差异显著,且耐盐品种微生物数量较高,本试验结果显示,JW根际土壤微生物数量和土壤酶活性显著低于HYD的,因此,可以认为HYD的耐盐碱能力高于JW的,产生这一结果的原因可能是由于芸豆品种根系分泌物的组成和含量有差异,从而导致两芸豆品种之间根际土壤微生物数量的差异,也可能由于2个品种自身对于盐碱胁迫的耐受能力不同和自身基因的差异,可为耐盐碱品种的筛选提供理论依据。除此之外,土壤环境相对较为复杂,根际微生物的数量和酶活性也会由于非生物等外界因素的干扰而发生变化,但具体原因还需进一步深入研究。
本试验结果表明,在盐碱胁迫条件下,pH上升,微生物数量发生变化,导致酶活性改变,间接改变根际土壤微环境,使植株的株高、根长、地上生物量和地下生物量等发生变化。盐碱胁迫处理对芸豆根际土壤微生物数量与酶活性有较为明显的影响,且土壤微生物数量与酶活性之间有一定的相关关系,脲酶活性与细菌数量、真菌数量、放线菌数量和微生物总量,磷酸酶活性与放线菌数量,过氧化氢酶活性与真菌数量均呈显著正相关;不同品种与不同浓度处理间芸豆根际土壤微生物数量及酶活性有显著性差异,HYD的根际土壤微生物数量及酶活性均显著高于JW的;在高浓度盐碱胁迫处理下,芸豆根际土壤微生物数量和酶活性的胁迫效应明显,但当达到适宜的浓度时却有一定的促进作用,即一定量的盐碱胁迫有利于提高芸豆根际土壤微生物数量及酶活性。
[1] 张体彬, 展小云, 冯浩. 盐碱地土壤酶活性研究进展和展望[J]. 土壤通报,2017, 48(2): 495-500.doi:10.19336/j.cnki.trtb.2017.02.35.
Zhang T B, Zhan X Y, Feng H. Research advance and prospect of soil enzyme activities in saline-alkali soils [J]. Chinese Journal of Soil Science, 2017, 48(2): 495-500.
[2] 殷厚民,胡建,王青青, 许晓鸿, 张玉斌. 松嫩平原西部盐碱土旱作改良研究进展与展望 [J]. 土壤通报,2017, 48(1): 236-242. doi: 10.19336/j.cnki.trtb.2017.01.31.
Yin H M, Hu J, Wang Q Q, Xu X H, Zhang Y B. Advance and prospect of the research on improvement by dry farming measures of saline-alkali soils in western Songnen Plain of China [J]. Chinese Journal of Soil Science, 2017, 48(1): 236-242.
[3] 杜双奎, 王华, 聂丽洁. 芸豆淀粉理化特性研究[J]. 中国粮油学报, 2012, 27(8): 31-35.10.3969/j.issn.1003-0174.2012.08.007.
Du S K, Wang H, Nie L J. Study on physical and chemical properties of kidney bean starch [J]. Journal of the Chinese Cereals and Oils Association, 2012,27(8):31-35.
[4] 马瑞瑞, 高小丽, 崔雯雯, 杨秋歌, 马淑蓉, 高金锋, 王鹏科, 冯佰利. 芸豆连作田土壤酶活性和养分含量研究[J]. 华北农学报, 2013, 28(5): 157-162.
Ma R R, Gao X L, Cui W W, Yang Q G, Ma S R, Gao J F, Wang P K, Feng B L. Research on soil nutrient and soil enzyme in kidney bean field with continuous cropping [J]. Acta Agriculturae Boreali-sinica, 2013,28(5):157-162.
[5] 孟宪欣, 王强, 张威. 芸豆品种龙芸豆5号及栽培要点 [J]. 中国种业, 2010(4): 73. doi: 10.19462/j.cnki.1671-895x.2010.04.038.
Meng X X, Wang Q, Zhang W. Longyungdou No.5 of common bean variety and its cultivation points[J]. China Seed Industry, 2010(4): 73.
[6] 马玲, 马琨, 杨桂丽, 牛红霞, 代晓华. 马铃薯连作栽培对土壤微生物多样性的影响[J]. 中国生态农业学报, 2015, 23(5): 589-596. doi:10.13930/j.cnki.cjea.140888.
Ma L, Ma K, Yang G L, Niu H X, Dai X H. Effects of continuous potato cropping on the diversity of soil microorganisms[J]. Chinese Journal of Eco-Agriculture, 2015, 23(5): 589-596.
[7] 莫俊杰, 彭诗春, 叶昌辉, 陈妤, 周鸿凯. 盐胁迫下甘蔗根际土壤微生物量及其酶活性的效应分析[J]. 广东农业科学, 2016, 43(6): 103-108. doi:10.16768/j.issn.1004-874X.2016.06.018.
Mo J J, Peng S C, Ye C H, Chen Y, Zhou H K. Effects of salt stress on microbial biomass and enzyme activities in rhizospheric soil of sugarcane [J]. Guangdong Agricultural Sciences, 2016,43(6):103-108.
[8] Chen G C, He Z L, Wang Y J.Impact of pH on microbial biomass carbon and microbial biomass phosphorus in red soils[J].Pedosphere,2004,14(1):9-15.
[9] 谢显传, 张少华, 王冬生, 皇甫伟国, 杨挺, 赵健. 阿维菌素对蔬菜地土壤微生物及土壤酶的生态毒理效应[J]. 土壤学报, 2007, 44(4): 740-743.10.3321/j.issn:0564-3929.2007.04.023.
Xie X C, Zhang S H, Wang D S, Huangpu W G, Yang T, Zhao J. Eco-toxlcological effects of abamectin on vegetable-growing soil microorganisms and enzymes activity [J]. Acta Pedologica Sinica, 2007,44(4):740-743.
[10] 张旭龙, 马淼, 吴振振, 张志政, 高睿, 石灵玉. 不同油葵品种对盐碱地根际土壤酶活性及微生物群落功能多样性的影响[J]. 生态学报, 2017, 37(5): 1659-1666. doi: 10.5846/stxb201510172095.
Zhang X L,Ma M,Wu Z Z,Zhang Z Z,Gao R,Shi L Y. Effects of Helianthus annuus varieties on rhizosphere soil enzyme activities and microbial community functional diversity of saline-alkali land in Xinjiang[J]. Acta Ecologica Sinica, 2017, 37(5): 1659-1666.
[11] 万忠梅, 宋长春. 土壤酶活性对生态环境的响应研究进展[J]. 土壤通报, 2009, 40(4): 951-956. doi:10.19336/j.cnki.trtb.2009.04.050.
Wan Z M, Song C C. Advance on response of soil enzyme activity to ecological environment[J]. Chinese Journal of Soil Science, 2009, 40(4): 951-956.
[12] 邵丽, 谷洁, 张社奇, 高华, 秦清军. 生物复混肥对土壤微生物功能多样性及土壤酶活性的影响[J]. 农业环境科学学报, 2012, 31(6): 1153-1159.
Shao L, Gu J, Zhang S J, Gao H, Qin Q J. Effects of bio-compound fertilizer on corn soil microbial community and enzyme activities [J]. Journal of Agro-environment Science, 2012,31(6):1153-1159.
[13] 郑丽娜, 梁海芸, 于崧, 于立河, 李欣, 陈心悦, 宋永峰, 杨煊禹. 盐碱胁迫对芸豆种子萌发特性的影响[J]. 种子, 2018, 37(11): 73-78. doi: 10.16590/j.cnki.1001-4705.2018.11.073.
Zheng L N, Liang H Y, Yu S, Yu L H, Li X, Chen X Y, Song Y F, Yang X Y. Effects of saline-alkali stress on seed germination characteristics of common bean[J]. Seed, 2018, 37(11): 73-78.
[14] Semida W M,Rady M M. Presoaking application of propolis and maize grain extracts alleviates salinity stress in common bean(Phaseolus vulgaris L.)[J]. Sci Horticulturae, 2014, 168: 210-217. doi: 10.1016/j.scienta.2014.01.042.
[15] 林先贵. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社, 2010:243-253.
Lin X G. Principles and methods of siol microbiology research. [M]. Beijing: Higher Education Press,2010:243-253.
[16] 沈仁芳, 赵学强. 土壤微生物在植物获得养分中的作用[J]. 生态学报, 2015, 35(20): 6584-6591. doi: 10.5846/stxb201506051140.
Shen R F, Zhao X Q. Role of soil microbes in the acquisition of nutrients by plants[J]. Acta Ecologica Sinica, 2015, 35(20):6584-6591.
[17] Mackay J E, Cunningham S C, Cavagnaro T R.Riparian reforestation: are there changes in soil carbon and soil microbial communities? [J].Science of the Total Environment,2016,566-567:960-967. doi:10.1016/j.scitotenv.2016.05.045.
[18] 孙慧, 张建锋, 许华森, 陈光才, 王利平. 余姚滨海不同盐碱度土壤微生物群落组成及土壤酶活性的变化[J]. 应用生态学报, 2016, 27(10): 3361-3370. doi: 10.13287/ j.1001-9332.201610.034.
Sun H, Zhang J F, Xu H S, Chen G C, Wang L P. Variations of soil microbial community composition and enzyme activities with different salinities on Yuyao coast,Zhejiang [J]. Chinese Journal of Applied Ecology, 2016, 27(10):3361-3370.
[19] 白晶芝, 赵源, 吴凤芝. 盐碱胁迫对黄瓜嫁接苗根际土壤细菌和真菌群落结构及丰度的影响[J]. 中国生态农业学报, 2017, 25(11): 1626-1635. doi: 10.13930/j.cnki.cjea.170302.
Bai J Z, Zhao Y, Wu F Z. Effects of saline-alkali stress on structure and abundance of bacteria/fungi community in rhizosphere soil of grafted cucumber seedlings [J]. Chinese Journal of Eco-agriculture, 2017,25(11):1626-1635.
[20] 吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J]. 植物生态学报, 2014, 38(3): 298-310. doi:10.3724/SP.J.1258.2014.00027.
Wu L K, Lin X M, Lin W X. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates [J]. Chinese Journal of Plant Ecology, 2014,38(3):298-310.
[21] Van overbeek L S,Saikkonen K.Impact of bacterial-fungal interactions on the colonization of the endosphere[J].Trends in Plant Science,2016,21(3):230-242. doi: 10.1016/j.tplants.2016.01.003.
[22] 褚素贞, 张乃明, 史静. 云南省设施土壤过氧化氢酶活性变化趋势研究[J]. 中国农学通报, 2015, 31(15): 220-225.
Chu S Z, Zhang N M, Shi J. Research on the variation trend of greenhouse soil hydrogen peroxidase activities inYunnan province [J]. Chinese Agricultural Science Bulletin, 2015,31(15):220-225.
[23] 曾宪军, 刘登魁, 朱世民. 不同浓度阿特拉津对三种肥力条件土壤过氧化氢酶的影响[J]. 湖南农业科学, 2005(6): 33-35. doi: 10.3969/j.issn.1006-060X.2005.06.014.
Zeng X J, Liu D K, Zhu S M. Effects of different concentration of atrazine on soil catalase activity under three soil fertilities[J]. Hunan Agricultural Sciences, 2005(6): 33-35.
[24] 颜路明, 郭祥泉. 盐碱胁迫对香樟幼苗根际土壤酶活性的影响 [J]. 土壤, 2017, 49(4): 733-737. doi: 10.13758/j.cnki.tr.2017.04.014.
Yan L M, Guo X Q. Effect of salinity-alkalinity stress on the rhizosphere soil enzyme activity of camphor seedlings [J]. Soils, 2017, 49(4):733-737.
[25] 曹帮华, 吴丽云. 滨海盐碱地刺槐白蜡混交林土壤酶与养分相关性研究 [J]. 水土保持学报,2008, 22(1):128-133. doi: 10.13870/j.cnki.stbcxb.2008.01.039.
Cao B H, Wu L Y. Studies on soil enzyme activity and soil nutrient content of mixed stands with Robinia pseudoacacia and Fraxinus velutina in coastal saline soil[J]. Journal of Soil and Water Conservation, 2008, 22(1): 128-133.
[26] 袁光林, 马瑞霞, 刘秀芬, 孙思恩. 化感物质对土壤脲酶活性的影响[J]. 环境科学, 1998, 19(2):55-57.
Yuan G L, Ma R X, Liu X F, Sun S E. Effects of allelochemicals on uricase activity[J]. Environmental Science, 1998, 19(2):55-57.
[27] 金兰淑, 申龙, 刘艳茹, 李平, 王建国.鸡粪与四环素对土壤脲酶和磷酸酶活性的影响[J]. 农业环境科学学报, 2013, 32(5): 986-990. doi: 10.11654/jaes.2013.05.016.
Jin L S, Shen L, Liu Y R, Li P, Wang J G. Effect of chicken manure and tetracycline on soil urease and phosphatase activity[J]. Journal of Agro-Environment Science, 2013, 32(5): 986-990.
[28] 朱芸芸, 李敏, 曲博, 赵暾, 滕泽栋. 湿地植物根际土壤磷酸酶活性变化规律研究[J]. 环境科学与技术, 2016, 39(10): 106-112. doi: 10.3969/j.issn.1003-6504.2016.10.020.
Zhu Y Y, Li M, Qu B, Zhao T, Teng Z D. Research on the variations of phosphatase activity in rhizosphere soil of wetland plants[J]. Environmental Science & Technology, 2016, 39(10): 106-112.
[29] 田幼华, 吕光辉, 杨晓东, 谢辉, 孙丽君. 水盐胁迫对干旱区植物根际土壤酶活性的影响[J]. 干旱区资源与环境, 2012, 26(3): 158-163.
Tian Y H, Lü G H, Yang X D, Xie H, Sun L J. Influence of water and saline stress on rhizosphere soil enzymes′activities for arid region plants [J]. Journal of Arid Land Resources and Environment, 2012,26(3):158-163.
[30] 刘磊, 李彩凤, 郭广昊, 桑丽敏, 郭剑, 陈明, 盖志佳, 于洋, 王玉波. NaCl+Na2SO4胁迫对甜菜根际土壤微生物数量及酶活性的影响[J]. 核农学报, 2016, 30(10): 2033-2040. doi: 10.11869/j.issn.100-8551. 2016.10.2033.
Liu L, Li C F, Guo G H, Sang L M, Guo J, Chen M, Gai Z J, Yu Y, Wang Y B. Effects of NaCl+Na2SO4 stress on rhizosphere soil microbial quantity and enzyme activity of sugar beet [J]. Journal of Nuclear Agricultural Sciences, 2016, 30(10): 2033-2040.