土壤在生物圈具有重要的生态功能,是人类赖以生存的物质基础和重要载体[1]。近年来,由于工农业及采矿业的快速发展,土壤重金属污染问题日益严重[2]。镉是毒性最强的重金属之一,具有半衰期长,不易降解等特点,在土壤中长期积累不仅会影响植株的生长发育,还会通过食物链危害人体健康[3]。调查发现,我国土壤的镉含量呈逐年递增的趋势,土壤受镉污染的情况令人担忧,这严重阻碍了我国农业的可持续发展[4]。镉是植物的非必需营养元素,长期被植物吸收不仅会抑制细胞分裂,延缓植株生长,还会破坏细胞结构,扰乱植物新陈代谢,最终影响经济作物的品质与产量[5-6]。面对日益严峻的镉污染问题,科研工作者提出可通过土壤淋洗[7]、动电修复[8]、客土改良[9]等物理修复技术,添加石灰[10]、沸石[11]、腐殖质[12]固化螯合土壤重金属等化学修复技术,植物修复技术[13]及微生物修复技术[14]等生物修复技术来净化污染土壤。但这些技术在改良土壤环境的同时也存在着成本高、操作难、耗时长等缺陷,很难大面积的推广应用。因此,在经济作物的栽培过程中,通过适宜的方法措施来提高植物对土壤重金属的抗逆性,减少植株对重金属的积累是目前符合国情的可行途径。
褪黑素(Melatonin,MT)是广泛存在于动、植物以及微生物体内的小分子内分泌激素,属吲哚类化合物,能与羟自由基以及过氧自由基发生反应[15]。褪黑素在植物体中具有调节昼夜节律,促进不定根生长,提高种子发芽率,增强植物抗逆性等重要生理功能[16]。目前已有研究证明,外源褪黑素在缓解重金属对植物的毒害作用发挥着重要作用。唐懿等[17]研究表明,在镉胁迫下,不同浓度褪黑素浸种处理可以在提高豌豆幼苗生物量、含水量、光合色素量以及抗氧化酶活性的同时,还能有效降低其根系及地上部分的镉含量。刘自力等[18]对小白菜叶面喷施褪黑素(100 μmol/L)后发现,外源褪黑素可以有效减缓镉胁迫对小白菜的毒害作用,并能通过降低小白菜对镉吸收的相关基因转录水平来降低小白菜幼苗的镉积累量。另外在水培条件下,根施适宜浓度的外源褪黑素可以通过提高水稻体内不易迁移的氯化钠提取态镉的比例,降低易迁移的水溶态及乙醇提取态镉的比例进而降低水稻对镉的吸收和转运[19]。这些研究表明,外源褪黑素具有提高植物对镉胁迫的抗逆性以及降低植物镉含量的潜力,可以在作物栽培的同时有效降低经济作物对土壤镉的富集能力。根系是植物与土壤的接触部位,在吸收土壤各种元素的同时还会释放大量根系分泌物,直接或间接地改变根际理化性质,进而影响土壤重金属的化学形态[20]。目前,多数科研人员将研究重点集中在褪黑素对植物生理生化的响应上,但有关外源褪黑素对植物根际影响的研究甚少,需要进一步探究。
豆瓣菜(Nasturtium officinale)是十字花科,豆瓣菜属的多年生草本植物,其茎叶可供食用,具有脆嫩多汁,清香可口,营养丰富等特点,广受人们的青睐[21]。但研究发现豆瓣菜对镉及其敏感,0.05 mg/L的Cd2+就能对豆瓣菜的细胞造成一定程度伤害并降低其光能利用率[22]。鉴于此,本试验以豆瓣菜为材料,研究了不同浓度褪黑素对豆瓣菜镉积累的影响,以期筛选出既能降低豆瓣菜镉含量又能提高其产量的最佳褪黑素浓度,为镉污染地区的豆瓣菜栽培提供参考。
1 材料和方法
1.1 供试材料
2017年5月,在四川农业大学成都校区(30°71′ N, 103°87′ E)周围农田收集豆瓣菜种子并保存备用。供试土壤为水稻土,取自四川农业大学成都校区周围农田(pH值7.42,有机质31.73 g/kg,全氮1.05 g/kg,全磷0.37 g/kg,全钾25.71 g/kg,碱解氮56.13 mg/kg,速效磷17.15 mg/kg,速效钾56.65 mg/kg,全镉0.025 mg/kg),土壤理化性质参照鲍士旦[23]方法测定。
1.2 试验方法
2017年9月,将土壤风干、压碎、混匀、过筛(孔径6.72 mm)后,分别精确称取10 kg装于23 cm×30 cm(高×直径)的塑料盆内,加入分析纯CdCl2·2.5H2O溶液至土壤田间持水量的60%,使其镉含量为5 mg/kg。在避雨棚内自然放置28 d后,待土壤风干,再将所有土壤倒出、压碎、混匀后,均匀地分装于23 cm×30 cm(高×直径)的塑料盆内备用,确保处理间的土壤理化性质保持一致。2017年10月,分别在准备好的含镉土壤中添加褪黑素溶液,使土壤褪黑素含量分别为:0,25,50,100,150,200 μmol/kg,添加方法同上述含镉土壤的制备方法。2017年9月,将豆瓣菜种子撒播于装有湿润基质的培养皿中,在25 ℃,4 000 lx光照强度条件下的培养箱中育苗。1个月后(2017年10月),待豆瓣菜幼苗的5片真叶完全展开,高约10 cm时选择长势一致的幼苗分别移栽至准备好的塑料盆中(每盆栽植3株,每个褪黑素浓度设置5个重复),在自然条件下,于四川农业大学成都校区避雨棚内栽培。在豆瓣菜的生长过程中不定期浇水,保持土壤处于淹水状态并不定期更换盆与盆的位置以减弱边际效应。2个月后(2017年12月),摘取豆瓣菜幼嫩叶片,参照李合生[24]的方法测定其叶绿素、可溶性蛋白的含量以及超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性。之后,整株收获豆瓣菜并拆分其根、茎、叶,用自来水洗净后,再用去离子水反复冲洗,于105 ℃的烘箱中杀青15 min后,在70 ℃条件下烘干至恒质量,用电子天平分别称取豆瓣菜根、茎、叶的重量。之后,粉碎植物样品并分别称取0.5 g,采用硝酸-高氯酸(4∶1)混合酸高温消煮法测定样品镉含量[23]。收集种植过豆瓣菜的土壤并去除土壤掺杂物,风干,粉碎,过1 mm筛后分别称取10 g土样于烧杯中,加入去离子水25 mL,用玻璃棒搅拌混匀后静置30 min,用8205型笔式pH计测定悬液pH值。土壤有效态镉含量采用DTPA-TEA浸提法测定[23]。土壤脲酶采用苯酚-次氯酸钠比色法测定,其活性以在37 ℃培养24 h后每克土壤中NH3-N的毫克数表示[25]。土壤蔗糖酶采用3,5-二硝基水杨酸比色法测定,其活性以在37 ℃培养24 h后每克土壤中生成葡萄糖毫克数表示[25]。土壤过氧化氢酶采用高锰酸钾滴定法测定,其活性以每克土壤在37 ℃培养1 h后消耗0.1 mol/L KMnO4的毫升数表示[25]。
1.3 数据处理与分析
采用SPSS 13.0统计软件(IBM,Chicago,IL,USA),通过单向ANOVA和Duncan的多范围检验在P=0.05置信水平下对试验结果进行统计分析。转运系数=植物地上部分镉含量/根系镉含量[25]。
2 结果与分析
2.1 不同浓度褪黑素对豆瓣菜生物量的影响
由表1 可知,随着褪黑素浓度的升高,豆瓣菜根、茎、叶、地上部分及整株的生物量均出现先上升后下降的趋势,且都在褪黑素浓度为50 μmol/kg时达到最大(P<0.05)。当褪黑素浓度为50 μmol/kg时,豆瓣菜根、茎、叶、地上部分及整株的生物量分别较对照提高了31.23%,32.87%,8.16%,12.88%,15.53%。另外,当褪黑素浓度为100,150,200 μmol/kg时,豆瓣菜各部分的生物量均显著低于对照(P<0.05)。当褪黑素浓度为200 μmol/kg时,豆瓣菜根、茎、叶、地上部分及整株的生物量分别较对照降低了59.29%,79.02%,66.61%,68.98%,67.58%。
表1 不同浓度褪黑素对豆瓣菜生物量的影响
Tab.1 Effects of different concentrations of melatonin on the biomass in N. officinale g
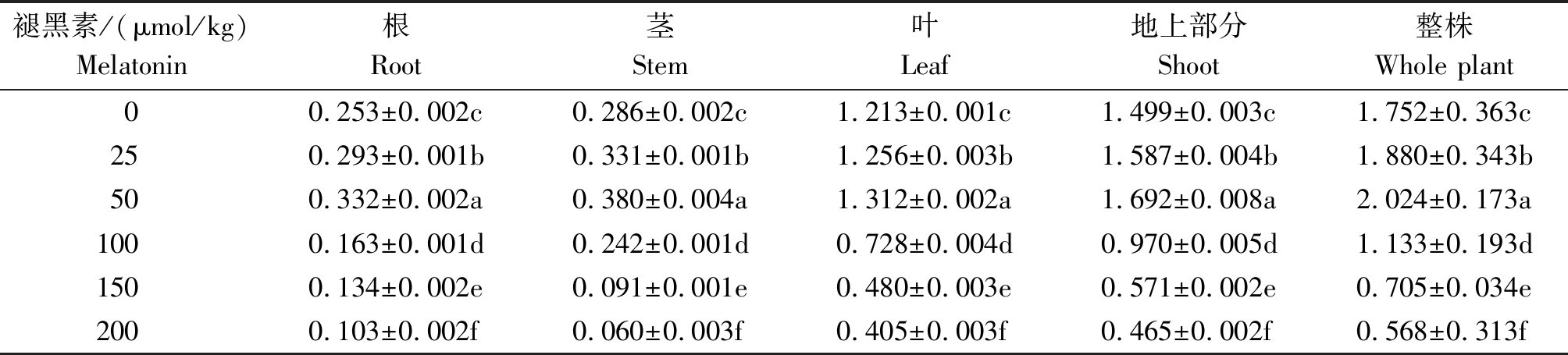
褪黑素/(μmol/kg)Melatonin根Root茎Stem叶Leaf地上部分Shoot整株Whole plant00.253±0.002c0.286±0.002c1.213±0.001c1.499±0.003c1.752±0.363c250.293±0.001b0.331±0.001b1.256±0.003b1.587±0.004b1.880±0.343b500.332±0.002a0.380±0.004a1.312±0.002a1.692±0.008a2.024±0.173a1000.163±0.001d0.242±0.001d0.728±0.004d0.970±0.005d1.133±0.193d1500.134±0.002e0.091±0.001e0.480±0.003e0.571±0.002e0.705±0.034e2000.103±0.002f0.060±0.003f0.405±0.003f0.465±0.002f0.568±0.313f
注:数据为平均值±标准差;2组处理数据后的英文字母若完全不同,则表示这2组处理间的数据差异显著(P<0.05)。表2-5同。
Note:The data were mean ± standard deviation. If the English letters of the two groups were completely different, the difference between the two groups was significant difference(P<0.05). The same as Tab.2-5.
2.2 不同浓度褪黑素对豆瓣菜叶绿素含量的影响
由表2 可知,豆瓣菜叶绿素a、叶绿素b、类胡萝卜素及叶绿素总量从大到小的顺序均为:50,25,0,100,150,200 μmol/kg。相较于对照,当褪黑素浓度为50 μmol/kg时,豆瓣菜叶绿素a、叶绿素b、类胡萝卜素及叶绿素总量均最高,分别较对照提高了12.99%,13.59%,13.11%,11.48%。另外,当褪黑素为100,150,200 μmol/kg时,豆瓣菜叶绿素a、叶绿素b及叶绿素总量均低于对照(P>0.05)。当褪黑素浓度为200 μmol/kg时,豆瓣菜叶绿素a、叶绿素b、类胡萝卜素及叶绿素总量最低,分别较对照降低了12.16%,15.22%,12.82%,13.11%。对豆瓣菜叶绿素a/b而言,只有50 μmol/kg浓度的褪黑素降低了豆瓣菜叶绿素a/b,其他浓度褪黑素处理则提高了豆瓣菜叶绿素a/b。
表2 不同浓度褪黑素对豆瓣菜叶绿素含量的影响
Tab.2 Effects of different concentrations of melatonin on chlorophyll content in N. officinale mg/g
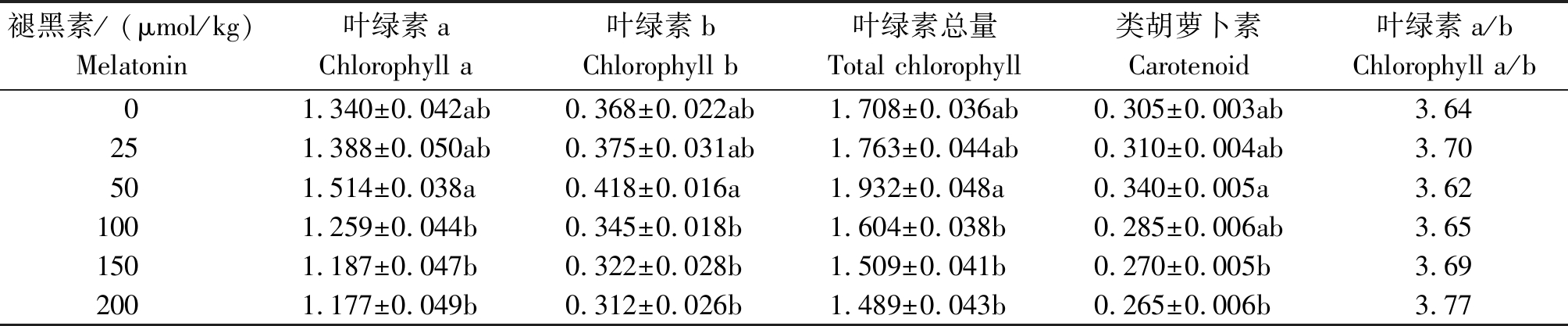
褪黑素/ (μmol/kg)Melatonin叶绿素aChlorophyll a叶绿素bChlorophyll b叶绿素总量Total chlorophyll类胡萝卜素Carotenoid叶绿素a/bChlorophyll a/b01.340±0.042ab 0.368±0.022ab1.708±0.036ab0.305±0.003ab 3.64251.388±0.050ab0.375±0.031ab 1.763±0.044ab 0.310±0.004ab 3.70501.514±0.038a 0.418±0.016a 1.932±0.048a 0.340±0.005a 3.621001.259±0.044b0.345±0.018b1.604±0.038b0.285±0.006ab3.651501.187±0.047b 0.322±0.028b1.509±0.041b0.270±0.005b3.692001.177±0.049b0.312±0.026b1.489±0.043b0.265±0.006b3.77
2.3 不同浓度褪黑素对豆瓣菜抗氧化酶活性的影响
由表3 可知,在镉胁迫下,随着褪黑素浓度的升高,豆瓣菜叶片的SOD、POD、CAT活性均出现了上升的趋势。对豆瓣菜SOD活性而言,所有褪黑素处理均显著提高了其SOD活性(P<0.05),当褪黑素浓度为200 μmol/kg时,豆瓣菜SOD活性较对照显著提高了138.76%(P<0.05)。对豆瓣菜POD活性而言,当褪黑素浓度为150,200 μmol/kg时显著提高了豆瓣菜POD活性,分别较对照提高了37.05%,48.52%(P<0.05)。对豆瓣菜CAT活性而言,所有褪黑素处理均显著提高了其CAT活性(P<0.05),当褪黑素浓度为200 μmol/kg时,豆瓣菜CAT活性较对照显著提高了45.70%(P<0.05)。
表3 不同浓度褪黑素对豆瓣菜抗氧化酶活性的影响
Tab.3 Effects of different concentrations of melatonin on antioxidant enzyme activities in N. officinale U/g
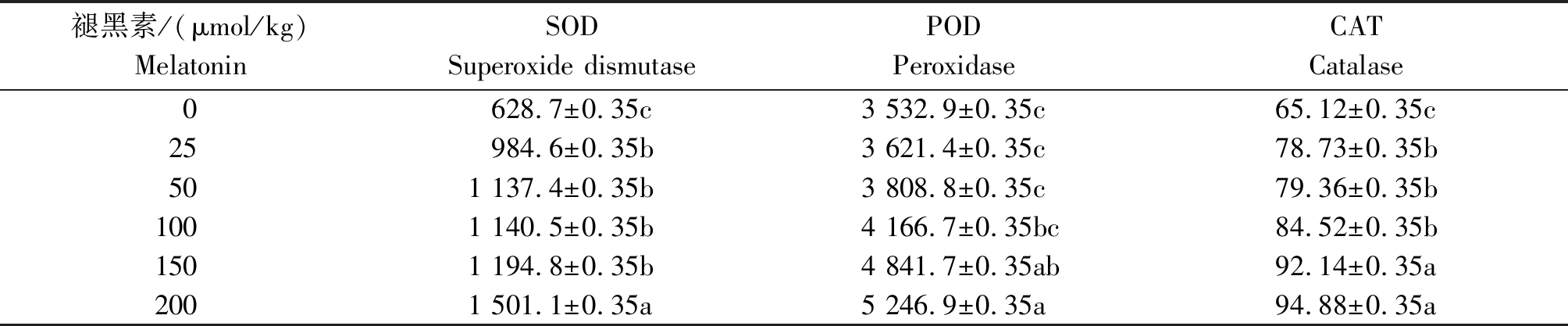
褪黑素/(μmol/kg)MelatoninSODSuperoxide dismutasePODPeroxidaseCATCatalase0628.7±0.35c3 532.9±0.35c65.12±0.35c25984.6±0.35b3 621.4±0.35c78.73±0.35b501 137.4±0.35b3 808.8±0.35c79.36±0.35b1001 140.5±0.35b4 166.7±0.35bc84.52±0.35b1501 194.8±0.35b4 841.7±0.35ab92.14±0.35a2001 501.1±0.35a5 246.9±0.35a94.88±0.35a
2.4 不同浓度褪黑素对豆瓣菜镉含量的影响
由表4 可知,在镉胁迫下,随着褪黑素浓度的升高,豆瓣菜根、茎、叶及地上部分的镉含量均出现先下降后上升的趋势,且豆瓣菜根、茎、叶的镉含量从大到小的顺序均为:200,150,100,0,25,50 μmol/kg。与对照相比,褪黑素浓度为25,50 μmol/kg时显著降低了豆瓣菜各部分的镉含量(P<0.05),而褪黑素浓度为150,200 μmol/kg时显著提高了豆瓣菜各部分的镉含量(P<0.05)。当褪黑素浓度为50 μmol/kg时,豆瓣菜根、茎、叶及地上部分的镉含量最低,分别较对照降低了9.82%,7.42%,8.19%,9.07%。当褪黑素浓度为200 μmol/kg时,豆瓣菜根、茎、叶及地上部分的镉含量达到最高,分别较对照提高了20.87%,28.53%,26.40%,29.09%。对豆瓣菜的转运系数而言,只有当褪黑素浓度为100 μmol/kg时降低了豆瓣菜的转运系数,其余处理对其转运系数均有所提升。
表4 不同浓度褪黑素对豆瓣菜镉含量的影响
Tab.4 Effects of different concentrations of melatonin on cadmium content in N. officinale mg/kg
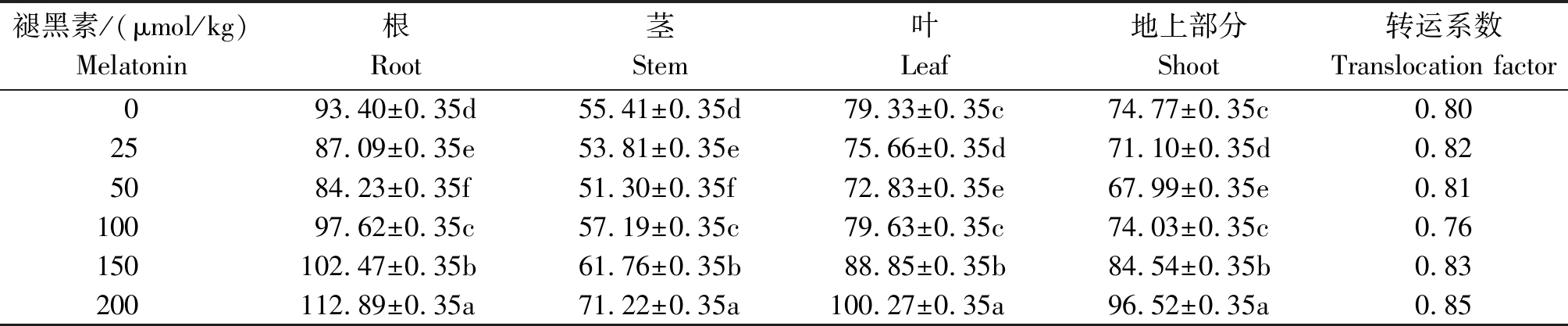
褪黑素/(μmol/kg)Melatonin根Root茎Stem叶Leaf地上部分Shoot转运系数Translocation factor093.40±0.35d55.41±0.35d79.33±0.35c74.77±0.35c0.802587.09±0.35e53.81±0.35e75.66±0.35d71.10±0.35d0.825084.23±0.35f51.30±0.35f72.83±0.35e67.99±0.35e0.8110097.62±0.35c57.19±0.35c79.63±0.35c74.03±0.35c0.76150102.47±0.35b61.76±0.35b88.85±0.35b84.54±0.35b0.83200112.89±0.35a71.22±0.35a100.27±0.35a96.52±0.35a0.85
2.5 不同浓度褪黑素对土壤酶活性的影响
由表5 可知,在镉胁迫条件下,褪黑素对土壤脲酶及过氧化氢酶活性的影响均不显著(P>0.05)。对土壤蔗糖酶而言,随着褪黑素浓度的升高土壤蔗糖酶的活性出现上升的趋势。相较于对照,所有褪黑素处理均显著提高了土壤蔗糖酶的活性(P<0.05),其中当褪黑素浓度为200 μmol/kg时,土壤蔗糖酶的活性达到最大,较对照提高了271.80%(P<0.05)。
表5 不同浓度褪黑素对土壤酶活性的影响
Tab.5 Effects of different concentrations of melatonin on soil enzyme activities
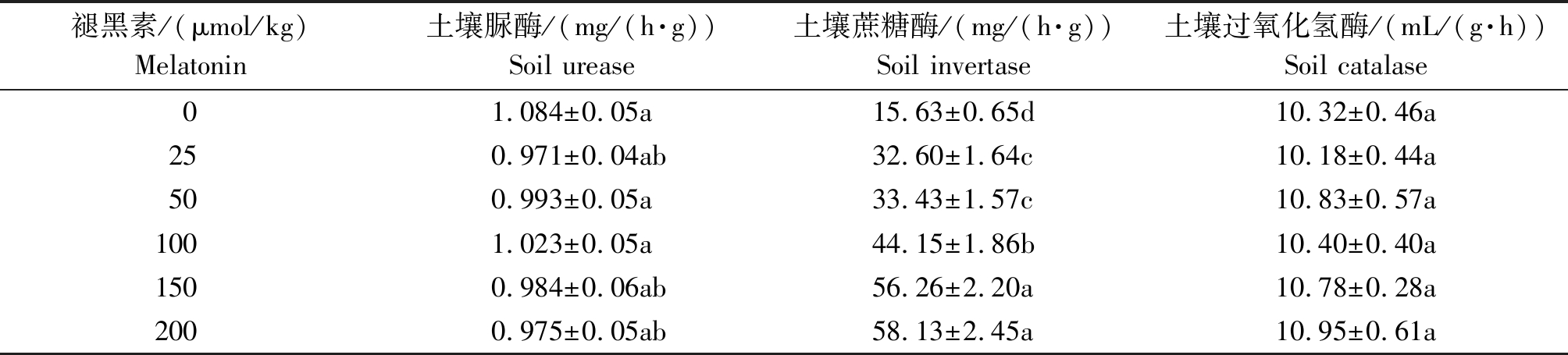
褪黑素/(μmol/kg)Melatonin土壤脲酶/(mg/(h·g))Soil urease土壤蔗糖酶/(mg/(h·g))Soil invertase土壤过氧化氢酶/(mL/(g·h))Soil catalase01.084±0.05a15.63±0.65d 10.32±0.46a250.971±0.04ab32.60±1.64c 10.18±0.44a500.993±0.05a33.43±1.57c 10.83±0.57a1001.023±0.05a44.15±1.86b10.40±0.40a1500.984±0.06ab56.26±2.20a10.78±0.28a2000.975±0.05ab58.13±2.45a10.95±0.61a
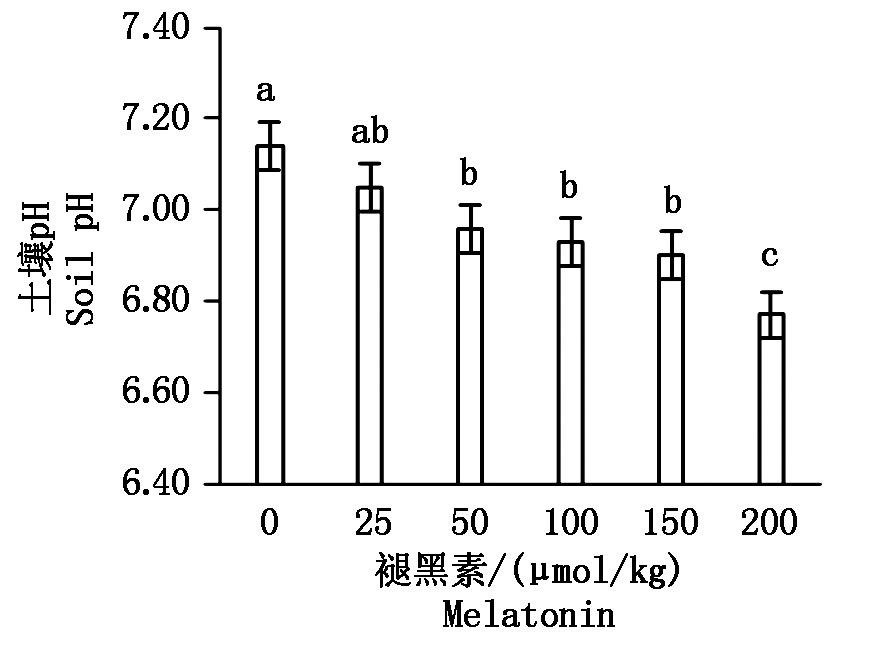
2.6 不同浓度褪黑素对土壤pH值及土壤有效态镉含量的影响
由图1可知,在镉污染条件下,相较于对照,外源褪黑素不同程度降低了土壤pH值。随着褪黑素浓度的升高,土壤pH值出现下降的趋势,其中当褪黑素浓度为50,100,150,200 μmol/kg时土壤pH值均显著低于对照(P<0.05)。由图2可知,相较于对照,外源褪黑素显著提高了土壤有效态镉含量(P<0.05)。随着褪黑素浓度的升高,土壤有效态镉含量出现上升的趋势,其中当褪黑素浓度为150,200 μmol/kg时土壤有效态镉含量均显著高于对照(P<0.05)。
2组处理数据间的英文字母若完全不同,则表示这2组处理间的数据差异显著(P<0.05)。图2同。
If the English letters of the two groups were completely different, the difference between the two groups was significant difference(P<0.05). The same as Fig.2.
图1 土壤pH值
Fig.1 Soil pH
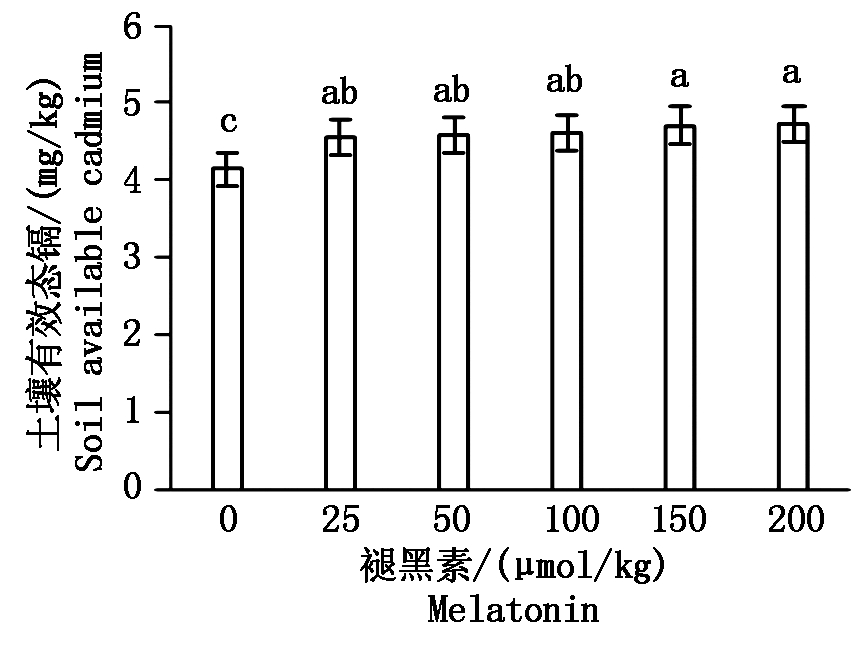
图2 土壤有效镉含量
Fig.2 Soil available cadmium concentration
3 结论与讨论
褪黑素是一种与IAA类似的吲哚类化合物,能够调节植物的生长发育,具有促进细胞膨大,节间生长,子叶延伸等作用[26]。Chen等[27]研究发现,低浓度外源褪黑素显著促进了芥菜根部的生长,但高浓度褪黑素则表现出抑制作用。刘仕翔等[19]在镉胁迫下对水稻根施不同浓度褪黑素后发现,随着外源褪黑素浓度的升高,水稻幼苗根系及地上部分的生物量均出现先上升后下降的趋势。本试验结果表明,不同浓度褪黑素对豆瓣菜根、茎、叶生物量的影响均具有低促高抑的作用,与前人的结果相似。这说明在镉胁迫下适宜浓度的外源褪黑素可以有效促进豆瓣菜的生长,可能与褪黑素可以提高植物对非生物胁迫的抗逆性,进而缓解了镉胁迫对豆瓣菜的毒害作用有关。而高浓度褪黑素可能抑制了豆瓣菜体内IAA的合成,并通过钙调蛋白引起微管蛋白的解聚,破坏了细胞的纺锤体结构进而影响了豆瓣菜的生长[28]。
褪黑素作为一种抗氧化剂,可以通过减缓叶绿素降解,增强抗氧化防御系统,降低重金属积累量等多种途径提高植物对不利环境的抵抗力[29]。光合作用是植物将光能、无机物转化为化学能及有机物的重要过程,也是植物生长发育的重要基础[30]。植物的光和色素含量与其光合作用密切相关,研究发现,镉胁迫不仅会直接破坏叶绿体结构还会显著降低叶片的光和色素含量,进而影响植物的光合作用[31]。黄佳璟等[32]在镉胁迫下对萝卜喷施褪黑素后发现,萝卜叶片的光合色素含量随着褪黑素浓度的升高出现了先增加后降低的趋势。另外,外源褪黑素还能显著缓解镉胁迫对小白菜叶绿素的降解幅度,提高植物的光合参数[18]。这些研究表明,褪黑素在镉胁迫下在保护叶绿素、延缓叶片衰老、增强光合效率等方面具有重要作用。本试验发现,豆瓣菜叶绿素a、叶绿素b及类胡萝卜素含量均随着褪黑素浓度的升高出现了先上升后下降的趋势,且都在褪黑素浓度为50 μmol/kg时达到峰值,出现这样的结果可能与豆瓣菜体内的镉含量有关。在镉胁迫下,豆瓣菜各部位的镉含量随着外源褪黑素浓度的升高出现了先下降后上升的趋势,且均在褪黑素浓度为50 μmol/kg时最低,与豆瓣菜光和色素含量的变化趋势相反。因此,可以推断适宜浓度的褪黑素可能通过降低豆瓣菜对土壤镉的吸收和转移,缓解了叶片光和色素的分解,进而提高了豆瓣菜叶绿素及类胡萝卜素的含量。在自然状态下,植物体内的活性氧及抗氧化系统处于动态平衡,植物在重金属胁迫下会催化产生大量活性氧自由基(ROS),易对植物的细胞膜及核酸、脂肪、蛋白质等大分子造成氧化性损伤[33]。为减缓逆境条件下的氧化胁迫,植物体内形成了一道由SOD、POD以及CAT组成的抗氧化系统,可以有效清除植物体内的自由基和活性氧,维持细胞及生物大分子结构的完整性[34]。研究证明,褪黑素在植物体内具有广泛的抗氧化功能,还能够与ROS反应形成抗氧化作用更强的N1-乙酰-N2-甲酰-5-甲氧犬脲酰胺(AFMK),两者通过协同作用,可进一步增强植物的抗逆性[35]。另外,其他研究表明,褪黑素对植物抗氧化酶的活性具有显著的促进作用,可以间接提高植物的抗氧化能力[36]。本试验发现,外源褪黑素显著提高了豆瓣菜叶片的SOD、POD、CAT活性,且随着褪黑素浓度的升高出现了上升的趋势。其相关机理可能是因为褪黑素能够与植物的细胞膜受体结合,影响细胞内的磷酸化级联反应从而引起豆瓣菜抗氧化酶相关基因的上调[37]。
镉离子在土壤中经过溶解、络合、沉淀等作用具有多种化学形态,与土壤酶活性及植物有效性密切相关[38]。有效态镉是指土壤中植物可利用态镉的总含量,是影响植物吸收并转移土壤镉的重要因素之一[39]。研究表明,土壤pH值是影响重金属离子在土壤中吸附-解吸、溶解-沉淀等反应的重要因子,对重金属离子的迁移及有效态的影响超过其他任何单一因素[40]。曹胜等[41]研究了不同酸碱度调节剂对稻田土壤中有效态镉的影响,发现土壤的有效态镉含量与其土壤pH值呈极显著负相关。本试验表明,种植豆瓣菜的土壤pH值及有效态镉含量随着褪黑素浓度的升高分别出现了下降和上升的趋势。这可能是因为外源褪黑素直接作用于豆瓣菜根系并促进其释放了某些酸性物质,导致土壤pH值下降,进而提高了土壤中的有效态镉含量[42]。另外,本研究发现豆瓣菜根、茎、叶的镉含量随着外源褪黑素浓度的升高呈先下降后上升的趋势,与土壤有效态镉含量的变化趋势不同。这说明适宜浓度的外源褪黑素可以有效降低豆瓣菜各部位的镉含量,但不只与土壤有效态镉含量有关,可能还与褪黑素具有影响植物装载转运镉元素的相关基因转录水平有关[18],需要进一步研究。土壤酶是推动土壤养分循环,参与土壤代谢过程的重要有机物,其活性高低可在一定程度上反映土壤各生化反应的方向和程度,也是评价诊断土壤重金属污染物生态效应的重要指标[43-44]。本试验结果显示,在镉胁迫下,外源褪黑素显著提高了种植豆瓣菜的土壤蔗糖酶的活性,且随着褪黑素浓度的升高呈现上升的趋势。罗虹等[45]采用回归正交设计研究了重金属对土壤酶活性的影响,结果表明,重金属复合污染与6种土壤酶之间均呈显著或极显著的相关关系。在本试验中,土壤有效态镉含量及土壤蔗糖酶的活性均随着外源褪黑素浓度的升高呈上升趋势,说明土壤蔗糖酶活性可能与土壤有效态镉含量存在紧密关系,对土壤镉的生物有效性具有指示作用。
综上所述,适宜浓度的褪黑素不仅对豆瓣菜的生物量、光和色素含量以及抗氧化酶活性都有显著的促进作用,还能有效降低豆瓣菜各部分的镉含量。在所有处理中,当褪黑素浓度为50 μmol/kg时,豆瓣菜根、茎、叶的镉含量均显著低于其他处理,生物量及光合色素含量均达到峰值,在提高豆瓣菜产量的同时有效降低了豆瓣菜对土壤镉的吸收。
[1] 苗亚琼, 林清. 广西土壤重金属镉污染及对人体健康的危害[J]. 环境与可持续发展, 2016, 41(5): 170-173. doi: 10.3969/j.issn.(673-288X.2016.05.046).
Miao Y Q, Lin Q. Pollution caused by heavy metal cadmium to the soil in Guangxi and its harm to human health [J]. Environment and Sustainable Development, 2016, 41(5): 170-173.
[2] 张连科, 李海鹏, 黄学敏, 李玉梅, 焦坤灵, 孙鹏, 王维大. 包头某铝厂周边土壤重金属的空间分布及来源解析[J]. 环境科学, 2016, 37(3): 1139-1146. doi: 10.13227/j.hjkx.2016.03.045.
Zhang L K, Li H P, Huang X M, Li Y M, Jiao K L, Sun P, Wang W D. Soil heavy metal spatial distribution and source analysis around an aluminum plant in baotou [J]. Environmental Science, 2016, 37(3): 1139-1146.
[3] 欧阳燕莎, 刘爱玉, 李瑞莲. 镉对作物的影响及作物对镉毒害响应研究进展[J]. 作物研究, 2016, 30(1): 105-110. doi:10.16848/j.cnki.issn.1001-5280.2016.01.027.
Ouyang Y S, Liu A Y, Li R L. Research progress on effects of cadmium on crops and the response of crops to cadmium [J]. Crop Research, 2016,30(1):105-110.
[4] 李婧, 周艳文, 陈森, 高小杰. 我国土壤镉污染现状、危害及其治理方法综述[J]. 安徽农学通报, 2015, 21(24): 104-107. doi:10.3969/j.issn.1007-7731.2015.24.044.
Li J, Zhou Y W, Chen S, Gao X J. Actualities, damage and management of soil cadmium pollution in China [J]. Anhui Agricultural Science Bulletin, 2015, 21(24):104-107.
[5] Asgher M, Khan M R, Anjum N A, Khan N A. Minimising toxicity of cadmium in plants-role of plant growth regulators[J].Protoplasma,2015,252(2):399-413. doi: 10.1007/s00709-014-0710-4.
[6] Shahid M, Dumat C, Khalid S, Niazi N K, Antunes P M C. Cadmium bioavailability, uptake, toxicity and detoxification in soil-plant system[J]. Reviews of Environmental Contamination and Toxicology, 2017, 241: 73-137. doi: 10.1007/398_2016_8.
[7] 李玉双, 胡晓钧, 孙铁珩, 侯永侠, 宋雪英, 杨继松, 陈红亮. 污染土壤淋洗修复技术研究进展[J]. 生态学杂志, 2011, 30(3): 592-602. doi: 10.13292/j.1000-4890.2011.0077.
Li Y S, Hu X J, Sun T H, Hou Y X, Song X Y, Yang J S, Chen H L. Soil washing/flushing of contaminated soil a review [J]. Chinese Journal of Ecology, 2011, 30(3):592-602.
[8] Zhang Y W, Huang T, Huang X, Faheem M A, Yu L, Jiao B Q, Yin G Z, Shiau Y C, Li D W.Study on electro-kinetic remediation of heavy metals in municipal solid waste incineration fly ash with a three-dimensional electrode[J].RSC Advances,2017,7(45):27846-27852.doi:10.1039/c7ra01327b.
[9] 侯李云, 曾希柏, 张杨珠. 客土改良技术及其在砷污染土壤修复中的应用展望[J]. 中国生态农业学报, 2015, 23(1): 20-26.doi:10.13930/j.cnki.cjea.140797.
Hou L Y, Zeng X B, Zhang Y Z. Application and outlook of alien earth soil-improving technology in arsenic-contaminated soil remediation [J]. Chinese Journal of Eco-agriculture, 2015, 23(1):20-26.
[10] Singh J, Kalamdhad A S.Effect of lime on speciation of heavy metals during composting of water hyacinth[J].Frontiers of Environmental Science and Engineering,2016,10(1):93-102.doi:10.1007/s11783-014-0704-7.
[11] He K, Chen Y C, Tang Z H, Hu Y Y. Removal of heavy metal ions from aqueous solution by zeolite synthesized from fly ash[J].Environmental Science and Pollution Research,2016,23(3):2778-2788. doi:10.1007/s11356-015-5422-6.
[12] 毕冬雪, 邓亚娟, 孟凡德, 韦婧, 王海龙, 袁国栋. 腐殖质纳米颗粒对镉污染土壤的修复[J]. 环境工程学报, 2018, 12(5): 1295-1302. doi: 10.12030/j.cjee.201711218.
Bi D X, Deng Y J, Meng F D, Wei J, Wang H L, Yuan G D. Humic nanoparticles for remediation of Cd-contaminated soils [J]. Chinese Journal of Environmental Engineering, 2018, 12(5):1295-1302.
[13] Mahar A, Wang P, Ali A, Awasthi M K, Lahori A H, Wang Q, Li R H, Zhang Z Q. Challenges and opportunities in the phytoremediation of heavy metals contaminated soils: A review[J].Ecotoxicology and Environmental Safety,2016,126:111-121.doi:10.1016/j.ecoenv.2015.12.023.
[14] 张彩丽. 微生物修复重金属污染土壤的研究进展[J]. 安徽农业科学, 2015, 43(16): 225-229. doi: 10.13989/j.cnki.0517-6611.2015.16.080.
Zhang C L. Research process on treatment of heavy metal contaminated soil by microbial remediation [J]. Journal of Anhui Agricultural Sciences, 2015, 43(16): 225-229.
[15] 王蕊, 杨小龙, 须晖, 李天来. 高等植物褪黑素的合成和代谢研究进展[J]. 植物生理学报, 2016, 52(5): 615-627. doi: 10.13592/j.cnki.ppj.2016.0052.
Wang R, Yang X L, Xu H, Li T L. Research progress of melatonin biosynthesis and metabolism in higher plants [J]. Plant Physiology Journal, 2016, 52(5): 615-627.
[16] Sharif R, Xie C, Zhang H Q, Arnao M B, Ali M, Ali Q, Muhammad I, Shalmani A, Nawaz M A, Chen P, Li Y H. Melatonin and its effects on plant systems[J].Molecules,2018,23(9):2352-2371. doi:10.3390/molecules23092352.
[17] 唐懿, 任纬, 刘副刚, 李焕秀, 廖明安, 蒋伟, 林立金. 褪黑素浸种对豌豆幼苗生长及镉积累的影响[J]. 土壤, 2018, 50(1): 109-114. doi: 10.13758/j.cnki.tr.2018.01.015.
Tang Y, Ren W, Liu F G, Li H X, Liao M A, Jiang W, Lin L J. Effects of melatonin soaking on growth and cadmium accumulation of pea seedlings [J]. Soils, 2018, 50(1):109-114.
[18] 刘自力, 黄一凡, 朱正波, 陈亚华, 崔瑾. 叶面喷施褪黑素对小白菜幼苗镉耐性的影响[J]. 植物生理学报, 2018, 54(4): 660-668. doi: 10.13592/j.cnki.ppj.2018.0066.
Liu Z L, Huang Y F, Zhu Z B, Chen Y H, Cui J. Effects of foliar feeding of melatonin on cadmium tolerance of Chinese cabbage seedlings [J]. Plant Physiology Journal, 2018, 54(4): 660-668.
[19] 刘仕翔, 黄益宗, 罗泽娇, 黄永春, 杨秀文. 褪黑素对水稻镉积累及其化学结合形态的影响[J]. 应用生态学报, 2017, 28(5): 1588-1594. doi: 10.13287/j.1001-9332.201705.027.
Liu S X, Huang Y Z, Luo Z J, Huang Y C, Yang X W. Effects of exogenous melatonin on accumulation and chemical form of Cd in rice [J]. Chinese Journal of Applied Ecology, 2017, 28(5):1588-1594.
[20] Zhan F D, Qin L, Guo X H, Tan J B, Liu N N, Zu Y Q, Li Y. Cadmium and lead accumulation and low-molecular-weight organic acids secreted by roots in an intercropping of a cadmium accumulator sonchus asper l. with Vicia faba L.[J]. RSC Advances, 2016, 6(40): 33240-33248. doi: 10.1039/c5ra26601g.
[21] Pinela J, Barreira J C, Barros L, Verde S C, Antonio A L, Carvalho A M, Oliveira M B, Ferreira I C. Suitability of gamma irradiation for preserving fresh-cut watercress quality during cold storage[J].Food Chemistry,2016,206:50-58.doi:10.1016/j.foodchem.2016.03.050.
[22] 宋关玲. 铜和镉对水体修复植物西洋菜的生理影响[J]. 东北林业大学学报, 2008, 36(2): 42-44. doi: 10.13759/j.cnki.dlxb.2008.02.011.
Song G L. Physiological effects of copper and cadmium on Nasturtium officinale R.Br [J]. Journal of North-East Forestry University, 2008, 36(2):42-44.
[23] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.
Bao S D. Soil and agricultural chemistry analysis [M]. Beijing: China Agriculture Press,2000.
[24] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
Li H S. Principles and techniques of plant physiological and biochemical experiments[M]. Beijing: Higher Education Press,2000.
[25] Rastmanesh F, Moore F, Keshavarzi B. Speciation phytoavailability of heavy metals in contaminated soils in sarcheshmeh area, Kerman province,Iran[J].Bulletin of Environmental Contamination and Toxicology,2010,85(5):515-519. doi: 10.1007/s00128-010-0149-z.
[26] Arnao M B, Hernández-Ruiz J. Functions of melatonin in plants: A Review[J]. Journal of Pineal Research, 2015, 59(2): 133-150. doi: 10.1111/jpi.12253.
[27] Chen Q, Qi W B, Reiter R J, Wei W, Wang B M. Exogenously applied melatonin stimulates root growth and raises endogenous indoleacetic acid in roots of etiolated seedlings of Brassica juncea[J].Journal of Plant Physiology,2009,166(3):324-328.doi:10.1016/j.jplph.2008.06.002.
[28] ![]() I. Melatonin in higher plants: occurrence and possible functions[J].Journal of Pineal Research,2005,39(4):333-341.doi:10.1111/j.1600-079X.2005.00276.x.
I. Melatonin in higher plants: occurrence and possible functions[J].Journal of Pineal Research,2005,39(4):333-341.doi:10.1111/j.1600-079X.2005.00276.x.
[29] 姜超强, 祖朝龙. 褪黑素与植物抗逆性研究进展[J]. 生物技术通报, 2015, 31(4): 47-55. doi: 10.13560/j.cnki.biotech.bull.1985.2015.03.013.
Jiang C Q, Zu C L. Advances in melatonin and its roles in abiotic stress resistance in plants [J]. Biotechnology Bulletin, 2015, 31(4): 47-55.
[30] 李合生. 现代植物生理学[M]. 3版. 北京: 高等教育出版社, 2012.
Li H S. Modern plant physiology [M]. 3rd. Beijing: Higher Education Press,2012.
[31] 李佩华. 铅,镉胁迫对马铃薯叶绿素含量及细胞超微结构的影响[J]. 湖北农业科学, 2015, 54(16): 3974-3977. doi: 10.14088/j.cnki.issn0439-8114.2015.16.036.
Li P H. Effects of Pb and Cd on chlorophyll content and cell ultrastructure of potato [J]. Hubei Agricultural Sciences, 2015,54(16):3974-3977.
[32] 黄佳璟, 林立金, 陈发波, 魏斩连, 温铿, 王铤, 刘磊, 廖明安, 任纬. 喷施褪黑素对萝卜生长及镉积累的影响[J]. 四川农业大学学报, 2017, 35(3): 375-380. doi: 10.16036/j.issn.1000-2650.2017.03.014.
Huang J J, Lin L J, Chen F B, Wei Z L, Wen K, Wang D, Liu L, Liao M A, Ren W. Effects of spraying melatonin on growth and cadmium accumulation of radish [J]. Journal of Sichuan Agricultural University, 2017, 35(3): 375-380.
[33] 郭瞻宇, 张子杨, 蒋亚辉, Lahori A H, 张增强, 李荣华. 不同品种芥菜对镉胁迫的敏感性分布及抗氧化特征[J]. 农业环境科学学报, 2018, 37(12): 2660-2668. doi: 10.11654/jaes.2018-0202.
Guo Z Y, Zhang Z Y, Jiang Y H, Lahori A H, Zhang Z Q, Li R H. Assessment of variation in sensitivity and antioxidant characteristics of different mustard cultivars under different Cd stress leaves [J]. Journal of Agro-environment Science, 2018,37(12):2660-2668.
[34] Salin M L.Toxic oxygen species and protective systems of the chloroplast[J].Physiologia Plantarum,1988,72(3):681-689. doi: 10.1111/j.1399-3054.1988.tb09182.x.
[35] Zhang N, Zhao B, Zhang H J, Weeda S, Yang C, Yang Z C, Ren S X, Guo Y D. Melatonin promotes water-stress tolerance, lateral root formation, and seed germination in cucumber(Cucumis sativus L.)[J].Journal of Pineal Research, 2013, 54(1):15-23.doi:10.1111/j.1600-079X.2012.01015.x.
[36] Arnao M B, Hern ndez-Ruiz J. Chemical stress by different agents affects the melatonin content of barley roots[J].Journal of Pineal Research,2009,46(3):295-299.doi:10.1111/j.1600-079X.2008.00660.x.
ndez-Ruiz J. Chemical stress by different agents affects the melatonin content of barley roots[J].Journal of Pineal Research,2009,46(3):295-299.doi:10.1111/j.1600-079X.2008.00660.x.
[37] 王怀清, 刘志民. 褪黑素及其代谢物抗氧化作用研究进展[J]. 国际内分泌代谢杂志, 2009, 29(2): 129-131. doi: 10.3760/cma.j.issn.1673-4157.2009.02.018.
Wang H Q, Liu Z M. Progress on antioxidant properties of melatonin and its metabolites [J]. International Journal of Endocrinology and Metabolism, 2009, 29(2): 129-131.
[38] Ma L Q, Rao G N. Chemical fractionation of cadmium, copper, nickel, and zinc in contaminated soils[J].Journal of Environmental Quality,1997,26(1):259-264.doi:10.2134/jeq1997.00472425002600010036x.
[39] 张磊,孟湘萍. 不同水分条件下镉在土壤中形态转化的动态过程[J]. 安徽农业科学, 2008, 36(17): 7332-7334. doi: 10.13989/j.cnki.0517-6611.2008.17.039.
Zhang L, Meng X P. Dynamic process of the morphological transformation of cadmium in soil under different moisture conditions [J]. Journal of Anhui Agricultural Sciences, 2008, 36(17): 7332-7334.
[40] Yu H Y, Liu C P, Zhu J S, Li F B, Deng D M, Wang Q, Liu C S. Cadmium availability in rice paddy fields from a mining area: the effects of soil properties highlighting Iron fractions and pH value[J].Environmental Pollution, 2016, 209: 38-45. doi: 10.1016/j.envpol.2015.11.021.
[41] 曹胜, 周卫军, 罗思颖, 周雨舟, 谭洁, 段群涛. 酸碱度调节剂对稻田土壤中有效态镉的影响研究[J]. 中国农学通报, 2017,33(30):97-102.
Cao S, Zhou W J, Luo S Y, Zhou Y Z, Tan J, Duan Q T. Effect of pH adjustor on available cadmium in paddy soils [J]. Chinese Agricultural Science Bulletin, 2017, 33(30): 97-102.
[42] Montiel-Rozas M M,Madejón E, Madejón P. Effect of heavy metals and organic matter on root exudates(low molecular weight organic acids)of herbaceous species: an assessment in sand and soil conditions under different levels of contamination[J]. Environmental Pollution, 2016, 216: 273-281. doi:10.1016/j.envpol.2016.05.080.
[43] 王巧红, 董金霞, 张君, 杨万勤, 张健, 陈良华. Cd污染对3种类型土壤酶活性及Cd形态分布的影响[J]. 四川农业大学学报, 2017, 35(3): 339-344. doi: 10.16036/j.issn.1000-2650.2017.03.009.
Wang Q H, Dong J X, Zhang J, Yang W Q, Zhang J, Chen L H. Effects of Cd pollution on soil enzyme activities and Cd forms in three soil types [J]. Journal of Sichuan Agricultural University, 2017, 35(3):339-344.
[44] 郭碧林, 陈效民, 景峰, 张晓玲, 杨之江, 刘巍, 刘文心. 外源Cd胁迫对红壤性水稻土微生物量碳氮及酶活性的影响[J]. 农业环境科学学报, 2018, 37(9): 1850-1855. doi: 10.11654/jaes.2018-0344.
Guo B L, Chen X M, Jing F, Zhang X L, Yang Z J, Liu W, Liu W X. Effects of exogenous cadmium on microbial biomass and enzyme activity in red paddy soil [J]. Journal of Agro-environment Science, 2018, 37(9): 1850-1855.
[45] 罗虹, 刘鹏, 宋小敏. 重金属镉、铜、镍复合污染对土壤酶活性的影响[J]. 水土保持学报, 2006, 20(2): 94-96, 121. doi:10.3321/j.issn:1009-2242.2006.02.023.
Luo H, Liu P, Song X M. Effect of compound pollution of Cd, Cu and Ni on soil enzyme activities [J]. Journal of Soil and Water Conservation, 2006, 20(2):94-96, 121.