在各种非生物逆境胁迫中,干旱胁迫是对植物生长发育影响最大的自然灾害,对作物产量和品质产生严重影响[1-2]。有研究表明,植物在遭遇干旱胁迫时,体内会产生大量的活性氧,造成活性氧代谢失衡,给植物造成氧化损伤,光合机构遭到破坏,光合效率显著降低,植物生长发育受到严重影响[3-4]。油用向日葵(Helianthus annuus L.)属菊科(Composite)向日葵属(Helianthus),是世界重要的油料作物之一,也是我国的五大油料作物之一,在我国的东北、西北及华北地区的干旱和半干旱地区广泛种植。油用向日葵虽然具有较强的耐旱性和耐盐性,但其苗期春旱现象仍时常发生,不仅影响幼苗的生长发育,而且会对后期的营养生长和生殖生长带来严重影响,导致产量和含油量显著降低,给生产带来巨大损失。如何进一步提高油用向日葵的耐旱性,已成为油用向日葵产业发展中亟待解决的关键问题之一[5]。
褪黑素(Melatonine,MT)又称N-乙酰-5-甲氧基色胺,在动物、植物和微生物体内广泛存在,是一种潜在的生长调节剂。大量研究表明,植物体内褪黑素含量虽然较低,但是其在提高植物对冷害[6]、干旱[7]、盐胁迫[8]及重金属胁迫[9]等逆境的抗性方面发挥着重要的作用,其作用机制主要包括两方面:一方面褪黑素本身就是一种抗氧化剂,可直接中和OH·、H2O2等活性氧自由基[10];另一方面褪黑素作为一种信号分子,不仅可以诱导抗氧化酶活性(如SOD、POD、CAT、APX及GR等)和抗氧物质含量(AsA及GsH等)提高,而且可以诱导抗性基因的表达(如WRKY、bHLH及TFs等),从而提高植物抗逆性[3,6,11]。目前,关于褪黑素提高植物抗旱性的研究已有相关报道,但是尚存在一定的局限性。首先,研究对象大多集中于园艺作物(如黄瓜[12]、苹果[13]、雏菊[7]等),鲜有油料作物方面的研究报道;其次,褪黑素是否可以提高油用向日葵的耐旱性及作用机制如何尚未见相关研究报道;再次,关于褪黑素浓度效应方面的研究尚不多见,筛选褪黑素最佳施用浓度,对其在农业生产上的推广应用具有重要意义。
本研究以油用向日葵品种晋葵5号为试验材料,研究了干旱胁迫条件下不同浓度外源褪黑素对其生长、光合和抗氧化特性的影响,以探讨外源褪黑素对干旱胁迫下向日葵幼苗生长的缓解机制,筛选最佳的施用浓度,旨在为油用向日葵的抗旱栽培提供一定的理论依据。
试验在山西省农业科学院经济作物研究所试验基地塑料防雨棚内进行。供试向日葵品种为晋葵5号,由油用向日葵课题组自主选育;试验用褪黑素为分析纯,购自上海生工生物工程有限公司。
试验采用盆栽方式进行,花盆规格为45 cm×50 cm,以试验田土壤为栽培土壤,每盆装土3 kg,定植1株向日葵幼苗。共设置6个处理,即CK1(正常供水)、CK2(干旱胁迫)、S50(干旱胁迫+50 μmol/L MT)、S100(干旱胁迫+100 μmol/L MT)、S150(干旱胁迫+150 μmol/L MT)和S200(干旱胁迫+200 μmol/L MT),每个处理20盆,重复3次,共计360 盆,随机区组排列。干旱胁迫前,连续2 d傍晚在向日葵幼苗叶片喷施相应浓度的褪黑素,喷施量以水珠悬挂不滴为标准,CK1和CK2分别喷施等量清水。分别于处理后第0,5,10 天进行取样,用于测定各处理生长、光合及生理指标。
向日葵幼苗株高、茎粗分别用直尺和游标卡尺进行测定;参照刘易等[14]的方法进行叶面积测定;干质量采用烘干法进行测定;叶绿素含量测定采用丙酮-乙醇混合法;净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(Ci)和蒸腾速率(Tr)采用Li-6400便携式光合作用仪进行测定,光强为900 μmol/(m2·s),流速为500 mL/s;参照吴雪霞等[15]的方法测定向日葵幼苗叶片MDA含量、SOD、POD及CAT活性;相对电导率![]() 产生速率、H2O2含量、APX及GR活性、AsA和GsH含量参照郭欣欣等[16]的方法进行测定。
产生速率、H2O2含量、APX及GR活性、AsA和GsH含量参照郭欣欣等[16]的方法进行测定。
采用Excel 2010软件进行数据处理及作图;采用SPSS 18.0软件进行差异显著性分析。
从表1可以看出,与CK1(正常供水)相比,干旱胁迫会显著抑制向日葵幼苗生长。干旱处理达到10 d时,株高、茎粗、叶面积及干质量分别较CK1降低9.42%,7.39%,10.15%,13.18%;外源施用褪黑素可明显促进干旱胁迫下向日葵幼苗的生长,并且生长积累量随外源褪黑素浓度的升高而呈现先升高后降低的变化趋势。其中,以100 μmol/L褪黑素处理效果最佳,与CK2(干旱胁迫)相比,在干旱处理达到10 d时,株高、茎粗、叶面积及干质量分别提升7.13%,7.48%,8.13%和12.48%,较CK2、S50及S200均达到显著差异水平(P<0.05)。结果表明,干旱胁迫会显著抑制向日葵幼苗生长,而外源施用褪黑素可明显缓解干旱胁迫对向日葵幼苗生长的抑制作用,并且具有一定的剂量-效应关系,以100 μmol/L褪黑素处理效果最佳。
表1 褪黑素对干旱胁迫下向日葵幼苗生长的影响
Tab.1 Effects of melatonin on growth of sunflower seedlings under drought stress

处理时间/dTreatment time处理Treatment株高/cmHeight茎粗/cmStem diameter叶面积/cm2Leaf area干质量/gDry weight0CK117.31±2.03a0.752±0.05a6.52±1.03a0.581±0.03aCK217.36±2.15a0.753±0.11a6.53±1.11a0.583±0.15aS5017.38±2.26a0.754±0.08a6.53±1.25a0.579±0.13aS10017.32±1.93a0.753±0.13a6.52±1.36a0.579±0.11aS15017.29±2.22a0.752±0.06a6.52±1.26a0.581±0.06aS20017.33±2.06a0.753±0.05a6.53±1.61a0.582±0.13a5CK118.92±2.65e0.791±0.08d7.18±1.25d0.675±0.05eCK217.75±2.02a0.763±0.15a6.75±1.33a0.602±0.21aS5018.08±2.18bc0.773±0.18b6.91±1.15bc0.632±0.16bcS10018.56±2.13d0.788±0.21cd7.08±1.28d0.656±0.22dS15018.22±2.25c0.784±0.14c7.01±1.35cd0.641±0.13cdS20017.98±2.06ab0.769±0.18ab6.89±1.38b0.622±0.18b10CK120.59±3.05e0.852±0.12e8.08±1.55e0.812±0.25eCK218.65±2.83a0.789±0.15a7.26±1.23a0.705±0.18aS5019.02±2.56bc0.836±0.13c7.52±1.35bc0.765±0.16bcS10019.98±3.01d0.848±0.18de7.85±1.28d0.793±0.22dS15019.31±2.85c0.841±0.15cd7.63±1.46c0.779±0.26cdS20018.95±2.73ab0.814±0.21b7.34±1.22ab0.752±0.17b
注:CK1表示正常水分处理+0 μmol/L MT;CK2表示单独干旱处理;S50、S100、S150和S200分别表示干旱胁迫下,叶面喷施50,100,150,200 μmol/L MT;同列数据后不同小写字母表示差异达到显著差异水平(P<0.05)。图1-4、表2同。
Note:CK1 is the normal water and without MT treatment;CK2 represent drought stress and without MT treatment;S50,S100,S150 and S200 are represent drought stress with 50,100,150 and 200 μmol/L MT treatment respectively;Different letters in the same column indicated significant difference among treatments at 0.05 level.The same as Fig.1-4,Tab.2.
如图1所示,干旱胁迫会显著降低向日葵幼苗叶片的叶绿素含量,且干旱胁迫越重降低幅度越大。与CK1(正常供水)相比,干旱胁迫时间达到5,10 d时,向日葵幼苗叶片的叶绿素含量分别降低18.4%和47.51%。外源施用褪黑素可明显提升干旱胁迫下向日葵幼苗叶片的叶绿素含量,且提升幅度随外源褪黑素浓度的升高而呈现先升高后降低的变化趋势,其中,以100 μmol/L褪黑素处理效果最佳。在干旱处理达到10 d时,外源施用浓度为50,100,150,200 μmol/L褪黑素处理条件下,向日葵幼苗叶片的叶绿素含量分别较CK2(干旱胁迫)提升25.32%,61.43%,43.61%和18.52%,较CK2、S50、S150及S200均达到显著差异水平(P<0.05)。结果表明,干旱胁迫会显著降低向日葵幼苗叶片叶绿素含量,而外源施用褪黑素可明显提升干旱胁迫下向日葵幼苗的叶绿素含量,增强其对干旱胁迫的抗性,以100 μmol/L褪黑素处理效果最佳。
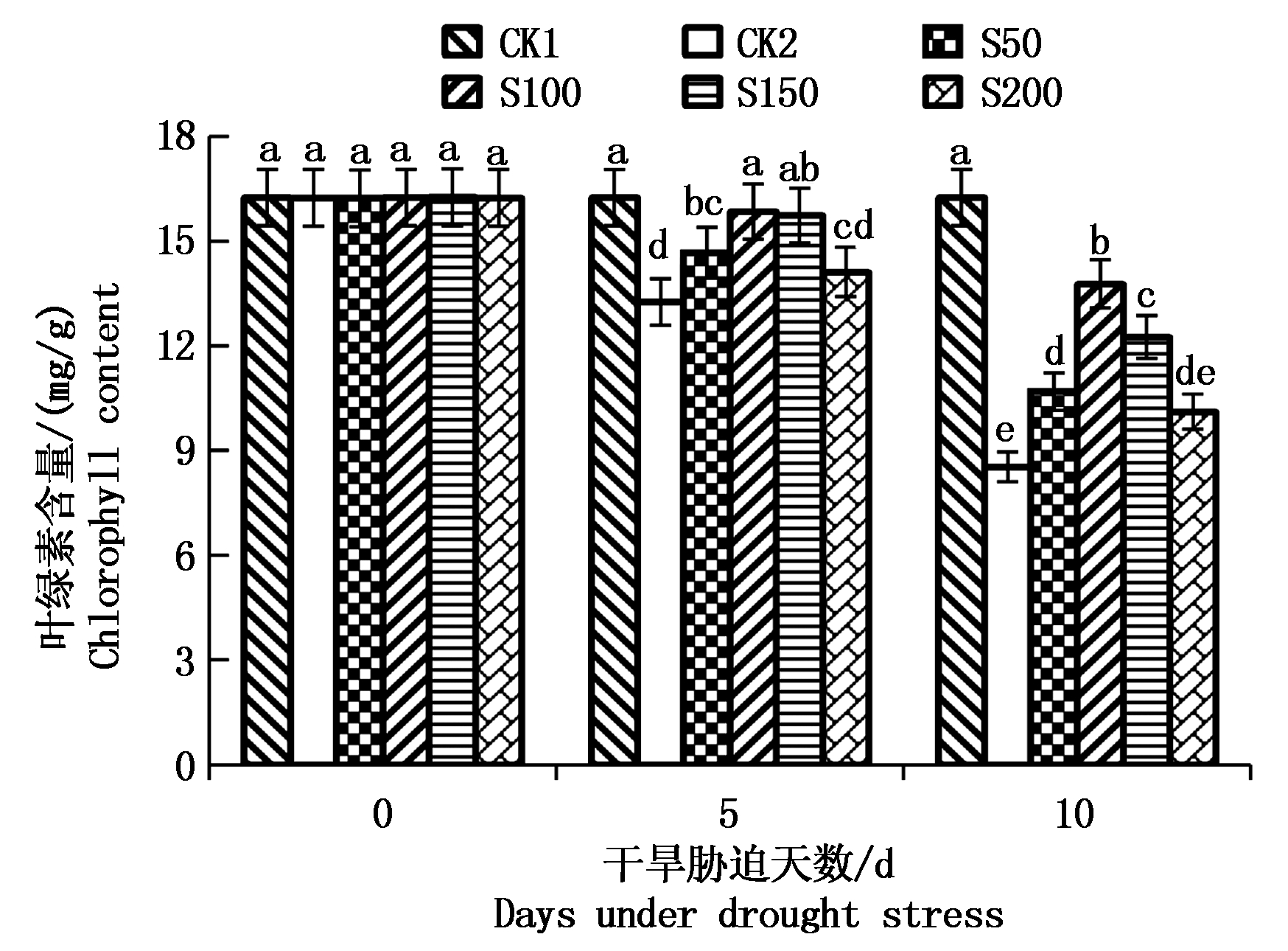
图1 褪黑素对干旱胁迫下向日葵幼苗叶片叶绿素含量的影响
Fig.1 Effects of MT on chlorophyll content of leaves in sunflower seedlings under drought stress
如图2所示,与CK1(正常供水)相比,干旱胁迫会显著抑制向日葵幼苗叶片的光合作用,其中, Pn、Gs和Tr随干旱胁迫程度加重而逐渐降低,而Ci则先下降后上升。干旱处理10 d时,Pn、Gs及Tr分别较CK1降低54.11%,60.53%和47.59%,而Ci较CK1则略有提升。外源施用褪黑素可明显促进干旱胁迫下向日葵幼苗的光合作用,且提升幅度随施用浓度增加而表现为先升高后降低;其中,以100 μmol/L褪黑素处理效果最佳,与CK2(干旱胁迫)相比,在干旱处理达到10 d时,其Pn、Gs及Tr分别提升52.71%,60.00%和39.29%,而Ci则降低12.66%,较CK2、S50及S200均达到显著差异水平(P<0.05)。结果表明,干旱胁迫会显著降低向日葵幼苗的光合效率,而外源施用褪黑素可明显缓解干旱胁迫对向日葵幼苗的伤害,提升光合效率,并且具有一定的剂量-效应关系,以100 μmol/L褪黑素处理效果最佳。

图2 褪黑素对干旱胁迫下向日葵幼苗光合作用的影响
Fig.2 Effects of MT on photosynthesis of leaves in sunflower seedlings under drought stress
由图3可知,随着干旱胁迫时间的延长,向日葵幼苗叶片的相对电导率、MDA含量、H2O2含量及![]() 产生速率均表现为逐渐上升。与CK1(正常供水)相比,干旱处理达到10 d时,相对电导率、MDA含量、H2O2含量及
产生速率均表现为逐渐上升。与CK1(正常供水)相比,干旱处理达到10 d时,相对电导率、MDA含量、H2O2含量及![]() 产生速率分别提升133.33%,135.67%,74.89%和84.83%。外源施用褪黑素可明显降低干旱胁迫下向日葵幼苗的相对电导率、MDA含量、H2O2含量及
产生速率分别提升133.33%,135.67%,74.89%和84.83%。外源施用褪黑素可明显降低干旱胁迫下向日葵幼苗的相对电导率、MDA含量、H2O2含量及![]() 产生速率,并且降低幅度随外源褪黑素浓度的升高而表现为先升高后降低;其中,以100 μmol/L褪黑素处理效果最佳,与CK2(干旱胁迫)相比,在干旱处理达到10 d时,相对电导率、MDA含量、H2O2含量及
产生速率,并且降低幅度随外源褪黑素浓度的升高而表现为先升高后降低;其中,以100 μmol/L褪黑素处理效果最佳,与CK2(干旱胁迫)相比,在干旱处理达到10 d时,相对电导率、MDA含量、H2O2含量及![]() 产生速率分别降低26.79%,35.81%,24.33%和23.13%,较CK2、S50及S200均达到显著差异水平(P<0.05)。结果表明,干旱胁迫会对向日葵幼苗产生严重危害,而外源施用褪黑素可显著抑制干旱胁迫下向日葵幼苗叶片的活性氧产生、积累和膜质过氧化,并且具有一定的剂量-效应关系,以100 μmol/L褪黑素处理效果最佳。
产生速率分别降低26.79%,35.81%,24.33%和23.13%,较CK2、S50及S200均达到显著差异水平(P<0.05)。结果表明,干旱胁迫会对向日葵幼苗产生严重危害,而外源施用褪黑素可显著抑制干旱胁迫下向日葵幼苗叶片的活性氧产生、积累和膜质过氧化,并且具有一定的剂量-效应关系,以100 μmol/L褪黑素处理效果最佳。

图3 褪黑素对干旱胁迫下向日葵幼苗相对电导率、MDA含量、H2O2含量及![]() 产生速率的影响
产生速率的影响
Fig.3 Effects of MT on the relative conductivity,MDA content,H2O2 content and ![]() producing rate of leaves in sunflower seedlings under drought stress
producing rate of leaves in sunflower seedlings under drought stress
从表2可以看出,与CK1(正常供水)相比,随着干旱胁迫时间的延长,向日葵幼苗叶片的SOD、POD、CAT、APX及GR活性均表现为先升高后降低的变化趋势。在干旱胁迫达到10 d时,SOD、POD、CAT、APX及GR活性分别较CK1(正常供水)降低21.94%,34.13%,22.44%,35.36%和56.25%。外源施用褪黑素可明显提升干旱胁迫下向日葵幼苗叶片的SOD、POD、CAT、APX及GR活性,并且5种保护酶活性提升幅度均随外源褪黑素浓度的升高而表现为先升高后降低;其中,以100 μmol/L褪黑素处理效果最佳,与CK2(干旱胁迫)相比,在干旱处理达到10 d时,其SOD、POD、CAT、APX及GR活性分别提升43.03%,70.16%,57.00%,85.22%和148.09%,较CK2、S50及S200均达到显著差异水平(P<0.05)。结果表明,向日葵幼苗通过提升自身的抗氧化酶活性来清除活性氧,从而减轻干旱胁迫对其造成的伤害;而外源施用褪黑素可明显促进干旱胁迫下向日葵幼苗的抗氧化酶活性提升,并且具有一定的剂量-效应关系,以100 μmol/L褪黑素处理效果最佳。
AsA和GSH是植物细胞内重要的抗氧化物质。由图4可知,与CK1(正常供水)相比,向日葵幼苗叶片的AsA和GSH含量随着干旱胁迫时间的延长而表现为先升高后降低的变化趋势;在干旱胁迫达到10 d时,向日葵幼苗叶片的AsA和GSH含量分别较CK1提升7.84%和35.56%。在干旱胁迫条件下,外源施用褪黑素可明显提升向日葵幼苗叶片的AsA和GSH含量,且提升幅度随施用浓度增加而表现为先升高后降低;其中,以100 μmol/L褪黑素处理效果最佳,与CK2(干旱胁迫)相比,在干旱处理达到10 d时,其AsA和GSH含量分别提升20.00%和40.98%,较CK2、S50及S200均达到显著差异水平(P<0.05)。结果表明,干旱胁迫会显著提升向日葵幼苗的AsA和GSH含量,而外源施用褪黑素则可进一步促进向日葵幼苗的AsA和GSH含量提升,并且具有一定的剂量-效应关系,以100 μmol/L褪黑素处理效果最佳。
表2 褪黑素对干旱胁迫下向日葵幼苗叶片抗氧化酶活性的影响
Tab.2 Effects of melatonin on antioxidant enzyme activity of leaves in sunflower seedlings under drought stress
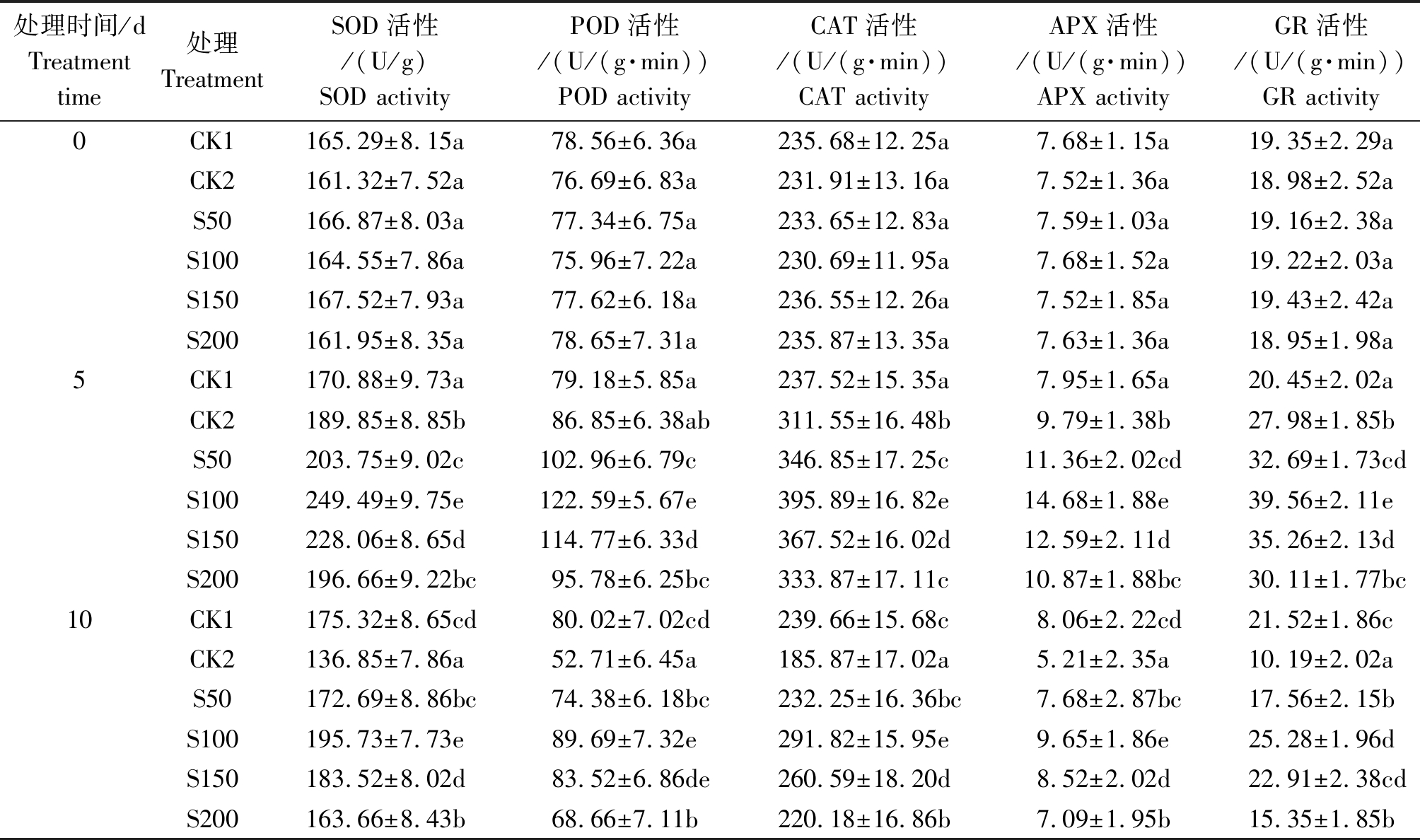
处理时间/dTreatment time处理TreatmentSOD活性/(U/g)SOD activityPOD活性/(U/(g·min))POD activityCAT活性/(U/(g·min))CAT activityAPX活性/(U/(g·min))APX activityGR活性/(U/(g·min))GR activity0CK1165.29±8.15a78.56±6.36a235.68±12.25a7.68±1.15a19.35±2.29aCK2161.32±7.52a76.69±6.83a231.91±13.16a7.52±1.36a18.98±2.52aS50166.87±8.03a 77.34±6.75a233.65±12.83a7.59±1.03a19.16±2.38aS100164.55±7.86a 75.96±7.22a230.69±11.95a7.68±1.52a19.22±2.03aS150167.52±7.93a77.62±6.18a236.55±12.26a7.52±1.85a19.43±2.42aS200161.95±8.35a 78.65±7.31a235.87±13.35a7.63±1.36a18.95±1.98a5CK1170.88±9.73a79.18±5.85a237.52±15.35a7.95±1.65a20.45±2.02aCK2189.85±8.85b86.85±6.38ab311.55±16.48b9.79±1.38b27.98±1.85bS50203.75±9.02c102.96±6.79c346.85±17.25c11.36±2.02cd32.69±1.73cdS100249.49±9.75e122.59±5.67e395.89±16.82e14.68±1.88e39.56±2.11eS150228.06±8.65d114.77±6.33d367.52±16.02d12.59±2.11d35.26±2.13dS200196.66±9.22bc95.78±6.25bc333.87±17.11c10.87±1.88bc30.11±1.77bc10CK1175.32±8.65cd80.02±7.02cd239.66±15.68c8.06±2.22cd21.52±1.86cCK2136.85±7.86a52.71±6.45a185.87±17.02a5.21±2.35a10.19±2.02aS50172.69±8.86bc 74.38±6.18bc232.25±16.36bc7.68±2.87bc17.56±2.15bS100 195.73±7.73e89.69±7.32e291.82±15.95e9.65±1.86e25.28±1.96dS150183.52±8.02d 83.52±6.86de260.59±18.20d8.52±2.02d22.91±2.38cdS200163.66±8.43b 68.66±7.11b220.18±16.86b7.09±1.95b15.35±1.85b

图4 褪黑素对干旱胁迫下向日葵幼苗叶片AsA和GsH含量的影响
Fig.4 Effects of MT on the AsA content and GsH content of leaves in sunflower seedlings under drought stress
干旱胁迫条件下,植物细胞的结构和功能常遭到破坏,导致植物生长发育受到显著抑制,生物量积累明显下降[12]。本试验中,干旱胁迫显著降低了向日葵幼苗的株高、茎粗、叶面积和干质量,向日葵幼苗生长受到明显抑制,并且干旱胁迫时间越长抑制幅度越大;外源施用褪黑素可明显缓解干旱胁迫对向日葵幼苗生长的抑制作用,并可促进其生长,其中以100 μmol/L褪黑素处理效果最佳。这与吴燕等[7]在雏菊及邹京南等[17]在大豆方面的研究结果较为一致。其原因可能是由于一方面外源施用褪黑素可以提升干旱胁迫下植物叶片的叶绿素含量;另一方面外源施用褪黑素可以提升干旱胁迫下植物叶片的光合作用效率。
光合作用是植物进行生长发育不可或缺的生理功能之一,其主要色素便是叶绿素。前人研究表明,植物在遭遇干旱胁迫时,叶片叶绿素较易降解、光合效率和功能明显降低[18]。本试验中,干旱胁迫显著降低了向日葵幼苗叶片的叶绿素含量,并且随着干旱胁迫时间的延长降低幅度增大,而外源施用褪黑素可明显提升干旱胁迫下向日葵幼苗叶片的叶绿素含量,以100 μmol/L褪黑素处理效果最佳。这与吴燕等[7]在雏菊及叶君等[3]在小麦方面的研究结果较为一致,但是其作用机制尚不清楚,是褪黑素直接影响了叶绿素合成与降解的关键酶活性,还是通过其他间接方式影响了叶绿素的合成与降解,尚待进一步研究。同时,本研究发现,随着干旱胁迫时间的延长,向日葵幼苗叶片Pn、Gs和Tr逐渐降低,Ci则先下降后上升,这与姚春娟等[4]在决明属植物方面的研究报道基本一致,说明气孔因素是干旱胁迫下向日葵幼苗光合效率降低的主要因素[19]。与CK2(干旱胁迫)相比,外源施用褪黑素可明显提升干旱胁迫下向日葵幼苗叶片的Pn、Gs和Tr,且提升幅度随着褪黑素浓度的升高表现为先升高后降低,Ci则相反,以100 μmol/L褪黑素处理效果最佳。这与邹京南等[17]在大豆方面、杨小龙等[20]在番茄方面的研究报道较为一致,其原因可能是由于适宜浓度的褪黑素可以提高干旱胁迫下植物叶片的光合酶活性,提高CO2转化效率,从而降低Ci;而高浓度的褪黑素则会对光合机构产生一定的抑制作用,导致CO2转化效率降低,Ci提升。
大量研究表明,干旱胁迫会导致植物体内产生大量的活性氧自由基(ROS),引起细胞膜膜质过氧化,造成植物代谢紊乱,其中,相对电导率和MDA含量是衡量膜质过氧化程度的重要指标[21]。为了适应干旱环境,植物常通过提高自身的保护酶(POD、SOD和CAT)活性和抗氧化物质(AsA和GsH)含量来清除体内过量的活性氧,从而减轻活性氧对自身的伤害,维持代谢平衡[22]。本研究发现,随着干旱胁迫时间的延长,向日葵幼苗叶片H2O2含量![]() 产生速率、MDA含量及相对电导率均表现为逐渐上升趋势,而POD、SOD及CAT活性则均表现为先升高后降低的变化趋势。与CK2(干旱胁迫)相比,外源施用褪黑素可明显提升干旱胁迫下向日葵幼苗叶片的POD、SOD及CAT活性,且提升幅度随着褪黑素浓度的升高而表现为先升高后降低,以100 μmol/L褪黑素处理效果最佳,叶片H2O2含量
产生速率、MDA含量及相对电导率均表现为逐渐上升趋势,而POD、SOD及CAT活性则均表现为先升高后降低的变化趋势。与CK2(干旱胁迫)相比,外源施用褪黑素可明显提升干旱胁迫下向日葵幼苗叶片的POD、SOD及CAT活性,且提升幅度随着褪黑素浓度的升高而表现为先升高后降低,以100 μmol/L褪黑素处理效果最佳,叶片H2O2含量![]() 产生速率、MDA含量及相对电导率均显著低于CK2,膜质过氧化程度显著降低。这与叶君等[3]在小麦及吴雪霞等[6]在茄子方面的研究报道基本一致,其原因可能是由于适宜浓度外源褪黑素可以增强向日葵叶片中抗氧化酶合成关键基因的表达,提高抗氧化酶活性,从而增强活性氧自由基清除能力。AsA和GsH是植物体内重要的抗氧化物质,与APX及GR等酶共同组成抗坏血酸-谷胱甘肽抗氧化系统,在植物活性氧自由基清除中发挥重要的作用[23]。本研究发现,向日葵幼苗叶片的APX活性、GR活性、AsA和GsH含量均随着干旱胁迫时间的延长而表现为先升高后降低的趋势。与CK2(干旱胁迫)相比,外源施用褪黑素可明显促进干旱胁迫下向日葵幼苗叶片的APX活性、GR活性、AsA和GsH含量的提升,以100 μmol/L褪黑素处理效果最佳。这与吴雪霞等[6]在茄子方面的研究报道基本一致,说明适宜浓度的褪黑素可显著提升干旱胁迫下向日葵幼苗叶片的APX及GR活性,从而促进AsA和GsH含量的提升,增强向日葵耐旱性。
产生速率、MDA含量及相对电导率均显著低于CK2,膜质过氧化程度显著降低。这与叶君等[3]在小麦及吴雪霞等[6]在茄子方面的研究报道基本一致,其原因可能是由于适宜浓度外源褪黑素可以增强向日葵叶片中抗氧化酶合成关键基因的表达,提高抗氧化酶活性,从而增强活性氧自由基清除能力。AsA和GsH是植物体内重要的抗氧化物质,与APX及GR等酶共同组成抗坏血酸-谷胱甘肽抗氧化系统,在植物活性氧自由基清除中发挥重要的作用[23]。本研究发现,向日葵幼苗叶片的APX活性、GR活性、AsA和GsH含量均随着干旱胁迫时间的延长而表现为先升高后降低的趋势。与CK2(干旱胁迫)相比,外源施用褪黑素可明显促进干旱胁迫下向日葵幼苗叶片的APX活性、GR活性、AsA和GsH含量的提升,以100 μmol/L褪黑素处理效果最佳。这与吴雪霞等[6]在茄子方面的研究报道基本一致,说明适宜浓度的褪黑素可显著提升干旱胁迫下向日葵幼苗叶片的APX及GR活性,从而促进AsA和GsH含量的提升,增强向日葵耐旱性。
综上所述,外源褪黑素可显著提升干旱胁迫下向日葵幼苗的抗氧化能力,活性氧自由基得到有效清除,降低了膜质过氧化,减轻了对光合系统的氧化损伤,促进了干旱胁迫下向日葵幼苗的生长发育,耐旱性得到显著提升。此外,外源褪黑素提高向日葵耐旱性具有一定的剂量-效应关系,以100 μmol/L处理效果最佳。褪黑素作为一种潜在的植物生长调节剂,在提高植物抗旱性方面具有广阔的应用前景,本研究结果可以为褪黑素在农业生产上的开发和利用提供一定的参考依据。
[1] 林少雯,刘树堂,隋凯强,皇甫呈惠.水分胁迫下硅素对玉米苗期生理生化性状的影响[J].华北农学报,2018,33(1):160-167.doi:10.7668/hbnxb.2018.01.024.
Lin S W,Liu S T,Sui K Q,Huangfu C H.Effects of silicon on corn physiological and biochemical characters under the conditions of water stress[J].Acta Agriculturae Boreali-Sinica,2018,33(1):160-167.
[2] Lobell D B,Roberts M J,Schlenker W,Braun N,Little B B,Rejesus R M,Hammer G L.Greater sensitivity to drought accompanies maize yield increase in the U.S Midwest[J]. Science,2014,344(6183):516-519.doi:10.1126/science.1251423.
[3] 叶君,邓西平,王仕稳,殷俐娜,陈道钳,熊炳霖,王鑫月.干旱胁迫下褪黑素对小麦幼苗生长、光合和抗氧化特性的影响[J].麦类作物学报,2015,35(9):1275-1283.doi:10.7606/j.Issn.1009-1041.2015.09.15.
Ye J,Deng X P,Wang S W,Yin L N,Chen D Q,Xiong B L,Wang X Y.Effects of melatonin on growth,photosynthetic characteristics and antioxidant system in seedling of wheat under drought stress[J].Journal of Triticeae Crops,2015,35(9):1275-1283.
[4] 姚春娟,郭圣茂,马英超,赖晓莲,杨肖华.干旱胁迫对4种决明属植物光合作用和叶绿素荧光特性的影响[J].草业科学,2017,34(9):1880-1888.doi:10.11829/j.issn.1001-0629.2016-0588.
Yao C J,Guo S M,Ma Y C,Lai X L,Yang X H.Effect of drought stress on characteristics of photosynthesis and chlorophyll fluorescence of four species of Cassia[J].Pratacultural Science,2017,34(9):1880-1888.
[5] 梁春波.国外引进油用向日葵资源苗期耐旱性鉴定[J].黑龙江农业科学,2015(6):9-11.doi:10. 11942/j.issn.1002-2767.2015.06.0009.
Liang C B.Drought tolerance identification of exotic oiltype sunflower germplasm in seedling stage[J].Heilongjiang Agricultural Sciences,2015(6):9-11.
[6] 吴雪霞,朱宗文,张爱冬,许爽,姚静,查丁石.外源褪黑素对低温胁迫下茄子幼苗生长及其光合作用和抗氧化系统的影响[J].西北植物学报,2017,37(12):2427-2434.doi:10.7606/j.issn.1000-4025.2017.12.2427.
Wu X X,Zhu Z W,Zhang A D,Xu S,Yao J,Zha D S.Effects of exogenous melatonin on the growth,photosynthesis and antioxidant system in eggplant(Solanum melongena L.)seedlings under low temperature stress[J]. Acta Botanica Boreali-Occidentalia Sinica,2017,37(12):2427-2434.
[7] 吴燕,连洪燕,牟雪姣,王雪娟,张远兵.干旱胁迫下叶面喷施褪黑素对滁菊幼苗生理生化特性的影响[J].西北植物学报,2016,36(11):2241-2246.doi:10.7606/j.issn.1000-4025.2016.11.2241.
Wu Y,Lian H Y,Mou X J,Wang X J,Zhang Y B.Effects of foliar spraying exogenous melatonin on physiological and biochemical characteristics of Dendranthema morifolium‘Chuju’seedlings under drought stress[J].Acta Botanica Boreali-Occidentalia Sinica,2016,36(11):2241-2246.
[8] 宋雪飞,甘淳丹,赵海燕,孙志国,李刚华,张春明,陈刚,郑青松.叶面喷施褪黑 素调控水稻幼苗耐盐性的浓度效应研究[J].土壤学报,2018,55(2):455-465.doi:10.11766/trxb201708150308.
Song X F,Gan C D,Zhao H Y,Sun Z G,Li G H,Zhang C M,Chen G,Zheng Q S.Concentration-Dependent effect of foliar spraying of melatonin on salt tolerance of rice[J].Acta Pedologica Sinica,2018,55(2):455-465.
[9] 黄益宗,蒋航,王农,刘岩.外源褪黑素对不同价态砷胁迫下水稻种子萌发和生理指标的影响[J].生态学杂志,2018,37(6):1730-1737.doi:10.13292/j.1000-4890.201806.036.
Huang Y Z,Jiang H,Wang N,Liu Y.Effects of exogenous melatonin on seed germination and physiological indices of rice under As3+ and As5+ stress[J].Chinese Journal of Ecology,2018,37(6):1730-1737.
[10] Galano A,Tan D X,Reiter R J.On the free radical scavenging activities of melatonin′s metabolites,AFMK and AMK[J].Journal of Pineal Research,2013,54(3):245-257.doi:10.1111/jpi.12010.
[11] Shi H T,Chen Y H,Tan D X,Reiter R J,Chan Z L,He C Z.Melatonin induces nitric oxide and the potential mechanisms relate to innate immunity against bacterial pathogen infection in Arabidopsis[J].Journal of pineal research,2015,59(1):102-108.doi:10.1111/jpi12244.
[12] Zhang N,Zhao B,Zhang H J,Sarah W,Yang C,Yang Z C,Ren S X,Guo Y D.Melatonin promotes water-stress tolerance,lateral root formation,and seed germination in cucumber(Cucumis sativus L.)[J].Journal of Pineal Research,2013,54(1):15-23.doi:10.1111/j.1600-079x.2012.01015.x.
[13] Wang P,Sun X,Li C,Wei Z W,Liang D,Ma F W.Long-term exogenous application of melatonin delays drought-induced leaf senescence in apple[J].Journal of Pineal Research,2013,54(3):292-302.doi:10.1111/jpi.12017.
[14] 刘易,祁通,孟阿静,黄建,冯耀祖,王新勇.生物质炭输入对盐胁迫下玉米幼苗生长和光合生理特征的影响[J].华北农学报,2017,32(4):182-188.doi:10.7668/hbnxb.2017.04.029.
Liu Y,Qi T,Meng A J,Huang J,Feng Y Z,Wang X Y.Effect studying of biomass carbon input to growth and photosynthetic physiology feature of corn seedling cultivated on saliferous soil[J].Acta Agriculturae Boreali-Sinica,2017,32(4):182-188.
[15] 吴雪霞,朱月林,朱为民,陈建林,刘正鲁.外源一氧化氮对NaCl胁迫下番茄幼苗生理影响[J].中国农业科学,2006,39(3):575-581.doi:10.3321/j.issn:0578-1752.2006.03.020.
Wu X X,Zhu Y L,Zhu W M,Chen J L,Liu Z L.Physiological effects of exogenous nitric oxide in tomato seedlings under NaCl stress[J].Scientia Agricultura Sinica,2006,39(3):575-581.
[16] 郭欣欣,李晓锋,朱红芳,朱玉英,刘金平.淹水胁迫对不结球白菜抗坏血酸-谷胱甘肽循环的影响[J].植物生理学报,2015,51(12):2181-2187.doi:10.13592/j.cnki.ppj.2015.0405.
Guo X X,Li X F,Zhu H F,Zhu Y Y,Liu J P.Effects of Waterlogging Stress on ascorbate-glutathione cycle in brassica campestris ssp. chinensis[J].Plant Physiology Journal,2015,51(12):2181-2187.
[17] 邹京南,金喜军,王孟雪,张明聪,任春元,于奇,胡国华,张玉先.外源褪黑素对干旱胁迫条件下大豆苗期光合及生理的影响[J].大豆科学,2018,37(6):896-905.doi:10.11861/j.issn.1000-9841.2018.06.0896.
Zou J N,Jin X J,Wang M X,Zhang M C,Ren C Y,Yu Q,Hu G H,Zhang Y X.Effects of exogenous melatonin on photosynthesis and physiology of soybean seedlings under drought stress[J]. Soybean Science,2018,37(6):896-905.
[18] 张敏,李静媛,张占彪,李培环.干旱胁迫对’夕阳红’幼苗生长和生理生化指标的影响[J].灌溉排水学报,2015,34(9):99-104.doi:10.13522/j.cnki.ggps.2015.09.020.
Zhang M,Li J Y,Zhang Z B,Li P H.Effects stress on growth,physiological and biochemical index of acer rubrum‘Red Sunset’seedlings[J].Journal of Irrigation and Drainage,2015,34(9):99-104.
[19] Zhang Y P,Yang S J,Chen Y Y.Effects of melatonin on photosynthetic performance and antioxidants in melon during cold and recovery[J].Biologia Plantarum,2017,61(3):571-578.doi:10.1007/s10535-017-071-8.
[20] 杨小龙,须晖,李天来,王蕊.外源褪黑素对干旱胁迫下番茄叶片光合作用的影响[J].中国农业科学,2017,50(16):3186-3195.doi:10.3864/j.issn.0578-1752.2017.16.013.
Yang X L,Xu H,Li T L,Wang R.Effects of exogenous melatonin on photosynthesis of tomato leaves under drought stress[J].Scientia Agricultura Sinica,2017,50(16):3186-3195.
[21] 李本峰,杜红梅.褪黑素预处理对多年生黑麦草抗旱性的影响[J].上海交通大学学报(农业科学版),2018,36(3):21-26.doi:10.3969/j.issn.1671-9964.2018.03.004.
Li B F,Du H M.The effects of melatonin pretreament on drought tolerance of perennial ryegrass(Lolium perenne)[J].Journal of Shanghai Jiaotong University(Agricultural Science),2018,36(3):21-26.
[22] 陈浩维,邓明华,黄尧瑶,彭春秀,文锦芬.干旱胁迫对玫瑰花瓣膜脂过氧化及抗氧化酶活性的影响[J].西北植物学报,2018,38(5):885-893.doi:10.7606/j.issn.1000-4025.2018.05.0885.
Chen H W,Deng M H,Huang Y Y,Peng C X,Wen J F.Membrane lipid peroxidation and antioxygen enzyme activities of rose petals under drought stress[J].Acta Botanica Boreali-Occidentalia Sinica,2018,38(5):885-893.
[23] 王聪,杨恒山,董永义,马玉露,贾俊英,包金花,郑毅.NaCl胁迫下外源壳聚糖对菜用大豆光合作用及叶绿体活性氧代谢的影响[J].华北农学报,2016,31(4):162-167.doi:10.7668/hbnxb.2016.04.026.
Wang C,Yang H S,Dong Y Y,Ma Y L,Jia J Y,Bao J H,Zheng Y.Effects of exogenous chitosan on photosynthesis and chloroplast reactive oxygen species metabolism of vegetable soybean under NaCl stress[J].Acta Agriculturae Boreali-Sinica,2016,31(4):162-167.