质子泵是氧化磷酸化过程中合成ATP的能量系统,存在于几乎所有的真核细胞内。植物液泡质子泵(V-ATPase)最早发现于液泡中,是一种由13个亚基组成的多亚基复合体酶,由V1和V0 2个结构域构成类似“球茎”的结构[1]。其中,V1域突出膜外,由A~H共8个亚基构成。V0域镶嵌于膜内,由a、c、c′、e和d共5个亚基组成[2]。
在对V-ATPase各亚基的研究中,c亚基备受关注,它与酵母Vma3p的c亚基同源。分子质量约为16 ku,是形成V0膜域的主要组件。同时,也是质子转运的通道,与H+ 转运有关[3]。此外,c亚基对V1与V0结构域的装配也是必不可少的。有报道称c亚基是细胞通讯中间隙联结的部分,是神经递质释放介导体的组分,也是某种罕见的病毒癌基因产物的靶蛋白[4]。c亚基在细胞信号转导过程中起重要作用。
研究发现,当植物处于逆境环境中,V-ATPase 能够通过结构、状态及植物体内数量的改变来适应环境的改变,从而降低逆境对其造成的伤害[5-7]。在高盐、寒冷、干旱等环境下,山墙藓(Tortularuralis)、冰叶日中花(Mesembryanthemum crystallinum)、二色补血草(Limonium bicolor)中的V-ATPase转录水平和活性都明显提高[8-9]。Xu等[10]将二色补血草的VHA-c1基因在烟草(Nicotiana tabacum L.)中过表达后,可以显著增强转基因烟草对盐胁迫的耐受能力,研究认为这是由于转基因株系中超氧化物歧化酶与过氧化物酶被显著激活,能够有效地清除细胞内的氧化物质,使细胞膜不被氧化达到保护细胞完整性的作用、进而提高细胞耐受高盐环境的能力。
为了更深入地了解拟南芥VHA-c1基因的功能,本研究利用RNA干扰技术构建了VHA-c1基因沉默的转基因纯合株系,并对其纯合体进行了盐胁迫、外源ABA和糖处理,旨在为进一步探明VHA-c1基因在植物非生物胁迫方面的抗性机制提供理论依据。
1 材料和方法
1.1 试验材料
根癌农杆菌GV3101、大肠杆菌DH5α、pHANNIBAL载体、pART27载体和拟南芥(Columbia,Col-0)由内蒙古自治区植物逆境生理与分子生物学重点实验室保存。拟南芥培养条件:22 ℃,16 h光照/8 h黑暗,相对湿度60%。
1.2 试验方法
1.2.1 VHA-c1基因沉默载体的构建与农杆菌转化 采用CTAB法[11]提取拟南芥基因组DNA,以其为模板PCR扩增VHA-c1目的片段。正义链(Sense)特异引物为c1-s-5和 c1-s-3,反义链(Anti-sense)特异引物为c1-as-5和 c1-as-3,具体的引物序列与引入的酶切位点见表1。凝胶纯化回收PCR产物,利用XhoⅠ和EcoRⅠ双酶切的方法将正义链和pHANNIBAL载体连接,测序鉴定正确命名为pHAN-c1-s。同理,利用XbaⅠ和BamHⅠ双酶切方法将反义链与pHAN-c1-s载体相连接,测序鉴定正确命名为pHAN-c1-s-as。最后,用NotⅠ单酶切pHAN-c1-s-as质粒,回收包含35S启动子、ocs终止子、c1-s和c1-as片段,并与经NotⅠ酶切pART27载体的回收片段相连接,测序正确的重组表达载体命名为pART-c1。
将pART-c1载体用电击法[12]转化到农杆菌GV3101细胞中,在含25 μg/mL庆大霉素和100 μg/mL放线菌素的固体培养基平板上筛选阳性克隆。用c1-s-5或c1-as-3为引物,进行菌落鉴定,鉴定为阳性的保种,用于下一步转化植物。
1.2.2 VHA-c1基因沉默植株的筛选及纯系的获得 拟南芥的转化采用浸花法[13],转化后将拟南芥在正常条件下继续培养21~28 d,收取成熟种子。将种子播种于含30 μg/mL卡那霉素的1/2 MS选择培养基中,22 ℃培养10~12 d后挑选阳性植株,待其成熟后分单株收取种子(T1);T1种子按单株种于含30 μg/mL卡那霉素的选择培养基上,选择有1/3性状分离的株系,将绿苗移至蛭石上培养,单株收取种子(T2);T2种子按单株在含30 μg/mL卡那霉素的培养基上继续筛选,不再分离的即为纯合体株系,用于各项指标的分析。
1.2.3 RT-PCR半定量VHA-c1基因沉默效果 提取拟南芥野生型(CK)和VHA-c1基因沉默株系总RNA[14],反转录cDNA。以cDNA为模板,分别以c1-RT-F和c1-RT-F为引物PCR扩增VHA-c1,以actin-RT-F和 actin-RT-R为引物扩增内参基因actin(At3g12110)。将PCR产物于1.5%琼脂糖凝胶电泳后,成像分析结果。
1.2.4 基因沉默株系c1-1的胁迫处理与表型分析 拟南芥野生型和VHA-c1基因沉默株系种子同时种在1/2 MS 培养基中,4 ℃春化 3 d,22 ℃,16 h光照/8 h黑暗条件下培养 5 d后,同时分别转移到含有0,25,50,100 mmol/L NaCl和含有0,4,8,12 μmol/L ABA的 1/8 MS 的平板上,光下竖直放置4 d,记录主根相对伸长量。
野生型和VHA-c1基因沉默株系种子同时种在含有50 mmol/L NaCl及6%葡萄糖的 1/2 MS 培养平板上,4 ℃春化3 d。然后,在22 ℃,16 h光照/8 h黑暗条件下培养 ,此刻计时为0 h,并再后续的24,48,72,96 h时间点统计种子萌发率。
表1 特异性引物与酶切位点
Tab.1 The specific primers sequences and restriction sites

引物名称Primers name特异序列Specific sequences酶切位点 Restriction sites c1-s-5TCATCTCAGACCACCAGACTGCTCAAAGGTXhoⅠc1-s-3TCGAATTCGGAGGAGAATGAAGATAGGCGGTTTEcoRⅠc1-as-5TCATTCTAGACCACCAGACTGCTCAAAGGTXbaⅠc1-as-3CTCGGATCCGGAGAATGAAGATAGGCGGTTTBamHⅠc1-RT-FGATTTAAGATCTCAGATACAAAACTCCGAC -c1-RT-RTCCTACAATAAGCCCGTAAAGAGCAAGCGC -actin-RT-FATGGCAGATGGTGAAGACATTCAG -actin-RT-RGAAGCACTTCCTGTGGACTATTGA -
2 结果与分析
2.1 VHA-c1基因沉默株系的筛选与鉴定
基因沉默质粒pART-c1经农杆菌介导转化野生型拟南芥。经过抗生素筛选,最终获得了5株T2转基因纯合株系,分别命名为c1-1、c1-2、c1-3、c1-4、c1-5。分别提取其RNA,反转录得到cDNA。利用半定量RT-PCR技术,分别扩增actin基因和VHA-c1基因。微调凝胶电泳上样量,在actin基因转录量相同的情况下,比较5株基因沉默株系与野生型的VHA-c1表达量。结果显示:c1-1和c1-2株系的VHA-c1基因几乎95%被沉默,而其他3株系都有不同程度的表达(图1-A)。因此,选择c1-1株系用于后续的功能试验。
由于VHA-c1~c5基因具有很高的序列同源性,对设计的siRNA-c1沉默片段特异性进行测定。结果表明:设计的基因沉默片段特异性非常好,它只对VHA-c1基因沉默,并不影响其他4个VHA-c2~c5基因的表达(图1-B)。
2.2 NaCl处理VHA-c1基因沉默株系主根伸长与种子萌发的变化
在前期的研究中发现VHA-c1过表达的转基因植株表现出很强的NaCl耐受性[15]。因此,为了进一步明确VHA-c1基因与NaCl耐受性之间的关系,对基因沉默株c1-1在不同浓度NaCl下培养,测量其根相对伸长量。结果表明:25,50,100 mmol/L的NaCl浓度下,VHA-c1基因沉默的株系的根相对伸长量都小于野生型,特别是在NaCl浓度为50 mmol/L时,VHA-c1基因沉默株系根伸长量比对照减少12%(图2-A)。
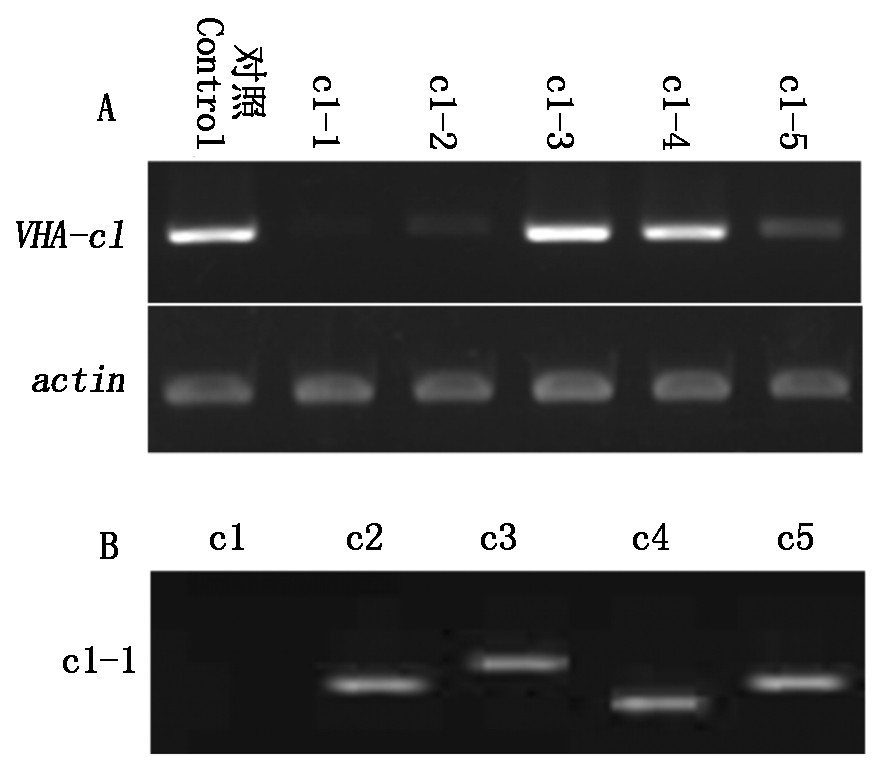
A.VHA-c1基因沉默株系中VHA-c1基因的表达水平检测;B. RNAi 突变纯合体 c1-1 中 VHA-c1基因沉默特异性检测; Control.野生型; c1-1~c1-5.转基因植株。图2-4同。
A.Detection of VHA-c1 mRNA expression in silenced homozygous plants by RT-PCR; B. Specificity detection of VHA-c1 silencing construct in homozygous line c1-1;Control. Wild type;c1-1-c1-5. Transgenic plants. The same as Fig.2-4.
图1 c1基因沉默株系中VHA-c1基因的表达水平与半定量RT-PCR检测
Fig.1 Detection of c1 gene mRNA expression and specificity in silenced homozygous plants by semi-quantitative RT-PCR
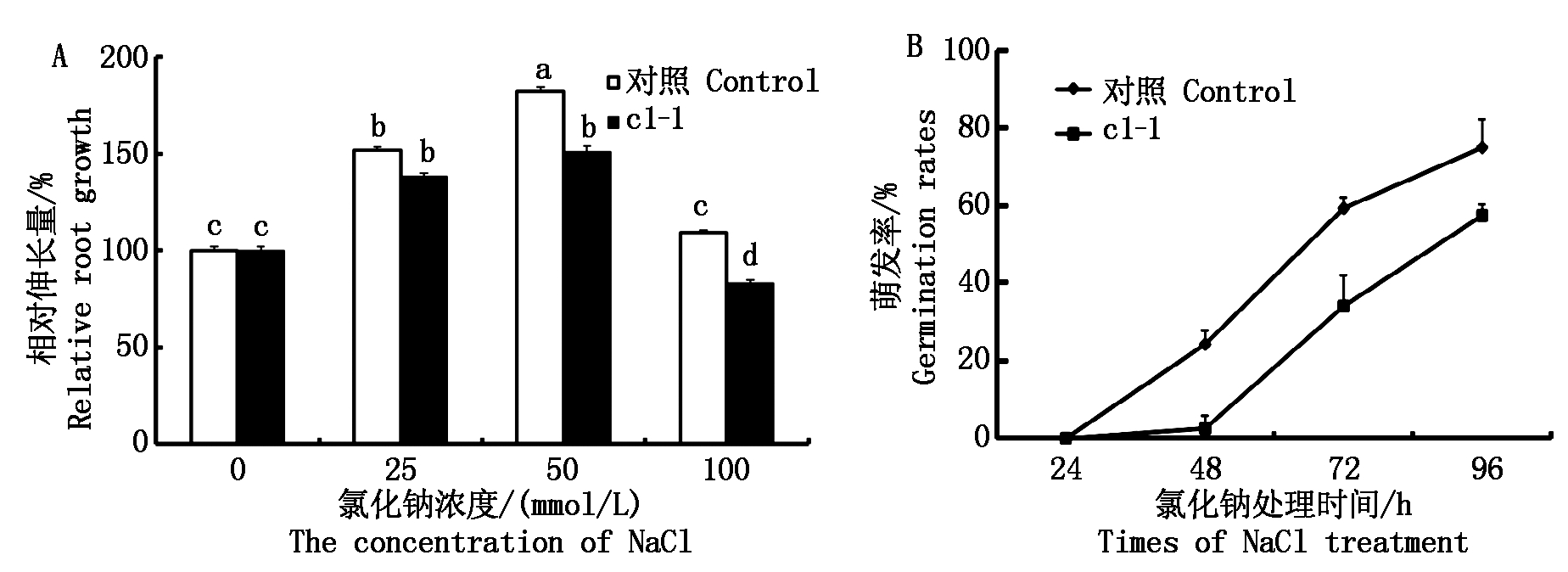
A. 在含 NaCl 的培养基上 VHA-c1 基因沉默突变纯合体根的相对伸长量;B. VHA-c1 基因沉默突变纯合体在 50 mmol/L NaCl 处理下的萌发率。
不同小写字母表示差异显著(P<0.05)。图3同。
A. Relative root growth of VHA-c1 silenced homozygous seedlings on MS containing different concentrations of NaCl; B.Germination rate of VHA-c1 silenced homozygous lines on MS containing 50 mmol/L NaCl.Different lowercase letter indicate significant differences (P<0.05).The same as Fig.3.
图2 NaCl处理VHA-c1基因沉默株系根相对伸长量与萌发率的变化
Fig.2 The relative root growth and germination rates assay of VHA-c1 gene silenced homozygous plants under salt stress
50 mmol/L NaCl对基因沉默株c1-1的种子萌发率结果表明:随着NaCl处理时间的增加,VHA-c1基因沉默株系种子的萌发被严重的抑制(图2-B)。综上,VHA-c1基因与植物应对NaCl胁迫具有直接的关系。
2.3 ABA处理VHA-c1基因沉默株系主根伸长的变化
不同浓度ABA处理基因沉默株c1-1与野生型拟南芥,随着ABA浓度的增加,c1-1和野生株的主根生长被抑制的程度均增加。但是,相对于野生型拟南芥,基因沉默株的主根被ABA抑制的程度较小。特别是在4,8 μmol/L ABA浓度下,c1-1株系的主根相对伸长量平均比野生株系分别长32%,48%(图3)。
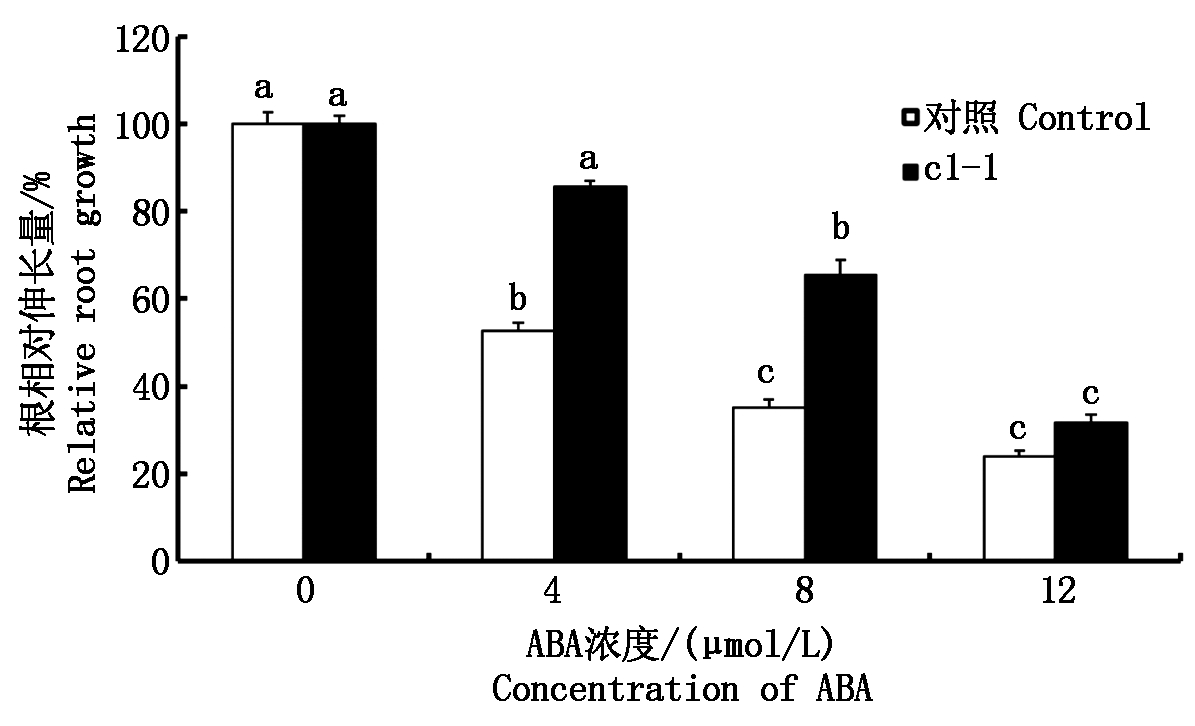
图3 ABA处理VHA-c1基因沉默株系根相对伸长量的变化
Fig.3 The relative root growth assay of VHA-c1 gene silenced homozygous plants under ABA stress
2.4 葡萄糖处理VHA-c1基因沉默株系种子萌发率的变化
通常在研究植物响应ABA胁迫处理的过程中,也要研究植物响应糖处理的试验,这是由于糖胁迫信号通路与ABA信号通路的相关性所致。本试验选择了6%的葡萄糖作为糖胁迫材料,分别对拟南芥进行24,48 ,72 ,96 h的胁迫处理。结果表明:从24 h后开始,基因沉默株系c1-1种子的萌发率与野生型株系种子的萌发率在这4个时间节点上几乎没有明显区别(图4)。
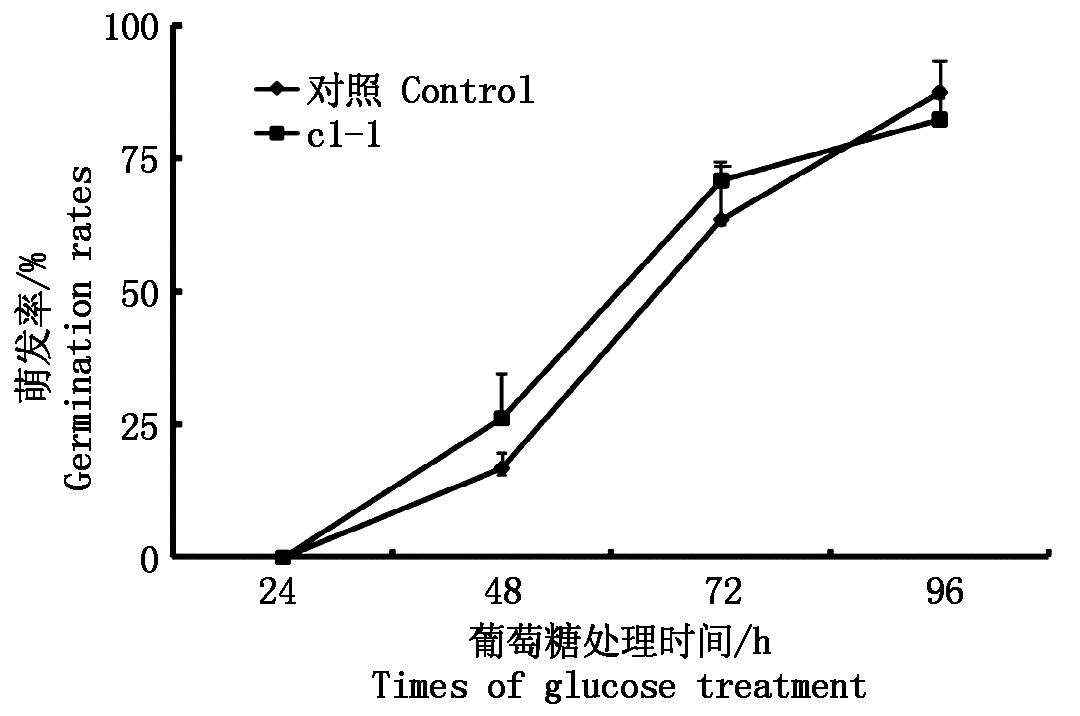
图4 葡萄糖处理VHA-c1基因沉默株系种子的萌发率
Fig.4 The germination rates assay of VHA-c1 gene silenced homozygous plants under glucose stress
3 结论与讨论
已有报道,V-ATPase通过c亚基表达量的变化,影响细胞扩展[16]。其机制是V-ATPase利用液泡中ATP所释放的能量将H+泵到液泡腔中,产生H+电化学梯度,使液泡酸化,为物质运输提供能量,从而影响膨压和细胞扩增[17-18]。本研究利用高度特异性的RNA干扰技术,沉默VHA-c1基因,获得了稳定的拟南芥株系c1-1。
V-ATPase的一个重要功能就是将H+泵入膜内的同时,伴随着将Na+泵出膜外。多数植物种,随着环境中NaCl浓度的提高,V-ATPase的转录水平与生物活性都有所增加。在笔者前期的研究中,过表达VHA-c1基因后,显著提升过表达株系的NaCl耐受能力[19-20]。本研究将VHA-c1基因沉默后,在系列NaCl浓度梯度胁迫下沉默株系的根相对伸长量与种子的萌发率都有明显的降低,在浓度为50 mmol/L和100 mmol/L NaCl胁迫处理下,VHA-c1基因沉默株系的主根相对伸长量被显著抑制。这意味着VHA-c1亚基表达与其对NaCl胁迫的耐受性有着直接的关系。
脱落酸(ABA)作为一种重要的植物激素,参与植物胚胎发育、种子休眠、果实成熟等生理活动;同时,它在植物抵抗非生物胁迫过程中起着非常关键的作用[21-22]。用不同浓度的ABA处理 VHA-c1基因沉默株系探究ABA 与 VHA-c1 的关系。结果表明,基因沉默和对照株系的幼苗都随着ABA浓度的增加,它们的根相对伸长量都在减小。VHA-c1基因沉默株系的根伸长量均长于对照株系。特别是在浓度为4,8 μmol/L ABA胁迫处理后,c1-1株系的主根相对伸长量显著(P<0.05)长于野生株系的主根伸长量。另外,VHA-c1基因沉默株系在含有6%的葡萄糖MS平板生长时,其种子的萌发率和野生型株系的种子萌发率是相同的。这进一步说明VHA-c1基因对ABA的胁迫不敏感,这可能是因为H+-ATPase在盐胁迫信号通路和ABA信号通路中起着不同的调控功能。
综上所述,本研究获得了拟南芥VHA-c1基因特异性沉默株系,对其进行NaCl、ABA处理后发现其表型与野生型不同,为进一步研究VHA-c1基因在植物生长发育、激素响应和抗逆境过程中的功能奠定了基础。
[1] Ratajczak R. Structure, function and regulation of the plant vacuolar H+-translocating ATPase[J]. Biochimica et Biophysica Acta, 2000, 1465(1-2):17-36. doi: 10.1016/s0005-2736(00)00129-2.
[2] Sze H, Schumacher K, Müller M L, Padmanaban S,Taizd L.A simple nomenclature for a complex proton pump: VHA genes encode the vacuolar H+-ATPase[J]. Trends in Plant Science, 2002, 7(4):157-161.doi:10.1016/S1360-1385(02)02240-9.
[3] 徐萍, 刘瑞香,曾卫军, 李国婧, 王瑞刚, 王水平.拟南芥VHA-c基因在非生物胁迫响应中的作用[J]. 华北农学报, 2006, 21(1):19-22. doi: 10.3321/j.issn:1000-7091.2006.01.005.
Xu P, Liu R X, Zeng W J, Li G J, Wang R G, Wang S P. Function of VHA-c genes in Arabidopsis thaliana in response to abiotic stresses[J]. Acta Agriculture Boreali-Sinica, 2006, 21(1):19-22.
[4] Romina M W, Karin V S, Andrea P, Laura S, Rebekka K, Johanna L, Christina S, Dirk T, Gyorgy V, Stefan Z, Ernst W, Rolf M, Giorgio S, Angelika M V. The V-ATPase-inhibitor archazolid abrogates tumor metastasis via inhibition of endocytic activation of the rho-GTPase Rac1[J]. Cancer Research, 2012, 72(22):5976-5987. doi: 10.1158/0008-5472.can-12-1772.
[5] Yu H F, Chen J, Wang X C. Effects of salt stress on the activity and the amount of tonoplast H+-ATPase front pea roots[J]. Acta Botanica Sinica, 2001, 43(6):586-591. doi: 10.3321/j.issn:1672-9072.2001.06.006.
[6] 冯兰东, 丁同楼, 王宝山. 植物液泡膜H+-ATPase及其在胁迫中的响应[J]. 湛江师范学院学报, 2005, 26(6):71-76. doi: 10.3969/j.issn.1006-4702.2005.06.017.
Feng L D, Ding T L, Wang B S. Plant H+-ATPase and it′ s responses to stresses[J]. Journal of Lingnan Normal University, 2005, 26(6):71-76.
[7] 杨桂燕, 郭宇聪, 赵玉琳, 张凤娇, 高彩球. 过表达ThVHAc1对拟南芥V-ATPase各亚基表达的影响[J]. 植物研究, 2015, 35(5):692-695. doi:10.7525/j.issn.1673-5102.2015.05. 009.
Yang G Y, Guo Y C, Zhao Y L, Zhang F J, Gao C Q. The Expression of V-ATPase subunits in overexpression ThVHA-c1 Arabidopsis under salt stress[J]. Bulletin of Botanical Research, 2015, 35(5):692-695.
[8] Dietz K J, Tavakoli N, Kluge C, Mimura T, Sharma S S, Harris G C, Chardonnens A N, Golldack D. Significance of the V-type ATPase for the adaptation to stressful growth conditions and its regulation on the molecular and biochemical level[J]. J Exp Bot, 2001, 52(363):1969-1980. doi: 10.1093/jexbot/52.363.1969.
[9] Kabala K, Janicka-Russak M, Anklewicz A. Mechanism of Cd and Cu action on the tonoplast proton pumps in cucumber roots[J]. Physiologia Plantarum, 2013, 147(2):207-217. doi: 10.1111/j.1399-3054.2012.01655.x.
[10] Xu C X, Zheng L, Gao C Q, Wang C, Liu G F, Jiang J, Wang Y C. Ovexpression of a vacuolar H+-ATPase c subunit gene mediates physiological changes leading to enhanced salt tolerance in transgenic tobacco[J]. Plant Molecular Biology Reporter, 2011, 29(2):424-430. doi: 10.1007/s11105-010-0247-4.
[11] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA[J]. Nucleic Acids Research, 1980, 8(19):4321-4326. doi:10.1093/nar/8.19.4321.
[12] 钟鸣, 黄国涛, 白丽萍, 张丽, 马慧, 张立军, 郭志富.基于农杆菌介导法的植物转基因载体的改造[J]. 华北农学报, 2011, 26(1):41-46.
Zhong M, Huang G T, Bai L P, Zhang L, Ma H, Zhang L J, Guo Z F. New strategy to reconstruct Agrobacterium-mediated plant transgenic expression vectors[J]. Acta Agriculturae Boreali-Sinica, 2011, 26(1):41-46.
[13] Bent A. Arabidopsis thaliana floral dip transformation method[J]. Methods in Molecular Biology, 2006, 343:87-90. doi: 10.1385/1-59745-130-4:87.
[14] Chomczynski P, Sacchi N. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction: twenty-something years on[J]. Nature Protocols, 2006, 1(2):581-585. doi: 10.1038/nprot.2006.83.
[15] 苏杰, 郭荣起, 姜树原, 邸娜, 李国婧, 王瑞刚. 过表达VHA-c1基因对拟南芥根长及ABA与糖响应的影响[J]. 西北植物学报, 2015, 35(5):865-871. doi: 10.7606/j.issn.1000-4025.2015.05.0865.
Su J, Guo R Q, Jiang S Y, Di N, Li G J, Wang R G. Effect on root length, responses to ABA and sugar by overexpressing Arabidopsis VHA-c1[J]. Acta Botanica Boreali-Occidentalia Sinica,2015,35(5):865-871.
[16] Xiao Z Y, Tan K L, Hu M Y, Luo M. Overexpression of cotton, vacuolar H+-ATPase subunit C promotes cell elongation and regulates stress tolerance in fission yeast[J]. Hereditas, 2008, 30(4):495-500. doi: 10.3724/SP.J.1005.2008.00495.
[17] Li P H, Wang Z L, Zhang H, Wang B S. Cloning and expression analysis of the B subunit of V-H+-ATPase in leaves of halophyte Suaeda salsa under salt stress[J]. Acta Botanica Sinica, 2004, 46(1):93-99. doi: 10.1300/J079v30n03_01.
[18] Schumacher K, Krebs M. The V-ATPase: small cargo, large effects[J]. Curr Opin Plant Biol, 2010, 13(6): 724-730. doi:10.1016/j.pbi.2010.07.003.
[19] Queirós F, Fontes N, Silva P, Almeida D, Maeshima M, Gerós H, Fidalgo F. Activity of tonoplast proton pumps and Na+/H+ exchange in potato cell cultures is modulated by salt[J]. J Exp Bot, 2009, 60(4): 1363-1374. doi:10.1093/jxb/erp011.
[20] Silva P, Gerós H.Regulation by salt of vacuolar H+-ATPase and H+-pyrophosphatase activities and Na+/H+ exchange[J]. Plant Signal Behav, 2009, 4(8): 718-726. doi:10.4161/psb.4.8.9236.
[21] Kovaleva L V, Voronkov A S, Zakharova E V, Minkina Y V, Timofeeva G V, Andreev I M. Exogenous IAA and ABA stimulate germination of petunia male gametophyte by activating Ca2+-dependent K+-channels and by modulating the activity of plasmalemma H+-ATPase and actin cytoskeleton[J]. Russian Journal of Developmental Biology, 2016, 47(3): 109-121. doi:10.1134/s1062360416030036.
[22] Peirats-Llobet M, Han S K, Gonzalez-Guzman M, Miguel J, Cheol W R, Lesia B P, Borja W, Doris R, Pedro L.A direct link between abscisic acid sensing and the chromatin remodeling ATPase BRAHMA via core ABA signaling pathway components[J]. Molecular Plant, 2016,9(1):136-147. doi:10.1016/j.molp.2015.10.003.