麦谷蛋白由高分子量麦谷蛋白亚基(HMW-GS)和低分子量麦谷蛋白亚基(LMW-GS)通过分子间二硫键聚合而成[1],HMW-GS对面包的加工品质有重要影响[2-4],分析HMW-GS组成已成为品质育种中亲本选配和杂交后代选择的重要依据,LMW-GS对小麦加工品质也有不可忽视的作用,不仅影响小麦面团的延展性和稳定性[5-6],对面筋的强度也有明显的影响[7-9],因此,同时鉴定小麦的高低分子量麦谷蛋白亚基组成对研究小麦品质具有重要意义。
SDS-PAGE是分离小麦高低分子量麦谷蛋白亚基的常用方法,但根据试验目的的不同,在麦谷蛋白样品的制备上可分为2种主要类型:一种是侧重定性分析,要求制备的麦谷蛋白样品纯度比较高,Singh等[10]报道的方法是这类方法的代表,典型特征是用50%的异丙醇去除单体蛋白,孙辉等[11]曾对这类方法制备的麦谷蛋白样品进行过样品浓缩方面的优化;另一种是侧重定量分析,要求在制备麦谷蛋白样品过程中不损失麦谷蛋白,这种类型的典型代表是Fu和Kovacs[12]报道的方法,典型特征是用0.3 mol/L的NaI和7.5%异丙醇混合溶液去除单体蛋白,纪军等 [13]和覃建兵等 [14]曾以该方法为基础进行不同方面的优化。这2种样品制备方法各有优缺点,第2种方法在去除单体蛋白的过程中为避免去除麦谷蛋白,在制备的麦谷蛋白样品中含有少量的单体蛋白,第1种方法在去除单体蛋白的过程中虽然会去除一部分麦谷蛋白,但最后制备的麦谷蛋白样品纯度很高[12],从目前使用情况来看,Singh等 [10]的方法在国内外应用更为广泛[15-19],但笔者发现该方法中单体蛋白去除和麦谷蛋白还原过程有些环节和因素仍需改进,本研究主要针对这一问题以及麦谷蛋白烷化处理的简化问题开展深入研究。
1 材料和方法
1.1 供试小麦品种
科农199、济麦22、师栾02-1和烟农19。
1.2 提取液母液
A1: 50%异丙醇(异丙醇由天津市凯通化学试剂有限公司生产);A2:30%异丙醇;B1: 10%异丙醇+0.08 mol/L Tris-HCl(pH值8.0)(Tris为Amresco产品);B2: 15%异丙醇+0.08 mol/L Tris-HCl(pH值8.0);B3: 20%异丙醇+0.08 mol/L Tris-HCl(pH值8.0);B4: 25%异丙醇+0.08 mol/L Tris-HCl(pH值8.0);B5: 30%异丙醇+0.08 mol/L Tris-HCl(pH值8.0);B6: 35%异丙醇+0.08 mol/L Tris-HCl(pH值8.0);B7: 50%异丙醇+0.08 mol/L Tris-HCl(pH值8.0);C:样品缓冲液 0.08 mol/L Tris-HCl(pH值8.0)+2%SDS(SDS为Biotopped产品)+ 40%甘油(甘油为上海生工产品)+0.02%溴酚蓝(溴酚蓝为上海生工产品)。
1.3 Singh等的麦谷蛋白提取方法
醇溶蛋白的去除:取单粒小麦种子用电动粉碎器(型号为WD9419,由北京市六一仪器厂生产)磨成粉或取20 mg面粉置于2 mL离心管中, 加1 mL提取液A1,涡旋混匀后65 ℃水浴提取30 min, 水浴其间至少再混匀2次以便充分提取, 12 000 r/min离心1 min, 弃上清,重复提取1次,沉淀用移液枪头挑起后容易混匀,经过2次提取后的沉淀再用0.5 mL的提取液A1洗一次, 12 000 r/min离心5 min, 弃上清,沉淀用于下一步试验。
麦谷蛋白的还原:向上述沉淀中加入100 μL含1%DDT(m/V)(DTT为上海生工产品)的提取液B7, 涡旋混匀后在65 ℃水浴提取30 min, 12 000 r/min离心5 min。
麦谷蛋白亚基的烷化:向上述还原的麦谷蛋白溶液中加入100 μL含1.4% 4-VP(4-VP为索莱宝产品)的提取液B7, 65 ℃水浴处理15 min, 12 000 r/min离心2 min。
烷化的麦谷蛋白亚基与样品缓冲液的混合:取上述烷化处理后的上清100 μL加到含100 μL溶液C的离心管中,简单涡旋后65 ℃水浴处理15 min, 12 000 r/min离心2 min,取10 μL或20 μL上清进行下一步的SDS-PAGE电泳(丙烯酰胺为上海生工产品;甲叉双丙烯酰胺为Sigma产品)。
1.4 增设的麦谷蛋白提取方法
在醇溶蛋白去除环节,异丙醇浓度设50%(对照)和30% 2种处理;在麦谷蛋白的还原环节,设10%,15%,20%,25%,30%,35%和50% 6种异丙醇浓度处理,即分别用加有1%DTT的提取液母液B1-B6进行麦谷蛋白的还原处理;在麦谷蛋白亚基的烷化环节,麦谷蛋白还原后不直接进行烷化处理,而是把烷化剂4-VP直接加到样品缓冲液C中,在麦谷蛋白亚基提取液与样品缓冲液混合过程中同时进行烷化,4-VP在样品缓冲液中的浓度分别设1.4%,1.0%和0.6% 3种处理,操作时取50 μL经过还原处理的上清液分别加到50 μL含不同4-VP浓度的样品缓冲液C中,简单涡旋后65 ℃水浴处理15 min。通过优化处理与Singh等方法进行比较,明确优化处理的优缺点。
1.5 SDS-PAGE电泳
电泳槽型号JY-SCZ9,玻璃板规格14 cm×16 cm,由北京君意东方电泳设备有限公司生产,采用SDS不连续缓冲系统, 分离胶缓冲液为0.375 mol/L Tris-HCI, pH值8.8,0.1% SDS,分离胶浓度10%,浓缩胶缓冲液为0.125 mol/L Tris-HCI,pH值6.8,0.1% SDS,浓缩胶浓度4.8%,分离胶和浓缩胶交联度均为2.6%,电极缓冲液0.025 mol/L Tris-HCI,pH值8.3,0.192 mol/L甘氨酸(甘氨酸为上海生工产品),0.1% SDS,每孔上样量10~20 μL,22 ℃循环水浴,电流20 mA, 电泳约5.5 h。电泳结束后,凝胶在染色液(10%三氯乙酸,0.05%考马斯亮蓝R-250)中染色, 在脱色液(10%乙醇, 8%乙酸)中脱色至背景清晰(三氯乙酸由天津市科密欧化学试剂有限公司生产,考马斯亮蓝R-250为索莱宝产品,乙醇和乙酸为天津永大产品)。
2 结果与分析
2.1 麦谷蛋白还原步骤异丙醇浓度对麦谷蛋白提取效果的影响
以科农199为试材,比较了麦谷蛋白还原步骤不同异丙醇浓度对麦谷蛋白亚基提取效果的影响,从图1可以看出,在10%~50%的异丙醇浓度范围内,高分子量麦谷蛋白亚基的溶解性没有明显差别,而低分子量麦谷蛋白亚基的溶解性却差别很大,异丙醇浓度低时,低分子量麦谷蛋白的溶解性也很低,随着异丙醇浓度提高,低分子量麦谷蛋白的溶解性也逐渐提高,异丙醇浓度达到30%时,溶解性达到最大,之后溶解性维持在最大水平,说明麦谷蛋白还原溶液中异丙醇浓度由50%降到30%,对小麦高低分子量麦谷蛋白亚基的提取效果没有影响,但异丙醇浓度继续降低就会影响低分子量麦谷蛋白的提取效果。
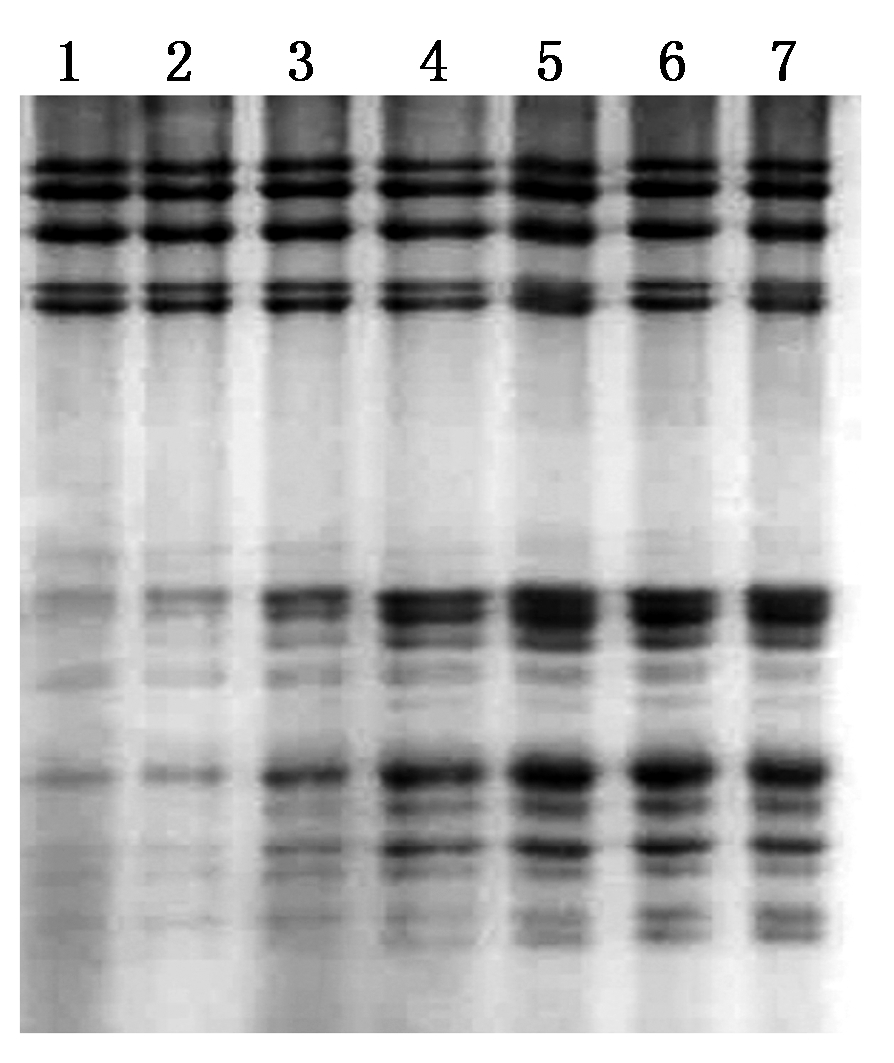
1.10%;2.15%;3.20%;4.25%;5.30%;6.35%;7.50%。
图1 麦谷蛋白还原时不同异丙醇浓度对麦谷蛋白亚基分离效果的影响
Fig.1 Effect of different isopropanol concentrations on the separation of glutenin subunits during glutenin reduction
2.2 单体蛋白去除步骤异丙醇浓度对麦谷蛋白提取效果的影响
以科农199为试材,进一步对50%和30% 2种异丙醇浓度去除单体蛋白的效果进行了比较,从图2可以看出,用50%的异丙醇去除单体蛋白和用30%的异丙醇去除单体蛋白最后提取的麦谷蛋白效果没有差别。
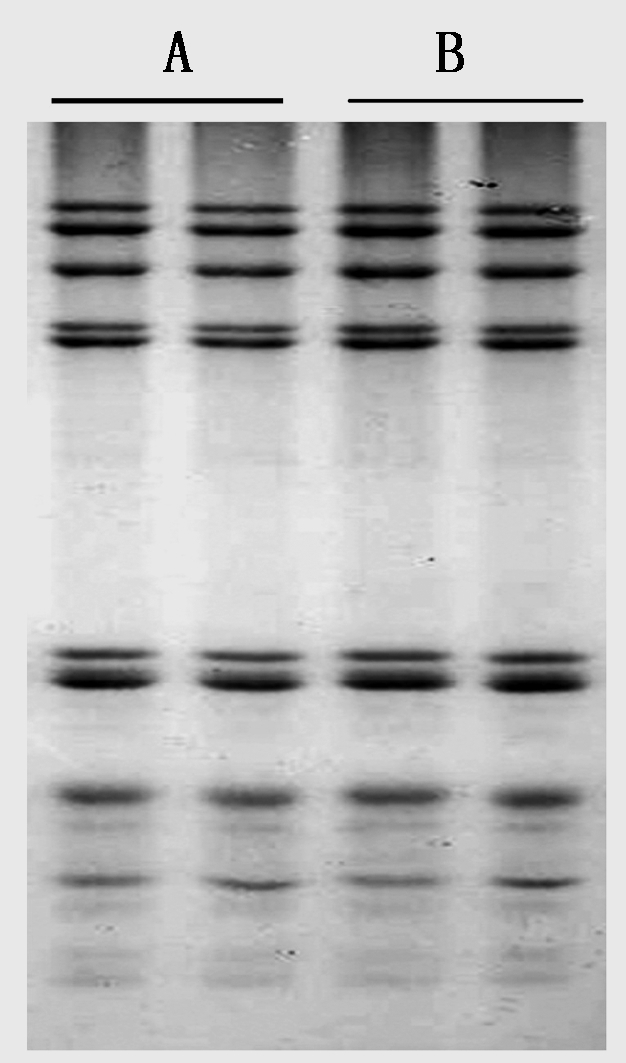
A.50%异丙醇;B.30%异丙醇。
A. 50% isopropanol;B.30% isopropanol.
图2 用50%和30%异丙醇去除单体蛋白对麦谷蛋白亚基分离效果的影响
Fig.2 Effect of removal of gliadin from 50% and 30% isopropanol on the separation of glutenin subunits
2.3 烷化剂4-VP直接加到样品缓冲液中进行烷化对麦谷蛋白分离效果的影响
把烷化剂4-VP直接加到样品缓冲液中进行烷化,3种4-VP浓度的烷化效果没有明显差别,但不同烷化剂浓度对电泳背景却有明显影响(图3),当烷化剂浓度为1.4%时,泳道的背景比较深,尤其是上样量为20 μL时,而当烷化剂浓度降为1.0%和0.6%时,背景恢复正常,烷化效果并没有因浓度降低而受影响。另外,从图3还可以看出,提取步骤简化后,电泳条带的强度提高了1倍,10 μL的上样量(图中的A2、A3和A4)与原方法中20 μL的上样量(图3中B1)条带强度相当。
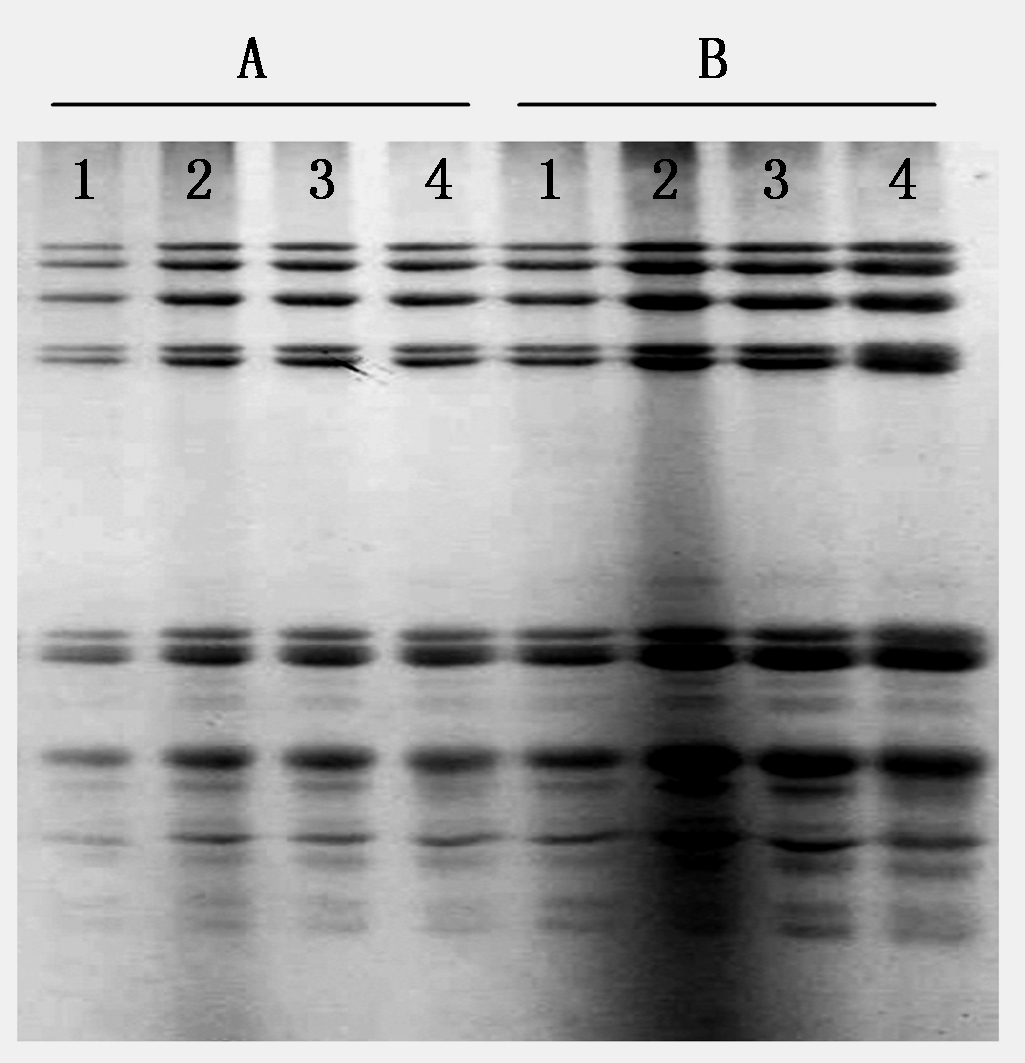
1.对照;2.1.4% 4-VP;3.1.0% 4-VP;4.0.6% 4-VP;A.上样量10 μL;B.上样量20 μL。
1. Control; 2. 1.4% 4-VP; 3.1.0% 4-VP; 4.0.6% 4-VP; A.Sample loading 10 μL; B.Sample loading 20 μL.
图3 上样缓冲液中不同烷化剂浓度对麦谷蛋白亚基分离效果的影响
Fig.3 Effect of different alkylating agent concentrations in loading buffer on the separation of glutenin subunits
2.4 优化程序的应用
优化程序为在去除单体蛋白和麦谷蛋白还原的步骤中,异丙醇浓度由原来的50%下调到30%,在麦谷蛋白亚基烷化方面,去除单独的烷化步骤,把烷化剂4-VP直接加到样品缓冲液中进行烷化,烷化剂浓度由原来的1.4%降为0.6%。优化程序在4个小麦品种上进行了应用,小麦品种师栾02-1和烟农19为强筋小麦,济麦22和科农199为中筋小麦,从图4可以看出,优化程序在这4个小麦品种上应用效果良好。
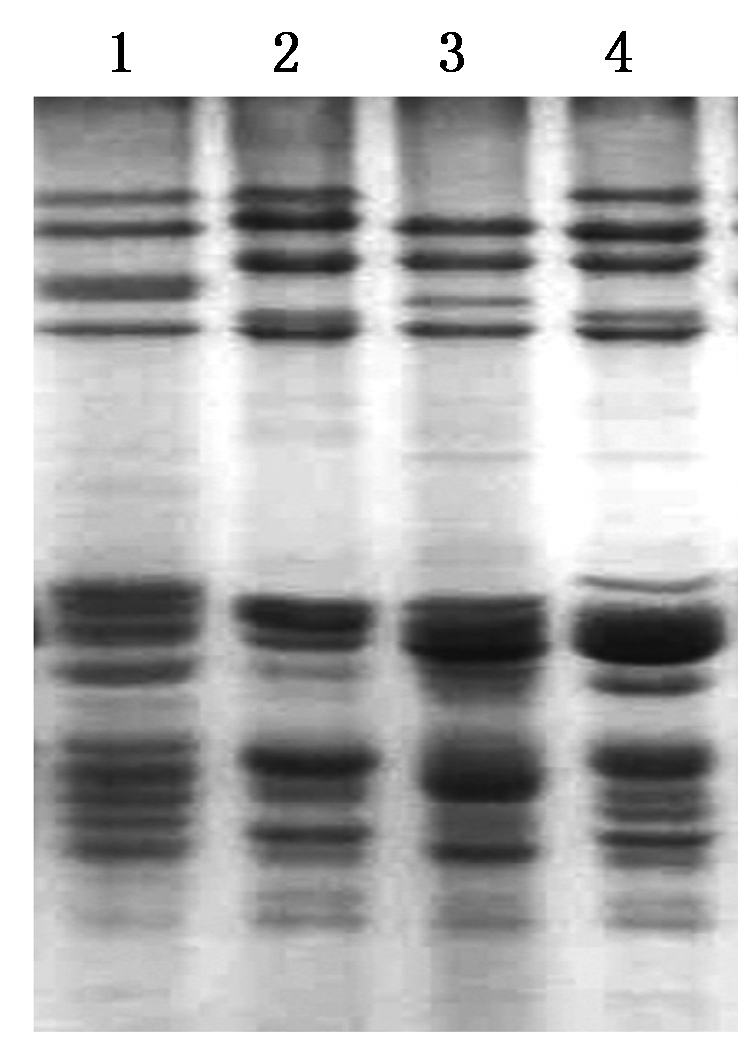
1.烟农19;2.科农199;3.济麦22;4.师栾02-1。
1.Yannong 19; 2.Kenong 199; 3.Jimai 22; 4.Shiluan 02-1.
图4 用优化程序分离不同小麦品种的麦谷蛋白亚基
Fig.4 Separation of glutenin subunits from different wheat varieties by optimization method
3 讨论与结论
在Singh等 [10]的方法中,麦谷蛋白还原时采用的异丙醇浓度为50%,但对于为什么采用此浓度,从文献中没有找到答案,在50%异丙醇中呈溶解状态的小麦麦谷蛋白,在70%异丙醇中高分子量麦谷蛋白就会沉淀下来,而低分子量麦谷蛋白仍呈溶解状态[20],说明小麦高低分子量麦谷蛋白在高浓度异丙醇溶液中溶解性并不相同,但在异丙醇浓度低于50%时,小麦高低分子量麦谷蛋白的溶解性将如何变化尚未见报道,通过试验,明确了在30%~50%的异丙醇浓度范围内,小麦高低分子量麦谷蛋白的溶解性没有明显差别,异丙醇浓度低于30%以后继续下降到10%,低分子量麦谷蛋白的溶解性逐渐变差,而高分子量麦谷蛋白亚基的溶解性差别仍不明显,这一发现以前未见报道,根据这一发现,在优化程序中,异丙醇浓度由原来的50%降到了30%,另外,该发现还显示,在麦谷蛋白还原过程中,采用低浓度异丙醇(10%甚至更低)可以分离出纯度较高的高分子量麦谷蛋白亚基,在只需要鉴定高分子量麦谷蛋白亚基组成时,可有效减少低分子量麦谷蛋白亚基的干扰。
在Singh等 [10]的方法中,去除单体蛋白时采用的异丙醇浓度也是50%,为明确该浓度能否降低,进一步对50%异丙醇和30%异丙醇去除单体蛋白的效果进行了对比,发现2种浓度的作用效果没有明显差别,为此,在优化程序中,把单体蛋白去除步骤中使用的异丙醇浓度也由50%下调到了30%。
在Singh等[10]的方法中,麦谷蛋白亚基的烷化是单独的一步,能否把烷化剂直接加到上样缓冲液中进行烷化,关键是要明确烷化效果是否会受影响,通常情况下人们可能认为上样缓冲液中较高浓度的甘油会影响烷化的效果,通过试验,发现烷化剂直接加到上样缓冲液中烷化效果并未受到不良影响,但原烷化剂浓度对电泳背景有明显不良影响,通过降低烷化剂浓度有效解决了电泳背景问题,需要注意的是,使用1.0%的烷化剂浓度多数情况下不会加重电泳背景,但有时会由于操作误差产生一些弱的背景,而采用0.6%的烷化浓度,均没有产生背景,为保险起见,推荐使用0.6%的烷化剂浓度。关于烷化剂浓度对烷化效果的影响,孙辉等 [11]曾对更大浓度范围(0.01%,0.1%,1.4%,2.8%和14%)的4-VP处理进行过烷化效果比较,除0.01%的浓度处理烷化效果较差外,其他浓度处理烷化效果均没有明显差别,这与本研究的结果是一致的,该研究中高浓度烷化剂处理没有增加电泳背景是由于烷化处理后的麦谷蛋白又用丙酮进行了沉淀,去除了烷化剂对电泳背景的影响。在Singh等[10]的方法中,1.4%的烷化浓度没有产生较深的电泳背景,是由于还原后的麦谷蛋白溶液与等量的烷化溶液混合时烷化剂浓度稀释了1倍,之后与上样缓冲液等量混合时又稀释了一倍,最终的烷化剂浓度只有0.35%。
本研究针对影响小麦麦谷蛋白亚基分离的几个关键因素展开了研究,并在此基础上对分离方法进行了优化,优化方法在单体蛋白去除和麦谷蛋白还原步骤中,把异丙醇浓度由原来的50%下调到了30%,在麦谷蛋白亚基烷化方面,省去了单独的烷化步骤,把烷化剂4-VP直接加到样品缓冲液中进行烷化,烷化剂浓度由原来的1.4%降为0.6%。优化后的麦谷蛋白亚基分离程序,在不影响分离效果的前提下,不但降低了药品用量,简化了提取步骤,而且提高了电泳条带的强度。
[1] Luo C, GriffinW B, Brandlard G, McNei D L.Comparison of low-and high molecular-weight wheat glutenin allele effects on flour quality [J]. Theoretical and Applied Genetics, 2001, 102(6-7): 1088-1098. doi:10.1007/s001220000433.
[2] Carrillo J M, Rousset M, Qualset C O, Kasarda D D. Use of recombinant inbred lines of wheat for study of associations of high-molecular-weight glutenin subunit alleles to quantitative traits. 1. Grain yield and quality prediction tests [J]. Theoretical and Applied Genetics, 1990, 79(3): 321-330. doi:10.1007/BF01186074.
[3] 赵和,卢少源,李宗智.小麦高分子量麦谷蛋白亚基遗传变异及其与品质和其它农艺性状关系的研究[J].作物学报,1994,20(1):67-75.
Zhao H,Lu S Y,Li Z Z. Studies on inheritance and variation of HMW glutenin subunits and their correlation with quality and other agronomic characters in wheat [J].Agronomica Sinica, 1994,20(1):67-75.
[4] 刘会云,刘畅,王坤杨,杜丽璞,王轲,佘茂云,叶兴国. 小麦高分子量麦谷蛋白亚基鉴定及其品质效应研究进展[J]. 植物遗传资源学报,2016,17(4): 701-709. doi: 10.13430/j.cnki.jpgr.2016.04.015.
Liu H Y, Liu C, Wang K Y, Du L P, Wang K, Yu M Y, Ye X G. Review on the identification and bread-making quality of high molecular weight glutenin subunits in wheat[J]. Journal of Plant Genetic Resources, 2016,17(4): 701-709.
[5] Gupta R B, Bekes F, Wrigley C W. Prediction of physical dough properties from glutenin subunit composition in bread wheats correlation studies [J]. Cereal Chemistry, 1991, 68(4):328-333.
[6] 马勇. 小麦低分子量麦谷蛋白亚基研究进展[J]. 农业科技通讯,2017(9):9-10.
Ma Y. Research progress of wheat low molecular weight glutenin subunits[J]. Agricultural Science and Technology Communication, 2017(9):9-10.
[7] 宋维富,杨雪峰,宋庆杰,张春利,辛文利,肖志敏. 低分子量麦谷蛋白亚基种类与强筋小麦品质关系[J]. 黑龙江农业科学,2018(2):133-135. doi:10.11942/j.issn1002-2767.2018.02.0133.
Song W F, Yang X F, Song Q J, Zhang C L, Xin W L, Xiao Z M. Relationship between the low-molecular-weight glutenin subunits and quality of strong gluten wheat[J]. Heilongjiang Agricultural Sciences, 2018(2):133-135.
[8] Tanaka H, Shimizu R, Tsujimoto H. Genetical analysis of contribution of low-molecular-weight glutenin subunits to dough strength in common wheat(Triticum aestivum L.)[J]. Euphytica, 2005, 141(1-2):157-162. doi:10.1007/s10681-005-6714-6.
[9] 刘丽, 周阳, 何中虎, 王德森, 张艳, Pena R J. 高、低分子量麦谷蛋白亚基等位变异对小麦加工品质性状的影响[J]. 中国农业科学, 2004, 37(1): 8-14.
Liu L, Zhou Y, He Z H, Wang D S, Zhang Y, Pena R J. Effect of allelic variation in HMW and LMW glutenin subunits on the processing quality in common wheat[J]. Scientia Agricultura Sinica, 2004, 37(1): 8-14.
[10] Singh N K, Shepherd K W, Cornish G B. A simplified SDS-PAGE procedure for separating LMW subunits of glutenin [J]. Journal of Cereal Science, 1991, 14(3): 203-208. doi:10.1016/s07ss-5210(09)80039-8.
[11] 孙辉,李保云,朱金宝,刘广田, 张树臻.小麦高、低分子量谷蛋白亚基单向一步分离法新探[J]. 中国农业大学学报,1998,3(S4):19-23.
Sun H, Li B Y, Zhu J B, Liu G T, Zhang S Z. A simple SDS-PAGE procedure for separation of high and low molecular weight glutenin subunits [J]. Journal of Chinese Agricultural University, 1998,3(S4):19-23.
[12] Fu B X, Kovacs M I P. Rapid single-step procedure for isolating total glutenin proteins of wheat flour [J]. Journal of Cereal Science,1999, 29(2):113-116.doi:10.1006/jcrs.1998.0225.
[13] 纪军, 刘冬成, 王静,李俊明, 张爱民. 一种小麦高、低分子量麦谷蛋白亚基的提取方法[J]. 遗传,2008, 30(1): 123-126. doi: 10.3724/SP.J.1005.2008.00123.
Ji J, Liu D C, Wang J, Li J M, Zhang A M. A method of extraction and separation of wheat gluten[J]. Hereditas, 2008, 30(1): 123-126.
[14] 覃建兵,任燕萍,祝长青. 小麦低分子量麦谷蛋白亚基分离条件优化[J]. 生物技术, 2010, 20(4):37-39. doi:10.3969/j.issn.1004-311X.2010.04.122.
Tan J B, Ren Y P, Zhu C Q. Separation of Low-Molecular-Weight glutenin subunits in wheat[J]. Biotechnology, 2010, 20(4):37-39.
[15] 吴芳, 董惠, 韩兆雪,潘志芬, 邓光兵, 余懋群. 中国小麦品种高分子量谷蛋白亚基和低分子量谷蛋白亚基组成分析[J]. 麦类作物学报,2006, 26(3): 82-86.doi:10.7606/j.issn.1009-1041.2006.03.110.
Wu F, Dong H, Han Z X, Pan Z F, Deng G B, Yu M Q. Genetic diversity of HMW and LMW glutenin subunits in chinese hexaploid wheats[J]. Journal of Triticeae Crops, 2006, 26(3): 82-86.
[16] 张平平,马鸿翔,姚金保, 周淼平, 张鹏. 高分子量谷蛋白单亚基缺失对软质小麦宁麦9号加工品质的影响[J].作物学报,2016,42(5):633-640. doi: 10.3724/SP.J.1006.2016.00633.
Zhang P P, Ma H X, Yao J B, Zhou M P, Zhang P. Effect of HMW-GS deletion on processing quality of soft wheat Ningmai 9[J]. Acta Agronomica Sinica, 2016,42(5):633-640.
[17] Ibba M I, Kiszonas A M, Guzmán C, Morris C F. Definition of the low molecular weight glutenin subunit gene family members in a set of standard bread wheat(Triticum aestivum L.)varieties [J], Journal of Cereal Science, 2017, 74:263-271. doi:10.1016/j.jcs.2017.02.015.
[18] Lee J Y, Beom H R, Altenbach S B, Lim S H, Kim Y T, Kang C S, Yoon U H, Gupta R, Kim S T, Ahn S N, Kim Y M. Comprehensive identification of LMW-GS genes and their protein products in a common wheat variety [J]. Functional & Integrative Genomics, 2016, 16(3):269-279. doi:10.1007/s10142-016-0482-3.
[19] Beom H R, Kim J S, Jang Y R, Lim S H, Kim C K, Lee C K, Lee J Y. Proteomic analysis of low-molecular-weight glutenin subunits and relationship with their genes in a common wheat variety [J]. 3 Biotech, 2018, 8(1):56. doi:10.1007/s13205-017-1081-2.
[20] Fu B X, Sapirstein H. Procedure for isolating monomeric proteins and polymeric glutenin of wheat flour [J]. Cereal Chemistry, 1996, 73(1):143-152.