肌肉是动物运动系统的组成器官,肌纤维是肌肉的最基本单位,它的数量和类型直接影响动物肉产品品质[1],进而影响动物的经济效益。肌肉最终形成需要经历成肌细胞分化、迁移和增殖以及肌管形成几个阶段[2],在这样一个复杂的发育过程中,各种因素相互调节,其中与肌肉发育相关的基因发挥非常重要的作用[3]。成肌细胞调控因子家族MyoD(Myogenic differentiation antigen)是目前研究较为透彻的肌肉发育相关基因,但肌肉的生长发育应该是很多基因共同调控的结果,不只是单个基因发挥作用,因此筛选影响肌肉生长发育相关基因尤为重要。
成纤维细胞生长因子家族(Fibroblast growth factors,FGFs)已发现有23个成员[4-6],它们之间有20%~50%高度同源的氨基酸序列,且分子质量在20~35 ku。FGFs是由垂体和下丘脑经旁分泌或自分泌产生的多肽,它能促进细胞迁移、增殖和分化,使胚胎发育、肿瘤形成,对损伤组织的修复也有较大作用[7-8]。FGF9是成纤维细胞生长因子家族中的重要成员之一,最早在人类神经胶质瘤细胞中分离得到[9],编码208个氨基酸,所具有的三叶草核心结构需要与肝素结合激活受体来发挥作用,受体通常为FGFR2和FGFR3。研究发现FGF9 mRNA在人体各组织中广泛表达,尤其是在脑、肾、子宫和骨组织中,但FGF9蛋白在正常生理条件下以相对低的水平表达。FGF9可以促进上皮细胞、神经胶质细胞和成纤维细胞等的增殖,对胚胎期生殖系统和肺组织的发育也有重要作用[10]。此外,FGF9敲除小鼠出生后死于肺细胞缺氧,并表现出各种异常现象,如睾丸发育不全和男女性别逆转[11]。FGF9的异常表达还与几种人类癌症如子宫内膜癌[12]和子宫内膜异位症有关。这些研究提示必须严格控制FGF9的表达以维持机体内平衡。综上所述,目前关于FGF9的研究主要集中在性别决定、骨骼发育与损伤修复、卵巢癌肿瘤等方面[13-16]。尚未见FGF9在山羊中的报道,其是否与山羊肌肉生长有关,是否可作为肌肉生长的关键调控基因还有待进一步地研究。
本试验以生长速度快、肉质特性好的简州大耳羊为研究对象,采用RT-PCR技术克隆获得FGF9基因序列,然后利用实时荧光定量PCR技术分析组织表达特性,构建该基因的组织表达谱,同时检测其在山羊成肌细胞分化过程中的表达模式,旨在为后续研究FGF9基因在山羊成肌细胞分化中的调控作用提供重要数据。
1 材料和方法
1.1 试验材料
1.1.1 试验动物及取材 在四川省简阳市大哥大牧业有限公司挑选6只健康的1周岁简州大耳羊公羊,将其空腹颈动脉放血致死,无菌采集各山羊心、肝、脾、肺、肾、小肠、瘤胃、皮下脂肪和背最长肌等组织,用0.1% DEPC水冲洗干净裹上锡箔纸装入冻存管,迅速放入液氮内带回实验室用于提取组织总 RNA。山羊成肌细胞则由实验室前期试验分离得到,并冻存于液氮罐内备用。
1.1.2 主要试剂 TRIzol试剂、pMD-19T载体、荧光定量试剂盒(TaKaRa公司,大连);DNA 聚合酶、总RNA提取试剂盒、大肠杆菌感受态细胞DH5α(天根生化科技有限公司,北京);反转录试剂盒(Thermo公司,美国);胶回收试剂盒(Axygen公司,美国);DEPC、胎牛血清、DMEM培养基、油酸(Sigma公司,美国)。
1.2 试验方法
1.2.1 山羊FGF9基因的克隆测序 根据GenBank公布的山羊FGF9基因预测序列(登录号为XM_005687564.3)在Primer Premier 5.0软件上设计PCR引物(表1)。研磨成年羊肺组织样品,用TRIzol法提取总RNA,电泳检测正确并用紫外分光光度计测得总RNA的OD值在1.8~2.0,符合试验要求。参照反转录试剂盒(Revert Aid First Strand cDNA Synthesis Kit)说明书,按2 μg反转录获得cDNA。PCR反应体系:DNA聚合酶12.5 μL、模板cDNA 1.0 μL、上下游引物(10 μmol/L)各1 μL、ddH2O 9.5 μL。 PCR程序设定:94 ℃预变性4 min;94 ℃ 20 s,58 ℃ 60 s,72 ℃ 90 s,32个循环;72 ℃延伸 10 min。PCR产物经2%琼脂糖凝胶电泳检测正确后,做胶回收再连接pMD-19T 载体,转化感受态细胞DH5α,37 ℃过夜培养,挑取阳性单克隆经菌液PCR鉴定正确后送成都擎科梓熙生物技术有限公司测序。
1.2.2 FGF9基因序列分析 测序结果在NCBI的Blast上比对序列同源性,用MEGA 5.0 绘制系统进化树,应用ExPASy分析蛋白质的基本理化性质,利用Signal P 4.1 分析信号肽序列,通过TMHMM 2.0预测蛋白跨膜结构域,使用Net Phos 3.1预测FGF9蛋白磷酸化位点,采用Hopfield和PHYRE2 Server工具进行二级结构和三级结构预测。
1.2.3 FGF9基因组织表达谱的构建 用TRIzol法提取成年羊(6只)心、肝、脾、肺、肾、小肠、瘤胃、皮下脂肪和背最长肌等组织总RNA,反转录得到cDNA。根据1.2.1中克隆的FGF9基因序列与NCBI公布的山羊磷酸三丁酯(Tributyl phosphate,TBP)序列(登录号为XM_018053502.1),在Primer Premier 5.0 软件上分别设计特异性引物(表1)。采用实时荧光定量 PCR(qPCR)检测FGF9 mRNA在简州大耳羊各组织中的表达水平,构建其组织表达谱。qPCR反应体系:SYBR ®Premix Ex TaqTM(2×) PCR 10 μL,模板cDNA 1 μL,上下游引物(10 μmol/L)各 1 μL,ddH2O 7 μL。程序设定:95 ℃预变性 3 min;95 ℃ 10 s,66 ℃ 10 s,72 ℃延伸15 s,39个循环。
1.2.4 山羊成肌细胞的复苏 取山羊脂肪代谢实验室前期冻存的山羊成肌细胞,迅速置于37 ℃水浴锅内振荡解冻。待细胞复苏后转入100 mm培养皿,用含10%胎牛血清的DMEM 培养基在 37 ℃、5%CO2培养箱中培养,传代。
1.2.5 FGF9基因在山羊成肌细胞分化中的表达差异 成肌细胞传至第3代且有90% 的细胞发生融合时,用终浓度100 μmol/L的油酸诱导完全培养基中的细胞进行分化,收集分化0.0,0.5,1.0,2.0,4.0 d的肌肉细胞,参照细胞RNA提取试剂盒说明书提取细胞中总RNA,再用RNA反转录试剂盒按1 μg将其反转录为cDNA。根据NCBI公布的山羊18SrRNA基因序列(登录号为DQ149973.1),在Primer Premier 5.0 软件上设计特异性引物(表1)。利用qPCR技术,对不同分化天数的肌肉细胞中FGF9基因表达量进行检测,qPCR反应体系及条件同1.2.3。
1.2.6 数据统计与分析 定量数据用2-ΔΔCt方法计算,其中ΔΔCt=(CtFGF9-CtTBP)试验组-(CtFGF9-CtTBP)对照组,计算结果在SPSS 18.0中进行单因素方差分析和显著性检验,P<0.05为差异显著,P<0.01为差异极显著。试验数据均用“平均值±标准差(X±SD)”表示。
表1 引物信息
Tab.1 Primer information
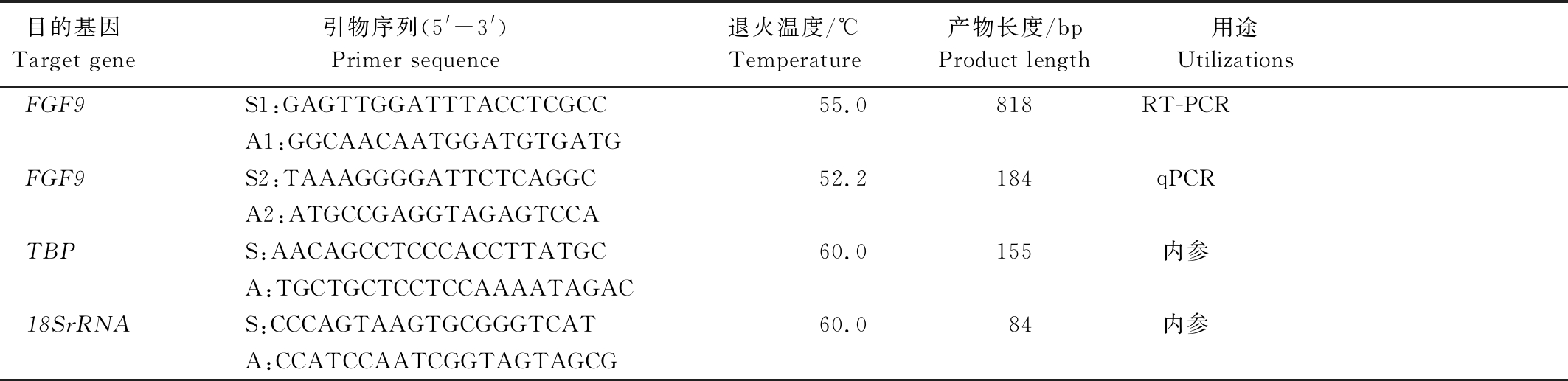
目的基因Target gene引物序列(5'-3')Primer sequence退火温度/℃Temperature产物长度/bpProduct length用途UtilizationsFGF9S1:GAGTTGGATTTACCTCGCC55.0818RT-PCRA1:GGCAACAATGGATGTGATGFGF9S2:TAAAGGGGATTCTCAGGC52.2184qPCRA2:ATGCCGAGGTAGAGTCCATBPS:AACAGCCTCCCACCTTATGC60.0155内参A:TGCTGCTCCTCCAAAATAGAC18SrRNAS:CCCAGTAAGTGCGGGTCAT60.084内参A:CCATCCAATCGGTAGTAGCG
注:S.正义链引物; A.反义链引物; TBP.磷酸三丁酯。
Note:S.Sense primer; A.Antisense primer;TBP.Tributyl phosphate.
2 结果与分析
2.1 山羊FGF9基因克隆及同源性分析
经克隆测序得到1条长818 bp的FGF9基因序列,包括627 bp的编码区,编码了208个氨基酸(图1),另有88 bp的 5′UTR序列和103 bp的3′UTR序列,上传全长序列到NCBI获得GenBank登录号:MH358358。同源性分析表明,山羊FGF9基因的CDS区序列与绵羊(XM_004012161.3)、牛(NM001245926.1)和獐鹿(HG326981.1)的同源性高达99%,与猪(AK343298.1)、大鼠(NM_012952.1)的同源性达91%,与小鼠(HM988990.1)和人(NM_002010.2)的同源性为90%。构建的系统进化树(图2)显示,山羊FGF9基因序列在各物种进化上是高度保守的,尤其与绵羊亲缘关系最近。
2.2 FGF9基因生物信息学分析
蛋白质理化性质分析发现,FGF9蛋白理论分子质量为23.38 ku,等电点为7.06,属于不稳定亲水蛋白。利用Signal P 4.1 Server预测FGF9 蛋白的信号肽序列(图3),发现其中并不存在信号肽序列。利用SMART软件预测蛋白结构域,发现该蛋白具有1个跨膜结构域,跨膜结构在第17-33个氨基酸残基,还有1个从第60-190个氨基酸残基的FGF特有结构域。磷酸化位点对蛋白质功能具有重要作用,运用 Net Phos 3.1 软件对FGF9 蛋白可能的磷酸化位点进行分析,发现该蛋白具有6个酪氨酸、7个苏氨酸和8个丝氨酸磷酸化位点(图4),第625个氨基酸残基处还有1个O-糖基化位点,但无N-糖基化位点。

起始密码子用方框表示;跨膜结构域(AA17-33)下划黑色双线;阴影部分(AA60-190)为FGF家族同源性结构域;*表示终止密码子。
The start codon (ATG) is represented by the box;Transmembrane spaning domain(AA17-33)is under black double line;FGFs homologous domain is indicated as shaded residues(AA60-190);*Represents the stop codon.
图1 FGF9基因的ORF区序列和编码的氨基酸序列
Fig.1 ORF and amino acid sequences of FGF9 gene
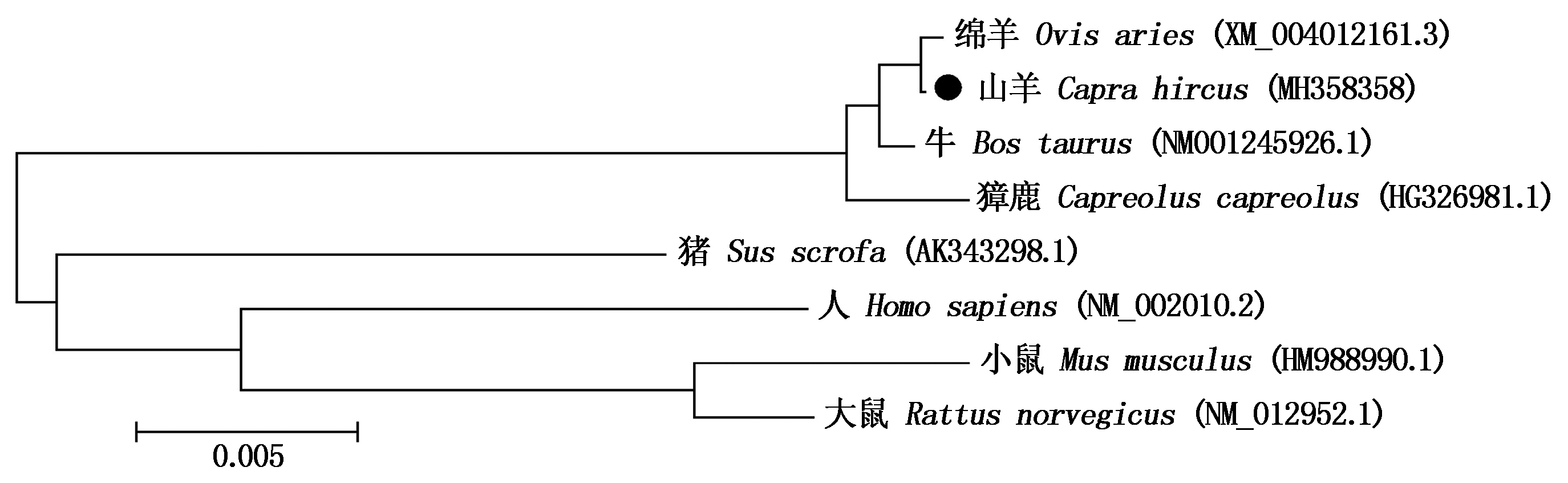
图2 采用MEGA 5.0构建山羊FGF9序列系统进化树
Fig.2 Phylogenetic tree was constructed based on FGF9 sequence using MEGA 5.0
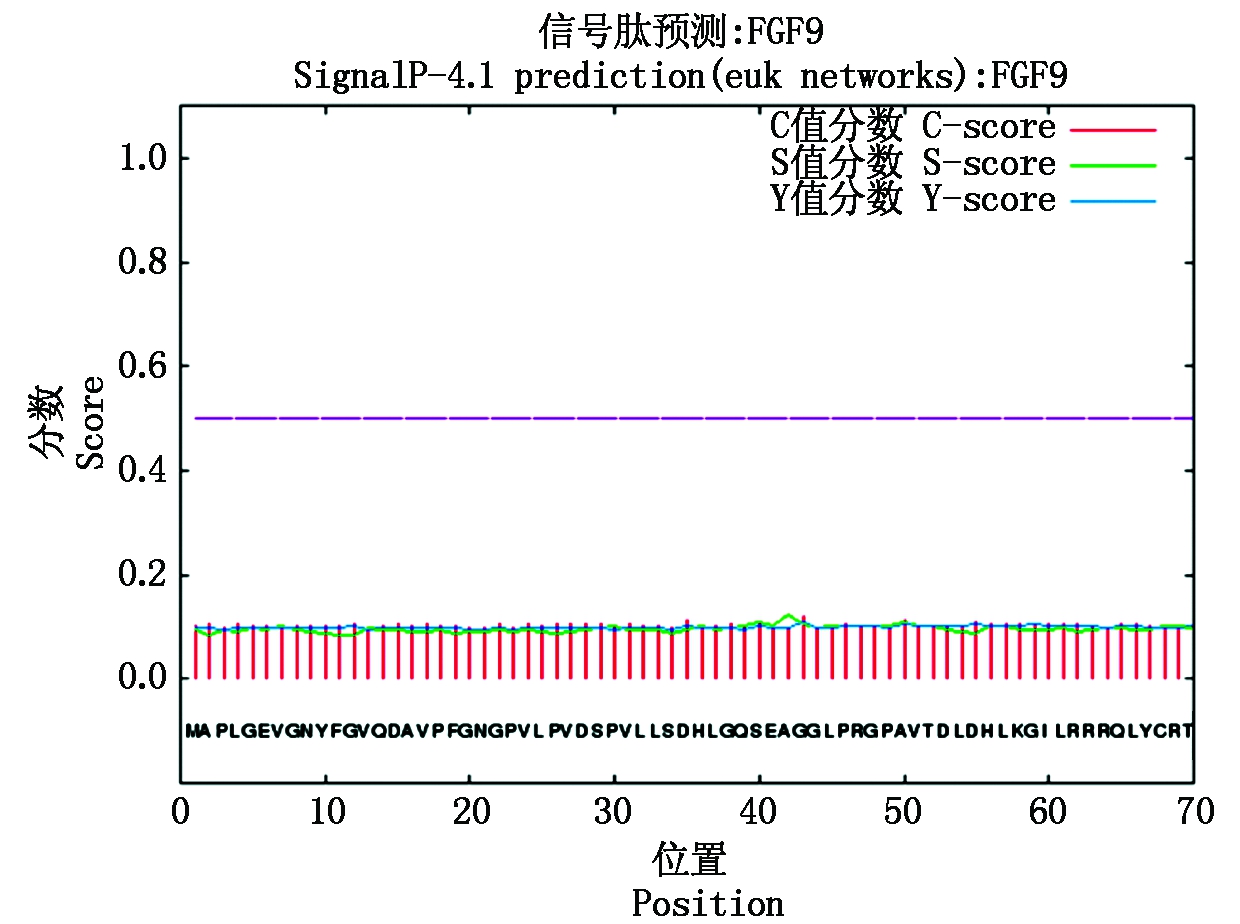
图3 山羊FGF9蛋白的信号肽分析
Fig.3 Signal peptide analysis of goat FGF9 protein
二级结构预测显示FGF9蛋白主要有3种存在形式,包括66.35% 的无规卷曲(c),17.31% 的β-折叠(e)和16.35% 的α-螺旋(h)。并且用PHYRE2 Server(http://www.sbg.bio.ic.ac.uk/~phyre2/html/page.cgi? id=index)分析了该蛋白的三级结构(图5)。利用STRING数据库搜索到GRB2、MAPK3、FGFR3等蛋白可能和FGF9蛋白存在相互作用(图6)。采用PSORT Ⅱ进行亚细胞定位,发现该蛋白主要在线粒体(30.4%)、细胞质(30.4%)和高尔基体(13.0%)中发挥生物学作用。
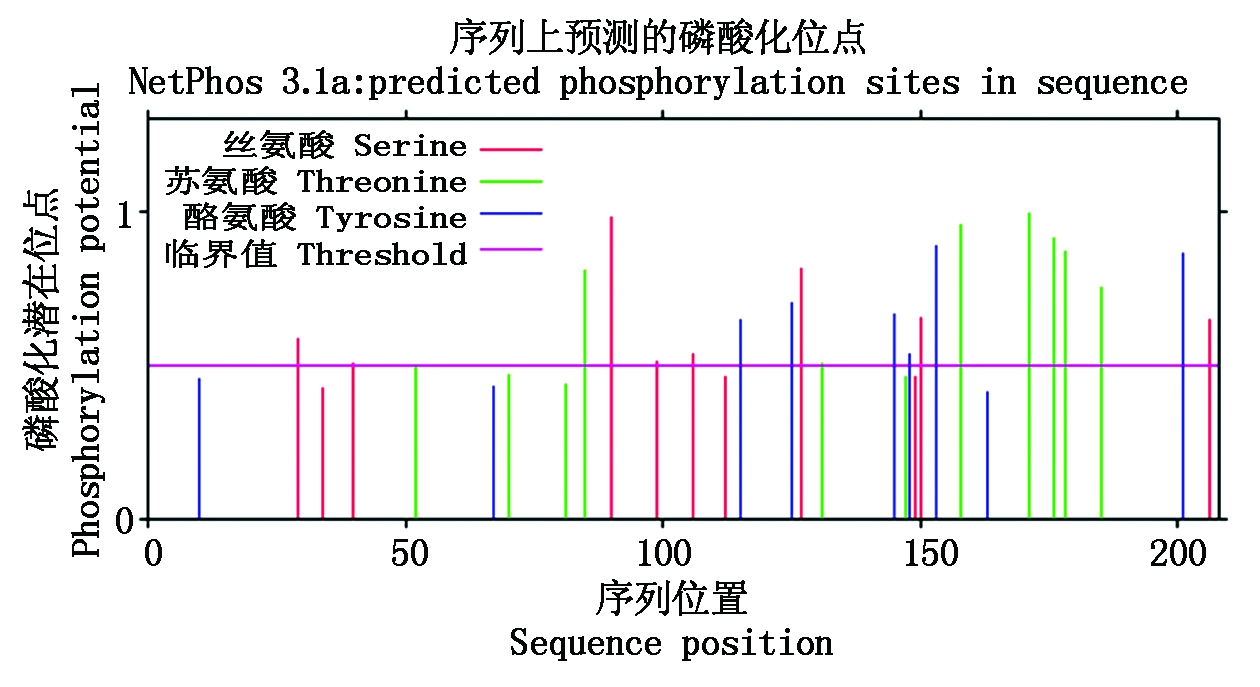
图4 山羊FGF9序列的磷酸化位点预测
Fig.4 Predicted phosphorylation site in FGF9 sequence
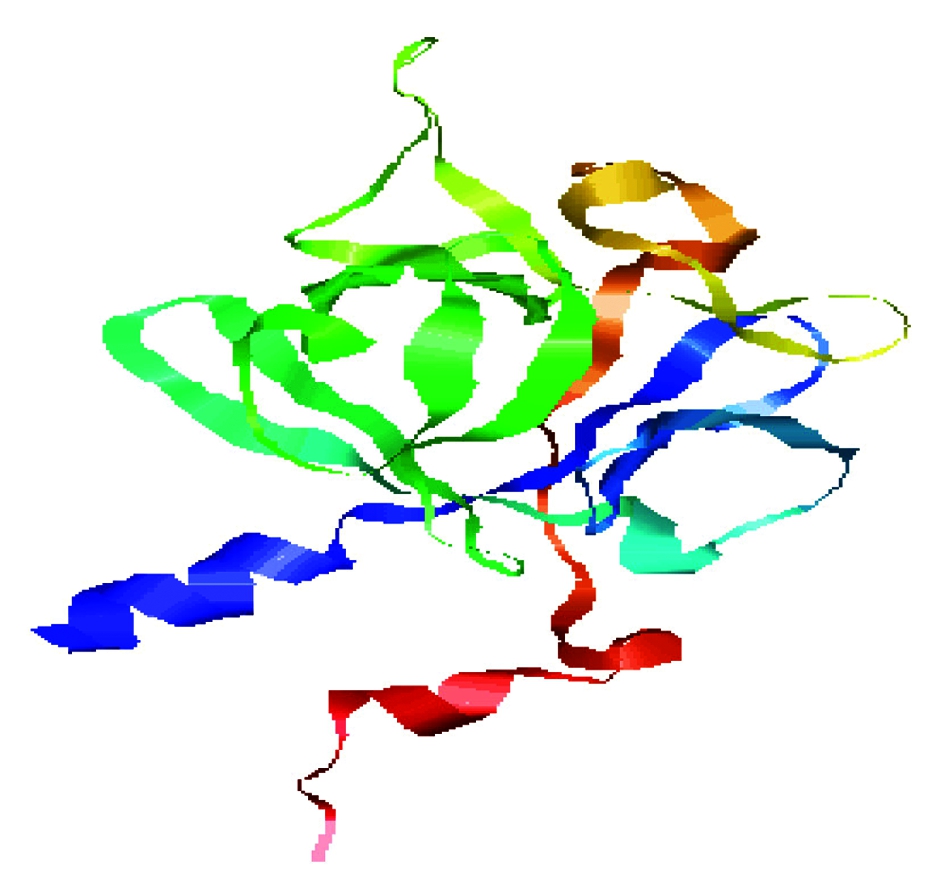
图5 山羊FGF9蛋白三级结构预测
Fig.5 Tertiary structure prediction of goat FGF9 protein

图6 与山羊FGF9蛋白相互作用蛋白预测
Fig.6 Prediction of proteins interacting with goat FGF9 protein
2.3 山羊FGF9基因组织表达谱的构建
以TBP为内参基因,用qPCR技术检测FGF9基因的组织表达情况,根据在山羊不同组织的表达差异构建组织表达谱。结果发现在心、肝、脾、肺、肾、小肠、瘤胃、皮下脂肪和背最长肌中均检测到FGF9的表达,但表达程度不同,肾脏中的相对表达量最高,且极显著高于其他被测组织(P<0.01),小肠组织次之,肝脏和脾脏最低(图7)。
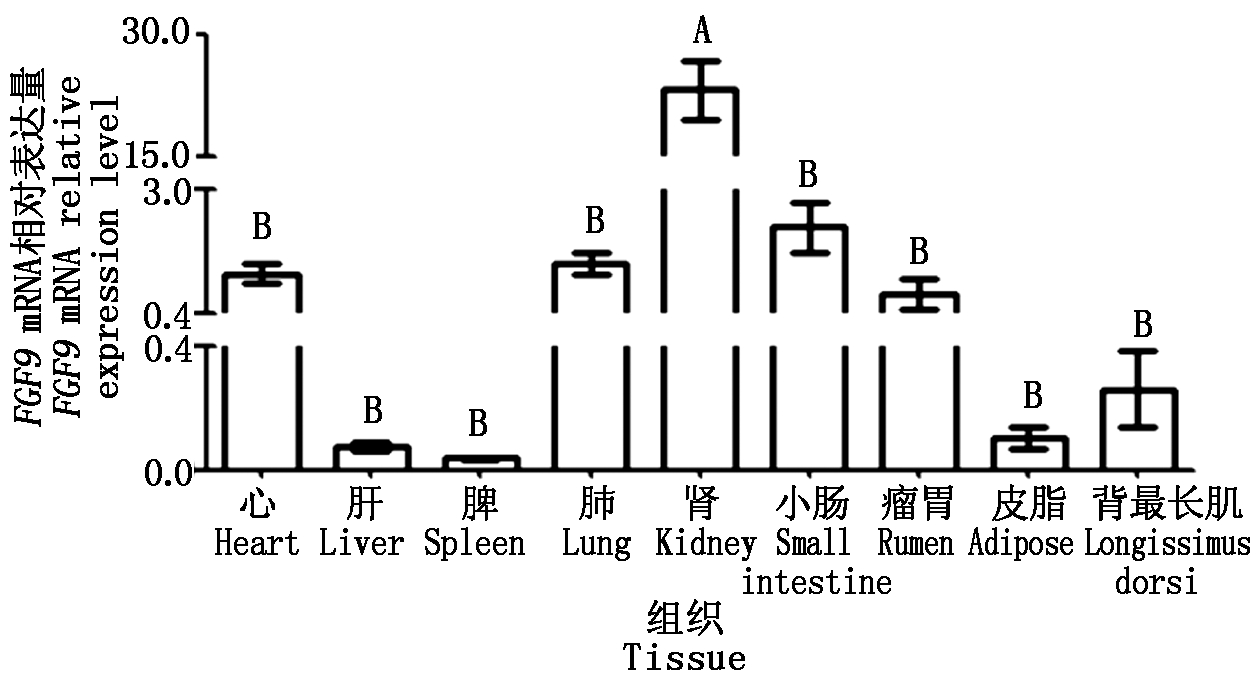
不同大写字母表示差异极显著(P<0.01)。
Different capital letter indicate extremely significant differences(P<0.01).
图7 山羊FGF9基因组织表达谱
Fig.7 Spatial expression profile of FGF9 gene in goat
2.4 FGF9基因在山羊成肌细胞分化中的表达差异
以18SrRNA为内参基因,采用qPCR技术检测FGF9基因在山羊成肌细胞不同分化阶段的表达情况(以0 d的表达水平为对照)(图8),结果发现FGF9基因在成肌细胞诱导分化第2天表达水平显著高于分化前(P<0.05),且在第4天达到极显著水平(P<0.01)。
3 结论与讨论
FGF9作为成纤维细胞生长因子家族(FGFs)成员之一,是参与许多生理过程的有效促分裂剂,它能刺激中胚层和神经外胚层细胞生长,促进分化[17]。近年来,有关FGF9的研究不断深入,发现FGF9活化FGFR2、FGFR3可以促进成骨细胞生长,提高骨密度[18-19],揭示FGF/FGFR信号传导是维持成体骨稳态的重要途径。先天性缺乏FGF9可导致显著的骨骼软骨发育不良,同时发现在颅面骨、椎骨和肋骨中还有其他的缺陷,但是给予体外培养的小鼠颅骨FGF9后,发现颅缝愈合、骨细胞分化增强[20]。这说明在骨骼发育中,FGF9可以促进软骨内骨化和膜内成骨。FGF9还可以直接调节骨代谢,裴育等[21]发现FGF9通过MAPK信号通路抑制小鼠MA3T3-E1和C2C12细胞中Cbfa1基因的启动子活性和mRNA水平,推测可能有其他FGF家族成员与FGF9形成互补,共同调节成骨细胞分化。Frontini等[22]报道,FGF9通过SHH和血小板源性生长因子受体β(PDGFRβ) 在刺激平滑肌细胞形成微管的过程中发挥关键作用。但FGF9在山羊肌肉生长中的作用,及其在成肌细胞分化中的研究还尚未见报道。
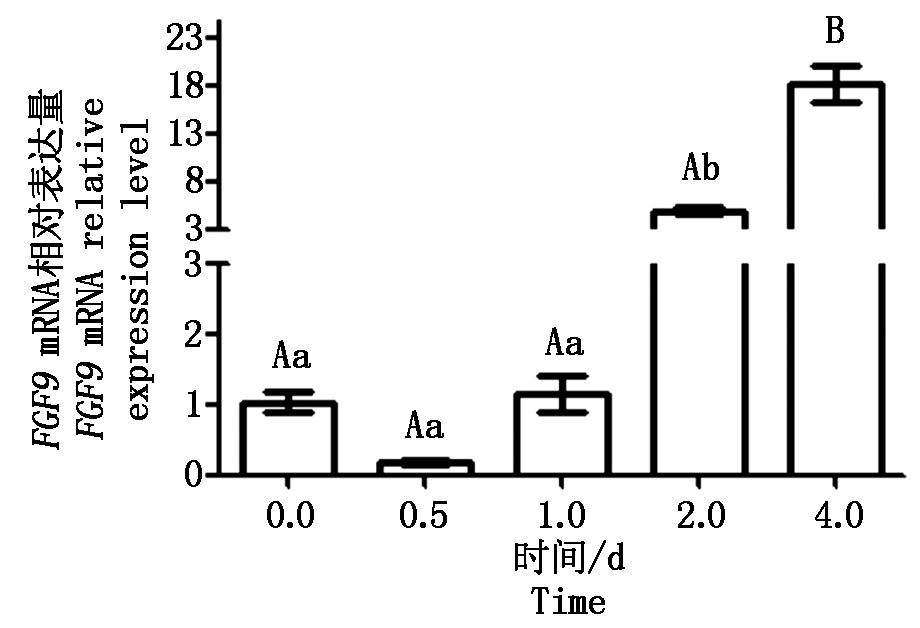
不同大写字母表示差异极显著(P<0.01);不同小写字母表示差异显著(P<0.05)。
Different capital letter indicate extremely significant differences(P<0.01);Different lowercases indicate significant differences (P<0.05).
图8 FGF9基因在山羊成肌细胞分化过程中的表达差异
Fig.8 FGF9 expression levels during goat myoblast differentiation
本试验克隆获得山羊FGF9基因序列818 bp,其中CDS区627 bp,编码208个氨基酸,与NCBI上公布的绵羊、牛、獐鹿、猪、大鼠、小鼠和人的CDS区序列分别有99%,99%,99%,91%,91%,90%,90%的同源性,表明FGF9在不同种属间有着较高的同源性。通过蛋白结构域预测,发现FGF9蛋白具有1个跨膜结构域和1个FGF同源结构域[23]。但是信号肽预测结果显示,在FGF9蛋白中不存在信号肽序列,有文献称FGF9 N端的35个氨基酸作为非剪切信号肽可以替代经典的信号肽,使FGF9同其他分泌蛋白一样分泌到胞外[24]。相互作用蛋白分析则显示该蛋白可能和GRB2、MAPK3、FGFR3等蛋白存在相互作用。
本试验利用qPCR技术进一步研究了FGF9 mRNA在1周岁山羊体内的表达情况,根据组织表达谱分析,发现该基因在体内各组织中广泛表达,在肾脏中表达量最高,极显著高于其他组织,其次是小肠,表达最低的是肝脏和脾脏。在牛和小鼠的研究中也同样证明了FGF9基因具有在各组织中广泛表达的特点[17,25]。陈晓怡等[26]研究发现,FGF9在小鼠心、肝、肺、肾、大脑、小脑、骨骼肌等12种组织中均有表达,且在心、肾、小脑和骨骼肌中高表达,在大脑和关节中表达较弱。这些报道与本试验结果存在相似及不同之处。
前人在研究FGF家族时,比较过其他几个分泌型FGFs,发现FGF4、FGF5、FGF6在骨骼肌成肌细胞亚群中以肌管形成的形式表达[27-29],而FGF9则以另一种不同的时空模式在小鼠成肌细胞中表达,在E9.5和E10.5的肌节中检测到FGF9 mRNA的表达,在E12.5中通过比较FGF9和α-心肌肌动蛋白探针杂交相邻部分,证明了FGF9在E12.5的小鼠头部和躯干的大部分乃至全部骨骼肌成肌细胞中表达[30]。在本试验中,检测了FGF9在山羊成肌细胞不同分化阶段的表达水平,发现该基因在成肌细胞诱导分化第2天表达水平显著高于分化前(P<0.05),且在第4天达到极显著水平(P<0.01),由此推测其可能参与山羊肌肉组织的生长。
本研究成功克隆山羊FGF9基因,序列长818 bp,其中CDS区627 bp,编码208个氨基酸。获得GenBank登录号:MH358358。FGF9基因在山羊心、肝、脾、肺、肾、小肠、瘤胃、皮下脂肪和背最长肌等组织中存在广泛表达,且在肾脏组织中存在较高水平表达。FGF9在成肌细胞诱导分化第2天表达水平显著高于分化前,且在第4天达到极显著水平,推测其可能作为调控山羊成肌细胞分化的候选基因。本研究为进一步探究FGF9基因在山羊肌肉生长中的作用提供基础数据。
[1] 王敬,王琪,黄金秀,齐仁立. 动物肌肉生长发育相关microRNAs的表达模式和调控机制[J]. 动物营养学报,2016,28(3):687-694. doi:10.3969/j.issn.1006-267x.2016.03.008.
Wang J,Wang Q,Huang J X,Qi R L.Expression patterns and regulation mechanisms of micrornas relate in growth and development of muscle in animals[J]. Chinese Journal of Animal Nutrition,2016,28(3):687-694.
[2] Deng S,Azevedo M,Baylies M. Acting on identity:Myoblast fusion and the formation of the syncytial muscle fiber[J]. Seminars in Cell & Developmental Biology,2017,72:45-55. doi:10.1016/j.semcdb.2017.10.033.
[3] 文逸凡,贺花,宋成创,彭术军,雷初朝,陈宏,黄永震. 家养动物肌肉发育相关基因的研究进展[J]. 基因组学与应用生物学,2017,09(12):1-8. doi:10.13417/j.gab.037.002825.
Wen Y F,He H,Song C C,Peng S J,Lei C C,Chen H,Huang Y Z. The research progress of genes related to the domestic animals muscle development[J]. Genomics and Applied Biology,2017,09(12):1-8.
[4] Gnatenko D A,Kopantzev E P,Sverdlov E D. Fibroblast growth factors and their effects in pancreas organogenesis[J]. Biomeditsinskaia Khimiia,2017,63(3):211-218. doi:10.18097/PBMC20176303211.
[5] Chang M M,Lai M S,Hong S Y,Pan B S,Huang H,Yang S H,Wu C C,Sun H S,Chuang J I,Wang C Y,Huang B M. FGF9/FGFR2 increase cell proliferation by activating ERK1/2,Rb/E2F1,and cell cycle pathways in mouse Leydig tumor cells[J]. Cancer Science,2018,109(11):3503-3518. doi:10.1111/cas.13793.
[6] Korsensky L,Ron D. Regulation of FGF signaling:Recent insights from studying positive and negative modulators[J]. Seminars in Cell & Developmental Biology,2016,53:101-114. doi:10.1016/j.semcdb.2016.01.023.
[7] Oisen S K,Garbi M,Zampieri N,Eliseenkova A V,Ornitz D M,Goldfarb M,Mohammadi M. Fibroblast growth factor(FGF)homologous factors share structural but not functional homology with FGFs[J]. Journal of Biological Chemistry,2003,278(36):34226-34236. doi:10.1074/jbc.M303183200.
[8] Dunstan C R,Zhou H,Seibel M J. Fibroblast growth factor 23:a phosphatonin regulating phosphate homeostasis[J]. Endocrinology,2004,145(7):3084-3086. doi:10.1210/en.2004-0354.
[9] Naruo K,Seko C,Kuroshima K,Matsutani E,Sasada R,Kondo T,Kurokawa T. Novel secretory heparin-binding factors from human glioma-cells (glia-activating factors) involved in glial-cell growth-purification and biological properties[J]. Journal of Biological Chemistry,1993,268(4):2857-2864.
[10] Itoh N,Ohta H,Nakayama Y,Konishi M. Roles of FGF signals in heart development,health,and disease[J]. Frontiers in Cell and Developmental Biology,2016,4:110. doi:10.3389/fcell.2016.00110.
[11] Colvin J S,Green R P,Schmahl J,Capel B,Ornitz D M. Male-to-female sex reversal in mice lacking fibroblast growth factor 9[J]. Cell,2001,104:875-889. doi:10.1016/s0092-8674(01)00284-7.
[12] Abdel-Rahman W M,Kalinina J,Shoman S,Eissa S,Ollikainen M,Elomaa O,Eliseenkova A V,Bützow R,Mohammadi M,Peltomäki P. Somatic FGF9 mutations in colorectal and endometrial carcinomas associated with membranous beta-catenin[J]. Human Mutation,2008,29(3):390-397. doi:10.1002/humu.20653.
[13] Fakhry A,Ratisoontorn C,Vedhachalam C,Salhab I,Koyama E,Leboy P,Pacifici M,Kirschner R E,Nah H D.Effectsof FGF-2/-9 in calvarial bone cell cultures:differentiationstage-dependent-mitogeniceffect,inverse regulation of BMP-2 and noggin,and en-hancement of osteogenic potential[J]. Bone,2005,36(2):254-266. doi:10.1016/j.bone.2004.10.003.
[14] Hung I H,Schoenwolf G C,Lewandoski M,Ornitz D M. A combined series of Fgf9 and Fgf18 mutant alleles identifies unique and redundant roles in skeletal development[J]. Developmental Biology,2016,411(1):72-84. doi:10.1016/j.ydbio.2016.01.008.
[15] Behr B,Leucht P,Longaker M T,Quarto N. Fgf-9 is required for angiogenesis and osteogenesis in long bone repair[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(26):11853-11858. doi:10.1073/pnas.1003317107.
[16] 易善勇,杨晶,官丽莉,王艳芳,黄建,王立勇,李海燕,李校堃,姜潮. 成纤维细胞生长因子9(FGF9)的研究进展[J]. 中国生物工程杂志,2015,35(7):94-101. doi:10.13523/j.cb.20150713.
Yi S Y,Yang J,Gong L L,Wang Y F,Huang J,Wang L Y,Li H Y,Li X K,Jiang C. Research progresses on the fibroblast growth factor 9[J]. China Biotechnology,2015,35(7):94-101.
[17] 廖冰,吴宁,韩凤桐,林秀坤. 牛性别决定新基因Fgf9的克隆及生物信息学分析[J].中国生物工程杂志,2009,29(8):45-50. doi:10.13523/j.cb.20090808.
Liao B,Wu N,Han F T,Lin X K. Cloning and bioinformatics analysis of Fgf9,a novel gene related to sex determination in cow[J]. China Biotechnology,2009,29(8):45-50.
[18] Karuppaiah K,Yu K,Lim J,Chen J,Smith C,Long F,Ornitz D M. FGF signaling in the osteoprogenitor lineage non-autonomously regulates postnatal chondrocyte proliferation and skeletal growth[J]. Development,2016,143(10):1811-1822. doi:10.1242/dev.131722.
[19] 于丽云,周学瀛. 成纤维细胞生长因子9及其受体对骨骼的作用[J].国外医学(内分泌学分册),2005,25(5):324-327.
Yu L Y,Zhou X Y. Effect of fibroblast growth factor 9 and its receptor on bone[J]. Foreign Medicine(Endocrinology),2005,25(5):324-327.
[20] Rodriguez Z M,Aza C M,Rivera P C I,Belinchón A,Guerrero Z I,Barraza G J,Vallespin E,Lu M,Del Pozo A,Glucksman M J,Santos S F,Heath K E. FGF9 mutation causes craniosynostosis along with multiple synostoses[J]. Human Mutation,2017,38(11):1471-1476. doi:10.1002/humu.23292.
[21] 裴育,孟迅吾,周学瀛,邢小平,夏维波. 成纤维细胞生长因子9影响成骨细胞核心结合因子α1基因表达的作用[J]. 中国临床康复,2005,9(10):32-34.
Pei Y,Meng X W,Zhou X Y,Xin X P,Xia W B. Effect of fibroblast growth factor 9 on the expression of core binding factor α1 gene in osteoblasts[J]. Chinese Journal of Clinical Rehabilitation,2005,9(10):32-34.
[22] Frontini M J,Nong Z,Gros R,Drangova M,O′Neil C,Rahman M N,Akawi O,Yin H,Ellis C G,Pickering J G. Fibroblast growth factor 9 delivery during angiogenesis produces durable,vasoresponsive microvessels wrapped by smooth muscle cells[J]. Nature Biotechnology,2011,29(5):421-427. doi:10.1038/nbt.1845.
[23] Xie B,Tassi E,Swift M R,McDonnell K,Bowden E T,Wang S,Ueda Y,Tomita Y,Riegel A T,Wellstein A.Identification of the fibroblast growth factor(FGF)-interacting domain in a secreted FGF-binding protein by phage display[J]. Journal of Biological Chemistry,2006,281(2):1137-1144. doi:10.1074/jbc.M510754200.
[24] Revest J M, Demoerlooze L,Dickson C. Fibroblast growth factor 9 secretion is mediated by a non-cleaved amino-terminal signal sequence[J]. Journal of Biological Chemistry,2000,275(11):8083-8090. doi:10.1074/jbc.275.11.8083.
[25] Lai M S,Wang C Y,Yang S H,Wu C C,Sun H S,Tsai S J,Chuang J I,Chen Y C,Huang B M. The expression profiles of fibroblast growth factor 9 and its receptors in developing mice testes[J]. Organogenesis,2016,12(2):61-77.doi:10.1080/15476278.2016.1171448.
[26] 陈晓怡,吴晓林,顾鸣敏,陆顺元,王铸钢. TFGF9转基因小鼠的功能及组织表达谱的研究[J]. 诊断学理论与实践,2009,8(5):496-501.doi:10.16150/j.1671-2870.2009.05.006.
Chen X Y,Wu X L,Gu M M,Lu S Y,Wang Z G. Investigation on function and tissue expression profile of transgenic mice with mutated FGF9 gene[J]. Journal of Diagnostics Concepts & Practice,2009,8(5):496-501.
[27] Zimna A,Janeczek A,Rozwadowska N,Fraczek M,Kucharzewska P,Rucinski M,Mietkiewski T,Kurpisz M.Biological properties of human skeletal myoblasts genetically modified to simultaneously overexpress the pro-angiogenic factors vascular endothelial growth factor-a and fibroblast growth factor-4[J]. Journal of Physiology and Pharmacology,2014,65(2):193-207.
[28] Bao W L,Yao R Y,He Q,Guo Z X,Bao C,Wang Y F,Wang Z G. Cloning,molecular characterization,and expression pattern of FGF5 in Cashmere goat (Capra hircus)[J]. Genetics and Molecular Research,2015,14(3):11154-11161. doi:10.4238/2015.September.22.9.
[29] Han D,Zhao H,Parada C,Hacia J G,Bringas P Jr,Chai Y. A TGF β-Smad4-Fgf6 signaling cascade controls myogenic differentiation and myoblast fusion during tongue development[J]. Development,2012,139(9):1640-1650. doi:10.1242/dev.076653.
[30] Colvin J S,Feldman B,Nadeau J H,Goldfarb M,Ornitz D M. Genomic organization and embryonic expression of the mouse fibroblast growth factor 9 gene[J]. Developmental Dynamics:an Official Publication of the American Association of Anatomists,1999,216(1):72-88. doi:10.1002/(SICI)1097-0177(199909)216:1<72::AID-DVDY9>3.0.CO;2-9.