猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种猪的重要传染病[1-2],临床特征表现为母猪的繁殖障碍、死胎、流产,以及各年龄段猪严重呼吸道症状[3-4]。该病于1987年首次在北美被发现[5],我国于1996年首次从疑似PRRSV感染的猪群中分离出PRRSV[6]。20多年来,国内外学者对PRRSV的分子流行病学、病毒复制机制、致病和免疫应答机制进行了大量的研究,也开发出了一系列的防控疫苗,但由于PRRSV独特而复杂的免疫和致病机制,已开发的疫苗仍存在低效、不安全等诸多问题,距完全控制该病还相距甚远[7]。目前,PRRS在世界范围内仍呈蔓延之势,每次暴发都会给养猪业造成极大的经济损失[8]。病毒特异性单克隆抗体是研究病毒免疫机制,特别是体液免疫识别机制的基本工具,也是开发和诊断检测试剂的必需材料。制备病毒的单克隆抗体需要经过抗原纯化、小鼠免疫、细胞融合、单抗筛选、鉴定等重要步骤。其中,单抗筛选是指用病毒抗原来识别鉴定混合在大量杂交瘤细胞中少数能够分泌特异性单克隆抗体杂交瘤细胞株的过程。建立准确、简单、快速的高通量病毒单克隆抗体筛选方法,在细胞融合后用于短时间内数百至数千个培养上清样品的筛选,是制备病毒单克隆抗体的关键技术。PRRSV具有高变异性[9-10],分为基因1型和2型,其特异性单克隆抗体的制备可以用于区分2个基因型的毒株[11]。此外,PRRSV是一种具有囊膜的单股正链RNA病毒,属于套式病毒目(Nidovirales)动脉炎病毒科(Arteriviridae)动脉炎病毒属(Arterivirus)。PRRSV的基因组中含有10个开放阅读框,分别编码14个非结构蛋白和8个结构蛋白,其中GP5、M和N蛋白是主要结构蛋白[12-13],M蛋白和N蛋白较保守,N蛋白在病毒粒子中含量最高[14]。国内外学者分别采用不同方法制备了针对PRRSV病毒结构蛋白和非结构蛋白的单抗[15-16]。国内研究者对PRRSV病毒单克隆抗体的筛选多采用经典的酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA),但由于聚苯乙烯96孔板只能够强力吸附可溶性蛋白而对颗粒病毒的吸附能力较差[17-18],所以使用包被病毒进行单克隆抗体筛选时,常常出现目的抗体漏筛、非特异性抗体误判或筛选完全失败的结果。免疫过氧化物酶单层细胞试验(Immunoperoxidase monolayer assay,IPMA)常用于细胞蛋白质变化分析及畜禽体液免疫应答抗体的检测[19-22],也较多用于单克隆抗体筛选后的鉴定[23-25],而使用IPMA法进行抗病毒单克隆抗体的初次筛选已有报道[26-27],但缺乏技术细节。本研究对IPMA反应板的PRRSV感染量、感染时间、PRRSV感染细胞固定于96孔细胞培养板的条件等试验细节进行优化,以建立特异性强、敏感性高且适合高通量筛选病毒单抗的方法,并筛选出高特异性、高敏感性的抗PRRSV的单克隆抗体,建立详细完整的IPMA筛选病毒单克隆抗体的方法,为其他动物疫病病毒单克隆抗体制备和筛选提供借鉴。
1 材料和方法
本研究于2016-2018年在河南省农业科学院动物免疫学重点实验室完成。
1.1 病毒和细胞
PRRSV高致病毒株HN07-1、猪瘟病毒(CSFV)、猪伪狂犬病毒(PRV)和传代细胞Marc-145、PK-15、Vero细胞均由河南省农业科学院动物免疫学重点实验室保存,PRRSV经典毒株BJ-4由中国农业大学杨汉春教授惠赠,猪流行性腹泻病毒(PEDV)由河南农业大学王川庆教授惠赠,猪肺泡巨噬细胞系CRL-2843-CD163细胞株由西北农林科技大学周恩民教授惠赠。
1.2 试验试剂
胎牛血清、液体培养基1640、DMEM购自GIBCO;猪抗PRRSV阳性血清由河南省农业科学院动物免疫学重点实验室自制;山羊抗猪IgG-HRP和山羊抗鼠IgG-HRP购自Abbkine。
1.3 试验仪器
生物安全柜、CO2细胞培养箱(Thermo fisher);倒置光学显微镜(德国Leica);实验超净工作台;37 ℃普通温箱;酶标仪及洗板机(TECAN);96孔细胞板;移液加样器。
1.4 Marc-145细胞培养和PRRSV感染增殖
将PRRSV病毒HN07-1接种Marc-145细胞,设未接毒细胞为对照,于37 ℃ 5% CO2条件下进行培养,分别在12,24,36,48,60,72 h时连续观察细胞的状态,并无菌收集病毒培养上清,于-70 ℃保存。
1.5 PRRSV的IPMA效价测定
制备5×104 个/mL的Marc-145细胞悬液,以每孔100 μL加入96孔细胞培养板,置于37 ℃、5% CO2的培养箱中,待细胞的覆盖度达到85%时,将1.4中6个时间点收集的待测病毒以10倍倍比梯度稀释至10-6,每个稀释度做2孔重复(结果取平均值),12 h后弃除培养上清;每孔用100 μL甲醇(含3% H2O2)于37 ℃固定细胞10 min,弃除固定液;每孔用200 μL含5%脱脂乳的磷酸盐吐温缓冲液(PBST)于常温下封闭1 h,弃除封闭液;每孔加入1∶200稀释抗PRRSV的猪阳性血清100 μL,于37 ℃孵育30 min;用PBST洗板3次,每孔加入1∶500稀释的羊抗猪IgG-HRP 100 μL,于37 ℃孵育30 min,PBST洗板3次;最后加入AEC底物显色5 min,用蒸馏水终止显色,在倒置光学显微镜下观察感染PRRSV病毒的Marc-145细胞的染色情况。观察顺序为从较多染色孔开始观察到最少染色孔,即从高浓度病毒感染孔到低浓病毒感染度孔,并将最后2个孔细胞染色数量≤10的病毒平均稀释度倒数作为各时间点PRRSV病毒上清的IPMA效价。
1.6 IPMA反应板的制备
根据1.5的结果,选用每孔能够感染约100个细胞的PRRSV病毒稀释度(用于IPMA的PRRSV病毒效价的前一个稀释度)接种96孔细胞培养板培养的单层Marc-145细胞来制备IPMA反应板,其中保留2个孔(G12和H12)不接种病毒,将其设为对照,置于37 ℃、5% CO2的培养箱中孵育12 h后弃除培养上清,然后用甲醇固定细胞10 min后弃除固定液,每孔再用200 μL含5%脱脂乳的PBST于常温下封闭1 h,备用。
1.7 IPMA法筛选PRRSV单克隆抗体
融合后的杂交瘤细胞培养10 d后开始筛选。将96孔细胞培养板中的培养上清以每孔100 μL转移至制备好的IPMA反应板中,并设置阳性试验孔和阴性对照孔,在孔E12和G12中加入1∶600稀释的PRRSV免疫鼠阳性血清(或1∶200稀释的猪PRRSV阳性血清),在孔F12和H12中加入1∶600稀释的PRRSV阴性鼠血清,于37 ℃孵育30 min后用PBST洗板3次,再于每孔加入1∶500稀释的羊抗鼠IgG-HRP(或1∶500稀释的羊抗猪IgG-HRP)100 μL,于37 ℃孵育30 min后用PBST洗板3次,最后加入AEC底物显色5 min,蒸馏水终止显色,最后显微镜下分析染色。显微镜下首先观察设置的试验对照孔,然后扫描分析每个检测孔,根据感染细胞的特异性染色判定单克隆抗体。
1.8 PRRSV单克隆抗体的稳定性试验
将PRRSV单克隆抗体阳性孔的培养基更换为新鲜培养基,取培养24,48,72 h时的培养基上清,重复筛选试验。
1.9 PRRSV单克隆抗体的交叉反应试验
将5×104 个/mL的CRL-2843-CD163细胞、PK-15细胞和Vero细胞悬液分别铺至96孔细胞培养板。PRRSV的HN07-1和BJ-4毒株分别接种于CRL-2843-CD163细胞,CSFV、PRV分别接种于PK-15细胞,PEDV接种于Vero细胞,每种病毒量为每孔能感染100个细胞左右,留未感染的正常细胞为对照。检测抗体上清(一抗),以各对应病毒株的猪阳性血清或特异性单克隆抗体为一抗阳性对照,二抗为山羊抗鼠IgG-HRP和山羊抗猪IgG-HRP,最后加入AEC底物显色。
1.10 PRRSV的HN07-1毒株单克隆抗体免疫印迹试验
将经Sepharose 4 Fast Flow提纯的PRRSV(HN07-1毒株)进行SDS-PAGE电泳后,进行蛋白质免疫印迹(Western Blotting)试验。
1.11 单克隆抗体与PRRSV重组N蛋白ELISA试验
用得到的10 μg/mL重组N蛋白(试验)和pET28a质粒转化细菌蛋白(对照)包被ELISA板,试验孔和对照孔分别用猪PRRSV阳性血清和猪PRRSV阴性血清,二抗为山羊抗鼠IgG-HRP和山羊抗猪IgG-HRP,最后加入TMB进行底物显色。
2 结果与分析
2.1 不同PRRSV感染时间Marc-145细胞的状态和上清中的病毒增殖效价
PRRSV感染Marc-145细胞12 h时,Marc-145细胞状态仍然处于最佳时期,PRRSV尚在胞浆中进行复制,IPMA效价检测结果表明,此时PRRSV尚没有释放至培养基中,是进行IPMA试验的最佳时间。但随着感染时间延长,PRRSV快速分裂繁殖,出现细胞融合病变(CPE)使Marc-145细胞死亡脱落离壁(表1)。
表1 不同PRRSV感染时间对Marc-145细胞状态的影响
Tab.1 The effect of PRRSV infection time on Marc-145 cell culture
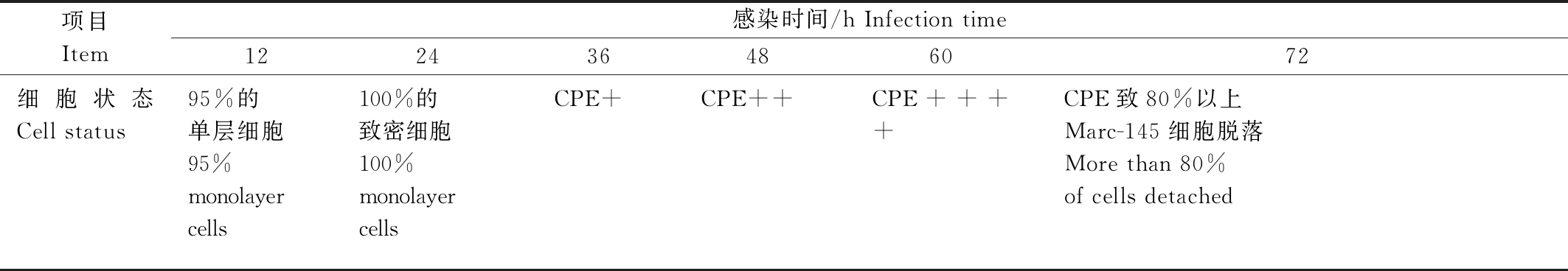
项目Item感染时间/h Infection time12243648 6072细胞状态Cell status95%的单层细胞95%monolayer cells100%的致密细胞100%monolayer cells CPE+CPE++CPE++++CPE致80%以上Marc-145细胞脱落More than 80%of cells detached
不同时间段收集的PRRSV感染Marc-145细胞的培养上清做10倍递增稀释接种细胞发现,细胞染色孔数量与IPMA效价成正相关。将PRRSV感染12 h时收集的Marc-145细胞的培养上清进行10倍稀释接种细胞后发现,没有细胞染色,无IPMA效价。当PRRSV感染24,36,48 h时,Marc-145细胞培养上清中病毒效价较高。当PRRSV感染60 h和72 h时,随着Marc-145细胞受损严重(CPE++++),病毒效价开始明显下降(图1)。因此,筛选PRRSV单克隆抗体制备IPMA板时应选用PRRSV感染24~48 h的Marc-145细胞培养上清,病毒接种量为效价的前一个稀释度。
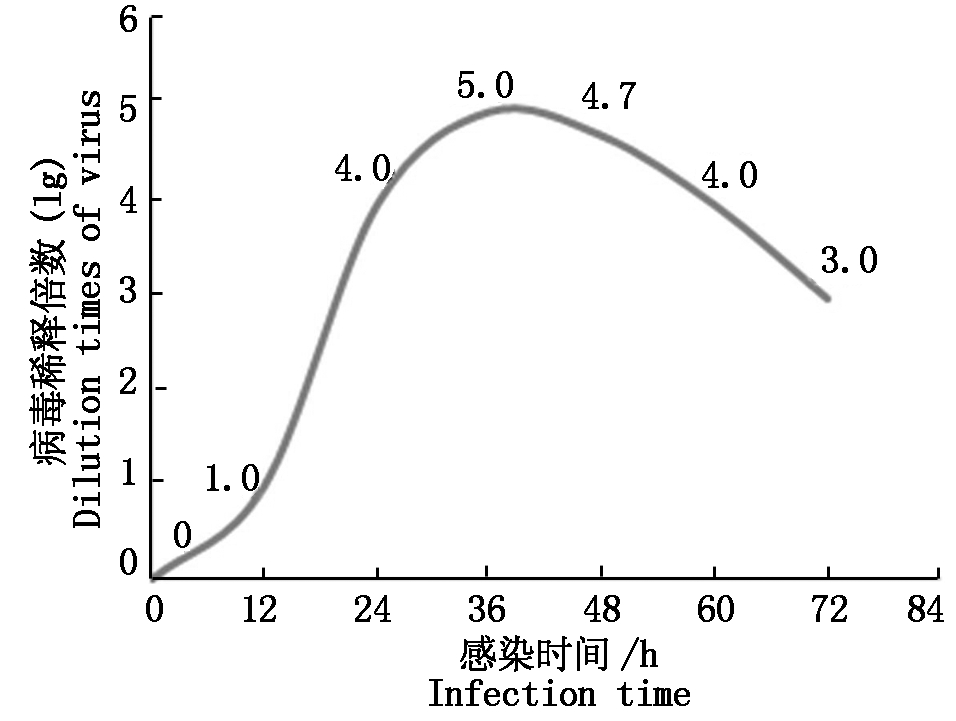
图1 不同PRRSV感染时间上清中病毒的IPMA效价(lg)
Fig.1 The IPMA titers of PRRSV culture supernatant in different infected time
2.2 IPMA的筛选时间、反应条件和PRRSV单克隆抗体染色的鉴别判定及处理依据
以96孔细胞培养板中杂交瘤细胞融合后的10 d时检测培养上清最佳,此时高敏感性单克隆抗体(仅占孔底面积1/20)即可被检出。从显微镜中观察IPMA染色,判定筛选的单克隆抗体结果:首先观察所设的试验对照孔(PRRSV抗体阳性及阴性血清孔)染色,试验的阳性孔的细胞胞浆被染色,多抗常伴有非特异着染(图2-A-B),试验的阴性孔的细胞未被染色(图2-C),阳性和阴性血清显色结果正确说明试验可靠。然后观察检测孔的染色,检测孔中有100个左右的细胞胞浆清晰染色(无任何其他背景着染),判定为细胞上清分泌PRRSV特异性单克隆抗体(图2-D),要格外注意筛到的分泌特异性单抗的细胞,注意培养和冻存,避免污染而检测孔中无细胞染色或细胞普遍染色的是无抗体分泌和非特异性抗体反应(图2-D-F),可弃之。
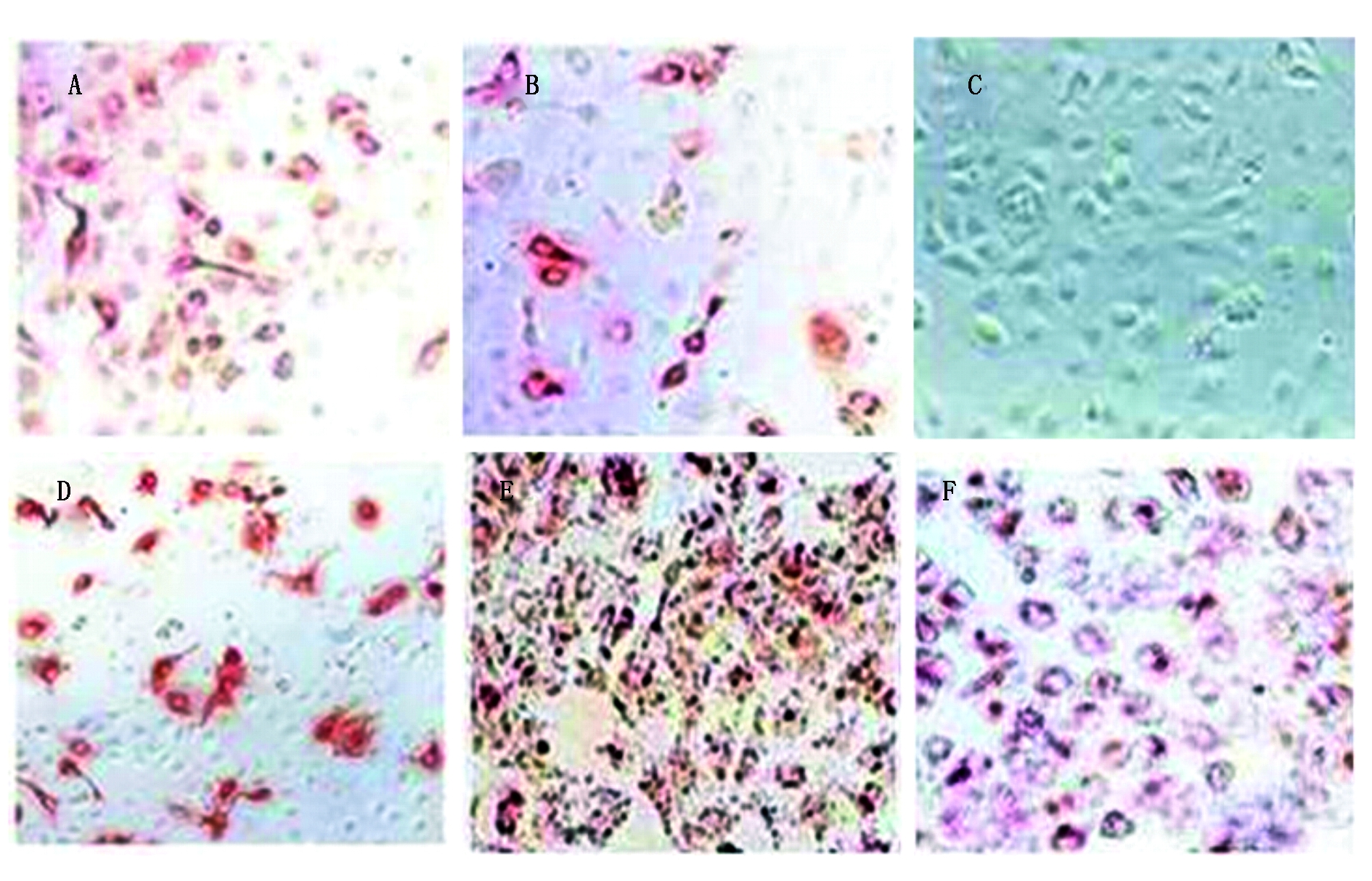
A.PRRSV免疫小鼠的阳性血清;B.猪PRRSV阳性血清;C.PRRSV阴性鼠血清;D.PRRSV特异性单克隆抗体;E-F.非特异性Abs。
A.Serum of PRRSV immunized mice; B.Porcine PRRSV positive serum; C.PRRSV negative mouse serum; D.PRRSV specific mAb; E-F.Nonspecific Abs.
图2 IPMA细胞染色
Fig.2 IPMA cell staining
2.3 PRRSV单克隆抗体稳定性和特异性
将PRRSV单克隆抗体孔的培养基更换为新鲜培养基继续培养24,48,72 h后,再收集细胞培养上清进行重复试验发现反应稳定。将筛选到的含有PRRSV单克隆抗体(39份)的上清分别与CSFV、PRV、PEDV感染细胞进行IMPA检测发现,所有单克隆抗体仅和PRRSV感染的CRL-2843-CD163细胞产生染色反应,与其他病毒株的感染无交叉反应(表2),表明筛选的PRRSV单克隆抗体特异性良好。
2.4 PRRSV单克隆抗体的Western Blotting结果
通过Western Blotting对筛选的PRRSV单克隆抗体进行鉴定发现,39份PRRSV单克隆抗体中有26份能与PRRSV的HN07-1毒株的N蛋白条带产生良好显色,如单抗1D1(图3)。
表2 IPMA交叉反应试验结果
Tab.2 The cross reactivity of the IPAM assay
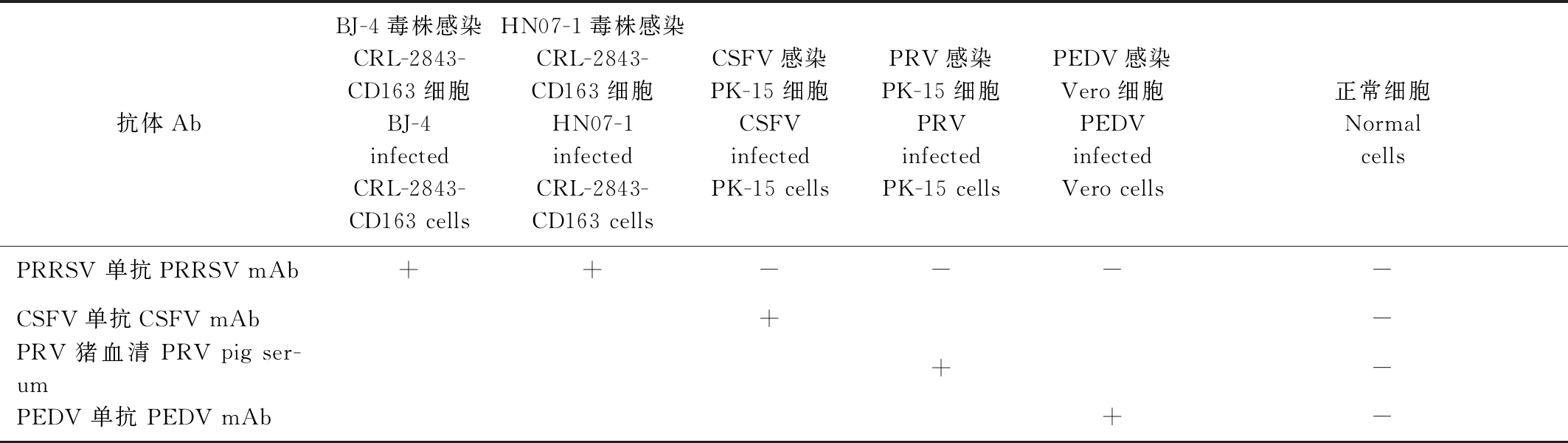
抗体AbBJ-4毒株感染CRL-2843-CD163细胞BJ-4infected CRL-2843-CD163 cellsHN07-1毒株感染CRL-2843-CD163细胞 HN07-1infectedCRL-2843-CD163 cellsCSFV感染PK-15细胞CSFVinfected PK-15 cellsPRV感染PK-15细胞PRVinfected PK-15 cellsPEDV感染Vero细胞PEDVinfected Vero cells正常细胞Normal cellsPRRSV 单抗PRRSV mAb ++----CSFV单抗CSFV mAb+-PRV 猪血清 PRV pig ser-um+-PEDV 单抗 PEDV mAb+-
注:+.感染细胞染色;-.无细胞染色。
Note:+.Staining;-.No staining.
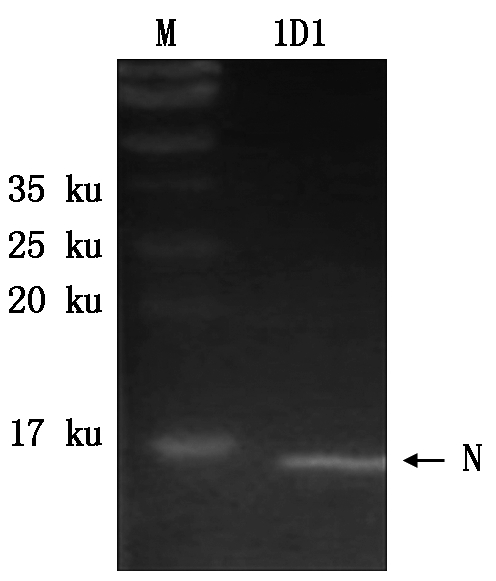
图3 PRRSV单克隆抗体1D1的Western Blotting
Fig.3 Western Blotting result with PRRSV mAb 1D1
2.5 PRRSV单克隆抗体与重组N蛋白的ELISA结果
利用大肠杆菌表达系统所制备的重组N蛋白包被ELISA板后对PRRSV单克隆抗体进行分析发现,1D1、7G8等27份单克隆抗体能与重组N蛋白产生良好反应,OD值在0.981~1.329(表3);6E7、7F12等15份单克隆抗体不能与重组N蛋白发生反应,OD值在0.043~0.050(表3)。
表3 PRRSV单克隆抗体与重组N蛋白包被的ELISA结果(OD450)
Tab.3 The reactivity of the mAbs with PRRSV N protein by ELISA(OD450)
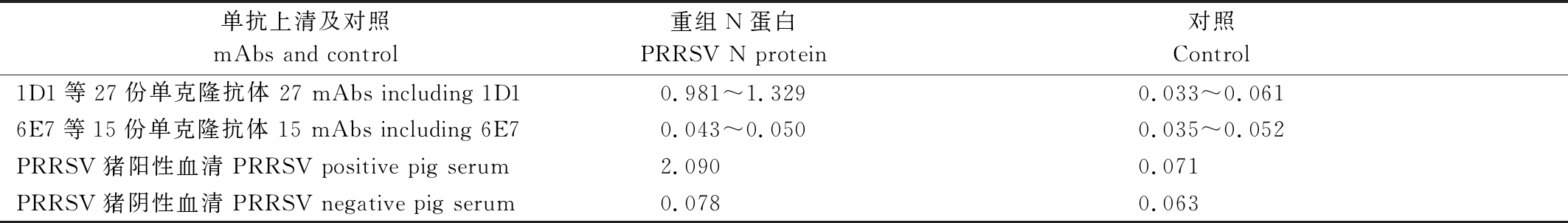
单抗上清及对照mAbs and control重组N蛋白PRRSV N protein对照Control1D1等27份单克隆抗体 27 mAbs including 1D10.981~1.3290.033~0.0616E7等15份单克隆抗体 15 mAbs including 6E70.043~0.0500.035~0.052PRRSV猪阳性血清 PRRSV positive pig serum2.0900.071PRRSV猪阴性血清 PRRSV negative pig serum0.0780.063
3 结论与讨论
细胞成功融合后,杂交瘤细胞样品数量巨大(108个B细胞和5×107个骨髓瘤细胞融合后分散在10~40块96孔细胞培养板中培养,共有960~3 840个样品),因此建立快速准确的高通量筛选方法是制备PRRSV单克隆抗体的关键。此前,国内外学者曾经采用ELISA方法筛选鉴定单抗[28-29]。前期研究中也曾多次使用同样的方法进行病毒包被建立ELISA方法并用于PRRSV单克隆抗体的筛选,尽管病毒纯化、小鼠免疫和细胞融合过程均取得成功,但难以筛选出敏感性高、特异性强的PRRSV单克隆抗体。分析原因可能是由于聚苯乙烯96孔板不能牢固吸附完整的颗粒病毒,在反应过程中多次洗涤会造成病毒颗粒脱落,从而导致PRRSV单克隆抗体筛选的失败。用IPMA方法筛选PRRSV单克隆抗体时,PRRSV病毒可通过感染细胞进行增殖并被固定在96孔细胞培养板上从而直接捕获PRRSV单克隆抗体,所获得的PRRSV单克隆抗体具有高度特异性。Yoon等[30]和Liang等[31]的报道中,对病毒的单克隆抗体进行筛选的试验中IPMA比ELISA的免疫反应更敏感、准确,这与本研究的结果一致。
应用IPMA法筛选抗病毒的单克隆抗体时特别要注意做好以下几点:①细胞单层,接种病毒时用覆盖度为80%~85%对数生长期的单层细胞,以利于病毒的快速分裂和繁殖,感染的单层细胞在培养12~15 h时状态最好,此时固定并进行后续试验,染色后的结果最佳;②定量接种病毒,以每孔能够感染100个细胞的PRRSV病毒量最佳,若接种的病毒过多,细胞感染率过高或全部感染均不易区分,而病毒接种太少则容易漏筛;③细胞固定时间,当病毒感染细胞后,一定时间内病毒于胞浆进行复制,选择病毒未大量释放胞外前的时间进行细胞固定,例如对于PRRSV的HN07-1毒株来说,于感染细胞12~15 h时对细胞进行固定最佳;④选择适当的细胞固定剂,合适的细胞固定剂能够让细胞更具通透性,有利于抗体与病毒的接触;⑤单克隆抗体开始筛选的时间,当杂交瘤细胞融合后继续生长10 d左右,此时杂交瘤细胞的覆盖度达到16.7%以上,开始进行筛检最佳;⑥筛选对照的设置,试验中应设置抗体的阳性对照和阴性对照,对已筛出的单克隆抗体进行重复IPMA筛选时还应设置正常细胞对照。
本研究将定量感染复制在Marc-145细胞内的PRRSV固定在含有单层细胞的96孔IPMA板上,从而精准筛选出融合后的杂交瘤细胞所分泌的抗PRRSV单克隆抗体,39份含有PRRSV单克隆抗体的上清经过交叉反应试验、Western Blotting和重组N蛋白的ELISA试验后,证实所筛选到的PRRSV单克隆抗体具备高度特异性和敏感性。本研究所得的IPMA法既适用于PRRSV单克隆抗体制备中的样品初筛和鉴定,也适用于对PRRSV单克隆抗体的特异性鉴定。
[1] Whitworth K M,Rowland R R,Ewen C L,Trible B R,Kerrigan M A,Cino-Ozuna A G,Samuel M S,Lightner J E,McLaren D G,Mileham A J,Wells K D,Prather R S .Gene-edited pigs are protected from Porcine reproductive and respiratory syndrome virus[J].Nat Biotechnol,2016,34(1):20-22.doi:10.1038/nbt.3434.
[2] Collins J E,Benfield D A,Christianson W T,Harris L,Hennings J C,Shaw D P,Goyal S M,McCullough S,Morrison R B,Joo H S,et al.Isolation of Swine infertility and respiratory syndrome virus(isolate ATCC VR-2332)in North America and experimental reproduction of the disease in gnotobiotic pigs[J].J Vet Diagn Invest,1992,4(2):117.doi:10.1177/104063879200400201.
[3] Stevenson G W,Alstine W G V,Kanitz C L.Characterization of infection with endemic Porcine reproductive and respiratory syndrome virus in a swine herd[J].Journal of the American Veterinary Medical Association,1994,204(12):1938-1942.
[4] 郭敏,郎广平,冯娇,李彬,付云云,单悦,赵建增,高英杰.猪繁殖与呼吸综合征的研究进展[J].中国畜牧兽医,2013,40(4):211-215.
Guo M,Lang G P,Feng J,Li B,Fu Y Y,Shan Y,Zhao J Z,Gao Y J.Research progress in porcine reproductive and respiratory syndrome[J].China Animal Husbandry and Veterinary Medicine,2013,40(4):211-215.
[5] Benfield D A,Nelson E,Collins J E,Harris L,Goyal S M,Robison D,Christianson W T,Morrison R B,Gorcyca D,Chladek D.Characterization of Swine infertility andrespiratory syndrome(SIRS)virus(isolate ATCC VR-2332)[J].J Vet Diagn Invest,1992,4(2):127-133.doi:10.1177/104063879200400202.
[6] 郭宝清,陈章水,刘文兴,崔益沫.从疑似PRRS流产胎儿分离 PRRSV的研究[J].中国畜禽传染病,1996,2:1-4.
Guo B Q,Chen Z S,Liu W X,Cui Y M.Separation of PRRSV from fetus with suspected PRRS abortion[J].Chinese Livestock and Infectious Diseases,1996,2:1-4.
[7] 郭振华,陈鑫鑫,李睿,乔松林,郭军庆,张改平.我国猪繁殖与呼吸综合征病毒流行历史及现状[J].畜牧兽医学报,2018,49(1):1-9.doi:10.11843/j.issn.0366-6964.2018.01.001.
Guo Z H,Chen X X,Li R,Qiao S L,Guo J Q,Zhang G P.The prevalence history and current status of porcine reproductive and respirotory syndrome in China[J].Acta Veterinaria et Zootechnica Sinica,2018,49(1):1-9.
[8] 代军,雷蕾,任志华.猪繁殖与呼吸综合征防控研究进展[J].动物医学进展,2014,35(4):97-101. doi:10.16437/j.cnki.1007-5038.2014.04.022.
Dai J,Lei L,Ren Z H.Advances in research on prevention and control of porcine reproductive and respiratory syndrome[J].Progress in Veterinary Medicine,2014,35(4):97-101.
[9] Chaikhumwang P,Tantituvanont A,Tripipat T,Tipsombatboon P,Piriyapongsa J,Nilubol D .Dynamics and evolution of highly Porcine reproductive and respiratory syndrome virus following its introduction into a herd concurrently infected with both types 1 and 2[J].Infect Genet Evol,2015,30:164-174.doi:10.1016/j.meegid.2014.12.025.
[10] 杨汉春,周磊.猪繁殖与呼吸综合征病毒的遗传变异与演化[J].生命科学,2016,28(3):325-336.doi:10.13376/j.cbls/2016041.
Yang H C,Zhou L.Genetic variation and evolution of Porcine reproductive and respiratory syndrome virus[J].Chinese Bulletin of Life Sciences,2016,28(3):325-336.
[11] Yang L,Yoon K J,LI Y,Lee J H,Zimmerman J J,Frey M L,Harmon K M,Platt K B .Antigenic and genetic variations of the 15 kD nucleocapsid protein of Porcine reproductive and respiratory syndrome virus isolates[J].Arch Virol,1999,144:525-546.
[12] Meulenberg J J,Petersen-Den Besten A,De Kiuyer E P,Moormann R J,Schaaper W M,Wensvoort G .Characterization of proteins encoded by ORFs 2 to 7 of Lelystad virus[J].Virology,1995,206:155-163.
[13] Wu W H,Fang Y,Farwell R,Christopher-Hennings J,Nelson E A.A 10-kDa structural protein of Porcine reproductive and respiratory syndrome virus encoded by ORF2b[J].Virology,2001,287:183-191.doi:10.1006/viro.2001.1034.
[14] Dea S,Gagnon C A,Mardassi H,Pirzadeh B,Rogan D.Current knowledge on the structural proteins of porcine reproductive and respiratory syndrome(PRRS)virus:comparison of the North American and European Isolates[J].Arch Virol,2000,145(4):659-688.
[15] Guo Z,Chen X X,Li R,Qiao S,Zhang G .The prevalent status and genetic diversity of Porcine reproductive and respiratory syndrome virus in China:A molecular epidemiological perspective[J].Virol J,2018,15:2.doi:10.1186/s12985-017-0910-6.
[16] Wang F X,Yang Y,Liu X,He M H,Liu Y,Sun N,Zhu H W,Ren J Q,Wu H,Wen Y J.Development of a monoclonal antibody for differentiating Porcine reproductive and respiratory syndrome virus and identification of a novel non-structural protein 2 epitope peptide[J].Virus Disease,2017,28(4):408-415.doi:10.1007/s13337-017-0400-x.
[17] Plagemann P G.Epitope specificity of monoclonal antibodies to the N-protein of Porcine reproductive and respiratory syndrome virus determined by ELISA with synthetic peptides[J].Vet Immunol Immunopathol,2005,104(1/2):59-68.doi:10.1016/j.vetimm.2004.10.004.
[18] 胡美茹,孙英勋,董家新,于鸣,舒翠玲.间接ELISA法用于细胞抗原特异的单克隆抗体筛选[J].细胞与分子免疫学杂志,1998,14(3):212-216.doi:10.13423/j.cnki.cjcmi.002191.
Hu M R,Sun Y X,Dong J X,Yu M,Shu C L.Indirect ELISA for cell-antigen-specific monoclonal antibody screening[J].J Cell Mol Immunol,1998,14(3):212-216.
[19] 王刚,张鹤晓,甘孟侯,张玉忠,王彩兰,崔向东,苏世敏,张兆平,姜永庄.IPMA检测猪生殖和呼吸综合征病毒抗体的研究[J].中国兽医杂志,1996,22(12):3-5.
Wang G,Zhang H X,Gan M H,Zhang Y Z,Wang C L,Cui X D,Su S M,Zhang Z P,Jiang Y Z.Studies on the detection of antibodies to Porcine reproductive and respiratory syndrome virus using immunoperoxidase monolayer assay[J].China Veterinary Medicine,1996,22(12):3-5.
[20] Drew T W.Comparative serology of porcine reproductive and respiratory syndrome in eight European laboratories,using immunoperoxidase monolayer assay and enzyme-linked immunosorbent assay[J].Rev Sci Tech,1995,14(3):761-775.
[21] Deregt D,Prins S.A monoclonal antibody-based immunoperoxidase monolayer(micro-isolation)assay for detection of type 1 and type 2 bovine viral diarrhea viruses[J].Can J Vet Res,1998,62(2):152-155.
[22] Ooms K,Van G H,Botti S,Van Gaever T,Delputte P L,Nauwynck H J.Evaluation of viral peptide targeting to porcine sialoadhesin using a Porcine reproductive and respiratory syndrome virus vaccination-challenge model[J].Virus Res,2013,177(2):147-155.doi:10.1016/j.virusres.2013.07.019.
[23] Trus I,Bonckaert C,Vander M K,Nauwynck H J.Efficacy of an attenuated European subtype 1 Porcine reproductive and respiratory syndrome virus(PRRSV)vaccine in pigs upon challenge with the East European subtype 3 PRRSV strain Lena[J].Vaccine,2014,32(25):2995-3003.doi:10.1016/j.vaccine.2014.03.077.
[24] Huang L P,Lu Y H,Wei Y W,Guo L J,Liu C M.Identification of one critical amino acid that determines a conformational neutralizing epitope in the capsid protein of porcine circovirus type2[J].BMC Microbiol,2011,11:188.
[25] 唐娜,王金良,张春玲,董林,祖立闯,曲光刚,谢金文,张松林,柳增善,沈志强.猪繁殖与呼吸综合征病毒单克隆抗体的制备及鉴定[J].动物医学进展,2013,34(11):27-31.doi:10.16437/j.cnki.1007-5038.2013.11.018.
Tang N,Wang J L,Zhang C L,Dong L,Zu L C,Qu G G,Xie J W,Zhang S L,Liu Z S,Shen Z Q.Development and identification of monoclonal antibodies against Porcine reproductive and respiratory syndrome virus[J].Progress in Veterinary Medicine,2013,34(11):27-31.
[26] Pileri E,Cortey M,Rodriguez F,Sibila M,Fraile L,Segalés J.Comparison of the immunoperoxidase monolayer assay and three commercial ELISAs for detection of antibodies against porcine circovirus type2[J].Vet J,2014,201(3):429-432.doi:10.1016/j.tvjl.2014.05.025.
[27] 李青梅,王丽,冯丽丽,张雨杭,赵东,杨艳艳,邢广旭,柴书军,李赛赛,张丽萍,郭军庆,张改平.鸡新城疫病毒中和单克隆抗体的制备及鉴定[J].河南农业科学,2017,46(1):127-131.doi:10.15933/j.cnki.1004-3268.2017.01.023.
Li Q M,Wang L,Feng L L,Zhang Y H,Zhao D,Yang Y Y,Xing G X,Chai S J,Li S S,Zhang L P,Gui J Q,Zhang G P.Production and characterization of neutralizing monoclonal antibodies against Newcastle disease virus[J].Journal of Henan Agricultural Sciences,2017,46(1):127-131.
[28] Wensvoort G,Terpstra C,Boonstra J,Bloemraad M,Van Z D.Production of monoclonal antibodies against Swine fever virus and their use in laboratory diagnosis[J].Vet Microbiol,1986,12(2):101-108.
[29] 徐璇,董静,白娟,王先炜,姜平.两株抗猪伪狂犬病毒的单克隆抗体制备与鉴定[J].畜牧与兽医,2017,49(5):118-120.
Xu X,Dong J,Bai J,Wang X W,Jiang P.Preparation and characterization of two monoclonal antibodies against Pseudorabies virus[J].Animal Husbandry & Veterinary Medicine,2017,49(5):118-120.
[30] Yoon K J,Zimmerman J J,Swenson S L,Mcginley M J,Eernisse K A,Brevik A,Rhinehart L L,Frey M L,Hill H T,Platt K B.Characterization of the humoral immune response to Porcine reproductive and respiratory syndrome(PRRS)virus infection[J].J Vet Diagn Invest,1995,7(3):305-312.
[31] Liang H,Wang H,Zhang L,Gu H,Zhang G.Development of a novel immunoperoxidase monolayer assay for detection of Swine Hepatitis E virus antibodies based on stable cell lines expressing the ORF3 protein[J].Acta Vet Hung,2014,62(2):243-256.doi:10.1556/AVet.2013.051.