向日葵锈病(Puccinia helianthi Schw)是向日葵重要病害之一,严重危害向日葵的品质及含油量。向日葵锈菌是一种单性寄生菌,属于担子菌门(Basidiomycota)冬孢子纲(Teliomycetes)锈菌目(Uredinales)柄锈菌属(Puccinia),是一种具有性孢子、锈孢子、夏孢子、冬孢子、担孢子5种不同孢子的真菌[1]。锈菌侵染向日葵后,形成大量的孢子堆,降低向日葵叶片光合作用和蒸腾作用,导致向日葵营养及水分缺失过多过早枯死[2]。近10年来随着我国向日葵种植面积不断增加,向日葵锈病的发生逐年加重,给向日葵生产带来的危害也日益严重[3]。
随着现代分子生物学及分子植物病理学的快速发展,人们对病原菌与寄主的互作机制的认识日益完善。致病真菌通过分泌胞外酶来降解寄主结构性屏障是其常用的策略[4-6]。例如,引起肺部病害的一种曲霉病是宿主通过吸入曲霉菌引起肺部屏障组织蛋白破坏,曲霉菌主要破坏肺部的免疫活性物质,通过分解细胞组织达到致病效果[7],曲霉菌(引起曲霉菌病)中的酶可以作为治疗该病的靶标。肺部蛋白有30%是弹性蛋白,弹性蛋白酶被认为在真菌侵染过程中发挥着重要作用[8]。金属弹性分泌蛋白酶是水解酶类的一种,对丙氨酸、甘氨酸、异亮氨酸、亮氨酸或缬氨酸等含羧基的多肽键起催化水解的作用,是活性中心依赖于金属离子的一类蛋白酶[9]。金属蛋白酶(Metalloproteinase)和弹性丝氨酸蛋白酶(Elastinolytic serine proteinase)在烟曲霉(Aspergillus fumigatus)及黄曲霉(Aspergillus flavus)均有发现,它们是引起曲霉病的2个重要发病因子[6,8,10-15]。并且已有证据表明,弹性蛋白酶是关键的毒力因子,丝氨酸蛋白酶基因丧失的烟曲霉突变体仍然具有毒性,可能是存在其他的一些蛋白酶起到补偿作用。1994年Markaryan等[8]从烟曲霉中纯化得到一个弹性金属蛋白酶,并证明金属蛋白酶并不能水解弹性蛋白。 向日葵锈菌是一类主要侵染向日葵叶片的真菌,向日葵锈菌可以分泌多种胞外蛋白酶发挥其致病作用[15],此菌中的弹性金属蛋白酶分泌到胞外可能与寄主互作来破坏向日葵叶片细胞壁中的蛋白质,从而利于其进一步侵染,进而达到致病效果。本试验对向日葵锈菌转录组数据中一个高表达的基因(推断其编码弹性金属蛋白酶)进行引物设计,对其基因进行分子克隆,通过生物信息学对其成熟蛋白基因序列分析,推断蛋白功能。
1 材料和方法
1.1 序列的生物信息学分析
1.1.1 蛋白序列及特征性分析 应用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)对转录组测序获得的蛋白序列进行开放阅读框的分析;利用Interpro对蛋白ORF区域进行分析确定序列成熟区域;蛋白质的功能区由PROSITE tools(http://au.expasy.org/prosite/)预测;Compute pI/Mw tool(http://us.expasy.org/tools/pi_tool.html)分析蛋白质的等电点以及分子量。
1.1.2 蛋白疏水性、跨膜区、信号肽、GPI锚定位点及亚细胞定位分析 通过ProtScale tool(http://www.expasy.org/cgi-bin/protscale.pl)预测蛋白酶的疏水性;应用 TMpred(http://www.ch.embnet.org/software/TMPRED_form.html)对其进行跨膜区分析;big-PI predictor(http://mendel.imp.ac.at/gpi/fungi_server.html)软件用于鉴定蛋白质的GPI锚定位点;应用 SignalP4.1Server(http://www.cbs.dtu.dk/services/SignalP/)进行蛋白质的信号肽分析;利用在线软件TargetP 1.1(http://www.cbs.dtu.dk/services/SignalP/)确定蛋白酶在细胞的定位。
1.1.3 蛋白二三级结构与结构域 蛋白的二级结构通过SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.plpage=npsa_sopma.html)在线工具分析;通过 SWISS-MODEL(https://www.swissmodel.expasy.org/)对其成熟区域的三级结构进行同源建模;使用Blast(http://www.ebi.ac.uk/interpro/)搜索蛋白酶的相似家族[16-17]。
1.2 试验试剂
TIANGEN 植物总RNA提取试剂盒(PD432)、琼脂糖凝胶DNA回收试剂盒(PD209-02)及质粒小提试剂盒(PD103-02)、大肠杆菌DH5α感受态细胞、2 000,15 000 bp DNA Ladder及T4 DNA 连接酶(RT406)购自天根生化科技(北京)有限公司;质粒pET28a由内蒙古农业大学昆虫研究实验室馈赠;GoScriptTM Reverse Transcription System购自普洛麦格(北京)生物技术有限公司;ToPo pBoLn-TA Easy克隆试剂盒购自北京博凌科为生物科技有限公司;限制性内切酶购自赛默飞世尔科技有限公司;其他试剂均为分析纯,购自天津市英博生化世纪有限公司;引物及测序在华大基因科技股份有限公司合成及检测。
1.3 蛋白酶基因克隆
1.3.1 向日葵锈病菌RNA提取及cDNA合成 向日葵锈菌为专性寄生菌,利用感病向日葵品种扩繁锈菌得到新鲜夏孢子,对夏孢子进行RNA提取。依据TIANGEN RNA prep Pure 植物总 RNA 提取试剂盒(PD432)说明进行。用1%的琼脂糖凝胶电泳检测提取总RNA的质量。参照GoScriptTM Reverse Transcription System(ADA5001)操作步骤反转录合成cDNA第1链,于-20 ℃保存备用。
1.3.2 蛋白酶基因片段扩增 以蛋白酶基因序列为模板,选取分泌蛋白酶成熟序列作为模板,利用Primer Premier 5.0 设计带有NdeⅠ及BglⅡ酶切位点的引物,上游引物Met-F:5′-TTTCATATGATGTCCTA
TCGCGTCTTTCCCTGGTCG-3′,下游引物Met-R:5′-GGAAGATCTTCAGTTCTCGCAAACACCTCTTGG-3′。下划线标出的碱基为酶切位点,前面3个碱基为保护碱基。以cDNA作为模板,利用引物进行序列扩增。PCR反应体系为25 μL,PCR反应程序:95 ℃预变性5 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸1 min,35个循环;最后72 ℃延伸10 min,4 ℃保存。
1.3.3 PCR产物纯化 依据TIANGEN普通琼脂糖凝胶DNA回收试剂盒(DP209-02)回收说明进行。
1.3.4 ToPo pBoLn-TA克隆载体构建及测序 将PCR胶回收产物连接到ToPo pBoLn-TA克隆载体上,连接体系为 10 μL,于室温20~30 ℃,参照ToPo pBoLn-TA Easy克隆试剂盒说明书进行(1715)。反应体系配制完成后,用移液枪轻轻捶打至混匀,避免气泡,室温连接10 min。将重组质粒转化到大肠杆菌DH5α感受态细胞中,于37 ℃过夜培养14 h,在LB(Amp+)培养基上筛选阳性克隆菌落。挑取单克隆菌落在LB(Amp+)液体培养基内进行摇菌14 h,利用特异性引物Met-F和Met-R进行菌液PCR鉴定(PCR反应程序同1.3.2),PCR反应结束后,取7 μL反应液电泳检测,通过凝胶电泳成像系统观察结果后,选取阳性克隆菌液交给华大基因科技股份有限公司测序,使用通用引物M13F及M13R进行测序,结果通过DNAMAN进行序列比对。对测序正确的重组质粒用限制性内切酶NdeⅠ和BglⅡ进行酶切验证,酶切体系参照Thermo Scientific FastDigest NdeⅠ及BglⅡ限制性内切酶说明书进行(FD0584及FD0084)。
1.3.5 pET28a原核表达载体的构建及测序 用插入酶切位点的引物以阳性克隆的菌液为模板进行PCR扩增、鉴定、胶回收纯化,步骤同1.3.2及1.3.3。按照TIANGEN质粒小提试剂盒(DP103-02)的步骤对带有pET28a的菌液进行空质粒的提取。将回收的目的基因片段和表达载体pET28a经Nde Ⅰ及BglⅡ在37 ℃下1 h进行双酶切,经1%琼脂糖凝胶电泳后回收凝胶片段,将回收的目的片段和回收的质粒载体片段在T4 DNA 连接酶作用下相连接,连接体系为10 μL,参照TIANGEN T4 DNA 连接酶(RT406)说明书进行。将连接产物转化到大肠杆菌DH5α感受态细胞中,于37 ℃ LB(Kan+)固体培养基过夜培养,利用特异性引物Met-F及Met-R对菌液进行PCR鉴定,运用TIANGEN质粒小提试剂盒将带有pET28a重组质粒进行质粒提取,通过酶切验证,选取菌悬液送到华大基因科技股份有限公司进行测序鉴定,结果通过DNAMAN进行序列比对。
2 结果与分析
2.1 蛋白酶基因序列筛选及特征性分析
从向日葵锈菌转录组中发现表达量较高的一个基因,对其序列进一步分析。利用ORF Finder 对蛋白酶整条序列进行分析,得到1条2 781 bp序列(图1),确定其为蛋白酶的ORF区域,进一步利用Interpro对整条蛋白酶序列ORF区域进行分析,结果表明,ORF区域序列前22个氨基酸为信号肽,中间23-482氨基酸为多余的氨基酸,483-928为整条ORF序列的成熟区域,共编码445个氨基酸。


斜体为信号肽;加粗部分为成熟区域。
Italics are signal peptides; bold parts are mature areas.
图1 蛋白酶ORF区域基因序列及成熟区域的氨基酸序列
Fig.1 The sequence of protease ORF region gene and its amino acid sequence of mature region
通过Compute pI/Mw tool预测蛋白酶成熟区域分子式为C2193H3279N631O667S13,分子质量为49.5 ku,理论等电点为5.7,脂肪系数为57.9,带负电的残基(Asp+Glu)总数为57,带正电的残基(Arg+Lys)总数为46。利用PROSITE tools对蛋白酶的成熟区进行分析,结果表明此蛋白为锌依赖性金属肽酶,并且锌离子选择性的非共价的同序列相结合,称为metzincins,同M1、M2、M3、M4、M5、M6、M7、M8、M9、M10A、M10B、M11、M12A、M12B、M13、M27、M30、M32、M34、M35、M36家族相似。
2.2 蛋白酶疏水性、跨膜区、信号肽、GPI锚定位点及亚细胞定位分析
运用ProtScale tool对蛋白酶疏水性进行分析表明,蛋白酶多肽链上精氨酸和赖氨酸为亲水性最强的2个氨基酸,其分数为-4.5,-3.9;多肽链上异亮氨酸和缬氨酸为疏水性最强的2个氨基酸,其分数为4.5,4.2。从整体来看,蛋白酶的亲水氨基酸多于疏水氨基酸,属于亲水蛋白(图2)。蛋白质跨膜区分析表明,蛋白酶1-445全部氨基酸位于细胞膜表面,确定其为非跨膜蛋白质(图3)。利用big-PI predictor确定蛋白酶的GPI锚定位点,确定其无GPI锚定位点。从NCBI数据库中检索与金属蛋白酶基因编码蛋白的氨基酸相似度较高的5条蛋白序列,这5条蛋白均属于肽酶M36家族。利用TargetP 1.1分析软件分析,表明蛋白酶并非叶绿体转运肽、线粒体靶向肽和分泌通路信号肽的一种,并进一步利用SignalP4.1Server确定蛋白信号肽,确定其含有N端信号肽,因此,此蛋白可能通过信号肽分泌到胞外。
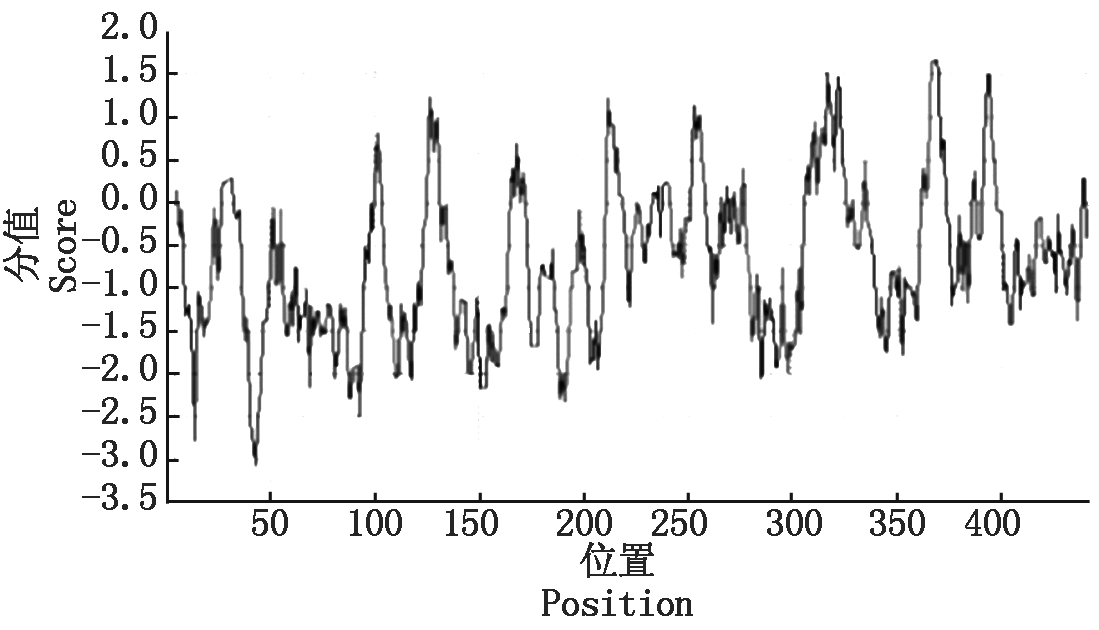
图2 蛋白酶亲水性
Fig.2 Hydrophilicity of protease
2.3 金属弹性分泌蛋白二三级结构与结构域预测
应用SOPMA软件分析金属弹性分泌蛋白酶的二级结构,其由22.3%的α-螺旋(Alpha helix)、16.0%的延伸链(Extended strand)、3.4%的β-转角(Beta turn)和58.4%的无规卷曲(Random coil)组成,其中α-螺旋和无规卷曲是蛋白酶中的主要结构原件,而β-转角和延伸链散步于整个蛋白中。通过SWISS-MODEL基于同源建模的方法检索PDB(Protein data bank)蛋白质结构数据库,发现同胞外金属蛋白酶(Extracellular metalloproteinase mep)基因序列相似度为53.77%(图4),以该蛋白晶体结构作为模板,构建了金属蛋白酶的三维结构模型(图5)。利用Blast搜索蛋白酶匹配家族,结果显示蛋白酶的1-419个氨基酸同真菌素M36的蛋白家族相似,235-432个氨基酸同CDT家族M1及M4相似。
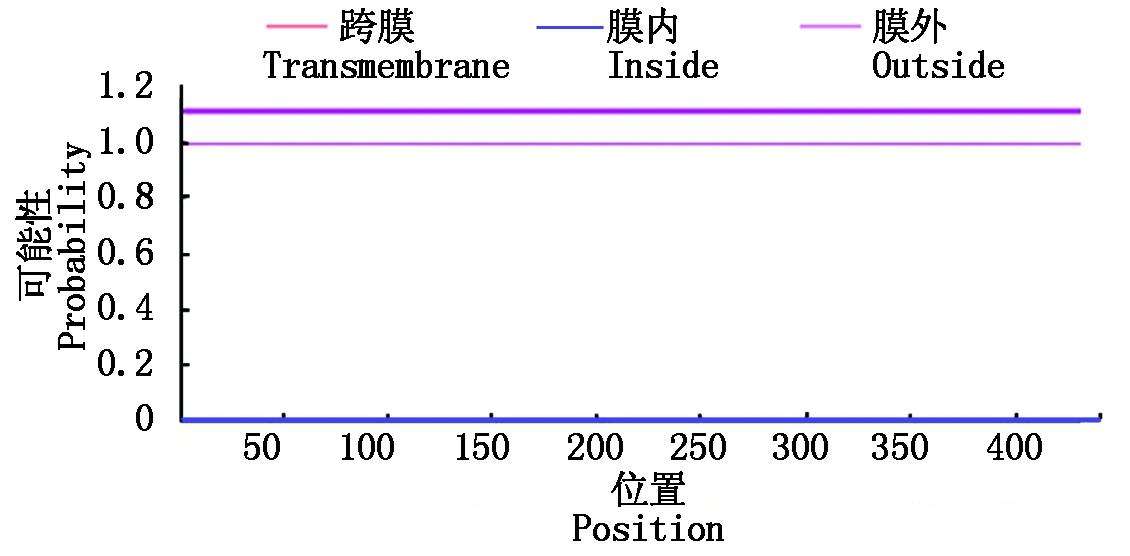
图3 蛋白酶的跨膜区
Fig.3 Transmembrane region of protease
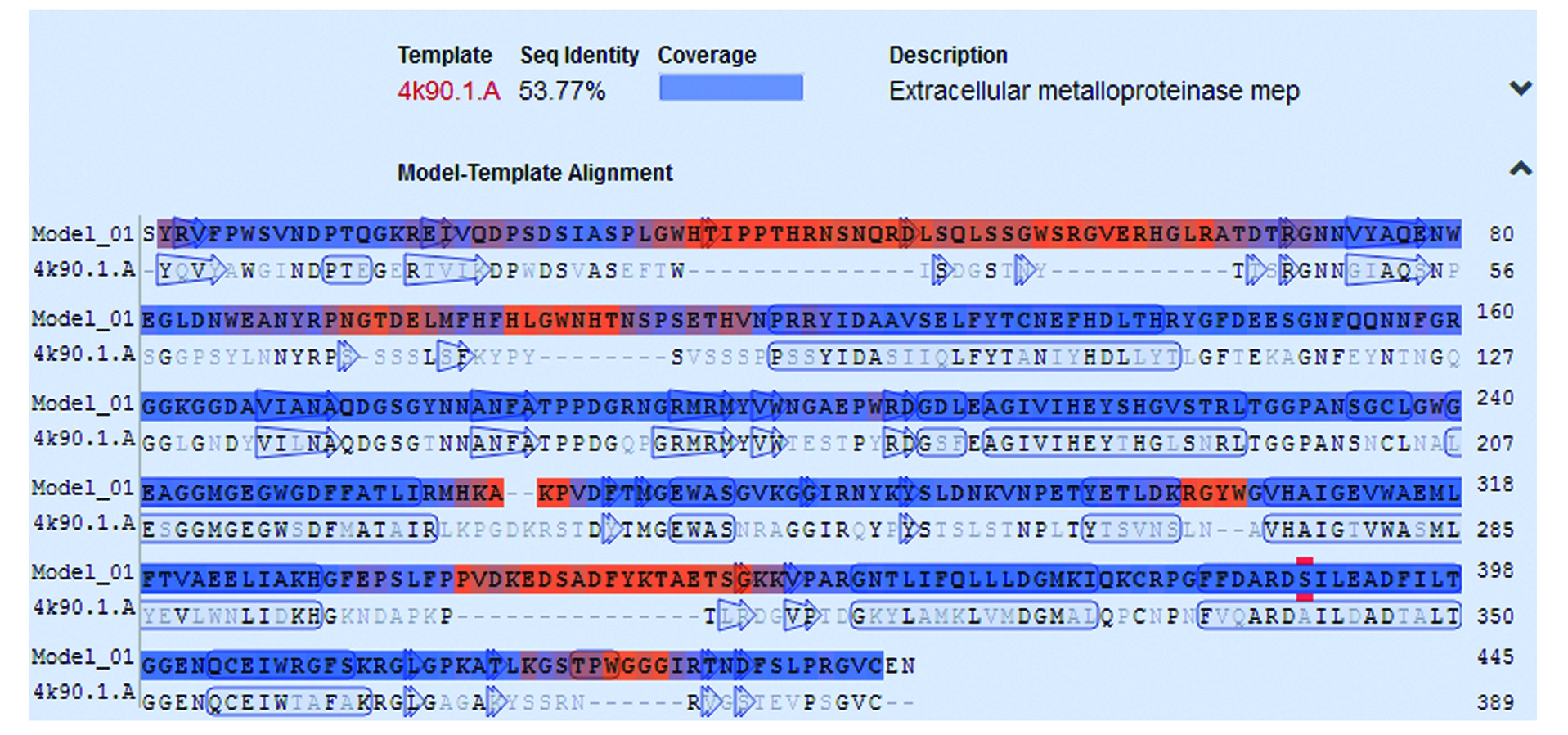
图4 蛋白酶同其他胞外金属蛋白酶相似度
Fig.4 The similarity of protease with an extracellular metalloproteinase
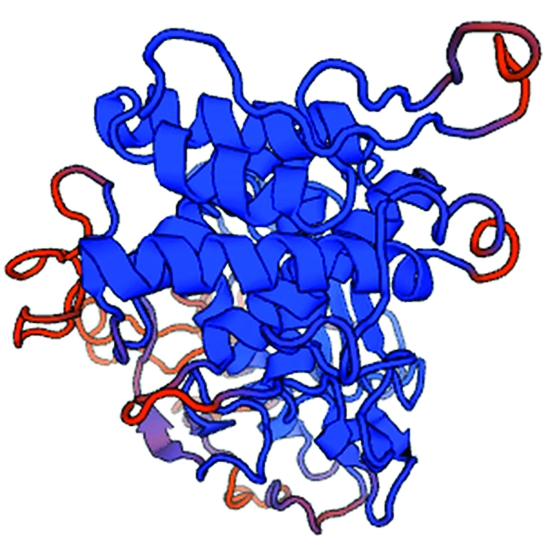
图5 基于同源建模预测的蛋白酶的三维结构模型
Fig.5 Three-dimensional structure model of protease predicted based on homology modeling
2.4 蛋白酶基因扩增及克隆载体构建
通过对向日葵锈菌总RNA的提取,经逆转录合成第1链cDNA,利用RT-PCR扩增技术对目标片段进行扩增,产物经1%的琼脂糖凝胶电泳鉴定,得到约为1 335 bp的条带(图6)。通过ToPo pBoLn-TA Easy试剂盒将目的基因导入克隆载体ToPo pBoLn-TA,涂板,挑选10个菌落进行摇菌,对菌悬液进行PCR鉴定,获得与预期结果相同的条带(图7),并挑选3个单克隆菌,在LB(Amp+)液体培养基中进行摇菌,选取3个菌悬液,送到华大基因科技股份有限公司进行测序检测,通过DNAMAN比对,序列相似率达到99.1%。以测序正确的菌液为模板,利用已插入的酶切位点进行酶切,通过Nde Ⅰ和Bgl Ⅱ对克隆载体进行双酶切,酶切产物通过1%的凝胶电泳成像鉴定,片段约为1 865 bp及1 335 bp(图8)。
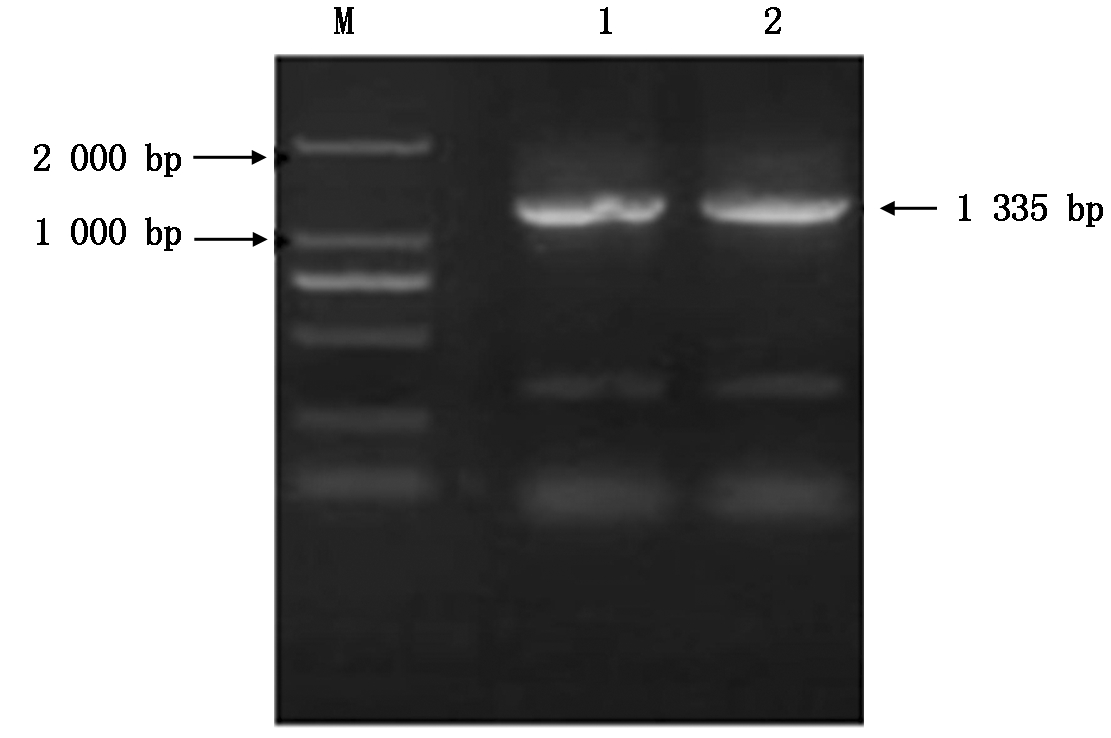
M.DL2000;1-2.PCR产物。图7同。
M.DL2000 DNA Marker; 1-2. Production of PCR.The same as Fig.7.
图6 通过RT-PCR技术扩增目的 DNA片段的琼脂糖凝胶电泳
Fig.6 The agarose gel electrophoresis of the target DNA fragment with using RT-PCR technology amplification
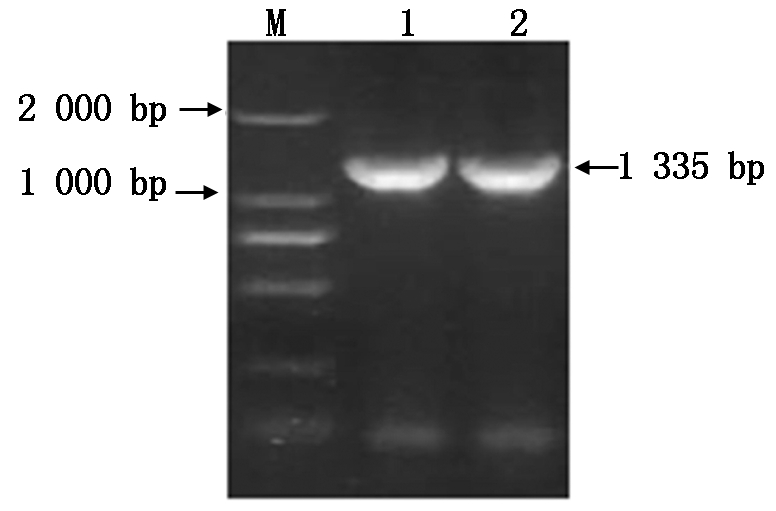
图7 克隆重组质粒的菌悬液PCR琼脂糖凝胶电泳
Fig.7 The agarose gel electrophoresis of suspension of cloning recombinant plasmid by PCR
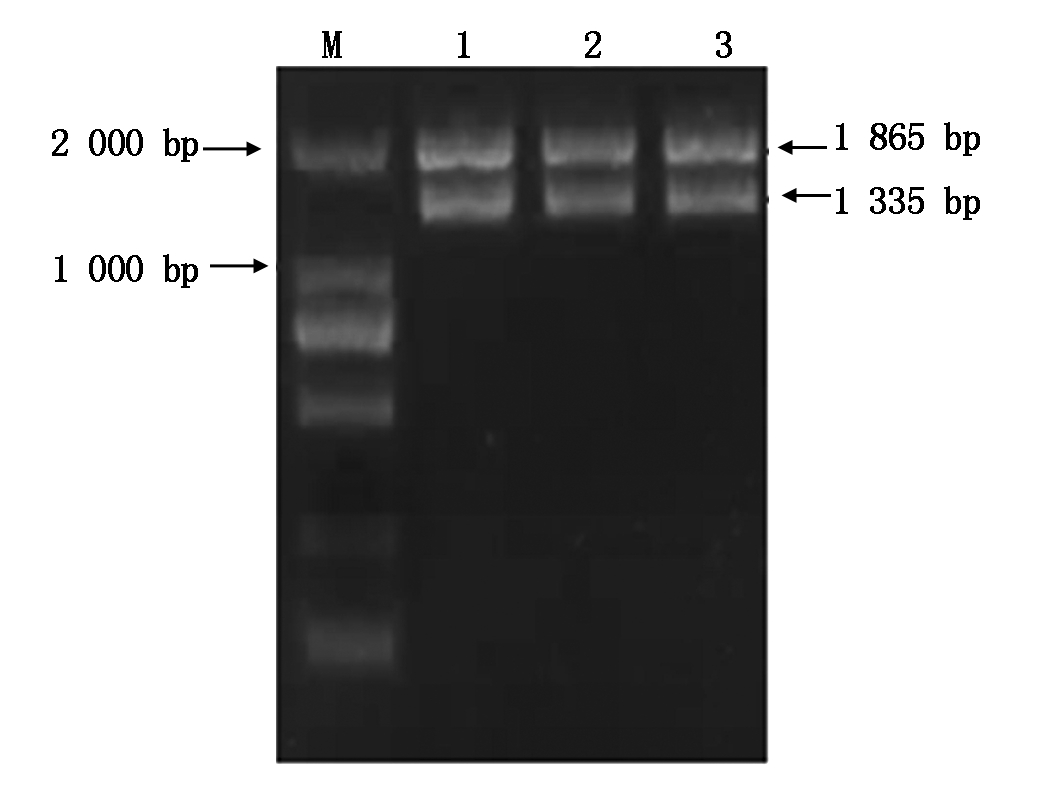
M. DL2000; 1-3.酶切产物。
M. DL2000 DNA Marker; 1-3. Production of double digestion.
图8 克隆载体双酶切鉴定琼脂糖凝胶电泳
Fig.8 The agarose gel electrophoresis of double digestion of cloning vector
2.5 蛋白酶基因表达载体构建
通过琼脂糖DNA纯化试剂盒纯化1 335 bp的目的DNA片段,利用T4 DNA连接酶将目的DNA片段与pET28a载体连接,将重组质粒导入大肠杆菌(DH5α)感受态细胞对原核表达载体扩增,对带有pET28a重组质粒的大肠杆菌菌液进行PCR鉴定,产物通过1%的琼脂糖凝胶电泳观察,结果与1 335 bp的目的基因条带大小相同(图9)。运用TIANGEN质粒小提试剂盒对带有pET28a重组质粒进行质粒提取,用NdeⅠ和BglⅡ进行双酶切,与预期结果一致(图10)。选取3个菌悬液送到华大基因科技股份有限公司进行测序检测,经DNAMAN比对,确定为蛋白酶成熟区域序列,原核表达载体构建成功。
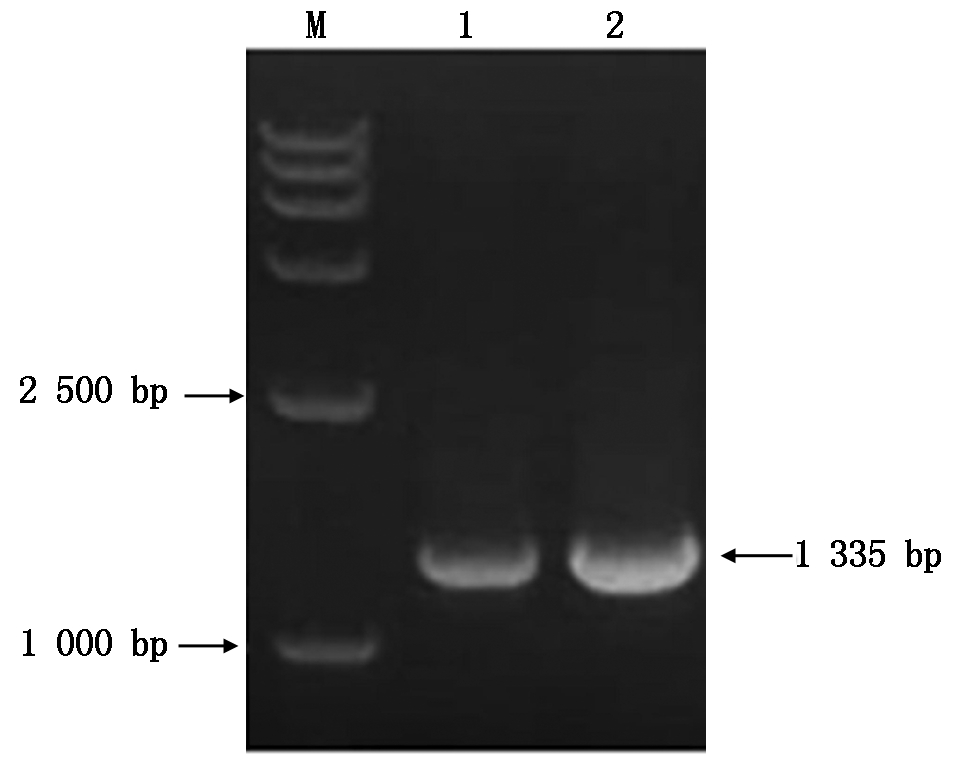
M. DL15000; 1-2.PCR产物。
M. DL15000 DNA Marker; 1-2. Production of PCR.
图9 目的基因与pET28a载体连接菌液PCR琼脂糖凝胶电泳
Fig.9 The agarose gel electrophoresis of target gene linking to the PCR of bacterial solution of pET28a vector
M. DL15000; 1-2.酶切产物。
M. DL15000 DNA Marker; 1-2. Production of double digestion.
图10 重组质粒双酶切鉴定琼脂糖凝胶电泳
Fig.10 The agarose gel electrophoresis of double digestion of recombinant plasmid
3 结论与讨论
生物信息学是对拥有准确基因序列的蛋白质进行预测,获得其编码区域信息,完成基础信息及结构预测的一门学科,其为后续蛋白功能的研究奠定基础。
由于向日葵锈菌是专性寄生菌之一,彻底根除十分困难,所以从分子水平了解向日葵锈菌的致病机制,寻找合适的靶标进行病害控制也是一种有效的病害管理途径。分泌蛋白需要具备以下4个特征:①N-端信号肽;②无跨膜结构域;③无GPI锚定位点;④没有将蛋白输送至线粒体或其他胞内细胞器的预测定位信号。本研究利用在线软件SignalP4.1Server、TMpred、big-PI predictor及TargetP 1.1确定此蛋白酶为胞外分泌蛋白,这类蛋白酶主要作为水解酶、酯酶及磷酸酶集中参与细胞代谢。据报道,许多病菌通过分泌蛋白进入寄主细胞,达到致病作用,如卵菌在侵染植株时,会分泌胞外效应子干扰植株自身免疫系统,其中就包含细胞壁降解酶(Cell wall-degrading enzymes,CWDE)[18]。
利用生物信息学在线软件,得到蛋白酶ORF区域,确定该蛋白酶成熟蛋白分子质量为49.5 ku,据报道烟曲霉(Aspergillus fumigatus)[8,19]、梗青霉(Nomuraea atypicola)[20]、灰盖鬼伞菌(Coprinopsis cinerea)[21]、白蜡多年卧孔菌(Perenniporia fraxinea)[22]都发现可分泌的金属蛋白酶,烟曲霉菌的金属蛋白酶分子质量为43 ku,梗青霉菌所分泌的金属肽酶为48 ku,灰盖鬼伞菌及白蜡多年卧孔菌分泌的金属蛋白酶分别为37~46 ku及42 ku。
通过分析软件分析蛋白酶序列发现其此类蛋白为活性中心依赖于锌的金属肽酶。许多含锌离子的金属蛋白酶在微生物中广泛存在,如荧光假单胞菌(Pseudamonas fluoroscens)的AprX细胞外金属蛋白酶[23-25];芽孢杆菌(Bacillus)中性金属蛋白酶[26-27],粘质沙雷氏菌(Serralysin)的SmP金属蛋白酶[28-29];皮氏罗尔斯通氏菌(Ralstonia pickettii)的RpA金属蛋白酶[30],这些病原菌分泌的金属蛋白酶,其活性中心都含有锌离子。利用SWISS-MODEL推断它为胞外弹性金属蛋白酶,通过比对,显示它属于真菌素M36蛋白酶家族,与NCBI数据库其他物种的金属蛋白酶进行比对,结果显示其氨基酸同M36家族中5条蛋白序列具有高度相似性,再通过SWISS-MODEL基于同源建模的方法,发现同M36胞外金属蛋白酶基因序列相似度达到53.77%。据报道[18],M36家族为金属肽酶,其为一种分泌蛋白,M36家族蛋白酶为依赖于金属离子的一类蛋白酶,已发现的M36家族金属肽酶编码氨基酸分子质量在40~48 ku,且M36金属肽酶水解氨基酸中多肽键以达到致病效果。随着研究不断深入[8,31],已发现多数M36肽酶家族在不同环境或不同发育调节下可以分解相应底物,在真菌中,细胞外分泌蛋白一般具有2种功能,一是可以水解相应底物的蛋白质,二是软化寄主组织进行自身的扩增、繁殖、定殖。因此,真菌素M36蛋白家族可能属于细胞外分泌蛋白,并且这类酶可能作为真菌的主要致病因子所存在。推断向日葵锈菌所分泌的弹性金属蛋白酶也很可能属于M36家族。
本研究对向日葵锈菌金属蛋白酶基因克隆及原核表达的载体构建,有利于锈菌或其他真菌致病基因的发现和研究,可以从基因水平上研究真菌侵染机制,也为进一步研究其蛋白质调控提供依据[32],进而有望在分子水平找到向日葵锈病防治靶标。本研究对向日葵锈菌金属蛋白酶基因的克隆和生物信息学的分析,为后续金属蛋白酶研究奠定了基础,也为其他真菌及致病蛋白的研究提供依据。
[1] 林晓红.向日葵NBS型抗锈病相关基因的克隆与分析[D].呼和浩特:内蒙古农业大学,2014.
Lin X H. Molecular cloning and characterrization of NBS orthologues of rust resistance gene from sunflower[D].Hohhot:Inner Mongolia Agricultural University,2014.
[2] 曹娜. 向日葵锈病初步研究[D].长春:吉林农业大学,2011.
Cao N. Preliminary studies on sunflower Rust[D]. Changchun:Jilin Agricultural University,2011.
[3] 王丽芳. 向日葵抗锈病生理机制及超微结构的研究[D].呼和浩特:内蒙古农业大学,2008.
Wang L F. Physiology mechanism and the ultrastructure studies on the resistance to sunflower rust[D]. Hohhot:Inner Mongolia Agricultural University,2008.
[4] Kolattukudy P E. Biopolyester membranes of plants:cutin and suberin[J]. Science,1980,208(4447):990-1000. doi:10.1126/science.208.4447.990.
[5] Kolattukudy P E. Enzymatic penetration of the plant cuticle by fungal pathogens[J]. Annu Rev Phytopathol,1985,23(4):223-250. doi:10.1146/annurev.py.23.090185.001255.
[6] Kolattukudy P E,Lee J D,Rogers L M,Zimmerman P,Ceselski S,Fox B,Stein B,Copelan E A. Evidence for possible involvement of an elastolytic serine protease in aspergillosis[J]. Infect and Immun,1993,61(6):2357-2368.doi:10.1016/0928-8244(93)90047-8.
[7] Starcher B C. Elastin and the lung[J]. Thorax,1986,41(8):577-585. doi:10.1136/thx.41.8.577.
[8] Markaryan A,Morozova I,Yu H,Kolattukudy P E. Purification and characterization of an elastinolytic metalloprotease from Aspergillus fumigatus and immunoelectron microscopic evidence of secretion of this enzyme by the fungus invading the murine lung[J]. Infect and Immun,1994,62(6):2149-2157.
[9] 荆谷,冯静,孔健,马桂荣.微生物金属蛋白酶的研究进展[J].生物工程进展,2002(1):61-63,56. doi:10.13523/j.cb.20020114.
Jing G,Feng J,Kong J,Ma G R.Research progress on microbial source metalloproteinases[J]. Progress in bioengineering,2002(1):61-63,56.
[10] Sirakova T D,Markaryan A,Kolattukudy P E . Molecular cloning and sequencing of the cDNA and gene for a novel elastinolytic metalloproteinase from Aspergillus fumigatus and its expression in Escherichia coli[J]. American Society for Microbiology,1994,62(10):4208-4218. doi:10.1016/0167-5699(94)90199-6.
[11] Kothary M,Chase T,Macmillan J M. Correlation of elastase production by some strains of Aspergillus fumigatus with ability to cause pulmonary invasive aspergillosis in mice[J]. Infect and Immun,1984,43(1):320-325. doi:10.1007/BF01641732.
[12] Monod M,Togni G,Rahalison L,Fren K E. Isolation and characterisation of an extracellular alkaline protease of Aspergillus fumigatus[J]. Journal of Medical Microbiology,1991,35(1):23-28. doi: 10.1099/00222615-35-1-23.
[13] Ramesh M V,Sirakova T,Kolattukudy P E. Isolation,characterization,and cloning of cDNA and the gene for anelastinolytic serine protease from Aspergillus flavus[J]. Infect and Immun,1994,62(1):79-85. doi:10.1007/BF01793577.
[14] Monod M,Paris S,Sanglard D,Jaton-Ogay K,Bille J,Latge J P. Isolation and characterization of a secreted metalloprotease of Aspergillus fumigatusl[J]. Journal of Medical Microbiology,Infect and Immun,1993,61(10):4099-4104. doi:10.1099/00222615-35-1-23.
[15] 郭丹丹. 向日葵锈菌分泌蛋白预测及内参基因筛选[D].呼和浩特:内蒙古农业大学,2016.
Guo D D. Secretory protein prediction and reference gene screening of Puccinia helianthi[D].Hohhot:Inner Mongolia Agricultural University,2016.
[16] 刘信丹,张英,吴孟华,曹晖. 广藿香醇合成酶基因Pc-PTS1的克隆和生物信息学分析[J]. 中药材,2018,49(2):302-308. doi:10.13863/j.issn1001-4454.2018.02.010.
Liu X D,Zhang Y,Wu M H,Cao H. Cloning and bioinformatics analysis of patchoulol synthase gene Pc-PTS1 from Pogostemon cablin[J]. Journal of Chinese Medicinal Materials,2018,49(2):302-308.
[17] 张胜博,刘景辉,李立军,赵宝平.燕麦AsNAC1耐盐基因的克隆及初步验证[J].北方农业学报,2016,44(5):1-7.doi:10.3969/j.issn.2096-1197.2016.05.01.
Zhang S B,Liu J H,Li L J,Zhao B P. Cloning and preliminary validation of the AsNAC1 gene for salt tolerance from oat[J]. Journal of Northern Agriculture,2016,44(5):1-7.
[18] 张美祥. 卵菌胞内效应子研究进展[J]. 南京农业大学学报,2018,41(1):18-25. doi:10.7685/jnau.201706100.
Zhang M Y. Recent research progress on oomycete cytoplasmic effectors[J]. Journal of Nanjing Agricultural University,2018,41(1):18-25.
[19] Kolattukudy P E,Sirakova T D. 233 Fungalysin[J]. Handbook of Proteolytic Enzymes,2004(1):792-793. doi:10.1016/C2009-1-60990-4.
[20] Ueda M,Yamaoto N,Kusuda M,Nakazawa M,Takenaka S,Miyatake K,Ouchi K,Sakaguchi M,Inouye K. Purification and characterization of a new fungalysin-like metallopeptidase from the culture filtrate of a plant worm,Nomuraea atypicola[J]. Process Biochemistry,2013,48(1):190-194. doi:10.1016/j.procbio.2012.11.005.
[21] Kilaru S,Hoegger P J,Majcherczyk A. Expreesion of laccase gene Iccl in Coprinopsis cinerea under control of various basidiomycetous promoters[J]. Appl Microbiol Biotechnol,2006,71(2):200-210. doi:10.1007/s00253-005-0128-1.
[22] Kim J S,Kim J E,Choi S E,Kumar P,Kim S S,Lee H H,Kim C S,Yeal,Kim M K,Kim Y S,Kim S J. Purification and characterization of fibrinolytic metalloprotease from Perenniporia fraxinea mycelia[J]. Mycol Res,2008,112(8):990-998. doi:10.1016/j.mycres.2008.01.029.
[23] Ahn J H, Pan J G, Rhee J S.Identification of the tliDEF ABC transporter specific for lipase in Pseudomonas fluorescens SIK W1[J]. Journal of Bacteriology, 1999, 181(6):1847-1852. doi: 10.1134/S0869593807040016.
[24] Dufour D, Nicodeme M, Perrin C,Driou A,Brusseaux E,Humbert G,Gaillard J, Dary A. Molecular typing of industrial strains of Pseudomonas spp. isolated from milk and genetical and biochemical characterization of an extracellular protease produced by one of them[J]. International Journal of Food Microbiology, 2008, 125(2):188-196. doi: 10.1016/j.ijfoodmicro.2008.04.004.
[25] Zhang W W, Hu Y H, Wang H L,Sun L.Identification and characterization of a virulence-associated protease from a pathogenic Pseudomonas fluorescens strain[J]. Veterinary Microbiology, 2009, 139(1-2):183-188. doi: 10.1016/j.vetmic.2009.04.026.
[26] Hase C C, Finkelstein R A. Bacterial extracellular zinc-containing metalloproteases[J]. Microbiol Rev, 1993, 57(4):823-837. doi: 10.1006/mpat.1993.1096.
[27] Wu J W, Chen X L. Extracellular metalloproteases from bacteria[J]. Appl Microbiol Biotechnol, 2011,92(2):253-262. doi: 10.1007/s00253-011-3532-8.
[28] Baumann U. Crystal structure of the 50kDa metallo protease from Serratia marcescens[J]. Journal of Molecular Biology, 1994, 242(3):244-251. doi: 10.1006/jmbi.1994.1576.
[29] Ishii K, Adachi T, Hamamoto H, Sekimizu K. Serratia marcescens suppresses host cellular immunity via the production of an adhesion-inhibitory factor against immunosurveillance cells[J]. Journal of Biological Chemistry, 2014, 289(9):5876-5888. doi: 10.1074/jbc.M113.544536.
[30] Chen C M, Liu J J, Chou C W, Lai C H,Wu L T. RpA, an extracellular protease similar to the metalloprotease of serralysin family, is required for pathogenicity of Ralstonia pickettii[J]. Journal of Applied Microbiology, 2015, 119(4): 1101-1111. doi: 10.1111/jam.12903.
[31] Kalisz H M,Wood D A,Moore D. Production,regulation and release of extracellular proteinase activity in basidiomycete fungi[J]. Transactions of the British Mycological Society,1987,88:221-227. doi:10.1016/s0007-1536(87)80218-8.
[32] 王佳,游松,周丽娜. 倍半萜生物转化的研究进展[J]. 沈阳药科大学学报,2012,29(2):156-164. doi:10.14066/j.cnki.cn21-1349/r.2012.02.006.
Wang J,You S,Zhou L N.Advances in research on sesquiterpene biotransformation[J]. Journal of Shenyang Pharmaceutical University,2012,29(2):156-164.