水稻是全球重要的粮食作物之一。随着劳动成本的逐年升高,轻简栽培将是未来我国水稻的主要种植方式[1]。水稻直播技术因其无需育秧移栽、无返青期、省时省力、操作简单、效率高等特点而越来越受欢迎[2]。然而,全苗、壮苗技术一直是影响直播稻总产量的因素之一[3]。直播种子萌发时稻田积水将显著影响出苗率和成活率,稻田积水主要对幼苗形成低氧胁迫,抑制水稻生长[4-5]。研究表明,仅4 d的淹水胁迫,水稻产量就受到不同程度的降低[6]。
早期淹水对水稻幼苗生长发育的影响主要原因并不在于水分本身,而是由于过量的水分诱导的次生胁迫[7-10],如缺氧等。在稻田没顶淹水的情况下,水稻生理生化和形态特征都会产生相应的变化,主要表现为:乙烯(ETH)大量生成,内源赤霉素(GA3)和脱落酸(ABA)活性升高;有氧代谢途径受阻,无氧代谢途径增强;质膜透性增加,MDA含量升高,离子渗漏量增加;酶系统异常,蛋白质合成受阻,分解速度加快,原生质结构遭破坏;胚芽鞘和中胚轴伸长,茎节部位长出部分不定根和不定芽,根毛减少,根系不再生长等[11-15]。因此,研究相关的耐受措施,增强水稻在淹水胁迫下的存活率和出苗能力,对减免水稻直播栽培因播种后渍涝带来的减产具有重要意义。
褪黑素(Melatonin,美拉酮宁,简称MT)作为一种新兴的植物生理调节激素,MT最初是在动物体内发现的,由大脑中松果体腺所合成,因此又称松果体素。化学名称为N-乙酰基-5-甲氧基色胺,分子式为C13N2H16O2,因其结构中的5-OCH3和N-Ac官能团的存在,决定了MT自身具有亲水性和高亲脂性,也决定了其与受体结合的特异性[16-17]。MT的化学结构和生物功能与生长素(IAA)相类似,因此也对光照敏感,可以有效清除自由基,在组织体内无限制转移[18-22]。
MT广泛存在于各类高等植物体中,尽管在植物体内MT含量非常低[23],但在增强植物抗逆性上发挥着重大的作用,特别是在抗氧化胁迫(例如干旱胁迫增强小麦抗氧化能力[24])。相较于其他抗氧化剂(如维生素E、谷胱甘肽),MT的抗氧化能力更强,同时MT的加入还可以诱导植物体内其他抗氧化剂(如抗坏血酸和谷胱甘肽)的合成[25],它可以缓解高盐胁迫、紫外、电离辐射、重金属、干旱、高温、低温等多种逆境压力对高等植物的损害[26-31],但在增强水稻幼苗抗淹水胁迫上鲜有报道。
水稻淹水过后易受到活性氧(ROS)诱导的膜脂过氧化作用的伤害,氧自由基氧化脂质不饱和脂肪酸,生成过氧化脂质;后者逐渐分解成一系列复杂的化合物,其中包括丙二醛(MDA)[32-33]。本研究通过测定淹水胁迫后幼苗相关农艺性状、保护酶系统的酶活以及MDA含量等生理生化指标,分析不同浓度褪黑素浸种对长、短中胚轴水稻耐淹效果的影响[34],为水稻直播技术的改良与发展提供科学依据。
1 材料和方法
1.1 试验材料
选用湖南杂交水稻研究中心赵炳然课题组淹水处理筛选的长中胚轴品种鄂中4号和DH4038,短中胚轴品种华航31和DH4040。其中鄂中4号和华航31为常规稻品种,DH4038和DH4040来自中科院遗传与发育学研究所储成才课题收集的代表全球水稻多样性微核心种质。
1.2 试验方法
种子先用1%的次氯酸钠消毒20 min,然后用灭菌蒸馏水冲洗5遍。种子消毒后,统一浸种、催芽。浸种时用MT处理,MT设置3种浓度,分别为10,100,1 000 μmol/L,以灭菌蒸馏水浸种作为对照[35-36]。浸种48 h后,37 ℃催芽18 h。共组成16种试验处理,每个品种3次重复,每个重复选取萌发一致的种子200粒,其中100粒用作生理指标和农艺性状测定,另外100粒用作成活率的测定,放置在萌发板上,相同处理的材料放置在同一黑色水培箱中,设置淹水高度10 cm。温室28 ℃黑暗条件下处理7 d,每天固定时间在黑暗或弱光的环境中换水。7 d后,用刻度尺测量每个水稻品种幼苗的中胚轴长、胚芽鞘长和芽长,用分析天平称量幼苗鲜质量。MDA含量及POD、SOD、CAT活性测定试剂盒均由苏州科铭试剂公司提供。吸光度使用酶标仪EnSpire 2300 Multilabel Reader测定。成活率测定材料在淹水处理后放置于漂浮板上,28 ℃,光培养16 h,暗培养8 h,15 d后统计成活率。
1.3 数据处理
利用Excel对数据进行基本的计算和作图,SPSS 22.0进行差异显著性检验及ANOVA分析,组间采用Duncan′s多重比较(α=0.05)。
2 结果与分析
2.1 MT浸种对水稻幼苗农艺性状的影响
在淹水处理下,DH4038的中胚轴长度最长,均值为0.52 cm,华航31的中胚轴长度最短,均值为0.14 cm(图1)。3种浓度的MT浸种均能提高4个水稻品种的中胚轴伸长能力,使用100,1 000 μmol/L的MT浸种效果均达到显著水平,100 μmol/L MT浸种效果最好。MT对短中胚轴品种提升中胚轴伸长能力更为明显,使用10,100,1 000 μmol/L MT浸种,华航31的提升幅度均最为明显,中胚轴长度分别增加33.06%,80.65%,70.97%。
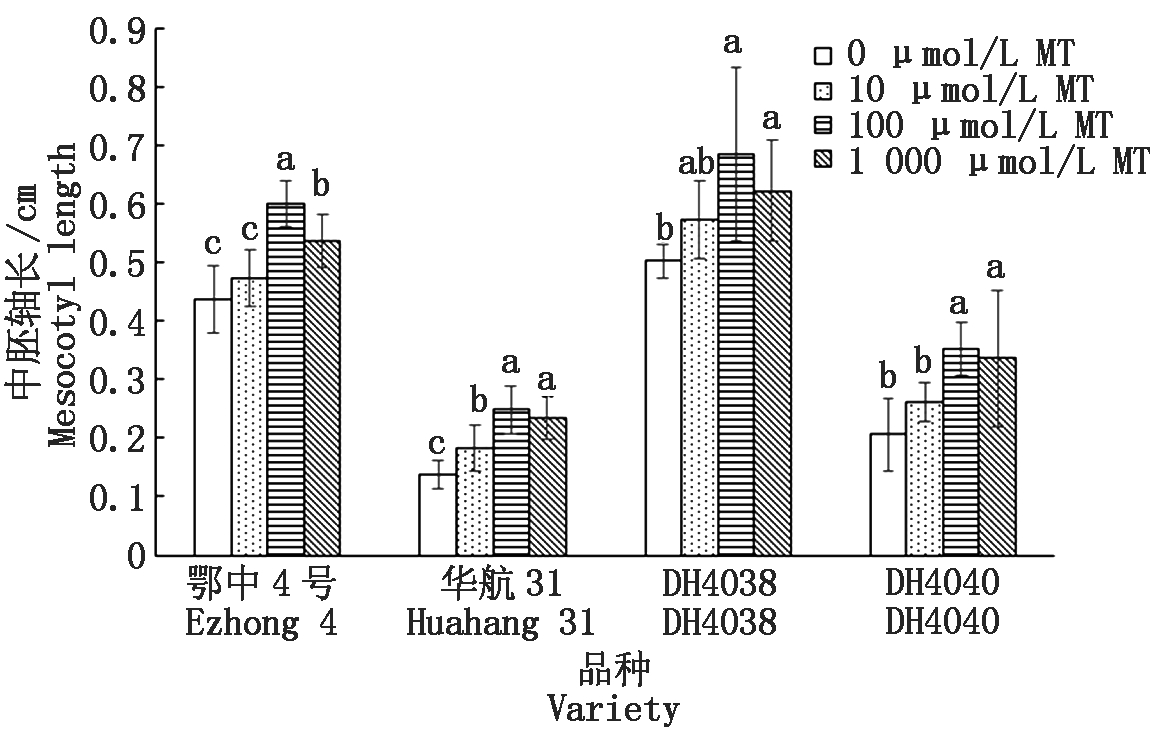
不同小写字母表示同一品种不同浓度褪黑素浸种处理间差异显著
(P<0.05),多重比较采用Duncan′s多重比较法。图2-9同。
Different small letters within the same rice varieties mean significant difference among different melatonin soaking-seeds treatments. Duncan′s multiple range test,at 5% level.The same as Fig.2-9.
图1 MT浸种对淹水胁迫下幼苗中胚轴伸长的影响
Fig.1 Effect of MT-soaking treatment on seedling mesocotyl length under submergence stress
长中胚轴品种鄂中4号和DH4038相比短中胚轴品种华航31和DH4040具有较强的胚芽鞘伸长能力(图2)。施加MT均能增强4种水稻品种胚芽鞘伸长能力,低浓度的MT浸种对长中胚轴品种鄂中4号和DH4038效果较好,而高浓度的MT浸种对短中胚轴品种华航31和DH4040效果更为明显。
10 μmol/L MT浸种具有提升水稻胚芽鞘伸长能力的趋势。使用100 μmol/L的MT浸种对提升长中胚轴品种鄂中4号和DH4038胚芽鞘伸长能力具有显著效果。10,100 μmol/L的MT浸种对鄂中4号的处理效果最好,胚芽鞘长度分别提升3.44%,7.42%。当使用浓度1 000 μmol/L的MT浸种时均能显著促进胚芽鞘伸长,且对短中胚轴品种华航31和DH4040效果更为明显,分别提升10.62%和12.76%。
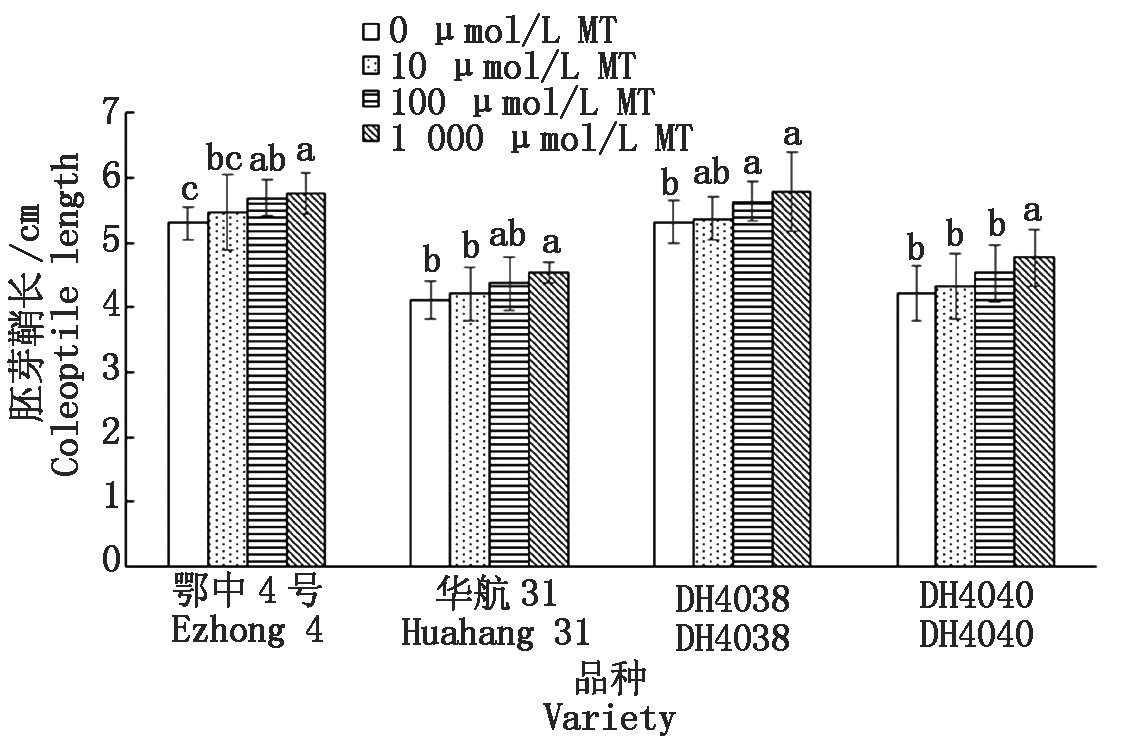
图2 MT浸种对淹水胁迫下幼苗胚芽鞘伸长的影响
Fig.2 Effect of MT-soaking treatment on seedling coleoptile length under submergence stress
长中胚轴品种同时也伴有更长的幼芽(图3)。淹水处理后,DH4038具有最强的幼芽伸长能力,均值为5.77 cm,其次为鄂中4号,均值为4.57 cm。
MT浸种对芽长影响不明显,但高浓度下(1 000 μmol/L)所有的水稻品种芽长有一定的抑制趋势。其中对短中胚轴品种DH4040和华航31抑制效果最为明显,分别达到10.17%和5.31%。
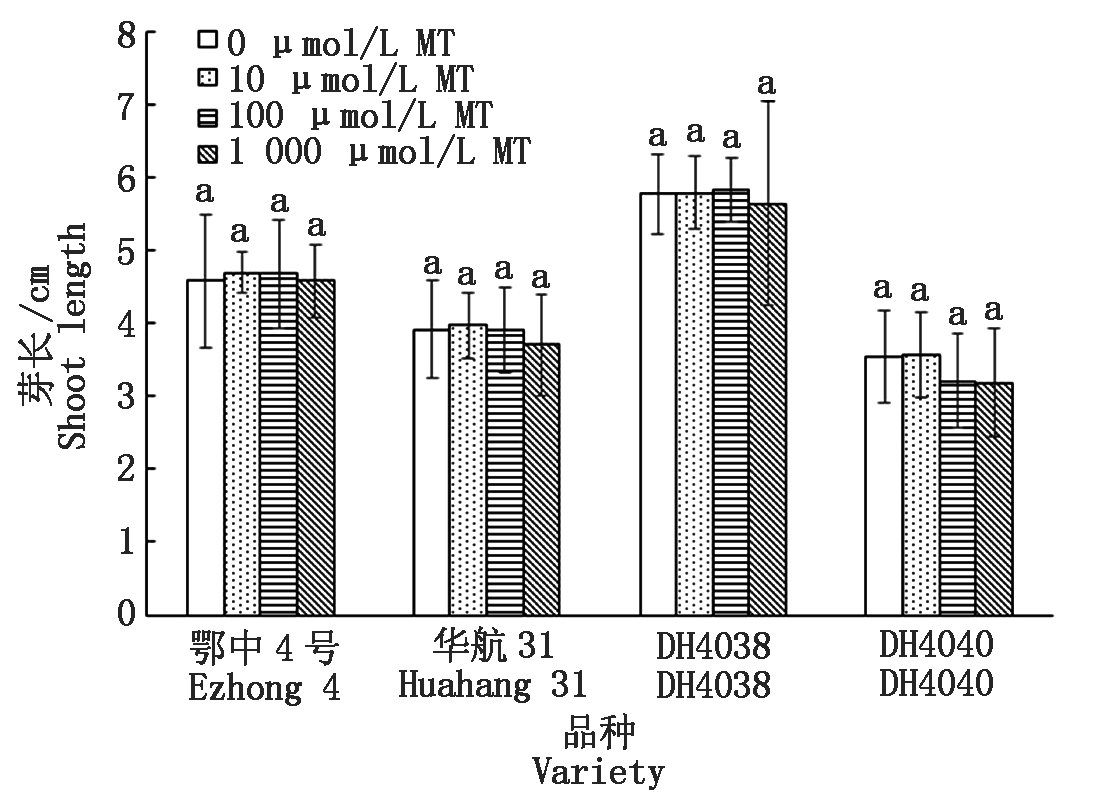
图3 MT浸种对淹水胁迫下幼苗芽长的影响
Fig.3 Effect of MT-soaking treatment on seedling shoot length under submergence stress
淹水处理下相比短中胚轴品种华航31和DH4040,长中胚轴品种鄂中4号和DH4038具有更高的鲜质量(图4)。10,100 μmol/L MT浸种对4种水稻品种的鲜质量均有显著的提升效果,而1 000 μmol/L MT浸种对DH4038和DH4040具有显著抑制效果。
10,100 μmol/L MT浸种能显著提高4种水稻品种的鲜质量。其中10 μmol/L MT浸种下,DH4040提升效果最为明显,达到7.69%。使用100 μmol/L MT浸种,DH4038促进效果最好,达到14.62%。当MT浓度提高到1 000 μmol/L后,对鄂中4号和华航31的处理效果不明显,而对于DH4038和DH4040具有显著的抑制效果,对DH4040抑制率达到3.85%。
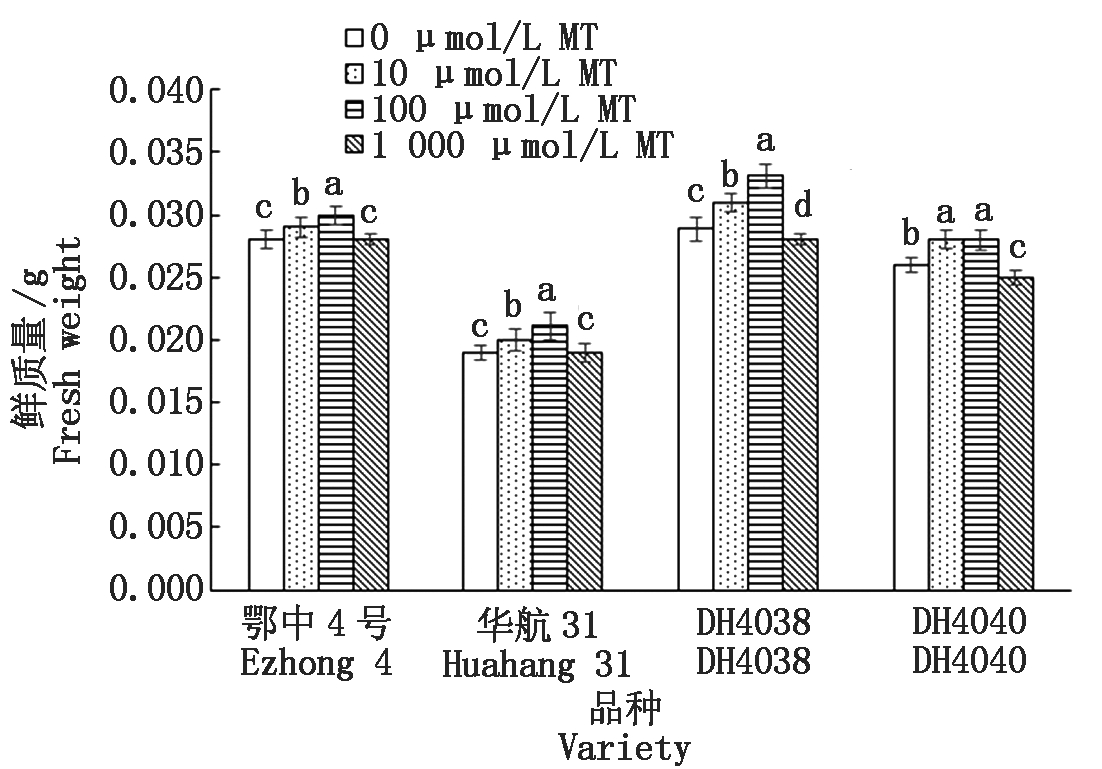
图4 MT浸种对淹水胁迫下幼苗鲜质量的影响
Fig.4 Effect of MT-soaking treatment on seedling fresh weight under submergence stress
2.2 MT对水稻幼苗成活率的影响
淹水处理下相比短中胚轴品种华航31、DH4040,长中胚轴品种鄂中4号、DH4038具有较高的成活率(图5)。一定浓度的MT浸种均能提高淹水胁迫下幼苗的成活率,但随着MT浓度的提高,MT表现为降低水稻幼苗的成活率。在对4个品种添加10,100 μmol/L的MT浸种时,华航31中MT浸种效果表现均是最好的,其幼苗成活率分别提高19.36,22.53百分点。其中100 μmol/L MT浸种处理在每个品种中均能显著提高幼苗的成活率。随着浓度提高到1 000 μmol/L,对鄂中4号和华航31具有抑制成活的趋势。对DH4038和DH4040具有显著的抑制效果,成活率分别降低为22.35,17.83百分点。
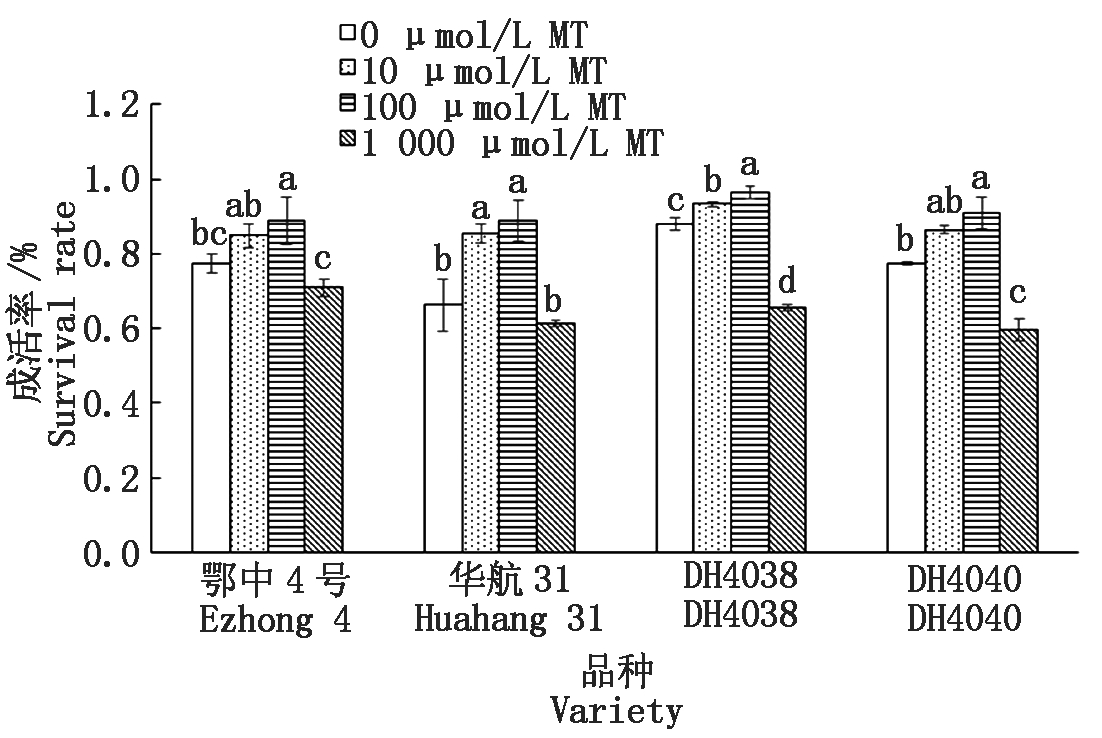
图5 MT浸种对淹水胁迫下幼苗成活率的影响
Fig.5 Effect of MT-soaking treatment on seedling survival rate under submergence stress
2.3 MT对水稻幼苗 MDA含量和POD、CAT、SOD活性的影响
相比于长中胚轴品种,短中胚轴品种在淹水处理下具有较高的MDA含量(以鲜质量计)(图6)。MDA含量最高的为华航31(18.92 nmol/g),最低的为鄂中4号(12.04 nmol/g)。10 μmol/L MT浸种在4个水稻品种中有降低MDA的趋势,其中可以显著降低短中胚轴品种华航31和DH4040中MDA含量。降幅分别为21.82%和28.71%。100 μmol/L MT浸种下,效果达到最大化,华航31和DH4040降幅分别为53.64%和41.58%。然而,当MT的浓度提升到1 000 μmol/L时,MDA含量降低到与10 μmol/L MT处理基本相同的水平(与对照组相比均无显著性差异),浸种处理效果有所下降。
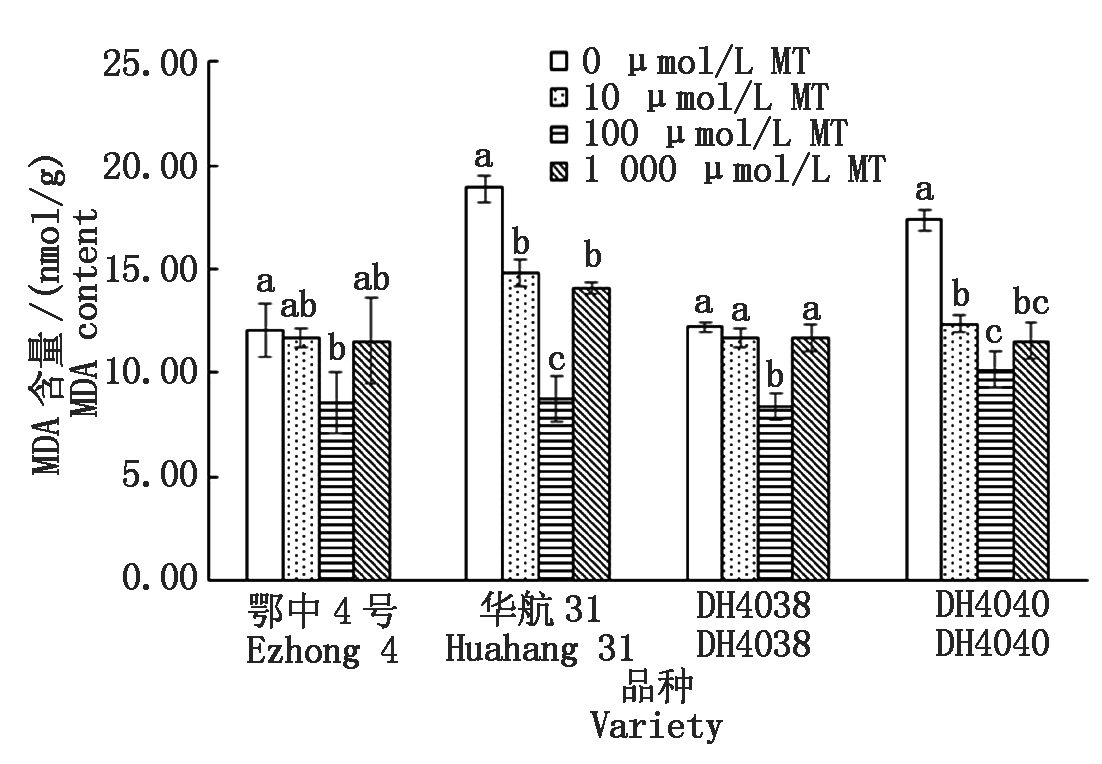
图6 MT浸种对淹水胁迫下幼苗MDA含量的影响
Fig.6 Effect of MT-soaking treatment on seedling MDA content under submergence stress
淹水处理下相比短中胚轴品种华航31和DH4040,长中胚轴品种鄂中4号和DH4038具有较高的POD活性(以鲜质量计)(图7)。DH4038的POD活性最高,达到16.61×103 U/g。添加10,100,1 000 μmol/L MT浸种,均能显著提高水稻POD活性。100 μmol/L MT为提高POD活性效率最适宜浓度,相比蒸馏水处理组,鄂中4号、华航31、DH4040和DH4038提升幅度分别为57.11%,86.86%,73.60%和99.05%。
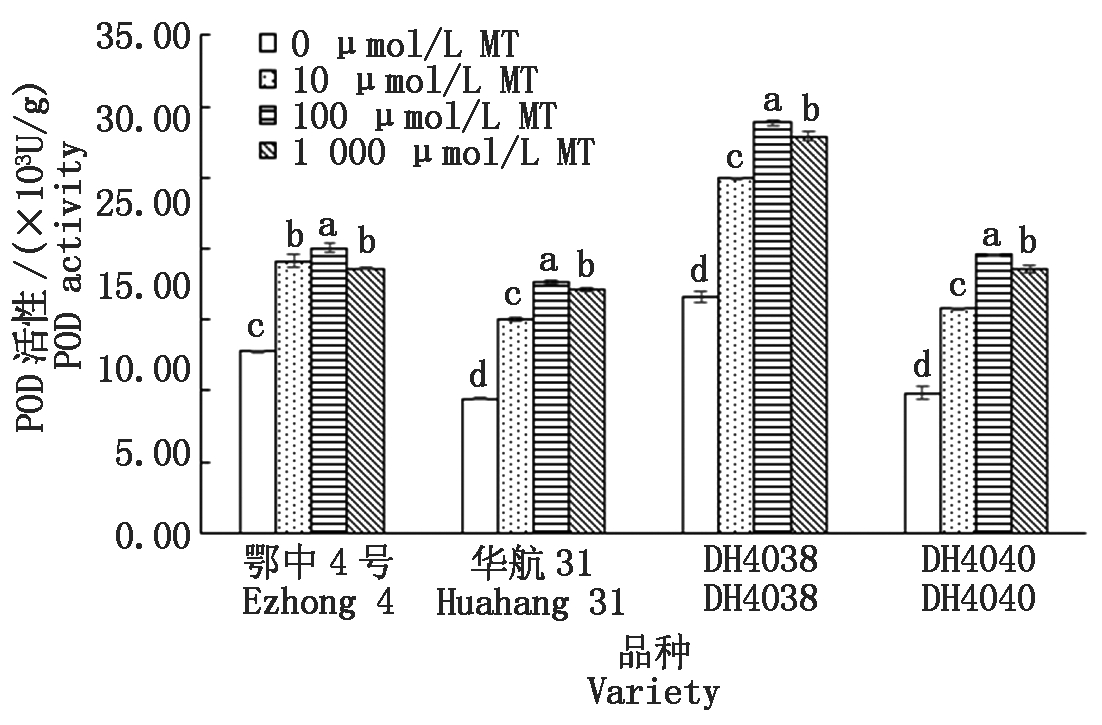
图7 MT浸种对淹水胁迫下幼苗POD活性的影响
Fig.7 Effect of MT-soaking treatment on seedling POD activity under submergence stress
淹水处理下相比短中胚轴品种华航31和DH4040,长中胚轴品种鄂中4号和DH4038具有较高的CAT活性(以鲜质量计)(图8),在鄂中4号中最高,达到64.26 nmol/(min·g)。添加MT浸种,有提升CAT活性的趋势,并且随着浓度的提高,提升效果越好。在DH4038中MT对提升CAT活性效果最明显,在10,100,1 000 μmol/L MT的处理下,DH4038的CAT活性分别提高为26.67%,46.67%和53.33%。DH4038也是唯一提升幅度达到显著差异的品种。
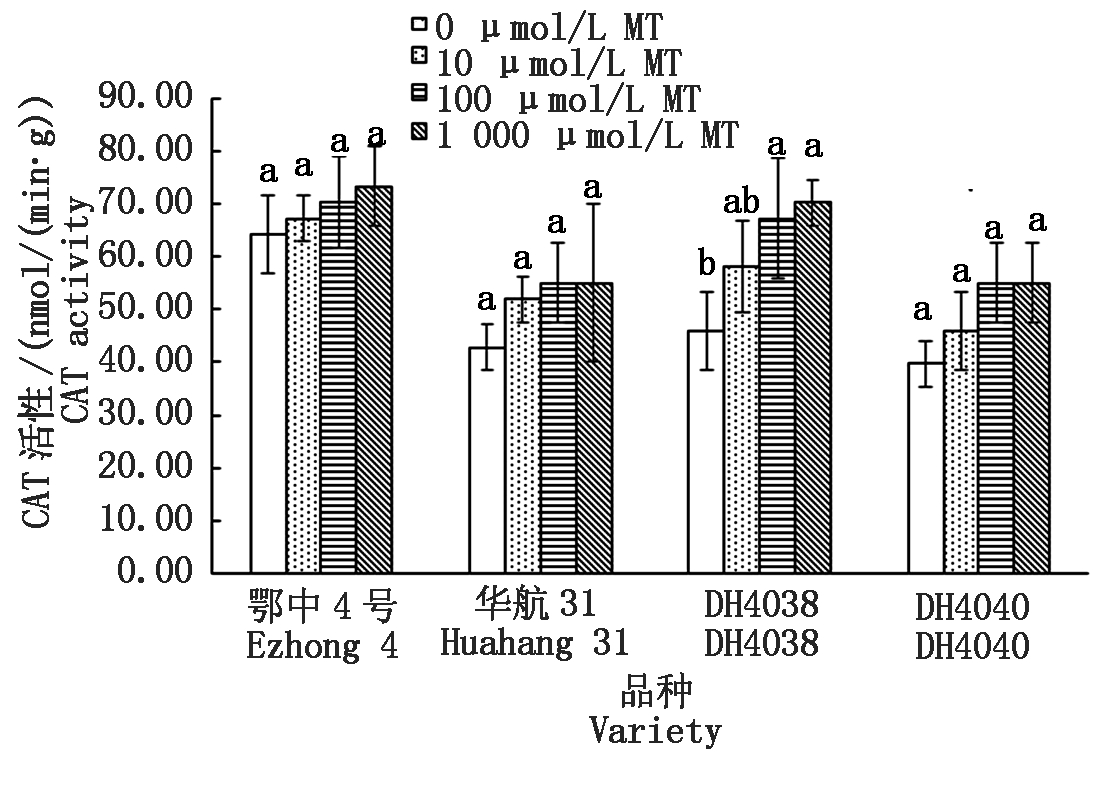
图8 MT浸种对淹水胁迫下幼苗CAT活性的影响
Fig.8 Effect of MT-soaking treatment on seedling CAT activity under submergence stress
淹水处理下相比短中胚轴品种华航31和DH4040,长中胚轴品种鄂中4号和DH4038均具有较高的SOD活性(以鲜质量计)(图9),DH4038最高,达到398.79 U/g。添加MT浸种,能提高SOD活性,并且随着MT浓度的提高,提升效果越好。当浓度到达1 000 μmol/L MT,与不添加MT处理相比,4种水稻品种均达到了显著水平。其中,在短中胚轴品种华航31和DH4040中有较好的提升效果。且在华航31中SOD的活性提升最明显,在10,100,1 000 μmol/L MT的处理下,华航31的提升幅度分别为39.02%,73.04%,73.96%。
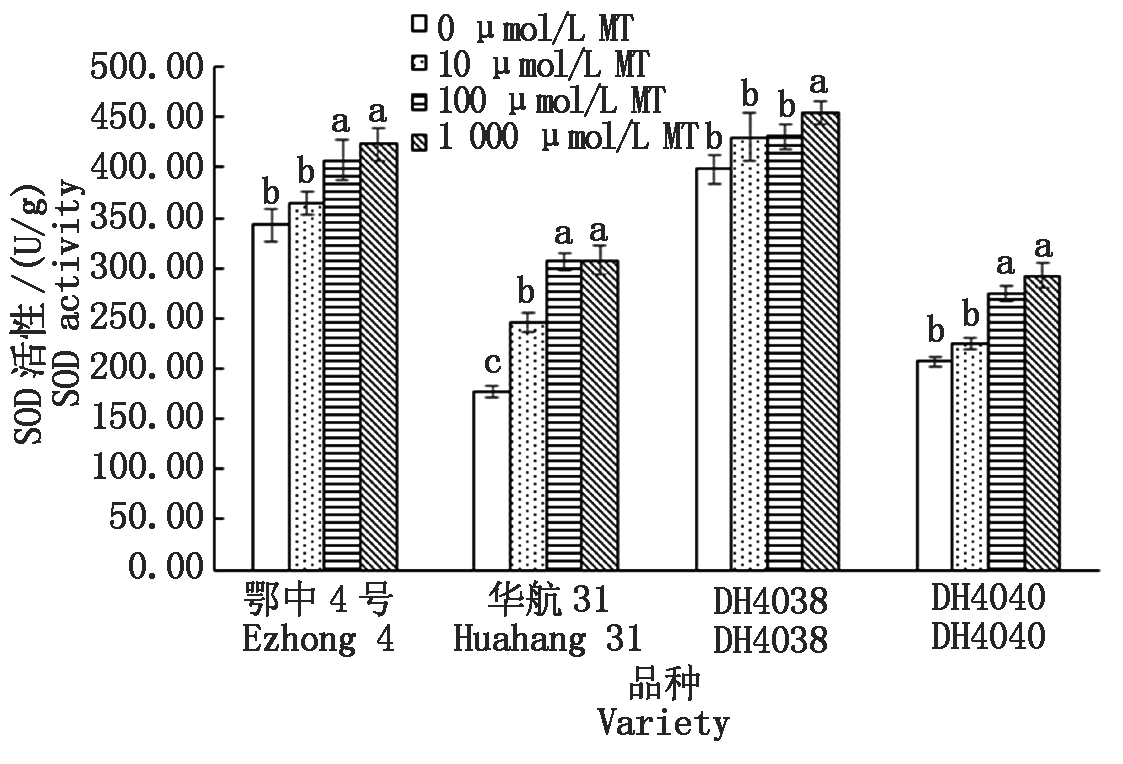
图9 MT浸种对淹水胁迫下幼苗SOD活性的影响
Fig.9 Effect of MT-soaking treatment on seedling SOD activity under submergence stress
3 结论与讨论
本研究所选用的水稻品种是关于淹水胁迫下中胚轴伸长的种质材料,发现在淹水胁迫下不同的中胚轴伸长材料具有不同的成活率,添加适宜浓度的MT能显著缓解淹水胁迫作用,提高所有品种的成活率,并且在短中胚轴品种中效果更为明显。
淹水处理7 d后,相比短中胚轴品种华航31、DH4040,长中胚轴品种鄂中4号、DH4038有较高的成活率,说明鄂中4号和DH4038均采用的是避淹策略[37],适合与水面缓慢升高或淹水较浅的胁迫环境下,通过迅速伸长生长,使叶片能伸出水面与空气相接触。随着农业技术和农田灌溉的提高,淹涝后的农田能有效地在短时间内排水。鄂中4号和DH4038更适宜短时间内淹涝胁迫下的直播种植方式。
使用一定MT浸种处理,4种水稻品种的成活率大幅度提升,说明适宜浓度的MT能显著提高水稻耐淹涝能力,值得注意的是,适宜浓度的MT对提升短中胚轴品种华航31和DH4040的成活率更为明显。因此,在实际的大田生产中可以制成相关的浸种剂或者种子包衣,促进幼苗出水,提高水稻耐淹涝能力。另外,MT成本低廉,容易获得,规模化使用时成本不高,具有潜在的应用前景。然而,当MT浓度过高时,幼苗成活率降低,说明过量的MT对水稻不仅没有缓解淹涝胁迫,还对水稻幼苗具有毒害作用,因此在实际的生产中需要选择合适的MT浓度进行浸种。
长中胚轴品种鄂中4号和DH4038鲜质量更大,生长更快。使用一定浓度的MT浸种处理能显著提高中胚轴长、胚芽鞘长和鲜质量,较高浓度下对胚芽鞘长具有抑制效果,不同浓度的MT对芽长影响不大,但是随着浓度的升高,有降低芽长的趋势。短中胚轴品种华航31和DH4040在MT浸种处理下能有效提高中胚轴长、胚芽鞘长和鲜质量。说明其生活力得到有效提高,同时成活率也相应提高。
淹水胁迫下相比华航31和DH4040,鄂中4号和DH4038具有较低的MDA含量水平,说明体内脂质氧化程度更低。使用100 μmol/L MT浸种处理时,4种水稻品种中均具有显著降低MDA含量的效果,其中华航31和DH4040效果更为明显,说明合适浓度的MT能显著降低淹水胁迫下水稻体内过氧化水平以及次生代谢产物所造成的毒害作用。
相比华航31和DH4040,鄂中4号和DH4038具有更高的POD、SOD和CAT活性。SOD是超氧化物阴离子清除酶,也是H2O2主要生成酶,CAT最主要的H2O2清除酶,POD具有消除H2O2、胺和酚毒性的多重作用。由此可以看出,SOD活性的提高,会加快生成H2O2,同时POD和CAT的相应提高可以清除产生的H2O2。
MT浸种处理能显著提高POD和SOD的活性,对CAT活性有提高的趋势。其中100 μmol/L MT对POD活性的促进效果最好,即降低水稻体内过氧化水平;1 000 μmol/L MT对CAT和SOD活性促进效果更好。由于1 000 μmol/L MT下SOD活性相比POD和CAT提升的更快,产生了更多的H2O2,在此浓度下MDA含量也有所提高,即更为严重的氧化损伤,所以更高浓度的MT表现为抑制水稻的生长,降低水稻淹水过后的成活率。Kanazawa等[38]报道,SOD/CAT、SOD/POD 比值的提高会进一步增加植物体的氧化胁迫。这与刘仕翔等[36]研究的镉胁迫和张娜[39]研究的盐胁迫所得的结果相同,即适宜低浓度的MT对逆境胁迫下的水稻生长具有显著的缓解作用,其作用主要是通过缓解氧化性损伤和促进植物幼苗生长,而过高浓度下的MT对逆境胁迫无明显的缓解作用或呈负面作用,这可能是因为高浓度的MT对植物的生长具有毒害作用。
用中低浓度的MT浸种对淹水胁迫下的水稻生长有缓解胁迫的作用,而高浓度的MT浸种却加剧对水稻幼苗的毒害。10,100 μmol/L MT浸种降低MDA含量,提高POD、SOD、CAT的活性,提高中胚轴长、胚芽鞘长、鲜质量等农艺性状,提高幼苗成活率。1 000 μmol/L MT浸种亦可以提高相关农艺性状和酶活性,但是,POD和SOD未能同步提高,引起水稻体内的生理失衡,使得成活率显著下降。所以,适当浓度的MT浸种,能提高淹水胁迫下水稻幼苗活力和出苗率。MT有望作为直播水稻种子浸种剂或者种子包衣成分。
[1] 凌启鸿. 关于水稻轻简栽培问题的探讨[J]. 中国稻米,1997,3(5):3-9.
Ling Q H. Discussion on light and simple cultivation of rice problems[J]. China Rice,1997,3(5):3-9.
[2] 李志辉. 水稻直播栽培技术要点[J]. 农村实用科技信息,2012(8):3.doi:10.3969/j.issn. 1674-0653.2012.08.002.
Li Z H. Key points of direct seeding cultivation techniques in rice[J]. Rural Science and Technology Information,2012(8):3.
[3] Angaji S A,Septiningsih E M,Mackill D J. QTLs associated with tolerance of flooding during germination in rice(Oryza sativa L.)[J]. Euphytica,2010,172(2):159-168.
[4] Julia B S,Takeshi F,Daniel J Gibbs,Michael J Holdsworth,Seung C L,Francesco L,Pierdomenico P,Laurentius A C J Voesenek,Joost T van D. Making sense of low oxygen sensing[J]. Trends in Plant Science,2012,17(3):129-138. doi:10.1016/j.tplants.2011.12.004.
[5] 徐春梅,陈丽萍,王丹英,陈松,章秀福,石庆华. 低氧胁迫对水稻幼苗根系功能和氮代谢相关酶活性的影响[J]. 中国农业科学,2016,49(8):1625-1634. doi:10.3864/j.issn.0578-1752. 2016.08. 020.
Xu C M,Chen L P,Wang D Y,Chen S,Zhang X F,Shi Q H. Effects of low oxygen stress on the root function and enzyme activities related to nitrogen metabolism in roots of rice seedlings [J]. Chinese Journal of Agricultural Sciences,2016,49(8):1625-1634.
[6] 李玉昌,李阳生,李绍清. 淹涝胁迫对水稻生长发育危害与耐淹性机理研究的进展[J]. 中国水稻科学,1998(S1):70-76. doi:10.16819/j.1001-7216.1998. s1.013.
Li Y C,Li Y S,Li S Q. Progress in research on injury to rice growth and development under submergence stress and mechanism of submergence tolerance [J]. Chinese Journal of Rice Science,1998(S1):70-76.
[7] 吴麟,张伟伟,葛晓敏,唐罗忠. 植物对淹水胁迫的响应机制研究进展[J]. 世界林业研究,2012,25(6):27-33. doi:10.13348/j.cnki.sjlyyj.2012.06.009.
Wu L,Zhang W W,Ge X M,Tang L Z. A review of the response mechanisms of plants to waterlogging stress [J]. World Forestry Research,2012,25(6):27-33.
[8] 马丽峰,李佐同,杨克军,赵长江,徐晶宇,杨荣斌,于高波,赵莹,石新新,许艳梅 刘承,闫博巍. 没顶淹水对敏感性水稻幼苗生长及抗氧化酶活性的影响[J]. 植物生理学报,2015(7):1082-1090. doi:10.13592/j.cnki.ppj.2015.0029.
Ma L F,Li Z T,Yang K J,Zhao C J,Xu J Y,Yang R B,Yu G B,Zhao Y,Shi X X,Xu Y M,Liu C,Yan B W. Effects of submergence on growth and antioxidant enzymes activities of sensitive rice(Oryza sativa)seedlings [J]. Acta Physiologica Sinica,2015(7):1082-1090.
[9] 潘澜,薛立. 植物淹水胁迫的生理学机制研究进展[J]. 生态学杂志,2012,31(10):2662-2672.doi:1000-4890(2012)10-2662-11.
Pan W,Xue L. Plant physiological mechanisms in adapting to waterlogging stress:A review[J]. Chinese Journal of Ecology,2012,31(10):2662-2672.
[10] 田志环. 淹涝胁迫对水稻影响的研究进展[J]. 安徽农业科学,2008,36(1):143-145. doi:10.3969/j.issn.0517-6611.2008.01.043.
Tian Z H. Research advance of the influence of submergence stress on rice [J]. Anhui Agricultural Sciences,2008,36(1):143-145.
[11] Fu K T,Bailey S J. Submergence tolerance conferred by sub1a is mediated by slr1 and slrl1 restriction of gibberellin responses in rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105(43):16814-16819.doi:10.1073/pnas.0807821105.
[12] Fu K T,Xu K,Ronald P C,Bailey S J. A variable cluster of ethylene response factor like genes regulates metabolic and developmental acclimation responses to submergence in rice[J]. Plant Cell,2006,18(8):2021-2034. doi:10.1105/tpc.106.043000.
[13] Nandi S,Subudhi P K,Senadhira D,Manigbas N L,Sen-Mandi S,Huang N. Mapping QTLs for submergence tolerance in rice by AFLP analysis and selective genotyping[J]. Molecular & General Genetics Mgg,1997,255(1):1. doi:10.1007/s004380050468.
[14] Endang M S, Alvaro M P, Darlene L S, Chirravuri N N, Georgina V V, Sigrid H, Abdelbagi M I, David J M. Development of submergence-tolerant rice cultivars:the Sub1 locus and beyond[J]. Annals of Botany,2009,103(2):151-160. doi:10.1093/aob/mcn206.
[15] Toojinda T,Siangliw M,Tragoonrung S,Vanavichit A. Molecular genetics of submergence tolerance in rice:QTL analysis of key traits[J]. Annals of Botany,2003,91(2):243-253. doi:org/10.1093/aob/mcf072.
[16] Arnao,Marino B,Hern ndezruiz. Melatonin:plant growth regulator and/or biostimulator during stress?[J]. Trends in Plant Science,2014,19(12):789-797. doi:10.1016/j.wasman. 2016. 06.040.
[17] 赵燕,王东华,赵曦阳. 植物中褪黑素的研究进展[J]. 西北植物学报,2014,34(1):196-205. doi:10.7606/j.issn.1000-4025.2014.01.0196.
Zhao Y,Wang D H,Zhao Y Y. Recent advance on the melatonin in plants[J]. Northwest Botanical Journal,2014,34(1):196-205.
[18] Hern ndezruiz J,Cano A,Arnao M B. Melatonin:a growth-stimulating compound present in lupin tissues.[J]. Planta,2004,220(1):140-144. doi:10.1007/s00425-004-1317-3.
ndezruiz J,Cano A,Arnao M B. Melatonin:a growth-stimulating compound present in lupin tissues.[J]. Planta,2004,220(1):140-144. doi:10.1007/s00425-004-1317-3.
[19] Kim M,Seo H,Park C,Park W J. Examination of the auxin hypothesis of phytomelatonin action in classical auxin assay systems in maize[J]. Journal of Plant Physiology,2016,190:67-71. doi:10.1016/j.jplph.2015.11.009.
[20] Zhang N,Sun Q Q,Zhang H J,Cao Y Y,Weeda S,Ren S X,Guo Y D. Roles of melatonin in abiotic stress resistance in plants[J]. Journal of Experimental Botany,2015,66(3):647. doi:10.1093/jxb/eru336.
[21] 王蕊,杨小龙,须晖,李天来. 高等植物褪黑素的合成和代谢研究进展[J]. 植物生理学报,2016,52(5):615-627. doi:10.13592/j.cnki.ppj.2016.0052.
Wang R,Yang X L,Xu H,Li T L. Research progress of melatonin biosynthesis and metabolism in higher plants[J]. Acta Physiologica Sinica,2016,52(5):615-627.
[22] 徐芳,周海鹏,郭早霞,于宏安,袁玉川,巩智刚,王玉华. 植物褪黑素及其抗逆性研究[J]. 基因组学与应用生物学,2013,32(2):260-266. doi:10.3969/gab.032.000260.
Xu F,Zhou H P,Guo Z X,Yu H A,Yuan Y C,Gong Z G,Wang Y H. The Melatonin and its resistance to stress in plants [J]. Genomics and Applied Biology,2013,32(2):260-266.
[23] Tan D X,Hardeland R,Manchester L C,Korkmaz A,Ma S,Rosales-Corral S,Reiter R J. Functional roles of melatonin in plants,and perspectives in nutritional and agricultural science[J]. Journal of Experimental Botany,2012,63(2):577. doi:10.1093/jxb/err256.
[24] 叶君,邓西平,王仕稳,殷俐娜,陈道钳,熊炳霖,王鑫月. 干旱胁迫下褪黑素对小麦幼苗生长、光合和抗氧化特性的影响[J]. 麦类作物学报,2015,35(9):1275-1283. doi:10.7606/j.issn.1009-1041.2015.09.15.
Ye J,Deng X P,Wang S W,Yin L N,Chen D Q,Xiong B L,Wang X Y. Effects of melatonin on growth,photosynthetic characteristics and antioxidant system in seedling of wheat under drought stress [J]. Journal of Triticeae Crops,2015,35(9):1275-1283.
[25] Wang P,Yin L,Liang D,Li C,Ma F,Yue Z. Delayed senescence of apple leaves by exogenous melatonin treatment:toward regulating the ascorbate-glutathione cycle[J]. Journal of Pineal Research,2012,53(1):11-20. doi:10.1111/j.1600-079x.2011.00966.x.
[26] Arnao M B,Hern ndez R J. Melatonin promotes adventitious and lateral root regeneration in etiolated hypocotyls of Lupinus albus L. [J]. Journal of Pineal Research,2007,42(2):147-152. doi:10.1111/j.1600-079X.2006.00396.x.
[27] Lei X Y,Zhu R Y,Zhang G Y,Dai Y R. Attenuation of cold-induced apoptosis by exogenous melatonin in carrot suspension cells:the possible involvement of polyamines[J]. Journal of Pineal Research,2010,36(2):126-131. doi:10.1046/j.1600-079X.2003.00106.x.
[28] Park S,Byeon Y,Back K. Functional analyses of three ASMT gene family members in rice plants[J]. Journal of Pineal Research,2013,55(4):409-415. doi:10. 1111/jpi.12088.
[29] Reiter R J,Tan D X,Zhou Z,Cruz M H,Fuentes B L,Galano A. Phytomelatonin:assisting plants to survive and thrive[J]. Molecules,2015,20(4):7396-7437. doi:10.3390/molecules20047396.
[30] 张娜,蒋庆,李殿波,蔡林桐,张海军,司文君,范希峰,郭仰东. 外源施加褪黑素对NaCl胁迫下狼尾草种子萌发及相关生理指标的影响[J]. 中国农业大学学报,2014,19(3):54-60. doi:10.11841/j.issn.1007-4333.2014.04.08.
Zhang N,Jiang Q,Li D B,Cai L T,Zhang H J,Si W J,Fan X F,Guo Y D. Effect of exogenous melatonin on germination of Pennisetum alopecuroides under NaCl stress [J]. Journal of China Agricultural University,2014,19(3):54-60.
[31] 高青海,贾双双,苗永美,陆晓民,李慧敏. 亚低温条件下外源褪黑素对甜瓜幼苗氮代谢及渗透调节物质的影响[J]. 应用生态学报,2016,27(2):519-524. doi:10.13287/j.1001-9332. 201602.016.
Gao Q H,Jia S S,Miao Y M,Lu X M,Li H M. Effects of exogenous melatonin on nitrogen metabolism and osmotic adjustment substances of melon seedlings under sub-low temperature. [J]. Chinese Journal of Applied Ecology,2016,27(2):519-524.
[32] 吴丽华,陈燕飞,陈鹏,仪慧兰. 亚砷酸钠对酵母细胞抗氧化酶活性和脂质过氧化的影响[J]. 生态毒理学报,2016,11(3):302-307. doi:10.7524/AJE.1673-5897.20151105001.
Wu L H,Chen Y F,Chen P,Yi H L. Sodium arsenite exposure affects the levels of antioxidant enzymes and lipid peroxidation in Saccharomyces cerevisiae [J]. Journal of Ecotoxicology,2016,11(3):302-307.
[33] Ren X,Pan L,Wang L. Toxic effects upon exposure to benzo[a]pyrene in juvenile white shrimp Litopenaeus vannamei[J]. Environ Toxicol Pharmacol,2015,39(1):194-207. doi:10.1016/j.etap.2014.08.006.
[34] Upadhyay R K. Oxidative injury and its detoxification in rice plants after submergence stress[J]. Proceedings of the National Academy of Sciences India,2016,88(5):1-7. doi:10.1007/s40011-016-0724-0.
[35] Zhang H J,Zhang N,Yang R C,Wang L,Sun Q Q,Li D B,Cao Y Y,Weeda S,Zhao B,Ren S,Guo Y D. Melatonin promotes seed germination under high salinity by regulating antioxidant systems,ABA and GA4 interaction in cucumber(Cucumis sativus L.)[J]. Journal of Pineal Research,2015,57(3):269-279. doi:10.1111/jpi.12167.
[36] 刘仕翔,黄益宗,罗泽娇,黄永春,保琼莉,王培培,袁彪,李文华. 外源褪黑素处理对镉胁迫下水稻种子萌发的影响[J]. 农业资源与环境学报,2016,35(6):1034-1041.
Liu S X,Huang Y Z,Luo Z J,Huang Y C,Bao Q L,Wang P P,Yuan B,Li W H. Effects of exogenous melatonin on germination of rice seeds under Cd stresses [J]. Journal of Agricultural Resources and Environment,2016,35(6):1034-1041. doi:10.11654/jaes.2016.06.003.
[37] 熊怀阳,阳菁,安保光. 水稻适应淹水胁迫的分子机理及品种改良[J]. 武汉大学学报:理学版,2013,59(1):17-23.doi:1671-8836(2013)01-0017-07.
Xiong H Y,Yang J,An B G. Molecular mechanism of rice adaptation and improvement strategies to submergence stress [J]. Journal of Wuhan University,2013,59(1):17-23.
[38] Kanazawa S,Sano S,Koshiba T,Ushimaru T. Changes in antioxidative enzymes in cucumber cotyledons during natural senescence:comparison with those during dark-induced senescence[J]. Physiologia Plantarum,2010,109(2):211-216. doi:10.1034/j.1399-3054. 2000.100214.x.
[39] 张娜. 褪黑素处理对渗透胁迫下黄瓜种子萌发及幼苗生长的影响及其分子机制[D].北京:中国农业大学,2014.
Zhang N. Regulation of melatonin on germination and seedling growth under osmotic stress in cucumber [D]. Beijing:China Agricultural University,2014.