玉米(Zea mays L.)是世界广泛种植的粮食作物,也是工业原料和动物饲料的主要来源。作为一种嗜热作物,玉米发芽的最佳温度为25~28 ℃。黑龙江省种植的春玉米在苗期常遭受10 ℃以下、0 ℃以上的低温冷害,低温冷害(低温和霜冻胁迫)是影响嗜热作物生长发育和产量最严重的环境胁迫之一[1-2]。低温胁迫通常会导致植物的形态、生理生化和分子结构发生变化[3]。当植物暴露在低于12 ℃的不冻温度一段时间,且超过临界期时,会发生一种被称为“低温损伤”的生理机能障碍[4-5]。然而,低温伤害的症状主要包括生长和光合能力下降、叶片坏死和变色、植株异常成熟和对疾病易感性的增加。
油菜素内酯(Brassinolide,BR),别名芸苔素内酯,是一类多羟基化的固醇类新型植物激素,在植物界广泛存在。它们在植物的细胞分裂、细胞伸长、脉管分化、花粉管生长、细胞衰老、基因调控、蛋白质与核酸生物合成和光合作用[6-7]等多种植物活动中具有不同的生理作用。一般来说,非生物胁迫可以引发植物体内如过氧化氢(H2O2)、单线态氧(1O2)等活性氧(ROS)物质的积累,从而增加植物的氧化应激反应[8];同时还可以增加植物的脯氨酸、甜菜碱、可溶性蛋白和可溶性糖含量[9-10],从而增强植物体对胁迫反应的抵抗能力。自从Hamada[11]首次报道油菜素内酯对植物非生物胁迫有改善作用以来,许多研究人员对油菜素内酯的作用进行了研究。大多数研究都集中在缓解或减轻温度或盐度胁迫的损伤。例如,油菜素内酯可以提高番茄[12]和水稻[13]的耐热性;在低温胁迫下油菜素内酯也被证实对辣椒[14]和茄子[15]有积极的作用。在水稻中,油菜素内酯增强了水稻幼苗抗低温损伤能力,并在低温条件下增加了水稻的株高、根长、根生物量和总生物量[16]。李淑叶等[17]应用2,4表油菜素内酯可以显著降低低温胁迫下棉花叶片相对电导率,显著提高光系统Ⅱ最大光化学效率,增加了总叶绿素的含量。
本研究中试验材料选取黑龙江省主栽玉米杂交品种天农九号和天和1号,在低温(芽期6 ℃,苗期4 ℃)和常温条件下,通过芽期浸种和苗期叶面喷施不同质量浓度的油菜素内酯溶液,研究不同质量浓度的油菜素内酯在低温胁迫下分别对玉米发芽和幼苗生理特性的调控,探究油菜素内酯不同浓度效应对玉米发芽及幼苗抗冷性的影响,为玉米抗低温逆境栽培提供参考依据。
1 材料和方法
1.1 试验材料与地点
供试品种为玉米杂交种天农九号、天和1号,由黑龙江省农业科学院提供;供试药剂油菜素内酯(Brassinolide)购自合肥博美生物科技公司。
1.2 试验设计
试验于2018年5月在东北农业大学农学院低温人工气候室盆栽进行。
芽期:选择饱满且大小一致种子,每个重复选取30粒种子,3次重复,用0.5%次氯酸钠(NaClO)溶液消毒种子3 min,然后用水冲洗3次,分别用质量浓度为0(T0),0.01(T1),0.100(T2),1.00 mg/L(T3)的油菜素内酯浸种24 h,用蒸馏水(CK)作为常温对照。转入垫有湿润滤纸的培养皿上,培养皿中水层深度为1 mm。低温发芽温度设置为6 ℃,常温对照为25 ℃。黑暗条件下萌发,逐天统计发芽率。
苗期:选择饱满且大小一致种子,用0.5% NaClO溶液消毒种子3 min,然后用水冲洗3次,蒸馏水浸种24 h于培养钵(90 mm×100 mm)内点播,土质为草碳土。每个处理保苗200棵,3次重复。玉米幼苗培养至三叶一心期,在上午同一时间分别用质量浓度为0(T0),0.01(T1),0.10(T2),1.00 mg/L(T3)的油菜素内酯进行叶面喷施处理1次,每株喷施量相同,约为10 mL,用蒸馏水(CK)作为常温对照。叶面喷施待常温培养24 h后,低温处理组放入4 ℃低温光照培养箱培养2 d(Percival I-36VL美国,光强为100~560 μmol/(m2·s),光照时数12 h,RH = 80%)。常温对照处理(CK)转入25 ℃ 培养箱正常生长,其他设置与低温处理组相同。低温处理结束后取代表性植株测定生理生化指标。
1.3 测定指标与方法
1.3.1 种子发芽率测定 种子发芽率![]()
1.3.2 幼苗干鲜质量、株高及根长测量 低温处理后立即取同位展开叶测定相关指标。随机选取5株幼苗,用刻度为1 mm的直尺测量株高和根长,算取5株平均值;用精度为0.001的电子天平(JA2603B型,上海精密科学仪器有限公司,中国)准确称量植株地上部和地下部鲜质量;植株置于烘干箱105 ℃杀青30 min后,置于80 ℃下烘至恒质量测定样品干质量。
1.3.3 生理指标测定 SPAD值于上午09:00-12:00利用叶绿素计SPAD-520Plus,选取距离生长点第2片完全展开叶,进行SPAD值测定,每片叶片选取上、中、下分别读数取平均值,每个处理重复3次。
相对电导率的测量,采用Mmettler Toledo FE30电导率仪进行测定,取新鲜叶,用蒸馏水洗净吸干水分,用叶片打孔器打成小片状,放入100 mL三角瓶中,加入20 mL蒸馏水,室温放置24 h后测定电导率L1,随后转入水浴锅中沸水浴20 min,冷却至室温后测定电导率L2。相对电导率=L1/L2×100%。
丙二醛(MDA)含量(以鲜质量计)采用硫代巴比妥酸(TBA)法测定[18],称取叶片0.5 g,加TCA冰浴研磨至匀浆,离心取上清液加入TBA,混匀后在沸水浴中煮沸,冷却后离心。上清液利用分光光度计(PERSEE,中国北京)分别测定在450,532,600 nm处的OD值;超氧化物歧化酶(SOD)活性采用氮蓝四唑法测定[19],反应混合物包括磷酸盐缓冲液(pH值7.8)、蛋氨酸、NBT、EDTA-Na2、酶提取液,4 000 lx照光后以空白调零,560 nm测量吸光值;过氧化物酶(POD)活性(以鲜质量计)采用愈创木酚混合液在470 mm下比色测定[20];过氧化氢酶(CAT)活性(以鲜质量计)采用紫外吸收法测定[18];采用酸性茚三酮法测定脯氨酸(Pro)含量(以鲜质量计);采用考马斯亮蓝G-250法测定可溶性蛋白含量;采用蒽酮比色法测定可溶性糖含量。
1.4 数据统计与分析
利用Microsoft Excel 2016作图,SPSS 22 软件进行统计分析,对各项生理生化指标进行差异显著性检验,用 Duncan′s 新复极差法进行多重比较,P<0.05。
2 结果与分析
2.1 低温胁迫下不同质量浓度BR浸种对玉米发芽的影响
由图1可以看出,低温胁迫明显降低两玉米种子的发芽率。使用不同质量浓度的BR浸种处理,不同玉米品种的发芽率差异显著。低温胁迫下天农九号在常温CK处理中3 d全部发芽;在低温胁迫下T0、T1和T3处理中第10天开始发芽,第24天结束发芽;各处理起始和结束发芽率分别为7.78%,13.33%,10.00%和93.33%,96.67%,98.89%。T2处理第10天开始发芽,第18天结束发芽,且起始和结束发芽率分别为26.67%和100.00%。天和1号在常温CK处理中第3天开始发芽,第6天全部发芽;在低温胁迫下T0、T1和T3处理中第10天开始发芽,第24天结束发芽;各处理起始和结束发芽率分别为8.89%,12.22%,14.44%和66.67%,60.00%,80.00%。T2处理第10天开始发芽,第24天结束发芽,且起始和结束发芽率分别为20.00%和85.56%。BR浸种处理可以明显缩短低温胁迫下玉米发芽时间,且T1、T2、T3浸种浓度明显提高玉米种子低温发芽率,其中T2浓度效果最好。天农九号在T2浓度浸种处理下,起始和结束发芽率分别比常温CK处理降低73.33,0百分点;比低温T0处理增加18.89,6.67百分点。天和1号在T2浓度浸种处理下,起始和结束发芽率分别比常温CK处理降低80.00,14.44百分点;比低温T0处理增加11.10,18.89百分点。结果表明,在低温胁迫下,T2处理为缓解低温抑制种子发芽的最适浓度;其中天农九号对低温抵抗能力大于天和1号。
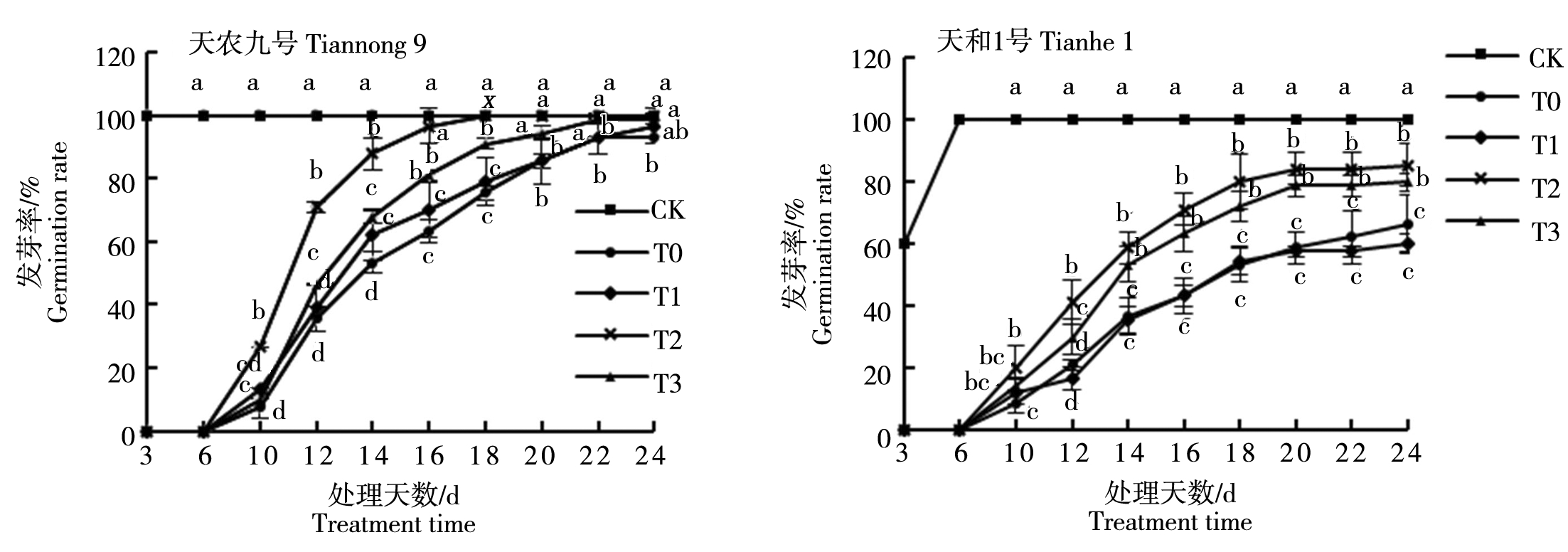
字母a、b、c、d表示各处理在0.05水平上差异显著。图2-6同。
The letters a,b,c and d indicate that the treatment differs significantly at the 0.05 level. The same as Fig.2-6.
图1 不同质量浓度BR浸种对种子发芽率的影响
Fig.1 The effects of different concentrations of brassinolide impregnation on seed germination rate
2.2 低温胁迫下不同质量浓度BR对玉米幼苗干鲜质量、株高及根长的影响
由表1可知,2个玉米品种在常温(25 ℃)和低温胁迫(4 ℃)处理下,经3种不同浓度(T1、T2、T3)BR喷施处理后,玉米幼苗农艺性状变化明显。低温胁迫可以明显降低玉米幼苗的株高、根长和地上、下部干鲜质量。低温胁迫下,T1、T2、T3叶喷处理明显缓解了低温对幼苗的生长抑制作用。低温胁迫下两玉米幼苗的株高明显低于常温CK处理,随着喷施处理浓度的增加,幼苗株高呈先上升后下降的趋势。两品种幼苗株高均在T2处理时最高,株高分别为32.50,34.76 cm,分别比低温T0处理增加20.07%,18.93%。低温胁迫下两玉米幼苗的根长明显低于常温CK处理,随着喷施处理浓度的增加,幼苗根长呈先上升后下降的趋势。两品种幼苗根长均在T2处理时最长,根长分别为26.30,32.83 cm,分别比低温T0处理增加41.40%,64.15%。同样的趋势也在地上、下部干鲜质量中被证实。天农九号和天和1号在T2处理时,地上部鲜质量和干质量分别比低温T0处理增加44.15%,55.92%和57.65%,49.15%;地下部鲜质量和干质量分别比低温T0处理增加32.04%,38.79%和49.87%,14.26%。结果表明,在试验浓度范围内,T2浓度为缓解低温胁迫对幼苗农艺性状伤害的最适浓度,且不同品种间存在差异;该处理浓度对天农九号地上部缓解能力大于天和1号,反之对天和1号地下部缓解能力大于天农九号。
表1 不同质量浓度BR对玉米幼苗干鲜质量、株高及根长的影响
Tab.1 The effects of different concentrations of brassinolide on dry weight,fresh weight, plant height and root length of maize seedlings
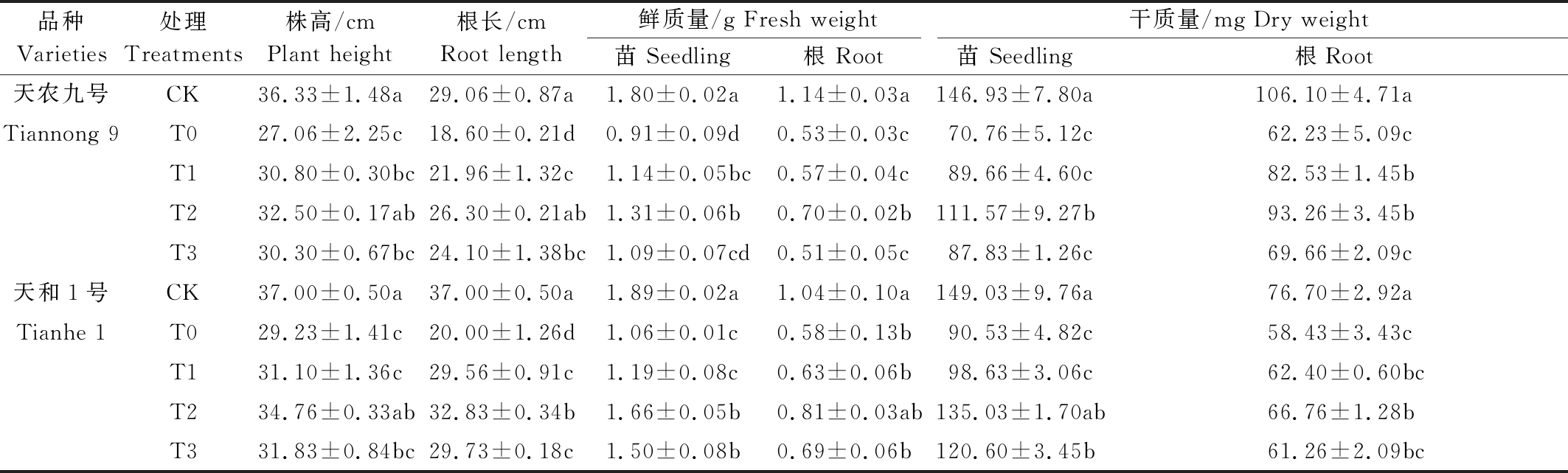
品种Varieties处理Treatments 株高/cmPlant height 根长/cm Root length鲜质量/g Fresh weight干质量/mg Dry weight苗 Seedling根 Root苗 Seedling 根Root天农九号CK36.33±1.48a29.06±0.87a1.80±0.02a1.14±0.03a146.93±7.80a106.10±4.71aTiannong 9T027.06±2.25c18.60±0.21d0.91±0.09d0.53±0.03c70.76±5.12c62.23±5.09cT130.80±0.30bc21.96±1.32c1.14±0.05bc0.57±0.04c89.66±4.60c82.53±1.45bT232.50±0.17ab26.30±0.21ab1.31±0.06b0.70±0.02b111.57±9.27b93.26±3.45bT330.30±0.67bc24.10±1.38bc1.09±0.07cd0.51±0.05c87.83±1.26c69.66±2.09c天和1号CK37.00±0.50a37.00±0.50a1.89±0.02a1.04±0.10a149.03±9.76a76.70±2.92aTianhe 1T029.23±1.41c20.00±1.26d1.06±0.01c0.58±0.13b90.53±4.82c58.43±3.43cT131.10±1.36c29.56±0.91c1.19±0.08c0.63±0.06b98.63±3.06c62.40±0.60bcT234.76±0.33ab32.83±0.34b1.66±0.05b0.81±0.03ab135.03±1.70ab66.76±1.28bT331.83±0.84bc29.73±0.18c1.50±0.08b0.69±0.06b120.60±3.45b61.26±2.09bc
注:同列数据不同小写字母表示在5%水平上差异显著。
Note:Different lowercase letters in each column means significant difference at 0.05 level.
2.3 低温胁迫下不同质量浓度BR对玉米幼苗SPAD值的影响
光合作用是植物生长和有机物积累的主要过程,叶绿素含量是评估光合能力的标准,而SPAD值可以直观地反映植物叶片的叶绿素含量。由图2可知,两玉米品种在低温胁迫下,SPAD值显著低于常温CK处理。经3种不同质量浓度(T1、T2、T3)BR喷施处理后,可以明显缓解低温对玉米幼苗SPAD值的降低程度;随着喷施浓度的增加,幼苗SPAD值呈先上升后下降的趋势,且不同浓度的BR处理对两品种SPAD值影响不同,其中T2处理时达到最大值。在低温胁迫下,T0处理的天农九号和天和1号的SPAD值分别比常温CK处理降低19.59%和21.74%,下降幅度天和1号>天农九号;T2处理的天农九号和天和1号的SPAD值分别比低温T0处理增加12.57%和18.88%。结果表明,喷施BR能够明显缓解低温胁迫对玉米幼苗SPAD值的降低,T2处理浓度效果最好;且不同品种间存在差异,天和1号对低温胁迫更敏感,低温喷施BR处理后叶绿素缓解能力天和1号>天农九号。
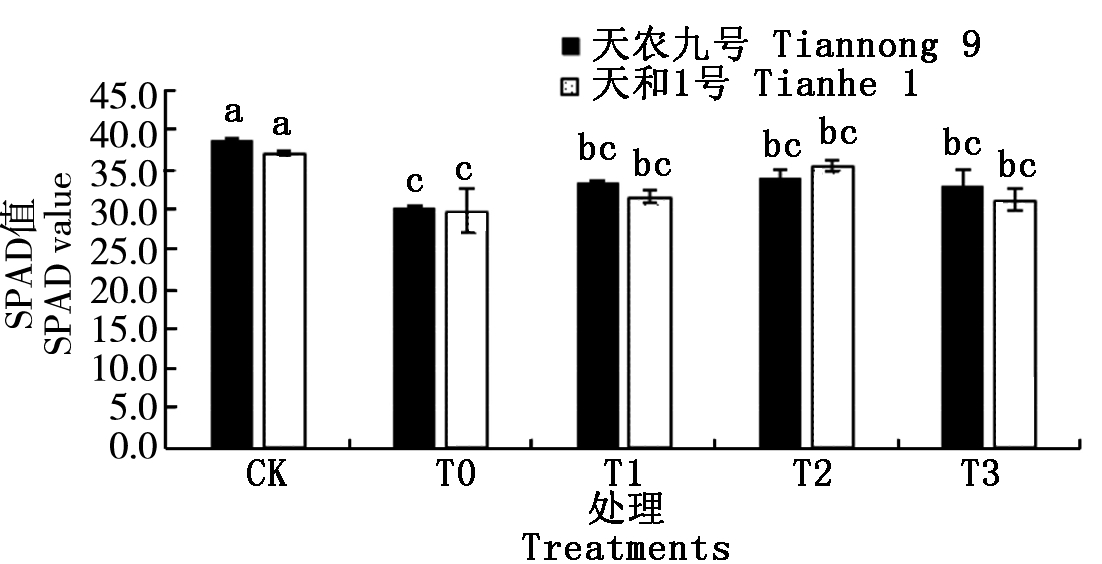
图2 不同质量浓度BR对幼苗SPAD的影响
Fig.2 The effects of different concentrations of brassinolide on SPAD value
2.4 低温胁迫下不同质量浓度BR对玉米幼苗相对电导率的影响
植物在低温胁迫下,通常细胞膜最先接触胁迫环境,相对电导率的高低可以直接反映植物细胞膜的损伤程度。不同质量浓度BR处理对低温胁迫下玉米幼苗相对电导率的影响如图3所示。在低温胁迫下,两玉米品种叶片相对电导率显著高于常温CK处理。经3种不同质量浓度(T1、T2、T3)BR喷施处理后,可以明显降低低温胁迫下玉米幼苗相对电导率;随着BR喷施浓度的增加,幼苗相对电导率呈单峰曲线先降后升的趋势,其中T2处理时相对电导率达到最小值。在低温胁迫下,T0处理的天农九号和天和1号的相对电导率分别比常温CK处理升高8.58%和9.54%,上升幅度天和1号>天农九号;T2处理较T0处理相对电导率降低,天农九号降低7.33%,天和1号降低6.80%。结果表明,低温BR喷施能够显著缓解玉米幼苗相对电导率升高,T2处理浓度效果最好;不同品种间存在差异,天和1号对低温胁迫更敏感,低温喷施BR处理后相对电导率缓解能力天农九号>天和1号。
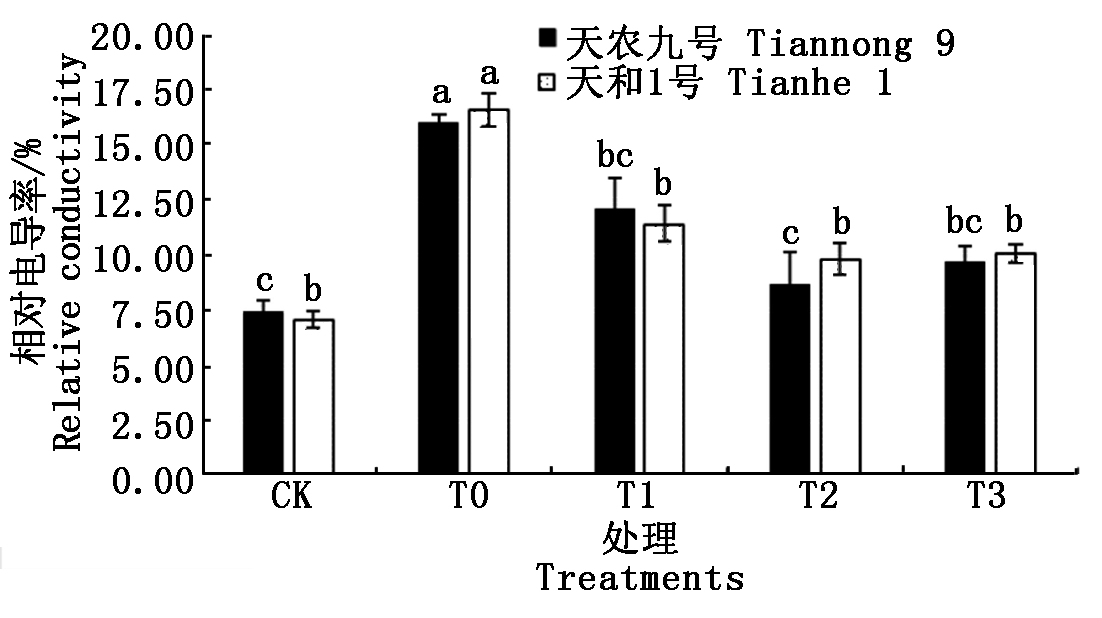
图3 不同质量浓度BR对幼苗相对电导率影响
Fig.3 The effects of different concentrations of brassinolide on relative conductivity
2.5 低温胁迫下不同质量浓度BR对玉米幼苗MDA含量的影响
MDA是细胞膜脂过氧化作用的最终产物,ROS的损伤程度与MDA含量的高低有密切关系,因此,MDA是氧化胁迫的重要参数。由图4可知,在低温胁迫下,两玉米品种叶片中MDA含量(以鲜质量计)高于常温CK处理。经3种不同质量浓度(T1、T2、T3)BR喷施处理后,可以明显缓解低温对玉米幼苗MDA含量的增加程度;随着BR喷施浓度的增加,幼苗MDA含量呈先降后升的趋势,其中T2处理时MDA含量达到最小值。低温胁迫下,T0处理的天农九号和天和1号的MDA含量分别比常温CK处理升高234.04%和267.07%,上升幅度天和1号>天农九号;T2处理的天农九号和天和1号的MDA含量分别比低温T0处理降低35.31%和40.01%。结果表明,喷施BR能够明显缓解低温胁迫对玉米幼苗MDA含量的升高,T2处理效果最好;不同品种间存在差异,低温喷施BR处理后MDA缓解能力天和1号>天农九号。
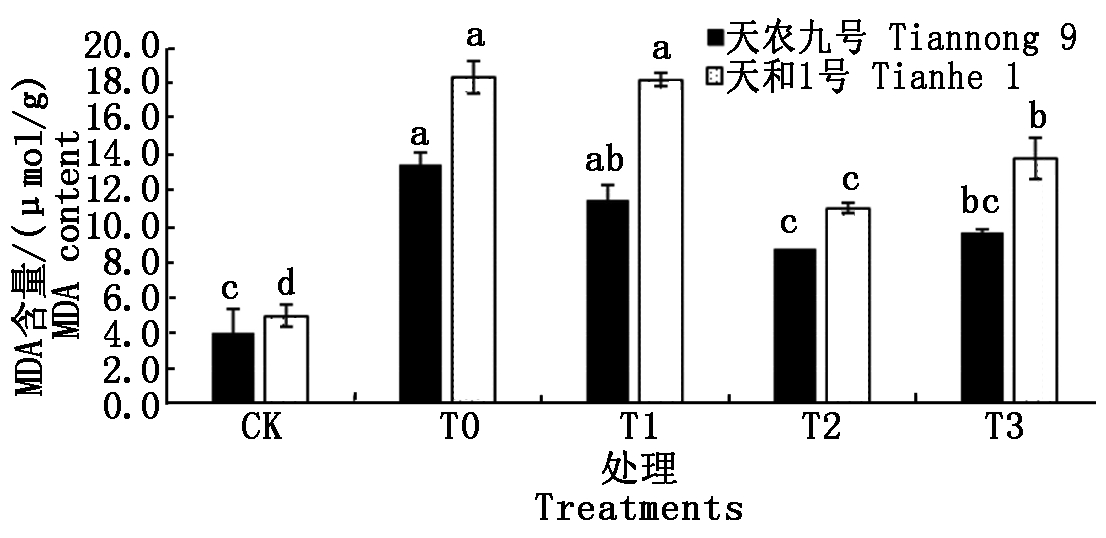
图4 不同质量浓度BR对幼苗MDA含量的影响
Fig.4 The effects of different concentrations of brassinolide on MDA content
2.6 低温胁迫下不同质量浓度BR对玉米幼苗抗氧化酶(SOD、POD、CAT)活性的影响
当植物暴露于低温环境下会产生大量的活性氧(ROS),抗氧化系统控制着ROS的水平并消除它们的不利影响。在该系统中,SOD、POD、CAT等抗氧化酶是胁迫阶段最活跃最有效的保护机制,这些酶被认为是指示生物和非生物胁迫的生物标志物。
SOD催化超氧化物自由基歧化生成H2O2和O2,该酶被认为是控制活性氧产生的第一道防线。从图5-A可以看出,两玉米品种在低温胁迫下SOD活性(以鲜质量计)显著高于常温CK处理。经3种不同质量浓度(T1、T2、T3)BR喷施处理后,可以明显增加低温下玉米幼苗SOD的活性;随着喷施浓度的增加,幼苗SOD活性呈先上升后下降的趋势,且不同浓度的BR处理对两品种SOD活性影响显著,其中T2处理时SOD活性达到最大值。在低温胁迫下,T0处理的天农九号和天和1号的SOD活性分别比常温CK处理升高36.42%和52.39%,上升幅度天和1号>天农九号;T2处理的天农九号和天和1号的SOD活性分别比低温T0处理升高20.68%和35.99%。结果表明,喷施BR能够明显增加低温胁迫下玉米幼苗SOD活性,T2处理浓度效果最好;不同品种间存在差异,天和1号对低温胁迫更敏感,低温喷施BR处理后SOD活性增加能力天和1号>天农九号。
POD是一种双功能酶,在标准过氧化物循环中,可以氧化H2O2等底物,POD可以通过各种分子催化还原H2O2,直接参与ROS的清除。如图5-B所示,两玉米品种在低温胁迫下POD活性(以鲜质量计)显著高于常温CK处理。经3种不同浓度(T1、T2、T3)BR喷施处理后,可以明显增加低温下玉米幼苗POD的活性;随着喷施浓度的增加,幼苗POD活性呈单峰曲线先升后降趋势,不同浓度的BR处理对两品种POD活性影响显著,其中T2处理时POD活性达到最大值。在低温胁迫下,T0处理的天农九号和天和1号的POD活性分别比常温CK处理升高35.97%和64.58%,上升幅度天和1号>天农九号;T2处理的天农九号和天和1号的POD活性分别比低温T0处理升高33.47%和46.28%。结果表明,喷施BR能够明显增加低温胁迫下玉米幼苗POD活性,T2处理浓度效果最好;不同品种间存在差异,低温喷施BR处理后POD活性增加能力天和1号>天农九号。
CAT是含有四聚体血红素的酶,具有直接将H2O2歧化为H2O和O2的潜力,CAT是所有酶中转换率最高的抗氧化酶之一,1个CAT分子每分钟可将600万分子的H2O2转化为H2O和O2,在胁迫条件下对于ROS的清除是必不可少的。如图5-C所示,两玉米品种在低温胁迫下CAT活性高于常温CK处理。经3种不同浓度(T1、T2、T3)BR喷施处理后,可以明显增加低温下玉米幼苗CAT的活性;随着喷施浓度的增加,幼苗CAT活性呈先升后降的趋势,其中T2处理时CAT活性达到最大值。在低温胁迫下,T0处理的天农九号和天和1号的CAT活性分别比常温CK处理升高22.09%和19.23%,上升幅度天农九号>天和1号;T2处理的天农九号和天和1号的CAT活性分别比低温T0处理升高110.58%和120.43%。结果表明,喷施BR能够明显增加低温胁迫下玉米幼苗CAT活性,T2处理度效果最好;不同品种间存在差异,低温喷施浓BR处理后CAT活性增加能力天和1号>天农九号。
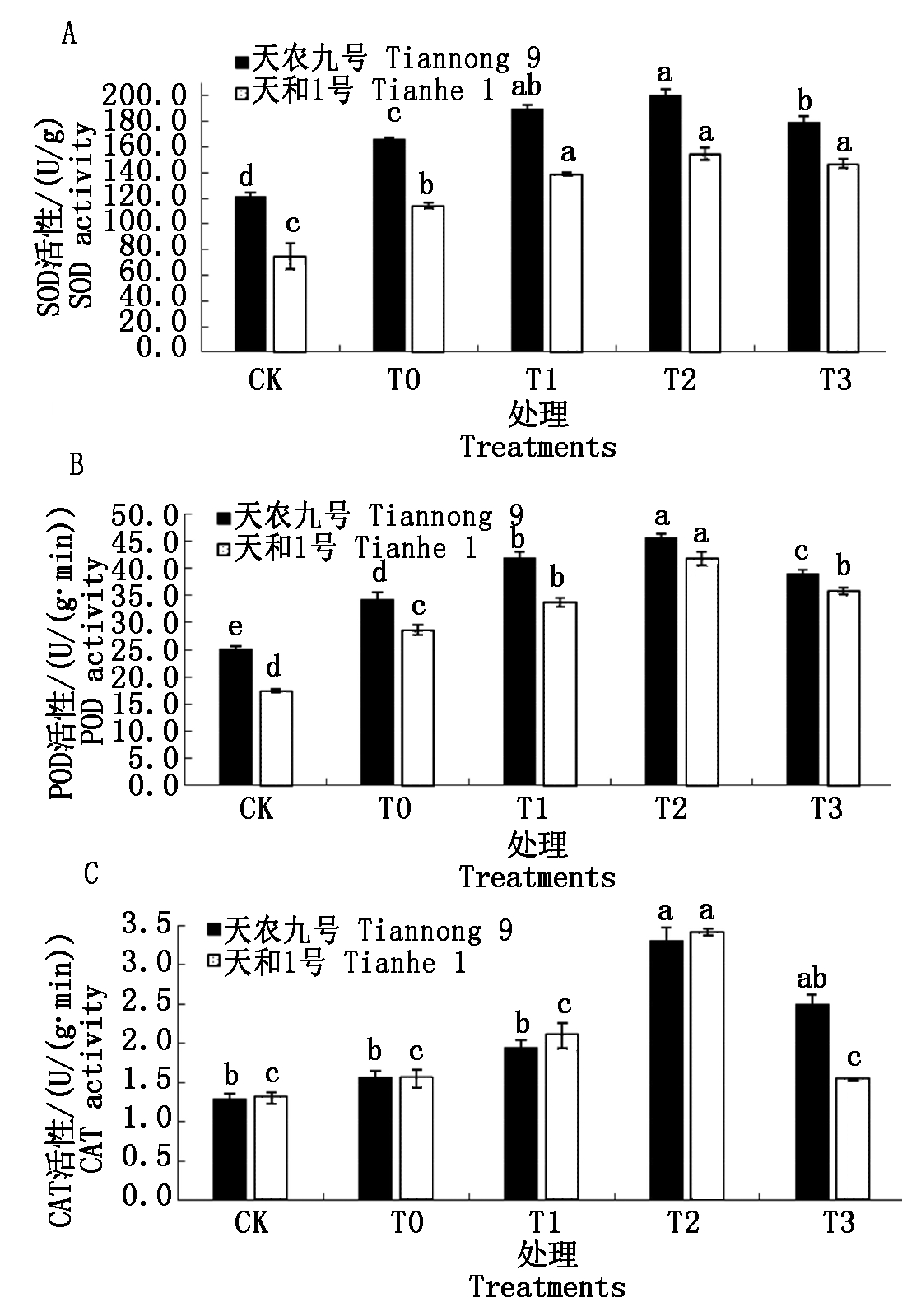
图5 不同质量浓度BR对幼苗抗氧化酶活性的影响
Fig.5 The effects of different concentrations of brassinolide on antioxidant enzyme activity
以上结果表明,喷施BR能够明显增加低温胁迫下玉米幼苗抗氧化酶活性,T2处理浓度为抗氧化酶提高的最适浓度;该浓度对3种抗氧化酶活性的提高幅度不同,分别为CAT活性>POD活性>SOD活性。
2.7 低温胁迫下不同质量浓度BR对玉米幼苗渗透调节物质的影响
低温胁迫下植物会产生过量ROS,超过细胞的整体抗氧化潜能,导致氧化胁迫,对植物生长产生不利影响,因此,植物会积累大量如Pro、可溶性糖、可溶性蛋白等低分子质量、高可溶性的有机化合物。这些化合物通常无毒,溶质通过促进细胞渗透调节、解毒活性氧、保护膜的完整性和酶的稳定性,进而保护植物免受低温胁迫的伤害。
Pro是一种氨基酸,其含量与植物胁迫之间存在正相关关系。它可以通过维持细胞膨胀或渗透平衡来赋予植物胁迫耐受性,从而稳定膜结构,防止电解质泄漏,使活性氧的浓度在正常范围内,在植物胁迫中发挥着重要作用。如图6-A所示,两玉米品种在低温胁迫下Pro含量高于常温CK处理。经3种不同质量浓度(T1、T2、T3)BR喷施处理后,玉米幼苗中Pro的含量显著增加;随着喷施浓度的增加,幼苗中Pro含量呈先升后降的趋势,不同浓度的BR处理对两品种Pro含量影响显著,其中T2处理时Pro含量达到最大值。在低温胁迫下,T0处理的天农九号和天和1号的Pro含量分别比常温CK处理升高8.17%和6.76%,上升幅度天农九号>天和1号;T2处理的天农九号和天和1号的Pro含量分别比低温T0处理升高66.59%和54.63%。结果表明,喷施BR能够明显增加低温胁迫下玉米幼苗Pro含量,T2处理浓度效果最好;不同品种间存在差异,低温喷施BR处理后Pro含量增加能力天农九号>天和1号。
可溶性糖作为相容性的溶质在植物抗低温过程中起着关键作用。随着低温胁迫的进行,植物体内的可溶性糖会不断累积,通过与脂质相互作用,保护细胞膜免受脱水和低温的伤害。如图6-B所示,两玉米品种在低温胁迫下可溶性糖含量显著高于常温CK处理。经3种不同质量浓度(T1、T2、T3)BR喷施处理后,可增加低温下玉米幼苗可溶性糖含量;随着BR施用浓度增加,幼苗可溶性糖含量呈单峰曲线先升后降的趋势,且两品种不同浓度的BR处理可溶性糖含量变化显著,其中T2处理时可溶性糖含量达到最大值。在低温胁迫下,T0处理的天农九号和天和1号的可溶性糖含量分别比常温CK处理升高15.98%和29.88%,上升幅度天和1号>天农九号;T2处理的天农九号和天和1号的可溶性糖含量分别比低温T0处理升高39.78%和58.51%。结果表明,低温胁迫下喷施BR能够显著增加玉米幼苗可溶性糖含量,T2处理浓度效果最好;不同品种间存在差异,天和1号对低温胁迫更敏感,低温喷施BR处理后可溶性糖含量增加能力天和1号>天农九号。
研究表明,可溶性蛋白的积累与植物冷冻或低温胁迫的耐受性呈正相关,能参与维持细胞稳定性。如图6-C所示,两玉米品种在低温胁迫下可溶性蛋白含量显著高于常温CK处理。经3种不同质量浓度(T1、T2、T3)BR喷施处理后,可以增加低温下玉米幼苗可溶性蛋白的含量;随BR喷施浓度的增加,幼苗可溶性蛋白含量呈先升后降的趋势,且不同浓度的BR处理对两品种可溶性蛋白含量影响显著,其中T2处理时可溶性蛋白含量达到最大值。在低温胁迫下,T0处理的天农九号和天和1号的可溶性蛋白含量分别比常温CK处理升高36.38%和18.97%,上升幅度天农九号>天和1号;T2处理的天农九号和天和1号的可溶性蛋白含量分别比低温T0处理升高33.52%和12.88%。结果表明,喷施BR能够显著增加低温胁迫下玉米幼苗可溶性蛋白含量,T2处理浓度效果最好;不同品种间存在差异,低温喷施BR处理后可溶性蛋白含量增加能力天农九号>天和1号。
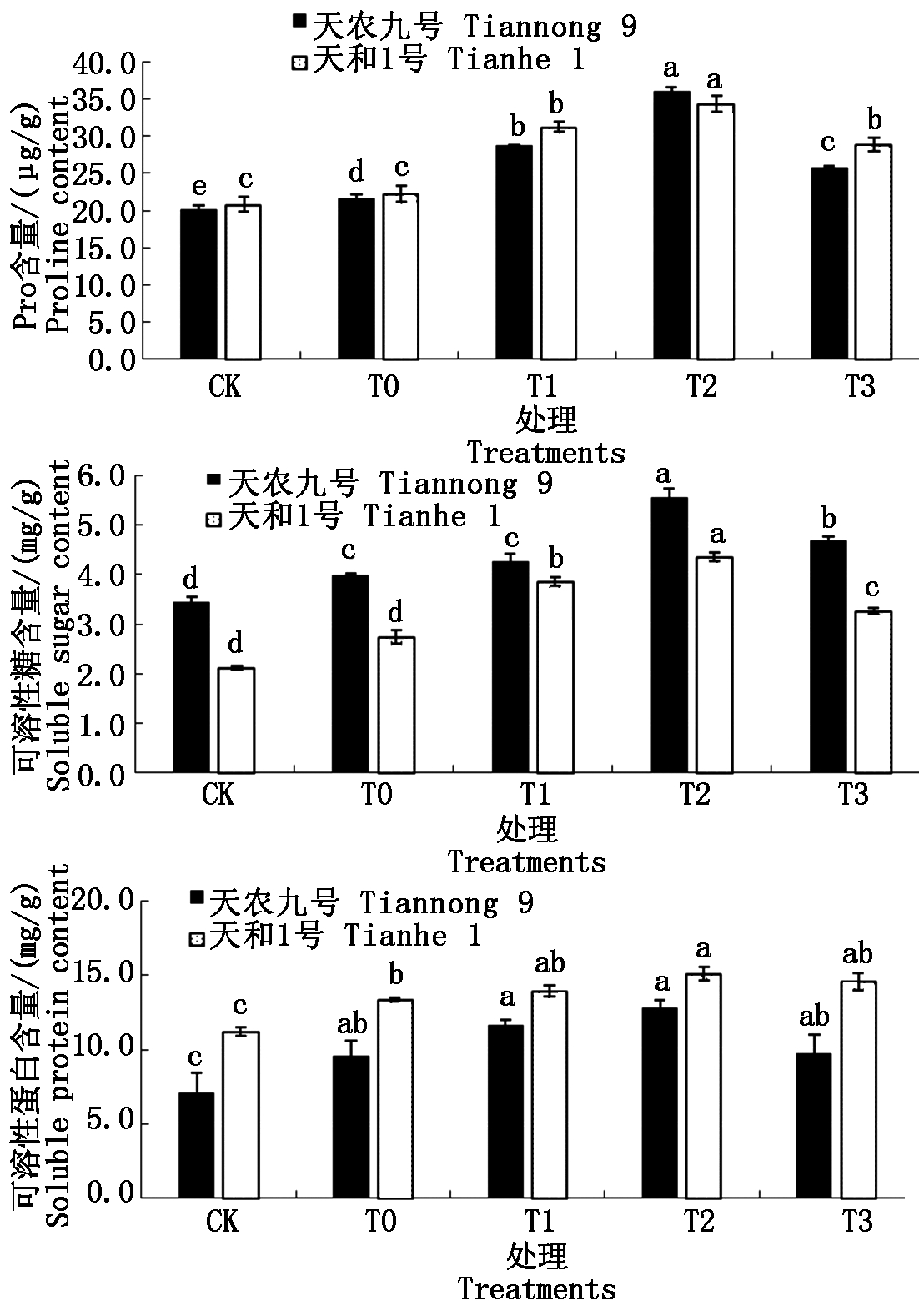
图6 不同浓度BR对幼苗脯氨酸、 可溶性糖和可溶性蛋白含量的影响
Fig.6 The effects of different concentrations of brassinolide on proline and soluble sugar and soluble protein content
以上结果表明,喷施BR能够明显增加低温胁迫下玉米幼苗渗透调节物质含量,T2处理为渗透调节物质提高的最适浓度;该质量浓度对3种渗透调节物质含量的提高幅度不同,分别为Pro含量>可溶性糖含量>可溶性蛋白含量。
3 结论与讨论
玉米生长的最佳温度为25~28 ℃,适用于种子萌发、芽伸长、叶片扩张和干物质积累等过程[21-24]。种子萌发和早期幼苗生长是玉米对环境胁迫最敏感的阶段[25]。低温不利于玉米种子萌发和早期发育,明显延长种子萌发和出苗的平均时间,从而影响作物生长和产量。本研究发现,两玉米品种经低温胁迫处理后,发芽时间明显延长,发芽率显著降低,且不同品种发芽延长时间差异显著,这也和前人的研究结果相似[26-28]。经不同质量浓度的BR浸种处理后,可以明显缓解低温胁迫对两玉米品种发芽的抑制作用,在马金虎[29]的研究中也证实了这一点。本研究在试验范围内筛选出玉米低温发芽的最适宜BR处理质量浓度T2(0.1 mg/L),该处理能显著降低低温胁迫对玉米发芽的抑制作用,T3处理优于T1处理;T2处理的天农九号在低温胁迫下发芽提前6 d,天和1号没有提前发芽,但明显提高了终日发芽率,说明天农九号比天和1号抗低温发芽能力强。
低温对植物的影响是多方面的,在植物幼苗生长阶段,低温可导致复杂的细胞功能障碍症状,如萎蔫、生长抑制、黄化甚至死亡。在生长发育的不同阶段,不同组织对低温的反应有所不同。茎尖对低温非常敏感,其会对叶片的质量增长以及生长速度产生消极影响[30-31]。然而,在其他试验中,茎尖的低温胁迫导致了叶片发育的延迟,但并没有显著影响光合作用的效率[32]。而叶片在低温胁迫下抑制生长现象似乎是由细胞周期持续时间的增加和幼苗在低温胁迫下细胞数量的减少引起的[33]。徐晓昀等[34]研究表明,油菜素内酯可以有效缓解低温造成的黄瓜生物量的下降,可以明显促进干物质的积累;刘巾瑞[35]通过试验证明,BR可以通过调节高粱的生理代谢,增强抵抗低温胁迫的能力;同样的结论也在甘薯、小麦、棉花等作物上得到证实[17,36-37]。本研究中发现,低温明显降低了两玉米幼苗株高、根长和地上、地下部干鲜质量。在试验范围内,叶面喷施3种(T1、T2、T3)质量浓度的BR溶液能够明显改善低温对玉米幼苗农艺性状的抑制现象,其中T2处理效果最显著。马金虎[29]的研究中也筛选出了试验范围内适宜低温胁迫下玉米生长的最适BR浓度。当低于或高于T2浓度时,不同品种的不同组织反应不同。T1与T3处理相比,T1处理时,天农九号的地上部和地下部生长较好;而天和1号表现则不同,地上部和地下部均在T3浓度时生长较好。这样的现象说明不同品种对低温胁迫和BR的适应能力不同,对于冷敏感品种在≥最适浓度下喷施有利于植株幼苗生长,而抗冷性较好的品种在≤最适浓度下喷施有利于植株幼苗生长。
低温胁迫已被公认为植物生长和农业生产的环境限制因素[38]。低温损伤症状的发展,在某种程度上可能是由于植物体内产生大量如超氧自由基、单线态氧、过氧化氢和羟基自由基等活性氧物质,对蛋白质、核酸和细胞膜结构造成损害[39]。Wang等[40]在研究中观察到玉米幼苗在低温胁迫时会明显增强MDA的含量和质膜的渗透性,这意味着玉米幼苗的膜结构受损,溶质和水在细胞内很容易丢失,使细胞的含水量减少,导致幼苗嫩叶萎蔫。本研究发现,两玉米品种经低温胁迫处理后,幼苗相对电导率、MDA含量显著增加,但两品种低温胁迫时表现不同,抗低温生长能力天农九号>天和1号。低温胁迫下叶面喷施3种(T1、T2、T3)质量浓度的BR溶液后,相对电导率和MDA含量有所下降,其中T2浓度处理效果最显著。这也与刘巾瑞[35]发现BR喷施可以降低MDA含量和质膜过氧化作的结果相一致。而本研究还发现,在T3浓度时天农九号和天和1号相对电导率与最适T2处理差异不显著;天农九号在T3浓度时MDA含量与最适T2处理差异不显著。
低温胁迫还会直接影响光合器官,本质上是通过影响光合作用的主要组件,包括类囊体电子传递受阻、脂质过氧化破坏、碳水化合物积累和光合色素的损失[41]。低温胁迫通过扰乱类囊体膜和光合色素从而影响光合作用装置[42-43]。本研究中发现低温胁迫喷施3种(T1、T2、T3)质量浓度的BR溶液后,两品种幼苗的叶绿素含量有所增加,其中T2处理叶绿素含量最高,但3种浓度处理间差异不显著。说明低温胁迫下叶绿素含量的下降不是抑制光合作用的主要因素。而BR是否对类囊体电子传递等过程起到调控作用目前未知。
为了清除活性氧的积累,减少细胞氧化损伤,植物必须刺激相应的抗氧化防御系统,产生如POD、CAT、抗坏血酸过氧化物酶(APX)等酶类[44]和抗坏血酸、谷胱甘肽(GSH) [45-46]等一些非酶的抗氧化剂。Liu等[47]报道BR处理促进高山离子芥植株中抗氧化酶的活性,增加了低温胁迫下Pro和还原型谷胱甘肽的含量,从而清除了过量的ROS;国内也有研究表明,适宜浓度的BR处理可以显著提高草莓叶片的保护酶活性。同样在本研究中也得到相同的结论,低温喷施3种(T1、T2、T3)质量浓度的BR溶液后,可以明显升高低温胁迫下抗氧化酶(SOD、POD、CAT)的活性,其中T2处理效果最显著。而在本研究中还发现,T2浓度BR提高CAT活性的幅度大于其他2种保护酶,这可以印证前人提出的CAT为高效保护酶的观点。抗氧化防御系统在植物抗低温胁迫耐受能力中起着一定作用,同时渗透调节物质也参与提高耐寒能力[48]。而另一类非酶的渗透调节物质如Pro、可溶性蛋白和可溶性糖等含量也会大量增加,从而缓解低温胁迫对植物体造成的伤害。本研究低温胁迫导致玉米幼苗Pro、可溶性糖和可溶性蛋白含量升高,BR喷施处理后提高了上述低温胁迫下3种物质的含量,其中Pro和可溶性蛋白含量上升显著。
综上所述,低温胁迫显著抑制不同玉米品种发芽和幼苗生长,低温下喷施油菜素内酯可以缓解玉米在低温胁迫下受到的损伤。不同质量浓度的油菜素内酯处理对玉米发芽率、农艺性状、叶绿素含量、抗氧化酶和渗透调节物质均有显著影响,0.1 mg/L BR处理条件下对玉米幼苗低温胁迫的缓解效果最显著。
[1] Farooqi M Q,Sa K J,Hong T K,Lee J K. Bulk segregant analysis(BSA)for improving cold stress resistance in maize using SSR markers[J]. Genet Mol Res,2016,15:1-12. doi:10.4238/gmr15049326.
[2] Li Z,Xu J G,Gao Y E,Wang C,Guo G A,Huang Y T,Hu W M,Sheteiwy M S,Hu J. The synergistic priming effect of exogenous salicylic acid and H2O2 on chilling tolerance enhancement during maize(Zea mays L.)seed germination[J].Frontiers in Plant Science,2017,8:1153.doi:10.3389/fpls.2017.01153.
[3] Krishna P,Prasad B D,Rahman T . Brassinosteroid action in plant abiotic stress tolerance[J]. Methods in Molecular Biology,2017,1564:193. doi:10.1007/978-1-4939-6813-8_16.
[4] 温万里,郑颖坤,艾莉,刘洪亮,孔伟庆,艾佳,杨德光,张志武. 玉米抗冷性研究进展[J]. 作物杂志,2014(4):16-21. doi:10.3969/j.issn.1005-0906.2013.04.
Wen W L,Zheng Y K,Ai L,Liu H L,Kong W Q,Ai J,Yang D G,Zhang Z W. Research progress on cold resistance of maize [J]. Crops,2014(4):16-21.
[5] Seydpour F,Sayyari M. Chilling injury in cucumber seedlings amelioration by methyl salicylate[J]. 2016,22(5):432-441. doi:10.1080/19315260.2015.1067938.
[6] Sasse J M. Physiological actions of brassinosteroids:An update[J].Journal of Plant Growth Regulation,2003,22(4):276-288.doi:10.1007/s00344-003-0062-3.
[7] Clouse S D,Sasse J M. Brassinosteroids:essential regulators of plant growth and development[J].Annual Review of Plant Physiology and Plant Molecular Biology,1998,49(49):427-451.doi:10.1146/annurev.arplant.49.1.427.
[8] You J,Chan Z L.ROS regulation during abiotic stress responses in crop plants[J].Frontiers in Plant Science,2015,6:1092.doi:10.3389/fpls.2015.01092.
[9] Burbulis ![]()
![]() A. Changes in proline and soluble sugars content during cold acclimation of winter rapeseed shoots in vitro[J].Journal of Food Agriculture & Environment,2011,99(22):371-374.
A. Changes in proline and soluble sugars content during cold acclimation of winter rapeseed shoots in vitro[J].Journal of Food Agriculture & Environment,2011,99(22):371-374.
[10] Ashraf M,Foolad M R.Roles of glycine betaine and proline in improving plant abiotic stress resistance[J].Environmental and Experimental Botany,2007,59(2):206-216. doi:10.1016/j.envexpbot.2005.12.006 .
[11] Hamada K. Brassinolide:some effects for crop cultivations[C]//Conf Proc Int Seminar Plant Growth Regul.Tokyo,1986:188-196.
[12] Singh I S,Shono M. Physiological and molecular effects of 24-epibrassinolide,a brassinosteroid on thermotolerance of tomato[J].Plant Growth Regulation,2005,47(2/3):111. doi:10.1007/s10725-005-3252-0.
[13] Thussagunpanit J,Jutamanee K,Kaveeta L A,Pankean P,Homvisasevongsa S A. Comparative effects of brassinosteroid and brassinosteroid mimic on improving photosynthesis,lipid peroxidation,and rice seed set under heat stress[J].Journal of Plant Growth Regulation,2015,34(2):320-331.doi:10.1007/s00344-014-9467-4.
[14] Li J,Yang P,Gan Y T,Yu J H,Xie J M. Brassinosteroid alleviates chilling-induced oxidative stress in pepper by enhancing antioxidation systems and maintenance of photosystem Ⅱ[J].Acta Physiologiae Plantarum,2015,37(11):1-11.doi:10.1007/s11738-015-1966-9.
[15] Wu X X,Ding H D,Chen J L,Zhu Z W,Zha D S. Amelioration of oxidative damage in Solanum melongena seedlings by 24-epibrassinolide during chilling stress and recovery[J].Biologia Plantarum,2015,59(2):350-356.doi:10.1007/s10535-015-0495-0.
[16] Hirai K,Fujii S,Honjo K.Plant-growth regulating action of brassinolide .1. the effect of brassinolide on the ripening of rice plants under the low-temperature condition[J].Japanese Journal of Crop Science,1991,60(1):29-35.doi:10.1626/jcs.60.29.
[17] 李淑叶,马慧娟,张思平,刘绍东,沈倩,陈静,葛常伟,庞朝友,赵新华. 外源2,4表油菜素内酯对低温胁迫下棉花幼苗光合生理的影响[J]. 棉花学报,2018,30(3):252-260.
Li S S,Ma H J,Zhang S P,Liu S D,Shen Q,Chen J,Ge C W,Pang C Y,Zhao X H. Effects of exogenous 2,4-epibrassinolide on photosynthetic physiology of cotton seedlings under low temperature [J]. Cotton Science,2018,30(3):252-260.
[18] 王学奎,黄见良. 植物生理生化实验原理与技术[M]. 北京:高等教育出版社,2015.
Wang X K,Huang J L. Principles and techniques of plant physiological biochemical experiment [M]. Beijing:Higher Education Press,2015
[19] Giannopolitis C N,Ries S K.Superoxide dismutases:I. Occurrence in higher plants[J].Plant Physiology,1977,59(2):309-314. doi:10.2307/4264724.
[20] Xu T. Bioaccumulation,subcellular,and molecular localization and damage to physiology and ultrastructure in Nymphoides peltata (Gmel.)O. Kuntze exposed to yttrium[J]. Environmental Science & Pollution Research,2014,21(4):2935-2942. doi:10.1007/s11356-013-2246-0.
[21] Alejandro Perdomo J,Conesa M A,Medrano H A,Galmes J. Effects of long-term individual and combined water and temperature stress on the growth of rice,wheat and maize:relationship with morphological and physiological acclimation[J].Physiologia Plantarum,2015,155(2):149-165.doi:10.1111/ppl.12303.
[22] Hatfield J L,Prueger J H. Temperature extremes:Effect on plant growth and development[J].Weather and Climate Extremes,2015,10(A,SI):4-10. doi:10.1016/j.wace.2015.08.001.
[23] Duncan W G,Hesketh J D.Net photosynthetic rates,relative leaf growth rates,and leaf numbers of 22 races of maize grown at eight temperatures 1[J].Crop Science,1968,8(6):670-674. doi:10.2135/cropsci1968.0011183X000800060009x.
[24] Muldoon D K,Wheeler J L,Pearson C J.Growth,mineral-composition and digestibility of maize,sorghum and barnyard millets at different temperatures[J].Australian Journal of Agricultural Research,1984,35(3):367-378.doi:10.1071/AR9840367.
[25] Yildirim E,Karlidag H,Dursun A.Salt tolerance of physalis during germination and seedling growth[J].Pakistan Journal of Botany,2011,43(6):2673-2676. doi:10.1.1.546.8972.
[26] 刘禹辰,杨德光,李梁,柴孟竹,鞠然,白冰,刘宇龙. 低温胁迫对玉米种子萌发及淀粉分解酶类活性的影响1[J]. 玉米科学,2017,26(1):64-68. doi:10.13597/j.cnki.maize.science.20180110.
Liu Y C,Yang D G,Li L,Chai M Z,Ju R,Bai B,Liu Y L. Effect of low temperature stress on maize seed germination and starch decomposition enzyme activity [J]. Journal of Maize Science,2017,26(1):64-68.
[27] 杨德光,马月,刘永玺,杨慧,周婷婷,边鸣镝. 低温胁迫下外源CaCl2对玉米种子萌发及幼苗生长的影响[J]. 玉米科学,2018,26(3):83-88. doi:10.13597/j.cnki.maize.science.20180314.
Yang D G,Ma Y,Liu Y X,Yang H,Zhou T T,Bian M D. Effects of exogenous CaCl2 on maize seed germination and seeding growth under low temperature stress [J]. Journal of Maize Sciences,2018,26(3):83-88.
[28] 杨德光,孙玉珺,Irfan A R,刘昕萌,吕金莹,尉菊萍,宫磊,刘哲,白冰. 低温胁迫对玉米发芽及幼苗生理特性的影响[J]. 东北农业大学学报,2018,49(5):1-8,44. doi:10.19720/j.cnki.issn.1005-9369.2018.05.001.
Yang D G,Sun Y J,Irfan A R,Liu X M,Lü J Y,Wei J P,Gong L,Liu Z,Bai B. Effect of low temperature stress on germination and physiological of maize seedling[J]. Journal of Northeast Agricultural University,2018,49(5):1-8,44.
[29] 马金虎. 油菜素内酯调控低温胁迫下玉米种子萌发的生理机制[D]. 晋中:山西农业大学,2015.
Ma J H. Physiolgical mechanism of EBR promotr low temperature stress in maize seed germination[D].Jinzhong:Shanxi Agricultural University,2015.
[30] Engels C. Effect of root and shoot meristem temperature on shoot to root dry matter partitioning and the internal concentrations of nitrogen and carbohydrates in maize and wheat[J].Annals of Botany,1994,73(2):211-219. doi:10.1006/anbo.1994.1025.
[31] Stone P J,Sorensen I B,Jamieson P D. Effect of soil temperature on phenology,canopy development,biomass and yield of maize in a cool-temperate climate[J].Field Crops Research,1999,63(2):169-178. doi:10.1016/S0378-4290(99)00033-7.
[32] Sowiński P,Rudzińskalangwald A,Adamczyk J,Kubica I,Fronk J.Recovery of maize seedling growth,development and photosynthetic efficiency after initial growth at low temperature[J].Journal of Plant Physiology,2004,162(1):67-80. doi:10.1016/j.jplph.2004.03.006.
[33] Rymen B,Fiorani F,Kartal F,Vandepoele K,Inze D,Beemster G T. Cold nights impair leaf growth and cell cycle progression in maize through transcriptional changes of cell cycle genes[J].Plant Physiology,2007,143(3):1429-1438.doi:10.1104/pp.106.093948.
[34] 徐晓昀,郁继华,颉建明,胡琳莉,李杰. 水杨酸和油菜素内酯对低温胁迫下黄瓜幼苗光合作用的影响[J]. 应用生态学报,2016,27(9):3009-3015. doi:10.13287/j.1001-9332.201609.020.
Xu X Y,Yu J H,Jie J M,Hu L L,Li J. Effects of exogenous salicylic acid and brassinolide on photosynthesis of cucumber seedlings under low temperature stress [J]. Chinese Journal of Applied Ecology,2016,27(9):3009-3015.
[35] 刘巾瑞. 表油菜素内酯对高粱低温胁迫的缓解作用研究[D]. 大庆:黑龙江八一农垦大学,2018.
Liu J R. Study on the alleviating effect of epibrassinolide on low temperature stress of sorghum[D].Daqing:Heilongjiang Bayi Agricultural University,2018.
[36] 张小贝,祝志欣,南文卓,孙言博,朱国鹏. 2,4-表油菜素内酯(EBR)对菜用甘薯抗寒生理生化的影响[J]. 安徽农业大学学报,2017,44(3):525-529. doi:10.13610/j.cnki.1672-352x.20170524.027.
Zhang X B,Zhu Z X,Nan W Z,Sun Y B,Zhu G P. Effects of 2,4-epibrassinolide(EBR)on cold resistance-related physiological-biochemical indexes of vegetable sweet potato [J]. Journal of Anhui Agricultural University,2017,44(3):525-529.
[37] 周爱清,骆炳山,任筱波. 油菜素内酯对水稻幼苗生长及耐冷性的影响[J]. 华中农业大学学报,1987(1):8-13. doi:10.13300/j.cnki.hnlkxb.1987.01.002.
Zhou A Q,Luo B S,Ren X B. Effcet of brassinolide on rice seedling growth and cold resistance [J]. Journal of Huazhong Agricultural,1987(1):8-13.
[38] Mauch-Mani B,Mauch F.The role of abscisic acid in plant pathogen interactions[J].Current Opinion in Plant Biology,2005,8(4):409-414. doi:10.1016/j.pbi.2005.05.015.
[39] Wise R R,Naylor A W. Chilling-Enhanced photooxidation:the peroxidative destruction of lipids during chilling injury to photosynthesis and ultrastructure[J].Plant Physiology,1987,83(2):272-277. doi:10.1104/pp.83.2.272.
[40] Wang Y,Zhou M,Gong X L,Liu C,Hong M M,Wang L,Hong F S. Influence of lanthanides on the antioxidative defense system in maize seedlings under cold stress[J].Biological Trace Element Research,2011,142(3):819-830.doi:10.1007/s12011-010-8814-y.
[41] Allen D J,Ort D R.Impacts of chilling temperatures on photosynthesis in warm-climate plants[J].Trends in Plant Science,2001,6(1):36-42. doi:10.1016/s1360-1385(00)01808-2.
[42] Wu X X,Ding H D,Chen J L,Zhu Z W,Zha D S. Exogenous spray application of 2,4-epibrassinolide induced changes in photosynthesis and anti-oxidant defences against chilling stress in eggplant(Solanum melongena L.)seedlings[J].Journal of Horticultural Science & Biotechnology,2015,90(2):217-224.doi:10.1080/14620316.2015.11513175.
[43] Machado D P,Ribeiro R V,Silveira J G,Filho J M,Machado E C. Rootstocks induce contrasting photosynthetic responses of orange plants to low night temperature without affecting the antioxidant metabolism[J].Theoretical and Experimental Plant Physiology,2013,25(1):26-35.
[44] Gapper C,Dolan L. Control of plant development by reactive oxygen species[J].Plant Physiology,2006,141(2):341-345.doi:10.1104/pp.106.079079.
[45] Zhou B Y,Guo Z F,Xing J P,Huang B R.Nitric oxide is involved in abscisic acid-induced antioxidant activities in Stylosanthes guianensis[J].Journal of Experimental Botany,2005,56(422):3223-3228. doi:10.1093/jxb/eri319.
[46] Ahammed G J,Yuan H L,Ogweno J O,Zhou Y H,Xia X J,Mao W H,Shi K,Yu J Q. Brassinosteroid alleviates phenanthrene and pyrene phytotoxicity by increasing detoxification activity and photosynthesis in tomato[J].Chemosphere,2012,86(5):546-555. doi:10.1016/j.chemosphere.2011.10.038.
[47] Liu Y J,Zhao Z G,Si J,Di C X,Han J,An L Z. Brassinosteroids alleviate chilling-induced oxidative damage by enhancing antioxidant defense system in suspension cultured cells of Chorispora bungeana[J].Plant Growth Regulation,2009,59(3):207-214. doi:10.1007/s10725-009-9405-9.
[48] Fariduddin Q,Yusuf M,Chalkoo S,Hayat S,Ahmad A.28-homobrassinolide improves growth and photosynthesis in Cucumis sativus L. through an enhanced antioxidant system in the presence of chilling stress[J].Photosynthetica,2011,49(1):55-64. doi:10.1007/s11099-011-0022-2.