农作物生长过程中会受到不同类型的环境干扰或者胁迫,其中,干旱是限制我国北方主要作物产量的重要因素,如玉米(Zea mays L.)、小麦(Triticum aestivum L.)[1]。干旱条件会降低植物的净光合效率(Pn),这不仅与植物叶片水势降低导致气孔关闭有关(气孔因素限制),还可能与干旱导致植物内部生化反应减慢(如Rubisco的活性降低)以及叶肉细胞光合能力下降(如植物耗散过多光能和保持较高电子传递效率的能力)有关(非气孔因素限制)[2]。随着测定方法的不断进步,通过便携式光合测定仪对不同环境条件下的植物进行叶片净光合速率-光照强度响应(Pn-PAR)和净光合速率-细胞间隙二氧化碳浓度响应(A-Ci)的测定,可估算植物光合生理特性和生化特性的多种参数,如最大净光合速率(Pmax)、光饱和点(PARLSP)、Rubisco的初始羧化效率(CE)等;利用便携调制叶绿素荧光仪对不同环境条件下植物叶片快速光曲线(Rapid light curve,RLC)进行测定,可得到相对电子传递效率(rETR)和光化学淬灭系数(qP)等参数,这些参数均可在植物无损伤条件下来帮助我们准确判断植物对逆境的响应状况和可能的机制[3-5]。因此,这些方法已逐渐被研究植物光合生理的研究者重视,可为植物耐受性的合理评估,筛选适用于干旱早期诊断的指标,及作物抗旱性育种提供数据支持和技术参考[6-8]。
作为世界上的第二大玉米生产国,我国玉米的种植面积和产量不断增加,目前已超过水稻(Oryza sative L.)成为中国的第一大粮食作物,约2/3的面积分布于依靠自然降雨的丘陵或平原上。干旱,特别是玉米发育早期干旱,会造成该作物不同程度的减产,严重时甚至绝产,因此,玉米品种对干旱的耐受性成为决定玉米产量的关键因素[9-12],而通过气体交换和荧光参数的测定来比较全面地了解干旱胁迫下玉米的光合特征在近几年陆续受到研究者的关注[13-15],对相关问题的深入研究亟需展开。因此,本研究选取在中国北方半干旱区有应用潜力的3个品种,在人工控制条件下构建干旱胁迫处理,通过Li-6400仪测定光合气体交换特征,通过叶绿素荧光仪MINI-PAM测定电子传递相关的生理特性,并通过模型模拟深入分析其内在的几种生理功能表现,旨在为玉米的早期诊断及抗旱育种提供参考,为玉米节水高产栽培提供理论依据,也为其他作物的耐受性评估提供切实可行的方法参考。
1 材料和方法
1.1 试验材料
选择在中国北方农业产区产量表现较好的3个夏玉米品种浚单20、津北288、迪卡667作为试验材料。其中,浚单20系河南省浚县农业科学研究所选育(2003年),为9058(母本)×浚92-8(父本)杂交后代;津北288系辽宁省北票市兴业玉米高新技术研究所选育(2013年),为BX144(母本)×BX143(父本)杂交后代;迪卡667是孟山都科技有限责任公司、中种迪卡种子有限公司选育(2013年),为G3545Z(母本)×G4808Z(父本)杂交后代。
1.2 试验方法
2017年8月25日,挑选3个玉米品种饱满的种子,于25 ℃光照培养箱中进行萌发。2017年9月5日,玉米长到三叶期时进行移栽,在直径30 cm的塑料盆中,放入5 kg砂质壤土(土壤有机质、全N、速效磷和有效钾含量分别为9.28 g/kg、1.01 g/kg、3.3 mg/kg、115 mg/kg,每盆3株玉米。2017年9月8日,幼苗长势良好,进行干旱处理,共3种处理,包括对照处理(CK),土壤含水量为13%~15%;轻度干旱处理(LD),土壤含水量为7%~9%;重度干旱处理(SD),土壤含水量为3%~5%。土壤含水量由土壤含水量监测系统(ECH2O,Decagon)测定。每个处理6盆作为6个重复,3个玉米品种,共54盆。4 d后,分别选取心叶下第1叶完全展开的叶片进行光合指标和荧光指标的测定。
1.3 指标测定
1.3.1 叶片光合速率-光响应曲线的测定 2017年9月12-14日,每天8:00-12:00,利用便携式光合作用系统(Li-6400 USA)测定不同光合有效辐射强度(PAR)条件下,不同处理玉米叶片的净光合速率(Pn),PAR梯度为1 900,1 500,1 100,700,400,200,100,60,30,0 μmol/(m2·s),并设置叶片和叶室的温度为25 ℃,进气口CO2浓度为390 mmol/L,所得结果用于光合速率-光响应(Pn-PAR)曲线的模拟;同时测定气孔导度(Gs)和细胞间隙CO2浓度(Ci)。每个处理测定3个重复,分3 d完成。
1.3.2 叶片光合速率-CO2响应曲线的测定 2017年9月12-14日每天14:00-18:00,在植物光合作用达到稳定状态后,利用便携式光合作用系统(Li-6400 USA)测定不同CO2浓度条件下不同处理玉米叶片的净光合速率(A),CO2浓度依次为350,250,200,150,100,50,350,500,700,900,1 200,1 500,1 800 μmol/L,并设置叶片和叶室的温度为25 ℃,PAR为1 500 μmol/(m2·s),所得结果用于光合-细胞间隙CO2浓度(A-Ci)响应曲线的模拟。每个处理测定3个重复,分3 d完成。
1.3.3 快速光曲线的测定 2017年9月13日4:00-6:00,利用便携调制叶绿素荧光仪(MINI-PAM,Walz,Germany)测定不同处理玉米叶片的快速光曲线。设置PAR 梯度为0,30,60,100,200,400,700,1 100,1 500,1 900,2 400 μmol/(m2·s),每个梯度持续 20 s,测定rETR、qP、非光化学淬灭系数(qN)、非调节性能量耗散的电子产量(Y(NO))和调节性能量耗散的电子产量(Y(NPQ))。rETR随PAR的变化趋势图即为快速光曲线。每种处理测定6个重复。
1.4 数据计算与分析
采用直角双曲线方程来估算Pn-PAR响应曲线方程[16],其表达式如下:
Pn=α×PAR×Pmax/(α×PAR+Pmax)-Rd
式中,Pn为净光合速率(μmol/(m2·s));Pmax为最大光合速率(μmol/(m2·s));α为Pn-PAR响应曲线的初始斜率,能反映叶片光合表观量子效率(AQY)(μmol/μmol);Rd为暗呼吸速率(μmol/(m2·s))。
根据以下公式计算光补偿点(LCP)和光饱和点(LSP)所对应的光强:
PARLCP= Pmax×Rd/α/(Pmax-Rd)和PARLSP = Pmax×(0.78×Pmax+Rd)/α/(0.22×Pmax-Rd)。
采用非直角双曲线方程来估算A-Ci响应曲线方程[17],其表达式如下:
A=(CE× Ci+Amax-((CE × Ci+Amax)2-4×CE ×Ci ×Amax×θ)0.5)/2θ-Resp
式中,A为Pn(μmol/(m2·s));Amax为一定光强下最大光合速率(μmol/(m2·s),反映了植物叶片的光合电子传递和磷酸化的活性;CE为光合速率的CO2响应曲线的初始斜率,反映了Rubisco的初始羧化效率(mol/(m2·s));Ci为胞间CO2浓度(μmol/mol);θ为A-Ci响应曲线的曲角;Resp为光呼吸速率(μmol/(m2·s))。
采用下式进行快速光曲线拟合[18] :
rETR=rETRmax×(1-e-a×PAR/rETRmax)×e-b×PAR/rETRmax
式中,rETR为相对电子传递速率;rETRmax为一定环境下最大相对电子传递速率;a为初始斜率,反映了光能的利用效率;b为光抑制参数。
利用Nonlinear regression方法来进行曲线模型,并对曲线的拟合程度进行检验(SPSS 21.0,IBM,USA);利用EXCEL软件进行常规图表的制作。
2 结果与分析
2.1 玉米叶片气体交换参数对PAR的响应
Pn随着PAR的增加逐渐增大,但不同品种对胁迫处理的响应并不一致,其中,浚单20对胁迫处理比较敏感,3种处理之间存在显著差异,即对照处理CK > 轻度胁迫处理LD > 重度胁迫处理HD(P<0.05)(图1-A1),而其他2个品种,仅HD显著降低叶片的Pn(P<0.05)(图1-A2,A3)。气孔导度(Gs)随PAR的变化规律与Pn相似(图1-B1-B3),进一步分析Pn与Gs之间的关系,发现Pn随着Gs的增加而增加,仅在迪卡667品种HD条件下,当Gs>0.03 mol/(m2·s)后,Pn增长变缓(图2)。胞间CO2浓度(Ci)随着PAR的增加先降低后缓慢上升,同一品种不同处理间无显著差异(图1-C1-C3);进一步分析Pn与Ci之间的关系发现,除迪卡667 HD处理,在Ci <160 μmol/mol,Pn有一个相对稳定值外,其他处理Pn随着Ci的增加而下降(图3)。
通过Pn-PAR直角双曲线模型估测得到的参数可以看出,估测模型与实际测定值之间有很好的拟合度(P < 0.01),且随着胁迫的加重,拟合度(R2)降低,即胁迫使得光合作用对光的响应发生了偏离(表1)。就所得结果可以看出,初始量子效率(AQY),浚单20表现为CK > LD >HD,津北288和迪卡667最高值出现在LD处理组,而津北288 AQY高达0.060 μmol/μmol,为所有处理组的最高值,且该品种LD处理组的Pmax与3个品种的对照组接近(均接近2,9 μmol/(m2·s)),高于其他品种;饱和光强(PARLSP)在同一品种的不同处理间也表现出CK > LD >HD,就品种间相比,浚单20的PARLSP低于其他2个品种(表1)。
2.2 玉米叶片光合作用-Ci的响应
通过A-Ci非直角双曲线模型估测可以看出,估测模型与实际测定值之间有很好的拟合度(P<0.01),但HD处理下,津北288和迪卡667的拟合度(R2)仅为0.654,0.574 (表2)。就所得结果可以看出,初始羧化效率(CE),3个品种均表现为LD>CK>HD;浚单20和迪卡667 2个品种的光合能力(Amax)均表现为对照组CK处理显著高于胁迫处理;而津北288品种的Amax在CK和LD处理组非常接近,分别为17.85,17.87 μmol/(m2·s),而HD处理下仅为5.30 μmol/ (m2·s),显著低于前两者(表2)。
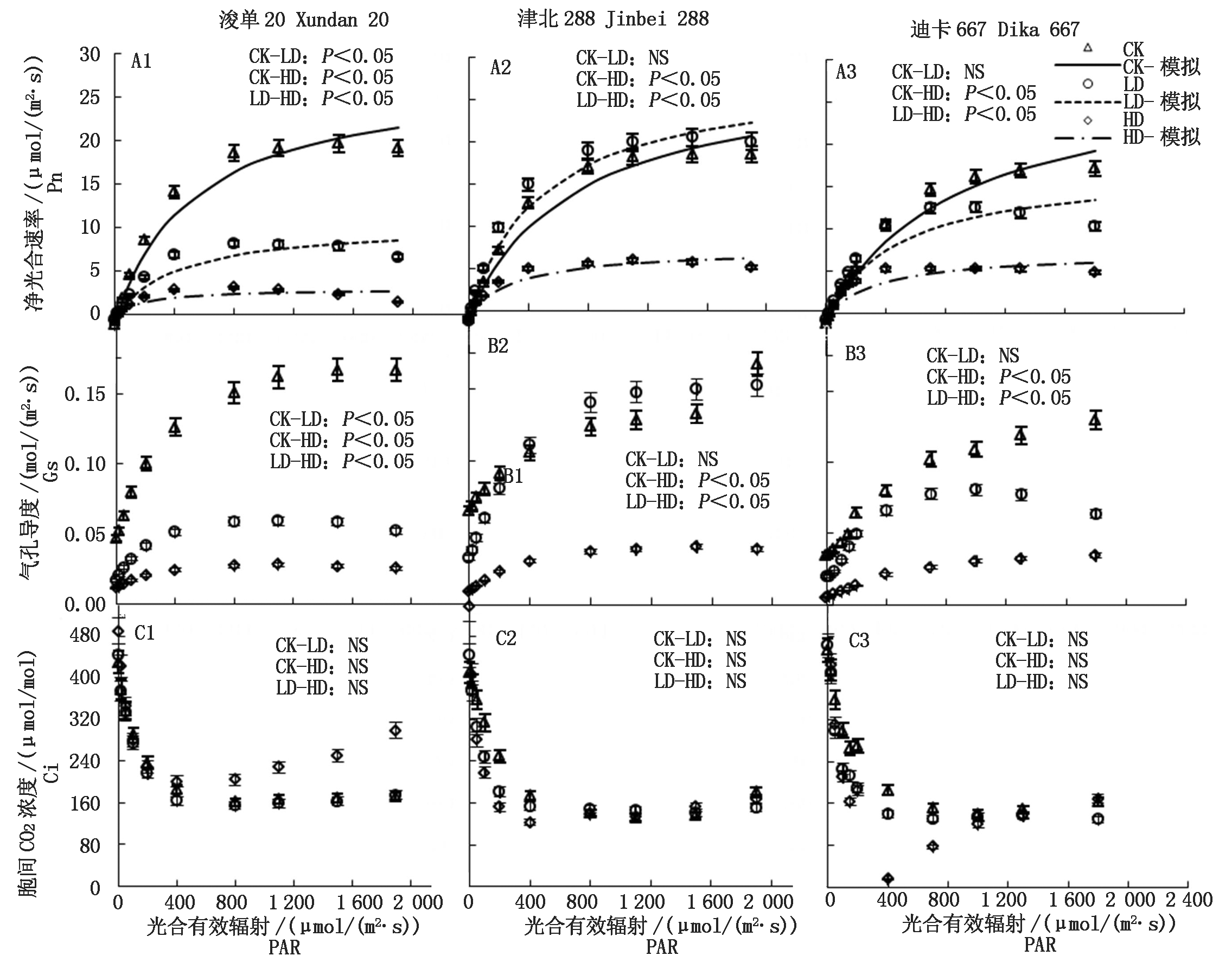
图1 不同处理条件下3个玉米品种Pn、Gs和Ci随PAR的变化
Fig.1 The changes of net photosynthetic rate(Pn),stomatal conductance(Gs)and intercellular CO2 concentration(Ci)of three maize cultivars along PAR under different treatments
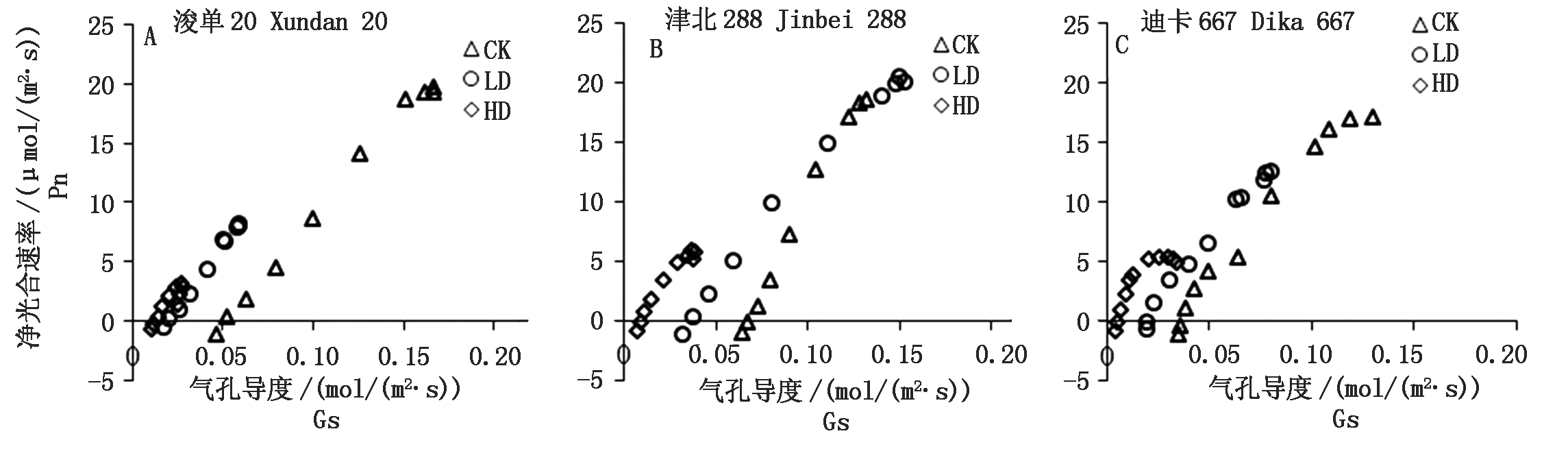
图2 不同处理条件下3个玉米品种Pn与Cs的关系
Fig.2 Relationships between net photosynthetic rate(Pn)and stomatal conductance(Gs) of three maize cultivars under different treatments
2.3 玉米叶片叶绿素荧光参数对PAR的响应
相对电子传递效率(rETR)随PAR的增加呈现出先上升后下降趋势,其中迪卡667的3种处理间rETR随PAR的变化无显著差异(P>0.05),而HD处理显著降低了其他2个品种的rETR(P<0.05)(图4-A1-A3);浚单20和迪卡677的光化学淬灭系数(qP)随着PAR的增加而下降,津北288在低PAR时,随着PAR的增加而上升,超过100 μmol/(m2·s)后,随着PAR的增加而下降,但各品种不同处理间均无显著差异(P>0.05)(图4-B1-B3);非光化学淬灭系数(qN)随着PAR的增加而增加,津北288品种的3个处理间无显著差异(P>0.05),浚单20和迪卡667的胁迫处理组显著低于CK(P < 0.05)(图4-C1-C3);非调节性能量耗散的量子产量(Y(NO))随PAR增加的变化趋势,在3个品种间完全不一致,其中,浚单20,Y(NO)表现为随着PAR的增加,先上升后下降,且对照组与干旱处理组间差异显著(P<0.05);津北288,Y(NO)随着PAR的增加,先下降后上升,再缓慢下降,3个处理组间无显著差异(P>0.05);而迪卡667,对照组随着PAR的增加,Y(NO)缓慢下降,且显著低于干旱处理组(P<0.05),干旱处理组随着PAR的增加先升高后缓慢降低,且2个处理组间无显著差异(P>0.05)(图4-D1-D3)。调节性能量耗散的量子产量(Y(NPQ))随着PAR的增加而增加,其中,浚单20和迪卡667表现为CK显著高于干旱处理组(P<0.05),而津北288的3种处理间无显著差异(P>0.05)(图4-E1-E3)。
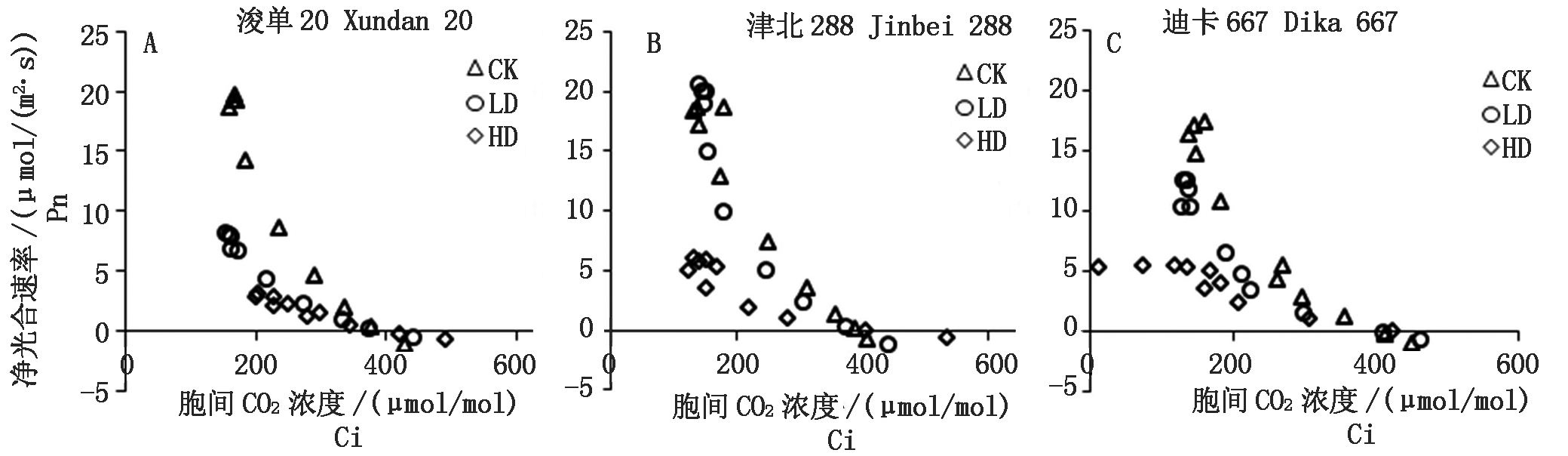
图3 不同处理条件下3个玉米品种Pn与Ci的关系
Fig.3 Relationships between net photosynthetic rate(Pn)and intercellular CO2 concentration(Ci)of three maize cultivars under different treatments
表1 不同处理条件下3个玉米品种光合-光响应曲线(Pn-PAR)拟合参数
Tab.1 Estimates of parameters from photosynthetic-light curve of three maize cultivars under different treatments
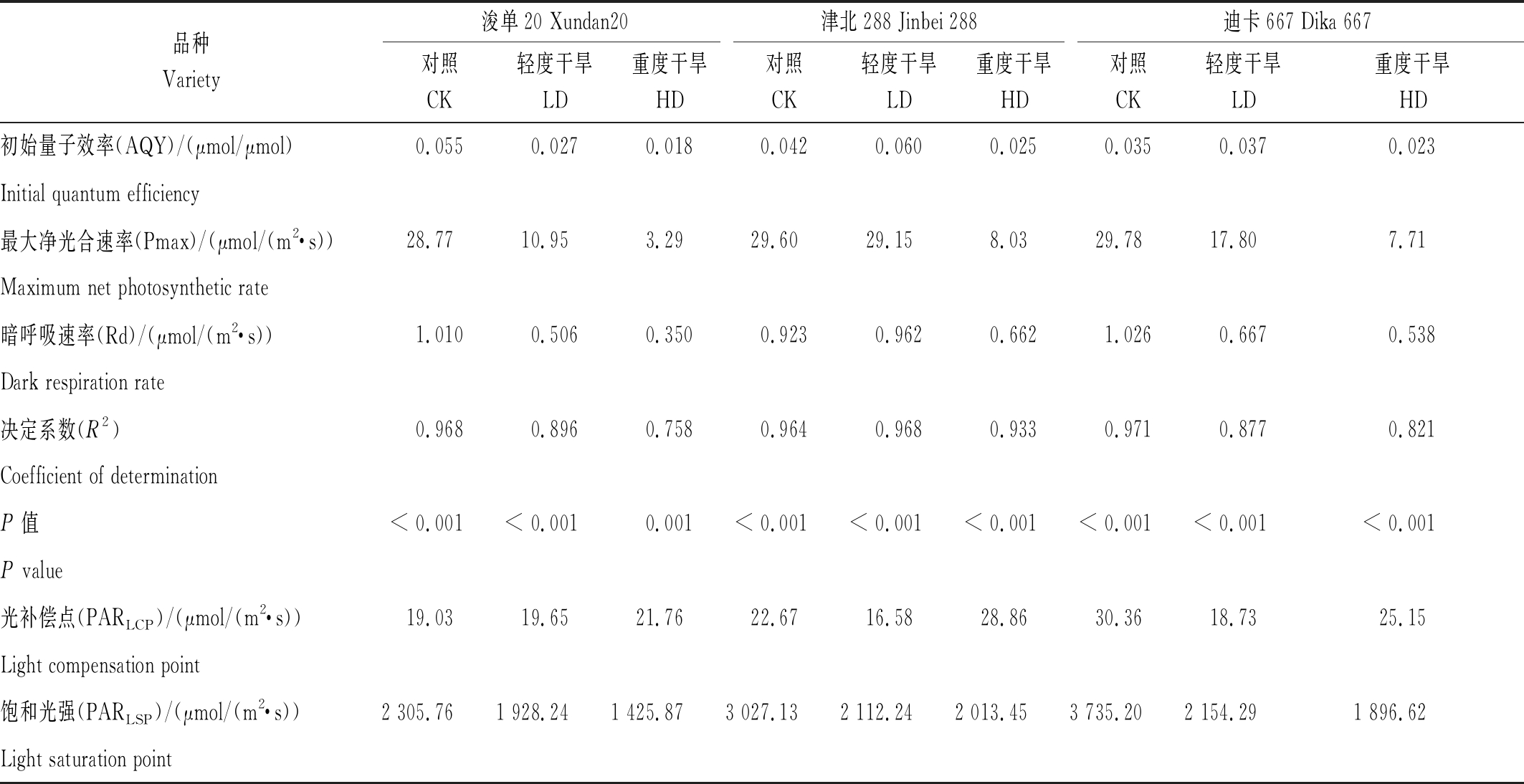
品种Variety浚单20 Xundan20津北288 Jinbei 288迪卡667 Dika 667对照CK轻度干旱LD重度干旱HD对照CK轻度干旱LD重度干旱HD对照CK轻度干旱LD重度干旱HD初始量子效率(AQY)/(μmol/μmol)0.0550.0270.0180.0420.0600.0250.0350.0370.023Initial quantum efficiency最大净光合速率(Pmax)/(μmol/(m2·s))28.7710.953.2929.6029.158.0329.7817.807.71Maximum net photosynthetic rate暗呼吸速率(Rd)/(μmol/(m2·s))1.0100.5060.3500.9230.9620.6621.0260.6670.538Dark respiration rate决定系数(R2)0.9680.8960.7580.9640.9680.9330.9710.8770.821Coefficient of determinationP值 < 0.001< 0.0010.001< 0.001< 0.001< 0.001< 0.001< 0.001< 0.001P value光补偿点(PARLCP)/(μmol/(m2·s))19.0319.6521.7622.6716.5828.8630.3618.7325.15Light compensation point饱和光强(PARLSP)/(μmol/(m2·s))2 305.761 928.241 425.873 027.132 112.242 013.453 735.202 154.291 896.62Light saturation point
表2 不同处理条件下3个玉米品种光合作用-胞间CO2(A-Ci)响应曲线拟合参数
Tab.2 Estimates of parameters from photosynthetic-the intercellular CO2(A-Ci) response curves of three maize cultivars under different treatments
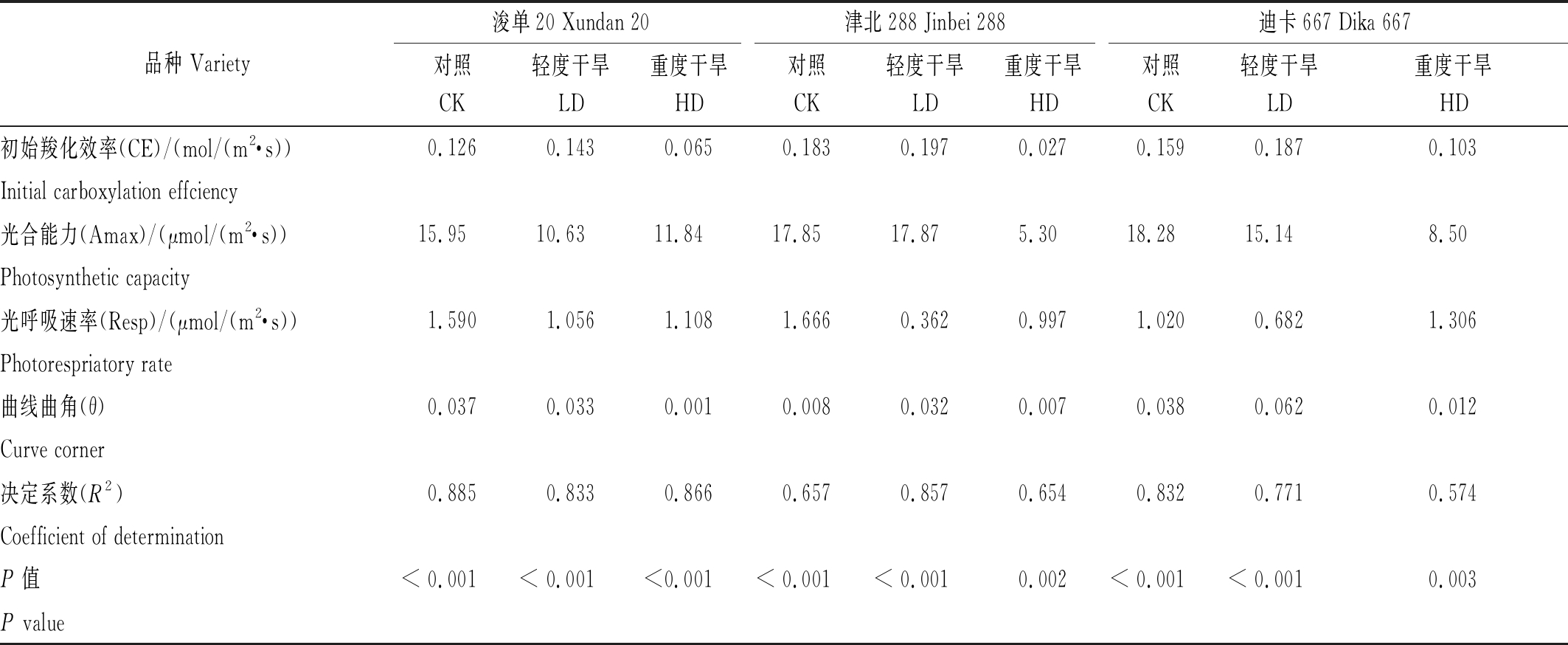
品种 Variety浚单20 Xundan 20津北288 Jinbei 288迪卡667 Dika 667对照CK轻度干旱LD重度干旱HD对照CK轻度干旱LD重度干旱HD对照CK轻度干旱LD重度干旱HD初始羧化效率(CE)/(mol/(m2·s))0.1260.1430.0650.1830.1970.0270.1590.1870.103Initial carboxylation effciency光合能力(Amax)/(μmol/(m2·s))15.9510.6311.8417.8517.875.3018.2815.148.50Photosynthetic capacity光呼吸速率(Resp)/(μmol/(m2·s))1.5901.0561.1081.6660.3620.9971.0200.6821.306Photorespriatory rate曲线曲角(θ)0.0370.0330.0010.0080.0320.0070.0380.0620.012 Curve corner决定系数(R2)0.8850.8330.8660.6570.8570.6540.8320.7710.574Coefficient of determinationP值 < 0.001< 0.001<0.001< 0.001< 0.0010.002< 0.001< 0.0010.003P value
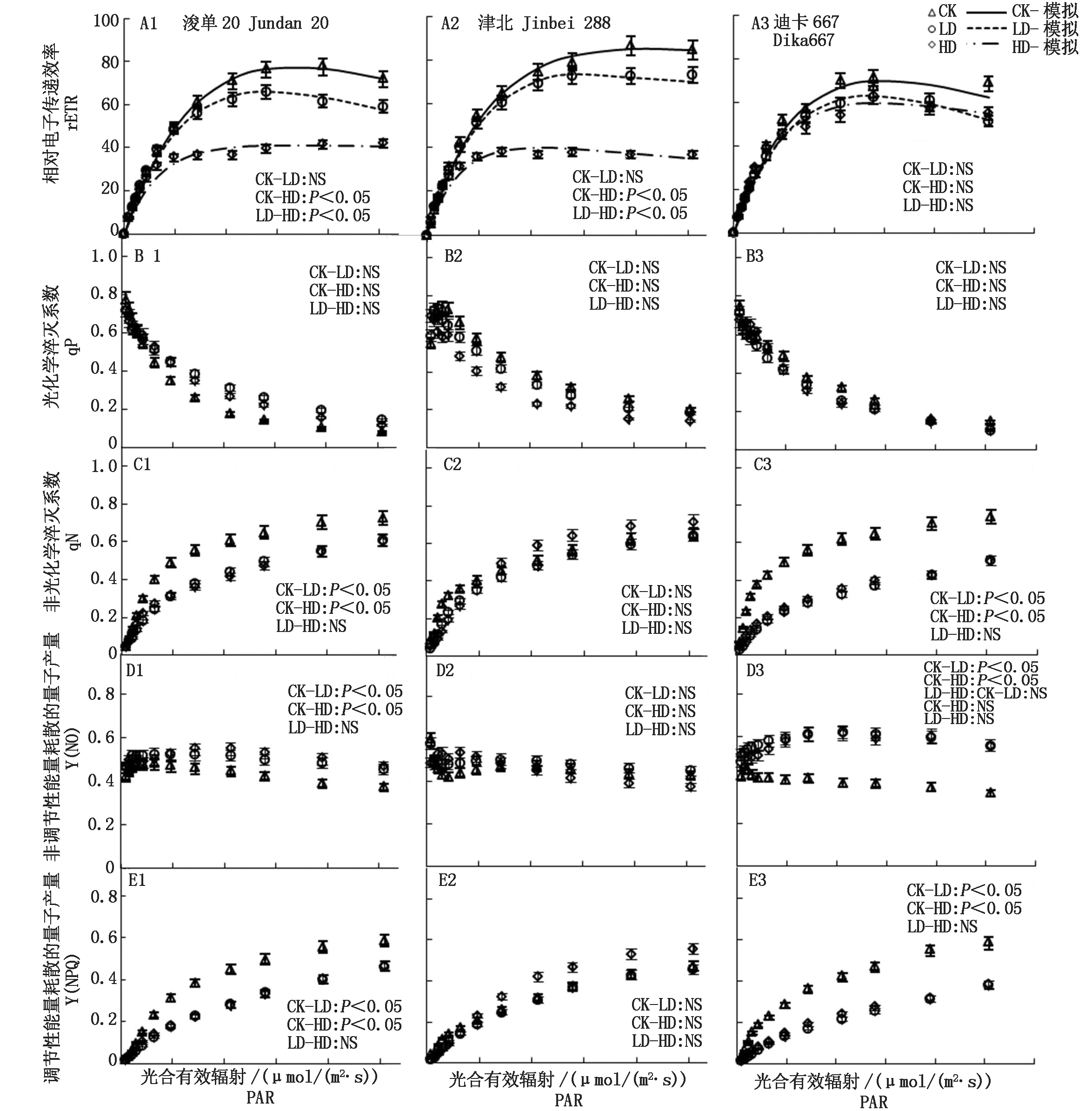
图4 不同处理条件下3个玉米品种荧光参数随PAR的变化
Fig.4 The changes of ETR,qP,qN,Y(NO)and Y(NPQ)of three maize cultivars along PAR under different treatments
通过快速光曲线模型估测可以看出,估测模型与实际测定值之间有很好的拟合度(P<0.001)。初始光能利用效率在各品种不同处理间比较接近(图4-A1-A3、表3);最大相对电子传递效率(rETRmax),浚单20表现为CK>LD>HD,津北288和迪卡667则表现为LD>CK>HD,即表现为LD可提高rETRmax(表3)。
表3 不同处理条件下3个玉米品种快速光曲线拟合参数
Tab.3 Estimates of parameters from rapid light curve of three maize cultivars under different treatments
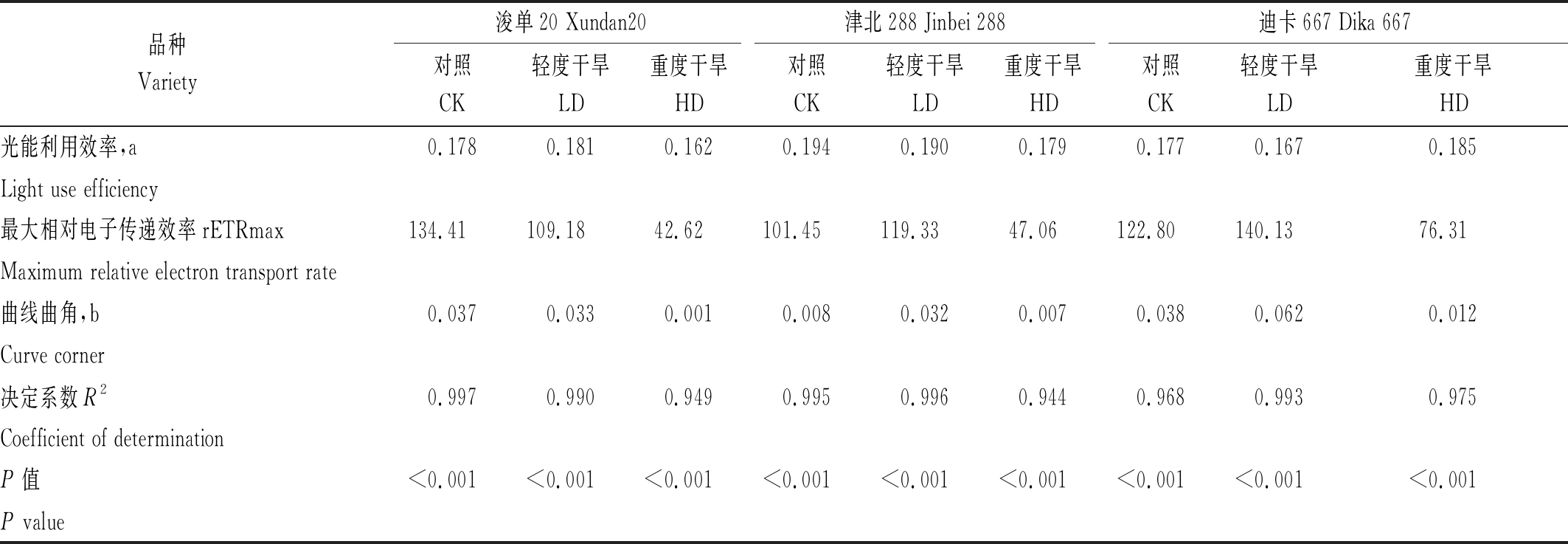
品种 Variety 浚单20 Xundan20津北288 Jinbei 288迪卡667 Dika 667对照CK轻度干旱LD重度干旱HD对照CK轻度干旱LD重度干旱HD对照CK轻度干旱LD重度干旱HD光能利用效率,a0.1780.1810.1620.1940.1900.1790.1770.1670.185Light use efficiency最大相对电子传递效率rETRmax134.41109.1842.62101.45119.3347.06122.80140.1376.31Maximum relative electron transport rate曲线曲角,b 0.0370.0330.0010.0080.0320.0070.0380.0620.012Curve corner决定系数R20.9970.9900.9490.9950.9960.9440.9680.9930.975Coefficient of determinationP值 <0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001P value
3 结论与讨论
干旱是影响作物生长和产量的最重要因素[19],而且随着全球变化的影响加剧,干旱对农业的影响会越来越严重[20]。本研究结果表明,本试验所用3个玉米品种均具有一定的干旱适应性。首先,气孔限制因素是轻度干旱胁迫条件下植物Pn下降的主导因素,而非气孔限制因素在重度干旱胁迫条件下对植物Pn下降的贡献逐步增加,会超越气孔限制因素而成为主导因素[14,21-23]。根据Farquhar和Sharkey的观点,可通过Pn与Ci之间是否存在正相关关系,来判断Pn下降是否由气孔限制所主导[24]。本研究结果表明,在干旱处理下,气孔限制均不是3个玉米品种Pn下降的主要原因。3个夏玉米品种的Gs与Pn对水分胁迫的响应具有相似的模式,这种平行关系常使人们误认为两者之间具有因果关系,气孔导度的降低是光合速率下降的原因。其实是由于Pn对Gs具有反馈调节的作用,即在有利于叶肉细胞光合时,Gs增大;不利于光合时,Gs减小,从而使Pn与Gs之间遵循直线关系[25]。另一方面,干旱胁迫导致3个玉米品种Pn-Gs的平行关系左移,即维持相等的Pn,Gs数值小从而蒸腾失水少,表明气孔调节机能对环境的适应性反映,同时支持3个玉米品种对干旱胁迫具有一定的适应性[25]。
本研究结果支持气孔限制因素是导致3个夏玉米品种Pn下降的主要因素。许多研究结果表明,干旱胁迫对Pn的抑制往往不是气孔因素所致,植物代谢过程及叶肉细胞光合能力的变化对Pn的影响比气孔限制对Pn的影响要复杂得多。Rubisco作为光合同化的关键酶,其活性的降低常被认作是Pn下降的非气孔因素之一[26-27],而A-Ci响应曲线中初始斜率与Rubisco活性呈正相关[28]。本研究发现,HD环境条件下的3个玉米品种,它们的初始羧化效率CE都显著低于其他2种处理,由此可以得出,Rubisco的活性降低是导致3个玉米品种Pn下降的主要原因之一。另外,核酮糖-1,5-二磷酸(RuBP)再生与光合电子传递速率直接关联[27],Amax能反映植物叶片的光合电子传递和磷酸化活性的高低[29],本研究发现,在HD环境条件下,Amax数值降低,支持光合电子传递和磷酸化活性降低是导致Pn下降的主要原因之二。叶绿素荧光参数与叶肉细胞光合作用中各种反应过程密切相关,是评估PSⅡ状态良好与否的指标。HD环境条件下,津北288的qP显著低于对照,即由光合作用引起的荧光淬灭降低或者光合活性降低,这可能是导致津北288品种rETRmax和Pn下降的主要原因之三。干旱胁迫(包括LD和HD)降低了浚单20和迪卡667 2个品种的qN和Y(NPQ)2个指标的响应,这2个指标表示植物耗散过量光能的能力,是反映植物光保护能力的重要指标,即高光强将会导致植物的受损[30],另外,高的Y(NO)也表明随着PAR的增加,即干旱胁迫条件下这2个品种植物的非调节性能量耗散增加,受损增加,而干旱胁迫对津北288的光合活性及光保护能力均无显著影响(P>0.05)且饱和光强也相对较高,即植物耗散过剩光能能力下降从而引起植物受损是干旱胁迫(包括LD和HD 2种环境条件)导致浚单20和迪卡667 2个品种Pn下降的另外一个主要原因。
通过上述分析,干旱胁迫条件下,浚单20和迪卡667受到非气孔限制主要表现在Rubisco活性的降低、光合电子传递和磷酸化活性降低、植物耗散过剩光能能力下降从而引起植物受损,且后者在轻度胁迫处理下(LD)即影响到了这2个品种的光合能力;津北288受到的非气孔限制主要表现在Rubisco活性的降低、光合电子传递和磷酸化活性降低、光合作用引起的荧光淬灭降低或者光合活性降低,且这些限制对轻度胁迫处理下的植株没有显著影响,甚至还有少许促进作用,即津北288具有较高的耗散过多光能的能力,以抵御不良环境,具有较强的干旱胁迫耐受性,为津北288在胁迫条件下AQY和Pmax在3个品种中都最高提供合理解释。
[1] 曹阳. 1961-2010年潜在干旱对中国玉米、小麦产量影响的模拟[D]. 北京:中国农业科学院,2014.
Cao Y. Simulation of maize and wheat yield influenced by potential drought in China during 1961-2010[D].Beijing:Chinese Academy of Agricultural,2014.
[2] Jones H G.Partitioning stomatal and non-stomatal limitations to photosynthesis[J]. Plant Cell & Environment,1985,8(2):95-104.doi:10.1111/j.1365-3040.1985.tb01227.x.
[3] 刘佳,杨永红,郝引川,张兴华,薛吉全,张仁和. 干旱胁迫和复水处理对玉米叶片光合电子传递特性的影响[J]. 植物生理学报,2017,53(10):1877-1884. doi:10.13592/j.cnki.ppj.2017.0206.
Liu J,Yang Y H,Hao Y C,Zhang X H,Xue J Q,Zhang R H.Effects of photosynthetic electron transport chain of maize leaves under drought stress and re-watering[J].Plant Physiology Journal,2017,53(10):1877-1884.
[4] 李立辉,王岩,胡海燕,赵天宏,郭书嫄,王伟,姚欣. 初花期干旱对不同抗旱性紫花苜蓿光合特征及荧光参数的影响[J]. 华北农学报,2015,30(4):126-131.doi:10.7668/hbnxb.2015.04.022.
Li L H,Wang Y,Hu H Y,Zhao T H,Guo S Y,Wang W,Yao X. Responses of photosynthetic characters and fluorescence parameters of alfalfa with different drought tolerances to drought[J]. Acta Agriculturae Boreali-Sinica,2015,30(4):126-131.
[5] 肖万欣,王延波,谢甫绨,赵海岩,刘晶,史磊. 干旱对玉米自交系叶片叶绿素荧光特性的影响[J]. 玉米科学,2015,23(4):54-61.doi:10.13597/j.cnki.maize.science.20150411.
Xiao W X,Wang Y B,Xie F T,Zhao H Y,Liu J,Shi L.Effects of drought on leaf chlorophyll fluorescence characteristics in maize inbred lines[J].Journal of Maize Sciences,2015,23(4):54-61.
[6] 田又升,范术丽,庞朝友,孙国清,张国丽,叶春秀,于航,马盼盼,苗领娟,谢宗铭. 全生育期干旱胁迫对棉花形态、生理、光合作用和产量的影响[J]. 华北农学报,2017,32(5):224-231.doi :10.7668/hbnxb.2017.05.033.
Tian Y S,Fan S L,Pang C Y,Sun G Q,Zhang G L,Ye C X,Yu H,Ma P P,Miao L J,Xie Z M. Effects of drought stress in the whole period on cotton morphology,physiology,photosynthesis and yield[J].Acta Agriculturae Boreali-Sinica,2017,32(5):224-231.
[7] 王海珍,韩路,徐雅丽,牛建龙,于军.土壤水分梯度对灰胡杨光合作用与抗逆性的影响[J].生态学报,2017,37(2):432-442.doi :10.5846/stxb201507291597.
Wang H Z,Han L,Xu Y,Niu J L,Yu J.Effects of soil water gradient on photosynthetic characteristics and stress resistance of Populus pruinosa in the Tarim Basin,China[J].Acta Ecologica Sinica,2017,37(2):432-442.
[8] 郭艳阳,刘佳,朱亚利,柏延文,李红杰,薛吉全,张仁和.玉米叶片光合和抗氧化酶活性对干旱胁迫的响应[J].植物生理学报,2018,54(12):1839-1846.doi :10.13592/j.cnki.ppj.2018.0437.
Guo Y Y,Liu J,Zhu Y L,Bai Y W,Li H J,Xue J Q,Zhang R H.Responses of photosynthetic and antioxidant enzyme activities in maize leaves to drought stress[J].Plant Physiology Journal,2018,54(12):1839-1846.
[9] 覃永嫒,温国泉,顾明华,王兵伟,郑加兴,覃嘉明,黄安霞,时成俏.干旱胁迫对4份玉米自交系生理与光合特性的影响[J].西南农业学报,2016,29(6):1264-1269.doi :10.16213/j.cnki.scjas.2016.06.005.
Qin Y A,Wen G Q,Gu M H,Wang B W,Zheng J X,Qin J M,Huang A X,Shi C Q.Effects of drought stress on physiology and photosynthesis in four maize onbred lines[J].Southwest China Journal of Agricultural Sciences,2016,29(6):1264-1269.
[10] Zhu J,Brown K M,Lynch J P.Root cortical aerenchyma improves the drought tolerance of maize(Zea mays,L.)[J].Plant Cell & Environment,2010,33(5):740-749.doi :10.1111/j.1365-3040.2009.02099.x.
[11] 马野,原换换,裴新涌,冉午玲,樊晓聪,郑博元,毛俊,杨青华,邵瑞鑫.干旱胁迫下外源油菜素内酯对玉米幼苗光合作用和D1蛋白的调控效应[J].华北农学报,2017,32(3):118-124.doi :10.7668/hbnxb.2017.03.018.
Ma Y,Yuan H H,Pei X Y,Ran W L,Fan X C,Zheng B Y,Mao J,Yang Q H,Shao R X.Exogenous BR alleviates drought stress by regulating photosynthesis and D1 protein in maize seedlings[J].Acta Agriculturae Boreali-Sinica,2017,32(3):118-124.
[12] Jiang T,Fountain J,Davis G,Kemerait R,ScullyR B,Lee D,Guo B Z.Root morphology and gene expression analysis in response to drought stress in maize(Zea mays)[J].Plant Molecular Biology Reporter,2012,30(2):360-369.doi:10.1007/s11105-011-0347-9.
[13] 于文颖,纪瑞鹏,冯锐,武晋雯,张玉书.干旱胁迫对玉米叶片光响应及叶绿素荧光特性的影响[J].干旱区资源与环境,2016,30(10):82-87.doi :10.13448/j.cnki.jalre.2016.321.
Yu W Y,Ji R P,Feng R,Wu J W,Zhang Y S.Effect of drought stress on light response and chlorophyll fluorescence of maize leaf[J].Journal of Arid Land Resources and Environment,2016,30(10):82-87.
[14] 张仁和,郑友军,马国胜,张兴华,路海东,史俊通,薛吉全.干旱胁迫对玉米苗期叶片光合作用和保护酶的影响[J].生态学报,2011,31(5):1303-1311.
Zhang R H,Zheng Y J,Ma G S,Zhang X H,Lu H D,Shi J T,Xue J Q.Effects of drought stress on photosynthetic traits and protective enzyme activity in maize seeding[J].Acta Ecologica Sinica,2011,31(5):1303-1311.
[15] 张兴华,高杰,杜伟莉,张仁和,薛吉全.干旱胁迫对玉米品种苗期叶片光合特性的影响[J].作物学报,2015,41(1):154-159.doi :10.3724/SP.J.1006.2015.00154.
Zhang X H,Gao J,Du W L,Zhang R H,Xue J Q.Effects of drought stress on photosynthetic characteristics of maize hybrids at seedling stage[J].Acta Agronomica Sinica,2015,41(1):154-159.
[16] 叶子飘.光合作用对光和CO2响应模型的研究进展[J].植物生态学报,2010,34(6):727-740.doi:10.3773/j.issn.1005-264x.2010.06.012.
Ye Z P.A review on modeling of responses of photosynthesis to light and CO2[J].Chinese Journal of Plant Ecology,2010,34(6):727-740.
[17] Thornley J H M.Mathematical models in plant physiology[M].London:Academic Press,1976:86-110.
[18] Platt T,Gallegos C L,Harrison W G.Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton[J].Journal of Marine Research,1980,38(4):687-701.
[19] Nemani R R,Keeling C D,Hashimoto H,Jolly W M,Piper S P,Tucker C J,Myneni R B,Running S W.Climatedriven increases in global terrestrial net primary production from 1982 to 1999[J].Science,2003,300:1560-1563.doi:10.1126/science.1082750.
[20] Morgan M R. Climate change 2001[J]. Weather,2004,59(8):235. doi:10.1256/wea.58.04.
[21] Earl H J.Stomatal and non-stomatal restrictions to carbon assimilation in soybean(Glycine max)lines differing in water use efficiency[J].Environmental & Experimental Botany,2002,48(3):237-246.doi:10.1016/S0098-8472(02)00041-2.
[22] Grassi G,Magnani F.Stomatal mesophyll conductance and biochemical limitations to photosynthesis as affected by drought and leaf ontogeny in ash and oak trees[J].Plant Cell & Environment,2005,28(7):834-849.doi:10.1111/j.1365-3040.2005.01333.x.
[23] Gallé A,Haldimann P,Feller U.Photosynthetic performance and water relations in young pubescent oak(Quercus pubescens)trees during drought stress and recovery[J].New Phytologist,2007,174(4):799-810.doi:10.1111/j.1469-8137.2007.02047.x.
[24] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33(4):317-345.doi:10.1146/annurev.pp.33.060182.001533.
[25] 孙广玉,邹琦,程炳嵩,王滔. 大豆光合速率和气孔导度对水分胁迫的响应[J]. 植物学报,1991,33(1):43-49.
Sun G Y,Zou Q,Cheng B S,Wang T.Responses stomatal ofphotosyntheticrateand conductance to water stress insoybeanleaves[J]. Journal of Integrative Plant Biology,1991,33(1):43-49.
[26] Kanechi M,Uchida N,Yasuda T,Yamaguchi T.Non-stomatal inhibition associated with inactivation of rubisco in dehydrated coffee leaves under unshaded and shaded conditions[J].Plant and Cell Physiology,1996,37:455-460.doi:10.1093/oxfordjournals.pcp.a028967.
[27] 黄红英,窦新永,孙蓓育,邓斌,吴国江,彭长连.两种不同生态型麻疯树夏季光合特性的比较[J]. 生态学报,2009,29(6):2861-2867.doi:10.3321/j.issn:1000-0933.2009.06.012.
Huang H Y,Dou X Y,Sun B Y,Deng B,Wu G J,Peng C L.Comparison of photosynthetic characteristics in two ecotypes of Jatropha curcas in summer[J].Acta Ecologica Sinica,2009,29(6):2861-2867.
[28] Deng X,Li X M,Zhang X M.The studies about the photosynthetic response of the four desert plants[J].Acta Ecologica Sinica,2003,23(3):598-605.doi:10.1023/A:1022289509702.
[29] Coste S,Roggy J C,Imbert P,Born C,Bonal D,Dreyer E.Leaf photosynthetic traits of 14 tropical rain forest species in relation to leaf nitrogen concentration and shade tolerance[J]. Tree Physiology,2005,25:1127-1137.doi:10.1093/treephys/25.9.1127.
[30] 张守仁.叶绿素荧光动力学参数的意义及讨论[J].植物学通报,1999(4):444-448.doi:10.3969/j.issn.1674-3466.1999.04.021.
Zhang S R.A discussion on chlorophyll fluorescence kinetics parameters and their significance[J].Chinese Bulletin of Botany,1999(4):444-448.