异源易位系/渐渗系的创制不仅为受体作物品种改良提供了丰富的种质资源,而且为外源基因在受体遗传背景下表达、互作等理论研究提供了珍贵的遗传材料[1-3]。分子标记在异源易位系/渐渗系外源染色体片段的鉴定与遗传稳定性分析中被广泛应用[4-5]。在芸薹属A 、C基因组种间外源片段的鉴定标记主要是SSR(Simple sequence repeat marker)标记[6-7]和InDel(Insert/delete marker)标记[8-9]。由于SSR标记在大白菜和甘蓝间的多态性比率相对较低[7,10],无法用于鉴定大白菜遗传背景中甘蓝外源小染色体片段的导入,基于大白菜和结球甘蓝基因组测序开发的InDel标记在大白菜-结球甘蓝易位系鉴定中表现了很大优势。如朱东旭等[11]从458 个InDel 标记中筛选出286 个标记表现出多态性,所占比率达到 62.45%,并鉴定了添加2号甘蓝染色体片段的易位系。李岩宾等[12]利用结球甘蓝C03染色体67个特异InDel标记从大白菜-结球甘蓝1号染色体二体异附加系自交后代中鉴定了一系列添加结球甘蓝C03染色体/染色体片段的异附加系或易位系。但InDel标记主要位于基因间隔区[13],无法鉴定具体导入的外源染色体片段、基因在大白菜染色体的精确位置,以及确定感兴趣基因是否能够稳定遗传,这为易位系中外源基因的表达调控和互作研究带来了困难。
基因标记(Gene marker)是基于基因与基因之间的多态性开发的一类分子标记,相对于其他的分子标记而言具有更强的针对性,并且基于表型相关的功能基因序列开发的基因标记可直接用来研究作物表型性状的变异。张涛等[14]利用产量功能基因标记对76 份籼型三系杂交水稻亲本进行了类群划分和遗传多样性分析。王军等[15]通过利用水稻香米2个等位基因的基因标记,对22个水稻品种进行了检测,证明分子检测结果与香米的基因型完全相符。田志喜等[16]通过分析水稻在淀粉合成中的重要基因序列设计了区分不同等位基因的分子标记。这些研究结果为水稻基因标记辅助选择及分子育种提供了参考依据。
本研究基于大白菜(Brassica rapa ssp. pekinensis,AA,2n=20)、结球甘蓝(B. oleracea L. var. capitata L.,CC,2n=18)基因组重测序结果,通过比对结球甘蓝外源染色体区段基因与大白菜共线性基因序列,根据序列差异位点设计引物,进行种间基因特异性标记的筛选与多态性鉴定,旨为外源染色体片段特异性的鉴定提供技术支持,并为深入开展甘蓝外源基因在大白菜遗传背景下的表达调控及互作研究奠定基础。
1 材料和方法
1.1 供试材料
植物材料:2个均添加结球甘蓝C03染色体顶端9个相同InDel标记的大白菜易位系AT1-41和AT1-47,易位系亲本大白菜自交系85-1和结球甘蓝自交系11-1;易位系AT1-47自交后代; 4个大白菜商品种山东6号、滕州白菜、北京新三号和油绿三号;4个结球甘蓝商品种中甘11、胜世金刚、元宝和绿砖55。
9个InDel标记在易位系中均能扩增出两亲本的特异条带,其引物信息见表1。
表1 9个InDel标记信息
Tab.1 Information of 9 InDel markers
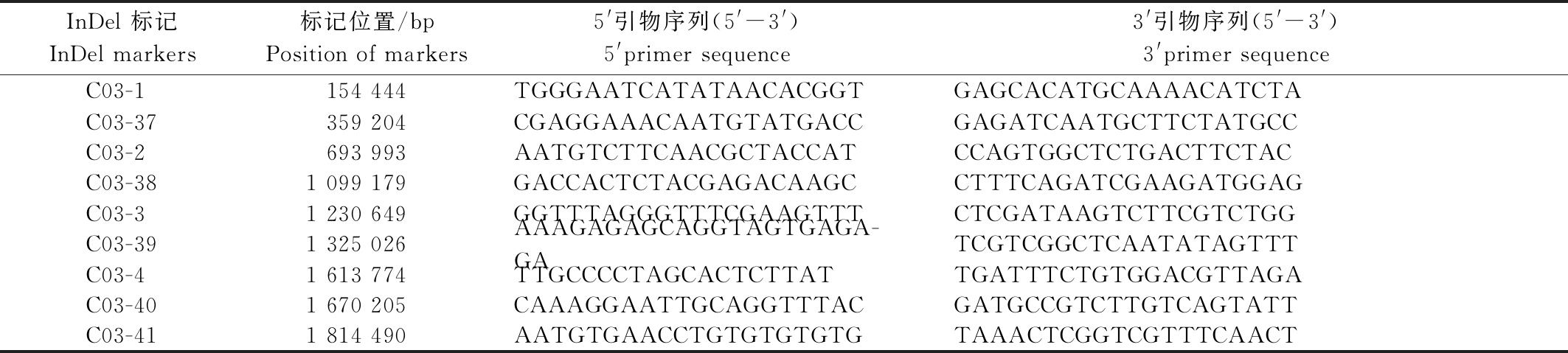
InDel 标记InDel markers标记位置/bpPosition of markers5'引物序列(5'-3')5'primer sequence3'引物序列(5'-3')3'primer sequenceC03-1154 444TGGGAATCATATAACACGGTGAGCACATGCAAAACATCTAC03-37359 204CGAGGAAACAATGTATGACCGAGATCAATGCTTCTATGCCC03-2693 993AATGTCTTCAACGCTACCATCCAGTGGCTCTGACTTCTACC03-381 099 179GACCACTCTACGAGACAAGCCTTTCAGATCGAAGATGGAGC03-31 230 649GGTTTAGGGTTTCGAAGTTTCTCGATAAGTCTTCGTCTGGC03-391 325 026AAAGAGAGCAGGTAGTGAGA-GATCGTCGGCTCAATATAGTTTC03-41 613 774TTGCCCCTAGCACTCTTATTGATTTCTGTGGACGTTAGAC03-401 670 205CAAAGGAATTGCAGGTTTACGATGCCGTCTTGTCAGTATTC03-411 814 490AATGTGAACCTGTGTGTGTGTAAACTCGGTCGTTTCAACT
1.2 试验方法
1.2.1 引物设计与合成 结合白菜、甘蓝基因组测序资料,从白菜基因组网站(http://brassicadb.org/brad/)上利用Search工具查找甘蓝染色体片段154 444~1 814 490 bp区段及其侧翼20 kb所有的基因,及与之对应的大白菜A03染色体共线性基因,下载其核苷酸序列,利用DNAMAN比对共线性基因核苷酸序列差异位点,查找差异位点,利用Primer premier 5.0软件设计引物,引物覆盖差异位点,共成功设计特异引物171对,其中140对引物是基于甘蓝基因序列设计(以BoC03开头),31对引物是基于白菜基因序列设计(以BrA03开头)。所设计引物由上海生物工程技术有限公司合成。
1.2.2 基因组DNA提取 采用改良的CTAB法提取基因组DNA。
1.2.3 标记的PCR扩增 PCR反应总体系20 μL,体系中各组分含量为:10×PCR Buffer(含Mg2+) 2 μL,2.5 mmol/L dNTPs 1.6 μL,1 U Taqase 0.2 μL,50 ng/μL Forward primer 1 μL,50 ng/μL Reverse primer 1 μL,30 ng/μL模板DNA 2 μL,灭菌双蒸水12.2 μL。
PCR扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55~57 ℃退火30 s(根据引物不同对退火温度进行调整),72 ℃延伸1.5 min,共计35个循环;72 ℃延伸10 min,4 ℃保存。
1.2.4 PCR产物检测 采用1.2%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 基因标记引物在大白菜和结球甘蓝基因组中的扩增结果
共下载甘蓝基因263个和白菜基因254个,其中9个甘蓝基因在白菜基因组中不存在共线性基因。以大白菜85-1和结球甘蓝11-1基因组DNA为模板,利用设计的171对引物进行PCR扩增,结果表明,共有66对引物在大白菜85-1和结球甘蓝11-1间表现为多态性(表2),占总引物的比率为38.60%。其中,基于结球甘蓝基因序列设计的引物有48对,43对在结球甘蓝中表现为特异扩增而在大白菜中无扩增,5对在大白菜和结球甘蓝中扩增条带位置不同(表2,带*标注);基于大白菜基因设计的引物有18对,16对在大白菜中表现为特异扩增而在结球甘蓝中无扩增,2对在大白菜和结球甘蓝中扩增条带位置不同(表2,带*标注)。此外,还有8对基于甘蓝基因序列设计的引物在大白菜和结球甘蓝中均有扩增条带且位置相同,但在结球甘蓝的扩增强度明显强于在大白菜中的扩增强度,占总引物的比率为4.67%。图1是部分引物在亲本大白菜和结球甘蓝基因组中的扩增结果。
表2 多态性引物编号及参考序列的基因编号
Tab.2 No. of the polymorphism primers and genes providing the reference sequences
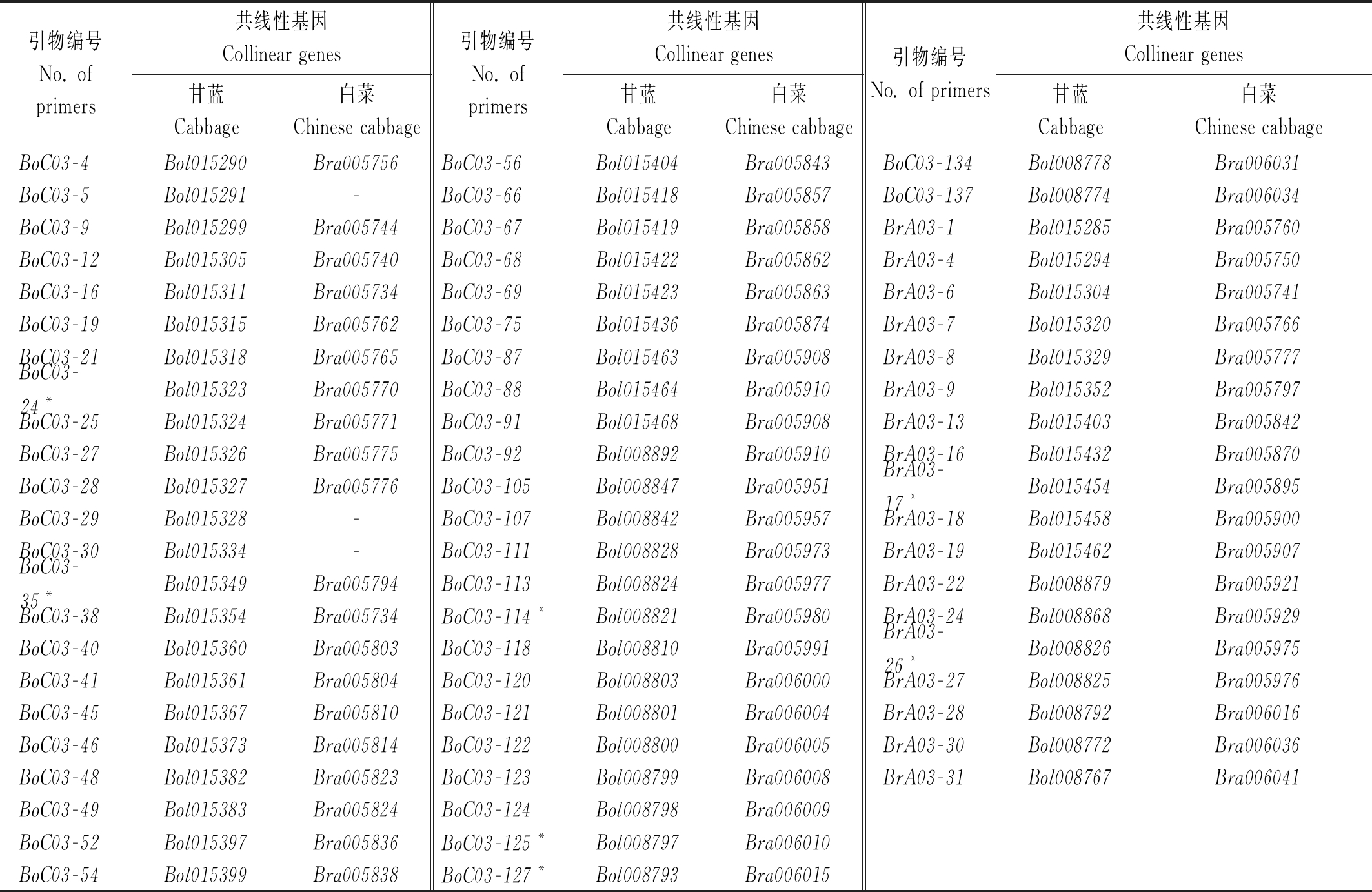
引物编号No. of primers共线性基因Collinear genes甘蓝Cabbage白菜Chinese cabbage引物编号No. of primers共线性基因Collinear genes甘蓝Cabbage白菜Chinese cabbage引物编号No. of primers共线性基因Collinear genes甘蓝Cabbage白菜Chinese cabbageBoC03-4Bol015290Bra005756BoC03-56Bol015404Bra005843 BoC03-134Bol008778Bra006031BoC03-5Bol015291-BoC03-66Bol015418Bra005857 BoC03-137Bol008774Bra006034BoC03-9Bol015299Bra005744BoC03-67Bol015419Bra005858BrA03-1Bol015285Bra005760BoC03-12Bol015305Bra005740BoC03-68Bol015422Bra005862BrA03-4Bol015294Bra005750BoC03-16Bol015311Bra005734BoC03-69Bol015423Bra005863BrA03-6Bol015304Bra005741BoC03-19Bol015315Bra005762BoC03-75Bol015436Bra005874BrA03-7Bol015320Bra005766BoC03-21Bol015318Bra005765BoC03-87Bol015463Bra005908BrA03-8Bol015329Bra005777BoC03-24*Bol015323Bra005770BoC03-88Bol015464Bra005910BrA03-9Bol015352Bra005797BoC03-25Bol015324Bra005771BoC03-91Bol015468Bra005908BrA03-13Bol015403Bra005842BoC03-27Bol015326Bra005775BoC03-92Bol008892Bra005910BrA03-16Bol015432Bra005870BoC03-28Bol015327Bra005776BoC03-105Bol008847Bra005951BrA03-17*Bol015454Bra005895BoC03-29Bol015328-BoC03-107Bol008842Bra005957BrA03-18Bol015458Bra005900BoC03-30Bol015334-BoC03-111Bol008828Bra005973BrA03-19Bol015462Bra005907 BoC03-35*Bol015349Bra005794BoC03-113Bol008824Bra005977BrA03-22Bol008879Bra005921BoC03-38Bol015354Bra005734BoC03-114*Bol008821Bra005980BrA03-24Bol008868Bra005929BoC03-40Bol015360Bra005803BoC03-118Bol008810Bra005991BrA03-26*Bol008826Bra005975BoC03-41Bol015361Bra005804BoC03-120Bol008803Bra006000BrA03-27Bol008825Bra005976BoC03-45Bol015367Bra005810BoC03-121Bol008801Bra006004BrA03-28Bol008792Bra006016BoC03-46Bol015373Bra005814BoC03-122Bol008800Bra006005BrA03-30Bol008772Bra006036BoC03-48Bol015382Bra005823BoC03-123Bol008799Bra006008BrA03-31Bol008767Bra006041BoC03-49Bol015383Bra005824BoC03-124Bol008798Bra006009BoC03-52Bol015397Bra005836BoC03-125*Bol008797Bra006010BoC03-54Bol015399Bra005838BoC03-127*Bol008793Bra006015
注:*.该引物在甘蓝和白菜基因组中均有扩增产物但位置不同。
Note:*.The pair of primers with the amplification product different in Chinese cabbage and cabbage.
为了便于后续分析,将基于甘蓝基因序列设计的48对引物,和基于白菜基因序列设计且在结球甘蓝和大白菜中均有扩增但位置不同的2对引物,共50对引物确定为结球甘蓝相对于大白菜特异的基因标记。
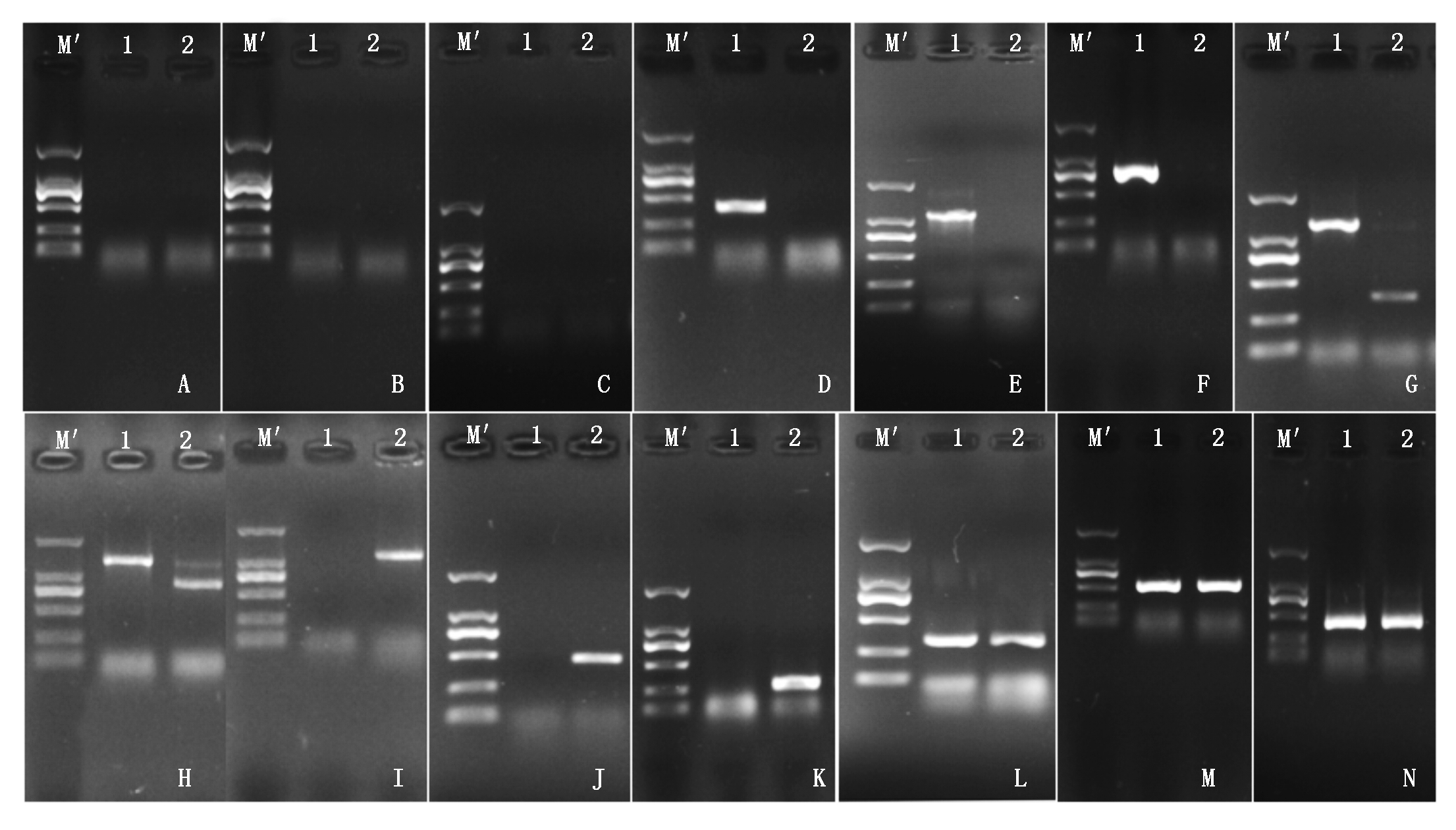
A-C.无扩增产物;D-E.85-1特异扩增;F-H.85-1和11-1扩增条带位置不同;I-K.11-1特异扩增;L-N.85-1和11-1有扩增无多态性。M′.Marker DL2000; 1.85-1;2.11-1。 A.BoC03-7;B.BoC03-13;C.BoC03-110;D.BrC03-9;E.BrC03-19;F.BrC03-29;G.BrC03-26;H.BoC03-124;I.BoC03-120;J.BoC03-114;K.BoC03-107; L.BrC03-5;M.BoC03-8;N.BrC03-19.
A-C.PCR-free product; D-E. 85-1 with specific PCR product; F-H.Different PCR products in 85-1 and 11-1; I-K. 11-1 with PCR product; L-N.PCR products without polymorphism in 85-1 and 11-1. M′.Marker DL2000; 1.85-1;2.11-1. A.BoC03-7;B.BoC03-13;C.BoC03-110;D.BrC03-9;E. BrC03-19;F.BrC03-29;G.BrC03-26;H.BoC03-124;I.BoC03-120;J.BoC03-114;K.BoC03-107; L.BrC03-5;M.BoC03-8;N.BrC03-19.
图1 部分引物在85-1和11-1基因组中的扩增结果
Fig.1 PCR amplification of some primers in the genomes of 85-1 and 11-1
2.2 结球甘蓝特异基因标记在大白菜-结球甘蓝易位系中的鉴定
利用获得的50个结球甘蓝相对特异的基因标记引物对易位系AT1-41和AT1-47进行鉴定。琼脂糖凝胶电泳检测结果表明,50个供试标记在2个易位系中均可扩增出与结球甘蓝相同的条带(图2),表明这些基因均随甘蓝外源片段导入了大白菜-结球甘蓝易位系。进一步利用这50个标记对AT1-47自交后代进行鉴定,结果均在供试的30株自交后代中表现出与甘蓝C03染色体特异的InDel标记一致的多态性,能够将携带外源基因的植株鉴定出来(图3)。研究结果为大白菜-结球甘蓝易位系的精确鉴定提供了技术支持,为外源基因的功能研究奠定了基础。
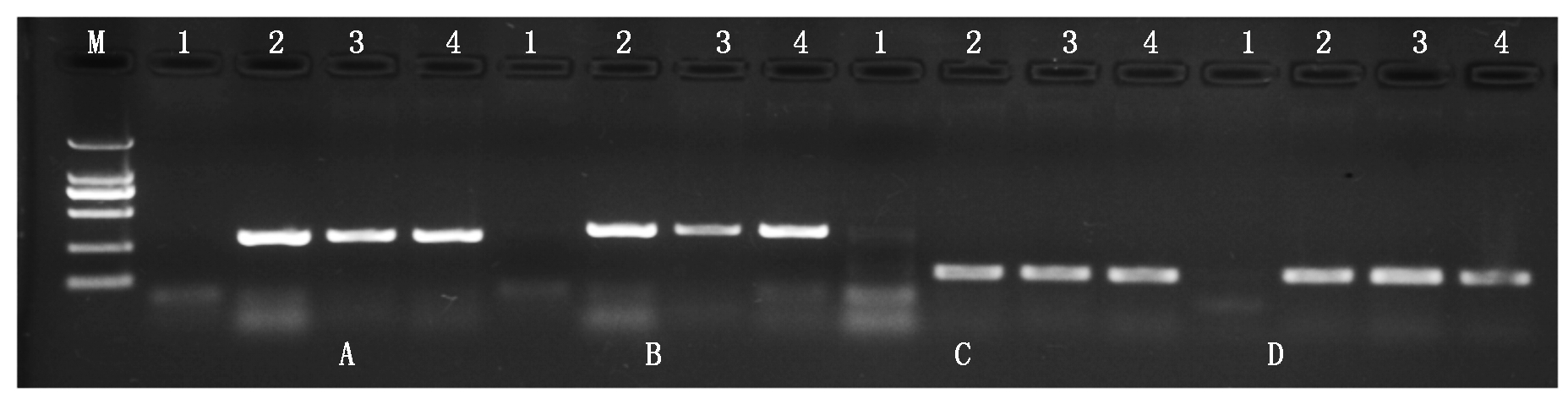
M.Marker DL2000; 1.85-1; 2.11-1; 3.AT1-41; 4.AT1-47;A.BoC03-4; B.BoC03-5; C.BoC03-9; D.BoC03-12。
图2 部分基因标记在易位系及其亲本中的扩增结果
Fig.2 PCR amplification of gene markers in the translocation lines and their parents
2.3 基因标记在大白菜和结球甘蓝种间鉴定中的应用
为了验证开发的多态性基因标记在大白菜和结球甘蓝物种间的通用性,为大白菜和结球甘蓝种间鉴定提供技术支持,以4个大白菜和4个结球甘蓝商品种基因组DNA为模板,用获得的66对多态性引物进行PCR扩增,结果表明,共有52个基因标记能将4个大白菜和4个结球甘蓝品种完全鉴别出来,所占比率为78.79%,包括根据结球甘蓝基因开发的38个标记和根据大白菜基因开发的14个标记;有11个标记仅在部分品种中表现出多态性,占16.67%;还有3个标记在供试大白菜和结球甘蓝品种中均没有扩增结果。部分标记扩增结果见图4。
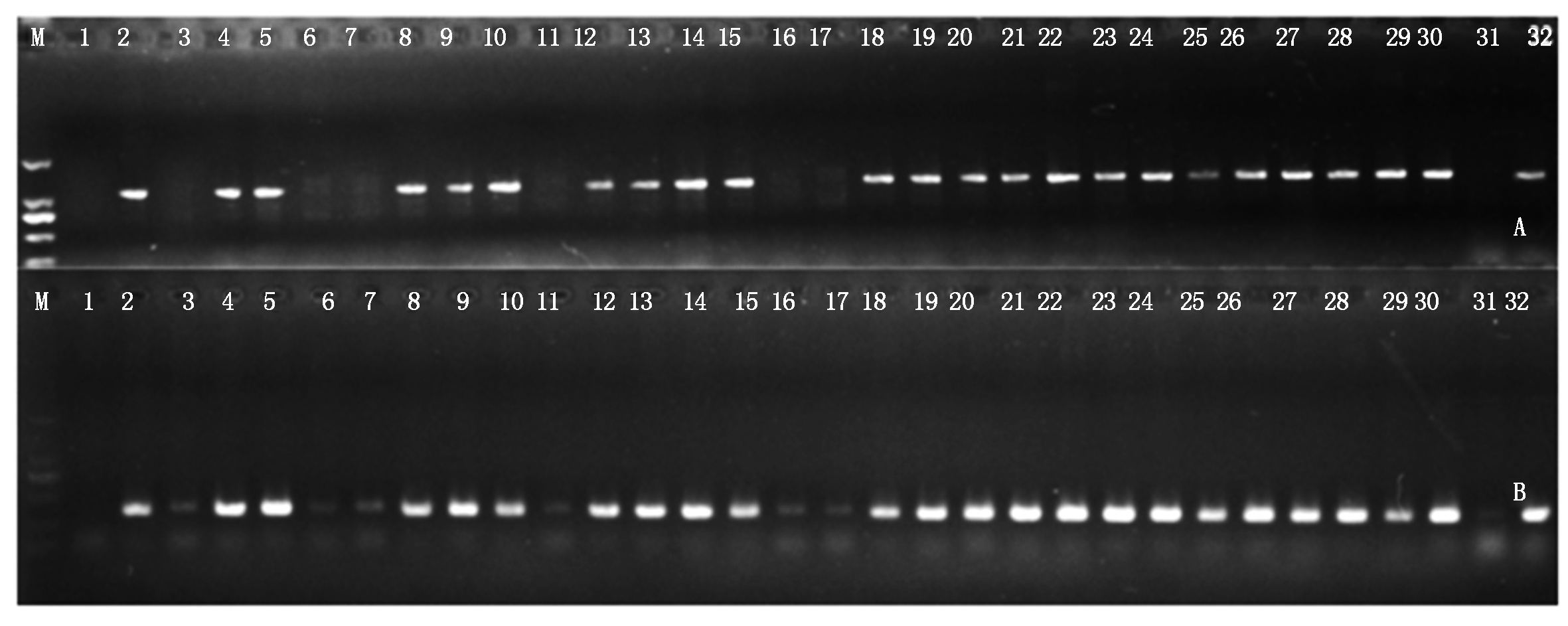
M.Marker DL2000; 1.85-1; 2.11-1; 3-32.易位系AT1-47自交后代;A.BoC03-3; B.BoC03-9。 M.Marker DL2000; 1.85-1; 2.11-1; 3-32.The selfing offspring of translocation line AT1-47;A.BoC03-3; B.BoC03-9.
图3 BoC03-3和BoC03-9在易位系AT1-47自交后代中的扩增结果
Fig.3 PCR amplification of BoC03-3 and BoC03-9 in the selfing offspring of translocation line AT1-47
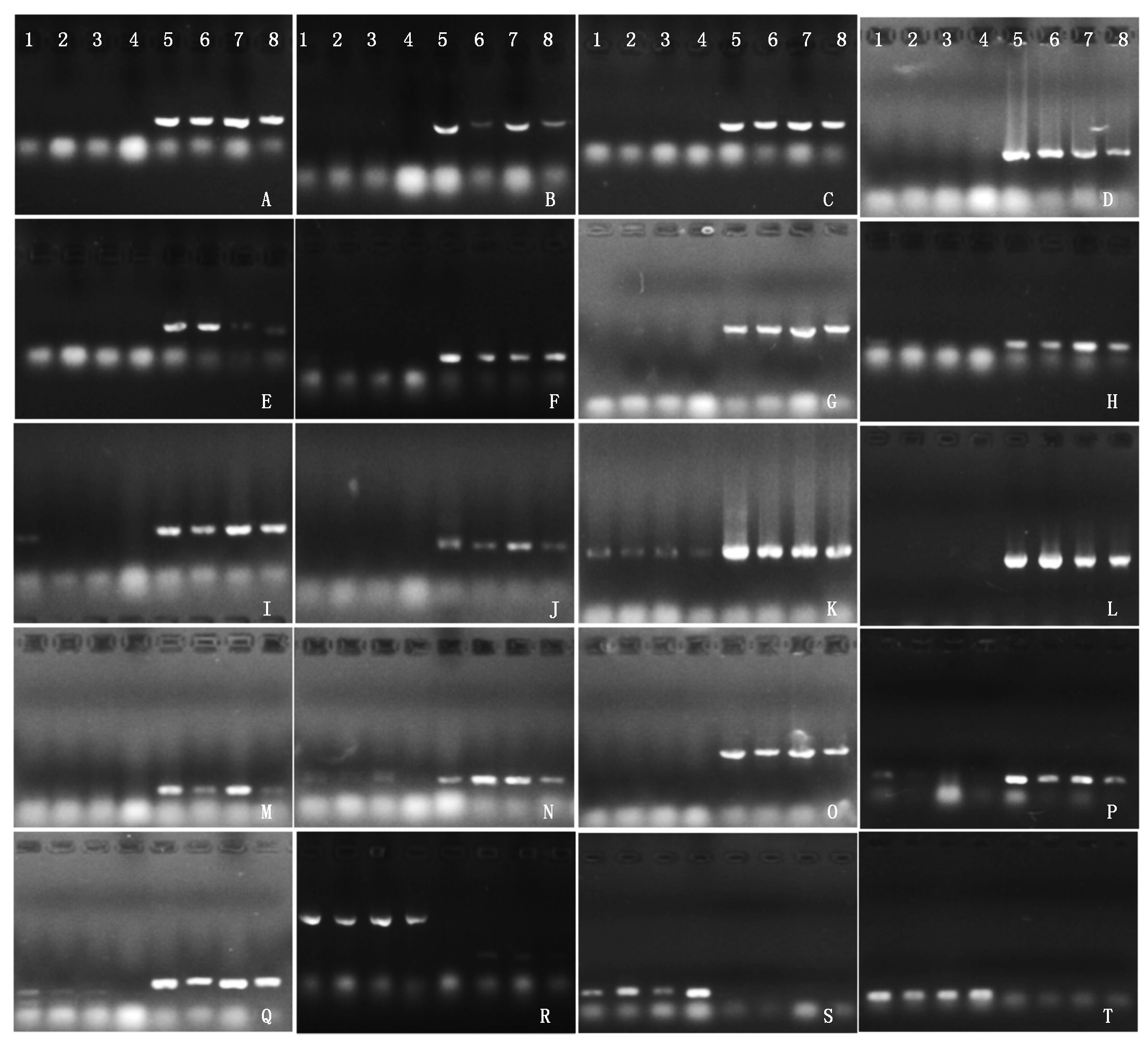
1.山东6号; 2.滕州白菜; 3.北京新三号; 4.油绿三号; 5.中甘11; 6.胜世金刚; 7.元宝; 8.绿砖55;A.BoC03-3; B.BoC03-4; C.BoC03-6; D.BoC03-12; E.BoC03-16; F.BoC03-19; G.BoC03-24; H.BoC03-27; I.BoC03-38; J.BoC03-41; K.BoC03-41; L.BoC03-46; M.BoC03-49; N.BoC03-54; O.BoC03-65; P.BoC03-67; Q.BoC03-72; R.BrA03-1; S.BrA03-4; T.BrA03-6。
1.Shandong No.6; 2.Tengzhoubaicai; 3.Beijingxin No.3; 4.Youlü No.3; 5.Zhonggan 11; 6.Shengshijingang; 7.Yuanbao; 8.Lüzhuan No.55; A.BoC03-3; B.BoC03-4; C.BoC03-6; D.BoC03-12; E.BoC03-16; F.BoC03-19; G.BoC03-24; H.BoC03-27; I.BoC03-38; J.BoC03-41; K.BoC03-41; L.BoC03-46; M.BoC03-49; N.BoC03-54; O.BoC03-65; P.BoC03-67; Q.BoC03-72; R.BrA03-1; S.BrA03-4; T.BrA03-6.
图4 部分引物在大白菜和结球甘蓝商品种基因组中的扩增结果
Fig.4 PCR amplification of some primers in the varieties of Chinese cabbage and cabbage
3 结论与讨论
分子标记在基因型确定、遗传多样性分析、标记辅助育种和系统发育分析等研究中是非常有价值的工具,近年来已广泛应用于多种外源片段易位系、渐渗系、导入系的鉴定中,为外源片段的鉴定、外源基因的功能研究提供了有力的工具[17-19]。如Hirani等[20]通过构建大白菜-花椰菜渐渗系利用分子标记找到硫苷合成同源基因替换位点,揭示了该基因位点的差异对于脂肪族硫苷碳链延长的重要作用。赵振国[21]利用分子标记定位了黄瓜-酸黄瓜抗霜霉病渐渗系中抗霜霉病基因,为其精细定位及图位克隆奠定了基础。
Geleta等[22]研究结果表明,油用白菜和芥蓝之间多态性SSR标记所占比例达到62.45%。顾爱侠等[7]、李雪姣等[10]利用SSR在大白菜和结球甘蓝间进行多态性标记鉴定,多态性SSR所占比例仅为27.47%和15.9%,表明相对于油用白菜和芥蓝,大白菜和结球甘蓝基因组具有更高的同源性。朱东旭等[11]研究表明,相对于SSR标记,针对大白菜和结球甘蓝基因组序列开发的InDel标记多态性可以达到62.45%。本研究根据结球甘蓝与大白菜共线性基因序列差异位点开发的基因标记,其多态性远低于InDel标记,仅占总设计引物的38.60%,其原因主要是大白菜和结球甘蓝之间的共线性基因同源性很高,很难设计出能够区分二者的特异性引物;此外,还有部分引物未进行反应体系的优化造成没有扩增产物。尽管开发的这些基因标记多态性较InDel标记低,但却加密了InDel标记之间的区段,为外源片段的精确鉴定提供了保证。此外,开发的结球甘蓝相对于大白菜特异的基因标记引物,大都适用于RT-PCR分析,其中很多基因具有重要的生物学功能,如对硫甙葡萄糖苷合成起调控作用的转录因子MYB29,细胞色素合成基因CYP79A2等,这为进一步深入开展甘蓝外源基因在大白菜遗传背景下的表达调控及互作研究奠定了基础。
利用开发的多态性基因标记对4个结球甘蓝和4个大白菜品种进行了鉴定,结果表明78.79%的基因标记能完全区分结球甘蓝和大白菜品种,16.67%的基因标记在部分品种中表现出多态性,这些标记为白菜和甘蓝种间鉴定提供了有力的支持。但鉴于其多为显性标记,在区分杂合子方面可能会存在一定局限。
[1] Qi W L,Tang Y,Zhu W,Li D Y,Diao C D,Xu L L,Zeng J,Wang Y,Fan X,Sha L A,Zhang H Q,Zheng Y L,Zhou Y H,Kang H Y. Molecular cytogenetic characterization of a new wheat-rye 1BLaEuro cent 1RS translocation line expressing superior stripe rust resistance and enhanced grain yield[J].Planta,2016,244(2):405-416.doi:10.1007/s00425-016-2517-3.
[2] Wang L,Yuan J H,Bie T D,Zhou B,Chen P D. Cytogenetic and molecular identification of three Triticum aestivum-Leymus racemosus translocation addition lines[J]. Journal of Genetics and Genomics,2009,36(6):379-385.doi:10.1016/S1673-8527(08)60127-7.
[3] 陈雅玲,罗向东,张帆涛,戴亮芳,胡标林,谢建坤. 东乡野生稻基因渐渗系中逆转座子逆转录酶序列的克隆及表达分析[J]. 植物学报,2013,48(2):138-144. doi:10.3724/SP.J.1259.2013.00138.
Chen Y L,Luo X D,Zhang F T,Dai L F,Hu B L,Xie J K. Cloning and expression analysis of retrotransposon reverse transcriptase in introgression lines from Dongxiang wild rice[J]. Bulletin of Botany,2013,48(2):138-144.
[4] 王虹,白杨,李集临,张延明. 小麦-黑麦小片段易位系的分子细胞遗传学分析[J]. 植物遗传资源学报,2014,15(2):383-388. doi:10.13430/j.cnki.jpgr.2014.02.023.
Wang H,Bai Y,Li J L,Zhang Y M. Molecular cytogenetic analysis of wheat-rye small fragment translocation lines[J]. Journal of Plant Genetic Resources,2014,15(2):383-388.
[5] 曹立超,樊双虎,张春义,陈茹梅. 大刍草渐渗系雌穗表型统计及SNP分子标记开发[J]. 种子,2014,33(4):42-47,68. doi:10.3969/j.issn.1001-4705.2014.04.013.
Cao L C,Fan S H,Zhang C Y,Chen R M. Female spike phenotypic statistics of teosinte introgression and development of SNP marker[J]. Seed,2014,33(4):42-47,68.
[6] 孟雅宁,王彦华,顾爱侠,李晓峰,申书兴. 大白菜-结球甘蓝5号二体异附加系的选育及鉴定[J]. 中国农业科学,2010,43(14):2937-2943. doi:10.3864/j.issn.0578-1752.2010.14.012.
Meng Y N,Wang Y H,Gu A X,Li X F,Shen S X. Generation and identification of 5 Chinese cabbage-cabbage disomic alien addition lines[J]. Scientia Agricultura Sinica,2010,43(14):2937-2943.
[7] 顾爱侠,王彦华,轩淑欣,陈雪平,申书兴.结球甘蓝相对于大白菜的连锁群特异SSR标记建立[J]. 园艺学报,2009,36(8):1221-1226. doi:10.3864/j.issn.0578-1752.2010.14.012.
Gu A X,Wang Y H,Xuan S X,Chen X P,Shen S X. Establishment of specific SSR from different linkage groups of cabbage compared with Chinese cabbage[J]. Acta Horticulturae Sinica,2009,36(8):1221-1226.
[8] 耿倩倩,王彦华,轩淑欣,毛清云,赵建军,申书兴.添加甘蓝2号染色体片段的大白菜易位系的获得及其遗传稳定性分析[J]. 园艺学报,2016,43(2):261-270. doi:10.16420/j.issn.0513-353x.2015-0858.
Geng Q Q,Wang Y H,Xuan S X,Mao Q Y,Zhao J J,Shen S X. Obtaining and genetic stability of Chinese cabbage-cabbage translocation lines with fragment of cabbage chromosome 2[J]. Acta Horticulturae Sinica,2016,43(2):261-270.
[9] 闫珍臣,王彦华,轩淑欣,赵建军,申书兴.添加甘蓝8号染色体片段的大白菜易位系的获得及其遗传稳定性分析[J]. 园艺学报,2015,42(6):1085-1092. doi:10.16420/j.issn.0513-353x.2015-0127.
Yan Z C,Wang Y H,Xuan S X,Zhao J J,Shen S X. Obtaining and genetic stability of Chinese cabbage-cabbage translocation lines with fragment of cabbage chromosome 8[J]. Acta Horticulturae Sinica,2015,42(6):1085-1092.
[10] 李雪姣,王彦华,轩淑欣,赵建军,顾爱侠.大白菜相对于结球甘蓝连锁群特异SSR标记的筛选[J]. 植物遗传资源学报,2013,14(4):694-698.
Li X J,Wang Y H,Xuan S X,Zhao J J,Gu A X. Screening of specific SSR markers on different linkage groups of Chinese cabbage compared with cabbage[J]. Journal of Plant Genetic Resources,2013,14(4):694-698.
[11] 朱东旭,王彦华,赵建军,刘博,李晓峰. 轩淑欣,申书兴.结球甘蓝相对于大白菜连锁群特异InDel标记的建立及应用[J]. 园艺学报,2014,41(8):1699-1706.
Zhu D X,Wang Y H,Zhao J J,Liu B,Li X F,Xuan S X,Shen S X. Establishment and application of specific InDel markers on different linkage groups of cabbage compared with Chinese cabbage[J]. Acta Horticulturae Sinica,2014,41(8):1699-1706.
[12] 李岩宾,轩淑欣,王彦华,冯大领,赵建军,申书兴.大白菜-结球甘蓝1号染色体二体异附加系自交后代InDel标记分析和染色体数鉴定[J]. 园艺学报,2015,42(7):1329-1337. doi:10.16420/j.issn.0513-353x.2015-0106.
Li Y B,Xuan S X,Wang Y H,Feng D L,Zhao J J,Shen S X. Analysis of InDel markers and identification of chromosome number in selfing progenies of Chinese cabbage head cabbage chromosome 1 disomic alien addition line[J]. Acta Horticulturae Sinica,2015,42(7):1329-1337.
[13] 岳晓鹏. 基于甘蓝性油菜基因组重测序开发InDel标记[D]. 武汉:华中农业大学,2014.
Yue X P. Developmeng of indel markers based on whole genome resequencing in Brassica napus[D].Wuhan:Huazhong Agricultural University,2014.
[14] 张涛,杨蛟,蒋开锋,曹应江,杨莉,杨乾华,万先齐,游书梅,罗婧,高磊,李昭祥,郑家奎. 利用产量功能基因标记分析三系杂交水稻亲本的遗传多样性[J]. 中国农业科学,2014,47(1):11-23. doi:10.3864/j.issn.0578-1752.2014.01.002.
Zhang T,Yang J,Jiang K F,Cao Y J,Yang L,Yang Q H,Wan X J,You S M,Luo J,Gao L,Li Z X,Zheng J K. Genetic diversity of the main Chinese three-line hybrid rice parents based on functional genetic markers related to yield[J]. Scientia Agricultura Sinica,2014,47(1):11-23.
[15] 王军,杨杰,陈志德,仲维功. 水稻香米基因标记的开发与应用[J]. 分子植物育种,2008,6(6):1209-1212. doi:10.3969/j.issn.1672-416X.2008.06.030.
Wang J,Yang J,Chen Z D,Zhong W G. Development and application of fragrance gene markers in rice[J]. Molecular Plant Breeding,2008,6(6):1209-1212.
[16] 田志喜,严长杰,钱前,严松,谢会兰,王芳,徐洁芬,刘贵富,王永红,刘巧泉,汤述翥,李家洋,顾铭洪. 水稻淀粉合成相关基因分子标记的建立[J]. 科学通报,2010,55(26):2591-2601. doi:10.1007/s11434.
Tian Z X,Yan C J,Qian Q,Yan S,Xie H L,Wang F,Xu J F,Liu G F,Wang Y H,Liu Q Q,Shang S Z,Li J Y,Gu M H. Development of gene-tagged molecular markers for starch synthesis-related genes in rice[J]. Chinese Science Bulletin,2010,55(26):2591-2601.
[17] Yonemaru J I,Choi S H,Sakai H,Ando T,Shomura A,Yano M,Wu J Z,Fukuoka S. Genome-wide indel markers shared by diverse Asian rice cultivars compared to Japanese rice cultivar Koshihikari[J].Breeding Science,2015,65(3):249-256.doi:10.1270/jsbbs.65.249.
[18] Liu L F,Dang P M,Chen C Y.Development and utilization of InDel markers to identify peanut (Arachis hypogaea) disease resistance[J].Frontiers in Plant Science,2015,6:988. doi:10.3389/fpls.2015.00988.
[19] 侯璐,宋晓贺,路亚明,胡茂林,贺苗苗,井金学,王保通. 小簇麦易位系V9128-3抗条锈病基因的遗传分析和SSR分子标记[J]. 植物病理学报,2009,39(1):67-75.doi:10.3321/j.issn:0412-0914.2009.01.010.
Hou L,Song X H,Lu Y M,Hu M L,He M M,Jing J X,Wang B T. Genetic analysis and SSR molecular mapping of translocation line V9128-3 drived from Haynaldia villosa resistance to stripe rust[J]. Acta Phytopathologica Sinica,2009,39(1):67-75.
[20] Hirani A H,Zelmer C D,Mcvetty P B,Li G Y. Homoeologous GSL-ELONG gene replacement for manipulation of aliphatic glucosinolates in Brassica rapa L. by marker assisted selection[J].Frontiers In Plant Science,2013,4:55.doi:10.3389/fpls.2013.00055.
[21] 赵振国. 黄瓜-酸黄瓜抗霜霉病渐渗系分子标记的筛选及细胞程序性死亡相关基因的表达分析[D]. 南京:南京农业大学,2011.
Zhao Z G. Screening of molecular for downy mildew resistance introgression line of Cucumis hystris-C.sativus and ananlysis of programmed cell death[D].Nanjing:Nanjing Agricultural University,2011.
[22] Geleta M,Heneen W K,Stoute A I,Scott R J,King G J,Kurup S,Bryngelsson T. Assigning brassica microsatellite markers to the nine c-genome chromosomes using Brassica rapa var. trilocularis-B. oleracea var. alboglabra monosomic alien addition lines[J].Theoretical and Applied Genetics,2012,125(3):455-466.doi:10.1007/s00122-012-1845-3.