大豆(Glycine max L. Merr.)是中国重要的粮食作物之一,已有5 000 a栽培历史,中国东北为主要产区,大豆中含有丰富且比较全面的营养素,是我国重要的含有高蛋白质的农作物。大豆不仅是世界上最初进行转基因大面积商业化种植的作物,而且也是种植面积最大的转基因作物。目前,在培育高产优质大豆新品种中,转基因技术已经成为非常重要的技术手段[1]。随着人们生活水平的不断提高,中国对大豆的需求量持续增加。
F-box 基因广泛存在于各种植物中,是植物最大的基因家族之一。最初由Kumar等[2]于1995年因发现存在于细胞周期蛋白Cyclin F而得名。大豆、玉米和鹰嘴豆分别含有 509,359,285 个 F-box 基因[3-5],F-box蛋白作为SCF复合物的主要亚基,可以通过蛋白质N末端的F-box基序与Skp1结合,该基序由40~50个氨基酸基序组成[6]。F-box基因在调节各种生命活动中具有重要作用,包括激素反应、侧根形成、衰老、花发育、自交不亲和等,以及对非生物和生物胁迫的反应[7-10]。例如,从小麦(Triticum aestivum L.)中分离出F-box基因TaFBA1发现过量表达TaFBA1的转基因植物的耐旱性得到了改善[11]。DOR在拟南芥中编码F-box蛋白,其在干旱胁迫下作为ABA诱导的气孔关闭的抑制剂起作用[12]。许媛等[13]经过研究发现,F-box蛋白与植物的干旱胁迫、盐碱胁迫、低温胁迫、重金属胁迫、抗病性相关。Unusual Floral Organs(UFO)是拟南芥中发现的第一个F-box蛋白,UFO是花分生组织特性和花器官发育所必需的[14-15]。霍冬英等[16]发现谷子Si F-box18对干旱、高盐和 ABA 等都有响应,推测 Si F-box18 基因可能在非生物胁迫响应中起重要的作用。于兰芳等[17]对葡萄干旱转录组进行分析,发现11个F-box基因受干旱胁迫的诱导表达,并对干旱响应最强烈的Vv F-box5基因进行了进一步的鉴定发现Vv F-box5与信号传导、抗病相关。刘选明等[18]经研究发现,F-box蛋白 FOF2参与了逆境胁迫,不同非生物胁迫的处理中,FOF2的功能表现并不完全一致,表明 FOF2在植物抗逆境胁迫响应中的多重性特征。
关于植物F-box基因的信息主要来自拟南芥的研究,而关于大豆F-box基因(GmFBXs)的知识非常有限。据笔者所知,虽然已经在大豆中预测了数百种F-box基因,但只有2种,即GmCOI1和GmZTL3,已被克隆并在功能上表征。GmCOI1与AtCOI1具有高百分比同源性,可能参与茉莉酮酸途径[19]。GmZTL3是AtZTL的同源物,参与光信号传导[20]。本研究以栽培大豆Williams 82的基因为材料,对Glyma08g11030基因进行了生物信息学分析,并用Glyma08g11030 基因的编码区和HIS融合成功构建了 His-Glyma08g11030融合表达载体,通过原核细胞从而使植物蛋白质在其中可以有效表达,以期为Glyma08g11030蛋白质的功能研究和表达水平检测奠定基础。
1 材料和方法
1.1 试验材料
本研究选取的大豆品种是Williams 82,该品种是新疆农业大学农业生物技术重点实验室前期从中国农业科学院获得的。本研究中所用到的pET28a原核表达载体是前期保存的。限制性核酸内切酶、T4 DNA连接酶购于Fermentas公司;Taq DNA聚合酶购于北京全式金生物有限公司;大肠杆菌菌株(E.coli)DH5α感受态细胞由本实验室制备;引物合成由北京鼎国昌盛生物技术有限责任公司完成。
1.2 试验方法
1.2.1 Glyma08g11030基因生物信息学分析 对Glyma08g11030序列进行生物信息学分析,使用NCBI查找Glyma08g11030的开放阅读框(ORF)及其编码的氨基酸序列。从GenBank上下载其他物种的氨基酸序列进行同源性分析,并用DNAMAN软件进行多重序列比较;通过MEGA 4.1软件构建Glyma08g11030和其他物种的系统发生树。用ExPASy(http://www. expasy.org/tools/protparam)在线工具,预测Glyma08g11030蛋白的分子质量、等电点及其理化性质;利用 Phytozome V 10.3在线数据库,发现了Glyma08g11030基因在染色体上的定位。使用 SWISS-MODEL(http://swiss model.expasy.org/)进行蛋白三维结构模拟。
1.2.2 pET28a-Glyma08g11030原核表达载体的构建 根据大豆Glyma08g11030基因的序列,设计带有正向BamH Ⅰ和反向Sac Ⅰ酶切位点的引物,Glyma08g11030-28-F:5′-AATGGATCCATGGAAGAA
GAAGAAGAAGGGCTTG-3′和Glyma08g11030-28-R:5′-TTTGAGCTCTCAAGCCATTGCAGTGAGGC-3′(引物中下划线表示酶切位点),按照TransStart-Taq(北京,TransGen)推荐的反应体系和反应程序进行PCR,扩增Glyma08g11030的ORF序列。将扩增得到的PCR产物经过纯化后,进行双酶切,将酶切产物亚克隆到含有HIS 标签的 PET-28a 原核表达载体上,经过菌液 PCR检测后,提取质粒进行检测,并送上海美季生物技术有限公司测序。
1.2.3 融合蛋白的诱导表达及可溶性分析 将构建成功的pET28a-Glyma08g11030菌株在LB液体培养基中37 ℃ 180 r/min 进行过夜培养,之后按照1∶100的比例用LB液体培养基稀释菌液,并将菌液培养至OD600值达到0.6左右时,分别用浓度为0,0.5,1.0,1.5 mmol/L的IPTG,37 ℃诱导6 h后收集菌液。菌体样品加入50 μL 2×上样缓冲液和50 μL ddH2O,沸水浴10 min,冰上冷却后,取10 μL进行SDS-PAGE(5%浓缩胶,12%分离胶),分析蛋白表达结果,确定蛋白表达的最适IPTG诱导浓度。同样,用最适IPTG诱导浓度1.0 mmol/L的IPTG,37 ℃培养0,2,4,6 h后收集菌液。以未加IPTG诱导的重组菌液,诱导和未诱导pET28a空载体菌液作为对照,进行SDS-PAGE分析[21]。
2 结果与分析
2.1 Glyma08g11030基因结构及序列分析
通过对Glyma08g11030序列的生物信息学分析,Glyma08g11030 cDNA全长1 419 bp,开放阅读框长1 362 bp,编码453个氨基酸,蛋白质分子质量约为51.288 ku,等电点为8.14。Glyma08g11030基因组DNA长度为 3 878 bp,使用GSDS 2.0在线软件分析Glyma08g11030基因的结构,通过分析发现该基因中包含2个外显子和1个内含子(图1-A)。Glyma08g11030蛋白包含1个F-BOX保守域,该结构域位于第106-147个氨基酸(图1-B)。该基因定位于大豆第8号染色体Chr08:8063060..8066966(forward)。
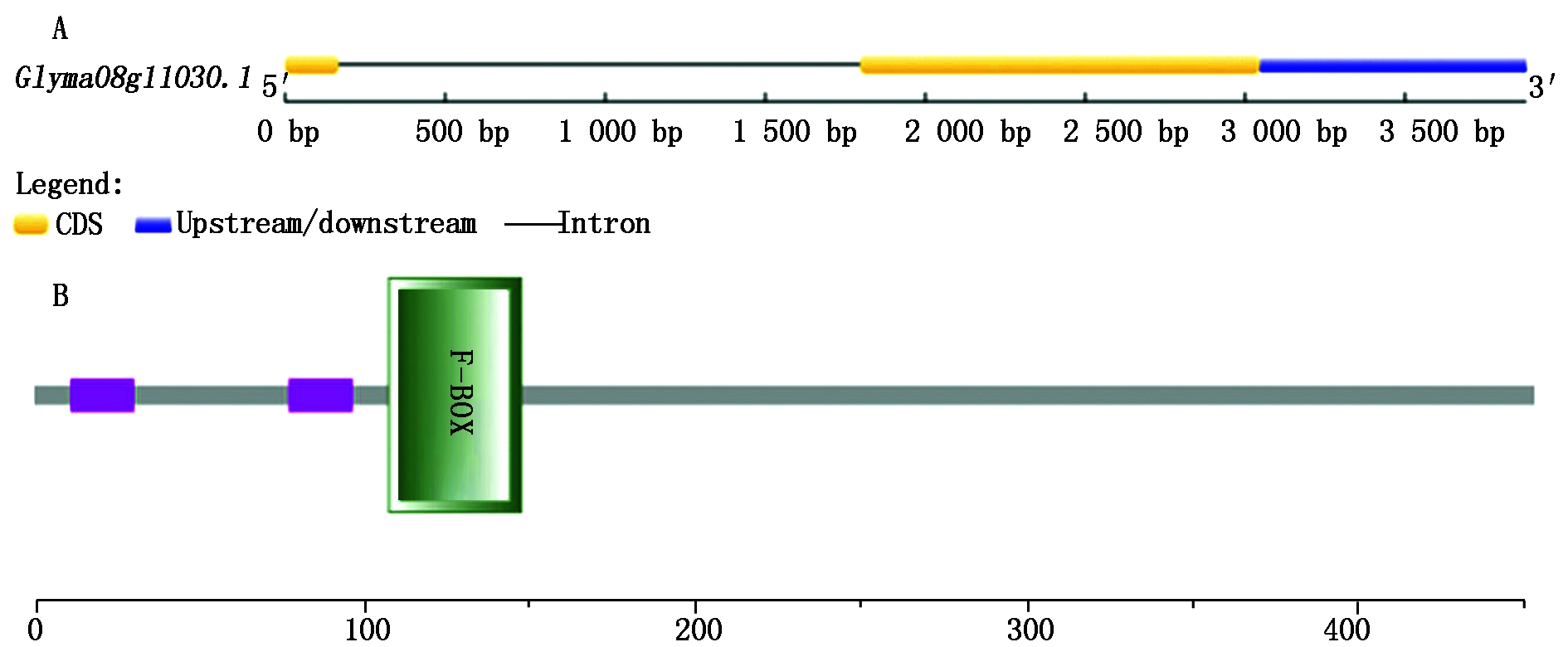
A.Glyma08g11030结构示意图;B.Glyma08g11030保守结构域示意图。
A.Schematic diagram of Glyma08g11030; B.Schematic diagram of Glyma08g11030 conserved domain.
图1 大豆Glyma08g11030基因结构及编码蛋白的保守结构域
Fig.1 The structure of soybean Glyma08g11030 gene and the conserved domain of the encoded protein
2.2 Glyma08g11030进化树及蛋白质结构分析
本研究通过与木豆CaF-box、菜豆PHAVU、花生AiF-box、豇豆ViF-box、红小豆VaF-box的氨基酸序列进行比对和保守结构域分析,大豆Glyma08g11030含有 F-BOX保守域,这也是此家族氨基酸序列的共性(图 2);将利用NCBI搜索得到的木豆、菜豆、花生、豇豆、红小豆的氨基酸序列与Glyma08g11030的氨基酸序列进行多序列比对并作系统进化树分析,发现Glyma08g11030与木豆CaF-box(Cajanus cajan,XP 020229814.1)聚在一个分支,亲缘关系较近,氨基酸一致性为86%(图3)。并通过SWISS-Model(http://swissmodel.expasy.org/)对Glyma08g11030蛋白质的三级结构进行预测,得到了该蛋白质的三级结构(图4)。
2.3 Glyma08g11030基因原核表达载体的构建
本试验利用PCR的方法扩增了Glyma08g11030基因的保守域,并将扩增得到的产物用试剂盒纯化回收,回收产物经过酶切检测,并连接到PET28a原核表达载体中,从而得到了pET28a-Glyma08g11030重组质粒。同时,对获得的重组质粒利用PCR的方法扩增得到了1段特异性条带,经过电泳检测分析发现该条带长约1 362 bp(图5);并且通过测序结果比对分析,发现连入PET28a载体中的 Glyma08g11030基因的保守域序列没有发生碱基变化,表明获得了正确的pET28a-Glyma08g11030原核表达载体。


图2 大豆Glyma08g11030蛋白与其他植物蛋白的同源性比对
Fig.2 Homology alignment of soybean Glyma08g11030 protein with other plant proteins
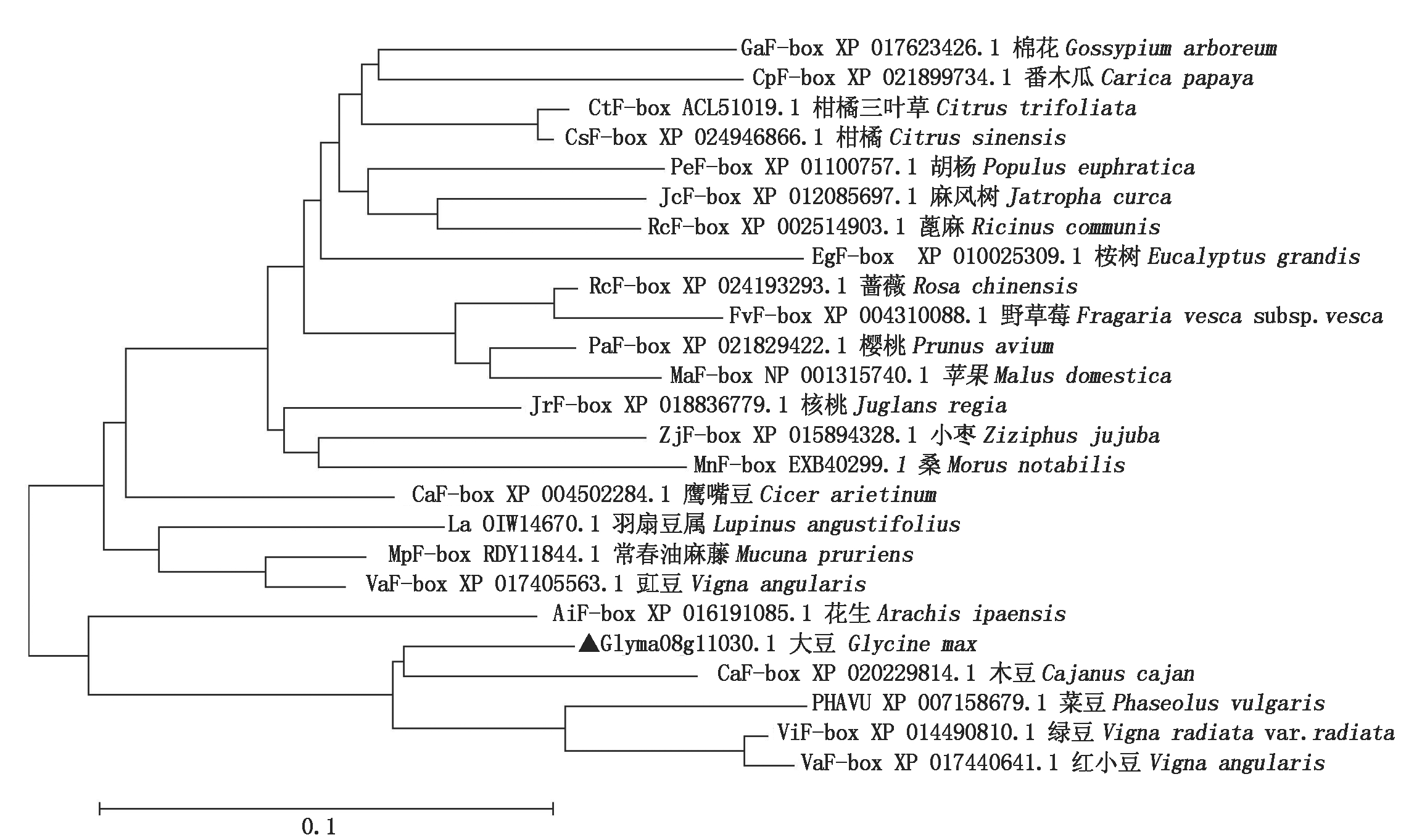
图3 Glyma08g11030蛋白与其他蛋白系统进化树分析
Fig.3 Evolutionary tree analysis of Glyma08g11030 protein and other protein systems
2.4 Glyma08g11030基因在大肠杆菌中的表达及可溶性分析
本研究为了明确 pET28a-Glyma08g11030融合蛋白是否为可溶性蛋白,通过IPTG 终浓度为0,0.5,1.0,1.5 mmol/L,37 ℃ 分别诱导 6 h 后收集菌液,分离蛋白上清和沉淀,进行SDS-PAGE 电泳分析,结果发现在4个不同浓度 IPTG 诱导下,均能诱导出大小约为 45 ku的 His-Glyma08g11030 融合蛋白。同时,用 1.0 mmol/L,37 ℃ 分别诱导 0,2,4,6 h 后收集菌液,SDS-PAGE 电泳分析表明,诱导 6 h 蛋白表达量最大(图6),说明 pET28a-Glyma08g11030融合蛋白在细胞内表达时以包涵体形式存在。
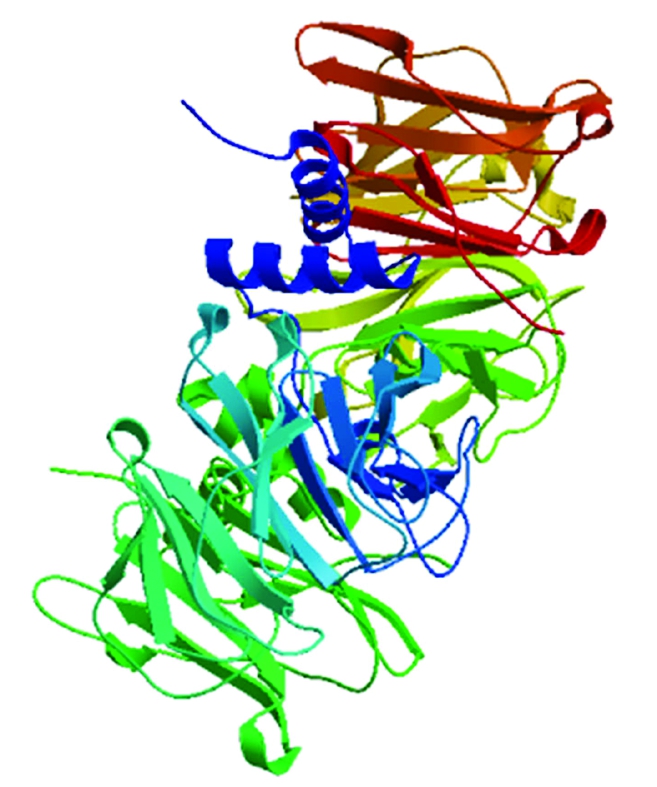
图4 大豆Glyma08g11030蛋白三级结构预测
Fig.4 Prediction of the tertiary structure of soybean Glyma08g11030 protein
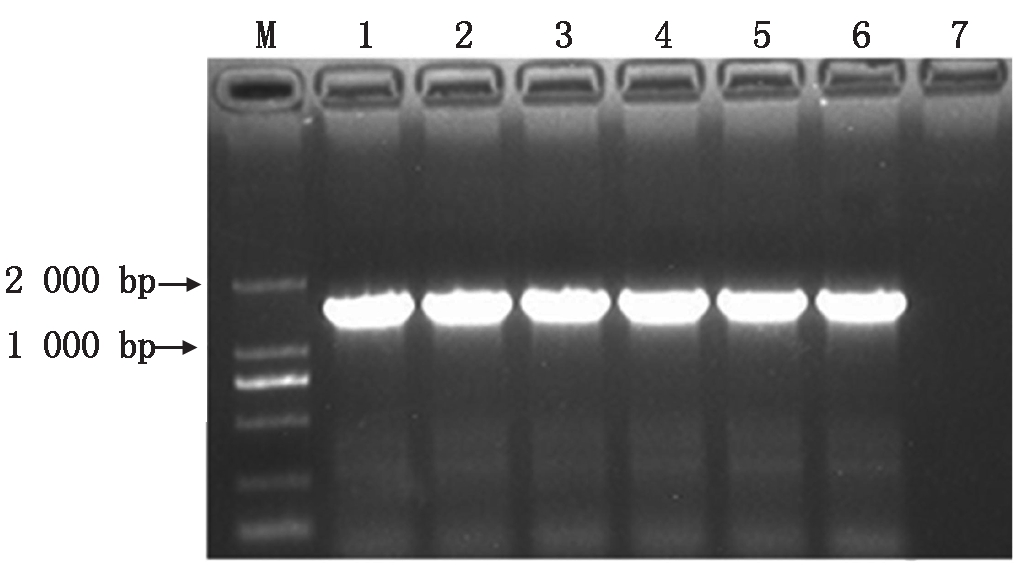
M.DNA DL2000 Marker;1-6.pET28a-Glyma08g11030
重组质粒菌液PCR检测;7.水对照。
M.DNA DL2000 Marker; 1-6.pET28a-Glyma08g11030
recombinant plasmid bacterial solution PCR; 7.Water control.
图5 pET28a-Glyma08g11030重组质粒菌液PCR鉴定
Fig.5 PCR identification of recombinant plasmid pET28a-Glyma08g11030
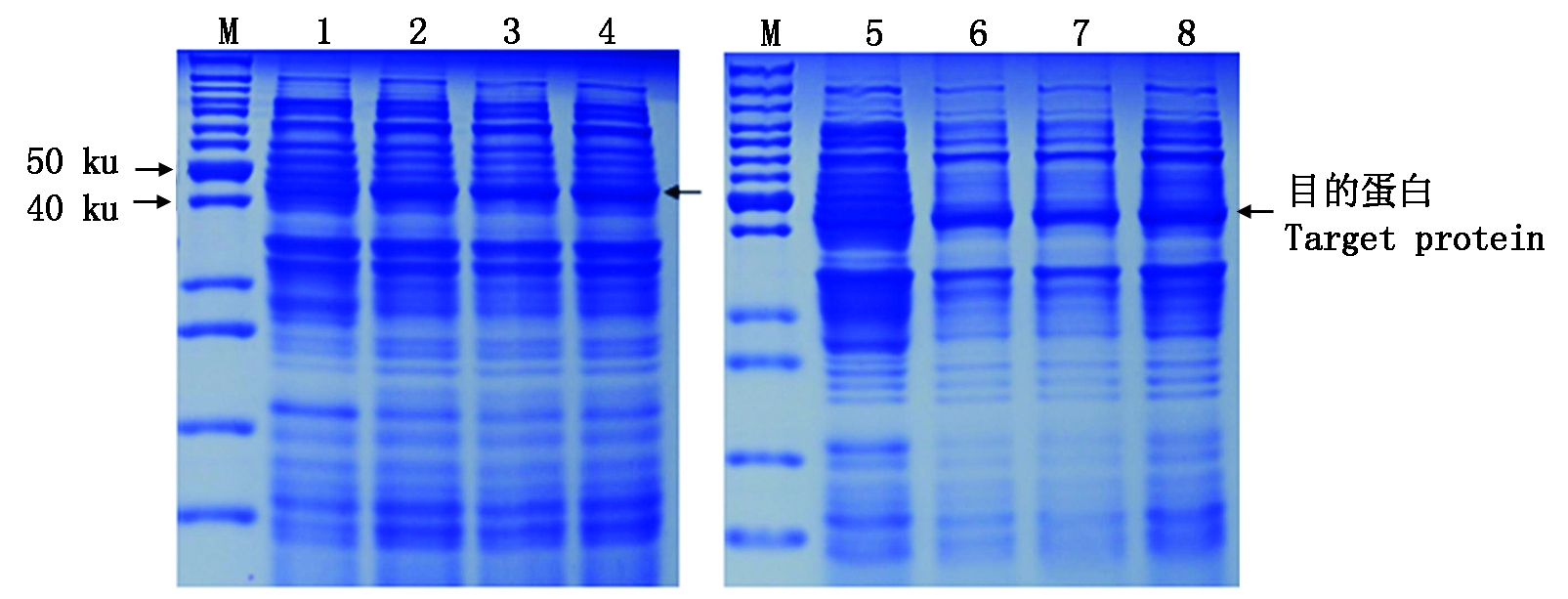
M.蛋白质分子质量 Marker; 1-4.pET28a-Glyma08g11030经IPTG诱导,IPTG诱导终浓度分别为0,0.5,1.0,1.5 mmol/L; 5-8.pET28a-Glyma08g11030经1.0 mmol/L IPTG诱导 0,2,4,6 h。
M.Protein molecular weight Marker; 1-4.pET28a-Glyma08g11030 induced by IPTG,the final concentration of IPTG induction is 0,0.5,1.0,1.5 mmol/L;5-8.pET28a-Glyma08g11030 1.0 mmol/L IPTG induced 0,2,4,6 h.
图6 His-Glyma08g11030蛋白在不同IPTG终浓度和诱导培养时间中的表达
Fig.6 Expression of His-Glyma08g11030 protein at different final concentrations of IPTG and induction culture time
3 结论与讨论
F-box蛋白是一个庞大的蛋白家族,在过去的几十年中,已经在真核生物中鉴定了许多F-box蛋白[22-23]。在植物中,F-box蛋白家族也是最大和最多样化的基因家族之一。F-box蛋白在其N-末端含有至少1个保守的F-box基序,其与SKP1相互作用以形成SCF复合物。它们的C-末端通常由1个或几个蛋白质-蛋白质相互作用结构域组成,用于特异性底物结合。F-box基因不仅参与信号传导等生命活动,还介导干旱等非生物胁迫响应[24]。然而,大多数植物F-box基因的功能仍然未知,特别是在大豆中。Jia等[25]经过研究,在新版本的大豆基因组数据库Wm82.a2.v1中鉴定了509个F-box基因,发现GmFBX列表与之前的研究基本相同[26],并根据大豆基因组数据库的更新进行更新。霍冬英等[16]研究发现,19个F-box基因对干旱胁迫的响应主要通过MYB和MYC转录因子调控。F-box蛋白介导了植物对逆境胁迫的应答响应,对植物正常生长发育至关重要。陈秀秀等[27]对部分F-box蛋白序列通过分析验证,发现F-box蛋白在一些非生物胁迫,如干旱、热激、ABA等胁迫中表达量会发生相应的变化。Chen等[28]研究发现,黄瓜CsTIR/AFB基因中含有 F-box 结构域,通过异位表达可以提高拟南芥的耐盐性。An等[29]发现,MAX2是一种多功能的 F-box蛋白,过表达Md MAX2能够提高植株的耐盐和耐旱性。
一些F-box蛋白参与植物激素信号传导和对生物胁迫的反应[30-32]。Kim等[33]通过对miR394a/b的研究发现,miR394a/b是保守的小RNA,它可以通过抑制F-box 蛋白LCR的表达,从而影响 ABA 途径,调控植物抗旱、抗盐性。拟南芥F-box蛋白AtFBP7是温度胁迫期间有效翻译所必需的[34]。一些研究表明,几种F-box蛋白基因的表达受非生物胁迫的调节,Jain 等[3]发现水稻中23种F-box蛋白的表达在盐胁迫中上调或下调。F-box蛋白CarF-box1也被鹰嘴豆的盐和干旱胁迫上调[35]。Yan等[36]发现 MAIF1基因的过表达降低了非生物胁迫耐受性并促进了水稻的根系生长。然而,小麦RING泛素连接酶 TdRF1对细胞脱水具有保护作用[37]。
最近,F-box蛋白FBL17被鉴定为植物发育不同阶段细胞周期的重要调节因子[38]。对于大多数植物而言,种子萌发和早期幼苗生长对非生物胁迫高度敏感[39]。以前的研究还表明,F-box基因在种子萌发中起重要作用[18]。大豆F-box蛋白的生化特征和亚细胞定位差异很大。预计大多数大豆F-box蛋白质位于细胞质、细胞核和细胞器中。预计会有一些细胞存在于质膜、细胞外空间和液泡中。大部分大豆F-box蛋白被预测有多个亚细胞定位。报告显示,测试的17种F-box蛋白中的大多数主要位于细胞内区室和单个F-box蛋白可以在拟南芥中形成多个SCF复合物[6]。这些都表明,F-box蛋白在调节植物的生物过程中具有不同的作用。本研究发现,Glyma08g11030基因定位于大豆第8号染色体Chr08:8063060..8066966(forward)。
本研究利用RT-PCR的方法从大豆中克隆了Glyma08g11030基因。该基因cDNA全长1 419 bp,开放阅读框长1 362 bp,编码453个氨基酸。序列分析表明,Glyma08g11030基因组包含2个外显子和1个内含子。多序列比对结果表明,Glyma08g11030蛋白含有1个F-BOX保守域。并成功构建了pET28a-Glyma08g11030原核表达载体。本研究为后续进一步研究Glyma08g11030的生物学功能奠定了基础。
[1] 韩强.抗虫及抗除草剂转基因大豆新品种的培育与鉴定[D]. 杭州:浙江大学,2015.
Han Q. Cultivation and identification of new varieties of transgenic soybeans resistant to insects and herbicides [D]. Hangzhou:Zhejiang University,2015.
[2] Kumar A,Paietta J V. The sulfur controller-2 negative regulatory gene of Neurospora crassa encodes a protein with-transducin repeats[J]. Proc Natl Acad Sci USA,1995,92(8):3343-3347. doi:10.1073/pnas.92.8.3343.
[3] Jain M,Nijhawan A,Arora R,Agarwal P,Ray S,Sharma P,Kapoor S,Tyagi A K,Khurana J P. F-box proteins in rice. Genomewide analysis,classification,temporal and spatial gene expression during panicle and seed development,and regulation by light and abiotic stress [J]. Plant Physiology,2007,143(4):1467-1483. doi:10.1104/pp.106.091900.
[4] Cui H R,Zhang Z R,Lv W,Xu J N,Wang X Y. Genome-wide characterization and analysis of f-box protein-encoding genes in the malusdomestica genome [J]. Molecular Genetics & Genomics,2015,290(4):1435-1446. doi:10.1007/s00438-015-1004-z.
[5] Jia F,Wu B,Li H,Huang J G,Zheng C C. Genome-wide identification and characterisation of F-box family in maize [J]. Molecular Genetics & Genomics,2013,288(11):559-577. doi:10.1007/s00438-013-0769-1.
[6] Koo A J,Thireault C,Zemelis S. Endoplasmic reticulum-associated inactivation of the hormone jasmonoyl-L-isoleucine by multiple members of the cytochrome P450 94 family in Arabidopsis[J].Journal of Biological Chemistry,2014,289(43):29728. doi:10.1074/jbc.M114.603084.
[7] Sadanandom A,Bailey M,Ewan R,Lee J,Nelis S. The ubiquitin-proteasome system:Central modifier of plant signalling[J]. New Phytol,2012,196:13-28. doi:10.1111/j.1469-8137.2012.04266.x.
[8] 吴丹,唐冬英,李新梅,李丽,赵小英,刘选明. F-box蛋白在植物生长发育中的功能研究进展[J]. 生命科学研究,2015,19(4):362-367. doi:10.16605/j.cnki.1007-7847.2015.04.012.
Wu D,Tang D Y,Li X M,Li L,Zhao X Y,Liu X M. The research progress of F-box protein in plant growth and development [J]. Life Science Research,2015,19(4):362-367.
[9] Liu Y,Ji X,Nie X. Arabidopsis AtbHLH112 regulates the expression of genes involved in abiotic stress tolerance by binding to their E-box and GCG-box motifs[J]. New Phytologist,2015,207(3):692-709. doi:10.1111/nph.13387.
[10] Stone S L . The Role of Ubiquitin and the 26S proteasome in plant abiotic stress signaling[J]. Frontiers in Plant Science,2014,5(5):135. doi:10.3389/fpls. 2014. 00135.
[11] Zhou S,Sun X,Yin S,Kong X,Zhou S,Xu Y. The role of the f-box gene tafba1 from wheat(Triticum aestivum L.)in drought tolerance[J]. Plant Physiology and Biochemistry,2014,84:213-223. doi:10.1016/j.plaphy.2014.09.017.
[12] Zhang Y,Xu W,Li Z,Deng X,Wu W,Xue Y. F-Box protein DOR functions as a novel inhibitory factor for abscisic acid-induced stomatal closure under drought stress in Arabidopsis[J]. Plant Physiology,2008,148(4):2121-2133. doi:10.1104/pp.108.126912.
[13] 许媛,李铃仙,于秀梅,刘大群. F-box蛋白在植物抗逆境胁迫中的功能[J].植物生理学报,2015,51(7):1003-1008. doi:10.13592/j.cnki.ppj.2015.0232.
Xu Y,Lu L X,Yu X M,Liu D Q. The functions of F-box protein in plant resistance to stress[J]. Journal of Plant Physiology,2015,51(7):1003-1008.
[14] Levin J Z,Meyerowitz E M. UFO:an Arabidopsis gene involved in both floral meristem and floral organ development[J]. Plant Cell,1995,7:529-548. doi:10.1105/tpc.7.5.529.
[15] Hepworth S R,Haughn K G W . UFO in the Arabidopsis inflorescence apex is required for floral-meristem identity and bract suppression[J]. Planta,2006,223(4):769-778. doi:10.2307/23389281.
[16] 霍冬英,郑炜君,李盼松,徐兆师,周永斌,陈明,马有志,闵东红,张小红. 谷子F-box家族基因的鉴定、分类及干旱响应[J]. 作物学报,2014,40(9):1585-1594. doi:10.3724/SP.J.1006.2014.01585.
Huo D Y,Zheng Y J,Li P S,Xu Z S,Zhou Y B,Chen M,Ma Y Z,Min D H,Zhang X H. Identification,classification and crought response of F-box family genes in millet[J]. Acta Agronomica Sinica,2014,40(9):1585-1594.
[17] 于兰芳,周硕,张双喜,纪玉洁,刘永伟. 葡萄F-box基因VvF-box5的基因结构与表达分析[J]. 植物遗传资源学报,2018,19(2):361-369. doi:10.13430/j.cnki.jpgr.2018.02.019.
Yu L F,Zhou S,Zhang S G,Ji Y J,Liu Y W. Gene structure and expression analysis of grape F-box gene VvF-box5[J]. Journal of Plant Genetic Resources,2018,19(2):361-369.
[18] 刘选明,孙孟思,李新梅,贺热情,屈丽娜,唐冬英,赵小英. F-box基因FOF2在拟南芥盐和冷胁迫响应中的功能分析[J]. 湖南大学学报(自然科学版),2018,45(6):120-127. doi:10.16339/j.cnki.hdxbzkb.2018.06.018.
Liu X M,Sun M G,Li X M,He R Q,Qu L N,Tang D Y,Zhao X Y. Functional analysis of F-box gene FOF2 in Arabidopsis salt and cold stress response[J]. Journal of Hunan University(Natural Science),2018,45(6):120-127.
[19] Wang Z,D L,Jiang Z,Peng W,Zhang L,Wang G,Xie D. GmCOI1,a soybean F-box protein gene,shows ability to mediate jasmonate-regulated plant defense and fertility in Arabidopsis[J]. Mol Plant Microbe Interact,2005,18:1285-1295. doi:10.1094/MPMI-18-1285.
[20] Xue Z G,Zhang X M,Lei C F,Chen X J,Fu Y F. Molecular cloning and functional analysis of one ZEITLUPE homolog GmZTL3 in soybean[J]. Mol Biol Rep,2012,39:1411-1418. doi:10.1007/s11033-011-0875-2.
[21] 倪志勇,王娟,吕萌,李波,白岩,范玲. 棉花 4-香豆酸辅酶 A 连接酶基因克隆及原核表达[J]. 西北植物学报,2010,30(3):429-436. doi:1000-4025(2010)03-0429-08.
Ni Z Y,Wang J,Lü M,Li B,Bai Y,Fan L. Cloning and prokaryotic expression of cotton 4-coumaric acid coenzyme A ligase gene[J]. Acta Botanica Sinica,2010,30(3):429-436.
[22] Somers D E,Fujiwara S. Thinking outside the F-box:Novel ligands for novel receptors[J]. Trends Plant Sci,2009,14:206-213.doi:10.1016/j.tplants.2009.01.003.
[23] Lechner E,Achard P,Vansiri A,Potuschak T,Genschik P. F-box proteins everywhere[J]. Curr Opin Plant Biol,2006,9:631-638.
[24] Jeevan R J,Vignesh D,Parameswari P,Prasath S D,Ryun S C,Young S Y,Hong S,Heon S O,Ho M O,Pyo Y L. F-Box genes in brassica rapa:genome-wide identification,structural characterization,expressional validation,and comparative analysis[J]. Plant Molecular Biology Reporter,2018,36(3):500-517.doi:10.1007/s11105-018-1083-1.
[25] Jia Q,Xiao Z X,Wong F L,Sun S,Liang K J,Lam H M. Genome-wide analyses of the soybean F-box gene family in response to salt stress[J].Int J Mol Sci,2017,18(4):818. doi:10.3390/ijms18040818.
[26] Bellieny-Rabelo D,Oliveira A E A,Venancio T M. Impact of whole-genome and tandem duplications in the expansion and functional diversification of the F-box family in legumes(Fabaceae)[J]. PLoS One,2013,8(2):e55127. doi:10.1371/journal.pone.0055127.
[27] 陈秀秀,张彤,余倩文,周 薇,安逸民,杜秉昊,郭长虹. 紫花苜蓿F-box蛋白基因MsFTL的克隆及功能分析[J]. 植物遗传资源学报,2019,20(3):750-759.doi:10.13430/j.cnki.jpgr.20180929001.
Chen X X,Zhang W,Yu Q W,Zhou W,An Y M,Du B Z,Guo C H. Cloning and functional analysis of F-box pr-otein gene MsFTL in alfalfa[J]. Journal of Plant Genetic Resources,2019,20(3):750-759.
[28] Chen Z H,Li M T,Yuan Y. Ectopic expression of cucumber(Cucumis sativus L.)Cs TIR/AFB genes enhance salt tolerance in transgenic Arabidopsis[J]. Plant Cell Tissue and Organ Culture,2017,131(1):107-118. doi:10.1007/s11240-017-1267-7.
[29] An J P,Li R,Qu F J. Apple F-Box protein Md MAX2 regulates plant photomorphogenesis and stress response[J]. Frontiers in Plant Science,2016,7(1235):1685-1699. doi:10.3389/fpls.2016.01685.
[30] Lyzenga W J,Stone S L. Abiotic stress tolerance mediated by protein ubiquitinnation[J]. J Exp Bot,2012; 63:599-616. doi:10.1093/jxb/err310.
[31] Xu G,Cui Y,Wang M. OsMsr9,a novel putative rice F-box containing protein,confers enhanced salt tolerance in transgenic rice and Arabidopsis[J]. Molecular Breeding,2014,34(3):1055-1064. doi:10.1007/s11032-014-0096-1.
[32] Gupta S,Garg V,Kant C,Bhatia S. Genome-wide survey and expression analysis of F-box genes in chickpea[J]. Bmc Genomics,2015,16(1):67. doi:10.1186/s12864-015-1293-y.
[33] Kim Y Y,Cui M H,Noh M S,Jung K W,Shin J S. The FBA motif-containing protein AFBA1 acts as a novel positive regulator of ABA response in Arabidopsis[J]. Plant and Cell Physiology,2017,58(3):574-586. doi:10.1093/pcp/pcx003.
[34] Calder n-Villalobos L I A,Nill C,Marrocco K,Kretsch T,Schwechheimer C. The evolutionarily conserved Arabidopsis thaliana F-box protein AtFBP7 is required for efficient translation during temperature stress[J]. Gene,2007,392:106-116. doi:10.1016/j.gene.2006.11.016.
n-Villalobos L I A,Nill C,Marrocco K,Kretsch T,Schwechheimer C. The evolutionarily conserved Arabidopsis thaliana F-box protein AtFBP7 is required for efficient translation during temperature stress[J]. Gene,2007,392:106-116. doi:10.1016/j.gene.2006.11.016.
[35] Jia Y Y,Gu H Y,Wang X S,Chen Q J,Shi S B,Zhang J S,Ma L,Zhang H,Ma H.Molecular cloning and characterization of an F-box family gene Carf-box1 from chickpea(Cicer arietinuml L.)[J]. Molecular Biology Reports,2012,39(3):2337-2345. doi:10.1007/s11033-011-0984-y.
[36] Yan Y S,Chen X Y,Yang K,Sun Z X,Fu Y P,Zhang Y M,Fang R X. Overexpression of an F-box protein gene reduces abiotic stress tolerance and promotes root growth in rice[J]. Molecular Plant,2011,4(1):190-197.doi:10.1093/mp/ssq066.
[37] Guerra D,Mastrangelo A M,Lopez-Torrejon G,Marzin S,Schweizer P,Stanca A M,del Pozo J C,Cattivelli L,Mazzucotelli E. Identification of a protein network interacting with TdRF1,a wheat RING ubiquitin ligase with a protective role against cellular dehydration[J]. Plant Physiol,2012,158(2):777-789. doi:10.2307/41435407 .
[38] Gusti A,Baumberger N,Nowack M,Pusch S,Eisler H,Potuschak T,De Veylder L,Schnittger A,Genschik P. The Arabidopsis thaliana F-box protein FBL17 is essential for progression through the second mitosis during pollen development[J]. PLoS One,2009,4:e4780. doi:10.1371/journal.pone.0004780.
[39] Mito T,Seki M,Shinozaki K,Ohme-Takagi M,Matsui K. Generation of chimeric repressors that confer salt tolerance in arabidopsis and rice[J]. Plant Biotechnology Journal,2011,9(7):736-746. doi:10.1111/j.1467-7652.2010.00578.x.