分子标记技术大大推动了作物育种和基因组研究的发展,其中,因SSR具有易操作、重复性好、多态性高、数量丰富及共显性遗传等优点,被广泛应用于小麦、水稻和玉米等植物的遗传连锁图谱构建、遗传多样性分析、基因定位及标记辅助选择等研究[1-2]。随着分子生物学的快速发展,新近开发的单核苷酸多态性(SNP)标记具有密度高、代表性强和遗传稳定性好等优点,目前,小麦上已开发出以SNP标记为基础的Illumina iSelect9k、Illumina iSelect90k、Affymetrix Axiom660k和Affymetrix Axiom55k等芯片[3],并逐步应用于小麦遗传连锁图谱构建和关联分析等方面的研究[4-6]。但SNP芯片价格昂贵是进行大规模群体检测的主要限制因素,相比之下SSR标记仍是多数学者进行遗传研究选用的重要标记类型。迄今,虽然普通小麦上已开发了大量SSR标记,但由于其基因组庞大且复杂(基因组大小达到了16×109 bp,其中超过80%为重复DNA),现有的SSR标记密度仍很低,难以满足当前高通量基因组的研究需要。因此,开发新的SSR标记对于小麦遗传研究具有重要意义。
SSR标记是根据每个SSR重复序列的两端保守序列设计特异性引物,通过PCR扩增及电泳检测分析不同样品间重复序列的长度多态性。早期SSR标记的开发主要是在构建基因组文库、筛选SSR克隆并测序的基础上根据DNA序列进行引物设计。例如,Guyomarc′h等[7]根据节节麦的SSR克隆序列成功开发了270个能在普通小麦中有效扩增的SSR引物。Röder等[8]根据中国春小麦基因组文库中720个SSR克隆序列设计引物,在294个能扩增出预期大小DNA片段的引物中,约80%在2个小麦品种Opata85和W7984间表现多态,并构建了第一张高密度微卫星标记小麦遗传图谱。Li等[1]开发了856个黑麦1~7 R的特异SSR标记。近年来,随着植物表达基因部分序列(EST)数据在GenBank(http://www.ncbi.nlm.nih.gov/dbEST/bEST_summary.html)等数据库的大量公开,从EST中发掘SSR成为分子标记开发简便而有效的方法,已成功应用于小麦[9-12]、水稻[13]、大麦[14]和花椒[15]等作物的SSR标记开发。目前,小麦测序工作取得突破性进展,普通小麦中国春的基因组序列公开释放,进一步为分子标记的开发奠定了理论基础。
本研究从普通小麦中国春2B染色体DNA序列中进行了SSR的查找和分析,通过设计引物及有效性验证,旨在开发可用于小麦的新SSR标记。
1 材料和方法
1.1 供试材料
试验材料为来自同一杂交组合的2个小麦姊妹系Cf5019-21和Cf5240-41。
1.2 试验方法
1.2.1 SSR的查找和引物设计 从网站(http://www.wheatgenome.org/)下载中国春2B染色体物理位置在159 206 132~184 196 812 bp的25 Mb DNA序列,利用SSRHunter软件[16]查找二、三、四、五核苷酸类型的SSR位点(核苷酸序列的重复次数大于或等于5次)。利用Primer 5.0软件根据查找的SSR位点两侧各150 bp的DNA序列设计SSR引物。引物设计的条件为:引物长度18~22 bp,退火温度50~65 ℃,且上游和下游的引物退火温度之差低于5 ℃,PCR扩增片段长度100~400 bp,尽可能防止出现二级结构。设计的引物由上海生工生物技术有限公司合成。引物命名为Xhwm加序号,例如Xhwm1。
1.2.2 PCR扩增与电泳 CTAB法提取DNA。PCR反应体积为20 μL,含1×Buffer(0.01 mol/L Tris-HCl,pH值8.3,0.05 mol/L KCl)、0.001 5 mol/L MgCl2、0.2 mol/L dNTPs、50 ng引物和60 ng模板DNA。扩增:94 ℃预变性5 min;然后94 ℃变性1 min,50~60 ℃退火1 min,72 ℃延长1min,35个循环;72 ℃延长10 min。扩增产物进行8%非变性聚丙烯酰胺凝胶电泳,硝酸银染色。
2 结果与分析
2.1 SSR位点的查找
利用SSRHunter软件在中国春2B染色体25 Mb的DNA序列中共找到2 852个SSR位点(表1),这些位点中二核苷酸重复最多,有2 293个,占所发现SSR位点总数的80.40%,其次是三核苷酸,有537个,占所发现SSR位点总数的18.83%;四核苷酸、五核苷酸重复单元数量很低,分别仅出现了21,1个。
2.2 SSR分布特征及重复次数
如表2所示,在2 852个SSR中,二核苷酸重复序列有6种,其中GA/CT、AG/TC数量最多,分别占
表1 不同重复核苷酸的SSR分布
Tab.1 Distribution of SSR based on different repeating nucleotides
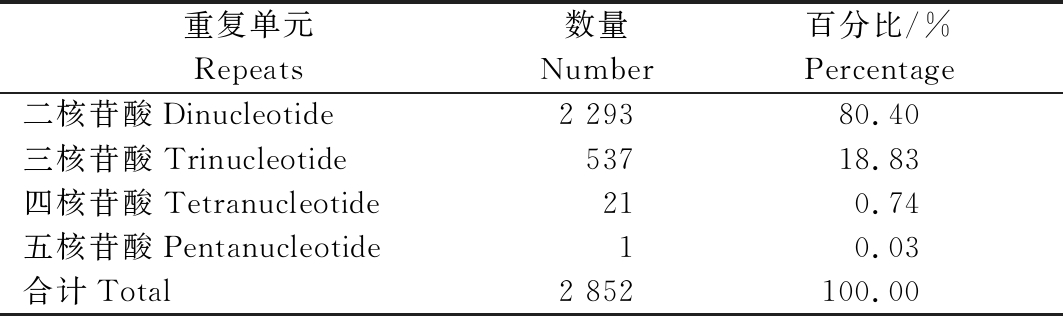
重复单元Repeats数量Number百分比/%Percentage 二核苷酸Dinucleotide2 29380.40三核苷酸Trinucleotide53718.83四核苷酸Tetranucleotide210.74五核苷酸Pentanucleotide10.03合计Total2 852100.00
SSR总数的20.44%,19.00%(表2);其次为AT/TA,占SSR总数的17.15%;AC/TG、CA/GT的数量接近,分别占SSR总数的10.76%,10.31%,CG/GC的数量最少,占SSR总数的2.73%。三核苷酸重复序列共30种,其中,CTT/GAA数量最多,占SSR总数的2.56%;其次是TTC/AAG、TCT/AGA、CCT/GGA,分别占SSR总数的1.79%,1.16%,1.02%;其余26种类型占SSR总数的比例均小于1.00%。四核苷酸重复序列共17种,五核苷酸仅有1种,各种重复占SSR总数的比例都较低。
表2中二核苷酸、三核苷酸分别统计重复次数≥10或8的SSR数量。进一步分析SSR的重复次数,发现二核苷酸重复次数总体较高,重复次数≥10的SSR序列有327个,占所有二核苷酸序列的14.26%,其中二核苷酸AT/TA最高重复次数达到了47次,AG/TC、AT/TA 2种重复基元中重复次数≥10的SSR序列分别有98,97个,而CG/GC仅有1个SSR序列的重复次数≥10。三核苷酸的重复次数总体偏低,重复次数≥8的SSR数量仅有62个,占所有三核苷酸序列的11.55%。其中TTC/AAG重复基元中重复次数≥8的SSR数量最多,有12个;而TAC/ATG的最高重复次数达到了33次。四核苷酸重复基元中只有ACAT/TGTA、TAGA/ATCT的重复次数分别达到了16,14次,其他重复基元的重复次数主要为5~7 次。五核苷酸TTTTA/AAAAT重复了5次。
表2 二核苷酸和三核苷酸重复基元的SSR分布
Tab.2 SSR distribution of dinucleotide and trinucleotide types
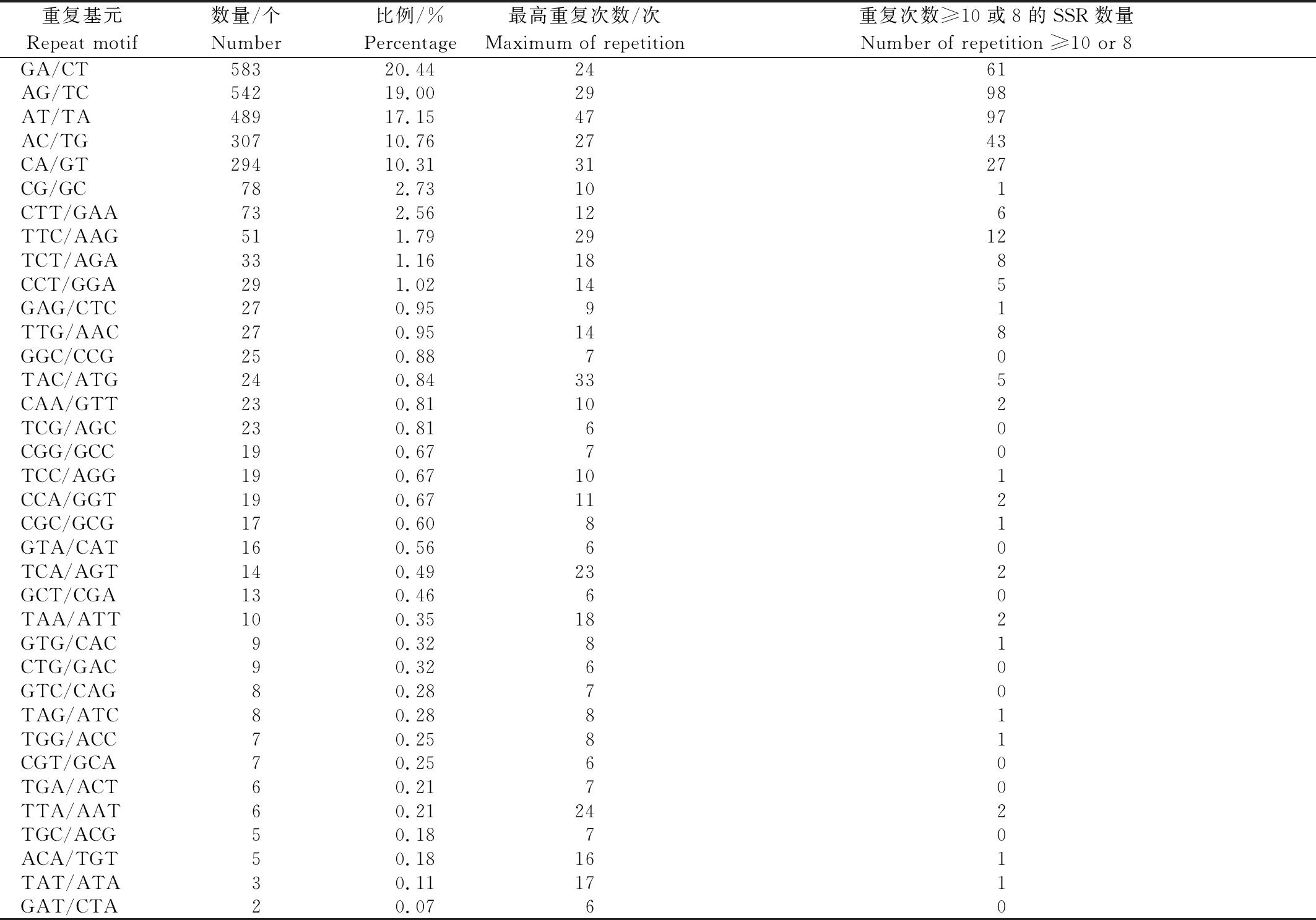
重复基元Repeat motif数量/个Number比例/%Percentage 最高重复次数/次Maximum of repetition重复次数≥10或8的SSR数量Number of repetition ≥10 or 8GA/CT58320.442461AG/TC54219.002998AT/TA48917.154797AC/TG30710.762743CA/GT29410.313127CG/GC782.73101CTT/GAA732.56126TTC/AAG511.792912TCT/AGA331.16188CCT/GGA291.02145GAG/CTC270.9591TTG/AAC270.95148GGC/CCG250.8870TAC/ATG240.84335CAA/GTT230.81102TCG/AGC230.8160CGG/GCC190.6770TCC/AGG190.67101CCA/GGT190.67112CGC/GCG170.6081GTA/CAT160.5660TCA/AGT140.49232GCT/CGA130.4660TAA/ATT100.35182GTG/CAC90.3281CTG/GAC90.3260GTC/CAG80.2870TAG/ATC80.2881TGG/ACC70.2581CGT/GCA70.2560TGA/ACT60.2170TTA/AAT60.21242TGC/ACG50.1870ACA/TGT50.18161TAT/ATA30.11171GAT/CTA20.0760
2.3 SSR有效性验证
根据上述的SSR位点共设计了135对SSR引物,以2个小麦品系Cf5019-21和Cf5240-41的DNA为模板进行PCR检测,发现有101对引物在这2个材料中扩增出了清晰的DNA条带(表3),占所设计SSR引物的74.81%,其中17对(16.83%)引物在二者间表现出差异扩增。图1为部分SSR引物的扩增结果。
表3 101个在小麦品系Cf5019-21和Cf5240-41上有扩增产物的SSR引物
Tab.3 Information of 101 SSR primers which amplified clear bands in wheat lines Cf5019-21 and Cf5240-41

引物名称Name ofprimers重复单元Repeat引物上链(5'-3')Forward primer引物下链(5'-3')Reverse primer 退火温度/℃Tm 产物长度/bpProduct size Xhwm1ATTAAATAGATAATCAGTTCCA-CACTTATAGGGCTGCTGTGA50209Xhwm2ACATAAACAAGCATTATACAGCACTCCTCCCCTTTCCTTCT50212Xhwm3GAATAGCAAAGCTCACGGTACGATGAGGAGGGAGTTGTTC50137Xhwm4ATGCCACCACCAACTTTCTCTAGGGTCCGATCACATTC50274Xhwm5TCACGAGGAGGGAGTAGTTCACCATTACAAGAAAGTAGAGGG50208Xhwm6ATCAAAACGCAAACGGTGGTGCTTGGGCTGGTTTGAGT55248Xhwm8TGGGAAACTTATTGTTGGTATGAAATAGGCCAGCCCAGTA50202Xhwm11CCTCCCTTGCCACGTTCAGTCGGGAGGAATGGGACTCGGATGT60168Xhwm12ATTTTGGAAATGGAAAGACAGCACCCACATCATCTTCCTG50248Xhwm13TACACAGGGTGAGGCTGACTTTAGCACGGGAGACCTATT50286Xhwm14TCCCATGACAAGGAGGGAGTCATCAAGATCGTGCCATAGA50141Xhwm16ACTCCCCGAGCCCATACACCCATCTAACATGCATTCATAC50161Xhwm17GAATGGTGCCAGGGCAGAATTGAAGATGGCGGAGGTGTT55280Xhwm18GACGTGCCAAATCAAGAACACATCATCCCGACGCTCT50121Xhwm20ACACAGGAGCGTGAAATAGAAGCCTTGATTGGCCTCCCT50188Xhwm21AGACAGGAGCGTGAAATAGAAGAAGATGGGAGGAGGTTTCC55169Xhwm22ACCGCAATCGGAGTTATGGGATGGGAGGAGGTTTCC50244Xhwm23AGCAGGAGCGTGAAATAGAAGAAGATGGGAGGAGGTTTCC55190Xhwm24GAGACAACGAAATCTCAAAGGTCATCATCCCGATAGCC50231Xhwm25CTGGGGACGGTGCTATCCAATGGCGGACCTGGCACTCAAAT60173Xhwm26TGATGTCAAGCGTCTGAGGAAGAGTCATGTACTGACCGTGAGAC55217Xhwm27CAATGGAAATGTGGGTTTGTCCACATCCTCCCTTTCTGC50154Xhwm28TATTCACTGTTTCCGTCGTTAGGGTCCGATCACATTC50158Xhwm29TCATCTCGGCGGTCTCCATCGTGCCAAATCAAGAACAA55131Xhwm30ATCATGAAGTCCTTTACCCTGGAAGTGCTGGTGAAGATGTTGATG55218Xhwm31TGTGTTGTTGTTGCTGCTGTTGCGGGCTGATGGCAAGGATA55128Xhwm32TCCTCGGAGCTGAGGGTATGATCCGATAAGATAACT-TCAAGAGG55195Xhwm33CTTCCCAAGTGACACCTAACCTCCTACCCAAGCCAAA50158Xhwm34GGACCCCGGAAGGAAACAACCCGGTCCCGATCATGCGAAACTC60176Xhwm35AGAATCCAATCTCAGTCCCTTTCATGTTCTTTCCTCCC50282Xhwm36TACAATGACCTATGGCACCTTGGGATTGAGTTGGAGGA50320Xhwm37TT-GCCACTTGTTGTTGGGTAAATGTCCCACATCCCAGTCAGTCTTCA55227Xhwm38CCGTTGTCTTACATGGTAT-CACGCTAGGAGAAGTGCCGCGAGGGAG60190Xhwm39GACATCAAGATCGTGCAACAGTCATTGACGAGAAGGGAGT50119Xhwm40TTGAAAGCCCATAAACATCCGGCAGCAGAATGCCTTGAT50198Xhwm41ATACGTAAAATTACGGTGCACTCGTCGTCAAAATGATGTA50251Xhwm43CTCCTCAAGAAATTCTGCGTGTTCGCCGTAATGTTGGTCTATGC60273Xhwm48ATCGAAAGAACCGTGGACTATGATCTTGAGGAGGTGTT50166Xhwm50CATACCCACCTCAAGGCCACACGCCGTCTTTGATCTACTCG60296Xhwm51GAAAGTGGAAGCACGAGTGTACAACTCCTGCTTTCACTC50190Xhwm52TAGGTTGGACGAACGACAGTACAACCACCTGAAACC50165Xhwm53GAGTCGTAATGTTGCTCTATGCTCTACGTGTTGCTTTTGTC50258Xhwm54TATATTCTCAAGATCAGAGGGTATCCCGTAGATGTGAATTTTG50192Xhwm55GACCGATAAGATAACTTCAAAGGCATCATACCAGGGCTCTTC50240Xhwm57CACGAGGAACCATCCATTTGCAAGCCTCCTCGTTAGAC50208Xhwm58TCACGAGGAGGGAGTAGTTCACATCAAGATCATGCCATAGA50108Xhwm59AGCTGAATCCGTCGGTCTGATGCGACATTTGTGAGTTG50217
表3(续)
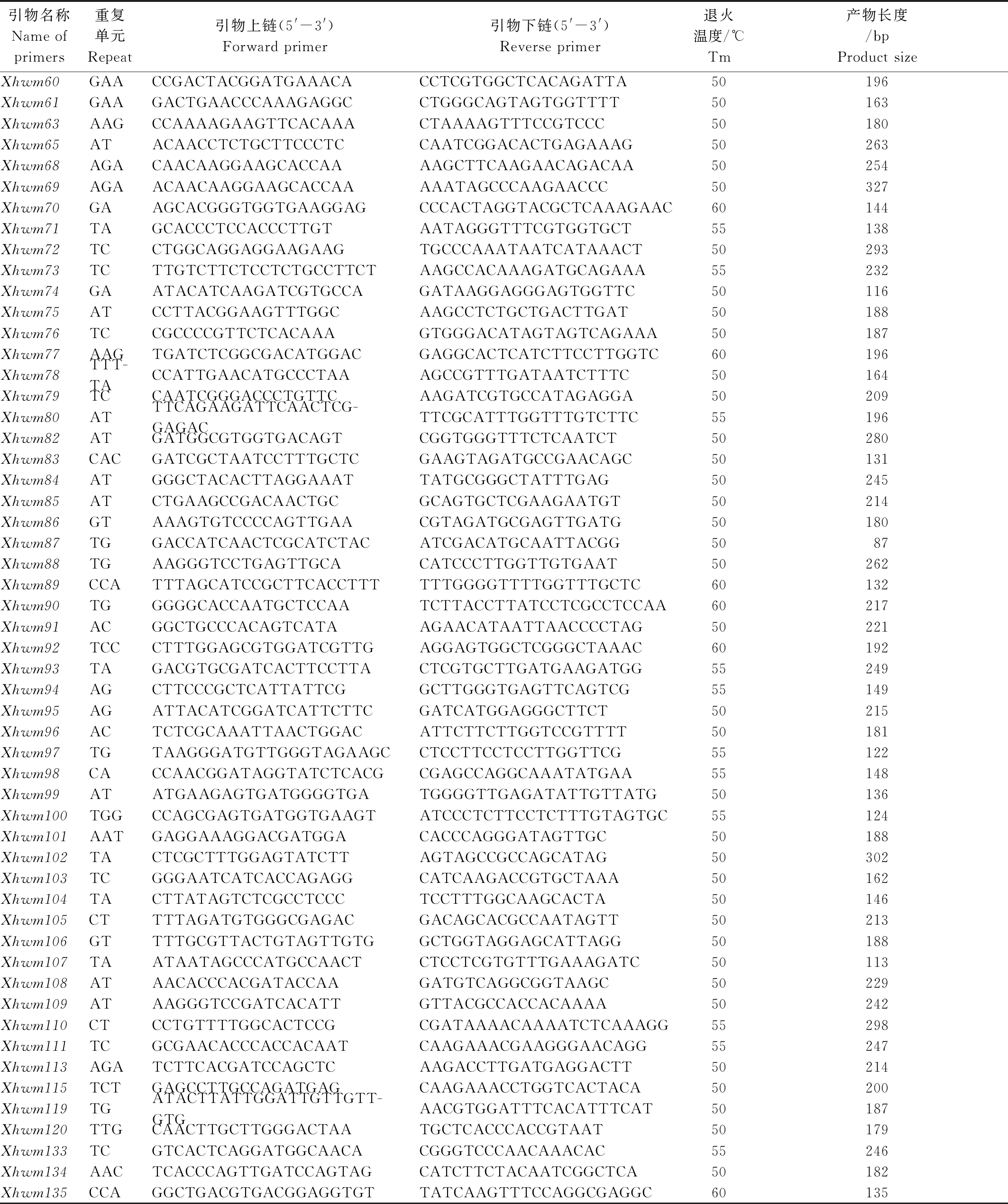
引物名称Name ofprimers重复单元Repeat引物上链(5'-3')Forward primer引物下链(5'-3')Reverse primer退火温度/℃Tm 产物长度/bpProduct size Xhwm60GAACCGACTACGGATGAAACACCTCGTGGCTCACAGATTA50196Xhwm61GAAGACTGAACCCAAAGAGGCCTGGGCAGTAGTGGTTTT50163Xhwm63AAGCCAAAAGAAGTTCACAAACTAAAAGTTTCCGTCCC50180Xhwm65ATACAACCTCTGCTTCCCTCCAATCGGACACTGAGAAAG50263Xhwm68AGACAACAAGGAAGCACCAAAAGCTTCAAGAACAGACAA50254Xhwm69AGAACAACAAGGAAGCACCAAAAATAGCCCAAGAACCC50327Xhwm70GAAGCACGGGTGGTGAAGGAGCCCACTAGGTACGCTCAAAGAAC60144Xhwm71TAGCACCCTCCACCCTTGTAATAGGGTTTCGTGGTGCT55138Xhwm72TCCTGGCAGGAGGAAGAAGTGCCCAAATAATCATAAACT50293Xhwm73TCTTGTCTTCTCCTCTGCCTTCTAAGCCACAAAGATGCAGAAA55232Xhwm74GAATACATCAAGATCGTGCCAGATAAGGAGGGAGTGGTTC50116Xhwm75ATCCTTACGGAAGTTTGGCAAGCCTCTGCTGACTTGAT50188Xhwm76TCCGCCCCGTTCTCACAAAGTGGGACATAGTAGTCAGAAA50187Xhwm77AAGTGATCTCGGCGACATGGACGAGGCACTCATCTTCCTTGGTC60196Xhwm78TTT-TACCATTGAACATGCCCTAAAGCCGTTTGATAATCTTTC50164Xhwm79TCCAATCGGGACCCTGTTCAAGATCGTGCCATAGAGGA50209Xhwm80ATTTCAGAAGATTCAACTCG-GAGACTTCGCATTTGGTTTGTCTTC55196Xhwm82ATGATGGCGTGGTGACAGTCGGTGGGTTTCTCAATCT50280Xhwm83CACGATCGCTAATCCTTTGCTCGAAGTAGATGCCGAACAGC50131Xhwm84ATGGGCTACACTTAGGAAATTATGCGGGCTATTTGAG50245Xhwm85ATCTGAAGCCGACAACTGCGCAGTGCTCGAAGAATGT50214Xhwm86GTAAAGTGTCCCCAGTTGAACGTAGATGCGAGTTGATG50180Xhwm87TGGACCATCAACTCGCATCTACATCGACATGCAATTACGG5087Xhwm88TGAAGGGTCCTGAGTTGCACATCCCTTGGTTGTGAAT50262Xhwm89CCATTTAGCATCCGCTTCACCTTTTTTGGGGTTTTGGTTTGCTC60132Xhwm90TGGGGGCACCAATGCTCCAATCTTACCTTATCCTCGCCTCCAA60217Xhwm91ACGGCTGCCCACAGTCATAAGAACATAATTAACCCCTAG50221Xhwm92TCCCTTTGGAGCGTGGATCGTTGAGGAGTGGCTCGGGCTAAAC60192Xhwm93TAGACGTGCGATCACTTCCTTACTCGTGCTTGATGAAGATGG55249Xhwm94AGCTTCCCGCTCATTATTCGGCTTGGGTGAGTTCAGTCG55149Xhwm95AGATTACATCGGATCATTCTTCGATCATGGAGGGCTTCT50215Xhwm96ACTCTCGCAAATTAACTGGACATTCTTCTTGGTCCGTTTT50181Xhwm97TGTAAGGGATGTTGGGTAGAAGCCTCCTTCCTCCTTGGTTCG55122Xhwm98CACCAACGGATAGGTATCTCACGCGAGCCAGGCAAATATGAA55148Xhwm99ATATGAAGAGTGATGGGGTGATGGGGTTGAGATATTGTTATG50136Xhwm100TGGCCAGCGAGTGATGGTGAAGTATCCCTCTTCCTCTTTGTAGTGC55124Xhwm101AATGAGGAAAGGACGATGGACACCCAGGGATAGTTGC50188Xhwm102TACTCGCTTTGGAGTATCTTAGTAGCCGCCAGCATAG50302Xhwm103TCGGGAATCATCACCAGAGGCATCAAGACCGTGCTAAA50162Xhwm104TACTTATAGTCTCGCCTCCCTCCTTTGGCAAGCACTA50146Xhwm105CTTTTAGATGTGGGCGAGACGACAGCACGCCAATAGTT50213Xhwm106GTTTTGCGTTACTGTAGTTGTGGCTGGTAGGAGCATTAGG50188Xhwm107TAATAATAGCCCATGCCAACTCTCCTCGTGTTTGAAAGATC50113Xhwm108ATAACACCCACGATACCAAGATGTCAGGCGGTAAGC50229Xhwm109ATAAGGGTCCGATCACATTGTTACGCCACCACAAAA50242Xhwm110CTCCTGTTTTGGCACTCCGCGATAAAACAAAATCTCAAAGG55298Xhwm111TCGCGAACACCCACCACAATCAAGAAACGAAGGGAACAGG55247Xhwm113AGATCTTCACGATCCAGCTCAAGACCTTGATGAGGACTT50214Xhwm115TCTGAGCCTTGCCAGATGAGCAAGAAACCTGGTCACTACA50200Xhwm119TGATACTTATTGGATTGTTGTT-GTGAACGTGGATTTCACATTTCAT50187Xhwm120TTGCAACTTGCTTGGGACTAATGCTCACCCACCGTAAT50179Xhwm133TCGTCACTCAGGATGGCAACACGGGTCCCAACAAACAC55246Xhwm134AACTCACCCAGTTGATCCAGTAGCATCTTCTACAATCGGCTCA50182Xhwm135CCAGGCTGACGTGACGGAGGTGTTATCAAGTTTCCAGGCGAGGC60135
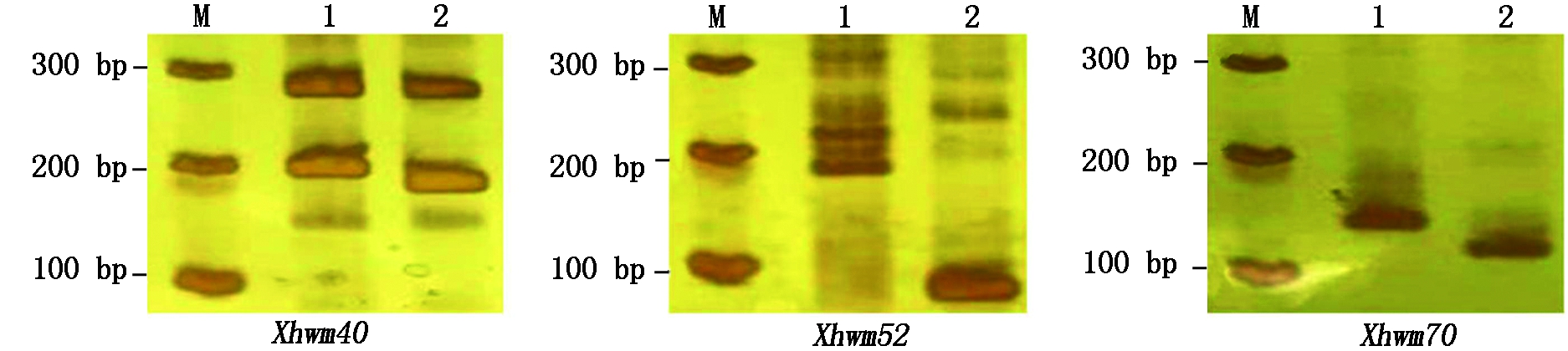
M.Marker;1,2分别为Cf5019-21、Cf5240-41。
M.Marker;1 and 2 are wheat lines Cf5019-21 and Cf5240-41,respectively.
图1 部分SSR引物在小麦品系Cf5019-21和Cf5240-41的扩增结果
Fig.1 Amplification results of some SSR markers in wheat lines Cf5019-21 and Cf5240-41
3 结论与讨论
Nicot等[9]发现,在555个小麦SSR序列中66.5%是三核苷酸重复,二核苷酸重复比例仅为15.5%;Chen等[11]发现,在小麦2 038个SSR序列中三核苷酸重复的出现频率明显高于其他类型,达到51.1%;陈军方等[17]在10 380个EST序列中检索到444个SSR,其中,三核苷酸重复单元比例达到78.0%。然而,潘海涛等[12]在小麦6 314个SSR中发现二核苷酸和三核苷酸重复序列最多,分别达到35.4%和33.0%;Li等[1]在黑麦51 138个SSR序列中发现二核苷酸重复序列比例最高,达到49.0%,其次是三核苷酸(38.0%)。本研究发现,小麦2B染色体25 Mb区段的DNA序列中二核苷酸的重复类型最多,占所有SSR位点总数的80.40%,其次为三核苷酸重复类型,占18.83%。不同研究的核苷酸重复数的差异可能和设置的SSR查找标准及所研究的基因组或基因组区段有关。例如,本研究查找SSR序列是以二、三、四、五核苷酸SSR重复次数均大于或等于5次为标准,这在一定程度上也提高了二核苷酸重复序列的出现频率。另外,本研究中GA/CT重复基元占SSR总数的比例最高(20.44%),潘海涛等[12]和Nicot等[9]也发现小麦SSR序列中二核苷酸重复基元出现频率最多的是GA/CT,该二核苷酸重复基元在黑麦、水稻、玉米、大豆和高粱中出现频率也很高[18],与本研究的结果相一致。
Nicot等[9]根据小麦SSR设计了688对引物,其中70%的引物扩增出清晰的DNA条带,53%的引物在8个小麦品种间表现多态;潘海涛等[12]根据小麦中筛选到的6 314个微卫星序列设计了596对SSR引物,电泳检测发现引物得分在95以上的194对引物中有165对(85%)能在3个小麦品种扩增出稳定清晰的带型,并利用重组自交系(RIL)群体将其中的23个位点整合到已有的小麦遗传图谱上。陈军方等[17]、刘泽涛等[19]分别在135,64对设计的SSR引物中发现60.7%,64.1%的引物在小麦品种扩增出DNA条带。Pestsova等[20]通过筛选粗山羊草基因组文库,根据二核苷酸微卫星设计了149对引物,其中65(43.6%)对引物在粗山羊草基因组扩增出预期大小的DNA片段,48对引物在小麦品种Opata85和W7984间呈现多态。本研究根据小麦2B染色体25 Mb区段的SSR序列设计了135对引物,有101(74.81%)对引物能在小麦品系Cf5019-21和Cf5240-41扩增出清晰的DNA条带,其中,17对引物在这2个材料间表现多态。多态引物比例(16.83%)低于Pestsova等[20]的研究结果,主要原因可能与Cf5019-21和Cf5240-41是来自同一杂交组合的姊妹系有关。本研究成功开发的小麦2B染色体SSR引物可用于小麦及其近缘植物的相关研究。
[1] Li J,Zhou R,Endo T R,Stein N. High-throughput development of SSR marker candidates and their chromosomal assignment in rye(Secale cereale L.)[J]. Plant Breeding,2018,137(4):561-572. doi:10.1111/pbr.12619.
[2] 朱振东,贾继增. 小麦SSR标记的发展及应用[J]. 遗传,2003,25(3):355-360. doi:10.16288/j.yczz.2003.03.026.
Zhu Z D,Jia J Z. Microsatellite marker development and applications in wheat genetics and breeding[J]. Hereditas,2003,25(3):355-360. doi:10.16288/j.yczz.2003.03.026.
[3] Rasheed A,Hao Y,Xia X,Khan A,Xu Y,Varshney R K,He Z. Crop breeding chips and genotyping platforms:Progress,challenges,and perspectives[J]. Molecular Plant,2017,10(8):1047-1064. doi:10.1016/j.molp.2017.06.008.
[4] Liu J,Luo W,Qin N,Ding P,Zhang H,Yang C,Mu Y,Tang H,Liu Y,Li W,Jiang Q,Chen G,Wei Y,Zheng Y,Liu C,Lan X,Ma J. A 55 K SNP array-based genetic map and its utilization in QTL mapping for productive tiller number in common wheat[J]. Theoretical and Applied Genetics,2018,131(11):2439-2450. doi:10.1007/s00122-018-3164-9.
[5] Sun C,Zhang F,Yan X,Zhang X,Dong Z,Cui D,Chen F. Genome-wide association study for 13 agronomic traits reveals distribution of superior alleles in bread wheat from the Yellow and Huai Valley of China[J]. Plant Biotechnology Journal,2017,15(8):953-969. doi:10.1111/pbi.12690.
[6] Cui F,Zhang N,Fan X L,Zhang W,Zhao C H,Yang L J,Pan R Q,Chen M,Han J,Zhao X Q,Ji J,Tong Y P,Zhang H X,Jia J Z,Zhao G Y,Li J M. Utilization of a Wheat 660K SNP array-derived high-density genetic map for high-resolution mapping of a major QTL for kernel number[J]. Scientific Reports,2017,7(1):3788. doi:10.1038/s41598-017-04028-6.
[7] Guyomarc′h H,Sourdille P,Charmet G,Edwards K J,Bernard M. Characterisation of polymorphic microsatellite markers from Aegilops tauschii and transferability to the D-genome of bread wheat[J]. Theoretical and Applied Genetics,2002,104(6):1164-1172. doi:10.1007/s00122-001-0827-7.
[8] Röder M S,Korzun V,Wendehake K,Plaschke J,Tixier M H,Leroy P,Ganal M W. A microsatellite map of wheat[J]. Genetics,1998,149(4):2007-2023. doi:10.0000/PMID9691054.
[9] Nicot N,Chiquet V,Gandon B,Amilhat L,Legeai F,Leroy P,Bernard M,Sourdille P. Study of simple sequence repeat(SSR)markers from wheat expressed sequence tags(ESTs)[J]. Theoretical and Applied Genetics,2004,109(4):800-805. doi:10.1007/s00122-004-1685-x.
[10] Gao L F,Jing R L,Huo N X,Li Y,Li X P,Zhou R H,Chang X P,Tang J F,Ma Z Y,Jia J Z. One hundred and one new microsatellite loci derived from ESTs(EST-SSRs)in bread wheat[J]. Theoretical and Applied Genetics,2004,108(7):1392-1400. doi:10.1007/s00122-003-1554-z.
[11] Chen H M,Li L Z,Wei X Y,Li S S,Lei T D,Hu H Z,Wang H G,Zhang X S. Development,chromosome location and genetic mapping of EST-SSR markers in wheat[J]. Chinese Science Bulletin,2005,50(20):2328-2336. doi:10.1360/982005-379.
[12] 潘海涛,汪俊君,王盈盈,齐照良,李斯深. 小麦EST-SSR标记的开发和遗传作图[J]. 中国农业科学,2010,43(3):452-461. doi:10.3864/j.issn.0578-1752.2010.03.002.
Pan H T,Wang J J,Wang Y Y,Qi Z L,Li S S. Development and mapping of EST-SSR markers in wheat[J]. Scientia Agricultura Sinica,2010,43(3):452-461.
[13] Cho Y G,Ishii T,Temnykh S,Chen X,Lipovich L,McCouch S R,Park W D,Ayres N. Diversity of microsatellites derived from genomic libraries and GenBank sequences in rice(Oryza sativa L.)[J]. Theoretical and Applied Genetics,2000,100(5):713-722. doi:10.1007/s001220051343.
[14] Kantety R V,La Rota M,Matthews D E,Sorrells M E. Data mining for simple sequence repeats in expressed sequence tags from barley,maize,rice,sorghum and wheat[J]. Plant Molecular Biology,2002,48(5-6):501-510. doi:10.1023/A:1014875206165.
[15] 李立新,司守霞,魏安智,刘玉林,冯世静,杨途熙. 基于花椒转录组序列SSR分子标记开发及花椒种质鉴定[J]. 华北农学报,2017,32(5):69-77. doi:10.7668/hbnxb.2017.05.011.
Li L X,Si S X,Wei A Z,Liu Y L,Feng S J,Yang T X. Study on development of SSR molecular markers based on transcriptome sequencing and germplasm identification in germplasm[J]. Acta Agriculturae Boreali-Sinica,2017,32(5):69-77.
[16] Li Q,Wan J M. SSRHunter:Development of a local searching software for SSR sites[J]. Hereditas,2005,27(5):808-810. doi:10.3321/j.issn:0253-9772.2005.05.023.
[17] 陈军方,任正隆,高丽锋,贾继增. 从小麦EST序列中开发新的SSR引物[J]. 作物学报,2005,31(2):154-158. doi:10.3321/j.issn:0496-3490.2005.02.004.
Chen J F,Ren Z L,Gao L F,Jia J Z. Developing new SSR markers from EST of wheat[J]. Acta Agronomica Sinica,2005,31(2):154-158.
[18] Li L,Wang J,Guo Y,Jiang F,Xu Y,Wang Y,Pan H,Han G,Li R,Li S. Development of SSR markers from ESTs of gramineous species and their chromosome location on wheat[J]. Progress in Natural Science,2008,18(12):1485-1490. doi:10.1016/j.pnsc.2008.05.012.
[19] 刘泽涛,苑少华,杨迪,王玉昆,张立平,赵昌平,刘丽华,李宏博,庞斌双. 小麦穗部组织EST-SSR标记引物开发及其在小麦遗传多样性分析中的应用[J].麦类作物学报,2013,33(6):1093-1099. doi:10.7606/j.issn.1009-1041.2013.06.005.
Liu Z T,Yuan S H,Yang D,Wang Y K,Zhang L P,Zhao C P,Liu L H,Li H B,Pang B S. Development of SSR markers derived from EST of wheat spikes and their use in genetic diversity analysis of wheat[J]. Journal of Triticeae Crops,2013,33(6):1093-1099.
[20] Pestsova E,Ganal M W,R der M S. Isolation and mapping of microsatellite markers specific for the D genome of bread wheat[J]. Genome,2000,43(4):689-697. doi:10.1139/g00-042.