在植物的整个生命周期中,缺水、高盐和冻害成为限制其生长发育的重要环境因素。在长期的进化过程中,植物为抵御这些非生物胁迫,形成了一系列特定、复杂的调控机制[1]。当植物受到非生物胁迫时,细胞壁可以保护细胞免受损伤和破坏,而细胞壁的主要组成部分是Ca2+。Ca2+作为第二信使,参与植物细胞骨架功能、体内激素调控、矿物质离子吸收等[2-3]。钙依赖蛋白激酶(Calcium-dependent protein kinases,CDPKs)是植物中特有的一种丝氨酸/苏氨酸蛋白激酶,可以参与植物激素的信号传导和代谢,介导植物对逆境的响应[4],参与细胞骨架的调控、生长发育以及碳氮代谢等[5]。CDPKs是植物中研究较多的一类蛋白激酶,目前已经在模式植物如拟南芥、烟草,双子叶植物如大豆、陆地棉等,单子叶植物如水稻、小麦、玉米、黄瓜、白羊草等均有发现[6-11]。非生物胁迫、生物胁迫、激素等不良因素都可以诱导CDPKs基因的表达。AtCDPK1基因转入拟南芥中,过表达植株具有明显的抗干旱和耐盐性[12];OsCDPK在水稻中的过表达可以增强水稻对盐胁迫的耐受性[13],在高粱中过表达能提高高粱对病害的耐受性[14],过表达天山雪莲SikCDPK1基因可以提高转基因烟草对低温的耐受性[15]。CDPK类基因除参与非生物胁迫途径,还参与多个ABA信号通路[16],启动相关基因的表达、维持细胞内离子的动态平衡、保护细胞膜的完整性,最终缓解胁迫对植物造成的影响,从而提高植物对高盐和干旱胁迫的耐受性[17]。
柠条锦鸡儿(Caragana korshinskii)是锦鸡儿属多年生灌木,根系庞大,耐贫瘠[18],具有很高的经济价值和生态价值[19],可用作饲料、工业原料以及再造林物种等[20]。多生长于半固定和固定沙地,适应性广,耐盐碱、抗干旱能力强[21]。在基因水平解析柠条锦鸡儿的抗逆性机制有助于更好地了解该物种。因此,对其抗逆相关基因开展挖掘和功能研究具有非常重要的意义。
本试验以柠条锦鸡儿为材料,成功克隆出一个CDPK基因,对其进行生物信息学分析,并研究在盐、干旱胁迫以及外源ABA诱导下CkCDPK基因的表达模式,同时构建植物超表达载体,旨在为后期研究CkCDPK基因的功能提供基础。
1 材料和方法
1.1 试验材料
试验中所用到的柠条锦鸡儿种子来源于中国农业科学院北京畜牧兽医研究所牧草资源研究室。DL2000、DL15000 Markers、DNA聚合酶 Ex Taq 酶、限制性内切酶 BglⅡ、BsteⅡ、T4 DNA 连接酶、pMD19-T 载体、SMARTer RACE cDNA Amplification Kit、In-Fusion HD Cloning Kit 均购自 TaKaRa 公司(Japan); RevertAidTM First Strand cDNA Synthesis Kit购自Fermentas(USA);RNA提取采用TRIzol,购自Invitrogen(USA);大肠杆菌感受态细胞Escherichia coli DH5α购自北京天根生化科技有限公司。试验中所用到试剂药品除ABA购自 Sigma(USA)外,其余药品如氯仿、PEG6000、异丙醇、乙醇、NaCl 等均为国产分析纯试剂。
1.2 试验方法
1.2.1 柠条锦鸡儿的种植与处理 2016年11月-2017年11月,挑选饱满的柠条锦鸡儿种子,用氯气消毒 24 h后,将种子均匀摆放在铺有滤纸的培养皿中,放置于光照培养箱(温度 24 ℃,14 h 光照/10 h黑暗)中发芽。待长出 2 叶后将种子移至花盆(基质为营养土∶蛭石∶珍珠岩比例为 3∶1∶1)中继续生长 30 d。取生长30 d的柠条锦鸡儿新鲜叶片0.1 g,在液氮中速冻,用TRzol法提取叶片总RNA,用于柠条锦鸡儿 CDPK基因的克隆。各胁迫试验前期均做预试验筛选出最佳胁迫浓度,即 PEG 浓度为 20%,NaCl 浓度为 250 mmol/L,外源 ABA 浓度为 0.1 mmol/L。选取植株大小基本一致的柠条锦鸡儿幼苗进行外源ABA 胁迫、PEG 模拟干旱和 NaCl 模拟盐胁迫。其中,每个胁迫用苗 5 株,重复 3 次。具体胁迫方法如下:ABA 胁迫:配制含有0.1 mmol/L ABA 的 1/2 MS 营养液,将柠条锦鸡儿幼苗根系置于其中,胁迫0,2,4,6,8,12,24 h;干旱胁迫:配制含有 20% PEG 6000 的 1/2 MS 营养液,将柠条锦鸡儿幼苗根系置于其中,胁迫0,2,4,6,8,12,24 h;高盐胁迫:配制含有 250 mmol/L NaCl 的 1/2 MS 营养液,将柠条锦鸡儿幼苗根系置于其中,胁迫 0,2,4,6,8,12,24 h。分别取以上各处理和不同胁迫时间下的柠条锦鸡儿新鲜叶片0.1 g,在液氮中速冻,用TRIzol法提取RNA,用于定量PCR试验。所有提取的RNA均经过浓度和纯度检测,检测合格后用于后续PCR试验。
1.2.2 柠条锦鸡儿 CDPK 基因的克隆与生物信息学分析 用 1.2.1 中提取到的柠条锦鸡儿叶片总 RNA,参照 RevertAidTM FirstStrand cDNA Asynthesis Kit 说明书,反转录成 cDNA。根据转录组测序得到的类CDPK基因序列片段,用 Primer Premier 5.0 分别设计 5′ RACE和 3′ RACE 的特异性引物GSP1和GSP2(表1),进行RACE-PCR 扩增。反应条件如下:94 ℃预变性 4 min;94 ℃ 30 s,72 ℃ 2 min,5个循环;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 2 min,5个循环;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 2 min,共 27个循环,反应结束后72℃延伸5 min。将得到的PCR产物在 1% 琼脂糖凝胶电泳上进行检测后回收,连接PMD19-T载体,将重组质粒转化大肠杆菌DH5α,挑选阳性克隆送上海英骏公司进行测序,分别得到3′ 端和5′ 端序列,用测序正确序列拼接出柠条锦鸡儿CDPK的全长cDNA序列。
用 DNAStar软件结合NCBI BlastP,对得到的柠条锦鸡儿CDPK基因序列进行分析,查找开放阅读框ORF序列,基因的功能位点和结构域。通过DNAMAN 6.0进行多序列比对分析。在NCBI上搜索下载拟南芥CDPK同源蛋白序列,利用MEGA 6.0软件的Neighbor-Joning法进行蛋白的系统进化树分析[22]。
表1 试验中的引物序列
Tab.1 Primer used in the study

引物名称Name of primer引物序列(5'-3') Sequence of primers (5'-3')用途ApplicationGSP1 CGACACCAGTCAATACCAT CkCDPK 克隆GSP2 TGTTGCCACTTATCATTGTC CkCDPK 克隆F1 TGACAGGATGAGCAAGGAGA 定量PCR R1GTTGGAAGGTGCTGAGGGA 定量PCR F2 CAGAGATTGTTGAAGCGATT 定量PCR R2 TGTTGCCACTTATCATTGTC 定量PCR F3TGACCATGGTAGATCTATGGGTTCCTGTTTAT-CATCTTC载体构建 R3ATTCGAGCTGGTCACCTCAAAGCCTCCTTGAGT-TCTTTC 载体构建
注:表中下划线表示BglⅡ和BsteⅡ限制性酶切位点。
Note:Underlined nucleotides indicate the BglⅡand BsteⅡ restriction site.
1.2.3 不同逆境胁迫下柠条锦鸡儿CDPK基因的表达特性 用 1.2.1 提取到的不同胁迫处理下的 RNA,反转录为 cDNA。以柠条锦鸡儿ACT2基因为内参基因,引物为F1/R1。参考 SYBR Premix Ex Taq的定量PCR引物设计原则,根据得到的柠条锦鸡儿CDPK基因 ORF 序列设计实时荧光定量 PCR 引物F2/R2,用 ABI 7500 荧光定量 PCR 仪(ABI,USA),采用2步法进行 Real-time PCR 扩增:第 1步,95 ℃预变性 30 s;第 2 步,95 ℃ 5 s,60 ℃ 34 s,共 40个循环,每个反应重复 3 次。反应结束后,根据得到的 Ct 值,将每种处理的 0 h 设为对照,利用 2-ΔΔct 法[23],分别计算柠条锦鸡儿CDPK基因在外源 ABA、PEG 以及 NaCl 胁迫下不同时间的表达量。
1.2.4 植物双元表达载体构建 根据pCAMBIA3301 植物超表达载体上的酶切位点和目的基因所用限制性内切酶,在柠条锦鸡儿CDPK基因的开放阅读框5′ 端添加BglⅡ限制性内切酶识别位点,3′ 端添加BsteⅡ限制性内切酶识别位点。以柠条锦鸡儿cDNA为模板进行PCR扩增,得到含有BglⅡ/BsteⅡ酶切位点的产物。用BglⅡ/BsteⅡ双酶切植物表达载体pCAMBIA3301。将二者产物用T4 DNA 连接酶进行连接,得到插入有柠条锦鸡儿CDPK基因的植物超表达载体(图1),通过农杆菌介导法转化 E. coli DH5α 感受态细胞,挑选阳性克隆送上海英骏公司测序,筛选得到测序正确的pCAMBIA3301-CkCDPK重组质粒用于后续试验[24]。
试验中所用到的所有引物用Primer Premier 5.0软件设计,引物序列如表1所示。
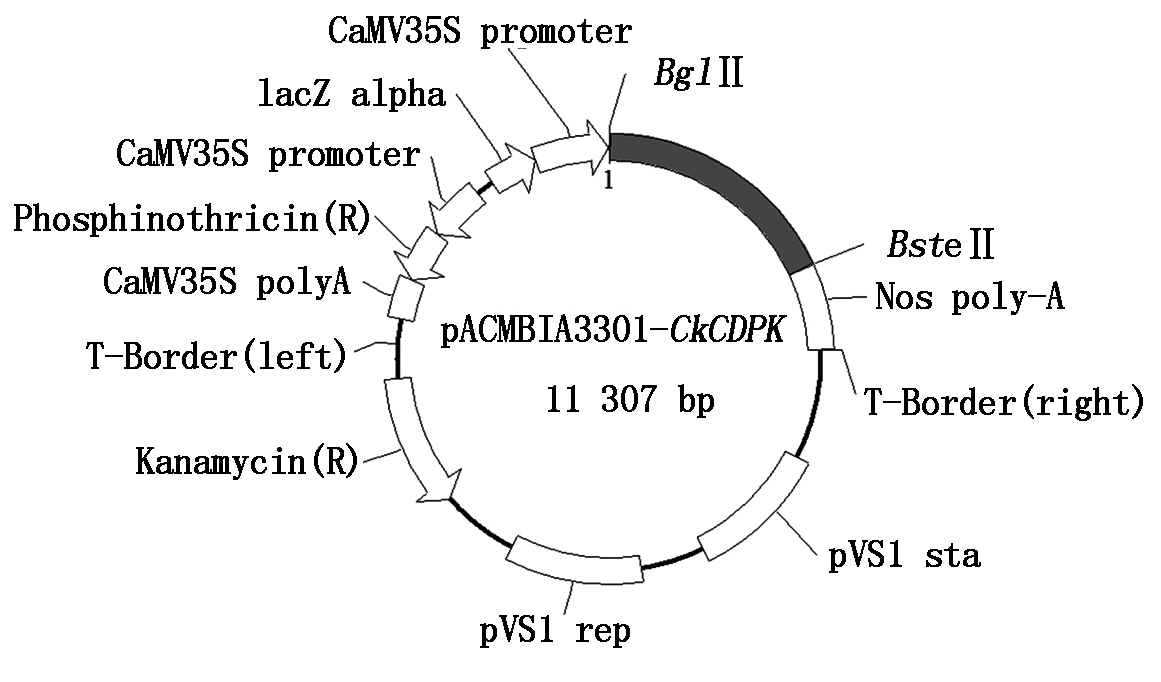
图1 pCAMBIA3301-CkCDPK植物超表达载体构建
Fig.1 Sketch map of over-expression vector of pCAMBIA3301-CkCDPK
2 结果与分析
2.1 柠条锦鸡儿CDPK基因的克隆
本研究根据转录组测序得到的长为300 bp的类CDPK基因片段,用Primer Premier 5.0软件设计引物,利用RACE-PCR技术进行扩增,分别得到5′端长度为1 500 bp(图2-A),3′端长度为800 bp的序列(图2-B)。利用DNAMAN 6.0软件将得到的序列进行拼接,获得长为1 800 bp的序列。在拼接的全长序列上设计引物进行PCR扩增,得到1 700 bp左右的开放阅读框序列(图2-C)。
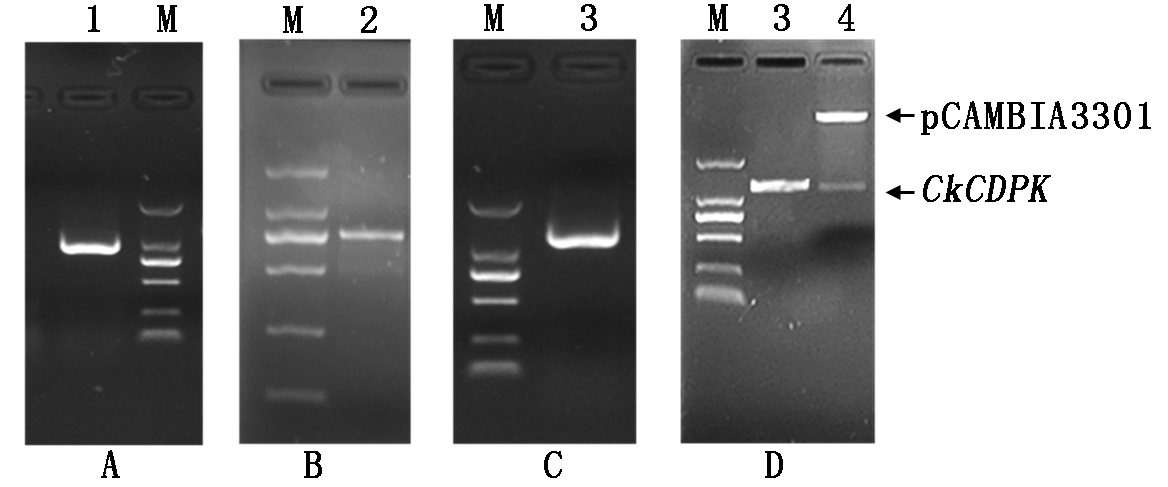
A.柠条锦鸡儿CkCDPK 5′RACE电泳图;B.柠条锦鸡儿CkCDPK 3′RACE电泳图;C.柠条锦鸡儿CkCDPK ORF电泳图;D.植物超表达载体pCAMBIA3301-CkCDPK酶切鉴定图;M.DNA Marker 2000。
A.Electrophoresis result of CkCDPK 5′RACE; B.Electrophoresis result of CkCDPK 3′RACE; C.The fragment of CkCDPK ORF;D.Enzyme digestion of over-expression vector pCAMBIA3301-CkCDPK by BglⅡ/BsteⅡ;M.DNA Marker 2000.
图2 柠条锦鸡儿CkCDPK电泳条带及载体酶切鉴定结果
Fig.2 PCR results of CkCDPK and constructed vector enzyme digestion
2.2 柠条锦鸡儿CDPK基因的生物信息学分析
用DNAStar软件对所得到的目的基因序列进行分析,结果发现,该序列含有1个1 710 bp的完整开放阅读框(图2-C),编码570个氨基酸。序列分析结果表明,该序列编码的蛋白质分子质量为64.03 ku,理论等电点(PI)为 9.12。氨基酸分析结果显示,包含90个强碱性氨基酸(K、R),77 个强酸性氨基酸(D、E),188个疏水性氨基酸(A、I、L、F、W、V),141个极性氨基酸(N、C、Q、S、T、Y)。利用NCBI的BlastP对该基因的蛋白序列进行分析,结果显示,包含有典型的N端可变区、蛋白激酶区以及EF手型结构域。其中蛋白激酶区的丝氨酸/苏氨酸蛋白激酶结构域中包含30个活性位点,18个ATP结合位点,14个多肽底物结合位点,14个活化环;EF手型结构域包含4个EF手型结构域和8个Ca2+结合位点,其中每个手型结构域有36个氨基酸序列(图3)。
将该序列在NCBI网站上进行Blast比对,从NCBI网站上下载鹰嘴豆(Cicer arietinum)、蒺藜苜蓿(Medicago truncatula)、大豆(Glycine max)等 8 个物种的CDPK蛋白序列,用DNAMAN 6.0 将所得到的目的基因序列与它们进行多序列比对,结果显示,与这几个物种的CDPK基因高度同源,蛋白序列相似度分别达到 77.19%,77.02% 和 75.75%(图 4)。以上结果说明,所获得的目的基因序列是一个CDPK类基因,将其命名为 CkCDPK。

箭头之前的序列为N端可变区;中间方框中的序列为蛋白激酶结构域;加粗的方框为4个EF手型结构域;三角形为8个Ca2+结合位点。
The previous sequence of the arrows is the N-terminal variable region;The sequence in the middle box is the serine/threonine kinases domain;The bold box is three EF-hand domains;Triangles are eight Ca2+ binding sites.
图3 CkCDPK 基因核苷酸序列及其推导氨基酸序列
Fig.3 Nucleotide acid sequence and deduced amino acid sequence of CkCDPK

Ck.柠条锦鸡儿;Gh.陆地棉;Ca.鹰嘴豆;Nt.烟草;Gm.大豆;Ca.黄瓜;Mt.蒺藜苜蓿;La.羽扇豆;Va.红豆。
Ck.Caragana korshinskii;Gh.Gossypium hirsutum; Ca.Cicer arietinum; Nt.Nicotiana tabacum; Gm.Glycine max; Ca.Cucumis sativus;
Mt.Medicago truncatula; La.Lupinus angustifolius; Va.Vigna angularis.
图4 CkCDPK 氨基酸序列与其他植物 CDPK 蛋白的多序列联配
Fig.4 Multiple alignment analysis of CkCDPK with homologous from other plants
从NCBI上获得拟南芥CDPK基因家族,共 34 个,分为四大类。将CkCDPK与拟南芥CDPK基因家族进行聚类分析,结果发现,其与拟南芥第 Ⅳ 亚族CDPK28聚为一类(图5),该蛋白可能具有与拟南芥第 Ⅳ 亚族CDPK28相似的功能。
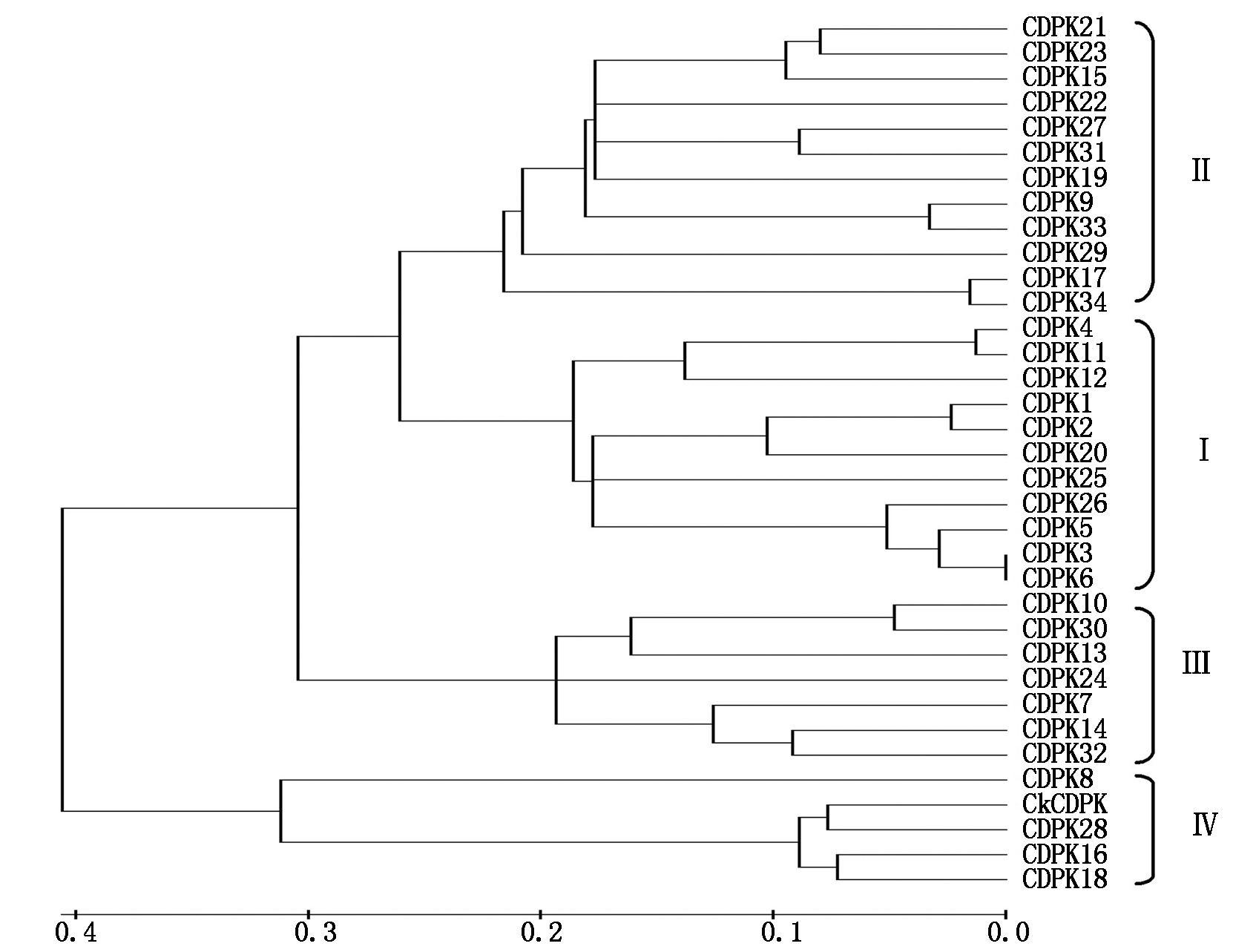
图5 拟南芥CDPK家族DNA序列系统进化树
Fig.5 Phylogenetic tree of CDPK DNA in Arabidopsis thaliana
2.3 逆境胁迫下柠条锦鸡儿CkCDPK基因的表达分析
为了检测CkCDPK基因在非生物胁迫下的表达量,利用qRT-PCR对柠条锦鸡儿CkCDPK基因在盐胁迫和干旱胁迫以及外源ABA诱导下的表达量进行了检测。结果显示,盐胁迫和干旱胁迫均能诱导柠条锦鸡儿 CkCDPK基因的增强表达,2种胁迫诱导下CkCDPK基因的表达量变化基本呈抛物线趋势。NaCl胁迫下,随胁迫时间的延长,CkCDPK基因的表达量逐渐上升,在胁迫 6 h 时表达量达最大,为对照的 7.6 倍,随后表达量逐渐下降(图6-A)。干旱胁迫下,在胁迫 4 h 时表达量最大,为对照的 3.43 倍,随后表达量逐渐下降(图6-B)。外源ABA也能明显诱导CkCDPK基因的表达,从图6-C可以看出,随诱导时间的变化CkCDPK表达量逐渐上升且呈双峰趋势,分别在胁迫6,24 h时表达量达到最大,分别为对照的 7.9,9.8 倍。所有胁迫下,CkCDPK基因的表达量均高于对照。
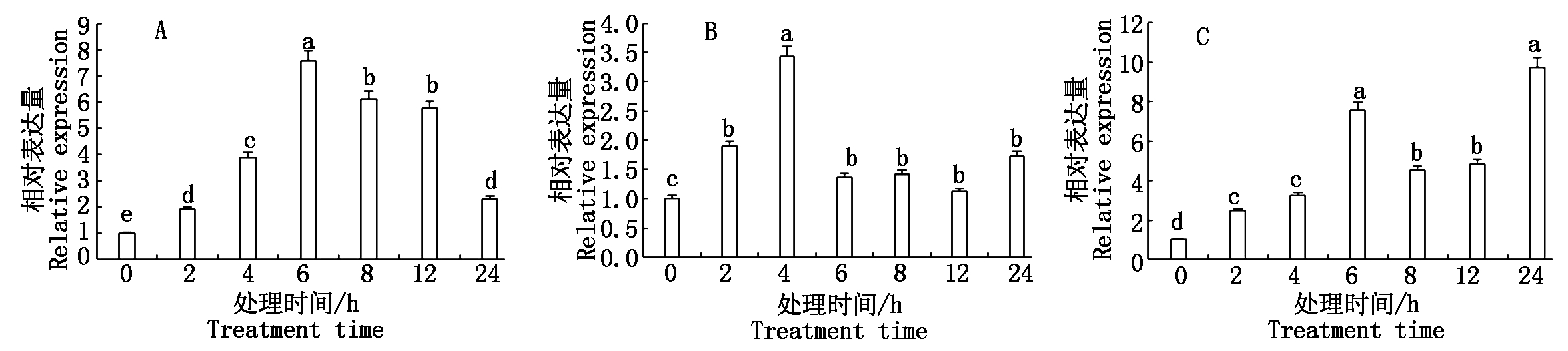
图中不同小写字母代表显著性差异(P<0.05)。A.250 mol/L NaCl处理;B.15% PEG处理;C.外源ABA处理。
Different lowercase letters represent significant differences(P<0.05).A.250 mmol/L NaCl treatment; B.15% PEG treatment; C.ABA treatment.
图6 不同胁迫下CkCDPK 基因的表达量分析
Fig.6 Gene expression analysis of CkCDPK in response to different stress
2.4 柠条锦鸡儿CkCDPK植物超表达载体的构建
本研究用限制性内切酶BglⅡ/BsteⅡ分别酶切植物双元表达载体pCAMBIA3301和柠条锦鸡儿CkCDPK基因开放阅读框ORF序列,用T4 连接酶进行连接。挑选阳性克隆进行测序检测,选用测序结果无缺失、无突变的pCAMBIA3301-CkCDPK重组质粒进行应用。将得到的重组质粒用限制性内切酶BglⅡ和BsteⅡ进行双酶切检测验证,获得2个条带,其中上面条带是pCAMBIA3301质粒条带,下面 1 710 bp左右的条带是柠条锦鸡儿CkCDPK基(图2-D)。结果表明,CkCDPK基因已经成功插入到pCAMBIA3301植物表达载体中。用NptⅡ基因引物和pCAMBIA3301载体引物进行PCR检测(图7),均获得与预测大小相符的条带,证明 pCAMBIA3301-CkCDPK 超表达载体构建成功,可用于后续CkCDPK基因功能验证试验中。通过农杆菌介导的蘸花法将构建好的pCAMBIA3301-CkCDPK 导入模式植物拟南芥中进行超量表达。
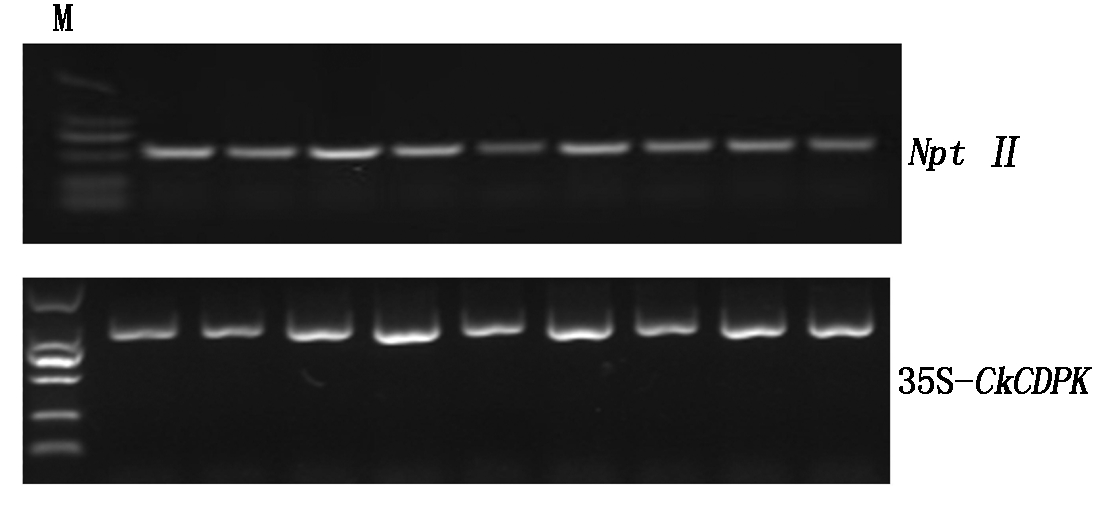
M.Marker 2000。
图7 pCAMBIA3301-CkCDPK PCR检测
Fig.7 The PCR detection of pCAMBIA3301-CkCDPKV
3 结论与讨论
钙依赖蛋白激酶从N端到C端具有可变区、催化区、连接区和调控区4个典型的结构域。每个结构域的氨基酸数量、同源性和功能都不同。其中,催化区和连接区同源性都比较高,催化区又称蛋白激酶区,具有典型的丝氨酸/苏氨酸蛋白激酶保守序列。连接区也有很重要的功能,当缺乏Ca2+时,连接区可能会与催化区结合,导致蛋白激酶活性被抑制。调控区是CDPK基因区别于其他激酶特有的区域,具有与钙离子结合的EF手型结构[25]。本研究对获得的 CkCDPK基因序列进行分析后发现,该序列包含有典型的N端可变区、蛋白激酶区以及 EF 手型结构域。其中,蛋白激酶区的丝氨酸/苏氨酸蛋白激酶结构域中包含 30 个活性位点,18 个ATP结合位点,14 个多肽底物结合位点,14 个活化环;EF手型结构域包含 4 个EF手型结构和 8 个Ca2+结合位点。CkCDPK基因序列结构与二穗短柄草、天山雪莲、陆地棉、花生等结构相似[26-29],可能会参与柠条锦鸡的逆境调控。
钙在植物的生长发育和生理代谢过程中发挥着重要的作用。Ca2+在植物体内的作用方式有2种,第1种是以游离的形式参与植物的生理过程,如缺钙会导致细胞内不能进行正常的有丝分裂,抑制顶芽或根毛的生长;钙离子会促进碳水化合物的代谢,提高植物对钾离子的吸收等[30]。第2种作用方式是细胞质里的Ca2+作为植物体内一些酶的组分和活化剂,如与钙调素或钙依赖型蛋白激酶(CDPK)相结合而起作用[31]。当植物遭受外界非生物胁迫时,会导致气孔关闭,引起细胞质内Ca2+浓度升高,在这个过程中将钙信号传递给下游的便是CDPKs。因此,CDPKs在 Ca2+介导的信号传递路径中扮演着关键角色,对植物感受钙信号和传递钙信号起关键作用[32]。CDPKs参与调控 ABA信号对外界胁迫的反应[33],如拟南芥CDPK4能磷酸化ABA信号途径中的Atlpk2β基因,提高转基因植株体内一系列ABA应答基因的表达[34]。CDPKs通过激活或诱导下游胁迫响应相关基因的表达,来参与植物体内的热胁迫[35]、盐胁迫、低温胁迫、光胁迫[36]等逆境胁迫。如水稻OsCPK12通过激活OsAPX2/OsAPX8的表达,抑制NADPH氧化酶基因,提高对盐的抗逆反应[33]。
本研究测定了盐、干旱和外源ABA诱导下CkCDPK的表达量,结果发现,各胁迫均能诱导该基因的表达,说明CkCDPK参与了柠条锦鸡儿的逆境调控,但CkCDPK是通过与Ca2+结合还是激活或诱导下游相关基因的表达来参与柠条锦鸡儿的逆境胁迫,还有待进一步研究。后期笔者将对CkCDPK基因增强表达的拟南芥株系进行抗逆性评价,进一步揭示CkCDPK基因在植物抗逆性调控中的生物学功能。同时继续筛选柠条锦鸡儿体内其他CDPK类基因,研究它们在逆境胁迫中的作用,并进行遗传转化,期望进一步揭示柠条锦鸡儿CDPK基因在非生物逆境胁迫中的调控作用。
[1] 韩艳丽,李静,操庆国,徐银,颜志明. 梨树CDPK基因家族进化和表达分析[J]. 西北农业学报,2017,26(7):1026-1032. doi:10.7606/j.issn.1004-1389.2017.07.010.
Han Y L,Li J,Cao Q G,Xu Y,Yan Z M. Evolution and expression analysis of CDPK gene family in pear(Pyrus spp.)[J]. Acta Agriculturae Boreali-occidentalis Sinica,2017,26(7):1026-1032
[2] 麻浩,王爽,周亚丽. 植物中钙依赖蛋白激酶的研究进展[J]. 南京农业大学学报,2017,40(4):565-572. doi:10.7685/jnau.201701036.
Ma H,Wang S,Zhou Y L. Research progress of calcium-dependent protein kinases in plants [J]. Journal of Nanjing Agricultural University,2017,40(4):565-572.
[3] Dubrovina A S,Aleynova O A,Kiselev K V. Influence of overexpression of the true and false alternative transcripts of calcium-dependent protein kinase CPK9 and CPK3a genes on the growth,stress tolerance,and resveratrol content in Vitis amurensis cell cultures [J]. Acta Physiologiae Plantarum,2016,38(3):78-88. doi:10.1007/s11738-016-2093-y.
[4] 程子义,魏凤菊,闫爱华,张蕴玮,王冬梅. TaCDPK2 基因在小麦与叶锈菌互作过程中的表达分析[J]. 华北农学报,2012,27(2):19-22.doi:10.3969.j.issn.1000-7091.2012.02.004.
Cheng Z Y,Wei F J,Yan A H,Zhang Y W,Wang D M. Expression analysis of TaCDPK2 gene in the process of wheat infected by Puccinia triticina[J]. Acta Agriculturae Boreali-Sinica,2012,27(2):19-22.
[5] Liu H L,Che Z J,Zeng X R,Zhou X Q,Stitoe H M,Wang H,Yu D. Genome-wide analysis of calcium-dependent protein kinases and their expression patterns in response to herbivore and wounding stresses in soybean [J]. Functional Integrative Genomics,2016,16(5):481-493. doi:10.1007/s10142-016-0498-8.
[6] Xu X W,Liu M,Lu L,He M,Qu W Q,Xu Q,Qi X H,Chen X H. Genome-wide analysis and expression of the calcium-dependent protein kinase gene family in cucumber [J]. Molecular Genetics and Genomics,2015,290(4):1403-1414. doi:10.1007/s00438-015-1002-1.
[7] Gromadka ![]() J,Olszak K,Szczegielniak J,Muszyńska G,Kowalczyk-Polkowska L. Genome-wide analysis and expression profiling of calcium-dependent protein kinases in potato(Solanum tuberosum)[J]. Plant Growth Regulation,2018,84(2):303-315. doi:10.1007/s10725-017-0341-9.
J,Olszak K,Szczegielniak J,Muszyńska G,Kowalczyk-Polkowska L. Genome-wide analysis and expression profiling of calcium-dependent protein kinases in potato(Solanum tuberosum)[J]. Plant Growth Regulation,2018,84(2):303-315. doi:10.1007/s10725-017-0341-9.
[8] Zuo R,Hu R B,Chai G H,Xu M L,Qi G,Kong Y Z,Zhou G K. Genome-wide identification,classification,and expression analysis of CDPK and its closely related gene families in poplar(Populus trichocarpa)[J]. Molecular Biology Reports,2013,40(3):2645-2662. doi:10.1007/s11033-012-2351-z.
[9] Fedorowicz-Stronska O,Koczyk G,Kaczmarek M,Krajewski P,Sadowski J. Genome-wide identification,characterisation and expression profiles of calcium-dependent protein kinase genes in barley(Hordeum vulgare L.)[J]. Journal of Applied Genetics,2017,58(1):11-22. doi:10.1007/s13353-016-0357-2.
[10] Zhang K,Han Y T,Zhao F L,Hu Y,Gao Y R,Ma Y F,Zheng Yi,Wang Y J,Wen Y Q. Genome-wide identification and expression analysis of the CDPK gene family in grape,Vitis spp.[J]. BMC Plant Biology,2015,15:164-182. doi:10.1186/s12870-015-0552-z.
[11] 王运琦,方志红,任彬琳,李莲芬,董宽虎. 白羊草BiCDPK基因保守区的克隆及序列分析[J]. 中国农学通报,2016,32(24):130-135.doi:10.11924/j.issn.1000-6850.casb16040171.
Wang Y Q,Fang Z H,Ren B L,Li L F,Dong K H. The clone and sequence analysis of BiCDPK conserved sequence from Bothriochloa ischaemum[J]. Chinese Agricultural Science Bulletin,2016,32(24):130-135.
[12] Huang K,Peng L,Liu Y Y,Yao R D,Liu Z B,Li X F,Yang Y,Wang J M. Arabidopsis calcium-dependent protein kinase AtCPK1 plays a positive role in salt/drought-stress response[J]. Biochemical and Biophysical Research Communications,2018,498(1):92-98. doi:10.1016/j.bbrc.2017.11.175.
[13] Asano T,Hakata M,Nakamura H,Aoki N,Komatsu S,Ichikawa H,Hirochika H,Ohsugi R. Functional characterisation of OsCPK21,a calcium-dependent protein kinase that confers salt tolerance in rice [J]. Plant Molecular Biology,2011,75:179-191. doi:10.1007/s11103-010-9717-1.
[14] Mall T K,Dweikat I,Sato S J,Neresian N,Xu K M,Ge Z X,Wang D,Elthon T,Clemente T. Expression of the rice CDPK-7 in sorghum:molecular and phenotypic analyses [J]. Plant Molecular Biology,2011,75:467-479. doi:10.1007/s11103-011-9741-9.
[15] 田晓涵,庞学兵,祝建波,朱新霞. 过表达天山雪莲 SikCDPK1 基因提高转基因烟草耐低温能力的机制初探[J]. 中国烟草学报,2016,22(6):98-103. doi:10.16472/j.chinatobacco.2016.210.
Tian X H,Pang X B,Zhu J B,Zhu X X. Effect of over-expression of Saussurea involucrata SikCDPK1 gene on improving cold tolerance in transgenic tobacco [J]. Acta Tabacaria Sinica,2016,22(6):98-103.
[16] 谢鑫,孙宁,魏凤菊. 拟南芥 CPK10/CPK30 双突变体的构建及表型分析[J]. 华北农学报,2016,31(4):94-99. doi:10.7668/hbnxb.2016.04.016.
Xie X,Sun N,Wei F J. Construction and phenotype analysis of CPK10/CPK30 double mutantin Arabidopsis [J]. Acta Agriculturae Boreali-Sinica,2016,31(4):94-99.
[17] 田晓涵. 两种不同生境植物CDPK1基因的克隆及功能初探[D]. 石河子:石河子大学,2016.
Tian X H. Cloning and functional analysis of CDPK1 genes in two different habitats plants [D]. Shihezi:Shihezi University,2016.
[17] 王赞,李源,陆景伟,徐博,高洪文. 中国柠条锦鸡儿资源表型多样性研究[J]. 华北农学报,2008,23(S1):59-61.doi:10.7668/hbnxb.2008.S1.015.
Wang Z,Li Y,Lu J W,Xu B,Gao H W. Study on phenotypic diversity of Caragana korshinskii[J]. Acta Agriculturae Boreali-Sinica,2008,23(S1):59-61.
[19] 任方媛,李高,张涛,杨杞,王瑞刚. 柠条锦鸡儿CkF5H基因及启动子的克隆[J]. 华北农学报,2018,33(2):79-86. doi:10.7668/hbnxb.2018.02.012.
Ren F Y,Li G,Zhang T,Yang Q,Wang R G. Cloning gene and promoter of CkF5H from Caragana korshinskii Kom.[J]. Acta Agriculturae Boreali-Sinica,2018,33(2):79-86.
[20] 任爱琴,易津,高洪文,李俊,王学敏. 柠条锦鸡儿CkNCED1基因启动子的克隆及表达分析[J]. 草业学报,2013,22(2):165-170.
Ren A Q,Yi J,Gao H W,L J,W X M. Cloning and expression analysis of the promoter of Caragana Korshinskii gene [J]. Acta Prataculturae Sinica,2013,22(2):165-170.
[21] 滑璐玢,于秀敏,杨杞,王瑞刚,宝力德. 柠条锦鸡儿CkLEA4-1 基因的克隆及表达分析[J]. 华北农学报,2017,32(2):96-103. doi:10.7668/hbnxb.2017.02.015.
Hua L F,Yu X M,Yang F,Wang R G,Bao L D. Clone and expression analysis of CkLEA4-1 from Caragana korshinskii Kom [J].Acta Agriculturae Boreali-Sinica,2017,32(2):96-103.
[22] 姜霁珊,方志红,陈敏,王运琦,吴欣明,贾慧丽,武语迪,高洪文,王学敏. 紫花苜蓿尿黑酸植基转移酶的克隆、表达分析以及遗传转化研究[J].草业学报,2017,26(3):82-90. doi:10.11686/cyxb016007.
Jiang J S,Fang Z H,Chen M,Wang Y Q,Wu X M,Jia H L,Wu Y D,Gao H W,Wang X M. Cloning and expression analysis of homogentisate phytyltransferase from Medicago sativa and its genetic transformation in Arabidopsis thaliana[J]. Acta Prataculturae Sinica,2017,26(3):82-90.
[23] Livak K J,Schmittgen T D. Analysis of relative gene expression data using real time quantitative PCR and the 2-ΔΔCT method[J]. Methods,2001,25(4):402-408. doi:10.1006/meth.2001.1262.
[24] 贾会丽,王学敏,郭继承,高洪文,吴欣明,刘建宁,石永红,董宽虎,王运琦. 紫花苜蓿MsLEA4-4基因的克隆、表达分析及遗传转化[J].草业学报,2017,26(12):108-116. doi:10.11686/cyxb2017202.
Jia H L,Wang X M,Guo J C,Gao H W,Wu X M,Liu J N,Shi Y H,Dong K H,Wang Y Q. Cloning and expression analysis of MsLEA4-4 from Medicago sativa[J]. Acta Prataculturae Sinica,2017,26(12):108-116.
[25] 费小钰,李红丽,王俊皓. 植物钙依赖蛋白激酶 CDPK 基因功能综述[J]. 吉林农业,2017(9):104-105. doi:10.14025/j.cnki.jlny.2017.09.064.
Fei X Y,Li H L,Wang J H. Function of plant calcium-dependent protein kinase CDPK gene was reviewed [J]. Agriculture of Jilin,2017,(9):104-105.
[26] 韦淑亚,赵旭东,王会平,杨广笑,何光源. 二穗短柄草钙依赖型蛋白激酶BdCDPK4基因的克隆及其编码蛋白质的生物信息学分析[J]. 浙江农业学报,2017,29(2):345-352. doi:10.3969/j.issn.1004-1524.2017.02.23.
Wei S Y,Zhao X D,Wang H P,Yang G X,He G Y. Cloning and encoding protein bioinformatics analysis of BdCDPK4 from Brachypodium distachyon[J]. Acta Agriculturae Zhejiangensis,2017,29(2):345-352.
[27] 田晓涵,刘玉玲,李永梅,李锦,庞学兵,祝建波,朱新霞. 两种不同生境植物棉花与雪莲CDPK1基因的克隆及生物信息学分析[J]. 江苏农业学报,2016,32(5):1005-1012. doi:10.3969/j.issn.1000-4440.2016.05.008.
Tian X H,Liu Y L,Li Y M,Li J,Pang X B,Zhu J B,Zhu X X. Cloning and bioinformatics analysis of CDPK1 gene in Gossypium hirsutum and Sasussured involucrata from two different habitats[J]. Jiangsu Journal of Agricultural Sciences,2016,32(5):1005-1012.
[28] 张青云,孙全喜,唐月异,王秀贞,吴琪,王云云,曹广英,祁雪,王传堂. 花生AhCDPK32基因克隆及表达载体的构建[J]. 分子植物育种,2016,14(5):1171-1178. doi:10.13271/j.mpb.014.001171.
Zhang Q Y,Sun Q X,Tang Y Y,Wang X Z,Wu Q,Wang Y Y,Cao G Y,Qi X,Wang C T. Cloning and expression vector construction of AhCDPK32 gene from peanut(Arachis hypogaea L.)[J].Molecular Plant Breeding,2016,14(5):1171-1178.
[29] 曹辉庆,蒋胜理,黄诚梅,邓智年,吴凯朝,徐林,陆珍,陈丽君,李秋凤,魏源文. 甘蔗钙依赖蛋白激酶基因克隆与序列分析[J]. 南方农业学报,2017,48(4):574-580. doi:10.3969/j.issn.2095-1191.2017.04.002.
Cao H Q,Jiang S L,Huang C M,Deng Z N,Wu K C,Xu L,Lu Z,Chen L J,Li Q F,Wei Y W. Cloning and sequence analysis of calcium-dependent protein kinase gene in sugarcane[J]. Journal of Southern Agriculture,2017,48(4):574-580.
[30] 于亚慧. 拟南芥CPK6在植物钙依赖性生长过程中的生理功能研究[D]. 呼和浩特:内蒙古大学,2018.
Yu Y H. Physiological function study in plant calcium dependent growth of Arabidopsis CPK6 [D]. Hohhot:Inner Mongolia University,2018.
[31] 印荔. 盐胁迫下莲藕对外源Ca2+的生理响应及Ca2+依赖蛋白基因-NnCDPKs克隆与表达分析[D]. 扬州:扬州大学,2016.
Yin L. Physiological effects of exogenous Ca2+ on Nelumbo nucifera Gaertn under salt stress,cloning and expression analysis of Ca2+-dependent protein genes-NnCDPKs[D]. Yangzhou:Yangzhou University,2016.
[32] Chen Y X,Zhou X J,Chang S,Chu Z L,Wang H M,Han S C,Wang Y D. Calcium-dependent protein kinase 21 phosphorylates 14-3-3 proteins in response to ABA signaling and salt stress in rice [J]. Biochemical and Biophysical Research Communications,2017,493(4):1450-1456. doi:10.1016/j.bbrc.2017.09.166.
[33] Zeng H Q,Zhang Y X,Zhang X J,Pi E,Zhu Y Y. Analysis of EF-Hand proteins in soybean genome suggests their potential roles in environmental and nutritional stress signaling [J]. Front Plant Science,2017,8:877. doi:10.3389/fpls.2017.00877.
[34] Wang P,Yang Q F,Sang S H,Yao C,Zhong Y J,Wei Z Y. Arabidopsis inositol polyphosphate kinase AtIpk2β is phosphorylated by CPK4 and positively modulates ABA signaling [J]. Biochemical and Biophysical Research Communications,2017,490(2):441-446. doi:10.1016/j.bbrc.2017.06.060.
[35] Dubrovina A S,Kiselev K V,Khristenko V S,Aleynova O A. The calcium-dependent protein kinase gene VaCPK29 is involved in grapevine responses to heat and osmotic stresses[J]. Plant Growth Regulation,2016,82(1):79-89. doi:10.1007/s10725-016-0240-5.
[36] Giammaria V,Grandellis C,Bachmann S,Gargantini P R,Feingold S E,Bryan G,Ulloa R M. StCDPK2 expression and activity reveal a highly responsive potato calcium-dependent protein kinase involved in light signaling [J]. Planta,2011,233(3):593-609. doi:10.1007/s00425-010-1319-2.