猪肺炎支原体(Mycoplasma hyopneumoniae,M.hyo)广泛分布于世界各地,患猪主要表现为生长速度减慢,饲料转化率低[1],该病原致死率不高,但如果继发感染可造成严重死亡,给养猪场带来巨大经济损失[2]。目前,用于预防猪肺炎支原体的疫苗主要是弱毒苗和灭活苗,疫苗免疫虽可提高猪群抵抗力,改善生产性能,但难以完全阻止该病原在猪群的传播[3-5]。新型疫苗以及免疫评估方法的研究一直受到广泛关注。其P36、P46、P97蛋白常作为基因工程疫苗或ELISA抗体检测方法研究的重要目的蛋白[6-10],另外,同样作为猪肺炎支原体黏附因子的P146蛋白也开始受到关注[11]。对这些蛋白基因在当前流行菌株进化、变异情况进行调查和分析,对于生猪猪肺炎支原体疫苗研究、评估方法的开发均具有重要的意义,但至今,GenBank登录的相关蛋白基因序列很少,不同蛋白分别只有8~17条左右的序列,且多数序列为2010年以前上传。目前也没有关于湖南省生猪猪肺炎支原体感染菌株遗传变异情况的研究报道。因此,本研究选取了2014-2017年从湖南省长沙市屠宰场收集的不同时间、不同来源地的猪肺炎支原体阳性样本,进行P36、P46、P97 R1、P146基因测序,并结合GenBank登录的菌株进行了氨基酸序列的比对分析,以便为该病原的防控研究提供参考。
1 材料和方法
1.1 主要试剂
PCR金牌Mix购自北京擎科新业生物技术有限公司。
1.2 猪肺炎支原体阳性样本DNA模板
于2014-2017年不同时间,从湖南省长沙市2个大型屠宰猪场收集了530个肺脏,用生理盐水进行气管灌洗,收集灌洗液、提取DNA进行猪肺炎支原体检测后,保存。本试验根据采样时间和屠宰猪来源地挑选了17个不同时间收集,不同来源地的猪肺炎支原体阳性的DNA样本作为研究对象。
1.3 猪肺炎支原体P36、P46、P97 R1、P146基因PCR扩增引物的设计与合成
根据GenBank登录的相关基因序列(CP003131.1、AE017332.1、CP002274.1、AE017243.1、CP003802.1),按照包含基因重要功能区、基因多变区和便于设计引物的原则,在P36基因的前后两端50~100个碱基处设计引物,P46基因选在起始与终止区域附近的合适位置设计引物,P97则在使猪肺炎支原体具备黏附呼吸道纤毛功能所不可或缺的区域,R1区[12-13]前后设计引物,P146基因则根据GenBank登录序列同源性比对情况,选在基因多变区的前后设计引物。具体引物信息见表1。引物送北京擎科新业生物技术有限公司进行合成。
1.4 不同基因片段的PCR扩增与测序
以选定的肺脏灌洗液DNA作为模板,采用高保真的金牌PCR Mix,按照表1中退火温度进行不同基因的PCR扩增,具体操作按常规进行,PCR完毕后进行DNA 电泳鉴定,并将阳性PCR产物送北京擎科新业生物科技有限公司进行测序。
表1 猪肺炎支原体P36、P46、P97 R1、P146基因引物信息
Tab.1 Primer used for P36,P46,P97 R1,P146 gene of M.hyo

引物Primer引物序列Primer sequence退火温度/℃Annealing temperature扩增片段长度/bp PCR product lengthP36FP5′-AATTTCATTTTTGATTCGTTTTAATT-3′63/551 376P36RP5′-ATGGTAGACACGGCAGACTCAAAACC-3′P46FP5′-TTCGCTTGCATCAATTATTGCATTTG-3′641 206P46RP5′-TAGGCATCAGGATTATCAACATTAGC-3′P97FP5′-TCAAGTTGCAAGTTATTTCCAGGAT-3′651 299P97RP5′-AGTTAATTCGGTAGTTGGGCTTTGT-3′P146FP5′-GCATAAAAAGCAAGAACATCATA-3′631 405P146RP5′-GTCAAGCCCCAGAAAAGTCACAA-3′
注:63/55.前10个循环63 ℃;后20个循环55 ℃。
Note:63/55.The first 10 cycles at 63 ℃; The next 20 cycles at 55 ℃.
1.5 不同基因片段所编码氨基酸序列的比对分析
根据PCR测序峰图,将PCR测序结果进行处理后,利用Lasergene生物软件翻译成氨基酸序列,结合GenBank登录的猪肺炎支原体菌株相应序列(疫苗相关菌株M.hyo J株、168株、168-L株,及其他不同菌株序列),采用Lasergene软件进行同源性比较,并采用DNAStar生物软件对不同蛋白差异明显的功能区域进行抗原表位预测。考察屠宰猪肺脏样本中菌株与GenBank登录的菌株之间各蛋白氨基酸序列的遗传变异情况。
2 结果与分析
2.1 P36、P46、P97 R1、P146基因PCR扩增结果
采用设计的引物,以挑选的猪肺炎支原体阳性DNA样本为模板,进行PCR扩增,代表性结果图片见图1-4。由图可见,各基因均扩增出了预期大小的特异性条带。
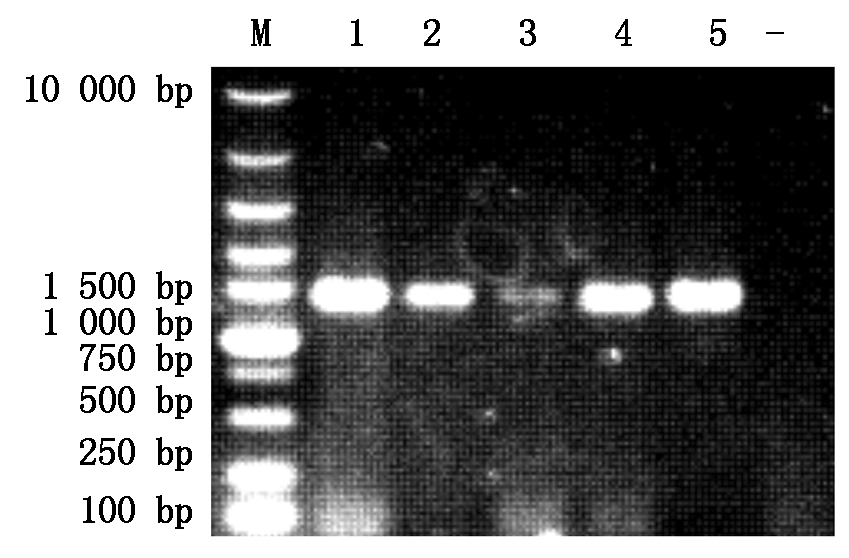
M.DNA分子质量标准;1-5.PCR扩增产物;-.阴性对照。图3同。
M.DNA Marker;1-5.Product of PCR;-. Negative control.The same as Fig.3.
图1 P36基因PCR扩增结果
Fig.1 PCR amplification of P36 gene
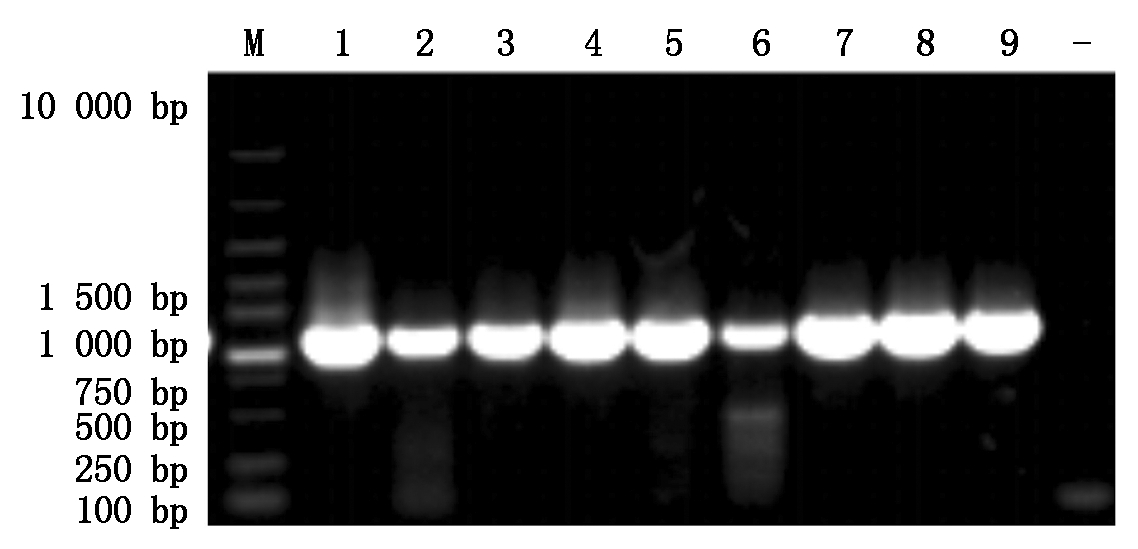
M.DNA分子质量标准;1-9.PCR扩增产物;-.阴性对照。
M.DNA Marker;1-9. Product of PCR; -. Negative control.
图2 P46基因PCR扩增结果
Fig.2 PCR amplification of P46 gene
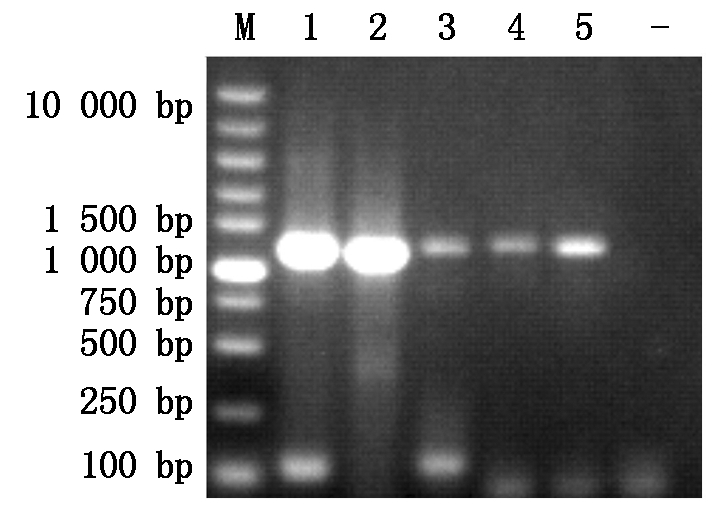
图3 P97 R1基因PCR扩增结果
Fig.3 PCR amplification of P97 gene R1 region
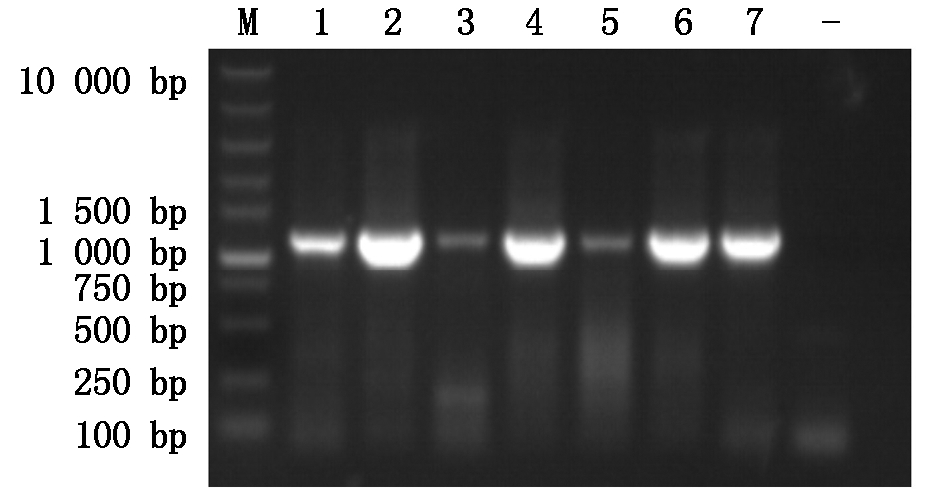
M.DNA分子量标准;1-7.PCR扩增产物;-.阴性对照。
M.DNA Marker; 1-7. Product of PCR; -.Negative control.
图4 P146基因PCR扩增结果
Fig.4 PCR amplification of P146 gene
表2 屠宰猪猪肺炎支原体基因序列GenBank登录号
Tab.2 Accession number of different gene of M.hyo from slaughter pigs
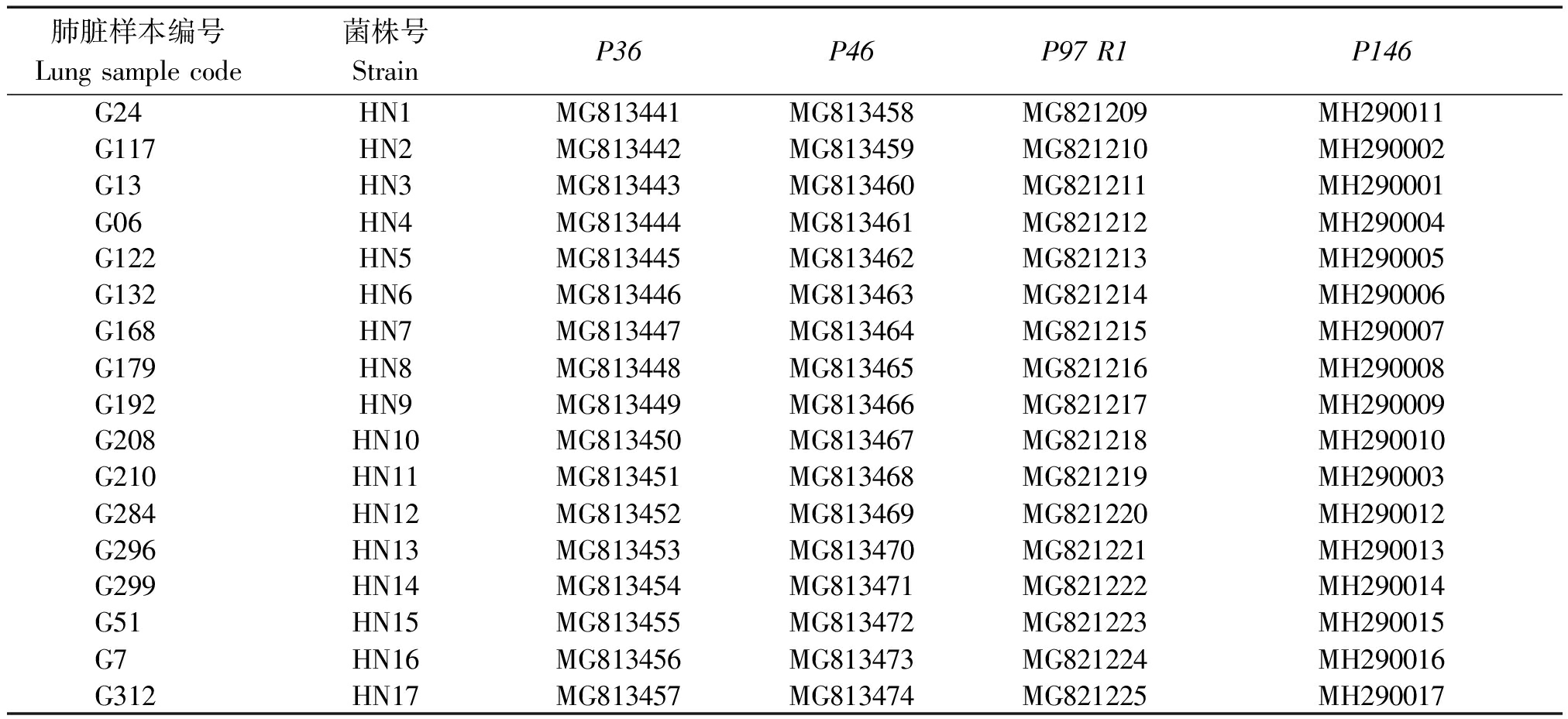
肺脏样本编号Lung sample code 菌株号StrainP36P46P97 R1P146G24HN1MG813441MG813458MG821209MH290011G117HN2MG813442MG813459MG821210MH290002G13HN3MG813443MG813460MG821211MH290001G06HN4MG813444MG813461MG821212MH290004G122HN5MG813445MG813462MG821213MH290005G132HN6MG813446MG813463MG821214MH290006G168HN7MG813447MG813464MG821215MH290007G179HN8MG813448MG813465MG821216MH290008G192HN9MG813449MG813466MG821217MH290009G208HN10MG813450MG813467MG821218MH290010G210HN11MG813451MG813468MG821219MH290003G284HN12MG813452MG813469MG821220MH290012G296HN13MG813453MG813470MG821221MH290013G299HN14MG813454MG813471MG821222MH290014G51HN15MG813455MG813472MG821223MH290015G7HN16MG813456MG813473MG821224MH290016G312HN17MG813457MG813474MG821225MH290017
2.2 P36、P46、P97 R1、P146基因测序结果
将各基因PCR扩增阳性产物送公司进行测序,然后根据测序峰图将序列进行编辑,结果表明,获得P36基因为948 bp的完整序列;P46为5′端缺少114 bp(该区域在GenBank已登录的13个序列中仅有2个序列出现1个核苷酸的差异,氨基酸序列无差异)、3′端缺少60 bp(该区域在GenBank已登录的13个序列中一致性为100%),共1 086 bp的基因片段;P97则为包含R1区在内的1 107 bp的部分基因片段;P146则为包含多变区在内的1 312 bp的基因片段。各序列GenBank登录号见表2。
2.3 P36氨基酸序列比对分析结果
利用生物软件Lasergene将测出的P36基因序列与GenBank登录的,包括3个疫苗菌株在内的9个猪肺炎支原体P36基因进行演绎氨基酸序列比对分析,结果见图5。由图可见各菌株间P36蛋白氨基酸序列同源性均在99%以上。
2.4 P46氨基酸序列比对分析结果
利用生物软件Lasergene将测出的P46基因序列与GenBank登录的,包括3个疫苗菌株在内的13个猪肺炎支原体P46基因进行演绎氨基酸序列的比对分析,结果见图6。由图可见各菌株间P46蛋白氨基酸序列同源性较高,相互之间存在99%以上的一致性。

MG813441-MG813457.屠宰猪猪肺炎支原体菌株。
MG813441-MG813457.Strains detected from bronchoalveolar lavage fluid of slaughter pigs.
图5 不同来源猪肺炎支原体P36基因演绎氨基酸序列的比对结果
Fig.5 Deduced amino acids sequence comparison analysis of P36 gene of different M.hyo strains

MG813458-MG813474.屠宰猪猪肺炎支原体菌株。
MG813458-MG813474.Strains detected from bronchoalveolar lavage fluid of slaughter pigs.
图6 不同来源猪肺炎支原体P46基因演绎氨基酸序列的比对结果
Fig.6 Deduced amino acids sequence comparison analysis of P46 gene of different M.hyo strains
2.5 P97 R1区氨基酸序列比对分析结果
利用生物软件Lasergene将测出的P97 R1区基因演绎氨基酸序列与GenBank登录的猪肺炎支原体氨基酸序列进行比对分析,同时统计各序列R1区重复氨基酸的类型及数量。结果见图7、表3。R1区重复氨基酸序列数量在9以下的有3个Gen-Bank登录的菌株(该3个菌株均为加拿大研究人员2003年上传的菌株);R1区包含9~11个重复氨基酸序列的菌株有3个疫苗相关菌株 168株(11个)、168-L(10个)、J株(9个),4个检测自屠宰猪肺脏的菌株,以及4个GenBank登录的非疫苗菌株(1个2003年上传序列,2个2005年上传序列,1个2012年上传序列);包含14个以上重复氨基酸序列的菌株有11个来自屠宰猪样本的菌株,5个GenBank登录的序列。34个被比较的序列中,重复氨基酸序列在14个以上者占总数的47%。另外,从图7和表3可见,包含疫苗菌株J株在内的只有9或9个以下重复氨基酸序列的4个菌株间,在重复氨基酸的类型(AAKPE/AAKPV/TTKPV/TAKPV/AVKPV/GAKPE)和数量之间只有2个菌株具有完全的一致性(AY512898、AY512903)。 通过DNAStar生物软件将R1区进行抗原表位预测,结果发现包含不同类型、数量重复氨基酸序列的菌株之间存在明显差异。尤其是存在16个以上重复序列组成的抗原表位与M.hyo J 株相应区域的抗原表位明显不同。

MG821209-MG821225.屠宰猪猪肺炎支原体菌株。表3同。
MG821209-MG821225.Strains detected from bronchoalveolar lavage fluid of slaughter pigs.The same as Tab.3.
图7 不同来源猪肺炎支原体P97基因R1区推导氨基酸序列比对结果
Fig.7 Deduced amino acids sequence comparison analysis of P97 gene R1 region of different M.hyo strains
表3 不同菌株P97 R1区氨基酸重复序列类型与数量
Tab.3 The number and types of amino acid repeat units of M.hyo P97 amino acid sequence R1 region
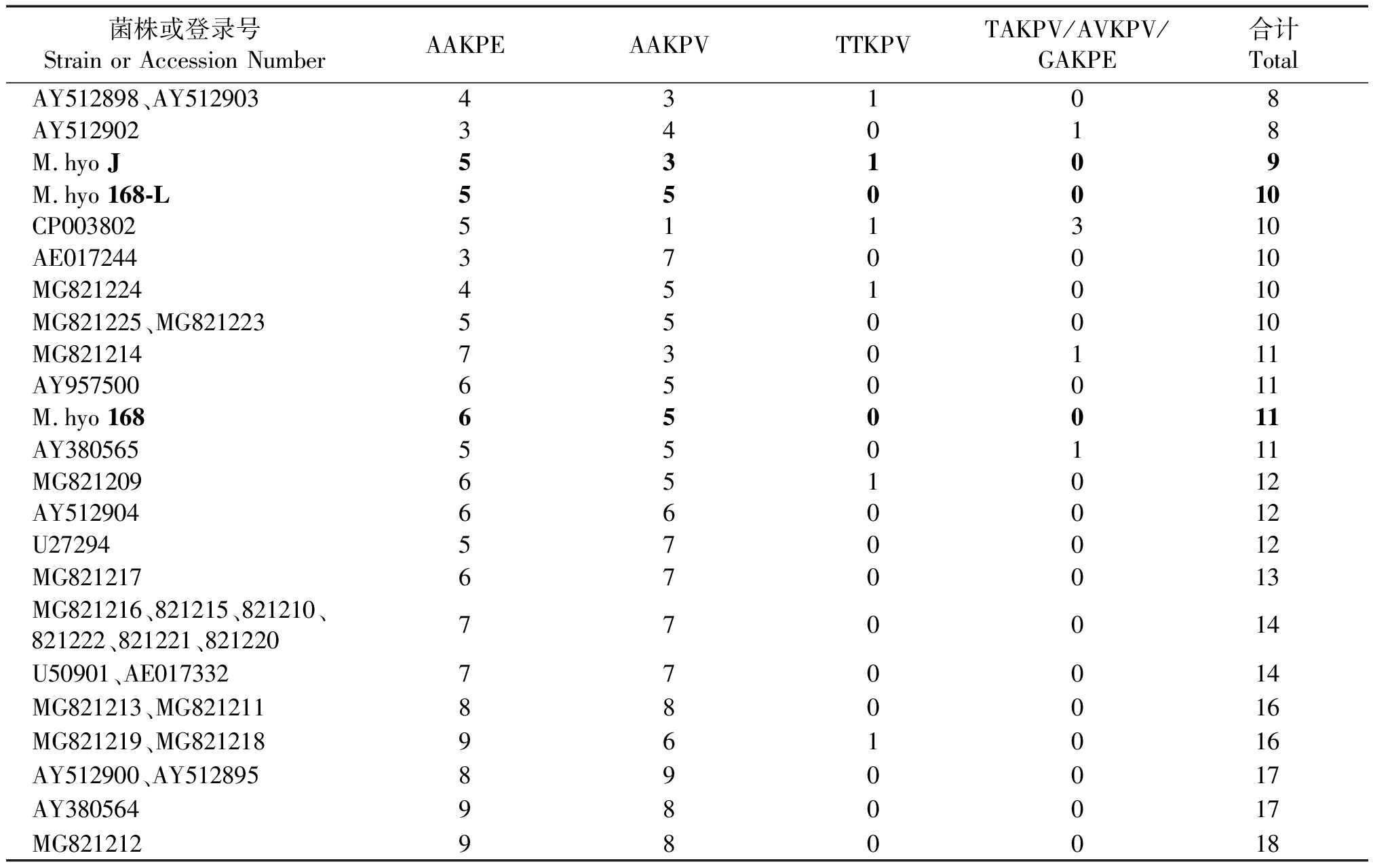
菌株或登录号Strain or Accession NumberAAKPEAAKPVTTKPVTAKPV/AVKPV/GAKPE合计TotalAY512898、AY51290343108AY51290234018M.hyo J53109M.hyo 168-L550010CP003802511310AE017244370010MG821224451010MG821225、MG821223550010MG821214730111AY957500650011M.hyo 168650011AY380565550111MG821209651012AY512904660012U27294570012MG821217670013MG821216、821215、821210、821222、821221、821220770014U50901、AE017332770014MG821213、MG821211880016MG821219、MG821218961016AY512900、AY512895890017AY380564980017MG821212980018
2.6 P146多变区氨基酸序列比对分析结果
利用生物软件Lasergene将样本中测出的P146序列与GenBank登录的猪肺炎支原体菌株进行P146氨基酸序列的比对分析。结果发现菌株间氨基酸序列差异主要集中在2个重复氨基酸序列区(P146 R1 PQ重复区、P146 R2 PS重复区)。2个重复区氨基酸序列同源性比较结果见图8,J 株、168株、168-L和2个GenBank登录序列(AE017244、DQ088147)、1个屠宰猪肺脏样本(MH290015)在R1区出现较多的氨基酸缺失;168株、168-L株及3个GenBank登录序列、6个屠宰猪肺脏样本在R2区出现3~9个氨基酸的缺失。通过DNAStar生物软件将P146多变区氨基酸序列进行抗原表位预测,结果发现R1、R2区氨基酸的缺失导致了相应区域抗原表位出现明显的变化。


MH290001-MH290017.屠宰猪猪肺炎支原体菌株。
MH290001-MH290017.Strains detected from bronchoalveolar lavage fluid of slaughter pigs.
图8 不同来源猪肺炎支原体P146 R1(上)、R2(下)区氨基酸序列比对结果
Fig.8 Deduced amino acids sequence comparison analysis of P146 R1,R2 region gene of different M. hyo strains
3 结论与讨论
猪肺炎支原体P36、P46基因比较保守[14-15],这在本研究中也得到了相同的结果。P46是猪肺炎支原体膜表面蛋白,具有种特异性和很强的免疫原性,常作为新型疫苗研究或ELISA抗体检测诊断抗原的研究靶蛋白[6,16]。P36蛋白是细胞胞浆蛋白,同样具有强的免疫原性,但产生抗体的时间比较晚[14],P97蛋白是主要参与猪肺炎支原体对猪呼吸道上皮纤毛细胞黏附的因子[12-13]。 P146蛋白是P97的同源类似物之一,同样具有黏附纤毛的作用, Bogema等[11]通过免疫印迹检测发现P146能被猪肺炎支原体疫苗免疫猪血清和康复猪血清识别,但目前尚没有关于该蛋白的进一步研究。Feng 等[17]采用P97 R1、P46、P36 3个蛋白作为抗原,检测猪肺炎支原体感染猪的免疫反应,证明针对P97R1的IgG出现相对更早、更明显,且抗P97R1的sIgA浓度最高。此外,也有研究证明,用P97 C末端蛋白免疫生猪可产生特异性体液和细胞免疫反应,并可对猪肺炎支原体的攻毒具有较好的保护作用[8], Okamba等[9]用P97 C末端蛋白通过肌肉和滴鼻免疫小鼠,在血液和肺泡灌洗液均产生明显的特异性抗体,并认为重组P97 C末端蛋白疫苗可能成为控制猪肺炎支原体感染的新策略。猪肺炎支原体在呼吸道是否能够定殖主要取决于其吸附于生猪气管纤毛的能力[18],P97蛋白是主要参与猪肺炎支原体对猪呼吸道上皮纤毛细胞黏附的因子,其R1区中的重复氨基酸序列(AAPKE/V)为P97发挥纤毛黏附作用所必需的氨基酸序列,该重复序列在不同菌株间可出现变异并且该变异可影响病原对纤毛的黏附能力[12-13]。 一株猪肺炎支原体要具备纤毛黏附能力,其P97蛋白R1区至少应具备8个以上的重复氨基酸序列,并且至少要具备3个以上重复序列,该重复区才能被抗体识别[13]。猪肺炎支原体黏附生猪支气管纤毛过程,主要是通过纤毛相应受体配位基与猪肺炎支原体P97、P146等黏附因子结合来实现[19]。针对P97蛋白的抗体能够体外抑制猪肺炎支原体对宿主细胞的黏附[20-21]。P97重复氨基酸的增加或减少,将会导致蛋白发生改变,从而干扰免疫系统识别[22]并且支原体某些表面蛋白基因的变异可使其逃避动物抗体的攻击[23]。此外,不同猪场流行菌株P97黏附因子R1区氨基酸重复数量可能存在差异,多数猪场可能有2个以上的菌株同时存在,且同一头猪感染2个以上菌株后,肺脏病变更严重[24]。
猪肺炎支原体基因组A、T含量高,且存在较多重复序列,PCR扩增和测序均存在较大难度。本试验首次对湖南生猪猪肺炎支原体感染菌株遗传变异情况进行了初步调查以及重要蛋白氨基酸序列分析。17个样本中有11个样本猪肺炎支原体P97 R1区重复序列数量比GenBank登录的3个疫苗相关菌株[25-28](J株、168株、168-L株)要多3~10个不等,但与猪肺炎支原体活疫苗菌株RM48株及Z株比较,17个样本中猪肺炎支原体除有1株P97R1区比R48株、Z株(17个重复序列[28])多1个重复序列外,其他都低于17个重复序列。此外,样本与M.hyo J株、168株、168-L株之间P146均存在较大的差异,168株、168-L株在R1、R2重复区均存在氨基酸的缺失,J株在R1重复区存在氨基酸缺失,至于其他疫苗菌株,由于没有相应基因序列上传至GenBank,所以未进行比较分析。
已有研究表明,猪肺炎支原体灭活疫苗或活苗均可以诱导生猪产生系统和局部的免疫反应[10,29-30],并且可诱导产生针对P36、P46、P97 R1区蛋白的抗体[10]。但当前猪肺炎支原体灭疫苗或活苗仅可减轻生猪感染猪肺炎支原体的临床症状,改善健康水平,提高饲料转化率,并不能完全阻止该病原的感染传播[3-5,22]。是否与菌株间某一个或某一些蛋白的变异存在关系,尚没有详细的报道。鉴于P97、P146等蛋白的作用与特性,提示开展P97、P146等黏附因子的氨基酸序列筛选和研究或许能进一步通过疫苗阻止猪肺炎支原体对气管纤毛的黏附,从而进一步提高疫苗的免疫效果。本研究进一步丰富了猪猪肺炎支原体4个重要功能蛋白的序列资料,首次对湖南省生猪猪肺炎支原体感染菌株遗传变异情况进行了初步调查。
[1] 杜德燕, 方鹏飞, 朱冬梅, 邹智坤, 严成, 郭健宝. 猪支原体肺炎病变对体重的影响[J]. 中国兽医杂志, 2018, 54(6): 60-62.
Du D Y, Fang P F, Zhu D M, Zou Z K, Yan C, Guo J B. Effects of Mycoplasma hyopneumoniae on bodyweight of pigs[J]. Chinese Journal of Veterinary Medicine, 2018,54(6):60-62.
[2] Simionatto S, Marchioro S B, Maes D, Dellagostin O A. Mycoplasma hyopneumoniae: From disease to vaccine development[J].Veterinary Microbiology,2013,165(3/4):234-242. doi:10.1016/j.vetmic.2013.04.019.
[3] Hillen S, Von Berg S, Koehler K, Reinacher M, Willems H, Reiner G. Occurrence and severity of lung lesions in slaughter pigs vaccinated against Mycoplasma hyopneumoniae with different strategies[J].Preventive Veterinary Medicine,2014,113(4):580-588. doi:10.1016/j.prevetmed.2013.12.012.
[4] Villarreal I, Meyns T, Dewulf J, Vranckx K, Calus D, Pasmans F, Haesebrouck F, Maes D. The effect of vaccination on the transmission of Mycoplasma hyopneumoniae in pigs under field conditions[J].Veterinary Journal,2011,188(1):48-52.doi:10.1016/j.tvjl.2010.04.024.
[5] 沈青春, 吴思杰, 范学政, 张广川, 高和义, 宁宜宝. 猪支原体肺炎活疫苗(RM48株)的最小免疫剂量测定及活菌滴度与免疫保护率平行关系试验[J]. 中国兽药杂志, 2014, 48(12): 1-4.
Shen Q C, Wu S J, Fan X Z, Zhang G C, Gao H Y, Ning Y B. The minimum immune dose measure of Mycoplasma hyopneumoniae live vaccine(RM48 strain)and the parallel assay of vaccine CCU titer and potency[J]. Chinese Journal of Veterinary Drug, 2014, 48(12):1-4.
[6] 田瑞雨, 熊祺琰, 刘茂军, 韦艳娜, 武昱孜, 冯志新, 姜平, 邵国青. 猪肺炎支原体抗原定量ELISA检测方法的建立[J]. 中国兽医科学, 2017, 47(4): 471-475. doi: 10.16656/j.issn.1673-4696.2017.04.011.
Tian R Y, Xiong Q Y, Liu M J, Wei Y N, Wu Y Z, Feng Z X, Jiang P, Shao G Q. Development of a quantitative enzyme-linked immunosorbent assay for the detection of Mycoplasma hyopneumoniae[J]. Chinese Veterinary Science, 2017,47(4):471-475.
[7] 沈青春, 王芳, 韩明远, 覃青松, 范学政, 杨汉春, 宁宜宝. 猪肺炎支原体P46基因的原核表达与间接ELISA方法的建立[J]. 畜牧兽医学报, 2012, 43(3): 431-437.
Shen Q C, Wang F, Han M Y, Qin Q S, Fan X Z, Yang H C, Ning Y B. Expression of P46 protein of Mycoplasma hyopneumoniae in Escherichia coli and used for indirect ELISA[J]. Acta Veterinaria et Zootechnica Sinica, 2012,43(3):431-437.
[8] Okamba F R, Arella M, Music N, Jia J J, Gottschalk M, Gagnon C A.Potential use of a recombinant replication-defective adenovirus vector carrying the C-terminal portion of the P97 adhesin protein as a vaccine against Mycoplasma hyopneumoniae in swine[J].Vaccine,2010,28(30):4802-4809.doi:10.1016/j.vaccine.2010.04.089.
[9] Okamba F R, Moreau E, Bouh K, Gagnon C A, Massie B, Arella M.Immune responses induced by replication-defective adenovirus expressing the C-terminal portion of the Mycolasma hyopneumoniae p97 adhesin[J].Clinical and Vaccine Immunology,2007,14(6):767-774.doi:10.1128/CVI.00415-06.
[10] 杜改梅, 刘茂军, 韦艳娜, 甘源, 马庆红, 邵国青. 猪肺炎支原体不同蛋白抗原检测疫苗诱导IgG产生规律的研究[J]. 畜牧兽医学报, 2013, 44(6): 925-930. doi:10.11843/j.issn.0366-6964.2013.06.014.
Du G M, Liu M J, Wei Y N, Gan Y, Ma Q H, Shao G Q. Detection of IgG antibodies regularity induced by vaccine using different Mycoplasma hyopneumoniae antigen proteins[J]. Acta Veterinaria et Zootechnica Sinica, 2013,44(6):925-930.
[11] Bogema D R, Deutscher A T, Woolley L K, Raymond B B, Tacchi J L, Dixon N E, Minion F, Walker M J, Djordjevic S P. Characterization of cleavage events in the multifunctional cilium adhesin Mhp684 (P146) reveals a mechanism by which Mycoplasma hyopneumoniae regulates surface topography[J].mBio,2012,3(2):1-10.doi:10.1128/mBio.00282-11.
[12] Wilton J L, Scarman A L, Walker M J, Djordjevic S P.Reiterated repeat region variability in the ciliary adhesin gene of Mycoplasma hyopneumoniae[J].Microbiology,1998,144(7):1931-1943. doi:10.1099/00221287-144-7-1931.
[13] Minion F C, Adams C, Hsu T.R1 region of P97 mediates adherence of Mycoplasma hyopneumoniae to swine cilia[J].Infection and Immunity,2000,68(5):3056-3060. doi: 10.1128/IAI.68.5.3056-3060.2000.
[14] Caron J, Sawyer N, Moumen B B, Bouh K C, Dea S. Species-specific monoclonal antibodies to Escherichia coli-expressed p36 cytosolic protein of Mycoplasma hyopneumoniae[J].Clinical and Diagnostic Laboratory Immunology,2000,7(4):528-535. doi:10.1128/CDLI.7.4.528-535.2000.
[15] Bouh K S, Shareck F, Dea S. Monoclonal antibodies to Escherichia coli-expressed P46 and P65 membranous proteins for specific immunodetection of Mycoplasma hyopneumoniae in lungs of infected pigs[J].Clinical and Diagnostic Laboratory Immunology,2003,10(3):459-468. doi: 10.1128/CDLI.10.3.459-468.2003.
[16] 彭丽萍, 刘思远, 朱晓萍, 陈珍, 姚昌茹, 赵宝华. 猪肺炎支原体168弱毒株P46-P65融合蛋白的免疫原性[J]. 中国兽医学报, 2017, 37(4): 1005-4545. doi: 10.16303/j.cnki.1005-4545.2017.04.08.
Peng L P, Liu S Y, Zhu X P, Chen Z, Yao C R, Zhao B H. Immunogenicity of P46-P65 fusion protein of avirulent Mycoplasma hyopneumoniae strain 168 in mice[J]. Chinese Journal of Veterinary Science, 2017,37(4):1005-4545.
[17] Feng Z X, Bai Y, Yao J T, Pharr G, Xiao S B, Chi L Z, Gan Y A, Wang H Y, Wei Y N, Liu M J, Xiong Q Y, Bai F F, Li B, Wu X S, Shao G Q. Use of serological and mucosal immune responses to Mycoplasma hyopneumoniae antigens P97R1, P46 and P36 in the diagnosis of infection[J].Veterinary Journal,2014,202(1):128-133.doi:10.1016/j.tvjl.2014.06.019.
[18] Mebus C A, Underdahl N R. Scanning electron microscopy of trachea and bronchi from gnotobiotic pigs inoculated with Mycoplasma hyopneumoniae[J].American Journal of Veterinary Research,1977,38(8):1249-1254. doi: 10.2754/avb197847030203.
[19] Ferreira H B, De Castro L A.A preliminary survey of M.hyopneumoniae virulence factors based on comparative genomic analysis[J].Genetics and Molecular Biology,2007,30(1, S):245-255.doi:10.1590/S1415-47572007000200012.
[20] 王凯, 杨青春, 陈绍红, 刘艳芬, 刘铀. 猪肺炎支原体P97基因重组腺病毒的构建及其免疫原性[J]. 中国兽医科学, 2015, 45(11): 1114-1121.
Wang K, Yang Q C, Chen S H, Liu Y F, Liu Y. Construction and immunogenicity of the recombinant adenovirus containing P97 gene of Mycoplasma hyopeumoniae[J]. Chinese Veterinary Science, 2015,45(11):1114-1121.
[21] Zhang Q J, Young T F, Ross R F. Identification and Characterization of a Mycoplasma hyopneumoniae Adhesin[J].Infection and Immunity,1995,63(3):1013-1019. doi: 10.1016/0162-3109(94)00058-N.
[22] Zimmerman J J, Karriker L A, Ramirez A, Schwartz A, Stevenson G W. 猪病学[M]. 10版. 北京: 中国农业大学出版社, 2014:826.
Zimmerman J J, Karriker L A, Ramirez A, Schwartz A, Stevenson G W. Diseases of swine[M]. 10th ed. Beijing: China Agricultural University Press,2014:826.
[23] Razin S. Adherence of pathogenic mycoplasmas to host cells[J].Bioscience Reports,1999,19(5):367-372.doi:10.1023/A:1020204020545.
[24] Michiels A, Vranckx K, Piepers S A, Arsenakis I, Boyen F A, Maes D.Impact of diversity of Mycoplasma hyopneumoniae strains on lung lesions in slaughter pigs[J].Veterinary Research,2017,48(1):2.doi:10.1186/s13567-016-0408-z.
[25] Liu W, Xiao S, Li M, Guo S, Li S, Luo R, Feng Z, Li B, Zhou Z, Shao G, Chen H, Fang L. Comparative genomic analyses of Mycoplasma hyopneumoniae pathogenic 168 strain and its high-passaged attenuated strain[J].BMC Genomics,2013,14:80. doi:10.1186/1471-2164-14-80.
[26] Vasconcelos A R, Ferreira H B, Bizarro C V, Bonatto S L, Carvalho M O, Pinto P M. Swine and poultry pathogens: the complete genome sequences of two strains of Mycoplasma hyopneumoniae and a strain of Mycoplasma synoviae[J].Journal of Bacteriology,2005,187(16):5568-5577. doi: 10.1128/JB.187.16.5568-5577.2005.
[27] 车艳杰, 王勇鶼, 柳舒航, 王贵华. 我国市场上猪支原体肺炎疫苗现状及应用效果[J]. 中国兽药杂志, 2014, 48(12): 61-65.
Che Y J, Wang Y J, Liu S H, Wang G H. The situation and application of swine Mycoplasma pneumonia vaccine in domestic market[J]. Chinese Journal of Veterinary Drug, 2014,48(12):61-65.
[28] 武昱孜, 邢宪平, 韦艳娜, 熊祺琰, 冯志新, 邵国青. 不同猪支原体肺炎活疫苗菌株P46和P97基因序列差异性分析[J]. 畜牧兽医学报, 2017, 48(12): 2365-2373. doi: 10.11843/j.issn.0366-6964.2017.12.016.
Wu Y Z, Xing X P, Wei Y N, Xiong Q Y, Feng Z X, Shao G Q. Comparison of nucleotide and deduced amino acid sequences of P46 and P97 for the different live vaccine strains of Mycoplasmal pneumonia of swine[J]. Acta Veterinaria et Zootechnica Sinica, 2017,48(12):2365-2373.
[29] Marchioro S B, Maes D, Flahou B A, Sacristan R D, Vranckx K A, Cox E, Wuyts N, Haesebrouck F. Local and systemic immune responses in pigs intramuscularly injected with an inactivated Mycoplasma hyopneumoniae vaccine[J].Vaccine,2013,31(9):1305-1311. doi:10.1016/j.vaccine.2012.12.068.
[30] Martelli P, Saleri R, Cavalli V, De Angelis E, Benetti M, Ferrarini G, Merialdi G.Systemic and local immune response in pigs intradermally and intramuscularly injected with inactivated Mycoplasma hyopneumoniae vaccines[J].Veterinary Microbiology,2014,168(2/4):357-364. doi:10.1016/j.vetmic.2013.11.025.