辣椒(Capsicum annuum L.)为茄科辣椒属,属于我国设施蔬菜主栽作物之一[1]。氮肥的施用是限制植物生长的重要因素,不合理施用氮会降低肥料利用率,并使残留氮素向下迁移,引发地下水污染,造成环境污染[2-3]。15N示踪技术是研究土壤-作物体系中氮素迁移、分配的重要方法,通过研究不同水氮处理下蔬菜对氮素吸收、利用及氮素去向可为田间管理提供理论依据,并揭示氮素的来源与去向途径[4-6]。
水分不足或过量均可抑制蔬菜正常生长,降低氮肥利用率[7]。向友珍[8]研究了滴灌施肥对甜椒水氮耦合效应的影响,结果表明,适当协调灌水与氮肥施用量会对甜椒正常的生长发育起促进作用,且可提高水分利用率。所以,合理地协调水、氮供应在农业生产中显得尤其重要。吕剑[9]在研究日光温室基质栽培番茄中发现60%~70%下限的灌水更有利于植株生物量的积累,而80%的灌水条件下会增加辣椒植株徒长速率。由于水分作为氮素运移的载体,氮素的淋失量与灌水量有密切关系,所以合理控制灌水量能够有效降低番茄在盛果期的氮素流失量[10]。于红梅等[11]在研究不同水氮管理对蔬菜地硝态氮淋洗中表明,控制灌水可以减少水分漏渗量,当土壤含水量在50%~80%,NO3--N的淋洗量较弱。邢英英等[12]、孙杨[13]、史书强等[14]研究表明,土壤含水量较高会引起土壤盐渍化,栽培基质中含水量与水分运移规律对基质中盐分的分布规律有密切关系:蒸腾及基质表层蒸发等共同作用可引起土壤盐分向上迁移。柴付军等[15]研究表明,对于含盐较低的土壤中,高频滴灌和低频滴灌对棉花产量没有显著差异。前人关于水氮互作的研究,大多是以露地栽培蔬菜为研究对象,而露地种植有许多不可控的环境因素。目前,利用同位素示踪技术研究不同灌水条件对日光温室氮素迁移和分配特性的影响鲜见报道。本试验在日光温室条件下,以基质栽培辣椒为研究对象,采用 15N同位素示踪技术研究2种不同灌水下限条件下,基质中氮素运移积累规律、氮素的吸收利用及其在辣椒各器官中的分配特性,为日光温室辣椒基质栽培水肥精准管理提供理论依据。
1 材料和方法
1.1 试验材料
试验材料是由甘肃省农科院蔬菜研究所选育的 陇椒10号(甘肃省设施辣椒主栽品种)。供试肥料有硝酸钾(K2O 46.3%)、过磷酸钙(P2O5 12%)、尿素(N 46%)以及由上海化工研究院提供的丰度为50.30%的K15NO3。栽培基质中草炭、蛭石、育苗基质(体积比)=1∶1∶2。栽培基质理化性状见表1。
表1 基质理化性状
Tab.1 Substrate physicochemical properties

容重/(g/cm3)Bulk density全氮量/(mg/kg)Total N碱解氮/(mg/kg)Available N速效磷/(mg/kg)Available P速效钾/(mg/kg)Available KpH(H2O)EC/(ms/cm)0.231 638.00462.00126.60654.006.291.72
1.2 试验方案
1.2.1 试验设计 2017年3-9月,本试验于甘肃农业大学日光温室进行,在处理后第90 天拉秧并开始测定指标。试验设2因子2水平:灌水量分别为田间持水量的60%,80%;从栽培基质表面向下5~10 cm或15~20 cm深处标记15N。灌溉方式采用膜下滴灌,由水表控制灌水量。试验设4个处理,处理组合见表2。
表2 试验处理方案
Tab.2 Experimental treatment

处理编号Treatment code试验处理TreatmentsW60F5灌水下限是田间持水量的60%,K15NO3标记于栽培槽5~10 cm处W60F15灌水下限是田间持水量的60%,K15NO3标记于栽培槽15~20 cm处W80F5灌水下限是田间持水量的80%,K15NO3标记于栽培槽5~10 cm处W80F15灌水下限是田间持水量的80%,K15NO3标记于栽培槽15~20 cm处
1.2.2 15N标记方式与栽培槽设置 试验采用槽式栽培,栽培槽大小为4 m×0.48 m×0.30 m(长×宽×高),在槽底铺衬1层有出水孔的塑料薄膜(图1)。每槽基质用量为0.5 m3,装填高度为25 cm,标记时将15.2 g外源 K15NO3(15N 1 060 mg,标记氮占总施氮量的1.7%)与相应层次基质混合均匀后填入栽培槽(图1)。采用膜下滴灌灌溉,每3槽(3个重复)为一个小区,每小区面积为3×3.84 m×0.48 m=5.53 m2,选择生长健壮且大小一致的辣椒苗双行定植,每小区共定植辣椒42株。
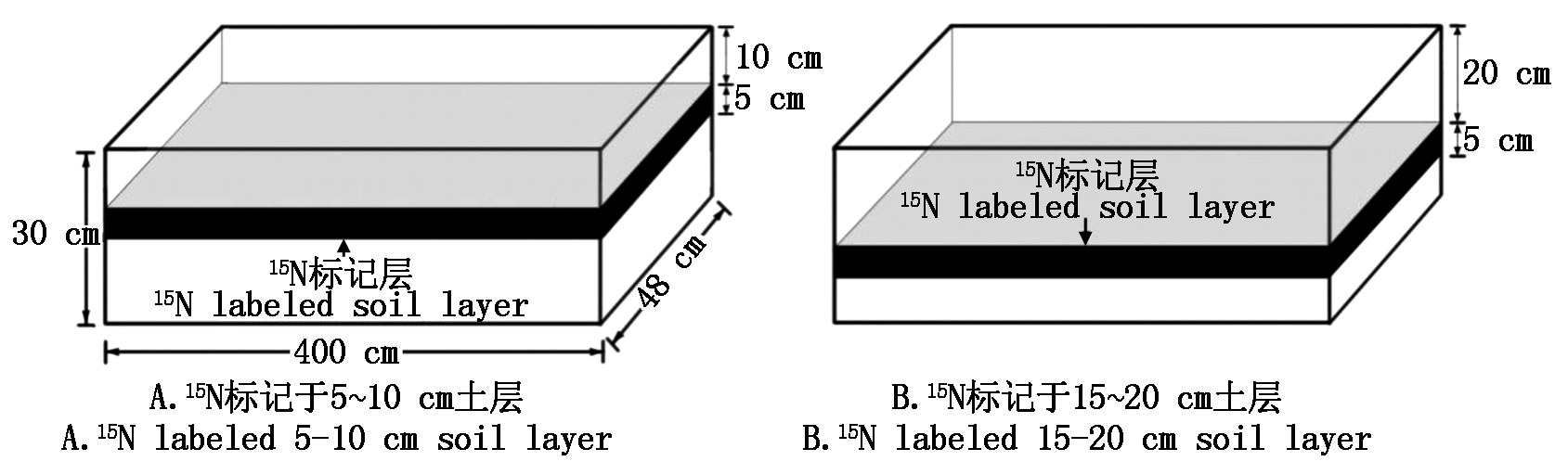
图1 15N标记与栽培槽示意图
Fig.1 15N marking and cultivation trough schematic
1.2.3 施肥与田间管理 目标产量为7.5 kg/m2,按当地农肥施用量每生产1 000 kg辣椒需吸收纯N 4.8 kg,P2O5 0.9 kg,K2O5 4 kg(即N∶P2O5∶K2O=1∶0.2∶1.2)[16]。磷肥作基肥一次性施入,钾肥与氮肥作基肥施入一次,然后分别在辣椒1、2、4穗果膨大期随水施入。试验通过烘干法来监测基质水分动态含量变化[9,17]。当基质水分含量降至灌水下限时,可通过公式M= r×p×s×h×θf ×(q1-q2)/η,将其补充至灌溉上限。各小区灌水量具体见表3。
式中:M. 灌水量,m3;r.基质容重,0.23 g/cm3;p.基质湿润比,取85%;s.灌水面积,5.53 m2;h.灌水计划层,0.25 m;θf.田间持水量,105%;q1.灌水相对田间持水量上限,100%;q2.灌水相对田间持水量下限,80%,60%;η.水分利用系数,100%。
表3 处理组灌水量
Tab.3 Irrigation volume of treatment group

处理Treatment小区每次灌水量/m3The amount of water per district每次总灌水量/(m3/hm2)Total irrigation amount平均间隔天数/dAverage interval daysW600.08139.007~8W800.0356.103~4
1.3 样品测定
1.3.1 植株样品采集 于2017年9月7日(处理90 d)采集样品,各处理分别采集9株,将其分为根、茎、叶、果实,把植株洗净并做好标记。将植株各器官于105 ℃作杀青处理30 min,80 ℃烘干至恒质量,然后称其地上部干质量。再取辣椒各器官干样品进行粉碎、研磨,用于植株各器官的全氮和15N丰度的测定。
1.3.2 基质样品采集 植株和基质样品同时采集。基质分4层(每5 cm为一层)取样,相同层面随机选取4个采集点,将各个重复的4个层面的基质样品分别装入自封袋,最后将样品带回实验室自然风干后过80 mm筛备用。通过MAT253质谱仪 (杨凌启翔生物科技有限公司测定) 测定基质和植株样品的15N丰度;采用 K1100全自动凯氏定氮仪测定全氮含量。
1.4 计算公式[9,18]
基质15N残留量=基质全氮15N原子百分超×基质各层全氮含量;15N的吸收量=植株吸氮量×植株15N丰度;15N的利用率= 15N的吸收量/标记氮带入15N的量×100%。
1.5 数据处理
应用SPSS 19.0、Origin 8.5和Excel 2010等软件进行数据分析与统计。
2 结果与分析
2.1 不同处理下辣椒植株生物量及吸氮量
如表4所示,相同灌水条件下,植株总生物量随着15N标记深度的加深呈下降趋势。60%的灌水下限植株总生物量比80%的灌水下限显著增高了72.3%(5~10 cm),82.4%(10~15 cm),平均高77.4%。
由表5可得,W80F15处理植株总氮含量比W60F15处理降低了36.0%,W80F5处理植株的总氮含量较W60F5处理下降了41.3%。处理W80F5中辣椒果实含氮量随着标记深度的加深,较W80F15处理显著增加了83.3%;在W60F5处理下,辣椒茎、叶、果实中的氮素含量较处理W60F15分别增加了22.2%,22.0%,35.7%。由此表明,同一灌水条件下基质层5~10 cm处的氮素可促进辣椒植株的吸收与利用。辣椒茎、叶、果中氮素含量最高的处理均是W60F5。不同处理下辣椒植株各器官的含氮量为茎<果<叶。
表4 辣椒不同处理地上部分的生物量
Tab.4 Above group biomass of pepper affected by different treatments g/株

处理Treatments茎Stem叶Leaf果实Fruit总生物量Total biomassW60F537.3±0.33a30.6±0.34a31.5±0.59a99.38±0.47aW60F1530.0±0.32b28.4±0.15b25.2±0.47b83.48±0.17bW80F516.2±0.20c21.9±0.23c19.5±0.68c57.68±0.87cW80F1516.3±0.41c19.2±0.12d10.3±0.45d45.76±0.86d
注:同列中不同字母表示差异达0.05显著水平。表5-7同。
Note: Different letters in the same column indicate significant difference at 0.05 level. The same as Tab.5-7.
表5 不同处理辣椒地上部含氮量
Tab.5 Different treatment of nitrogen content in the upper part of pepper g/株
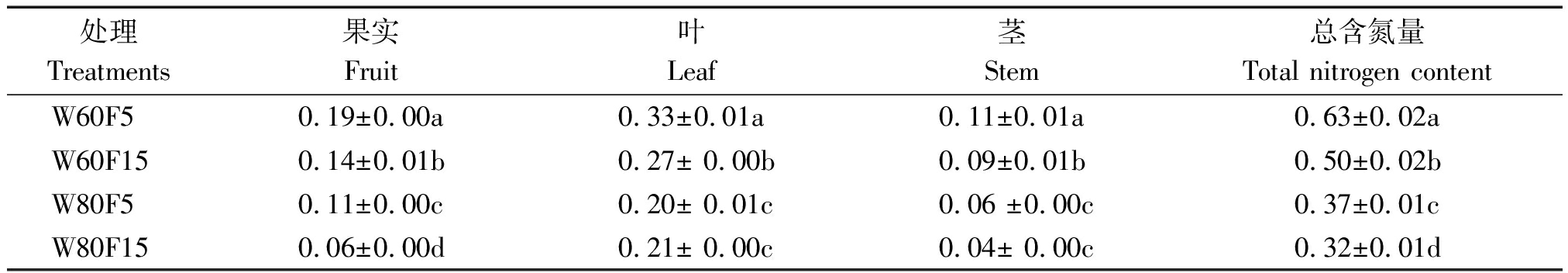
处理Treatments果实Fruit叶Leaf茎Stem总含氮量Total nitrogen contentW60F50.19±0.00a0.33±0.01a0.11±0.01a0.63±0.02aW60F150.14±0.01b0.27± 0.00b0.09±0.01b0.50±0.02bW80F50.11±0.00c0.20± 0.01c0.06 ±0.00c0.37±0.01cW80F150.06±0.00d0.21± 0.00c0.04± 0.00c0.32±0.01d
2.2 辣椒植株对不同标记深度的15N的吸收和利用
如表6所示,同一灌水下限条件下,茎、果及植株总15N吸收量和利用率随着15N标记深度从5~10 cm下降到15~20 cm,均显著下降,而叶片中15N的吸收量和利用率与之相反。在W60F15处理下,辣椒各器官对15N总利用率较W80F15处理显著增加了2.66百分点;W60F5处理下,辣椒植株15N总利用率较W80F5处理显著增加了2.52百分点,植株总15N的吸收量与利用率在W80F5处理下较W80F15显著增加了49.3%和0.86百分点;W60F5植株所吸收的15N总量较W60F15处理显著增加了17.7%。W60F5处理下,辣椒15N利用率最高,为5.44%。基质中15N随着较高灌水(80%灌水下限)下渗,加大其淋失量,从而减小植株吸收利用率。
表6 辣椒对不同基质深度标记15N的吸收量和利用率
Tab.6 Uptake and utilization rate of 15N by pepper from different substrate layers
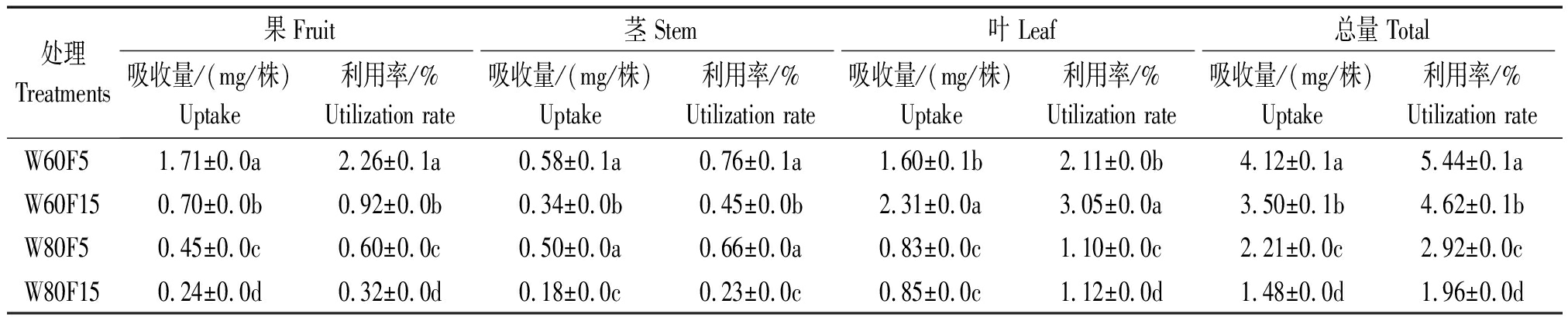
处理Treatments果Fruit茎 Stem叶 Leaf总量 Total吸收量/(mg/株)Uptake 利用率/%Utilization rate吸收量/(mg/株)Uptake利用率/%Utilization rate吸收量/(mg/株)Uptake利用率/%Utilization rate吸收量/(mg/株)Uptake利用率/%Utilization rate W60F51.71±0.0a2.26±0.1a0.58±0.1a0.76±0.1a1.60±0.1b 2.11±0.0b 4.12±0.1a5.44±0.1aW60F150.70±0.0b0.92±0.0b0.34±0.0b0.45±0.0b2.31±0.0a 3.05±0.0a 3.50±0.1b4.62±0.1bW80F50.45±0.0c0.60±0.0c0.50±0.0a 0.66±0.0a 0.83±0.0c 1.10±0.0c 2.21±0.0c2.92±0.0cW80F150.24±0.0d0.32±0.0d0.18±0.0c0.23±0.0c0.85±0.0c 1.12±0.0d 1.48±0.0d1.96±0.0d
2.3 基质中15N含量的累积与损失
由表7得知,15N的回收量是植株中15N的量加0~20 cm基质层中存留15N的量;15N损失量等于标记K15NO3带入15N的量减去15N的回收量。在灌水下限为60%(W60)的条件下,基质中15N的累积量随着15N标记深度的加深,显著降低了19.0%;灌水下限为80%(W80)的处理下,基质中15N的积累量变化随着15N标记层的加深没有显著差异。分析15N总回收量得知,W60F5处理下15N回收量较W80F5处理显著增加了23.8%;W60F15处理15N总回收量较W80F15显著增高了11.5%。就15N的损失率得知,W80F5处理15N损失率为29.42%,较W80F15减少了7.12百分点;W60F5较W60F15处理15N的损失率显著减少了16.38百分点; 15N标记层于5~10 cm处,W60F5处理15N损失率较W80F5显著减少了16.79百分点;当15N标记层于15~20 cm处,W60F15处理15N损失率较W80F15显著减少7.53百分点。
表7 辣椒0~20 cm基质层中15N的回收与损失情况
Tab.7 Recovery and loss of 15N in the 0-20 cm substrate layer

处理Treatments累积量/(g/m3)Accumulation 损失量/(g/m3)Loss 总回收量/(g/m3)Recovery损失率/%Loss rateW60F52.35±0.08a0.36±0.09c2.50±0.08a 12.63±2.94cW60F151.90±0.02b0.83±0.02b2.03±0.03b29.01±0.88bW80F51.94±0.04b0.84±0.04ab2.02±0.04bc 29.42±1.43abW80F151.76±0.02b1.05±0.02a 1.82±0.02c36.54±0.75a
注:15.2 g K15NO3中含有15N 1 060 mg。
Note:15.2 g K15NO3 contains 15N 1 060 mg.
2.4 不同基质层15N的迁移与分布
由图2得知, W60F5处理15N的积累量在10~15 cm处显著高于其他任一层面;W80F5处理下,标记层氮素向上与向下迁移的量没有显著差异。W60F15、W80F15处理在基质层0~20 cm处积累的15N分别![]() 总量的66.4%,61.5%,在15~20 cm处存留的15N分别占标记氮总量的17.6%,16.1%。在W60F15处理下,基质10~15 cm处的15N 积累量显著高于其他层;W80F15处理,在基层质15~20 cm处,15N 积累量显著高于其他层面。由此说明,标记层在15~20 cm处,80%灌水下限氮素向上迁移量小于60%灌水下限。
总量的66.4%,61.5%,在15~20 cm处存留的15N分别占标记氮总量的17.6%,16.1%。在W60F15处理下,基质10~15 cm处的15N 积累量显著高于其他层;W80F15处理,在基层质15~20 cm处,15N 积累量显著高于其他层面。由此说明,标记层在15~20 cm处,80%灌水下限氮素向上迁移量小于60%灌水下限。
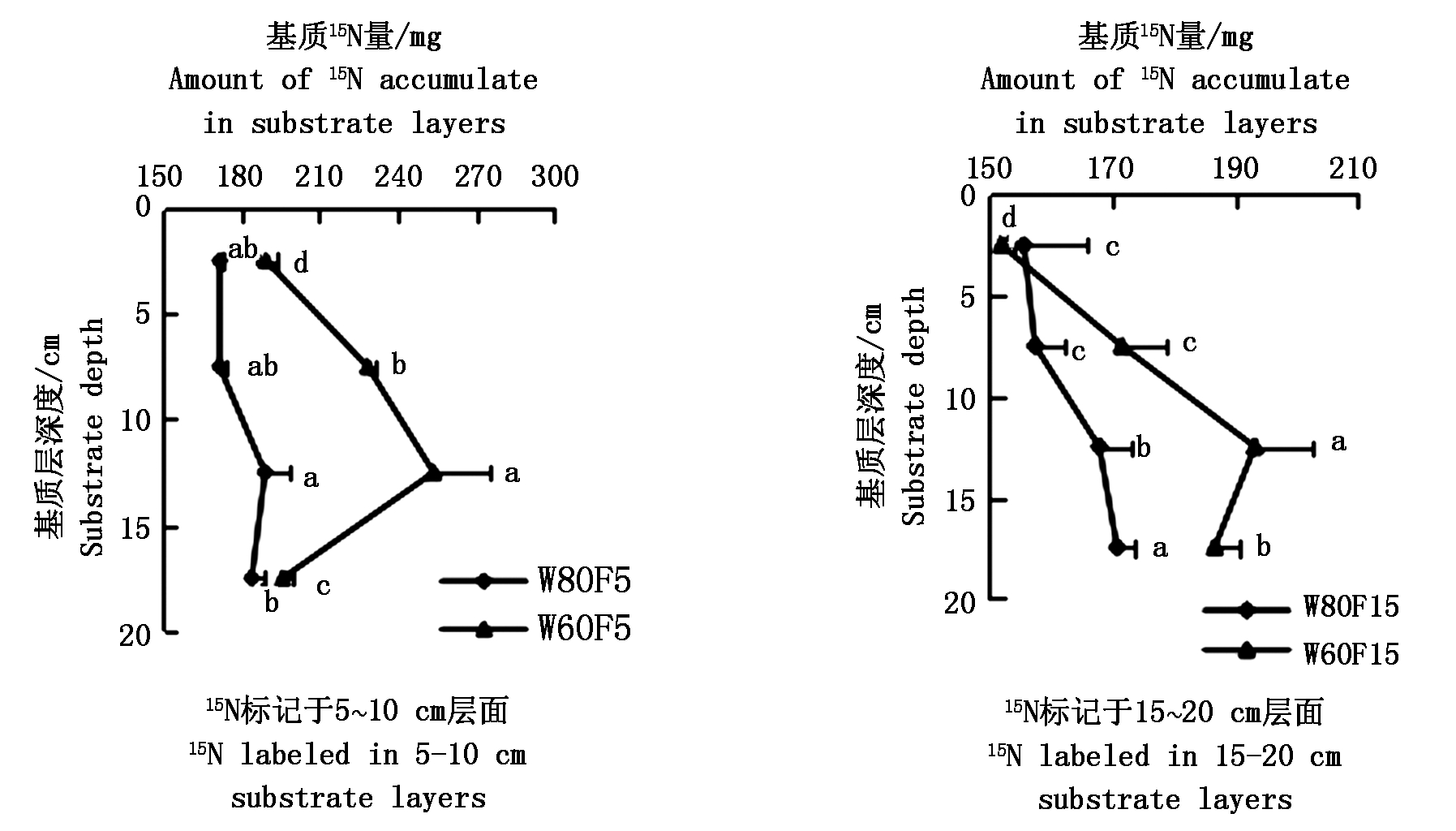
同一折线中不同字母代表差异达5%显著水平。
Different letters in the same line indicate significant difference at 5% level.
图2 各基质层中15N的累积分布
Fig.2 Accumulation and distribution of 15N in various matrix layers
3 结论与讨论
高水氮处理促进了植株的营养生长,抑制植株生殖生长[18]。合理的灌溉与施氮可以改变植物根系的生长与分布,促使根系对水氮的吸收从而提高地上部生物量的积累[19]。龚江等[4]通过研究膜下滴灌水氮耦合对棉花生长的影响,结果表明,膜下滴灌对棉花干物质的积累影响较大,而施氮量对干物质的影响较小,在棉花整个生育期施氮对棉花的影响作用小于灌水作用。张振贤等[20]认为,在大白菜的莲座期,灌水下限为40%~80%,叶面积及干质量都随灌水下限的提高呈递增趋势,大于 80%则稍有下降。本试验结果表明,随着灌水下限的下降,植株总生物量呈增大趋势,与吕剑等[9,21]的研究结果相一致。辣椒植株的含氮量与植株总生物量的变化趋势基本一致。张永丽等[22]研究结果表明,适当提高灌水量,有利于植株对氮素的吸收与利用,但过高的灌水会导致氮素利用率下降。正如本试验结果,60%的灌水下限更有利于植株对氮素的吸收。不同灌水处理对小麦各器官氮素的运移分配影响不尽相同。本试验利用15N标记法研究植株各器氮素吸收情况,结果表明,不同灌水下限与15N标记层次对植株各器官15N的吸收量依次表现为叶>果>茎。董雯怡等[23]通过研究毛白杨对15N 标记铵态氮和硝态氮的吸收能力,结果表明,氮素在毛白杨器官中的分配量差异显著,含量多少依次为茎<根<叶,且叶片的数量和生物量积累最多,说明叶的光合作用强从而导致其对15N吸收最高。与本试验研究结果有差异,原因可能与基质灌水下限及测定的时间有关,不同灌水下限会影响根毛的数量与质量,结果盛期辣椒需要较多氮素供其生殖生长,所以果实的氮含量高于茎、根。气候和田间管理等因素会影响氮素的分布与损失情况,左红娟[24]通过对肥料氮利用与去向研究表明,土壤中氮肥损失率为11.3%~48.3%,正如本研究所示,在灌水下限为60%的条件下,在标记层5~10 cm处,15N损失率为12.63%,当标记层为15~20 cm时,15N损失率为29.01%;在80%灌水下限下,W80F5与W80F15处理15N的损失率分别为29.42%,36.54%。本研究与王春辉等[2]研究结果一致。董雯怡等[23]采用15N示踪法研究毛白杨苗木对氮素的吸收及分配,结果发现,0~40 cm土层中土壤残留氮占残留氮总量的60.3%~76.5%。左红娟[24]研究发现,随土层深度的加深,标记氮在土壤中的残留率显著下降。试验研究结果显示,60%的灌水下限减弱了水分向深层的运移量,从而增大15~20cm处15N的损失率。
各处理辣椒植株各器官的全氮含量大小依次为叶>果>茎。辣椒植株对15N利用率表现为W60F5>W60F15>W80F5>W80F15。灌水下限60%或80%时,随着15N标记层的下降,15N在基质层中的残留量逐渐下降,损失率显著增高。W60F5更有利于植株对氮素吸收与利用。
[1] 马艳青. 我国辣椒产业形势分析[J]. 辣椒杂志, 2011(1): 1-5. doi:10.3969/j.issn.1672-4542.2011.01.001.
Ma Y Q. Analysis of chili pepper industry situation in China[J]. Journal of China Capsicum, 2011(1):1-5.
[2] 王春辉, 祝鹏飞, 束良佐,朱继荣,于红梅,詹雨珊,袁梅.分根区交替灌溉和氮形态影响土壤硝态氮的迁移利用[J]. 农业工程学报, 2014, 30(11): 1002-6819. doi: 10.3969/j.issn.1002-6819.2014.11.012.
Wang C H, Zhu P F, Shu L Z, Zhu J R, Yu H M, Zhan Y S,Yuan M. Effects of alternate partial root-zone irrigation and nitrogen forms on utilization and movement of nitrate in soil[J]. Journal of Agricultural Engineering, 2014, 30(11):1002-6819.
[3] 吴永成, 王志敏, 周顺利. 15N标记和土柱模拟的夏玉米氮肥利用特性研究[J]. 中国农业科学, 2011, 44(12): 2446-2453. doi: 10.3864/j.issn.0578-1752.2011.12.005.
Wu Y C, Wang Z M, Zhou S L. Studies on the characteristics of nitrogen fertilizer utilization in summer maize based on techniques of soil column and 15N-label[J]. Scientia Agricultural Sinica, 2011,44(12):2446-2453.
[4] 龚江, 王海江, 谢海霞, 侯振安, 吕新. 膜下滴灌水氮耦合对棉花生长和产量的影响[J]. 灌溉排水学报, 2008, 59(6): 51-54.
Gong J, Wang H J, Xie H X, Hou Z A, Lü X. Effects of water and nitrogen coupling under drip irrigation on cotton growth and yield[J]. Journal of Irrigation and Drainage, 2008,59(6):51-54.
[5] 文哲. 15N同位素稀释技术和示踪技术在森林土壤N素研究中的应用[J]. 南方农业, 2016, 10(30): 102-103. doi: 10.19415/j.cnki.1673-890x.2016.30.059.
Wen Z. Application of 15N isotope dilution technique and tracer technology in N soil research of forest soil[J]. South China Agriculture, 2016, 10(30): 102-103.
[6] 刘琦蕊. 毛竹林氮素吸收转化与利用研究[D]. 北京:中国林业科学研究院, 2016.
Liu Q R. Study on nitrogen absorption, transformation and utilization of Phyllostachys pubescens[D]. Beijing: Chinese Academy of Forestry, 2016.
[7] 田义, 张玉龙, 虞娜, 张辉, 邹洪涛. 温室地下滴灌灌水控制下限对番茄生长发育、果实品质和产量的影响[J]. 干旱地区农业研究, 2006, 24(5): 88-92. doi:10.3321/j.issn:1000-7601.2006.05.021.
Tian Y, Zhang Y L, Yu N, Zhang H, Zou H T. Effect of different low irrigation limit on growth, quality and yield of tomato under subsurface drip irrigation in greenhouse[J]. Agricultural Research in the Arid Areas, 2006,24(5):88-92.
[8] 向友珍. 滴灌施肥条件下温室甜椒水氮耦合效应研究[D]. 杨凌: 西北农林科技大学, 2017.
Xiang Y Z. Study on the coupling effect of water and nitrogen in greenhouse sweet pepper under drip fertigation conditions[D].Yangling: Northwest A&F University, 2017.
[9] 吕剑. 日光温室基质栽培越冬茬番茄灌水下限研究[D]. 兰州: 甘肃农业大学, 2012.
Lü J. Study on the lower limit of tomato irrigation for wintering in the greenhouse cultivation[D].Lanzhou: Gansu Agricultural University, 2012.
[10] 刘世全, 曹红霞, 张建青, 胡笑涛. 不同水氮供应对小南瓜根系生长、产量和水氮利用效率的影响[J]. 中国农业科学, 2014, 47(7): 1362-1371. doi:10.3864/j.issn.0578-1752.2014.07.013.
Liu S Q, Cao H X, Zhang J Q, Hu X T. Effects of different water and nitrogen supplies on root growth, yield and water and nitrogen use efficiency of small pumpkin[J]. Scientia Agricultura Sinica, 2014,47(7):1362-1371.
[11] 于红梅, 李子忠, 龚元石. 不同水氮管理对蔬菜地硝态氮淋洗的影响[J]. 中国农业科学, 2005, 38(9): 1849-1855. doi:10.3321/j.issn:0578-1752.2005.09.020.
Yu H M, Li Z Z, Gong Y D. Leached nitrate in vegetable field under different water and nitrogen fertilizer management practices[J]. Scientia Agricultura Sinica, 2005, 38(9):1849-1855.
[12] 邢英英, 张富仓, 张燕, 李静, 强生才, 吴立峰. 滴灌施肥水肥耦合对温室番茄产量、品质和水氮利用的影响[J]. 中国农业科学, 2015, 48(4): 713-726. doi:10.3864/j.issn.0578-1752.2015.04.09.
Xing Y Y, Zhang F C, Zhang Y, Li J, Qiang S C, Wu L F. Effect of irrigation and fertilizer coupling on greenhouse tomato yield, quality, water and nitrogen utilization under fertigation[J]. Scientia Agricultura Sinica, 2015,48(4):713-726.
[13] 孙杨. 滴灌条件下大同盆地盐碱地土壤水盐运移规律研究[D]. 太原: 太原理工大学, 2016.
Sun Y. Study on soil water and salt movement law of saline-alkali land in datong basin under drip irrigation[D].Taiyuan: Taiyuan University of Technology, 2016.
[14] 史书强, 赵颖, 何志刚, 娄春荣. 生物有机肥配施化肥对马铃薯土壤养分运移及产量的影响[J]. 江苏农业科学, 2016, 44(6): 154-157. doi: 10.15889/j.issn.1002-1302.2016.06.040.
Shi S Q, Zhao Y, He Z G, Lou C R. Effects of bio-organic fertilizer combined with chemical fertilizer on soil nutrient transport and yield of potato[J]. Jiangsu Agricultural Sciences, 2016,44(6):154-157.
[15] 柴付军, 李光永, 张琼, 程鸿, 李富先, 李旌胜, 季枫. 灌水频率对膜下滴灌土壤水盐分布和棉花生长的影响研究[J]. 灌溉排水学报, 2005, 24(3): 12-15. doi:10.3969/j.issn.1672-3317.2005.03.004.
Chai F J, Li G Y, Zhang Q, Cheng H, Li F X, Li J S, Ji F. Study on effects of irrigation frequency on moisture and salt regime and growth of cotton under mulch-film drip irrigation[J]. Journal of Irrigation and Drainage, 2005,24(3):12-15.
[16] 王翠丽. 不同施肥方式对辣椒生长生理和养分利用的影响[D]. 兰州: 甘肃农业大学, 2017.
Wang C L. Effects of different fertilization methods on growth physiology and nutrient utilization of pepper[D].Lanzhou: Gansu Agricultural University, 2017.
[17] 高方胜, 徐坤, 徐立功, 尚庆文. 土壤水分对番茄生长发育及产量品质的影响[J]. 西北农业学报, 2005, 14(4): 69-72. doi:10.3969/j.issn.1004-1389.2005.04.017.
Gao F S, Xu K, Xu L G, Shang Q W. Effect of soil water on the growth, development, yield and quality of tomato[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2005,14(4):69-72.
[18] 王少杰. 黄土高原旱作覆膜玉米不同时期施氮效果及气态氮损失[D].北京:中国科学院研究生院, 2016.
Wang S J. Nitrogen application effect and gaseous nitrogen loss in different periods of dry-mulched corn in the Loess Plateau[D]. Beijing: Graduate University of Chinese Academy of Sciences, 2016.
[19] 马耕, 张盼盼, 王晨阳, 刘卫星, 张美微, 马冬云, 谢迎新, 朱云集, 郭天财. 高产小麦花后植株氮素累积、转运和产量的水氮调控效应[J]. 麦类作物学报, 2015, 35(6): 798-805. doi:10.7606/j.issn.1009-1041.2015.06.10.
Ma G, Zhang P P, Wang C Y, Liu W X, Zhang M W, Ma D Y, Xie Y X, Zhu Y J, Guo T C. Regulation effect of irrigation and nitrogen on post-anthesis nitrogen accumulation, translocation and grain yield of high-yield wheat[J]. Journal of Triticeae Crops, 2015,35(6):798-805.
[20] 张振贤, 于贤昌, 陈利平, 史金玉, 梁书华. 水分状况与大白菜光合作用关系的研究[J]. 园艺学报, 1993(4): 358-362.
Zhang Z X, Yu X C, Chen L P, Shi J Y, Liang S H. Study on the relationship between water status and photosynthesis of Chinese cabbage[J]. ACTA Horticulturae Sinica, 1993(4): 358-362.
[21] 马国礼. 不同水氮处理对日光温室基质栽培辣椒生长生理及养分吸收分配的影响[D]. 兰州: 甘肃农业大学, 2017.
Ma G L. Effects of different water and nitrogen treatments on growth physiology and nutrient uptake and distribution of pepper in substrate culture in greenhouse[D].Lanzhou: Gansu Agricultural University, 2017.
[22] 张永丽, 于振文. 灌水量对小麦氮素吸收、分配、利用及产量与品质的影响[J]. 作物学报, 2008, 34(5): 870-878. doi:10.3321/j.issn:0496-3490.2008.05.021.
Zhang Y L, Yu Z W. Effects of irrigation amount on nitrogen uptake, distribution, use, and grain yield and quality in wheat[J]. Acta Agronomica Sinica, 2008,34(5):870-878.
[23] 董雯怡, 聂立水, 李吉跃, 沈应柏, 张志毅. 应用15N示踪研究毛白杨苗木对不同形态氮素的吸收及分配[J]. 北京林业大学学报, 2009, 31(4): 97-101. doi:10.3321/j.issn:1000-1522.2009.04.017.
Dong W Y, Nie L S, Li J Y, Shen Y B, Zhang Z Y. Effects of nitrogen forms on the absorption and distribution of nitrogen in Populus tomentosa seedlings using the technique of 15N tracing[J]. Journal of Beijing Forestry University, 2009, 31(4):97-101.
[24] 左红娟. 基于高丰度15N的肥料氮去向及利用率研究[D]. 北京:中国农业科学院, 2012.
Zuo H J. Study on the fattening and utilization of fertilizer based on high abundance of 15N[D]. Beijinng: Chinese Academy of Agricultural Sciences, 2012.