干旱缺水是影响农业生产力提高的重要因素。水稻是广东省种植面积最大的作物,也是需水最多的作物,其需水量约占广东农业用水量的65%~70%。实行节水栽培,提高植株的用水效率和对适度水分胁迫的适应性将是广东今后发展水稻生产的必然选择。
局部根系水分胁迫(Partial root-zone drying,简称PRD)作为一种新近发展起来的节水灌溉技术方法,正逐渐受到研究者的关注[1]。局部根系水分胁迫下,非胁迫一侧的根系仍然能够吸收水分、养分,而胁迫侧根系则通过产生水分胁迫响应信号(如ABA、pH) 并经木质部传输到地上部分,调节叶片气孔开度,减少奢侈的蒸腾耗水[2],提高水分利用效率(简称WUE)[3-7]。在葡萄、果树、玉米等作物上进行的分根试验结果表明,只给一半根区土壤供水就可以使幼苗保持正常生长,显著提高用水效率[3-5,8]。然而, 作物WUE的高低除与供水量和供水方式有关外,还与肥料的种类、施用量和施肥方式等密切相关[9]。因此,有必要开展局部根系水分胁迫下作物对水肥耦合效应的响应研究。
氮是植物生长发育不可缺少的营养元素。许多研究表明,氮肥供应可以减小干旱胁迫对植物生长的影响[10-12]。其中,通过氮素营养形态的不同组合调控水稻生长发育和用水效率的研究近年来受到越来越多国内学者的关注[13-14],并且多数研究结果显示,在水分胁迫条件下,单一供应铵态氮或硝态氮营养均会使水稻生物量的积累降低,铵态氮和硝态氮配合施用则能够促进植株生长,改善其水分利用[15-16]。由此可见,当前研究主要集中在揭示氮素形态和水分胁迫的相互作用对水稻的影响机制,并以此优化氮素配比,提高水稻水分利用效率(WUE)。然而,尽管研究显示局部根系水分胁迫或氮素供应可以提高植物WUE[17-18],但对局部根系水分胁迫和氮素形态的相互作用却知之甚少[2]。
本研究的目的是了解局部根系水分胁迫和不同形态氮素配比的相互作用如何影响水稻幼苗的光合生理特性和氮素积累,探讨有利于水稻WUE提高的铵、硝营养形态配比和根系供水模式。
供试水稻(Oryza sativa L.)品种为金优402。试验于韶关学院农业基础广东省实验教学示范中心温室内进行。试验采用营养液培养方法。水稻种子经30% H2O2溶液浸泡15 min,无菌水洗净后,用清水浸种24 h,取出后在32 ℃恒温培养箱中催芽24 h,再用砂培法于温室内进行育苗,温室内温度白天约为30 ℃,光合有效辐射为1 200~1 500 μmol/(m2·s),夜晚为27 ℃。培养至一叶一心时,挑选生长一致的幼苗,移栽到打好孔的PVC板上,每个孔内移入1株水稻,用海绵固定后放在装有全营养液的培养钵内进行培养,营养液采用国际水稻研究所(IRRI)的常规营养液配方并略作改进,并添加2 mmol/L的硅酸钠(pH 值4.9~5.1),以保持营养液中的SiO2含量为0.2 mmol/L,添加氮素用量5%的双氰胺2 mg/L,以抑制硝化作用。混合氮营养液采用硫酸铵与硝酸钙试剂配制。采用5%聚乙二醇6000(PEG 6000)模拟水分胁迫,加入量为100 g/L。
试验设置非水分胁迫(CK)、局部根系水分胁迫(PRD)、全根水分胁迫(P) 3类水分条件,及3种氮素形态配比(即![]() 和
和![]() 在营养液中所占的比例,用A/N表示):A/N分别为0/100、50/50、100/0,共计9个处理,每个处理3次重复,各处理的总氮量相同为40 mg/L。处理1~3为非水分胁迫(用-PEG表示);处理4~6为局部根系水分胁迫(用PRD表示),处理7~9为全根水分胁迫(用+PEG表示)。具体处理设置见表1。
在营养液中所占的比例,用A/N表示):A/N分别为0/100、50/50、100/0,共计9个处理,每个处理3次重复,各处理的总氮量相同为40 mg/L。处理1~3为非水分胁迫(用-PEG表示);处理4~6为局部根系水分胁迫(用PRD表示),处理7~9为全根水分胁迫(用+PEG表示)。具体处理设置见表1。
水稻培养至三叶一心后进行分根和PEG水分胁迫处理,处理的方法是:将水稻移入左右根室容积均为500 mL(8 cm×8 cm×12 cm)的分根箱进行分根处理(图1)。每个分根箱移栽4株苗,移苗时每株苗保留长势基本一致的8条根,在左根室和右根室中分别放置4条,其余根剪除。移苗后,先用![]() 和
和![]() 等体积混合的全营养液缓苗3 d,再进行不同氮形态处理,培养7 d后向右根室营养液中添加5% PEG6000模拟水分胁迫处理,加入量为100 g/L,其渗透势相当于-50 kPa。两侧根室内的营养液完全相同。
等体积混合的全营养液缓苗3 d,再进行不同氮形态处理,培养7 d后向右根室营养液中添加5% PEG6000模拟水分胁迫处理,加入量为100 g/L,其渗透势相当于-50 kPa。两侧根室内的营养液完全相同。
表1 试验处理设置
Tab.1 Treatments of the experiment
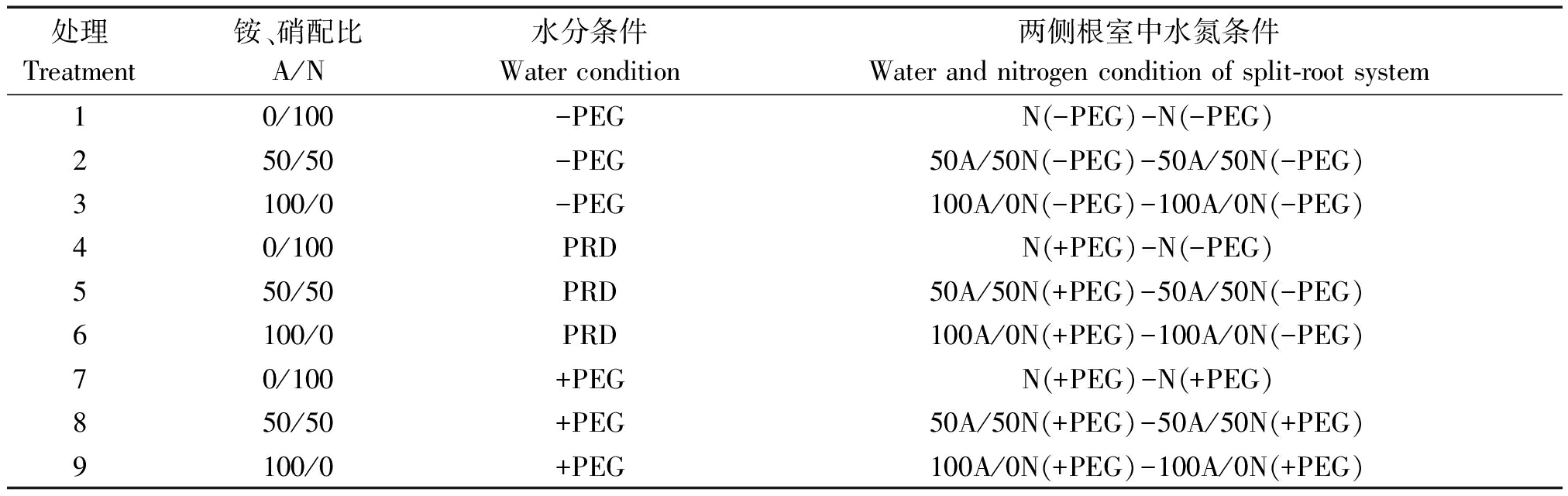
处理Treatment铵、硝配比A/N水分条件Water condition两侧根室中水氮条件Water and nitrogen condition of split-root system 10/100-PEGN(-PEG)-N(-PEG)250/50-PEG50A/50N(-PEG)-50A/50N(-PEG)3100/0-PEG100A/0N(-PEG)-100A/0N(-PEG)40/100PRDN(+PEG)-N(-PEG)550/50PRD50A/50N(+PEG)-50A/50N(-PEG)6100/0PRD100A/0N(+PEG)-100A/0N(-PEG)70/100+PEGN(+PEG)-N(+PEG)850/50+PEG50A/50N(+PEG)-50A/50N(+PEG)9100/0+PEG100A/0N(+PEG)-100A/0N(+PEG)
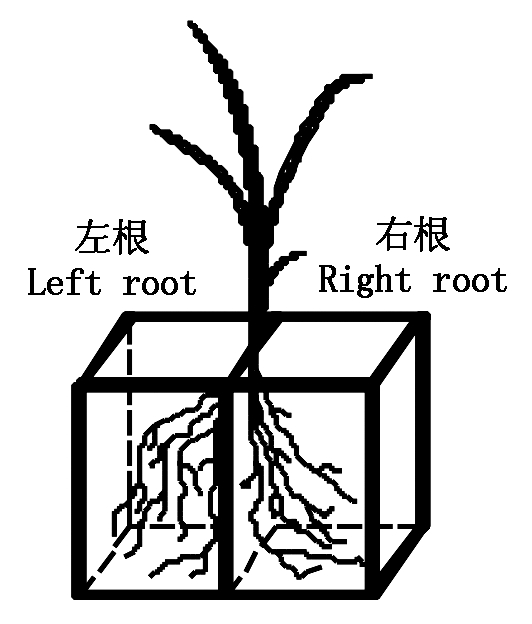
图1 水稻幼苗分根培养
Fig.1 Schematics view of split-root system of rice seedling
培养期间,每2 d 更换1次营养液,每天早、晚各调1次pH值。用0.1 mol/L NaOH和HCl将培养液pH值调到4.9~5.2。水分胁迫开始后第2天开始取样测定,每隔2 d取样1次,第4次取样后解除水分胁迫,水分胁迫解除后再连续取样测定2 d。
1.2.1 植株叶片和茎秆全氮 靛酚蓝比色法:取0.3 g烘干、磨碎的样品放入消煮管中,加入8 mL的硫酸,轻轻摇匀后在瓶口放一弯颈小漏斗,在KDN-04消化炉进行消煮。在消煮过程中重复3~5次加入H2O2,加入量逐渐减少,直到消煮液无色后取出。将消煮液无损地洗入100 mL容量瓶中,用水定容,后用H2SO4-H2O2测定。
将待测液用水准确稀释10倍,吸取稀释后的溶液1.00 mL于50 mL容量瓶中,加入1 mL EDTA-甲基红溶液,用氢氧化钠溶液调节至pH值6左右,再依次加入5 mL酚溶液和5 mL次氯酸钠溶液,摇匀,用水定容,待1 h后,用1 cm的比色皿在625 nm波长处比色,用空白试验溶液调节零点。
1.2.2 植株铵态氮和硝态氮净吸收量 铵态氮和硝态氮净吸收量=试验开始前营养液中铵态氮和硝态氮含量-试验结束后营养液中铵态氮和硝态氮含量。
铵态氮的测定:靛酚蓝比色法。吸取各处理培养液,放入50 mL容量瓶中,依次加入5 mL酚溶液和5 mL次氯酸钠碱性液,摇匀放置1 h后,加入1 mL掩蔽剂以溶解可能生成的沉淀物,然后用水定容,用1 cm比色皿在625 nm波长处进行比色。用空白试验溶液调节零点。绘制标准曲线从中查得显色液中氮的质量浓度(mg/L)。
计算公式为:水样中铵态氮含量(mg/L)=p×50/V
其中,p.从工作曲线上查得显色液中氮的质量浓度(mg/L);50.显色液体积(mL);V.吸取水样体积(mL)。
硝态氮的测定:紫外分光光度计法,吸取各处理的培养液直接在紫外分光光度计上用220,275 nm的波长和1 cm石英比色皿测定吸收值A=A220-A275。再从工作曲线上读取水样中硝酸根含量(mg/L)。
1.2.3 营养液质量的净减少值 营养液被植物吸收前后都用天平称量,相减得出植物净吸收营养液的质量。左根室与右根室中的营养液分别称质量。
1.2.4 光合作用 采用LI-6400便携式光合作用测定系统测定。
1.2.5 根系形态 采用加拿大REGENT根系分析系统(EPSON TWAIN PRO)分析测定根长、表面积、体积、分形维数等根系形态指标。
试验数据均采用Microsoft Excel软件进行统计分析,对各处理间的差异进行0.05水平上的显著性检验。
从图2,3可以看出,两侧根系均未受水分胁迫处理,且根室两侧同时供应![]() 和
和![]() (处理2)及单一供应
(处理2)及单一供应![]() (处理3)的水稻地上部全氮含量最高;当根室两侧根系均受水分胁迫时(处理7~9),水稻氮素积累受到明显抑制,处理7~9与处理2差异显著,且根室两侧均供应
(处理3)的水稻地上部全氮含量最高;当根室两侧根系均受水分胁迫时(处理7~9),水稻氮素积累受到明显抑制,处理7~9与处理2差异显著,且根室两侧均供应![]() (处理7)的植株受抑最多,处理7仅为处理2的15%;局部根系水分胁迫条件下,根室两侧同时供应
(处理7)的植株受抑最多,处理7仅为处理2的15%;局部根系水分胁迫条件下,根室两侧同时供应![]() 和
和![]() 的植株(处理5)氮素积累未受明显抑制,处理5与处理2差异不显著,前者可达后者的92%;与单一供应
的植株(处理5)氮素积累未受明显抑制,处理5与处理2差异不显著,前者可达后者的92%;与单一供应![]() 的植株(处理4)相比,单一供应
的植株(处理4)相比,单一供应![]() (处理6)的植株受抑制相对较小,处理6可达到处理2的85%,而处理4仅为处理2的66%。
(处理6)的植株受抑制相对较小,处理6可达到处理2的85%,而处理4仅为处理2的66%。
从叶片和茎秆全氮素含量来看,无论是非水分胁迫,还是局部根系水分胁迫,根室两侧同时供应![]() 和
和![]() 的植株及单一供应
的植株及单一供应![]() 的植株,叶片和茎秆的含氮量较为均衡。处理2叶片全氮含量和茎秆全氮含量分别占地上部全氮含量的47%和53%,处理3为49%和51%,处理5为50%和50%,处理6为54%和46%。根室两侧单一供应
的植株,叶片和茎秆的含氮量较为均衡。处理2叶片全氮含量和茎秆全氮含量分别占地上部全氮含量的47%和53%,处理3为49%和51%,处理5为50%和50%,处理6为54%和46%。根室两侧单一供应![]() 的植株则有利于叶片中氮素的积累,处理1、处理4、处理7的叶片全氮含量和茎秆全氮含量分别占地上部全氮含量为59%和41%,59%和41%及66%和34%。
的植株则有利于叶片中氮素的积累,处理1、处理4、处理7的叶片全氮含量和茎秆全氮含量分别占地上部全氮含量为59%和41%,59%和41%及66%和34%。
由此可见,在局部根系水分胁迫条件下,两侧根系同时供应![]() 和
和![]() 最有利于植株氮素的积累。局部根系胁迫和全部根系胁迫下,全部供应
最有利于植株氮素的积累。局部根系胁迫和全部根系胁迫下,全部供应![]() 均不利于植株氮素的积累,其中茎秆中氮素积累明显低于叶片。此外,随着水稻幼苗的生长,叶片与茎秆中的含氮量差异逐渐增大,茎秆中的氮更多地转运到叶片中。
均不利于植株氮素的积累,其中茎秆中氮素积累明显低于叶片。此外,随着水稻幼苗的生长,叶片与茎秆中的含氮量差异逐渐增大,茎秆中的氮更多地转运到叶片中。
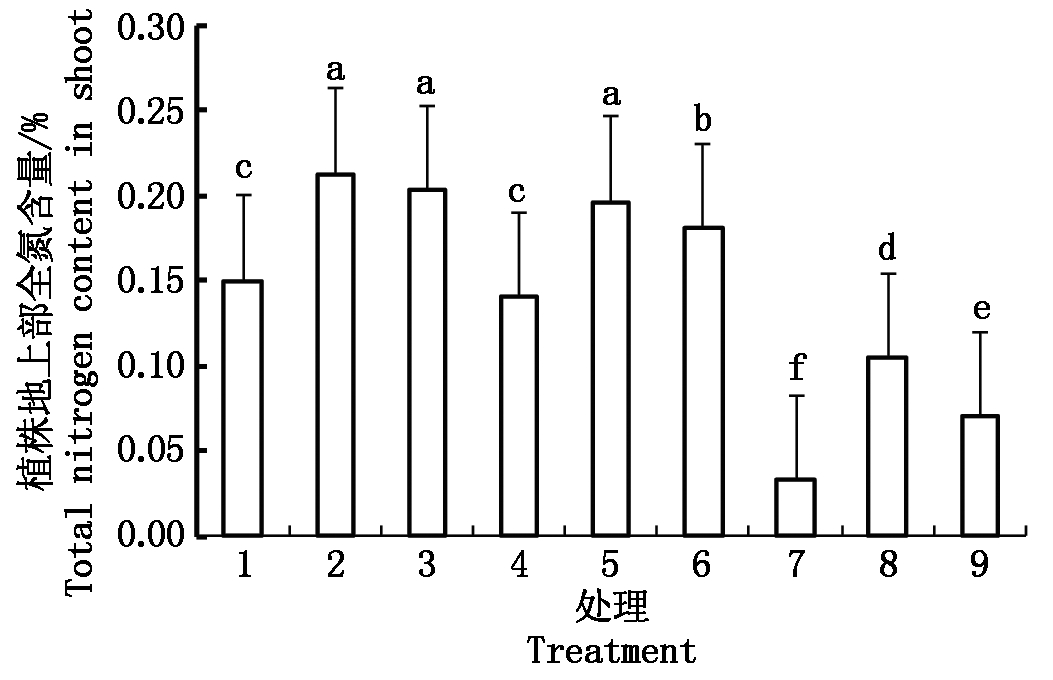
图中不同小写字母表示处理间差异达0.05显著水平。图3-5同。
Different small letters in the figure mean significant difference among treatment at 0.05 level. The same as Fig.3-5.
图2 局部根系水分胁迫下不同形态氮素营养对水稻幼苗地上部全氮素含量的影响
Fig.2 Effects of N form on rice seedling total nitrogen content in shoot under condition of PRD
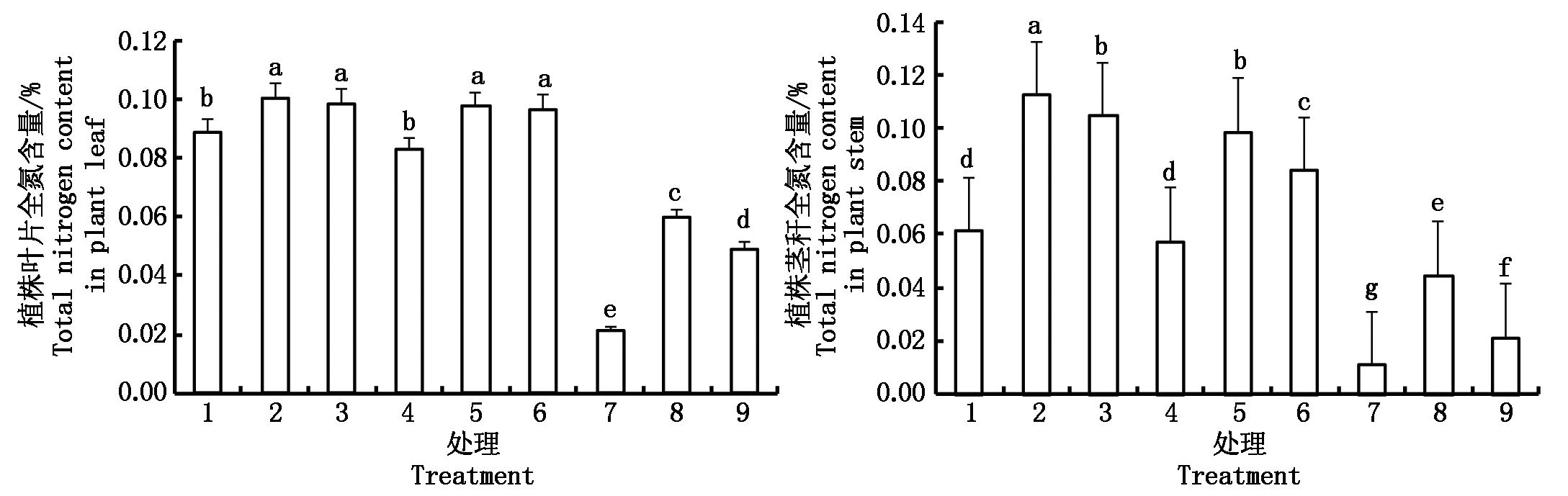
图3 局部根系水分胁迫下不同形态氮素营养对水稻幼苗叶片和茎秆氮素含量的影响
Fig.3 Effects of N form on rice seedling leaf and stem nitrogen content under condition of PRD
图4显示,3种氮素形态处理的植株氮素吸收量均表现为非水分胁迫的最高,局部根系水平胁迫的次之,全根水分胁迫的最低,其中,两侧根系均单一供应![]() 的水稻,不同水分条件之间差异显著,两侧根系均单一供应
的水稻,不同水分条件之间差异显著,两侧根系均单一供应![]() 的水稻和两侧根系同时供应
的水稻和两侧根系同时供应![]() 和
和![]() 的水稻,CK和PRD之间差异前者显著,后者不显著。3种氮素形态处理中,两侧根系同时供应
的水稻,CK和PRD之间差异前者显著,后者不显著。3种氮素形态处理中,两侧根系同时供应![]() 和
和![]() 的水稻氮素吸收量最多,且局部根系水分胁迫和非水分胁迫间的差异不显著,两侧根系均单一供应
的水稻氮素吸收量最多,且局部根系水分胁迫和非水分胁迫间的差异不显著,两侧根系均单一供应![]() 的水稻氮素吸收量最少。
的水稻氮素吸收量最少。
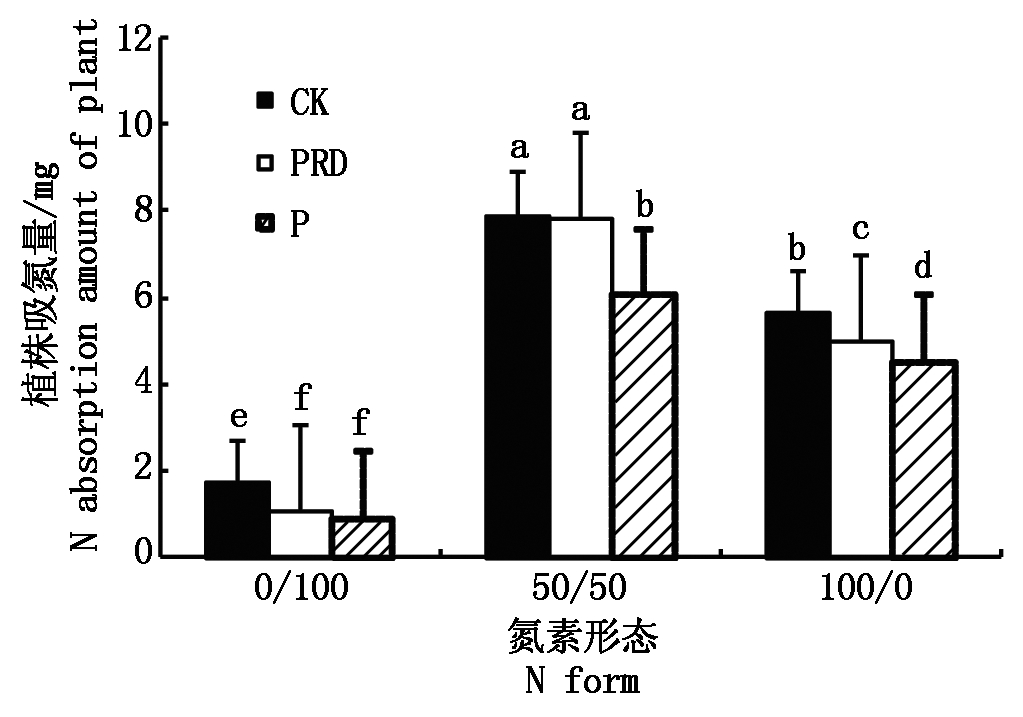
图4 局部根系水分胁迫下不同形态氮素营养对水稻氮素吸收量的影响
Fig.4 Effects of N form on N absorption amount of rice under condition of PRD
从图5可以看出,氮素形态为50/50的处理,不同水分条件下均以吸收铵态氮为主,其中非水分胁迫条件下铵态氮的吸收量最大,为全根水分胁迫的1.5倍,局部水分胁迫条件的次之,两者的差异不显著。非水分胁迫下,铵态氮的吸收量为硝态氮的1.92倍,局部根系水分胁迫下,前者为后者的1.96倍。全根水分胁迫下铵态氮和硝态氮的吸收量差异最大,前者为后者的2.23倍。水稻对硝态氮的吸收在非水分胁迫和局部根系水分胁迫之间的差异不显著。
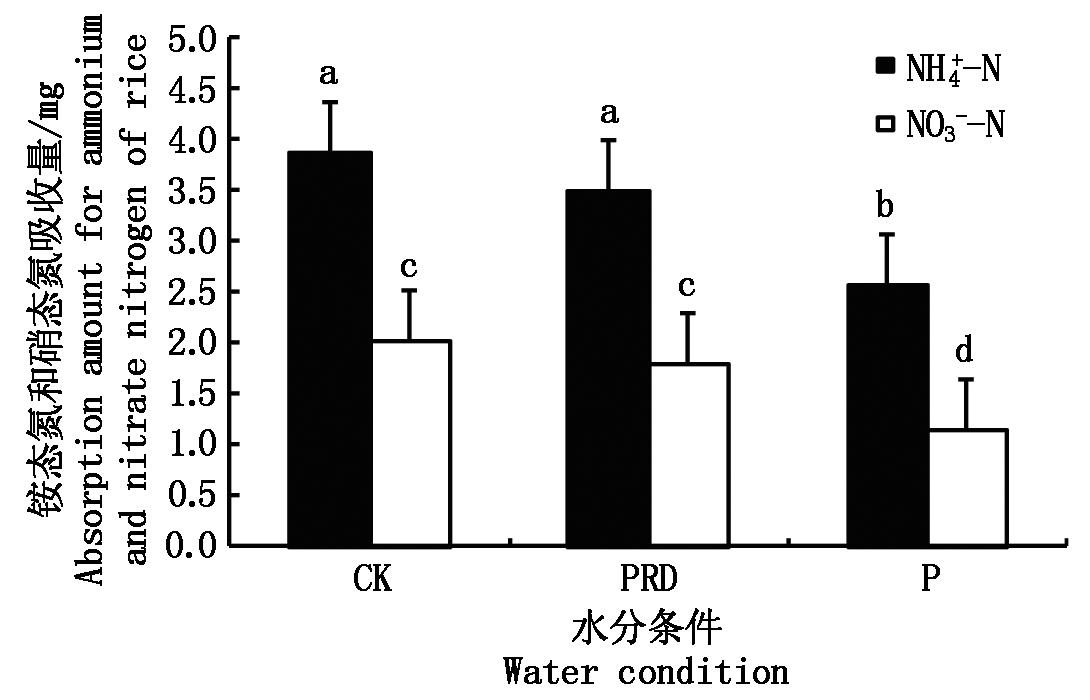
图5 不同水分条件下50/50氮素形态配比处理对水稻吸收铵态氮和硝态氮的影响
Fig.5 Effects of N form of 50/50 on ammonium and nitrate nitrogen absorption of rice under different water condition
由表2可以看出,与3种氮素形态供应下两侧根系均未施加水分胁迫的处理(处理1~3)植株相比,局部根系水分胁迫下两侧根系同时供应![]() 和
和![]() 的水稻(处理5)光合速率受影响较小,处理5可达到处理2的85%。当根室两侧根系均受水分胁迫时,水稻光合速率受抑明显,处理7~9与处理1~3之间差异显著,根室两侧同时供应
的水稻(处理5)光合速率受影响较小,处理5可达到处理2的85%。当根室两侧根系均受水分胁迫时,水稻光合速率受抑明显,处理7~9与处理1~3之间差异显著,根室两侧同时供应![]() 和
和![]() 的水稻光合速率受影响相对略小,而根室两侧单一供应
的水稻光合速率受影响相对略小,而根室两侧单一供应![]() 则受影响最大。
则受影响最大。
局部根系水分胁迫和全根水分胁迫条件下,水稻气孔导度和蒸腾速率均明显下降。处理5比处理2的气孔导度和蒸腾速率分别下降了70.59%,60.58%,处理8比处理2分别下降了81.72%,70.07%。在非水分胁迫条件下,不同氮形态处理间,根室两侧同时供应![]() 和
和![]() 的水稻光合速率、蒸腾速率和气孔导度均为最大,单一供应
的水稻光合速率、蒸腾速率和气孔导度均为最大,单一供应![]() 的最小,在水分胁迫条件下则略有不同。
的最小,在水分胁迫条件下则略有不同。
植物光合速率和蒸腾速率的比值称为叶片水分利用效率,可以反映植物蒸腾消耗单位质量的水分所同化的干物质量。表2显示,在所有处理中,局部根系水分胁迫下根室两侧同时供应![]() 和
和![]() 的水稻WUE最高;不管何种水分条件,3种氮素形态中,根室两侧同时供应
的水稻WUE最高;不管何种水分条件,3种氮素形态中,根室两侧同时供应![]() 和
和![]() 的水稻WUE均为最高,根室两侧单一供应
的水稻WUE均为最高,根室两侧单一供应![]() 的最低; 3种水分条件中,局部根系水分胁迫的水稻WUE最高,非水分胁迫处理的最低。
的最低; 3种水分条件中,局部根系水分胁迫的水稻WUE最高,非水分胁迫处理的最低。
表2 局部根系水分胁迫下不同形态氮素营养对水稻幼苗生理特性的影响
Tab.2 Effects of N form on rice seedling physiological functional properties under condition of PRD
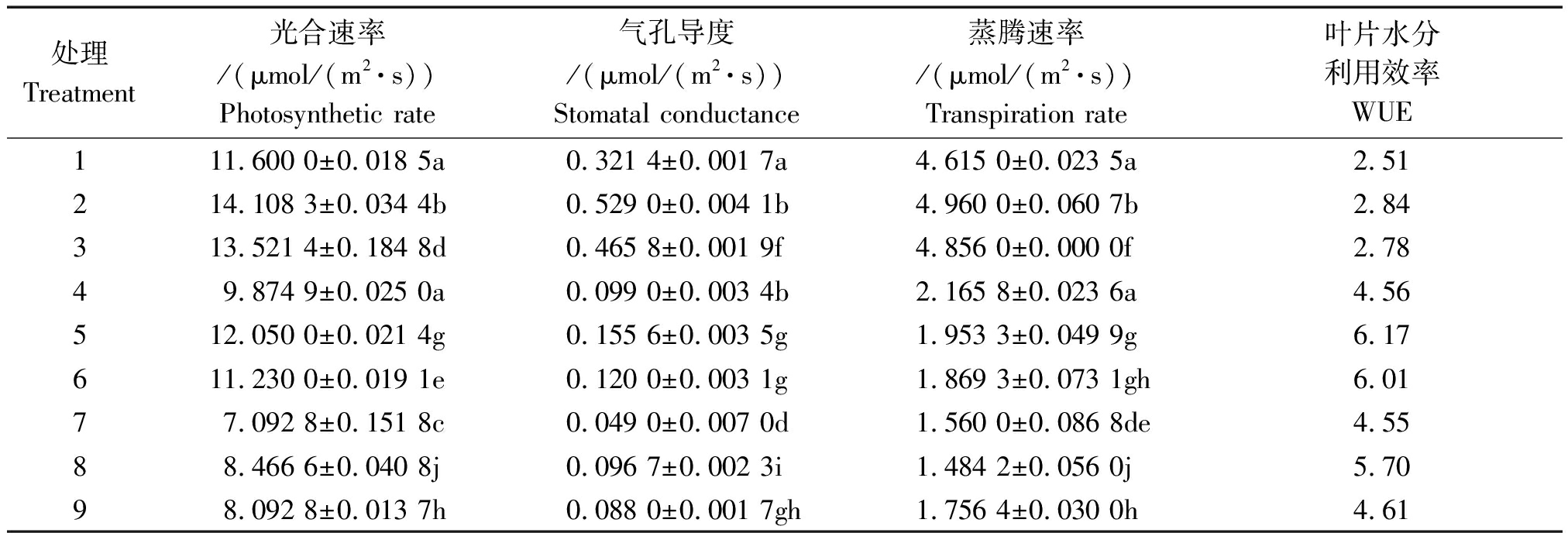
处理Treatment光合速率/(μmol/(m2·s))Photosynthetic rate气孔导度/(μmol/(m2·s))Stomatal conductance蒸腾速率/(μmol/(m2·s))Transpiration rate叶片水分利用效率WUE111.600 0±0.018 5a0.321 4±0.001 7a4.615 0±0.023 5a2.51214.108 3±0.034 4b0.529 0±0.004 1b4.960 0±0.060 7b2.84313.521 4±0.184 8d0.465 8±0.001 9f4.856 0±0.000 0f2.7849.874 9±0.025 0a0.099 0±0.003 4b2.165 8±0.023 6a4.56512.050 0±0.021 4g0.155 6±0.003 5g1.953 3±0.049 9g6.17611.230 0±0.019 1e0.120 0±0.003 1g1.869 3±0.073 1gh6.0177.092 8±0.151 8c0.049 0±0.007 0d1.560 0±0.086 8de4.5588.466 6±0.040 8j0.096 7±0.002 3i1.484 2±0.056 0j5.7098.092 8±0.013 7h0.088 0±0.001 7gh1.756 4±0.030 0h4.61
注:表中不同小写字母代表各处理间差异达0.05显著水平。表3同。
Note: Different small letters indicates significant difference among treatments at 0.05 level. The same as Tab.3.
表3所示,在非水分胁迫条件下(CK),相同氮素形态处理水稻两侧根室的根长、根表面积、根体积基本相近,差异不显著(50A/50N处理的根体积除外)。不同氮素形态处理间,两侧根室同时供应![]() 和
和![]() 的水稻根长、根表面积、根体积均大于其他2种氮素形态(50A/50N处理的右根体积除外),处理间差异显著;在局部根系水分胁迫条件下,根室两侧同时供应
的水稻根长、根表面积、根体积均大于其他2种氮素形态(50A/50N处理的右根体积除外),处理间差异显著;在局部根系水分胁迫条件下,根室两侧同时供应![]() 和
和![]() 的水稻根长、根表面积、根体积大于其他2种氮素形态(50A/50NP处理的左根表面积除外),且受胁迫一侧和不受胁迫一侧根系相差较小,两侧根系全部供应
的水稻根长、根表面积、根体积大于其他2种氮素形态(50A/50NP处理的左根表面积除外),且受胁迫一侧和不受胁迫一侧根系相差较小,两侧根系全部供应![]() 时则受胁迫一侧根系受到明显抑制。除左右根室均单一供应
时则受胁迫一侧根系受到明显抑制。除左右根室均单一供应![]() 的水稻外,局部根系胁迫处理的根长、根表面积、根体积均大于非胁迫处理。除左右根室均单一供应
的水稻外,局部根系胁迫处理的根长、根表面积、根体积均大于非胁迫处理。除左右根室均单一供应![]() 的水稻及左右根室同时供应
的水稻及左右根室同时供应![]() 和
和![]() 的水稻左根体积外,全根胁迫水稻的根长、根表面积、根体积均大于非水分胁迫处理。局部根系胁迫下不受胁迫一侧根系(左根)的根长、根表面积、根体积多数大于全部根系胁迫下左侧根系的根长、根表面积、根体积(100AP处理的根长和根体积除外)。
的水稻左根体积外,全根胁迫水稻的根长、根表面积、根体积均大于非水分胁迫处理。局部根系胁迫下不受胁迫一侧根系(左根)的根长、根表面积、根体积多数大于全部根系胁迫下左侧根系的根长、根表面积、根体积(100AP处理的根长和根体积除外)。
表3 局部根系水分胁迫下不同形态氮素营养对水稻根系形态的影响
Tab.3 Effects of N form on rice seedling root morphology under condition of PRD
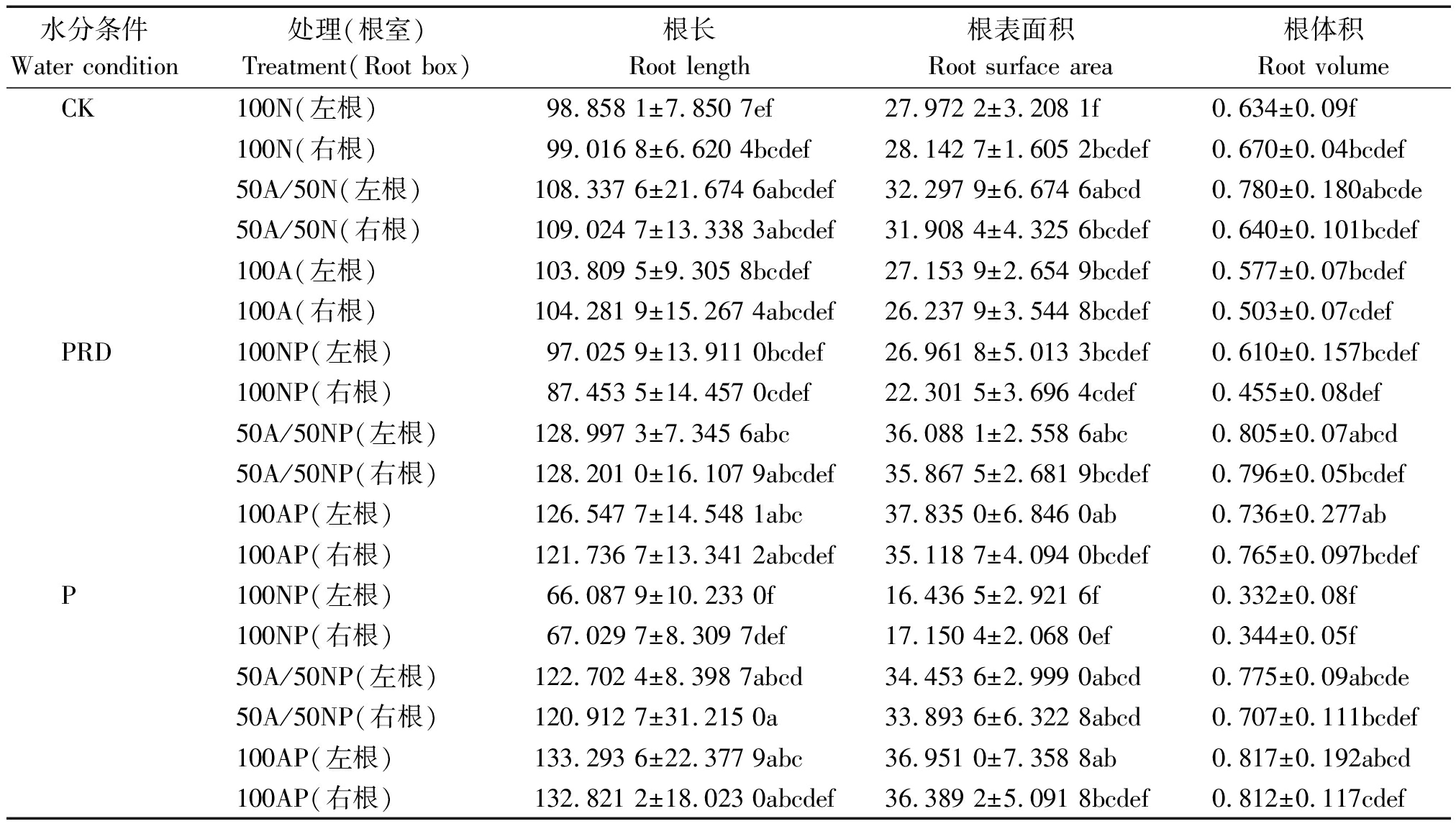
水分条件Water condition处理(根室)Treatment(Root box)根长Root length根表面积Root surface area根体积Root volumeCK100N(左根)98.858 1±7.850 7ef27.972 2±3.208 1f0.634±0.09f100N(右根)99.016 8±6.620 4bcdef28.142 7±1.605 2bcdef0.670±0.04bcdef50A/50N(左根)108.337 6±21.674 6abcdef32.297 9±6.674 6abcd0.780±0.180abcde50A/50N(右根)109.024 7±13.338 3abcdef31.908 4±4.325 6bcdef0.640±0.101bcdef100A(左根)103.809 5±9.305 8bcdef27.153 9±2.654 9bcdef0.577±0.07bcdef100A(右根)104.281 9±15.267 4abcdef26.237 9±3.544 8bcdef0.503±0.07cdefPRD100NP(左根)97.025 9±13.911 0bcdef26.961 8±5.013 3bcdef0.610±0.157bcdef100NP(右根)87.453 5±14.457 0cdef22.301 5±3.696 4cdef0.455±0.08def50A/50NP(左根)128.997 3±7.345 6abc36.088 1±2.558 6abc0.805±0.07abcd50A/50NP(右根)128.201 0±16.107 9abcdef35.867 5±2.681 9bcdef0.796±0.05bcdef100AP(左根)126.547 7±14.548 1abc37.835 0±6.846 0ab0.736±0.277ab100AP(右根)121.736 7±13.341 2abcdef35.118 7±4.094 0bcdef0.765±0.097bcdefP100NP(左根)66.087 9±10.233 0f16.436 5±2.921 6f0.332±0.08f100NP(右根)67.029 7±8.309 7def17.150 4±2.068 0ef0.344±0.05f50A/50NP(左根)122.702 4±8.398 7abcd34.453 6±2.999 0abcd0.775±0.09abcde50A/50NP(右根)120.912 7±31.215 0a33.893 6±6.322 8abcd0.707±0.111bcdef100AP(左根)133.293 6±22.377 9abc36.951 0±7.358 8ab0.817±0.192abcd100AP(右根)132.821 2±18.023 0abcdef36.389 2±5.091 8bcdef0.812±0.117cdef
研究发现,氮素营养形态与作物生长发育及抵抗干旱的能力存在较强的相关性,但不同作物种类间存在差异,刘秀珍等[19]的试验证实,供应![]() 的苋菜比供应
的苋菜比供应![]() 的苋菜具有更强的抗旱性。而陈贵等[13]和陈钰佩等[14]在水稻上的研究表明,在模拟水分胁迫条件下,供应
的苋菜具有更强的抗旱性。而陈贵等[13]和陈钰佩等[14]在水稻上的研究表明,在模拟水分胁迫条件下,供应![]() 水稻比供应
水稻比供应![]() 水稻受水分胁迫的影响更小。在局部根系水分胁迫条件下,当施用
水稻受水分胁迫的影响更小。在局部根系水分胁迫条件下,当施用![]() 时,受胁迫根系和未受胁迫根系的生物量均无明显差异,而当施用
时,受胁迫根系和未受胁迫根系的生物量均无明显差异,而当施用![]() 时,受胁迫根系的生物量累积则受到明显的抑制[13]。王海红等[20]认为,
时,受胁迫根系的生物量累积则受到明显的抑制[13]。王海红等[20]认为,![]() 对胁迫初期玉米幼苗的生长有明显的促进作用,其干物质量的增加多于
对胁迫初期玉米幼苗的生长有明显的促进作用,其干物质量的增加多于![]() 和混合氮处理。本研究结果与王海红等[20]不同,在局部根系水分胁迫下,根室两侧同时供应
和混合氮处理。本研究结果与王海红等[20]不同,在局部根系水分胁迫下,根室两侧同时供应![]() 和
和![]() 的水稻植株吸氮量和氮素积累最多,与非水分胁迫植株的差异最小,全部供应
的水稻植株吸氮量和氮素积累最多,与非水分胁迫植株的差异最小,全部供应![]() 植株的吸氮量和氮素积累最小,并且不同水分条件下,同时供应
植株的吸氮量和氮素积累最小,并且不同水分条件下,同时供应![]() 和
和![]() 处理的水稻植株均以吸收
处理的水稻植株均以吸收![]() 为主。说明在局部根系水分胁迫条件下,如果同时供应2种不同形态氮素,则
为主。说明在局部根系水分胁迫条件下,如果同时供应2种不同形态氮素,则![]() 可以通过刺激
可以通过刺激![]() 的吸收而促进水稻氮素的积累,与非水分胁迫水稻相比,其叶片含氮量明显提高,这与何海兵等[15]的结果较为一致。其原因可能是
的吸收而促进水稻氮素的积累,与非水分胁迫水稻相比,其叶片含氮量明显提高,这与何海兵等[15]的结果较为一致。其原因可能是![]() 更易促使氮素在叶片中积累,本研究中根室两侧全部供应
更易促使氮素在叶片中积累,本研究中根室两侧全部供应![]() 的植株其叶片全氮含量达到地上部全氮含量的59%以上,证明了这一点。此外,本研究还发现,水稻苗期的水分吸收量在不同氮素形态处理间存在明显差异,供应
的植株其叶片全氮含量达到地上部全氮含量的59%以上,证明了这一点。此外,本研究还发现,水稻苗期的水分吸收量在不同氮素形态处理间存在明显差异,供应![]() 的植株水分吸收量明显低于供应
的植株水分吸收量明显低于供应![]() 植株的吸收量。铵、硝营养配合施用被认为是提高作物水分吸收和用水效率的优化氮素供应模式,其重要原因之一是氮素形态加强了植株的细胞-细胞水分吸收过程[21]。
植株的吸收量。铵、硝营养配合施用被认为是提高作物水分吸收和用水效率的优化氮素供应模式,其重要原因之一是氮素形态加强了植株的细胞-细胞水分吸收过程[21]。
研究者认为,在局部根系水分胁迫下,不同氮形态对水稻幼苗生长的影响随胁迫时间的长短而不同。相对于全铵和全硝处理,铵、硝混合处理在胁迫初期对水稻幼苗的生长有明显促进作用,其干物质积累超过全铵和全硝处理,这可能是铵、硝营养的合理配比提升了水稻植株的光合速率、光能利用和转化效率。本研究结果支持这一观点:局部根系水分胁迫下根室两侧同时供应![]() 和
和![]() 的水稻光合速率未受到明显影响,而根室两侧单一供应
的水稻光合速率未受到明显影响,而根室两侧单一供应![]() 和
和![]() 则受影响较大。其原因可能是铵、硝混合由于增加了
则受影响较大。其原因可能是铵、硝混合由于增加了![]() 含量,因而可以减少
含量,因而可以减少![]() 同化所需的能量;同时混合营养液中的
同化所需的能量;同时混合营养液中的![]() 又可以抑制
又可以抑制![]() 的累积,进而维持植株体内代谢的相对平衡[20]。同时
的累积,进而维持植株体内代谢的相对平衡[20]。同时![]() 还可能会诱发氧化磷酸化、光合磷酸化与电子传递解偶联,从而抑制CO2暗固定,降低植物的光合能力。另外,铵态氮在植物体内的大量积累增加了对叶绿体中通过光合电子传递产生的同化力的消耗,从而降低光能的利用效率。
还可能会诱发氧化磷酸化、光合磷酸化与电子传递解偶联,从而抑制CO2暗固定,降低植物的光合能力。另外,铵态氮在植物体内的大量积累增加了对叶绿体中通过光合电子传递产生的同化力的消耗,从而降低光能的利用效率。
光合作用和蒸腾作用是植物水分代谢的2个重要方面。蒸腾作用受根系吸水力和叶片导水力的协同作用,当叶片导水力增强或减弱时,根系吸水力会随之提高或下降,进而影响蒸腾速率[15]。由此可见,氮素形态对蒸腾速率的调节实质上是根、冠吸水和导水能力反馈调控的结果。本研究表明,局部根系水分胁迫和全根水分胁迫条件下,水稻气孔导度和蒸腾速率均明显下降,其中根系两侧同时供应![]() 和
和![]() 的水稻下降最多,这充分体现了上述的调控过程。
的水稻下降最多,这充分体现了上述的调控过程。
陈晓远作物水分关系课题组多年的研究发现,当土壤水势下降到正常水平以下后,同时供应铵态氮和硝态氮的水稻木质部液流(Xylem sap)中ABA浓度和pH值均有升高的趋势。ABA浓度升高可以调节气孔开度,降低植株的蒸腾速率,其原因是木质部液流中![]() 浓度影响pH值的变化及气孔对ABA和土壤干旱的敏感度,随着木质部液流pH值的变化,气孔开度和水分利用效率随之发生变化。因此,木质部液流pH值和ABA协同调节植物的气体交换,抑制无效的水分吸收,改善植株叶片水分利用效率[22]。本研究再次证明了这一现象:根室两侧同时供应
浓度影响pH值的变化及气孔对ABA和土壤干旱的敏感度,随着木质部液流pH值的变化,气孔开度和水分利用效率随之发生变化。因此,木质部液流pH值和ABA协同调节植物的气体交换,抑制无效的水分吸收,改善植株叶片水分利用效率[22]。本研究再次证明了这一现象:根室两侧同时供应![]() 和
和![]() 的水稻WUE均为最高,根室两侧单一供应
的水稻WUE均为最高,根室两侧单一供应![]() 的最低。进一步的测定表明,在3种供水条件下,局部根系水分胁迫下的水稻WUE最高。因为与充分灌溉相比,由于根水势和其他生理参数的改变,PRD能够促进木质部液流ABA浓度的提高,进而降低气孔导度,提高WUE[7]。
的最低。进一步的测定表明,在3种供水条件下,局部根系水分胁迫下的水稻WUE最高。因为与充分灌溉相比,由于根水势和其他生理参数的改变,PRD能够促进木质部液流ABA浓度的提高,进而降低气孔导度,提高WUE[7]。
本研究显示,局部根系胁迫条件下,除左右根室均单一供应![]() 的水稻外,其他2种氮素形态配比处理的根长、根表面积、根体积均大于非胁迫处理。这可能是因为局部根系供水可以使另一半未受胁迫根系产生强烈的吸水补偿效应,并适当调节根系中吲哚乙酸含量,从而增加根中形成层的活力,促进根系的延伸生长,维持较大的根表面积,增强根系活力。表明这种局部根系胁迫的供水方式可能是通过提升根系的渗透调节能力来提高根系水势,同时通过水力信号或化学信号的传递而维持较高的光合和蒸腾速率,使植株保持良好的水分状况和对胁迫的抵御能力[13]。另一方面,当局部根系受水分胁迫时,两侧根系同时供应
的水稻外,其他2种氮素形态配比处理的根长、根表面积、根体积均大于非胁迫处理。这可能是因为局部根系供水可以使另一半未受胁迫根系产生强烈的吸水补偿效应,并适当调节根系中吲哚乙酸含量,从而增加根中形成层的活力,促进根系的延伸生长,维持较大的根表面积,增强根系活力。表明这种局部根系胁迫的供水方式可能是通过提升根系的渗透调节能力来提高根系水势,同时通过水力信号或化学信号的传递而维持较高的光合和蒸腾速率,使植株保持良好的水分状况和对胁迫的抵御能力[13]。另一方面,当局部根系受水分胁迫时,两侧根系同时供应![]() 和
和![]() 的水稻根长、根表面积(左根的表面积除外)、根体积均大于其他2种氮素形态,且受胁迫一侧和不受胁迫一侧根系相差较小。表明水稻受到水分胁迫时,同时供应
的水稻根长、根表面积(左根的表面积除外)、根体积均大于其他2种氮素形态,且受胁迫一侧和不受胁迫一侧根系相差较小。表明水稻受到水分胁迫时,同时供应![]() 和
和![]() 比单一供应
比单一供应![]() 或
或![]() 更有利于渗透调节能力的提高。这很好地解释了
更有利于渗透调节能力的提高。这很好地解释了![]() 和
和![]() 混合施用能够使局部根系水分胁迫下湿润一侧根系的氮素积累明显大于两侧根系均未受水分胁迫下各侧根系氮素积累的现象。
混合施用能够使局部根系水分胁迫下湿润一侧根系的氮素积累明显大于两侧根系均未受水分胁迫下各侧根系氮素积累的现象。
[1] Adu M O, Yawson D O, Armah F A, Asare P A, Frimpong K A. Meta-analysis of crop yields of full, deficit, and partial root-zone drying irrigation[J].Agricultural Water Management,2018,197:79-90.doi:10.1016/j.agwat.2017.11.019.
[2] Li W, Jia L, Wang L. Chemical signals and their regulations on the plant growth and water use efficiency of cotton seedlings under partial root-zone drying and different Nitrogen applications[J].Saudi Journal of Biological Sciences,2017,24(3):477-487. doi:10.1016/j.sjbs.2017.01.015.
[3] Wang H Q, Liu F L, Andersen M N, Jensen C R. Comparative effects of partial root-zone drying and deficit irrigation on nitrogen uptake in potatoes (Solanum tuberosum L.)[J].Irrigation Science, 2009, 27(6):443-448.doi:10.1007/s00271-009-0159-y.
[4] Jovanovic Zorica, Stikic Radmila, Vucelic-Radovic Biljana, Paukovic Milena, Brocic Zoran, Matovic Gordana, Rovcanin Sead, Mojevic Mirjana. Partial root-zone drying increases WUE, N and antioxidant content in field potatoes[J].European Journal of Agronomy,2010,33(2):124-131. doi: 10.1016/j.eja.2010.04.003.
[5] Wang Z, Kang S, Jensen C R, Liu F. Alternate partial root-zone irrigation reduces bundle-sheath cell leakage to CO2 and enhances photosynthetic capacity in maize leaves[J].Journal of Experimental Botany,2012,63(3):1145-1153.doi:10.1093/jxb/err331.
[6] Sampathkumar T, Pandian B J, Rangaswamy M, Jeyakumar P. Influence of deficit irrigation on growth, yield and yield parameters of cotton-maize cropping sequence[J].Agricultural Water Management,2013,130:90-102.doi:10.1016/j.agwat.2013.08.018.
[7] Nouna B B, Rezig M, Bahrouni H, Haroun Ben Ammar. Effect of partial root-zone drying irrigation technique(PRD)on the total dry matter, yield and water use efficiency of potato under Tunisian semi-arid conditions[J].The Journal of Agricultural Science,2016,8(7):129-141. doi: 10.5539/jas.v8n7p129.
[8] Gil P M, Lobos P, Duran K, Olguin J, Cea D.Partial root-zone drying irrigation, shading, or mulching effects on water savings, productivity and quality of Syrah grapevines[J].Scientia Horticulturae,2018,240:478-483.doi:10.1016/j.scienta.2018.06.050.
[9] 何海兵, 杨茹, 廖江, 武立权, 孔令聪, 黄义德. 水分和氮肥管理对灌溉水稻优质高产高效调控机制的研究进展[J]. 中国农业科学, 2016, 49(2): 305-318. doi:10.3864/j.issn.0578-1752.2016.02.011.
He H B, Yang R, Liao J, Wu L Q, Kong L C, Huang Y D. Research advance of high-yielding and high efficiency in resource use and improving grain quality of rice plants under water and nitrogen managements in an irrigated region[J]. Scientia Agricultura Sinica, 2016,49(2):305-318.
[10] Wu F Z, Bao W K, Li F L, Wu N. Effects of drought stress and N supply on the growth, biomass partitioning and water-use efficiency of Sophora davidii seedlings[J].Environmental and Experimental Botany,2008,63(1/3):248-255.doi:10.1016/j.envexpbot.2007.11.002.
[11] Cramer M D, Hawkins H J, Verboom G A. The importance of nutritional regulation of plant water flux[J].Oecologia,2009,161(1):15-24.doi:10.1007/s00442-009-1364-3.
[12] Gonzalez-Dugo V, Durand J L, Gastal F. Water deficit and nitrogen nutrition of crops. A review[J].Agronomy for Sustainable Development,2010,30(3):529-544. doi:10.1051/agro/2009059.
[13] 陈贵, 郭世伟, 赵国华, 张红梅, 沈亚强, 程旺大. N营养和水分胁迫互作对水稻渗透调节的影响[J]. 中国农业大学学报, 2014, 19(5): 38-45. doi:10.11841/j.issn.1007-4333.2014.05.06.
Chen G, Guo S W, Zhao G H, Zhang H M, Shen Y Q, Cheng W D. Effect of N nutrition and water stress on rice osmoregulation at seeding stage[J]. Journal of China Agricultural University, 2014,19(5):38-45.
[14] 陈钰佩, 高翠民, 任彬彬, 胡香玉, 沈其荣, 郭世伟. 水分胁迫下氮素形态影响水稻根系通气组织形成的生理机制[J]. 南京农业大学学报, 2017, 40(2): 273-280.
Chen Y P, Gao C M, Ren B B, Hu X Y, Shen Q R, Guo S W. Physiological mechanism of nitrogen forms affect aerenchyma formation of rice root under water stress[J]. Journal of Nanjing Agricultural University, 2017, 40(2):273-280.
[15] 何海兵, 杨茹, 吴汉, 尤翠翠, 朱德泉, 时强强, 武立权. 干湿交替灌溉下氮素形态对水稻花期光合及产量形成的影响[J]. 西北植物学报, 2017, 37(11): 2230-2237. doi: 10.7606/j.issn.1000-4025.2017.11.2230.
He H B, Yang R, Wu H, You C C, Zhu D Q, Shi Q Q, Wu L Q. Effects of N forms on photosynthesis at flowering and yield formation in weting-drying alternation irrigation[J]. Acta Botanica Boreali-occidentalia Sinica, 2017,37(11):2230-2237.
[16] 陈贵, 周毅, 郭世伟, 沈其荣. 水分胁迫条件下不同形态氮素营养对水稻叶片光合效率的调控机理研究[J]. 中国农业科学, 2007, 40(10): 2162-2168. doi: 10.3321/j.issn:0578-1752.2007.10.006.
Chen G, Zhou Y, Guo S W, Shen Q R. The regulatory mechanism of different nitrogen form on photosynthetic efficiency of rice plants under water stress[J]. Scientia Agricultura Sinica, 2007,40(10):2162-2168.
[17] Du S Q, Kang S Z, Li F S, Du T S. Water use efficiency is improved by alternate partial root-zone irrigation of apple in arid northwest China[J]. Agricultural Water Management,2017, 179:184-192. doi: 10.1016/j.agwat.2016.05.011.
[18] Ramazan Topak, Bilal Acar, Refik Uyanözb, Ercan Ceyhan. Performance of partial root-zone drip irrigation for sugar beet production in a semi-arid area[J]. Agricultural Water Management,2016, 176:180-190. doi: 10.1016/j.agwat.2016.06.004.
[19] 刘秀珍, 郭丽娜, 赵兴杰. 不同水分条件下氮肥形态配比对苋菜养分与产量的影响[J]. 水土保持学报, 2008, 22(6): 141-144. doi:10.3321/j.issn:1009-2242.2008.06.030.
Liu X Z, Guo L N, Zhao X J. Effects of nitrogen forms on nutrient and yield of amaranth with different irrigation[J]. Journal of Soil and Water Conservation, 2008,22(6):141-144.
[20] 王海红, 束良佐, 周秀杰, 祝鹏飞, 刘亚文. 局部根系水分胁迫下氮形态对玉米幼苗光合特性的影响[J]. 核农学报, 2009, 23(4): 686-691.
Wang H H, Shu L Z, Zhou X J, Zhu P F, Liu Y W. Effect of nitrogen form on photosynthetic characteristics of maize seedlings under partial root water stress[J]. Journal of Nuclear Agricultural Sciences, 2009, 23(4):686-691.
[21] 柏彦超,钱晓晴,周雄飞,蔡树美,王娟娟,赵进.不同氮素形态和水分胁迫对水稻水分吸收及光合特性的影响[J].扬州大学学报(农业与生命科学版),2010,31(3):50-54.
Bai Y C, Qian X Q, Zhou X F, Cai S M, Wang J J, Zhao J. Effect of nitrogen form and water stress on photosynthetic characteristics and water uptake in rice[J]. J ou rnal of Yangzhou University(Agricultural and Life Science Edition), 2010,31(3):50-54.
[22] Geilfus C M. The pH of the apoplast: dynamic factor with functional impact under stress[J].Molecular Plant,2017,10(11):1371-1386.doi:10.1016/j.molp.2017.09.018.