纳米颗粒是一种直径低于100 nm或更小的物质,具有优越的磁性电导性反应活性,因其具有独特的结构和优异的性能(如光稳定性高、生物相容性好等),而被广泛应用于生物成像[1]、传感[2]、光催化剂[3]、光电器件[4-5]等领域。另外,纳米材料还具有单原子或分子转移及相应体积材料的移动功能,可以改变物质的物理化学性质,可能对生命体产生正面或负面效应,因此在生物学等新领域中的运用也越来越受到重视。据报道,纳米材料具有促进果蔬保鲜、植物生长、杀菌、防止疾病等功效[6],可以促进油松种子的萌发和幼苗生长[7]、大豆种子萌发和生长[8]、组织培养幼苗再生发育[9]、绿豆下胚轴的不定根形成,以及促进绿豆芽幼苗的生长等[10-11];此外,研究表明,纳米材料还具有特殊的光催化作用,能明显促进植物的光合作用[12],提高植物的光能利用率等生物效应[13]。
花生作为我国最重要的油料作物之一,其总产居世界第1位。花生籽粒富含油脂和蛋白质,其总产的50%以上主要用于榨油和直接食用[14]。近年来,随着纳米颗粒的广泛应用,越来越多的纳米粒子被用于植物的生长发育过程中。然而,关于纳米材料在花生生产中的应用并不多见,尤其作为一种新型合成的纳米材料-纳米碳点,其对于花生生长生理调节作用的报道更少。鉴于此,本研究以花生为试验材料,旨在探讨纳米碳点对花生幼苗生长及相关生理生化指标的影响,以期为纳米碳点在花生生产中的应用提供理论依据。
1 材料和方法
1.1 供试材料
纳米碳点(Carbon nanodots)由郑州大学材料物理工程学院提供,纳米碳点颗粒直径在 0~100 nm。纳米碳点悬浮液的配制:称取1.000 g纳米碳点,用适量去离子水溶解,后移入1 000 mL容量瓶中定容,保存备用。供试花生品种为河南农业大学2013年通过国家审(鉴)定的花生新品种农大花103。
1.2 试验设计
选取饱满、大小均匀一致的花生种子,洗净后用次氯酸钠消毒,再用蒸馏水冲洗干净待用。纳米碳点设置5个质量浓度梯度,T1(50 mg/L)、T2(130 mg/L)、T3(180 mg/L)、T4(250 mg/L)、T5(500 mg/L),配制好的纳米碳点溶液注意避光保存。设清水(0 mg/L)处理作为对照(CK)。在每个玻璃瓶(直径10 cm)中放入10粒种子,每个处理6次重复。玻璃瓶中纳米溶液的使用量均为10 mL,每天更换1次溶液。将所有的玻璃瓶放入25 ℃恒温光照培养箱中,光照/黑暗为10 h/14 h。处理3 d和7 d后分别观察种子的萌发情况;处理15 d后调查花生幼苗根长、苗高、根条数、根鲜质量、地上部鲜质量、根干质量、地上部干质量等形态指标,同时取各处理相同部位的新鲜叶片和根,测定抗氧化酶超氧化物歧化酶(SOD) 活性、过氧化物酶(POD) 活性、过氧化氢酶(CAT)活性、丙二醛(MDA)含量、可溶性糖含量、根系活力等。
1.3 测定项目
1.3.1 发芽势和发芽率的测定 处理后3 d和7 d,分别统计种子的发芽数,并且计算发芽势和发芽率。计算方法:发芽势= 萌发的种子/全部种子 ×100% (以根伸出种皮为萌发);发芽率=发芽的种子/全部种子 ×100% (以根长超过种子长度一半为发芽)。
1.3.2 幼苗生长状况的调查 将花生幼苗取出并用去离子水冲洗干净,滤纸吸干水分,分别调查苗高、根长、根条数、地上部鲜质量、地下部鲜质量等。并将地上部和根分别放入105 ℃烘箱中杀青15 min,之后65 ℃烘干至恒质量。
1.3.3 生理生化指标的测定 根系活力的测定采用TTC(三苯基氯化四唑)方法[15],SOD活性的测定采用氮蓝四唑光化还原法[15];POD活性的测定采用愈创木酚法[15];CAT活性的测定采用紫外吸收法[15];MDA含量的测定采用硫代巴比妥酸法[15];可溶性糖含量的测定采用蒽酮比色法[15]。
1.4 数据分析
数据采用Excel 2013软件整理数据,使用SPSS 19.0进行统计分析和显著性检验。
2 结果与分析
2.1 不同质量浓度纳米碳点对花生种子萌发的影响
由表1可以看出,不同质量浓度的纳米碳点均可促进花生种子的萌发,且随着纳米碳点质量浓度的升高,花生种子的发芽势和发芽率均表现出先升高后降低的趋势。其中,以质量浓度为180 mg/L (T3) 的纳米碳点处理效果最佳,与CK相比,发芽势和发芽率分别提高了15,20百分点。同时,由图1可以看出,在纳米碳点处理7 d后,质量浓度为180 mg/L的纳米碳点处理花生种子整体发芽效果明显好于其他处理和CK,表现为花生胚根生长较快,发芽相对整齐一致等,表明适宜质量浓度的纳米碳点溶液处理可以有效促进花生种子的萌发。
表1 不同质量浓度纳米碳点对花生种子发芽势和发芽率的影响
Tab.1 Effect of different quality concentrations of carbon nanodots on the seed germination of peanut %
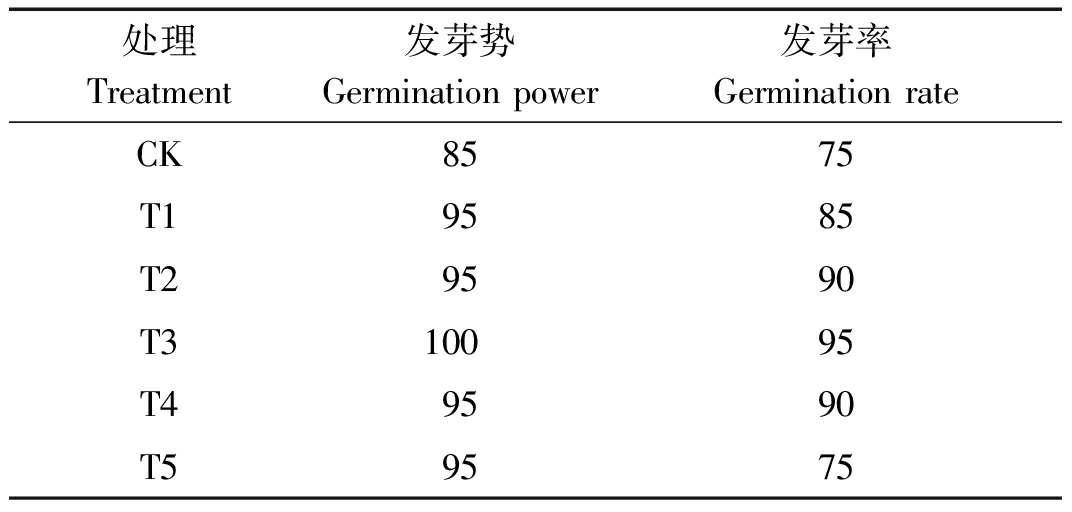
处理Treatment发芽势Germination power发芽率Germination rateCK8575T19585T29590T310095T49590T59575

图1 不同质量浓度纳米碳点处理7 d后花生种子发芽情况
Fig.1 Germination of peanut seeds treated with different quality concentrations of carbon nanodots for 7 days
2.2 不同质量浓度纳米碳点对花生幼苗根冠比的影响
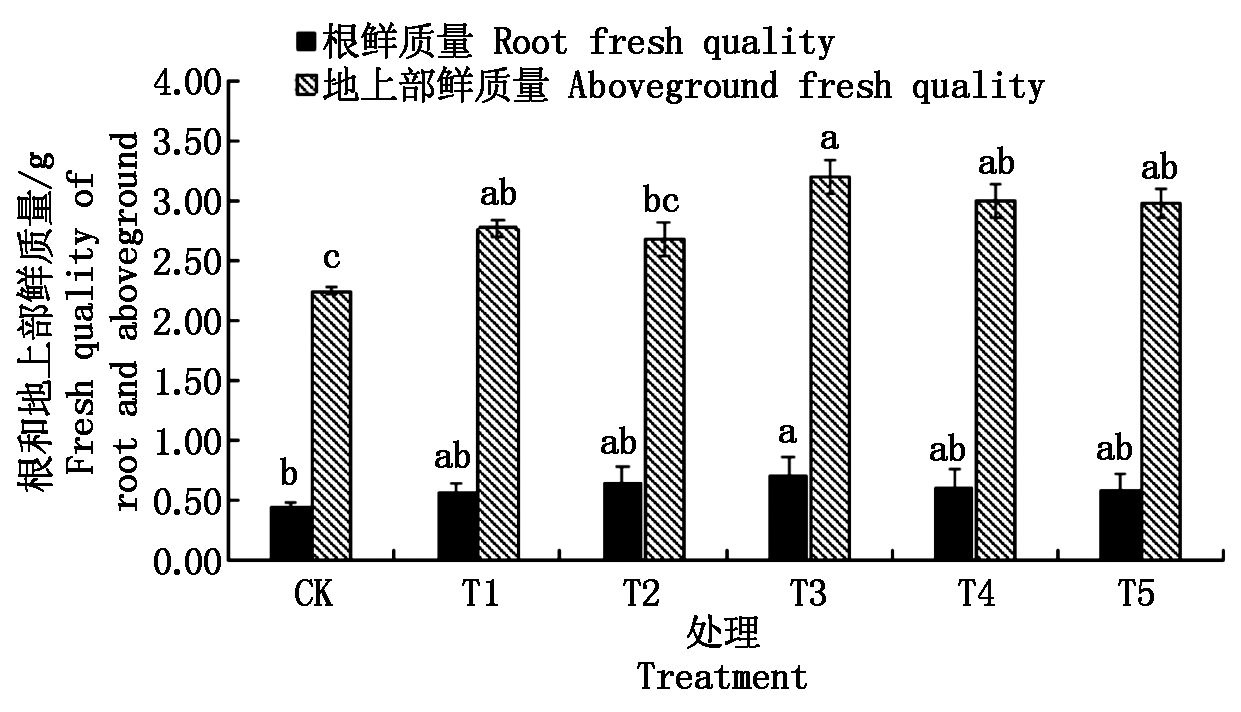
根冠比可反映植株地上和地下部生长发育情况,其值高则表明根系机能活性强,其值低则表明活性弱[16]。图2表明,不同质量浓度的纳米碳点处理均可以提高花生幼苗的根鲜质量和地上部鲜质量,在处理质量浓度为0~500 mg/L时,随着质量浓度的升高其根鲜质量和地上部鲜质量基本表现出先升后降的趋势。各处理中,以质量浓度为180 mg/L(T3)的处理效果最佳,其幼苗的根鲜质量、地上部鲜质量分别比对照处理增加了55.93%,42.22%。不同质量浓度纳米碳点处理的花生幼苗根冠比表现为T2>T3>T1>T4>CK>T5,虽然经过纳米碳点处理(T5除外)的花生幼苗根冠比略高于对照处理,但各处理间差异并未达到显著水平(图3)。
不同小写字母表示处理间差异显著(P<0.05) 。图3-6、表2同。
Different lowercases indicate significant differences at 0.05 level among different treatments. The same as Fig.3-6, Tab.2.
图2 不同质量浓度纳米碳点处理对花生幼苗的根鲜质量和地上部鲜质量的影响
Fig.2 Effects of different quality concentrations of carbon nanodots on root and aboveground fresh quality of peanut seedling
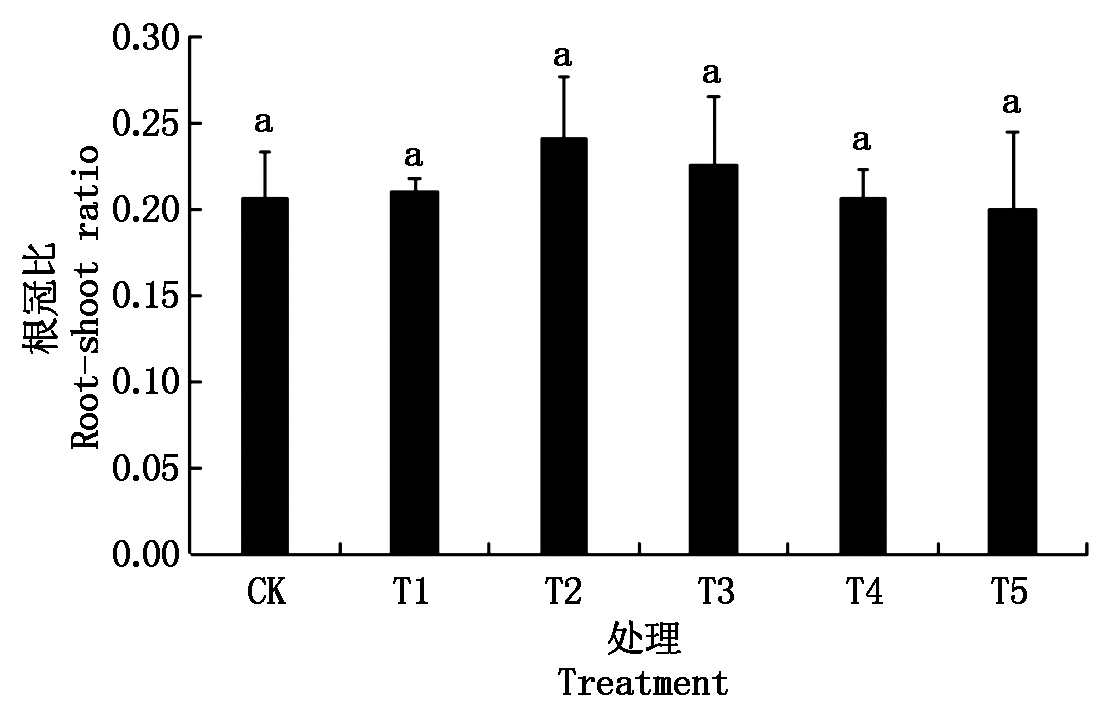
图3 不同质量浓度纳米碳点处理对花生幼苗根冠比的影响
Fig.3 Effect of different quality concentrations of carbon nanodots on the root-shoot ratio of peanut seeding
2.3 不同质量浓度纳米碳点对花生幼苗生长及干物质积累的影响
由表2可知,不同质量浓度的纳米碳点对花生幼苗的主根长、苗高、根条数、根质量、地上部质量均有不同程度的促进作用,且随着纳米碳点质量浓度的升高,花生幼苗的各项农艺指标也表现出先增加后减少的趋势。例如,不同质量浓度纳米碳点处理下花生幼苗的主根长表现为T3>T2>T4>T1>T5>CK;而苗高则表现为T3>T2>T1>T4>T5>CK。其中,T3(180 mg/L)处理的花生幼苗主根长、苗高分别比对照处理增加了36.84%,46.24%。而幼苗的根干质量、地上部干质量同样也表现出同样的规律,即以质量浓度为180 mg/L(T3)的处理效果最佳,分别比对照增加了31.03%,47.03%。但在根条数方面,以质量浓度为50 mg/L(T1)处理的效果最好,比对照显著增加了81.08%,但与其他各处理间无显著性差异。
表2 不同质量浓度纳米碳点处理对花生幼苗生长的影响
Tab.2 Effect of different quality concentrations of carbon nanodots on the growth situation of peanut seeding
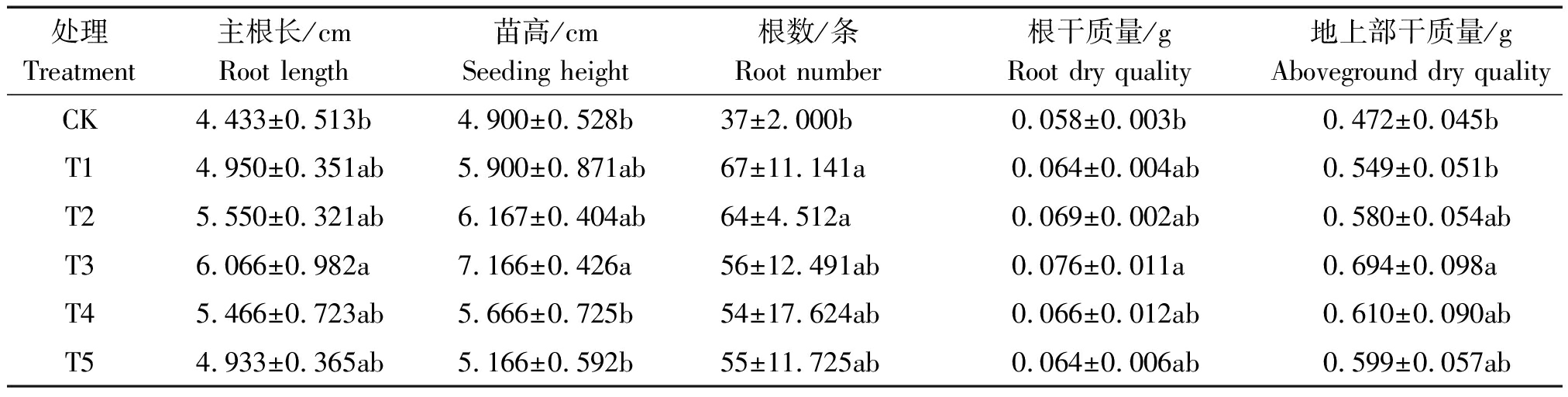
处理Treatment主根长/cmRoot length苗高/cmSeeding height根数/条Root number根干质量/gRoot dry quality地上部干质量/gAboveground dry qualityCK4.433±0.513b4.900±0.528b37±2.000b0.058±0.003b0.472±0.045bT14.950±0.351ab5.900±0.871ab67±11.141a0.064±0.004ab0.549±0.051bT25.550±0.321ab6.167±0.404ab64±4.512a0.069±0.002ab0.580±0.054abT36.066±0.982a7.166±0.426a56±12.491ab0.076±0.011a0.694±0.098aT45.466±0.723ab5.666±0.725b54±17.624ab0.066±0.012ab0.610±0.090abT54.933±0.365ab5.166±0.592b55±11.725ab0.064±0.006ab0.599±0.057ab
2.4 不同质量浓度纳米碳点对花生幼苗根系活力的影响
由图4可以看出,不同质量浓度的纳米碳点处理均可显著提高花生幼苗的根系活力,且根系活力随着纳米碳点质量浓度的升高表现出先升后降的趋势。各处理间的根系活力表现为T3>T2>T4>T1>T5>CK,尤其处理质量浓度为180 mg/L(T3)时,幼苗的根系活力比CK处理显著提高了4.5倍。
2.5 不同质量浓度纳米碳点对花生幼苗抗氧化酶活性及MDA含量的影响
从图5可知,在纳米碳点质量浓度为0~500 mg/L时,花生幼苗叶片中的抗氧化酶(SOD、POD、CAT)活性总体表现为随着纳米碳点质量浓度的增加,其抗氧化酶活性呈先升高后下降的趋势。花生幼苗的SOD活性总体表现为T3>T4>T5>T2>T1>CK。其中,以质量浓度为T3(180 mg/L)的SOD活性最强,与对照相比,其SOD活性提高了22.73%。花生幼苗的POD活性同样也以T3处理效果最好,与CK相比,T3处理的POD活性提高了5.32倍。CAT可以清除植物组织中的H2O2,因此CAT活性的强弱与植物的抗逆性密切相关[17]。从图5同样可以看出,在各处理中,以T3处理的CAT活性最强,与对照相比,其CAT活性显著提高了36.81%。MDA是膜质过氧化分解的产物之一,其含量可代表膜质过氧化程度,间接反映植物组织的抗氧化能力[18]。图5表明,经纳米碳点处理的花生幼苗叶片MDA含量均低于CK,以T3处理的MDA含量下降幅度最大,比对照显著降低了36.92%。方差分析同样表明,T3处理的MDA含量也显著低于其他处理。
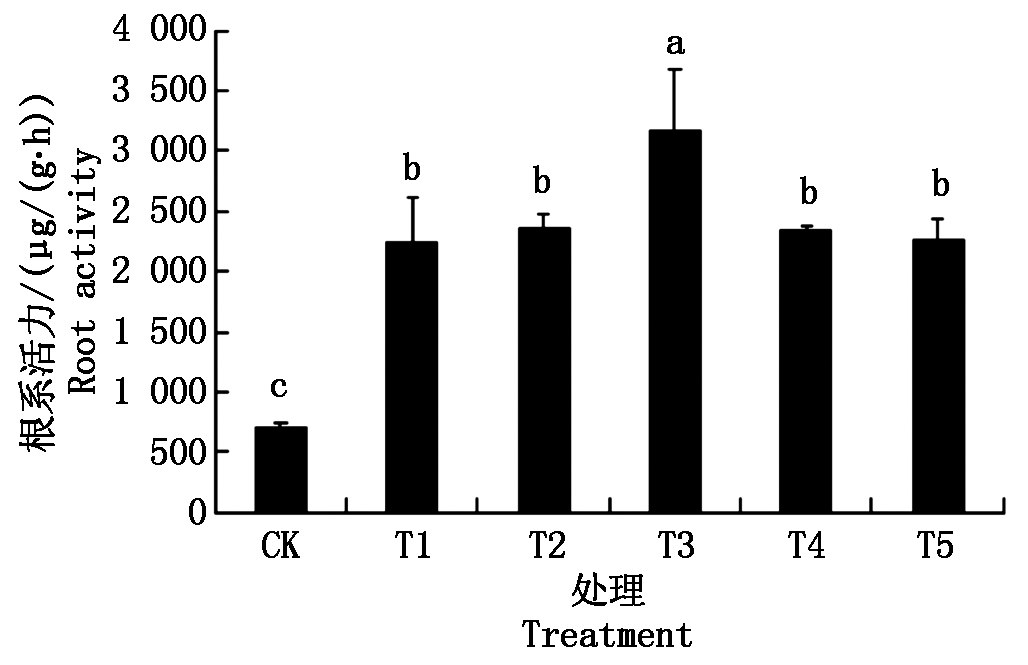
图4 不同质量浓度纳米碳点对花生幼苗根系活力的影响
Fig.4 Effect of different quality concentrations of carbon nanodots on the root activity of peanut seeding
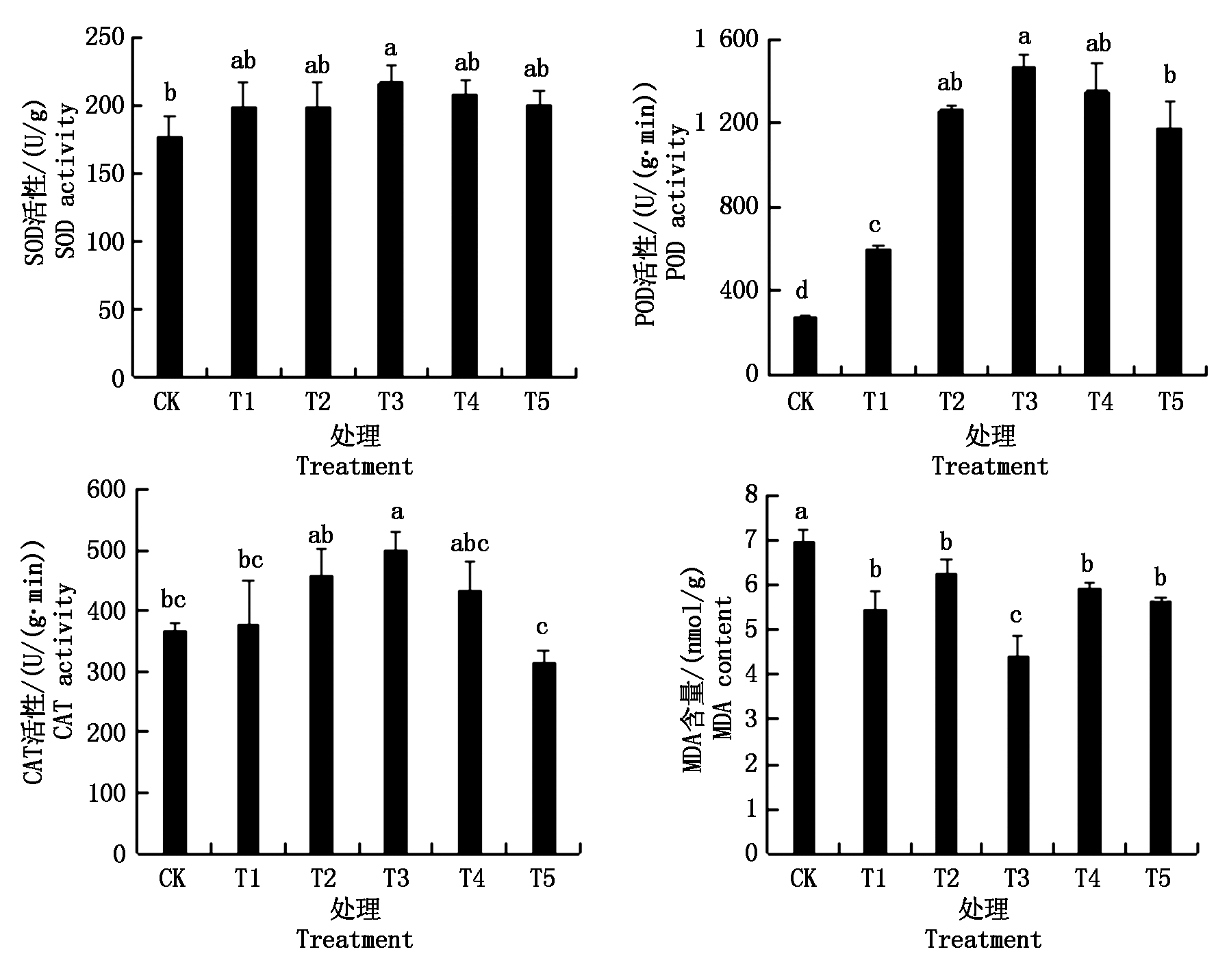
图5 不同质量浓度纳米碳点对SOD、 POD、CAT活性及MDA含量的影响
Fig.5 Effects of SOD, POD, CAT activity and MDA content with different carbon nanodots quality concentrations treatments
2.6 不同质量浓度纳米碳点对花生幼苗叶片可溶性糖含量的影响
由图6可以看出,不同质量浓度的纳米碳点对花生幼苗叶片可溶性糖含量的影响均不相同。除了质量浓度为130 mg/L的处理外,其他各处理叶片中的可溶性糖的含量与CK相比均表现为不同程度的提高。在各处理花生叶片中可溶性糖的含量总体表现为T4>T5>T3>T1>CK>T2。其中,T4、T5、T3处理的可溶性糖含量分别比对照提高了27.3%,26.1%,11.4%。T4、T5处理的可溶性糖含量略高于T3处理,但方差分析表明,差异未达到显著水平。
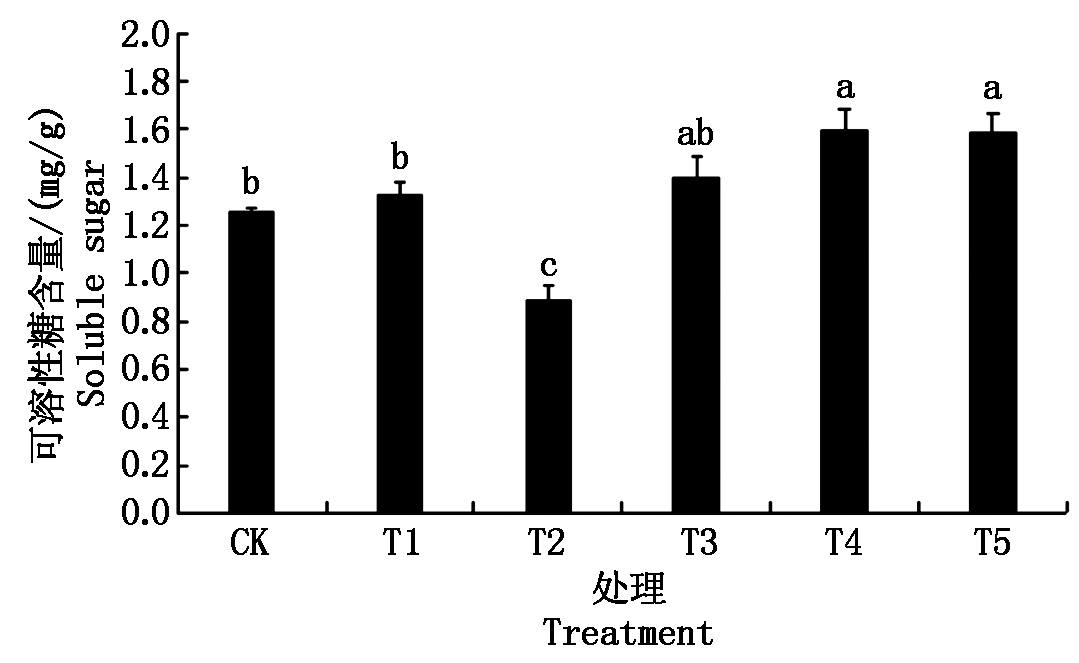
图6 不同质量浓度纳米碳点处理对可溶性糖含量的影响
Fig.6 Effects of different quality concentrations carbon nanodots treatments on soluble sugar content
3 结论与讨论
3.1 不同质量浓度纳米碳点对花生种子萌发和幼苗生长的影响
关于纳米材料对植物生长发育的影响,前人已做了一些研究。Khodakovskaya[19] 等的试验表明,纳米粒子能够穿透番茄种子,影响种子的生物活性,从而促进种子的发芽。陆长梅等[8]的研究则指出,纳米复合材料(含TiO2、SiO2等)可促进大豆种子的萌发和幼苗的生长发育。而周述波等[20]通过使用纳米瓷罐、纳米网、纳米胶片3种纳米复合材料处理鲜食型糯玉米香白糯种子,研究发现3种纳米材料均可提高种子的发芽势,后期的盆栽试验进一步表明,纳米材料促进了香白糯对水分的吸收,提高了植株的营养生长和干物质的积累。姜余梅等[21]的研究结果则同样表明,质量浓度为50~100 μg/mL的碳纳米管可促进水稻种子的萌发和幼苗的生长,提高根系活力。花生是世界上最重要的油料作物之一,深入研究纳米材料对花生种子萌发和幼苗生长的影响意义重大。
本研究结果表明,不同质量浓度的纳米碳点处理均对花生的种子萌发和幼苗的生长发育具有明显的生理调节作用,尤其质量浓度为180 mg/L的纳米碳点可显著提高花生种子的发芽势和发芽率,促进芽体的生长,增加花生幼苗的苗高、主根长、根鲜质量、地上部鲜质量、根干质量、地上部干质量,提高幼苗的根系活力。这可能与纳米碳点能够穿透花生种子,导致种子本身对水分吸收的加强,促进种子的代谢,从而使种子有更高的发芽率和生物量有关[22]。但在本研究中同样发现,高质量浓度的纳米碳点处理对花生的种子萌发和幼苗生长存在一定的抑制作用。例如,当质量浓度为500 mg/L时,其花生的发芽势、发芽率、主根长、苗高、根鲜质量、根干质量、地上部鲜质量、地上部干质量,根系活力均低于180 mg/L的处理,这与金玉等[23]在黑麦草中的研究结果一致。
3.2 不同质量浓度纳米碳点对花生幼苗相关生理生化指标的影响
POD、SOD 和CAT 是植株体内活性氧用以清除系统中酶促子系统的3种重要的保护酶,能够阻止活性氧(ROS)在植物体内的积累[24]。而可溶性糖则是调控植物代谢和发育的重要信号物质,可溶性糖在植物的生长发育过程中发挥着重要的作用[25]。目前,关于不同的纳米材料对于植物生长发育调控效应的研究结果说法不一。例如,刘振国等[26]的研究表明,高质量浓度的纳米氧化铜可明显降低紫花苜蓿幼苗的抗氧化活性,甚至对其幼苗的生长产生毒害作用。金盛杨等[27]的研究则指出,纳米氧化铜对小麦幼苗的生长表现出毒害效应,且质量浓度越大,效应越明显。而邹丽莎[28]的结果则表明,不同质量浓度的纳米氧化锌处理可以明显提高玉米幼苗叶片的SOD活性,但对POD活性的影响并不明显。本研究结果表明,利用不同质量浓度的纳米碳点处理可显著降低花生幼苗叶片MDA的含量,提高幼苗体内可溶性糖的含量,增强花生幼苗SOD、POD、CAT的活性,综合以上指标,以质量浓度为180 mg/L的生理调节效应最为明显。纳米材料对植物的调控效应可能与不同的纳米材料类型,以及不同的植物的耐受性有关,但无论是正向调控效应,还是负向调控效应,其作用机制尚需进一步明确。
[1] Cao L, Wang X, Meziani M J, Lu F S, Wang H F, Luo P J G, Lin Y, Harruff B A, Vecal L M, Murray D, Xie S Y, Sun Y P. Carbon dots for multiphoton bioimaging[J]. Journal of American Chemical Society, 2007, 129(37): 11318-11319. doi: 10.1021/ja073527l.
[2] Theodoros C, Athanasla K, Lamprini S, Apostolos A, Anastasios T, Constantine S. Two of a kind but different: Luminescent carbon quantum dots from citrus peels for iron and tartrazine sensing and cell imaging[J]. Talanta, 2017, 175: 305-312. doi: 10.1016/j.talanta.2017.07.053.
[3] Dong F, Zhao Z W, Sun Y J, Zhang Y X, Yan S, Wu Z B. An advanced semimetal-organic bi spheres-g-C3N4 nanohybrid with SPR-enhanced visible-light photocatalytic performance for NO purification[J]. Environmental Science & Technology, 2015, 49(20): 12432-12440. doi: 10.1021/acs.est.5b03758.
[4] Shen Y F,Juan S R,Markus R W,Axel H,Christian T,Lee J O,Heeg S,Hatting B,Reich S,Seki A,Seki S,Yoshida K,Sukkmaran S B,Helmuth M,Nakanish T.Assembly of carbon nanotubes and alkylated fullerenes: Nanocarbon hybrid towards photovoltaic applications[J]. Chemical Science, 2011, 2(11): 2243-2250. doi: 10.1039/C1SC00360G.
[5] Antonio B F, Marta S. Hierarchical microporous/mesoporous carbon nanosheets for high-performance supercapacitors[J]. ACS Applied Materials & Interfaces, 2015, 7(7): 4344. doi: 10.1021/am508794f.
[6] 梁宏宇, 胡迪, 肖红梅. 纳米技术在果蔬贮藏保鲜中的应用[J]. 保鲜与加工, 2008, 8(5): 51-54. doi: 10.3969/j.issn.1009-6221.2008.05.018.
Liang H Y, Hu D, Xiao H M. Application of nanotechnology for preservation of fruit and vegetable[J]. Storag and Process, 2008, 8(5): 51-54.
[7] 谢寅峰, 姚晓华. 纳米TiO2对油松种子萌发及幼苗生长生理的影响[J]. 西北植物学报, 2009, 29(10): 2013-2018.
Xie Y F, Yao X H. Effects of nano-meter TiO2 on germination and growth physiology of pinus tabulae formis[J]. Acta Agriculturae Boreali-Sinica, 2009, 29(10): 2013-2018.
[8] 陆长梅, 张超英, 温俊强, 吴国荣, 陶明煊. 纳米材料促进大豆萌芽、生长的影响及其机理研究[J].大豆科学, 2002, 21(3): 168-171. doi: 10.3969/j.issn.1000-9841.2002.03.002.
Lu C M, Zhang C Y, Wen J Q, Wu G R, Tao M X. Research of the effect of nanomater materials on germination and growth enhancement of glycine max and its mechanism[J]. Soybean Science, 2002, 21(3): 168-171.
[9] 李大力, 李丹, 汪信. 无机纳米粒子对人类细胞培养及植物组培苗影响的研究[J]. 江苏师范大学学报(自然科学版), 2002, 20(2): 51-53. doi: 10.3969/j.issn.1007-6573.2002.02.016.
Li D L, Li D, Wang X. Effects of inorganic nanoparticles on human cells reproduction and bramble tissue culture[J]. Journal of Jiangsu Normal University(Natural Science Edition), 2002, 20(2): 51-53.
[10] 涂庆华, 李娘辉, 李玲. 纳米化的二氧化钛促进绿豆下胚轴不定根形成[J]. 植物生理学报, 2005, 41(3): 313-315. doi: 10.13592/j.cnki.ppj.2005.03.010.
Tu Q H, Li N H, Li L. The promotive effect of nanometer TiO2 on the adventitious rooting of mung bean hypocotyl[J]. Plant Physlology Communications, 2005, 41(3): 313-315.
[11] 王振红, 罗专溪, 颜昌宙, 杨环清. 纳米氧化锌对绿豆芽生长的影响[J]. 农业环境科学学报, 2011, 30(4): 619-624.
Wang Z H, Luo Z X, Yan C Z, Yang H Q. Effects of nano-ZnO particles on the growth of green bean sprouts[J]. Journal of Agro-Environment Science, 2011, 30(4): 619-624.
[12] 汪冰, 丰伟悦, 赵宇亮, 邢更妹, 柴之芳, 王海芳, 贾光. 纳米材料生物效应及其毒理学研究进展[J]. 中国科学(化学), 2005, 35(1): 1-10. doi: 10.3321/j.issn:1006-9240.2005.01.001.
Wang B, Feng W Y, Zhao Y L, Xing G M, Chai Z F, Wang H F, Jia G. Advances in biological effects and toxicology of nanomaterials[J]. Scientia Sinica(Chimica), 2005, 35(1): 1-10.
[13] Su M Y, Hong F S, Liu C, Wu X, Liu X Q, Chen L, Gao F Q, Yang F, Li Z R. Effects of nano-anatase TiO2 on absorption, distribution of light, and photoreduction activities of chloroplast membrane of spinach[J]. Biological Trace Element Research, 2007, 118(2): 120-130. doi: 10.1007/s12011-007-0006-z.
[14] 刘娟, 汤丰收, 张俊, 臧秀旺, 董文召, 易明林, 郝西. 国内花生生产技术现状及发展趋势研究[J].中国农学通报, 2017, 33(22): 13-18.
Liu J, Tang F S, Zhang J, Zang X W, Dong W Z, Yi M L, Hao X. Current status and development trends of peanut production technology in China[J]. Chinese Agricultural Science Bulletin, 2017, 33(22): 13-18.
[15] 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2000.
Li H S. Principle and technology of plant physiological and biochemical experiments[M]. Beijing: Higher Education Press, 2000.
[16] 赵成刚. 根冠比与烟草品质的关系[J]. 科技资讯, 2007(23): 237. doi: 10.16661/j.cnki.1672-3791.2006.18.108.
Zhao C G. The relationship between root-shoot ratio and tobacco quality[J]. Science & Technology Information, 2007(23): 237.
[17] 李明, 王根轩. 干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响[J]. 生态学报, 2002, 22(4): 503-507. doi: 10.3321/j.issn:1000-0933.2002.04.008.
Li M, Wang G X. Effect of drought stress on activities of cell defense enzymes and lipid peroxidation in glycyrrhiza uralensis seedlings[J]. Acta Ecologica Sinica, 2002, 22(4): 503-507.
[18] 乔绍俊, 李会珍, 张志军, 张鑫. 盐胁迫对不同基因型紫苏种子萌发、幼苗生长和生理特征的影响[J]. 中国油料作物学报, 2009, 31(4): 499-502. doi: 10.3321/j.issn:1007-9084.2009.04.017.
Qiao S J, Li H Z, Zhang Z J, Zhang X. Effect of salinity on seed germination, seedling growth and physiological changes in perilla frutescens[J]. Chinese Journal of Oil Crop Sciences, 2009, 31(4): 499-502.
[19] Khodakovskaya M, Dervishi E, Mahmood M, Xu Y, Li Z, Watanabe F, Biris A S. Carbon nanotubes are able to penetrate plant seed coat and dramatically affect seed germination and plant growth[J]. ACS Nano, 2009, 3(10): 3221-3227. doi: 10.1021/nn900887m.
[20] 周述波, 贺立静, 贺立红. 纳米材料处理水对糯玉米生长及其生理变化的影响[J]. 玉米科学, 2010, 18(1): 87-89,95. doi: 10.13597/j.cnki.maize.science.2010.01.031.
Zhou S B, He L J, He L H. Effects of treated water of nano devices on waxy corn growth and physiological changes[J]. Journal of Maize Sciences, 2010, 18(1): 87-89,95.
[21] 姜余梅, 刘强, 赵怡情, 刘清岱, 王芳, 华泽田. 碳纳米管对水稻种子萌发和根系生长的影响[J]. 湖北农业科学, 2014(5): 1010-1012. doi: 10.14088/j.cnki.issn0439-8114.2014.05.039.
Jiang Y M, Liu Q, Zhao Y Q, Liu Q D, Wang F, Hua Z T. Effects of carbon nanotubes on seed germination and root growth of rice[J].Hubei Agricultural Sciences, 2014(5): 1010-1012.
[22] 刘尚杰. 石墨烯对水稻种子萌发及幼苗生长的影响[D]. 荆州:长江大学, 2013.
Liu S J. Effects of graphene on seed germination and seedling growth of rice[D]. Jingzhou: Yangtze University, 2013.
[23] 金玉, 梁淑轩, 刘微, 申世刚. 纳米炭黑对镉胁迫下黑麦草种子萌发和幼苗生长的影响[J]. 科学技术与工程, 2014, 14(36): 12-16. doi: 10.3969/j.issn.1671-1815.2014.36.003
Jin Y, Ling S X, Liu W, Shen S G. Effects of adding nano-carbon black on ryegrass seeds germination and seedling growth under cadmium stress[J]. Science Technology and Engineering, 2014, 14(36): 12-16.
[24] 严重玲, 洪业汤, 林鹏, 王世杰, 杨先科, 付舜珍, 朱克勇, 吴善绮. 酸雨胁迫下稀土元素对菠菜膜保护系统作用[J]. 生态学报, 1999(4): 543-545. doi: 10.1088/0256-307X/15/12/025.
Yan Z L, Hong Y T, Lin P, Wang S J, Yang X K, Fu S Z, Zhu K Y, Wu S Q. The effect of acid rain stress on membrane protective system of spinach and the conservation of rare earth elements[J]. Acta Ecologica Sinica, 1999(4): 543-545.
[25] 吉增宝, 王进鑫, 李继文, 薛设, 张慕黎. 不同季节干旱及复水对刺槐幼苗可溶性糖含量的影响[J]. 西北植物学报, 2009, 29(7): 1358-1363. doi: 10.3321/j.issn:1000-4025.2009.07.011.
Ji Z B, Wang J X, Li J W, Xuan S, Zhang M L. Dynamic changes of soluble sugar in the seedlings of robinia pseudoacacia under drought stress and rewatering in different seasons[J]. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(7): 1358-1363.
[26] 刘振国, 王伟, 王天慧. 纳米氧化铜对紫花苜蓿种子发芽和幼苗生长的毒害作用[J]. 上海农业学报, 2014, 30(4): 47-51. doi: 10.3969/j.issn.1000-3924.2014.04.011.
Liu Z G, Wang W, Wang T H. Toxicity of nano-copper oxide on the seed germination and seedling growth of alfalfa[J]. Acta Agriculturae Shanghai, 2014, 30(4): 47-51.
[27] 金盛杨, 王玉军, 汪鹏, 李连祯, 周东美. 不同培养介质中纳米氧化铜对小麦毒性的影响[J]. 生态毒理学报, 2010, 5(6): 842-848.
Jin S Y, Wang Y J, Wang P, Li L Z, Zhou D M. Influence of culture media on the phytotoxicity of CuO nanoparticles to wheat(Triticum aestivum L.)[J]. Asian Journal of Ecotoxicology, 2010, 5(6): 842-848.
[28] 邹丽莎. 纳米氧化锌的玉米吸收积累与毒性效应初探[D]. 杭州:浙江大学,2014.
Zhou L S. The uptake,accumulation and phytotoxicity of ZnO nanoparticles to maize(Zea mays L.)[D]. Hangzhou: Zhejiang University, 2014.