新疆核桃(Juglans regia L.)壳薄、早实丰产、出仁率高且种仁饱满,其中纸皮核桃品质尤为突出,成为近年消费热点[1]。纸皮核桃壳厚小于1 mm (大多在0.5~0.8 mm),出仁率达65%以上,种仁饱满,内果皮发育完整,其中温138核桃是纸皮核桃栽培园中发现的突变株,其平均出仁率高达83.2%,产量极高,果壳极薄、极易脱皮,但壳面(内果皮发育不完整)开裂导致露仁,是适于核桃深加工的优质种质资源[2-3]。
木质素是核桃内果皮(硬壳)的主要成分,且是内果皮中难分解的大分子有机物质,其沉积出现在次生加厚的细胞壁中以提高细胞壁的强度及硬度,对核桃内果皮发育影响较大[4-5]。其中4CL是起到连接木质素前体及各个分支反应作用的关键限速酶,在木质素生物合成途径中4CL分别催化对-香豆酸、咖啡酸、阿魏酸和芥子酸生成相应的辅酶A酯,促进木质素单体的合成[6-7]。通过活化基团生成相应辅酶A酯,从而促进木质素单体生成单加氧酶[8]。目前已从慈竹(Neosinocalamus affinis)[9]、青稞(Hulless barey)[10]、亚麻(Linum usitatissimum L.)[11]、芒果(Mangifera indica)[12]、白桦(Betula platyphylla)[13]、甜高粱(Sorghum dochna (Forssk.) Snowden)[14]等多种植物中克隆并编码4CL基因,在拟南芥、烟草、白杨、毛白杨等植物的研究中发现,抑制4CL基因表达会引起植物体内木质素含量显著降低,其中S/G比值却会根据植物种类的不同而有所差异,在拟南芥植株中G-木质素的含量显著降低,在烟草植株中S-木质素的含量显著降低,而在白杨中植株S/G却没有明显变化[15-16]。然而关于温138核桃露仁现象及其与之相关的核桃内果皮硬化过程中木质素沉积的系统分子机制尚不明确。
本研究拟通过对温138、纸皮核桃内果皮木质素生物合成途径中关键酶4CL基因进行克隆及时空表达模式的分析来研究4CL基因的表达特性,旨在为进一步研究4CL基因在核桃不同发育时期的表达模式及为核桃内果皮木质素的基因改造提供参考。
1 材料和方法
1.1 试验材料
供试材料露仁核桃温138及硬壳发育完整纸皮核桃,均采自新疆维吾尔自治区温宿县核桃木本粮油林场。在果实膨大期后期6月7日(约花后51 d)至硬核期7月26日(约花后100 d)采样,采样覆盖整个核桃内果皮硬化期。
1.2 核桃内果皮总RNA提取及cDNA合成
利用EZNA Plant RNA Kit试剂盒(Omega公司)提取核桃内果皮中总RNA。用1%琼脂糖凝胶电泳方法检测及鉴定PCR产物的浓度、纯度和亮度。采用cNDA合成试剂盒反转录合成cDNA。
1.3 核桃内果皮4CL基因的克隆
利用Premier 5.0设计引物,温138核桃引物4CL-F:5′-TCAACTTGGAAGACCAGCAGCCA-3′及4CL-R:5′-AGCCTCCGCTCTCACCAGCA-3′,RT-PCR反应体系20 μL。扩增条件:94 ℃/3 min(预变性);94 ℃ 45 s(变性),61 ℃ 45 s (退火),72 ℃ 2 min (延伸),31个循环;72 ℃ 8 min (继续延伸);4 ℃保存。用1%琼脂糖凝胶电泳检测PCR产物并成像,后将扩增的目的条带进行回收并连接到PMD-18T载体,筛选出阳性克隆测序。
1.4 4CL基因生物信息学分析
根据WJ-4CL、ZJ-4CL基因序列,推导氨基酸序列,采用NCBI数据库Blast功能进行在线4CL序列匹配度、同源性分析;ORF Finder检测cDNA序列的开放阅读框;采用MAGA 5.1软件(Neighbor-Joining)构建4CL基因与其他相似性高的植物的系统进化树。运用ExPASy数据库ProtParam功能分析核桃内果皮WJ-4CL、ZJ-4CL蛋白的相对分子质量、氨基酸数量及理论等电点等相关理化性质。采用PredictProtein在线平台分析4CL蛋白二级结构,选用在线同源服务软件SWISS-MODEL预测4CL蛋白质三维结构。
1.5 4CL基因的表达分析
以18S为内参,采用实时荧光定量PCR (qRT-PCR)检测4CL基因的相对表达量。根据已克隆的核桃内果皮木质素4CL基因序列,按照标准荧光定量PCR引物原则,分别设计温138、纸皮核桃4CL基因荧光定量PCR引物,露仁种质温138核桃PCR引物4CL-WF:5′-AATCTCGGTGTTGGGAAGG-3′,4CL-WR:5′-CTTTGGAGGATTTCGCTTG-3′;硬壳完整种质纸皮核桃PCR引物4CL-ZF:5′-CTTGCTACTCAC CCATCCTAAC-3′,4CL-ZR:5′-CACTTGATCGCACC ACAAAA-3′;内参基因引物:NBQ-F:5′-AGTCGTAA CAAGGTTTCCGTAGGT-3′;NBQ-R: 5′-GCTGGGCAG GTATCGACAAT-3′。以温138及纸皮核桃8个时期的cDNA为模板,采用两步法进行Real-time PCR扩增,反应体系10 μL。扩增条件:95 ℃ 30 s,95 ℃ 5 s,40个循环;熔解曲线生成步骤:58 ℃ 30 s,72 ℃ 30 s,95 ℃ 15 s,55 ℃ 15 s,55 ℃ 20 min,95 ℃ 15 s。利用2-ΔΔCt方法[17]分别计算4CL基因在硬壳完整和露仁核桃内果皮发育过程中的表达量。
2 结果与分析
2.1 核桃内果皮总RNA的提取及检测
核桃内果皮中总RNA凝胶成像呈现较清晰完整的28S rRNA和18S rRNA条带,5S rRNA条带较模糊,28S rRNA的亮度是18S rRNA的2倍,测得核酸浓度A260/280为1.90~2.20,说明提取的总RNA有较高的纯度(图1)。
2.2 核桃内果皮4CL基因的克隆
以温138和纸皮核桃内果皮总RNA反转录后的cDNA为模板进行RT-PCR反应(图2),得到露仁核桃WJ-4CL基因及硬壳完整核桃ZJ-4CL基因。WJ-4CL基因片段长度为1 000 bp (含有552 bp的ORF),编码184个氨基酸,分子质量20.10 ku,理论等电点5.83,属于酸性蛋白;ZL-4CL基因片段长度1 000 bp (含有453 bp的ORF),编码151个氨基酸,分子质量16.52 ku,理论等电点9.35,属于碱性蛋白。
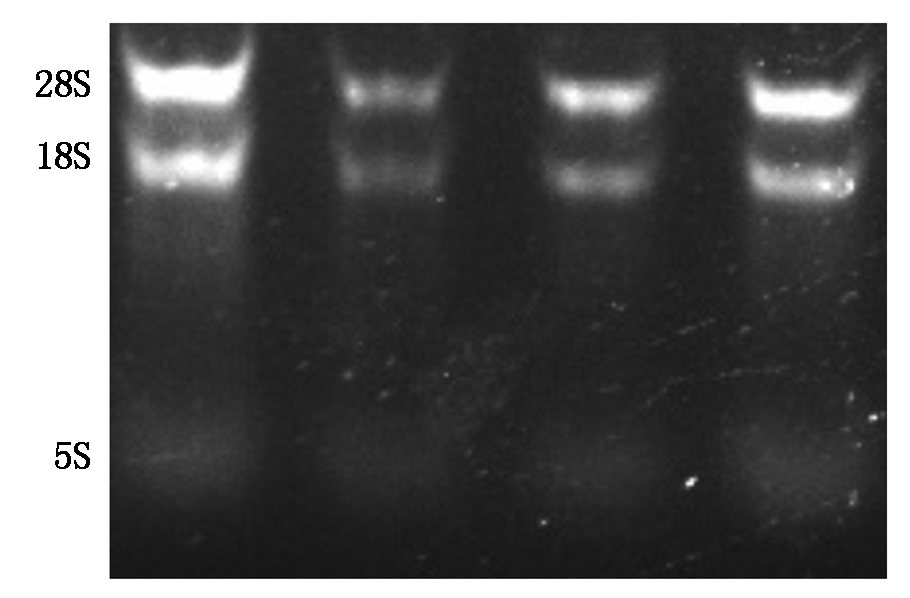
图1 电泳检测核桃内果皮总RNA
Fig.1 Electrophoresis of total RNA from walnut endocarp
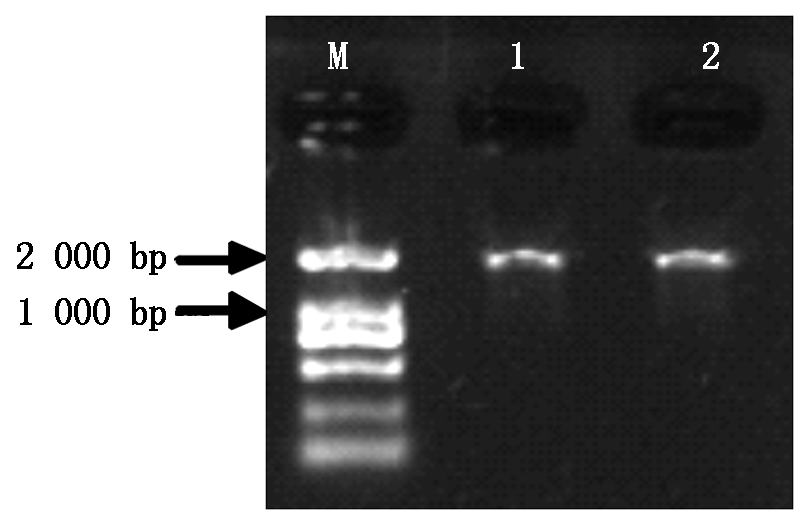
M.DL2000 DNA Marker; 1.温138核桃; 2.纸皮核桃。
M.DL2000 DNA Marker; 1.Wen 138 walnut; 2.Zhipi walnut.
图2 核桃内果皮4CL基因的保守区PCR产物
Fig.2 PCR product of 4CL gene conservative region in walnut endocarp
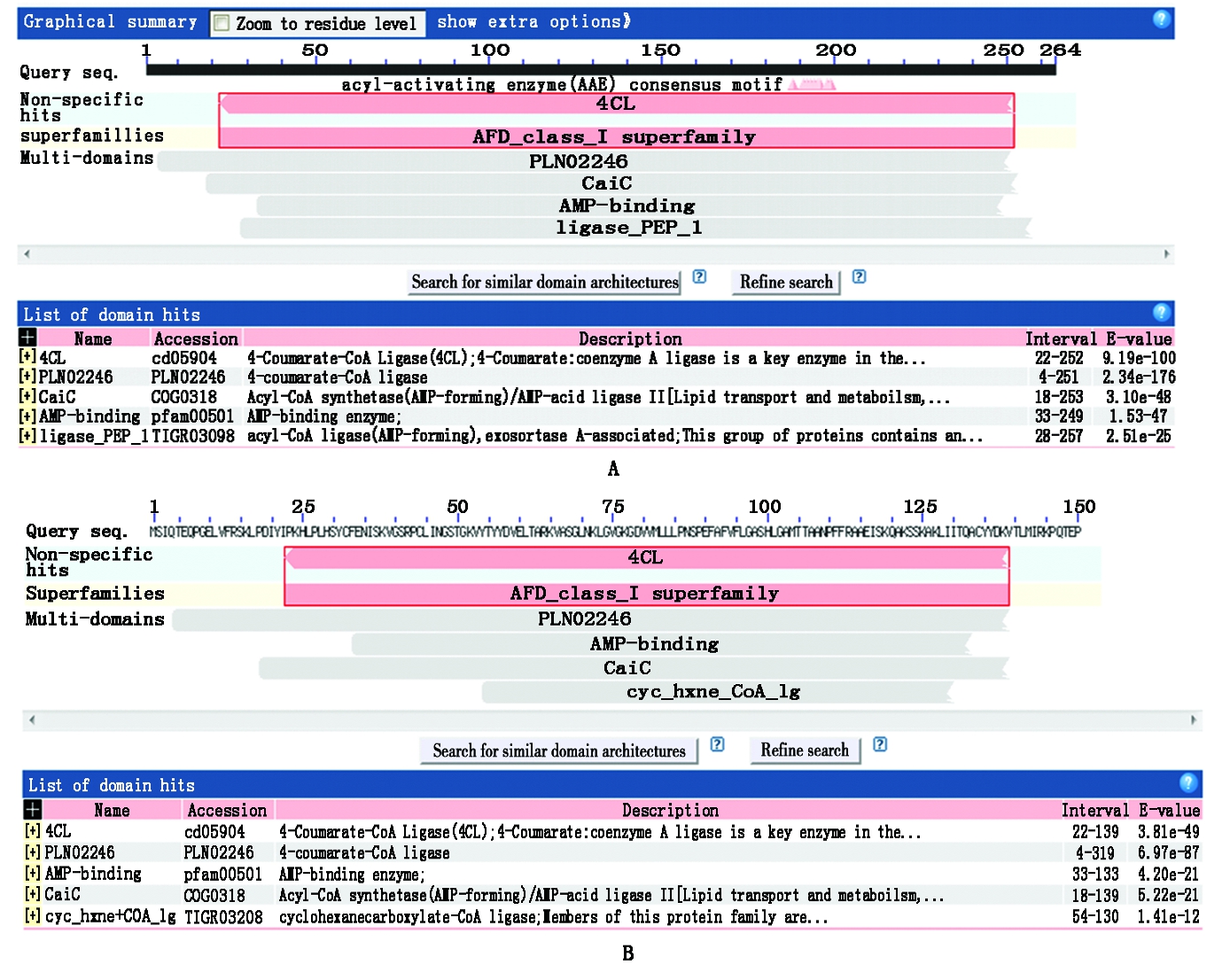
A.WJ-4CL基因的结构域分析; B.ZJ-4CL基因的结构域分析。
A.Domain analysis of WJ-4CL gene; B.Domain analysis of ZJ-4CL gene.
图3 4CL基因的结构域分析
Fig.3 Domain analysis of 4CL gene
2.3 4CL基因生物信息学分析
2.3.1 4CL基因序列分析 将本研究获得的2个基因相似性进行分析,发现与其他植物4CL基因序列有较高的匹配度。结果显示,核苷酸序列与光皮桦、白桦、欧洲白桦的4CL基因序列匹配度最高,其相似性达到83%以上,其中均与光皮桦的匹配度最高,相似性分别达到86%,83%。经NCBI数据库BlastP在线分析可知,WJ-4CL和ZL-4CL与光皮桦、白桦等其他植物推导氨基酸序列相似性均在70%以上。4CL推导氨基酸序列发现,WJ-4CL与ZL-4CL均存在一个4CL非特异性位点,WJ-4CL基因推导氨基酸序列存在PLN02246、AMP-binding、CaiC及ligase_PEP_1 4个功能结构域, ZL-4CL基因推导氨基酸序列含有cyc_hxne_CoA_lg、PLN02246、CaiC及AMP-binding 4个功能结构域,WJ-4CL与ZL-4CL推导氨基酸序列均为多结构域蛋白(AFD_class_Ⅰ)超家族(图3)。
2.3.2 4CL基因系统进化树分析 将本研究获得的WJ-4CL、ZJ-4CL基因核苷酸序列进行多重序列比对(图4),露仁种质温138克隆所得WJ-4CL基因和硬壳完整品种纸皮克隆所得ZJ-4CL基因序列一致性为74.76%。经过Blast在线比对,发现WJ-4CL及ZJ-4CL基因与其他植物的4CL基因具有较高的相似性,选取与WJ-4CL及ZJ-4CL相似性较高的19种植物构建核桃4CL基因的系统进化树(图5)。结果显示,核桃与乔木类植物亲缘关系较近,白桦、欧洲白桦与光皮桦等桦树较好的聚为一支,野草莓与覆盆子这2个蔷薇目植物聚为同一支,蔷薇科梨属的沙梨与芸香科花椒属花楸树聚为同一支,且自展值均为100,其他植物也各自与相近的植物聚为一支。硬壳完整核桃纸皮 (ZJ-4CL)与露仁核桃种质温138 (WJ-4CL)聚为同一支,这说明就4CL基因而言,硬壳完整核桃纸皮与露仁种质温138核桃的亲缘关系较近,但具有较远的遗传距离,可能由于4CL基因在不同品种间的差异性所导致。

图4 WJ-4CL及ZJ-4CL基因多重序列比对
Fig.4 Multiple sequence alignment of WJ-4CL and ZJ-4CL gene
2.4 4CL蛋白二级结构分析
WJ-4CL、ZJ-4CL蛋白的氨基酸序列在线预测分析(图6)。表明WJ-4CL蛋白含有32.34%的无规则卷曲和30.06%的α-螺旋,是WJ-4CL蛋白二级结构中最大量的结构元件,其次含有27.87%的延伸链和9.29%的β-转角等结构元件。ZJ-4CL蛋白主要含有39.33%的α-螺旋,是ZJ-4CL蛋白二级结构中最为重要的结构元件,其次含有28.00%延伸链、22.00%的无规则卷曲结构及10.67%的β-转角。
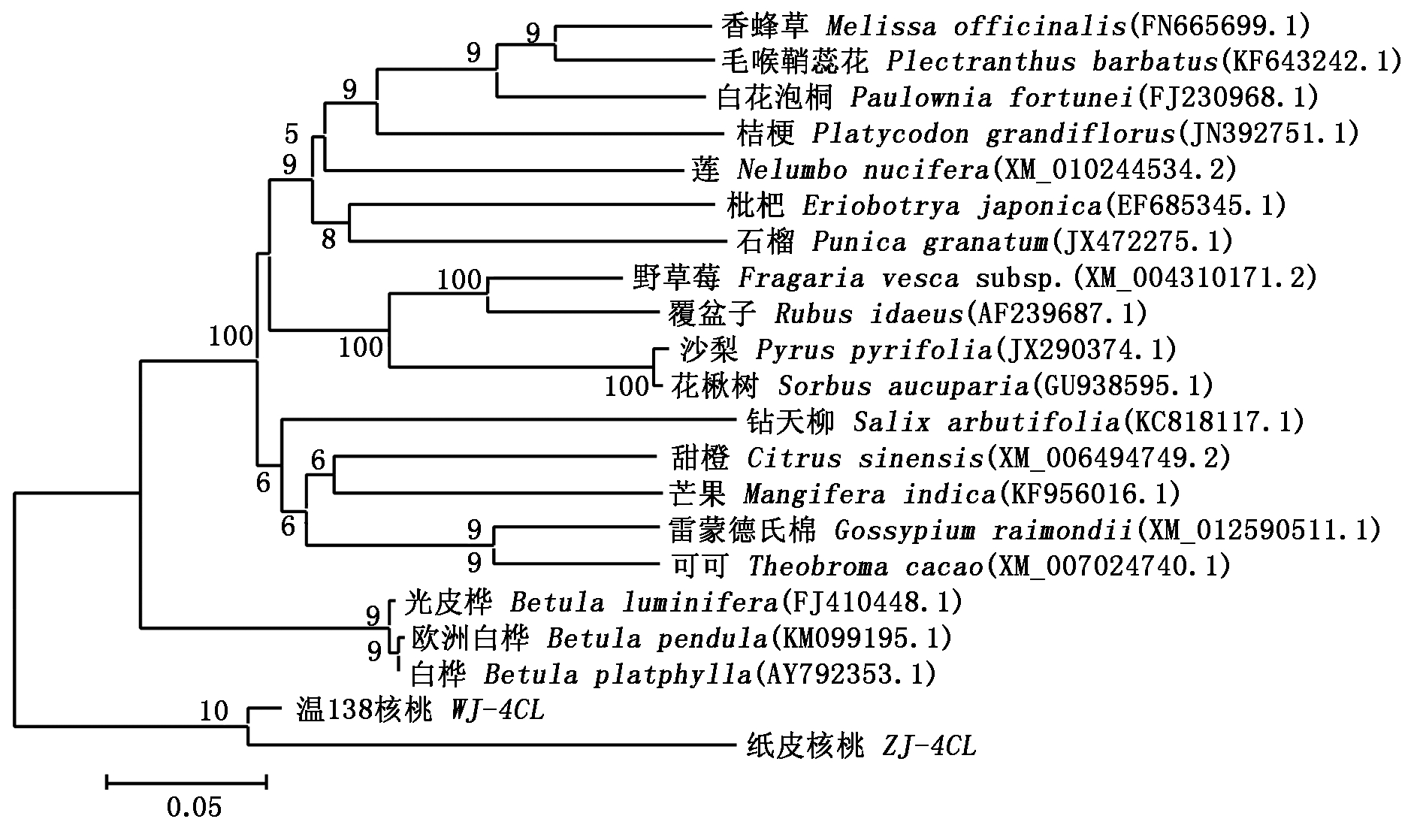
图5 核桃与19种植物4CL基因系统进化树分析
Fig.5 Phylogenetic tree of 4CL gene in walnut and 19 other plants

A.WJ-4CL蛋白二级结构; B.ZJ-4CL蛋白二级结构; h.α-螺旋; e.延伸链; t.β-转角; c.无规则卷曲。
A.Secondary structure of WJ-4CL protein; B.Secondary structure of ZJ-4CL protein; h.Alpha helix; e.Extended strand; t.Beta turn; c.Randon coil.
图6 4CL蛋白二级结构
Fig.6 Secondary structure of 4CL protein
2.5 4CL蛋白三级结构预测
分别建立WJ-4CL与ZJ-4CL蛋白三维空间结构模型(图7)。WJ-4CL与ZJ-4CL这2种蛋白质三级结构由α-螺旋、β-转角、β-折叠和无规则卷曲构成,其中均以α-螺旋为主要结构元件,其他元件较少。蛋白三级结构分析可知WJ-4CL较ZJ-4CL结构复杂得多,其α-螺旋、β-转角、β-折叠和无规则卷曲结构等元件含量较多。
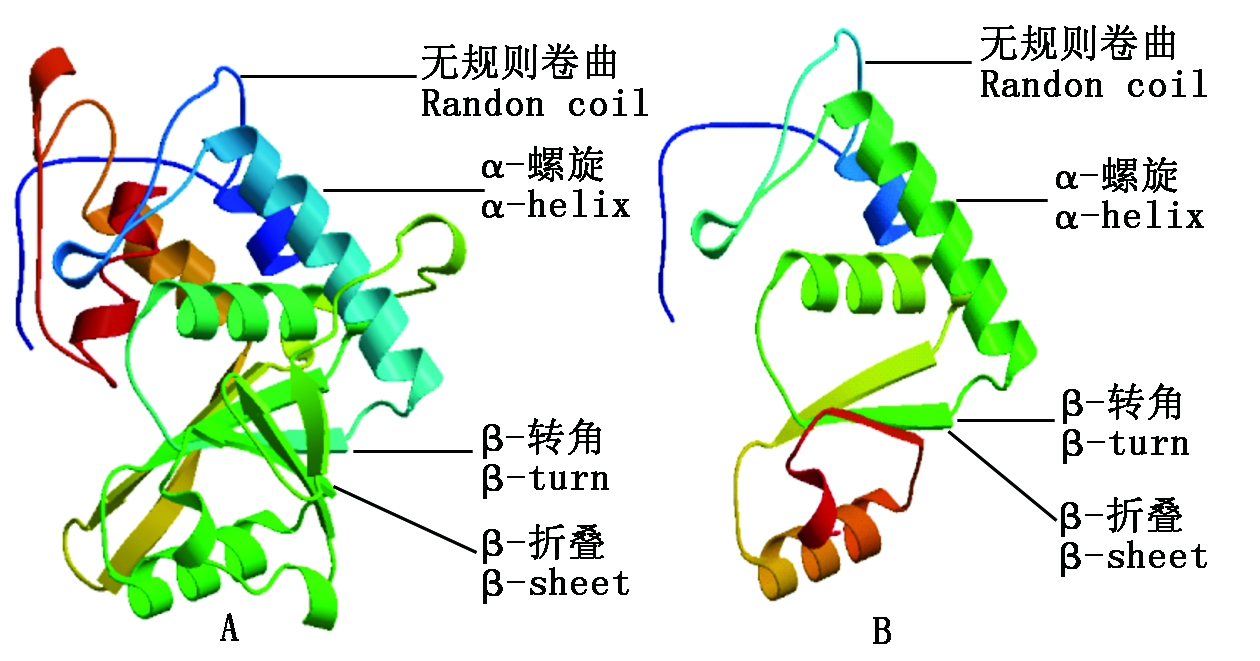
A.WJ-4CL蛋白三级结构; B.ZJ-4CL蛋白三级结构。
A.The tertiary structure of WJ-4CL protein; B.The tertiary structure of ZJ-4CL protein.
图7 4CL蛋白三级结构
Fig.7 The tertiary structure of 4CL protein
2.6 WJ-4CL、ZJ-4CL基因相对定量分析
实时荧光定量PCR技术分析WJ-4CL、ZJ-4CL在核桃内果皮硬化过程中的表达水平(图8)。WJ-4CL、ZJ-4CL基因相对表达量在核桃的8个不同发育时期中有非常明显的差异,其中WJ-4CL基因相对表达量最高的花后100 d (117.78)是相对表达量最低的花后51 d (1.00)的117倍,ZJ-4CL基因相对表达量最高的花后86 d (205.07)是相对表达量最低的花后51 d (1.00)的205倍。由图可以看出,温138核桃内果皮硬化过程表达量呈现增长-降低-增长趋势,相对表达整体呈现“N”型变化趋势,其前期4CL基因表达量相对较小,至核桃内果皮硬化过程的后期其4CL基因大量表达;而纸皮核桃内果皮硬化过程表达量呈现增长-降低-增长-降低趋势,相对表达整体呈现“M”型变化趋势,花后86 d 4CL基因表达量急剧下降。4CL基因在硬壳完整核桃内果皮中的表达量远高于同期露仁核桃内果皮中的表达量。
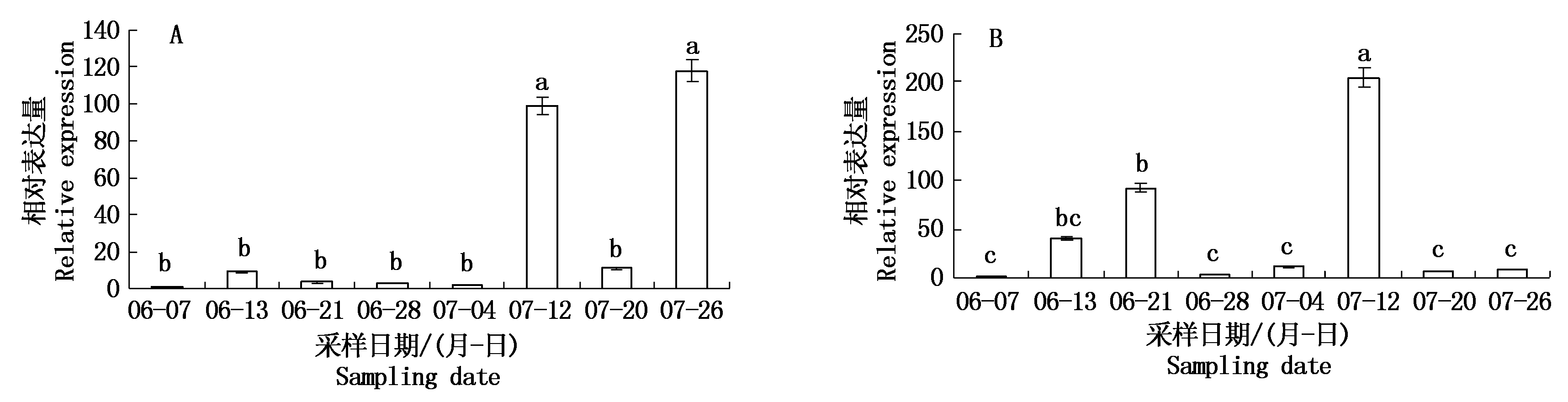
A.WJ-4CL基因相对表达量; B.ZJ-4CL基因相对表达量;06-07.花后51 d;06-13.花后57 d; 06-21.花后65 d; 06-28.花后72 d; 07-04.花后78 d; 07-12.花后86 d; 07-20.花后94 d; 07-26.花后100 d; 不同小写字母表示不同时期之间的显著性差异(P<0.05)。
A. Relative expression of WJ-4CL gene; B.Relative expression of ZJ-4CL gene; 06-07.51 d after anthesis; 06-13.57 d after anthesis; 06-21.65 d after anthesis; 06-28.72 d after anthesis; 07-04.78 d after anthesis; 07-12.86 d after anthesis; 07-20.94 d after anthesis; 07-26.100 d after anthesis; Different lowercase letters indicate significant differences between different periods (P<0.05).
图8 核桃内果皮硬化过程4CL基因相对表达水平
Fig.8 Relative expression level of 4CL gene during hardening of walnut endocarp
3 结论与讨论
本试验克隆得到露仁核桃种质温138及硬壳发育完整核桃种质纸皮内果皮4CL基因,分别命名为WJ-4CL与ZJ-4CL,利用生物信息学预测获得4CL基因的理化性质参数、二级结构、三级结构等,分析了4CL基因的进化关系及在核桃内果皮硬化过程中不同时期的相对表达特性。
WJ-4CL与ZJ-4CL基因均为AFD_class_Ⅰ蛋白超家族成员,根据试验结果得知,WJ-4CL与ZJ-4CL推导氨基酸序列存在相同的非特异性位点(4CL)及功能结构域(cyc_hxne_CoA_lg、PLN02246、CaiC及AMP-binding),这一结果与珊瑚菜(Glehnia littoralis)[18]、华南象草(Pennisetum purpureum cv. Huanan)[19]相关研究结果吻合。同源性分析显示,核桃露仁种质WJ-4CL基因与硬壳发育完整ZJ-4CL基因聚在一支,WJ-4CL、ZJ-4CL与乔木类植物亲缘关系较近。WJ-4CL与ZJ-4CL核苷酸序列与光皮桦、白桦、欧洲白桦4CL基因及其氨基酸序列的相似性均达到83%以上,2个基因编码的氨基酸序列与光皮桦、白桦、欧洲白桦4CL基因推导氨基酸序列相似性均在70%以上。发现不同植物间4CL基因也有较高的一致性,推测4CL在核桃发育过程中对内果皮(硬壳)完整程度有较大的影响。
本试验实时荧光定量PCR结果显示,温138、纸皮核桃4CL基因在内果皮硬化的8个不同发育时期的相对表达量存在显著差异,其中WJ-4CL前期的相对表达量均较低,在核桃硬核期的花后100 d达到最大值,是前期的117倍,相对表达整体呈现“N”型变化趋势,对照纸皮核桃ZJ-4CL在花后86 d达到最大值,是前期的205倍,相对表达整体呈现“M”型变化趋势,这与董丽丽等[20]的红玉石籽石榴(Punica granatum cv. Hongyushizi)研究有一定的差别,红玉石籽木质素含量与4CL基因存在相关性,4CL基因的表达量呈现“∧”趋势,前60 d木质素大量合成和积累(4CL基因表达量升高),当木质素含量高到一定程度其合成开始减弱(4CL基因表达量开始下降),说明4CL基因参与调控木质素合成。本研究与裴艳梅等[21]研究结果相吻合,在无核小枣(Ziziphus jujuba Mill. Wuhexiaozao)4CL基因研究中发现,花期到花后50 d呈现先上升后下降的总趋势,前期表达量很低,后期明显上升。本试验相对定量分析结果发现,4CL基因在硬壳完整核桃内果皮中的表达量远高于同期露仁核桃内果皮中的表达量,说明露仁现象可能由于硬核期缺乏木质素的积累。由本试验结果可以看出,在硬核期木质素的改变对核桃内果皮的发育存在一定的影响,核桃出现露仁现象与4CL活性的关系还有待进一步的研究。
[1] 李忠新, 杨莉玲. 阿布力孜·巴斯提,闫圣坤,刘奎,朱占江,杨忠强,刘佳,沈小贺,买合木江,马文强.新疆核桃产业化发展研究[J]. 新疆农业科学, 2014, 51(5): 1001-4330. doi:10.6048/j.issn.1001-4330.2014.05.027.
Li Z X, Yang L L, Abulizi B, Yan S K, Liu K, Zhu Z J, Yang Z Q, Liu J, Shen X H, Maihemujiang, Ma W Q. The development of walnut mechanization of production equipment in Xinjiang[J]. Xinjiang Agricultural Sciences, 2014,51(5):1001-4330.
[2] 徐凯, 夏玉芳, 李允祥, 谢钊俊. 贞丰核桃主要经济性状评价[J]. 种子, 2016, 35(4): 1001-4705. doi:10.16590/j.cnki.1001-4705.2016.04.118.
Xu K, Xia Y F, Li Y X, Xie Z J. Evaluation to the main economic characters of Zhenfeng walnut[J]. Seed, 2016,35(4):1001-4705.
[3] 田贝贝, 高疆生, 赵明, 王新建. 南疆核桃品种脂肪酸及氨基酸的营养评价[J]. 新疆农业科学, 2009, 46(5): 970-974.
Tian B B, Gao J S, Zhao M, Wang X J. Evaluation on nutrition of fatty acids and amino acid of walnut in the southern Xinjiang[J]. Xinjiang Agricultural Sciences, 2009,46(5):970-974.
[4] 武际, 郭熙盛, 鲁剑巍, 万水霞, 王允青, 许征宇, 张晓玲. 不同水稻栽培模式下小麦秸秆腐解特征及对土壤生物学特性和养分状况的影响[J]. 生态学报, 2013, 33(2): 565-575. doi:10.5846/stxb201111201769.
Wu J, Guo X C, Lu J W, Wan S X, Wang Y Q, Xu Z Y, Zhang X L. Decomposition characteristics of wheat straw and effects on soil biological properties and nutrient status under different rice cultivation[J]. Acta Ecologica Sinica, 2013,33(2):565-575.
[5] 文菁, 赵书岗, 王红霞, 张志华, 李夕勃. 核桃硬壳发育期内果皮木质素与相关酶活性的变化[J]. 园艺学报, 2015, 42(11): 2144-2152. doi:10.16420/j.issn.0513-353x.2015-0261.
Wen J, Zhao S G, Wang H X, Zhang Z H, Li X B. Changes of lignin content and its related enzyme activities in endocarp during walnut shell development period[J]. Acta Horticulturae Sinica, 2015,42(11):2144-2152.
[6] 邹丽秋, 王彩霞, 匡雪君, 李滢, 孙超. 黄酮类化合物合成途径及合成生物学研究进展[J]. 中国中药杂志, 2016, 41(22): 4124-4128. doi:10.4268/cjcmm20162207.
Zou L Q, Wang C X, Kuang X J, Li Y, Sun C. Advance in flavonoids biosynthetic pathway and synthetic biology[J]. China Journal of Chinese Materia Medica, 2016,41(22):4124-4128.
[7] Duthie G, Crozier A.Plant-derived phenolic antioxidants[J].Current Opinion in Lipidology,2000,11(1):43-47. doi: 10.1097/00075197-200011000-00006.
[8] 曹运鹏, 方志, 李姝妹, 闫冲冲, 丁庆庆, 程曦, 林毅, 郭宁, 蔡永萍. 砀山酥梨4CL基因家族的全基因组鉴定与分析[J]. 遗传, 2015, 37(7): 711-719. doi:10.16288/j.yczz.15-069.
Cao Y P, Fang Z, Li S M, Yan C C, Ding Q Q, Cheng X, Lin Y, Guo N, Cai Y P. Genome-wide identification and analyses of 4CL gene families in Pyrus bretschneideri Rehd[J]. Hereditas, 2015,37(7):711-719.
[9] 胡尚连, 曹颖, 黄胜雄, 孙霞, 卢学琴, 蒋瑶. 慈竹4CL基因的克隆及其生物信息学分析[J].西北农林科技大学学报(自然科学版), 2009, 37(8): 204-210. doi:10.13207/j.cnki.jnwafu.2009.08.020.
Hu S L, Cao Y, Huang S X, Sun X, Lu X Q, Jiang Y. Cloning and bioinformation analysis of 4CL gene in Neosinocalamus affinis[J]. Journal of Northwest A&F University(Nat.Sci.Ed),2009, 37(8): 204-210.
[10] 杨晓云, 杨智敏, 罗小娇, 孔德媛, 袁金娥, 刘新春, 冯宗云. 青稞4-香豆酸辅酶A连接酶基因4CL的克隆及表达分析[J]. 麦类作物学报, 2014, 34(12): 1603-1610. doi:10.7606/j.issn.1009-1041.2014.12.02.
Yang X Y, Yang Z M, Luo X J, Kong D Y, Yuan J E, Liu X C, Feng Z Y. Cloning and expression analysis of 4-Ceoumarate:CoA ligase gene 4CL in hulless barley[J]. Journal of Triticeae Crops, 2014,34(12):1603-1610.
[11] 龙松华, 李翔, 陈信波, 乔瑞清, 邓欣, 邱财生, 郭媛, 郝冬梅, 王玉富. 亚麻4CL基因克隆及RNAi遗传转化[J]. 西北植物学报, 2014, 34(12): 2405-2411. doi:10. 7606/j.issn.1000-4025.2014.12.2405.
Long S H, Li X, Chen X B, Qiao R Q, Deng X, Qiu C S, Guo Y, Hao D M, Wang Y F. RACE clone and RNAi transformation of flax 4CL gene[J]. Acta Botanica Boreali-Occidentalia Sinica, 2014,34(12):2405-2411.
[12] 罗睿雄, 赵志常, 高爱平, 黄建峰, 刘宽亮. 芒果4CL基因的克隆及其表达分析[J]. 华北农学报, 2016, 31(S1): 57-62. doi:10.7668/hbnxb.2016.S1.010.
Luo R X, Zhao Z C, Gao A P, Huang J F, Liu K L. Cloning and expression analysis of 4CL gene from mango(Mangifera indica)[J]. Acta Agriculturae Boreali-Sinica, 2016,31(S1):57-62.
[13] 李萌,哈努拉·塔斯肯,陈卓,田智丽,王超.白桦4CL基因启动子克隆及表达分析[J]. 中国农学通报, 2017, 33(05): 29-34.
Li M,Hanula·tasiken,Chen Z L,Tian Z L,Wang C.Cloning and expression analysis of 4CL gene promoter of betula platyphylla[J]. Chinese Agricultural Science Bulletin, 2017,33(5):29-34.
[14] 周龚, 王玉锋, 娄来清, 周华, 陈素丽, 蔡庆生, 滕胜. 甜高粱4-香豆酸辅酶A连接酶基因(4CL)的克隆与鉴定及时空表达分析[J]. 南京农业大学学报, 2014, 37(3): 1000-2030. doi:10.7685/j.issn.1000-2030.2014.03.002.
Zhou G, Wang Y F, Lou L Q, Zhou H, Chen S L, Cai Q S, Teng S. Cloning,characterization and spatio-temporal expression analysis of 4-coumarate:CoA ligase genes(4CL)in sweet sorghum[J]. Journal of Nanajing Agriculturul University, 2014,37(3):1000-2030.
[15] 倪志勇, 王娟, 吕萌, 李波, 白岩, 范玲. 棉花4-香豆酸辅酶A连接酶基因克隆及原核表达[J]. 西北植物学报, 2010, 30(3): 429-436. doi:1000-4025(2010)03-0429-OR.
Ni Z Y, Wang J, Lü M, Li B, Bai Y, Fan L. Cloning and prokaryotic expression of Gh4CL2 gene from Gossypium hirsutum L.[J]. Acta Botanica Boreali-Occidentalia Sinica, 2010,30(3):429-436.
[16] 黄满芬, 王恒, 方荣俊, 赵卫国, 张林, 潘刚, 刘利. 桑树肉桂酸-4-羟化酶基因(MmC4H)的克隆及在不同桑品种间的表达差异[J]. 蚕业科学, 2014, 40(4): 592-600. doi: 10.13441/j.cnki.cykx.2014.04.005.
Huang M F, Wang H, Fang R J, Zhao W G, Zhang L, Pan G, Liu L. Cloning and differential expression of cinnamic acid 4-Hydroxylase gene in different mulberry varieties[J]. Science of Sericulture, 2014,40(4):592-600.
[17] Livak K J, Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J].Methods,2001,25(4):402-408.doi:10.1006/meth.2001.1262.
[18] 宋洁洁, 罗红梅, 朱珣之, 张玉, 高婷. 珊瑚菜Gl4CL基因克隆与生物信息学分析[J]. 世界科学技术-中医药现代化, 2017, 19(4): 610-617. doi:10.11842/wst.2017.04.011.
Song J J, Luo H M, Zhu X Z, Zhang Y, Gao T. Cloning and bioinformatics analysis of Gl4CL gene in Glehnia littoralis[J]. World Science and Technology-Modernization of Traditional Chinese Medicine, 2017,19(4):610-617.
[19] 钟天秀, 李有涵, 李菲, 彭小群, 柯善文, 陈曙, 解新明. 华南象草Pp4CL基因的克隆及其转基因烟草木质素含量分析[J]. 西北植物学报, 2015, 35(12): 2355-2364. doi:10.7606/j.issn.1000-4025.2015.12.2355.
Zhong T X, Li Y H, Li F, Peng X Q, Ke S W, Chen S, Xie X M. Isolation of 4-coumarate CoA ligase gene from Pennisetum purpureum cv. Huanan and Lignin content analysis of transgenic tobacco plants[J]. Acta Botanica Boreali-Occidentalia Sinica, 2015,35(12):2355-2364.
[20] 董丽丽,阿不都热扎克·依沙克,户倩,李川微,张水明.石榴4-香豆酸辅酶A连接酶基因的克隆和表达分析[J]. 西北植物学报, 2016, 36(11): 1000-4025. doi:10.7606/j.issn.1000-4025.2016.11.2146.
Dong L L,Abdurazak·Isha,Hu Q,Li C W,Zhang S M.Cloning and expression analysis of pomegranate 4-coumarate-CoA ligase Pg4CL[J]. Acta Botanica Boreali-Occidentalia Sinica, 2016,36(11):1000-4025.
[21] 裴艳梅, 王金鑫, 彭建营. 无核小枣木质素合成基因Zj4CL的克隆和表达分析[J]. 植物遗传资源学报, 2016, 17(1): 147-152, 161. doi:10.13430/j.cnki.jpgr.2016.01.022.
Pei Y M, Wang J X, Peng J Y. Molecular cloning and expression analysis of a 4CL gene in Ziziphus jujuba mill.wuhexiaozao[J]. Journal of Plant Genetic Resources, 2016,17(1):147-152, 161.