马铃薯(Solanum tuberosum)在中国的粮食作物中扮演着重要的角色,出现在人类四季的饮食中。因此,马铃薯需要进行较长时间的窖储,这为真菌、细菌、病毒和线虫在内的病原体提供了侵染马铃薯的机会。马铃薯的病害主要包括枯萎病、粉痂病、干腐病、青枯病、软腐病、早疫病、晚疫病、疮痂病等,这些病害大大降低了马铃薯的质量[1-2]。对于病害的防治一般选用抗病品种和无病种薯进行合理种植;在病害田间喷洒噻菌灵、戊唑醇和咯菌腈等化学药剂进行防治;利用转基因技术获得抗病马铃薯[3-4]。
病程相关蛋白(Pathogenesis related protein,PR蛋白)是指植物在其受到生物或非生物的胁迫后所诱导产生并积累的一类蛋白总称[5],在发生病原体攻击时在植物中产生的蛋白质,被诱导为系统获得性抗性的一部分。其中一些蛋白质是抗菌的,可以攻击细菌或真菌细胞壁中的分子,并且一些蛋白质可作为病菌感染的传播信号。感染还刺激细胞壁中分子的交联和木质素的沉积,为反应建立了局部路障,减缓了病原体扩散到植物的其他部分[6-8]。
PR基因家族划分为1~17个家族[9]。在新鲜番红花柱头克隆CsPR10基因,发现其具有抵抗黄萎病菌(Verticillium dahliae)、青霉菌(Penicillium)和尖孢镰刀菌(Fusarium oxysporum)的能力[10]。表达分析表明,花药和苔藓组织中存在高转录水平,这种蛋白质似乎通过激活茉莉酸途径参与主动防御反应。在烟草中对PR-la基因进行研究,证明该基因在烟草花叶病毒和水杨酸诱导性中发挥着重要的作用[11]。在克隆烟草发病相关PR1基因及在烟草中的表达研究表明,铜和锌处理对烟草PR基因表达的诱导,其参与SA信号转导途径[12]。在烟草感病品种中克隆NtPR10基因,发现该基因在TMV感染过程发生上调,表明其具有重要功能[13]。PR1能够响应各种病原体并诱导该基因表达。它是SAR(系统性获得抗性)响应的有效分子标记,该基因的表达是水杨酸响应性的[14-16]。
目前,马铃薯抗病问题已经成为病理学家研究的重点内容,而对于马铃薯中PR基因与马铃薯抗病的关系研究较少。本研究以马铃薯大西洋品种为研究材料,克隆了StPR1基因,对该基因进行相关的生物信息学分析,进而更加明确该基因的功能;应用qRT-PCR技术,针对该基因在真菌、细菌及毒素胁迫下的表达特异性及差异,进而为马铃薯的生物防治奠定坚实的理论基础。
1 材料和方法
1.1 试验材料及处理
植物材料为马铃薯(大西洋品种),由黑龙江省农业科学院提供。
菌株材料真菌为接骨木镰孢(F.sambucinum)、燕麦镰孢(F.avenaceum)以及导致软腐病和青枯病等的细菌胡萝卜软腐欧文氏菌(E.carotovora subsp. Carotovora Borgey,Ecc)、菊欧氏菌(E.chrysanthemi Burkholder.Atroseptica Dye,Ech)、胡萝卜软腐欧文氏菌马铃薯黑胫亚种(E.carotovora subsp.Mc Fadden et Dimock,Eca)、茄科雷尔氏菌(Ralstonia solanacearum,RS)由东北农业大学植物资源与分子生物学研究室保存并提供。
选取大小均匀、表面光滑、无病斑的马铃薯,清水洗净马铃薯表面,随后将马铃薯置于75%的酒精中30 s,然后使用5%的NaClO溶液中浸泡5 min,最后使用无菌水清洗3次,置于超净工作台中备用。使用打孔器在马铃薯表面打下直径为1 cm,深度为2 cm的孔洞,将300 μL Ecc、Eca、Ech、RS菌液、接骨木镰孢及燕麦镰孢菌饼注入到孔洞中,以无菌水为对照。分别在处理0,4,12 h后进行取样,沿着孔洞的直径将马铃薯切两半,取孔洞周围的组织0.5~0.6 g,重复3次,用锡箔纸包好,液氮中速冻,置于-80 ℃保存、备用。
RNA提取选用Bio Teke试剂盒购于恒诚生物公司;DNA胶回收选用OMEGA试剂盒购于赛拓生物公司;RT-PCR的荧光染料SYBR Green、Top Taq酶、pEASY-T3克隆载体、大肠杆菌感受态DH5α、质粒提取试剂盒、反转录试剂盒购于全式金生物公司;试验所需引物合成于哈尔滨博仕生物公司;试验结果测序于库美生物公司;LB肉汤、LB营养琼脂、NaClO溶液购于恒诚生物公司;使用Primer Premire 5.0(Premier Biosoft)进行引物设计。
1.2 RNA提取及cDNA的合成
用Bio Teke试剂盒(RP3301)进行总RNA 的提取,分装进行UV-240紫外分光光度计浓度测定,OD260/280为1.8~2.0,测定合格后放入-80 ℃保存备用,琼脂糖凝胶电泳对RNA的完整性进行检验。选用Oligo(DT)为引物,对提取的RNA进行反转录,将反转录产物cDNA置于-20 ℃保存备用,使用β-actin对cDNA质量进行检测。
1.3 StPR1基因的克隆
根据NCBI上公布的马铃薯病程相关蛋白PR1(XM-006367029.2),找到CDS区,使用Primer Premire 5.0进行PR1克隆引物的设计(PR1-F:ATG GGATACTCCAATATTGCCTT;PR1-R:TTAGATATC AGTTGGAAGTTCCAAC),克隆记忆长度为540 bp。以DON处理12 h的cDNA为模板进行PCR扩增反应,将PCR产物进行琼脂糖凝胶电泳,进而将目的片段进行胶回收,并于pEASY-T3进行连接,并将连接产物转化到大肠杆菌感受态DH5α中,使用含有Amp(氨苄青霉素)(100 mg/mL)的LB营养琼脂培养基进行菌落筛选,随机挑取较圆、大小均匀的单菌落30个,待菌液浑浊进行菌液PCR验证,将出现目的基因的菌液送公司进行测序。
1.4 StPR1生物信息学分析
利用以下生物信息学分析软件以及在线工具对PR1基因进行相关分析。①保守结构域分析:https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi;②开放阅读框及氨基酸序列分析:https://www.ncbi.nlm.nih.gov/orffinder;③蛋白质信号肽预测:http://www.cbs.dtu.dk/services/SignalP/;④蛋白一级结构的预测及分析:http://web.expasy.org/protparam/;⑤蛋白质疏水性及亲水性预测:https://web.expasy.org/protscale/;⑥蛋白质二级结构的预测:https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html;⑦蛋白质三级结构预测:https://swissmodel.expasy.org/;⑧蛋白序列亚细胞定位:http://www.softberry.com;⑨系统发育树:MEGA 5.0。
1.5 StPR1表达特异性分析
根据PR1的CDS区进行表达特异性的qRT-PCR的引物设计(表1),将1.1中的6种处理及无菌水为对照的cDNA进行稀释,并以马铃薯肌动蛋白β-actin内参基因,进行qRT-PCR扩增反应,其中包含3次生物学重复,其反应体系为上下游引物各0.5 μL,cDNA 1.0 μL,2×Trans Star Top Green Qpcr Super Mix 10 μL,进行实时荧光定量分析。采用比较CT法(ΔΔCT)对荧光定量PCR扩增数据进行处理。
1.6 数据统计分析
试验数据录入及分析采用Microsoft Excel 2010,作图采用GraphPad Prism 5。相对表达量计算方法为2-ΔΔCT=2-(ΔCT处理-ΔCT对照) =2-((CT处理-CT内参)-(CT对照-CT内参))。使用Excel进行数据整理及处理。
表1 引物设计
Tab.1 Primers design
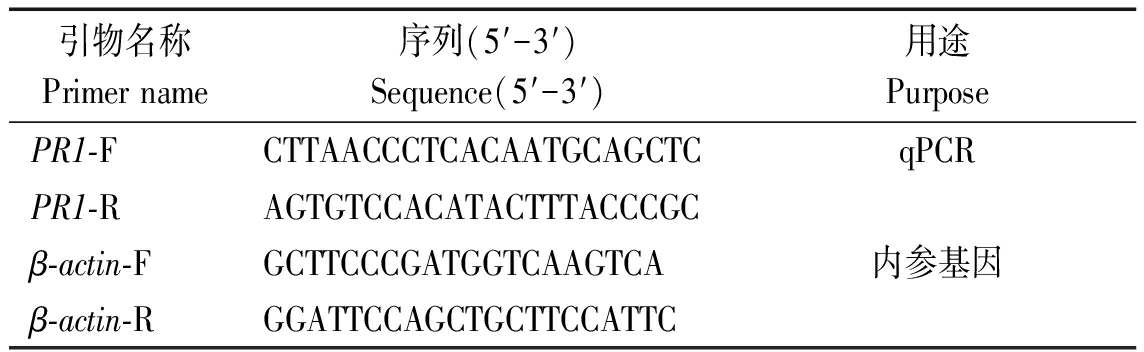
引物名称Primer name序列(5′-3′)Sequence(5′-3′)用途 PurposePR1-FCTTAACCCTCACAATGCAGCTCqPCR PR1-RAGTGTCCACATACTTTACCCGCβ-actin-FGCTTCCCGATGGTCAAGTCA内参基因β-actin-RGGATTCCAGCTGCTTCCATTC
2 结果与分析
2.1 马铃薯StPR1基因的克隆
根据马铃薯PR1(GenBank 登录号:XM-006367029.2)设计引物,进行PCR扩增,将产物进行1%琼脂糖凝胶电泳,可以获得500 bp左右的目的条带(图1),进行该目的基因的测序,获得540 bp序列,并将其进行生物信息学分析。
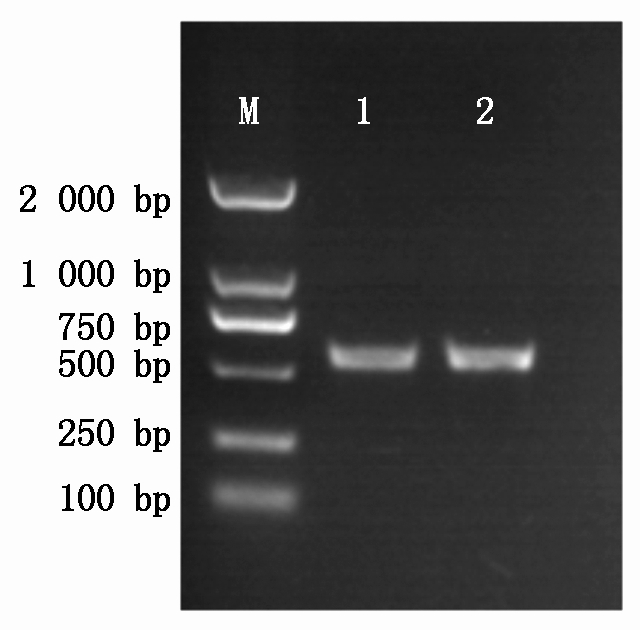
M.DNA分子量标准2000;1-2.PCR产物。M.DL2000 DNA Marker;1-2.The PCR production.
图1 PR1基因的PCR产物琼脂糖凝胶电泳检测
Fig.1 The detection agarose gel electrophoresis of PR1 gene PCR product
2.2 马铃薯StPR1基因生物信息学分析
对已经克隆的StPR1基因进行生物信息学分析,发现该基因具有一个SCP_PR-1_like结构域,位于79-480 bp(图2);该基因序列的起始密码子ATG位于1 bp处,终止密码子位于540 bp处,共编码179个氨基酸,该基因全长540 bp;其开放阅读框ORF1可翻译蛋白质序列;对其进行蛋白质信号肽预测,发现PR1蛋白含有信号肽,属于分泌蛋白;对PR1蛋白进行一级结构预测及分析、PR1蛋白氨基酸含量预测及蛋白质疏水性及亲水性预测,PR1蛋白序列的GRAVY值在+4~-3,含有亲水区及疏水区;蛋白质二级结构预测其属于混合型蛋白;蛋白质三级结构预测发现其为紧密复杂的螺旋结构(图3);预测蛋白质存在的位置,发现StPR1基因编码的蛋白在细胞膜以及细胞外基质,在细胞质、线粒体、内质网、高尔基体、过氧化物酶体、高尔基体、叶绿体有分布。

图2 StPR1基因保守结构域分析
Fig.2 Analysis of conserved domain of StPR1 gene
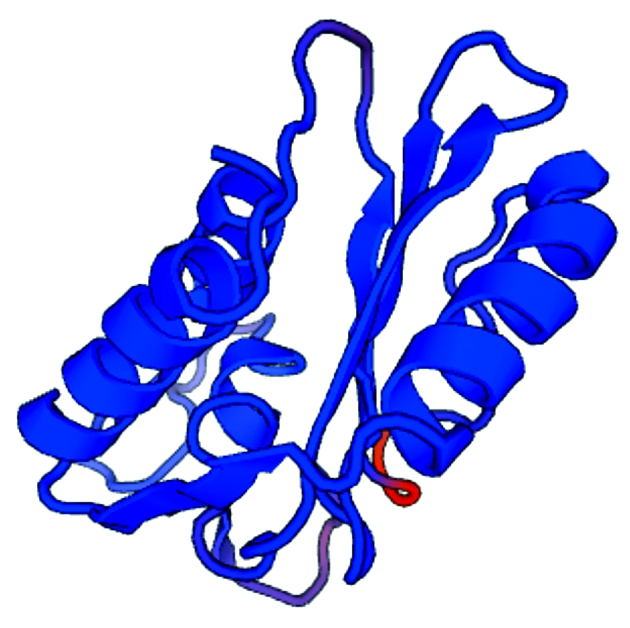
图3 蛋白质三级结构预测
Fig.3 Protein tertiary structure prediction
2.3 马铃薯StPR1基因的系统进化树构建
使用MEGA 5.0进行StPR1基因的系统进化树构建,结果表明马铃薯与辣椒PR1基因在一个进化分支上,相似性较高(图4)。
2.4 马铃薯StPR1基因表达特异性分析
利用已经获得的RNA为模板进行反转录,使用qRT-PCR进行荧光定量分析。该基因的表达在茄科雷尔氏菌侵染下呈先下调后上调的趋势;该基因的表达在接骨木镰孢侵染下无明显波动,而在燕麦镰孢的侵染下呈逐渐上调的趋势,12 h该基因的表达量显著高于0 h;该基因的表达在软腐病致病菌Ecc侵染下显著高于Ech、Eca侵染下该基因的表达,并且在Ech、Eca侵染条件下StPR1基因呈下调趋势,且此3组处理各个时间点的表达量均低于对照组。StPR1在参与马铃薯抗病过程中,抗真菌的能力可能强于抗细菌的能力(图5)。
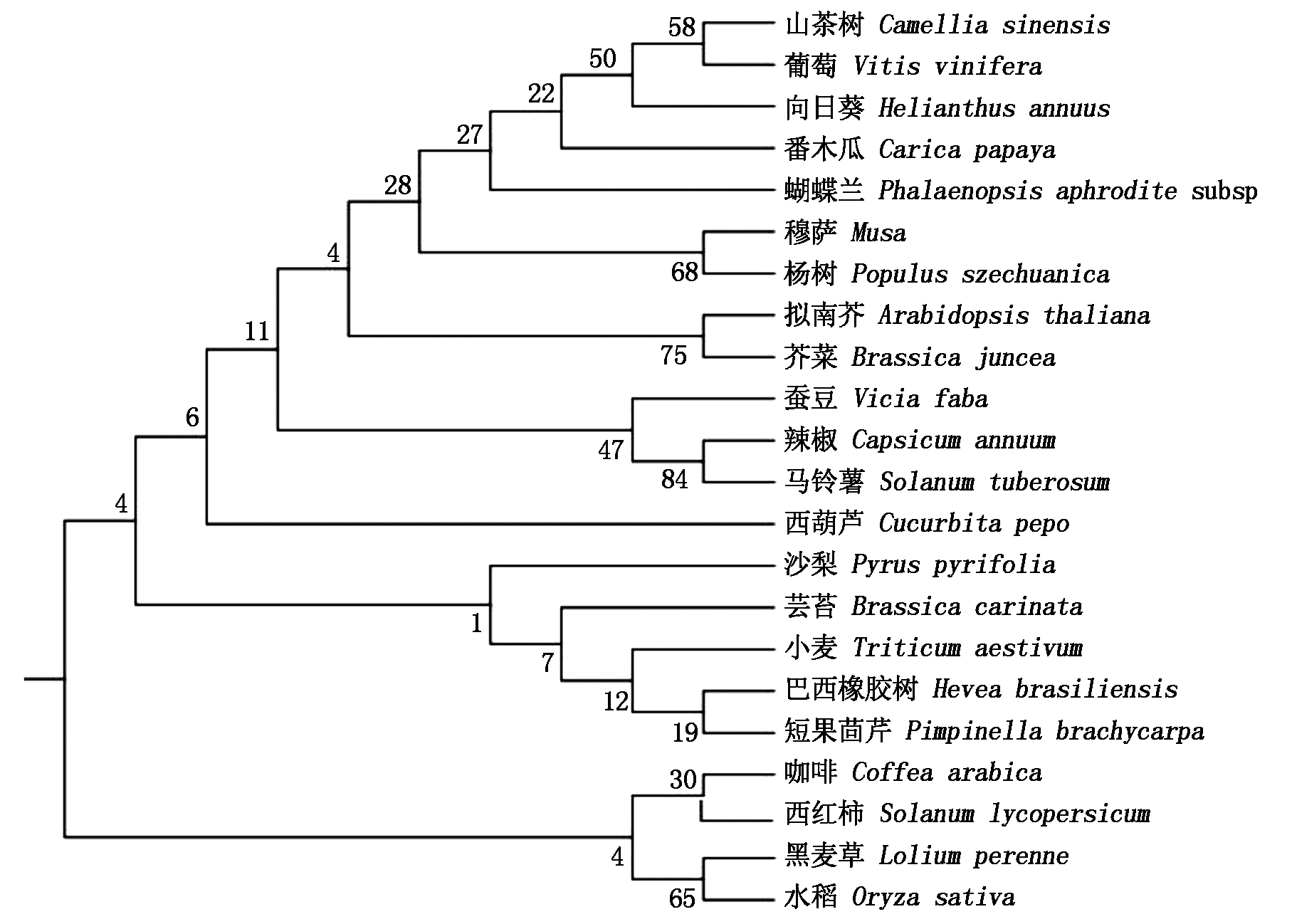
图4 StPR1与其他物种的PR1基因系统发生分析
Fig.4 Analysis of PR1 gene system in StPR1 and other species

图5 不同胁迫下StPR1基因的表达差异
Fig.5 Differential expression of StPR1 gene under different stresses
3 结论与讨论
近年来,马铃薯产业的发展受到了各种病害的严重制约,化学防治已经被广泛地应用到马铃薯的种植以及储存过程中,与此同时生物防治也得到了广泛的关注。杨德翠等[17]在以牡丹为研究材料,对PsPR1进行克隆及抗病研究,发现该基因受牡丹柱枝孢叶斑病病原菌(C.canadense)和信号物质SA的显著诱导,其与抗真菌的关系比较密切,分别在处理的12,24 h达到最高峰,这一研究表明,PsPR1可能参与了牡丹的抗病防御过程。张青等[18]对大薯中的PR1进行克隆,并对该基因进行生物信息学分析,表明该基因编码的蛋白具有典型SCP_PR-1_like保守结构域,Blast比对表明,DaPR1蛋白与多种植物的PR1蛋白高度同源。王乐等[19]在东方百合的相关研究中获得了LhSorPR1,并证明PR1蛋白在结构和功能上与其他植物中的PR1蛋白具有较强的保守性。马立功等[20]在以向日葵为研究材料,成功克隆了向日葵PR1基因,对该基因进行生物信息学分析发现,开放阅读框为489 bp,编码162个氨基酸,经比较HaPR1与多种物种PR1高度同源并预测其具有抗核盘菌的功能。本试验成功地从马铃薯大西洋品种中克隆出StPR1基因,在对其核苷酸序列进行生物信息学分析后发现,虽然该基因与NCBI上公布的StPR1存在几处差异,但其保守结构域没有受到任何影响,该蛋白典型的SCP_PR-1_like结构域仍然存在。
病程相关蛋白的抗细菌以及真菌的能力也成为相关研究的热点。发现转CpPR4基因植株对蛙眼病病菌有一定抗性[21]。肖栋等[22]、李雪姣等[23]在对不结球白菜病程相关蛋白基因研究表明,BcPR5在IPTG诱导4 h后能实现融合蛋白的高效表达,证明该基因在抗霜霉病防御反应中发挥着重要作用,并且推测这些PR蛋白质参与水稻白叶枯病菌抗病过程。ABA和SA处理后强烈诱导TcLr19PR1,其中TcLr19PR1的表达水平显著增加并在12,72 h达到最大值,发现TcLr19PR1基因在小麦发育和抗叶锈病病原体攻击中起重要作用[24-25]。PR1蛋白具有抗真菌能力和免疫抑制能力[26]。根据本试验的结果预测StPR1基因对抗干腐病的能力可能强于软腐病和青枯病。
[1] 孙海军.东北地区马铃薯常见病害的发生及防治[J].吉林农业,2016(15):92.doi:10.14025/j.cnki.jlny.2016.15.038.
Zhang H J. Occurrence and control of common diseases of potato in Northeast China[J]. Jilin Agriculture,2016(15):92.
[2] 张春.马铃薯常见病害的识别与防治[J].农业科技与信息,2016(28):103,105. doi:10.15979/j.cnki.cn62-1057/s.2016.28.065.
Zhang C. Identification and control of common diseases of potato[J]. Agricultural Technology and Information, 2016(28):103,105.
[3] 金飞跃,赵振杰,任乐乐,曹克强,胡同乐.十一种杀菌剂防治马铃薯晚疫病的适宜施用时期[J].农药学学报,2016,18(2):213-218. doi:10.16801/j.issn.1008-7303.2016.0028.
Jin F Y, Zhao Z J, Ren L L, Cao K Q, Hu T L. Appropriate application period of eleven fungicides for controlling potato late blight[J]. Journal of Agricultural Pharmacy, 2016,18(2):213-218.
[4] 张贺兰,王鑫,张若晗,杨圆圆,巩秀峰,赵永秀.利用基因工程育种提高马铃薯晚疫病抗性的研究进展[J].分子植物育种,2018,16(21):7038-7041. doi:10.13271/j.mpb.016.007038.
Zhang H L, Wang X, Zhang R H, Yang Y Y, Gong X F, Zhao Y X. Advances in research on improving resistance of potato late blight by genetic engineering breeding[J]. Molecular Plant Breeding,2018,16(21):7038-7041.
[5] Van Loon L C, Van Strien E A.The families of pathogenesis-related proteins, their activities, and comparative analysis of PR-1 type proteins[J]. Physiological and Molecular Plant Pathology, 1999,55(2):85-97.doi:10.1006/pmpp.1999.0213.
[6] Breiteneder H, Radauer C. A classification of plant food allergens[J]. J Allergy Clin Immunol, 2004, 113(5):821-830. doi:10.1016/j.jaci.2004.01.779.
[7] Liu J J, Akm E. The family 10 of plant pathogenesis-related proteins: their structure, regulation, and function in response to biotic and abiotic stresses[J]. Physiological & Molecular Plant Pathology, 2006, 68(1):3-13. doi:10.1016/j.pmpp.2006.06.004.
[8] Kim Y J, Jang M G, Lee H J, Jang G H, Sukweenadhi J, Kwon W S, Yang D C. Functional characterization of the pathogenesis-related protein family 10 gene, PgPR10-4, from Panax ginseng, in response to environmental stresses[J]. Plant Cell Tissue & Organ Culture, 2014, 118(3):531-543. doi:10.1007/s11240-014-0505-5.
[9] Sels J, Mathys J, De Coninck B M A, Cammue B P A, De Bolle M F C. Plant pathogenesis-related (PR) proteins: A focus on PR peptides[J].Plant Physiology and Biochemistry,2008, 46(11): 941-950.doi:10.1016/j.plaphy.2008.06.011.
[10] ![]() L, Rubio-Moraga A, Ahrazem O. Molecular cloning and characterisation of a pathogenesis-related protein CsPR10 from Crocus sativus[J]. Plant Biology, 2011, 13(2):297-303. doi:10.1111/j.1438-8677.2010.00359.
L, Rubio-Moraga A, Ahrazem O. Molecular cloning and characterisation of a pathogenesis-related protein CsPR10 from Crocus sativus[J]. Plant Biology, 2011, 13(2):297-303. doi:10.1111/j.1438-8677.2010.00359.
[11] Uknes S. Regulation of pathogenesis-related protein-1a gene expression in tobacco[J]. The Plant Cell Online, 1993,5(2): 159-169. doi:10.1105/tpc.5.2.159.
[12] Yun H K, Yi S Y, Yu S H, Choi D. Cloning of a pathogenesis-related protein-1 gene from Nicotians glutinosa L. and its Salicylic acid-independent induction by copper and β-aminobutyric acid[J]. Journal of Plant Physiology, 1999,154(3): 327-333.doi:10.1016/s0176-1617(99)80175-8.
[13] 张玉, 张增林, 蒋彩虹, 常爱霞,杨爱国,罗成刚,王绍美,王元英. 烟草病程相关蛋白NtPR10基因克隆与表达分析[J]. 中国烟草科学, 2017, 38(3):1-7. doi:10.13496/j.issn.1007-5119.2017.03.001.
Zhang Y, Zhang Z L, Jiang C H, Chang A X, Yang A G, Luo C G, Wang S M, Wang Y Y, Cloning and expression analysis of tobacco pathogenesis related protein NtPR10 gene[J]. Chinese Tobacco Science, 2017, 38(3):1-7.
[14] Chinnasri B, Borsics T, Christopher D A, Sipes B S. Induction of pathogenesis-related gene 1 (PR-1) by acibenzolar-s-methyl application in pineapple and its effect on reniform nematodes (Rotylenchulus reniformis)[J]. Agriculture & Natural Resources, 2016, 50(5):368-373.doi:10.1016/j.anres.2016.04.008.
[15] Sandhu D, Tasma I M, Frasch R, Bhattacharyya M K. Systemic acquired resistance in soybean is regulated by two proteins, Orthologous to Arabidopsis NPR1[J]. Bmc Plant Biology, 2009, 9(1):105. doi:10.1186/1471-2229-9-105.
[16] Fu Z Q, Dong X. Systemic acquired resistance: turning local infection into global defense[J]. Annual Review of Plant Biology, 2013,64(1):839-863.doi:10.1146/annurev-arplant-042811-105606.
[17] 杨德翠,张玉喜,郑国生.牡丹病程相关蛋白1基因的克隆及表达分析[J].园艺学报,2013,40(8):1583-1590. doi:10.16420/j.issn.0513-353x.2013.08.031.
Yang D C, Zhang Y X, Zheng G S. Cloning and expression analysis of the disease related protein 1 gene of peony[J]. Journal of Horticulture,2013,40(8):1583-1590.
[18] 张青, 赵景梅, 黄东益,肖鑫辉,夏薇,许云,黄小龙,吴文嫱.大薯病程相关蛋白1(PR1)基因及其启动子序列的克隆与分析[J]. 分子植物育种, 2018(7):2078-2084. doi:10.13271/j.mpb.016.002078.
Zhang Q, Zhao J M, Huang D Y, Xiao X H, Xia W, Xu Y, Huang X L, Wu W Q. Cloning and analysis of the sequence of the large potato disease path related protein 1 (PR1) gene and its promoter[J]. Molecular Plant Breeding, 2018(7):2078-2084.
[19] 王乐,杨柳,郭志鸿,张玉宝,王亚军,杨果,谢忠奎.东方百合(Lilium)杂交品种索邦病程相关蛋白(PR1)基因的克隆与原核表达[J].中国沙漠,2018,38(3):584-591. doi:10.7522/j.issn.1000-694X.2017.00031.
Wang L, Yang L, Guo Z H, Zhang Y B, Wang Y J, Yang G, Xie Z K. Cloning and prokaryotic expression of the disease related protein (PR1) gene of the lily (Lilium) hybrid[J]. Chinese Desert,2018,38(03):584-591.
[20] 马立功,张匀华,孟庆林,石凤梅,刘佳,李易初,王志英.向日葵病程相关蛋白HaPR1基因的克隆与功能[J].作物学报,2015,41(12):1819-1827. doi:10.3724/SP.J.1006.2015.01819.
Ma L G, Zhang Y H, Meng Q L, Shi F M, Liu J, Li Y C, Wang Z Y. Cloning and function of HaPR1 gene associated with sunflower disease path[J]. Crop Journal,2015,41(12):1819-1827.
[21] 秦朝,王斐,刘祥,王向东,眭顺照,李名扬.蜡梅CpPR-4基因的克隆及植物表达[J].西南师范大学学报(自然科学版),2012,37(12):98-101.doi:10.13718/j.cnki.xsxb.2012.12.012.
Qin C, Wang F, Liu X, Wang X D, Sui S Z, Li M Y. Cloning and plant expression of CpPR-4 gene from Chimonanthus praecox[J]. Journal of Southwest China Normal University (Natural Science Edition),2012,37(12):98-101.
[22] 肖栋,韦艳萍,李英,侯喜林.不结球白菜病程相关蛋白基因BcPR5的克隆及表达分析[J].南京农业大学学报,2018,41(4):640-646. doi:10.7685/jnau.201708031.
Xiao D, Wei Y P, Li Y, Hou X L. Cloning and expression analysis of a disease-related protein gene BcPR5 in non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University,2018,41(4):640-646.
[23] 李雪姣,范伟,牛东东,关明俐,缪刘杨,史佳楠,窦世娟,魏健,刘丽娟,李莉云,刘国振.水稻病程相关PR1家族蛋白质在叶片生长及与白叶枯病菌互作反应中的表达[J].植物学报,2014,49(2):127-138. doi:10.3724/SP.J.1259.2014.00127.
Li X J, Fan W, Niu D D, Guan M L, Mu L Y, Shi J N, Dou S J, Wei J, Liu L J, Li L Y, Liu G Z. Expression of PR1 family proteins related to rice pathogenesis in leaf growth and interaction with Xanthomonas oryzae[J]. Plant Journal,2014,49(2):127-138.
[24] Gao L, Wang S, Li X Y, Wei X J, Zhang Y J, Wang H Y, Liu D Q. Expression and functional analysis of a Pathogenesis-related protein 1 gene, TcLr19PR1, involved in wheat resistance against leaf rust fungus[J]. Plant Molecular Biology Reporter, 2015, 33(4):797-805. doi:10.1007/s11105-014-0790-5.
[25] Darwiche R, El Atab O, Baroni R M, Teixeira P J P L, Mondego J M C, Pereira G A G, Schneiter R. Plant pathogenesis related proteins of the cacao fungal pathogen Moniliophthora perniciosa differ in their lipid-binding specificities[J]. Journal of Biological Chemistry, 2017,292(50): 20558-20569. doi:10.1074/jbc.m117.811398.
[26] 栗小英,刘景坤,张艳俊,王海燕,刘大群.信号分子与叶锈菌诱导下小麦病程相关蛋白1基因的表达分析[J].江苏农业科学,2015,43(9):28-31. doi:10.15889/j.issn.1002-1302.2015.09.007.
Li X Y, Liu J K, Zhang Y J, Wang H Y, Liu D Q. Expression analysis of protein 1 gene related to wheat pathogenesis induced by signal molecule and leaf rust[J]. Jiangsu Agricultural Science,2015,43(9):28-31.