油菜在我国种植历史悠久,广泛地分布在全国各地,作为重要的油料作物之一,除了食用植物油之外,其菜用、饲用、旅游观光及药用等潜在价值得到了持续的关注和开发利用[1]。但目前我国普遍种植的是甘蓝型油菜,其生育期过长,影响“三熟制”实施,对农民造成了严重的经济损失。研究油菜开花基因FT的分子调控机制[2],可有效缩短油菜的生育期,为稻稻油“三熟制”的实施提供理论基础[3]。FT基因是开花关键基因,最早是在拟南芥晚花突变体中发现的[4]。FT基因编码的蛋白是一种Raf激酶蛋白,属于PEBP蛋白(磷脂酰乙醇胺结合蛋白),PEBP蛋白分布广泛,在动、植物、细菌、真菌中广泛分布[5]。Abe等[6]研究发现,FT基因只在叶片中特异性表达。Samach等[7]研究发现,光周期途径的关键基因CO在植物叶片中特异性调控FT基因的表达,特异性表达的FT蛋白被运输到茎尖分生组织,作用于下游基因调控植物开花。随着现代生物分子学的发展,越来越多的FT基因家族的成员被发现,比如水稻中的RFT1基因[8]和Hd3a基因[9]、麻风树中的JcFT基因[10]、短日照植物矮牵牛中的PnFT1基因[11]等。在拟南芥、水稻等模式植物中,大量开花相关基因被分离鉴定[12]。植物的基因表达调控主要是在转录水平上进行的,受到多种顺式作用元件和逆式作用元件的相互协调作用。研究顺式作用元件可以探讨胁迫诱导基因的表达机制[13]。
随着对启动子研究的不断深入,关于克隆启动子的技术越来越多,目前最常用的技术包括普通PCR、反向PCR、锚定PCR、MADE法、TALL-PCR等。由于条件的限制,普通PCR技术通常建立在完成全基因组测序的物种上,因为其在启动子序列是已知的。想要获得启动子的全序列,一般只需要设计出合适的引物,便可获得启动子的全长。但是目前绝大多数物种的全基因组测序未完成,因此,利用普通PCR获得启动子序列是非常困难的。其余PCR技术皆是用来扩增已知序列侧翼的未知片段,在分子生物学领域应用较为广泛[14]。
本研究根据甘蓝型油菜全基因组序列,利用PCR技术得到甘蓝型油菜A7-FT基因启动子序列。利用启动子在线预测软件预测其功能与结构,根据其预测的顺式元件的分布,从5′端开始缺失的方式获得5个不同片段长度的启动子序列。构建含不同片段长度的启动子的GUS基因表达载体,利用农杆菌介导拟南芥,得到T2幼苗,经过GUS染色与脱色,探讨A7-FT基因启动子的功能,为研究甘蓝型油菜开花调控机制提供理论基础。
1 材料和方法
1.1 试验材料
甘蓝型油菜湘油15由湖南农业大学油料研究所提供。Trans T1大肠杆菌感受态从北京全式金生物技术有限公司购买,pMD18-T载体从TaKaRa公司购买,野生型拟南芥种子与农杆菌菌株GV3101为国家油料改良中心湖南分中心提供。人工土=蛭石∶珍珠岩∶营养土=1∶1∶1混合。
1.2 A7-FT基因启动子的克隆
使用全式金DNA提取试剂盒提取油菜基因组DNA。A7-FT基因启动子序列PCR扩增通过拟南芥信息资源(TAIR)数据库(http://www.arabidopsis.org/)查找拟南芥AtFT基因(AT1G65480),用拟南芥AtFT基因编号在Brassica Database数据库(http://brassicadb.org/brad/index.php)中Blast,得到甘蓝型油菜中BnFT基因序列上游1 600 bp序列信息。根据上游约1 600 bp序列信息及BnFT-A7基因信息用Primer 5.0设计引物F/R,扩增BnFT-A7启动子的引物序列F1(ACAGAGTTGTAAAAGTA AAATTATGTG),R1(CTCTGATCTAAAACAAACAG GTTG),PCR反应体系50 μL:5× PCR Buffer 10 μL,5×PCR Buffer 10 μL,dNTP Mix (2.5 mmol/L) 4 μL,正向引用 (10 μmol/L) 1 μL,反向引物 (10 μmol/L) 1 μL,cDNA 1 μL,PrimeSTAR®GXL DNA 聚合酶 1 μL,ddH2O 32 μL。利用全式金的普通琼脂糖凝胶DNA回收试剂盒回收DNA片段。连接pMD19-T载体转化大肠杆菌。
1.3 启动子序列分析及缺失载体构建
利用PLACE和PlantCARE植物基因序列分析的网站对A7-FT基因启动子上的顺式作用元件进行生物信息学分析预测。根据对顺式作用元件分析的结果,对启动子进行逐段缺失,缺失片段及名称依次为-1 549~+57(M1)、-1 162~+57(M2)、-824~+57(M3)、-429~+57(M4)、-238~+57(M5)。对这些缺失片段进行高保真扩增,分别设计带有Hind Ⅲ酶切位点的正向引物和带有Nco Ⅰ酶切位点的反向引物。扩增这5个片段所需引物见表1。
表1 载体构建所需的引物
Tab.1 Primer required for vector construction
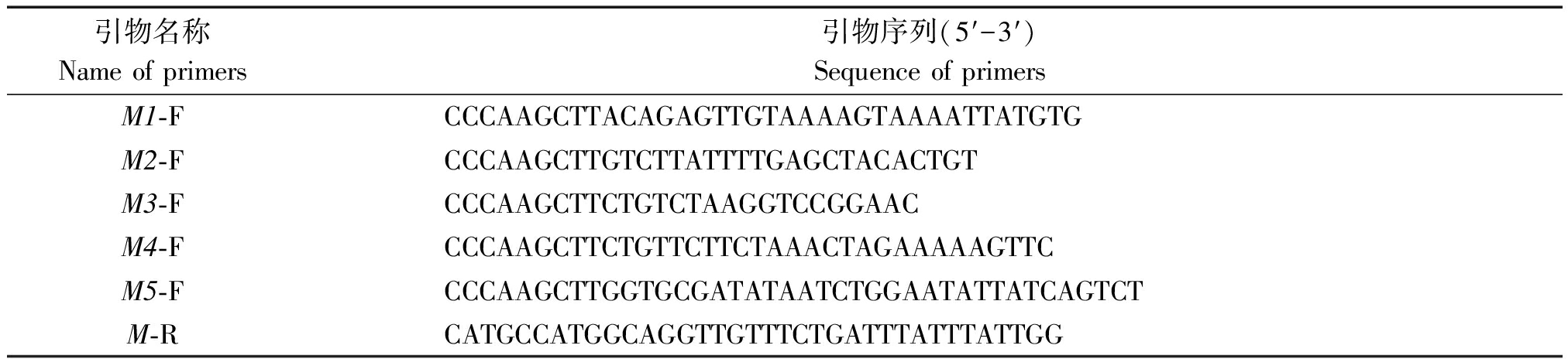
引物名称Name of primers引物序列(5′-3′)Sequence of primersM1-F CCCAAGCTTACAGAGTTGTAAAAGTAAAATTATGTGM2-F CCCAAGCTTGTCTTATTTTGAGCTACACTGTM3-F CCCAAGCTTCTGTCTAAGGTCCGGAACM4-F CCCAAGCTTCTGTTCTTCTAAACTAGAAAAAGTTCM5-F CCCAAGCTTGGTGCGATATAATCTGGAATATTATCAGTCTM-R CATGCCATGGCAGGTTGTTTCTGATTTATTTATTGG
启动子缺失片段的克隆是通过质粒DNA提取不同片段长度启动子表达载体的构建,使用农杆菌浸染拟南芥花序,利用MS培养基筛选转化子,进行阳性苗的鉴定,待阳性苗植株较大,取部分叶片,提取DNA,参考刘芳[15]已设计的引物(表1),F2:GTCGCGCAAGACTGTAACCA,R2:ACATACCATCC GTAATAAC,进行PCR检测,片段长度为842 bp,将检测为阳性的植株继续培养,并收集种子,筛选至得到T2种子。将T2种子铺于MS培养基中(含潮霉素B 50 mg/L),10 d后取出阳性苗用于下一步试验。GUS活性的组织化学检测,参照Jefferson 等[16]的GUS组织化学检测方法。

图1 A7-FT基因启动子序列上顺式作用元件预测
Fig.1 cis-acting element prediction on A7-FT gene promoter sequence
2 结果与分析
2.1 启动子上顺式作用元件预测
通过PlantCARE和PLACE在线软件对启动子序列进行序列分析(图1),结果表明, A7-FT基因启动子序列上存在多种不同功能的顺式作用元件。除了启动子-141,-30 bp处分别存在核心启动子必备的元件CAATbox和TATAbox,在启动子的其他核心元件有激素应答元件如ABRE/G-box/circadain(脱落酸应答元件)、TCA-element(水杨酸应答元件);光应答元件AE-box、ATCT-motif、Box4、Box I、GT1-motif/chs-CMA1a、TCT-motif/TC-rich repeats;抗逆性应答元件如Box-W1/W box(真菌应答元件)、ARE(缺氧应答元件)。另外,还发现了其他顺式作用元件,如分生组织表达相关的顺式元件CAT-box、参与胚乳表达的顺式元件GCN4_motif和Skn-1_motif、热激蛋白顺式作用元件HSE。
2.2 不同片段长度启动子的克隆及PCR检测
以湘油15苗期叶片基因组DNA为模板,F1/R1为引物,进行PCR扩增,得到一条约1 600 bp的片段(图2-A)。
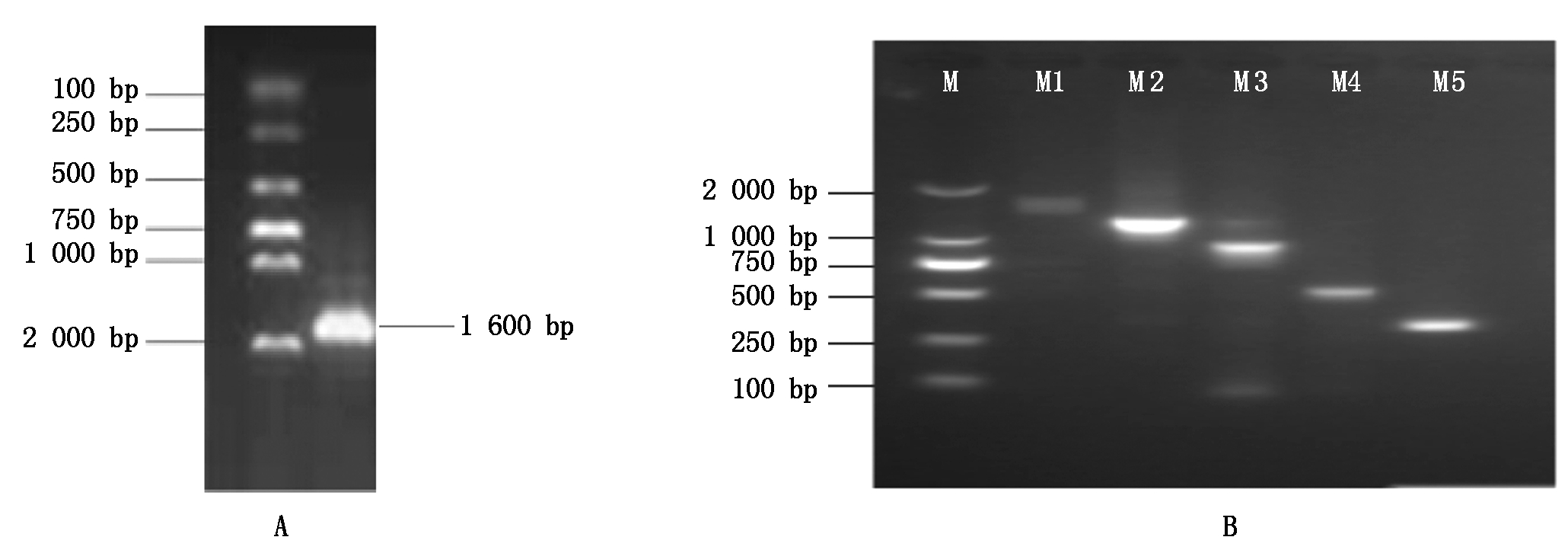
M.Trans 2kb® DNA Marker;M1.1 606 bp;M2.1 219 bp;M3.914 bp;M4.486 bp;M5.295 bp。
图2 不同片段长度启动子克隆及PCR检测
Fig.2 Electrophoresis of different fragments of promoters and colony PCR
为了深入了解甘蓝型油菜A7-FT基因启动子的功能,基于预测顺式作用元件的分布设计带有酶切位点的特异性引物,以PCR扩增湘油15苗期叶片基因组DNA后得到的1 600 bp片段为模板,分别切胶回收加“A尾”并连接pMD-19T载体转化大肠杆菌,通过菌落PCR鉴定,获得阳性克隆并测序,保留所含启动子序列与已知目的序列一致的菌液,放置-80 ℃保存。把不同长度的启动子分别命名为M1、M2、M3、M4、M5,长度分别为1 606,1 219,914,486,295 bp(图2-B)。
2.3 启动子缺失载体的构建
全长启动子连接pCAMBIA1303载体,启动子依然能使GUS基因正常表达,为了深入了解甘蓝型油菜A7-FT基因启动子的功能,探索A7-FT基因启动子不同区段的功能,因此,从5′端逐段缺失,构建M1、M2、M3、M4、M5表达载体。5′端缺失载体构建模型(图3),含CAMV35S启动子及去除CAMV35S启动子的pCAMBIA1303载体分别为阳性、阴性对照。
将含有不同片段长度启动子和pCAMBIA1303载体的大肠杆菌于37 ℃活化过夜,按照EasyPure Plasmid MiniPrep Kit试剂盒说明书提取质粒DNA,分别利用FlyCut Nco Ⅰ/FlyCut Hind Ⅲ对质粒进行双酶切,使用T4 连接酶分别将相对应的目的片段连接至载体,构建含不同片段长度启动子的表达载体。将构建好的表达载体转化大肠杆菌,通过LB培养基(含Kan 50 μg/mL)筛选阳性菌落,提取质粒,通过菌落PCR和双酶切检测(图4),结果说明含目的片段表达载体构建成功。
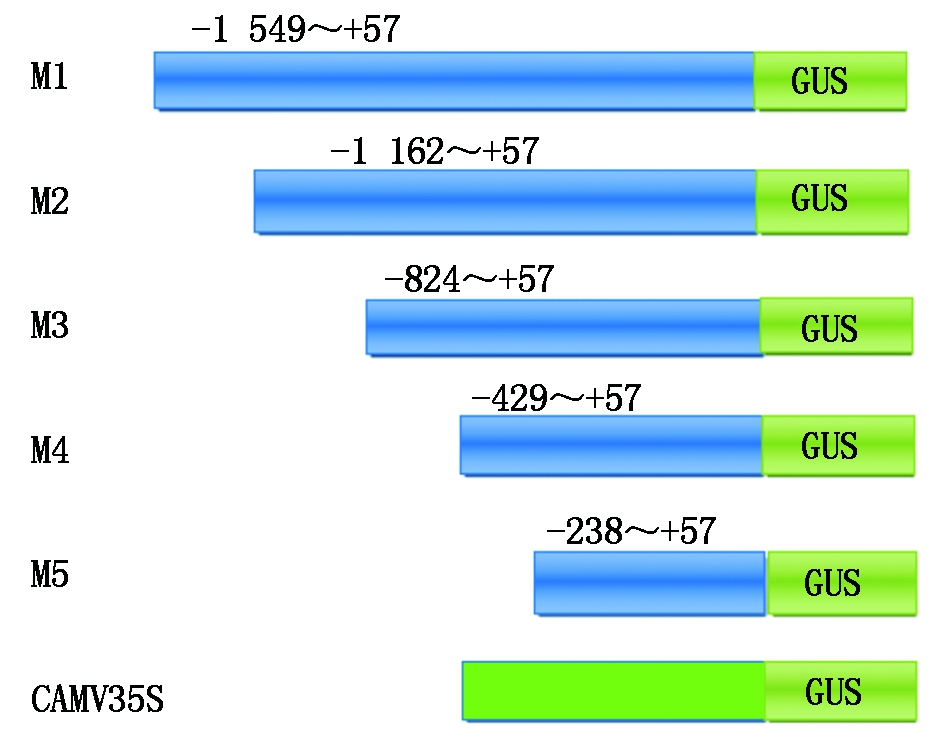
图3 5′端缺失载体构建模型
Fig.3 The pattern digaram of 5′deleted vecter
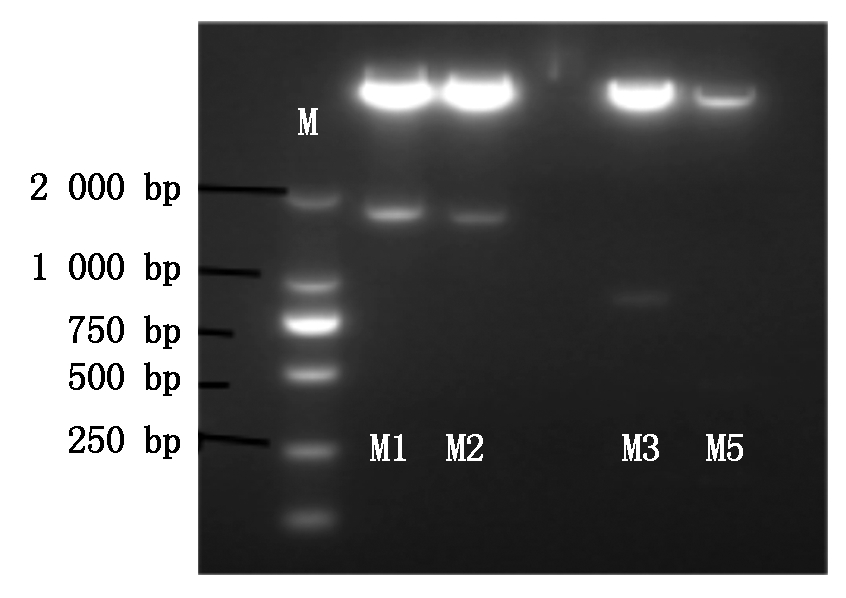
图4 不同片段长度启动子双酶切电泳
Fig.4 Electrophoresis of different fragments of promoters by two restriction enzymes
2.4 5′端缺失载体转化农杆菌结果分析
将含有不同片段长度启动子的表达载体分别转入农杆菌GV3101中,通过含有利福平(Rif 50 μg/mL)、卡那霉素(Kan 50 μg/mL)双抗YEB培养基进行筛选,挑选阳性菌落进行菌落PCR检测,结果如图5,凝胶电泳结果与预期一致,结果表明,5′端缺失载体成功转化农杆菌。
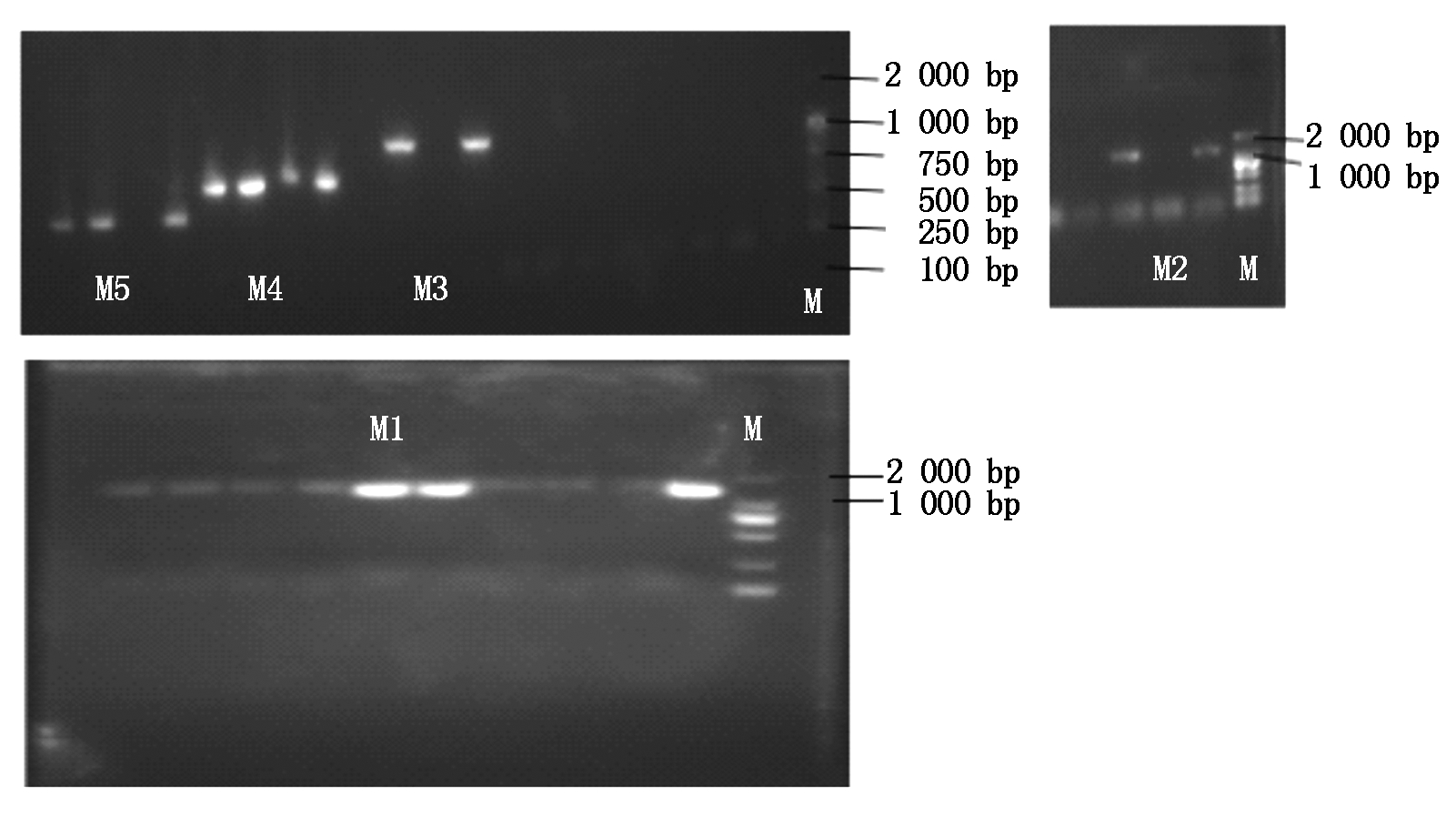
图5 转化的农杆菌菌落PCR检测结果
Fig.5 The colony PCR detection of transformed Agrobacterium
2.5 拟南芥转化结果
利用花序浸染法将含不同片段长度启动子的表达载体转化至野生型拟南芥后,于植物生长箱中培养至收获T0种子。通过MS培养基(含潮霉素B 50 mg/L)从T0种子中筛选出转化子。筛选过程中阳性幼苗主根和侧根的生长、发育正常;阴性幼苗发育迟缓,主根无法正常生长,且没有侧根形成。挑选主根和侧根的生长、发育正常的阳性苗,用无菌水洗净黏附的凝胶,移入已灭菌的人工土中覆盖白色薄膜3~4 d,置于植物生长培养箱中培养。待T1拟南芥生长较大时,取部分叶片,参照DNA提取试剂盒说明书提取基因组DNA,通过PCR再一次鉴定转化子,鉴定结果如图6所示。
待T1拟南芥开花后15 d依次收获成熟的T1种子。通过MS培养基(含潮霉素B 50 mg/L)筛选T1种子,从而得到T2种子。继续通过MS培养基(含潮霉素B 50 mg/L)进行筛选,待阳性苗在MS培养基中生长10~15 d,进行下一步试验。
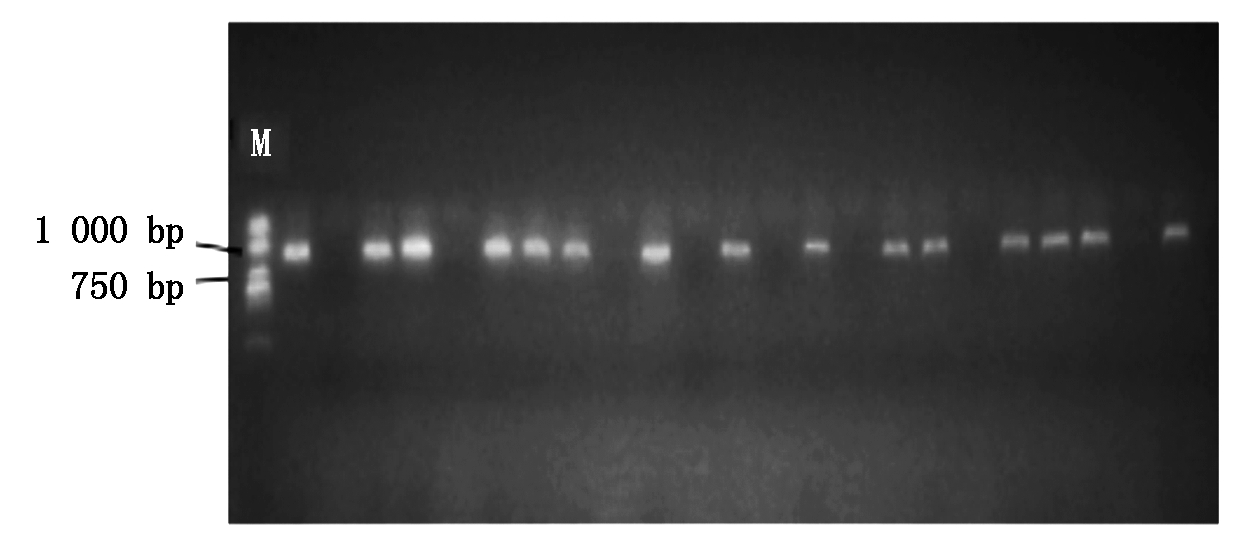
图6 转基因拟南芥PCR鉴定电泳(部分鉴定结果)
Fig.6 PCR identification of transgenic Arabidopsis(Partial identification results)
2.6 GUS染色结果检测
含有不同片段长度启动子的表达载体经过农杆菌转化后得到T2幼苗,约10 d的T2幼苗经过GUS染色与脱色处理后(图7),GUS基因在不同片段长度启动子的启动下均能表达,但是随着启动子5′端的逐渐缺失,GUS染色程度也有所变化,这说明启动子5′端的逐渐缺失影响了GUS基因的表达。从染色结果上看,M1、M2、M3、M4均比M5浅,说明在-1 549~-238可能存在一些负调控元件的结合位点,而M5启动GUS基因的表达情况与阳性对照CAMV35S相同,这说明-238~+1区域是该启动子的核心区段。
3 结论与讨论
通过PCR技术获取甘蓝型油菜A7-FT基因启动子并验证启动子的功能,对研究甘蓝型油菜开花调控具有重大意义。本试验克隆获得了295 bp甘蓝型油菜A7-FT基因启动子序列,该序列与甘蓝型油菜基因组FT基因上游序列比对,同源性100%,说明在同物种不同品种之间的A7-FT基因启动子高度保守。通过启动子在线预测软件分析甘蓝型油菜A7-FT基因启动子,预测结果表明,在启动子上分布许多光应答元件,说明光照能调控A7-FT基因的表达,这与郑小一[17]在光照条件下,苹果FT基因启动子才有活性的研究结论一致;预测结果显示,在启动子上还有一个与生理控制相关的顺式作用元件Circadian,这也表明,A7-FT基因的表达受昼夜的影响,间接地证明了该基因也受光周期调控;在启动子上还发现了各种激素元件,包括TAC-element(水杨酸应答元件)和ABRE(脱落酸应答元件),Wada等[18]用外源水杨酸处理日本牵牛花,发现FT基因高效表达,进而促进开花,这就表明植物开花也受生物压力影响;在启动子上发现W-box元件,该元件在植物开花上也扮演着重要的角色,因为转录因子WRKY特异性识别W-box,前者参与许多植物生理与发育过程[19],Miao等[19]在拟南芥中过表达WRKY53、WRKY6均使植株开花提前,Robatzek等[20]利用RNAi技术干扰WRKY表达,发现植株开花延迟,从这些研究推测W-box是A7-FT基因启动子上调控植物开花的重要顺式元件。
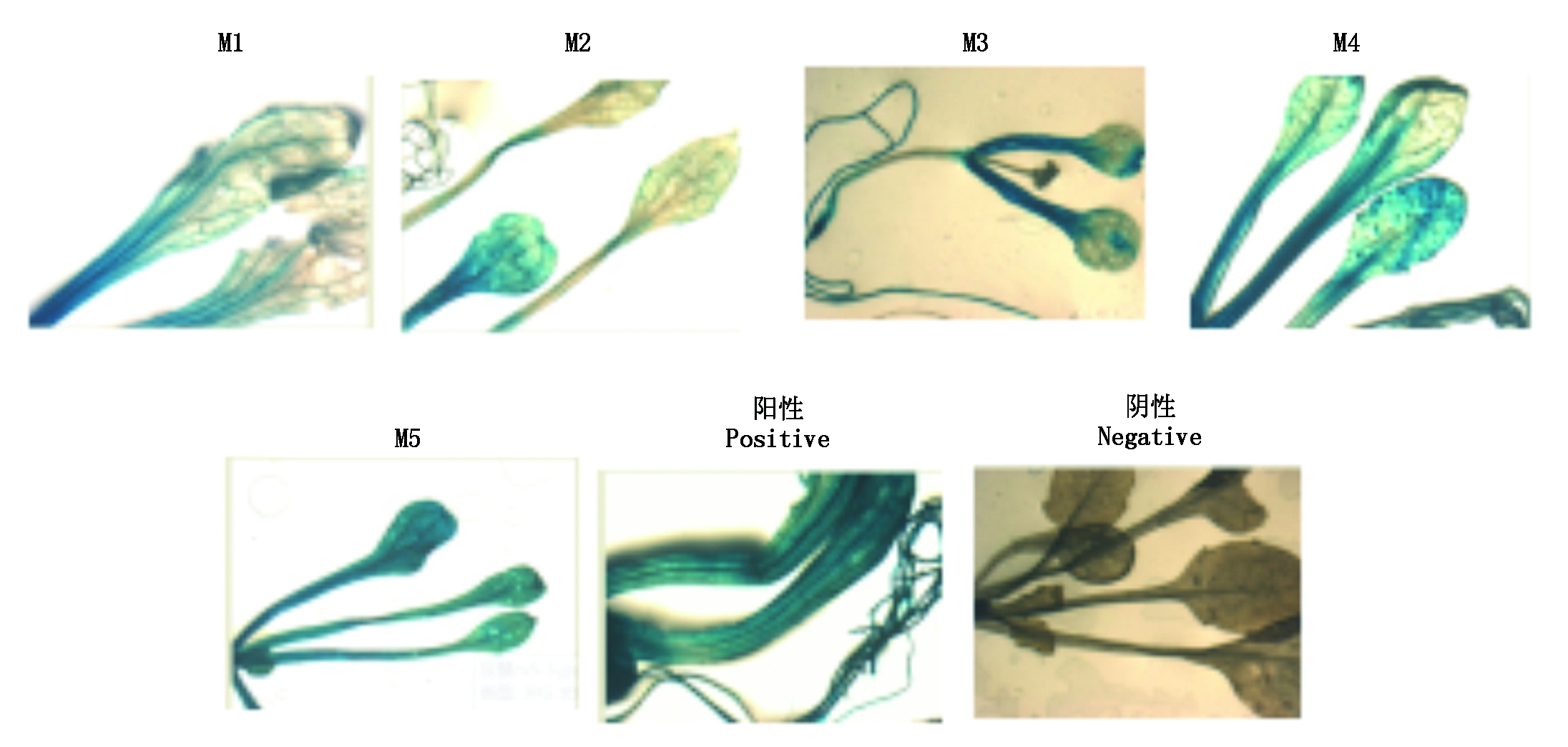
图7 不同片段长度启动子GUS染色结果
Fig.7 The GUS staining of different fragments of promoters
[1] 谢婷. 甘蓝型油菜3D基因组学的初步研究与应用[D]. 武汉: 华中农业大学, 2016.
Xie T. Preliminary study and application of 3D genomics in Brassica napus[D].Wuhan:Huazhong Agricultural University, 2016.
[2] 廖志强. 甘蓝型油菜花序生长调节因子基因BnTFL1的功能分析及遗传转化的优化[D]. 长沙: 湖南农业大学, 2015.
Liao Z Q. Function anlysis of BnTFL1 gene controling inforescense in Brassica napus L. and gentic transformation optimization of rapeseed[D].Changsha:Hunan Agricultural University, 2015.
[3] 周训华, 唐广心, 朱志华, 何华元. “稻—稻—油”三熟制生产模式探讨[J]. 作物研究, 2015, 29(1): 64-66. doi: 10.3969/j.issn.1001-5280.2015.01.15.
Zhou X H, Tang G X, Zhu Z H, He H Y. Study on the production mode of rice-rice-oil three-ripening system[J]. Crop Research, 2015,29(1):64-66.
[4] 刘丽敏, 陈福禄, 张晓玫, 武小霞, 陈庆山, 傅永福. 成花素基因FT及其调控机制研究进展[J]. 分子植物育种, 2016, 14(7): 1705-1717. doi: 10.13271/j.mpb.014.001705.
Liu L M, Chen F L, Zhang X M, Wu X X, Chen Q S, Fu Y F. Advances on florigen gene FT and its regulatory mechanism molecular plant breeding[J]. Molecular Plant Breeding, 2016,14(7):1705-1717.
[5] 汤方, 涂慧珍. 真核启动子研究进展[J]. 林业科技开发, 2015, 29(2): 7-12. doi:10.13360/j.issn.1000-8101.2015.02.002.
Tang F, Tu H Z. Research progress of eukaryotic promoter[J]. Journal of Forestry Engineering, 2015,29(2):7-12.
[6] Abe M, Kobayashi Y, Yamamoto S, Daimon Y, Yamaguchi A, Ikeda Y, Ichinoki H, Notaguchi M, Goto K, Araki T.FD, a bZIP protein mediating signals from the floral pathway integrator FT at the shoot apex[J].Science,2005,309(5737):1052-1056.doi:10.1126/science.1115983.
[7] Samach A, Onouchi H, Gold S E, Ditta G S, Schwarz-Sommer Z, Yanofsky M F, Coupland G. Distinct roles of CONSTANS target genes in reproductive development of Arabidopsis[J].Science,2000,288(5471):1613-1616. doi: 10.1126/science.288.5471.1613.
[8] Kojima S, Takahashi Y, Kobayashi Y, Monna L, Sasaki T, Araki T, Yano M. Hd3a, a rice ortholog of the Arabidopsis FT gene, promotes transition to flowering downstream of Hd1 under short-day conditions[J].Plant & Cell Physiology,2002,43(10):1096-1105. doi: 10.1093/pcp/pcf156.
[9] Tamaki S, Matsuo S, Wong H L, Yokoi S, Shimamoto K.Hd3a protein is a mobile flowering signal in rice[J].Science,2007,316(5827):1033-1036.doi:10.1126/science.1141753.
[10] Li W, Wang T, Zhang Y, Li Y.Overexpression of soybean miR172c confers tolerance to water deficit and salt stress, but increases ABA sensitivity in transgenic Arabidopsis thaliana[J].Journal of Experimental Botany,2016,67(1):175-194.doi:10.1093/jxb/erv450.
[11] Hayama R, Agashe B, Luley E, King R, Coupland G.A circadian rhythm set by dusk determines the expression of FT homologs and the short-day photoperiodic flowering response in Pharbitis[J].The Plant Cell,2007,19(10):2988-3000.doi:10.1105/tpc.107.052480.
[12] 解敏敏, 龚达平, 孙榕, 王蕾, 赵泽玉, 陈明丽. 烟草成花素FT基因及其调控机制研究进展[J]. 中国烟草科学, 2018, 39(3): 98-102. doi:10.13496/j.issn.1007-5119.2018.03.013.
Xie M M, Gong D P, Sun R, Wang L, Zhao Z Y, Chen M L. Research advances on tobacco florigen gene FT and its regulatory mechanisms[J]. Chinese Tobacco Science, 2018,39(3):98-102.
[13] 李濯雪, 陈信波. 植物诱导型启动子及相关顺式作用元件研究进展[J]. 生物技术通报, 2015, 31(10): 8-15. doi:10.13560/j.cnki.biotech.bull.1985.2015.10.006.
Li Z X, Chen X B. Research advances on plant inducible promoters and related cis-acting elements biotechnology bulletin[J]. Biotechnology Bulletin, 2015,31(10):8-15.
[14] 姚璐. 桑树FT基因启动子的克隆与分析[D]. 杨凌: 西北农林科技大学, 2016.
Yao L. Cloning and functional analysis of the promoter of FT gene in mulberr[D]. Yangling :Northwest A&F University, 2016.
[15] 刘芳. 甘蓝型油菜C5-FAD2基因转录调控初步探究[D]. 长沙: 湖南农业大学, 2015.
Liu F. Preliminary study on transcription regulation of C5-FAD2 gene in Brassica napus L.[D].Changsha: Hunan Agricultural University, 2015.
[16] Jefferson R A, Kavanagh T A, Bevan M W. GUS fusion: beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J].EMBO J,1987,6:3901-3907.
[17] 郑小一. 苹果Flowering locus T(FT)基因及其启动子的克隆及表达分析[D]. 南京: 南京农业大学, 2010.
Zheng X Y.Cloning and expression analysis of apple co-founder locus T(FT) gene and its promoter[D].Nanjing: Nanjing Agricultural University, 2010.
[18] Wada K C, Yamada M, Shiraya T, Takeno K.Salicylic acid and the flowering gene FLOWERING LOCUS T homolog are involved in poor-nutrition stress-induced flowering of Pharbitis nil[J].Journal of Plant Physiology,2010,167(6):447-452. doi:10.1016/j.jplph.2009.10.006.
[19] Miao Y, Laun T, Zimmermann P, Zentgraf U.Targets of the WRKY53 transcription factor and its role during leaf senescence in Arabidopsis[J].Plant Molecular Biology,2004,55(6):853-867. doi: 10.1007/s11103-004-2142-6.
[20] Robatzek S, Somssich I E. Targets of AtWRKY6 regulation during plant senescence and pathogen defense[J].Genes & Development,2002,16(9):1139-1149.doi:10.1101/gad.222702.