桃(Prunus persica L.)是深受人们喜爱的世界性大宗水果。2016年我国桃种植面积达836 500 hm2,总产量1 444万t,分别占世界总量的51.0%和57.8%,产量和收获面积均居世界首位[1]。随着我国对桃果需求量的增加及果树栽培技术的提高,简约化栽培已成为果树产业规范化管理和集约化经营发展的一个新趋势。桃矮化品种具有节间短、早结果、早丰产、产出果实品质较高和修剪整形技术容易掌握等众多优点。我国是桃的起源中心,桃的遗传资源种类丰富,生产中通过传统育种手段已经培育出一些矮化品种或类型[2-5],但这些矮化品种主要以观赏型为主,花果兼用或果用品种较少。目前生产上桃栽培品种由于营养生长旺盛,以至生产中依赖频繁修剪和施用植物生长调节剂对树体生长进行调控,这些措施费工费时,导致生产成本增加,且容易产生激素残留等安全方面的问题。刘伟等[6]对我国桃主产区山东省进行了桃生产成本分析,结果表明,桃生产过程中劳动力成本占据生产总成本的53%,其中整形修剪及植物生长调节剂的施用占总用工量的至少25%。因此,开展控制桃节间长度的分子研究,尝试利用基因工程手段培育适宜矮化密植的矮化桃品种对实现桃简约化栽培具有重要意义。
在果树生产中通过使用植物生长调节剂来调节果树生长、控制树势、调控植物的多种生长发育过程,目前常用的植物生长调节剂有赤霉素(Gibberellin,GA)和多效唑(Paclobutrazol,PBZ)2种。GA最显著的作用为促进植物茎端和节间伸长[7],当其合成受到抑制或信号转导途径受到阻遏都会引起活性GA水平的改变并最终导致植物的矮化;PBZ主要通过抑制GA生物合成过程中由贝壳杉烯到贝壳杉烯酸氧化过程来抑制GA的生物合成[8],在植物生长发育过程中通过抑制GA的合成抑制枝条生长,导致节间变短。
目前GA的合成代谢途径和信号转导途径已研究的较为透彻,相关基因在植物生长发育过程中的功能相继被报道。其中KO(Ent-kaurene oxidase,内根贝壳杉烯氧化酶)、GA20-ox(Gibberellin 20-oxidase)和GA3-ox(Gibberellin 3-oxidase)是GA合成途径中关键的合成酶,现有研究证明,该类氧化酶基因发生突变功能丧失后均导致植株矮化[9-11]。Itoh等[9]对1个水稻半矮化突变体进行研究,发现其半矮化性状是由KO基因的突变导致GA合成受抑制而产生;Xu等[12]发现拟南芥ga5突变体的半矮化是由于AtGA20-ox基因内1个点突变(G/A)导致基因功能改变影响活性GA的产生而形成;Carrera等[13]研究发现,外源GA3处理马铃薯叶片后GA20-ox基因的表达量明显被抑制,证明该基因具有明显的负反馈调节作用;Reinecke等[14]研究发现,过表达PsGA3-ox1基因的转基因豌豆节间明显伸长,且活性GA1水平升高。GA2-ox(Gibberellin 2-oxidase)为GA代谢途径中重要的代谢酶,其参与植物体内活性GA的平衡调节过程,该基因过表达后会引起植株出现矮化表型[15]。
GA信号转导途径的基本元件主要由活性GA受体蛋白GID1(Gibberellin insensitive dwarf1)[16]、GA信号途径阻遏蛋白DELLA[17]、泛素E3连接酶复合体(SCFSLY1/GID2)[18]和26S蛋白酶[19]等组成。现有的研究已明确,植物体内的活性GA被受体蛋白GID1感知后与DELLA蛋白互作,形成GA-GID1-DELLA复合体促进DELLA蛋白的降解;DELLA蛋白功能为抑制植物GA效应来抑制植物生长,是GA信号途径的负调控因子。Dill等[20]发现,拟南芥DELLA蛋白特征结构域的缺失直接导致了矮化表型的出现,并且在敲除该基因后GA信号转导途径完全被抑制;Li等[21]发现,1株油菜矮化突变体,由于其GID1基因启动子序列发生突变造成植株对活性GA不敏感从而导致矮化性状的产生。SLY1(SLEEY1)属于F-box蛋白家族,其与DELLA蛋白互作并介导DELLA蛋白的降解,是GA信号转导途径中的正调控因子,该基因的突变会引起植株出现矮化表型[22]。随着研究的不断深入,发现植物乙烯信号转导通路中的重要转录因子ERF类转录因子,其在GA合成和信号转导途径中也发挥重要作用。Zhou等[23]发现,AtERF11是GA合成和信号转导途径中的正调控因子,AtERF11基因的过表达导致活性GA含量升高,且植株表现出明显的节间伸长。
GA合成代谢和信号转导途径相关基因在模式植物和大田作物上的研究为该途径在木本果树上的研究奠定了基础。Boss等[24]研究发现,葡萄品种莫尼耶皮诺中1个单碱基的突变导致DELLA特征结构域发生改变而产生矮化表型;Zhu等[25]研究发现,在苹果中过量表达拟南芥Atgai基因可导致苹果节间长度降低、节数减少,表现矮化表型;Hollender等[26]发现1株桃的矮化突变体,其矮化表型是由PpeGID1c基因的无义突变导致。上述研究为利用GA途径相关基因实现果树矮化育种提供了新思路。基于此,选取对外源GA3和PBZ敏感性适中的黄水蜜桃[27]为试验材料,对其进行外源GA3和PBZ处理,研究其在不同处理后新梢生长变化规律以及嫩梢组织中GA合成代谢和信号转导途径相关基因表达量的变化,为通过基因工程手段获得桃矮化新种质奠定理论基础。
1 材料和方法
1.1 试验材料
供试材料为黄水蜜桃1年生嫁接苗,于2016年春定植于河南农业大学毛庄科教园区,定植时接穗枝条上留3~4个芽后剪去上部枝条,萌发后留下长势较一致芽,抹去其余嫩芽,并进行常规管理。
1.2 生长指标测量及取样方法
1.2.1 外源GA3和PBZ处理试验 于黄水蜜桃嫩梢长至10 cm长时(4月29日),对其进行叶面喷施处理,处理1:100 mg/L GA3;处理2:1 500 mg/L PBZ,均以喷施清水作为对照。每处理随机选取3株为一小区,重复3次,分别于喷施0,2,5,8,11,14,17 d对黄水蜜桃新梢长度及净生长量进行调查;并于处理后0 d、2 h、8 h、2 d、5 d、8 d、11 d、14 d和17 d采集嫩梢,采后迅速放入液氮中,之后放入-80 ℃超低温冰箱保存,用于后续基因表达量的测定。
1.2.2 外源GA3逆转处理试验 通过分析上述PBZ处理后黄水蜜桃嫩梢生长指标测量结果,发现处理后17 d时嫩梢生长受到较强的抑制,故选取PBZ处理后17 d的黄水蜜桃为试材,喷施100 mg/L GA3进行逆转处理,以喷施清水作为对照。随机选取3株为1个小区,重复3次,分别于喷施0,3,6,9,12 d时对黄水蜜桃新梢长度及净生长量进行调查;并于处理后0 d、2 h、8 h、3 d、6 d、9 d和12 d采集嫩梢,采后迅速放入液氮中,之后放入-80 ℃超低温冰箱保存,用于后续基因表达量测定。
1.3 GA代谢和信号转导途径相关基因表达水平的测定
黄水蜜桃嫩梢组织总RNA的提取参照柱式植物总RNA提取试剂盒(Spin Column Plant total RNA Purification Kit)方法进行,购于生工生物工程(上海)股份有限公司。RNA的浓度及质量分别使用分光光度计NanoDrop 2000(Thermo Scientific)和1%的琼脂糖凝胶进行检测。cDNA的合成参照TaKaRa PrimeScriptTM RT reagent Kit说明书进行操作,反转录所得cDNA稀释至200 ng/μL,用于后续试验。荧光定量Mix(PrimeScript RT Master Mix)购于美国应用生物系统公司。与GA合成代谢和信号转导途径相关基因CDS序列从NCBI(http://www.ncbi.nlm.nih.gov/dbest/)数据库下载,利用Primer 3.0在线工具(http://primer3.ut.ee/)设计实时荧光定量PCR引物,目的基因及内参基因定量引物信息见表1,由生工生物工程(上海)股份有限公司进行引物合成。在ABI Prism 7500 FAST Sequence Detection System(Applied Biosystems,Madrid,CA,USA)上进行qRT-PCR分析,以18S rRNA作为内参基因。反应体系和反应程序参照郝鹏博[28]的方法,每个反应设置3次重复。
表1 实时定量PCR引物
Tab. 1 Primers of Real-time quantitative PCR

基因名称Gene基因登录号Accession No.引物序列(5′-3′)Primer sequence引物长度/bpLengthKOXM_007223092.1FGCTGGTTCTCTTCAGGCAAT134RGGGTGGAGTTTGTGAGTGGTGA3-oxXM_007215494.1FGGTTCAGCAGAAGCTCAAGG108RGTGAAGCCCTCAGACCACATGA20-oxXM_007218056.1FACAGCCAAACACCAAGGAAG101RTGGGCACGAAGTATCATCAAGA2-oxXM_007211509.1FGGGAGAGGAGGAAAGCATGT115RTGAGGCTGCAATTCTCTCAADELLAXM_007225568.1FTACGAGACCTGCCCGTACTT121RACTGCATCCCTTGGTTCATCGID1cKT945238.1FTGCCTATGATGATGGATGGA114RTTCCCACCAGAGCTATCACCSLY1XM_007223468.1FCTTCTGGTTGGCAGGACAAT115RTGGTGGTTCAGAGCAGTCAGERF11KT223018.1FAGCATGACTTCCACGCCTAC140RAGGTGGAGGGAGGTTGAGAT18S rRNATC1229FTAGTTGGTGGAGCGATTTGTCTG114RCTAAGCGGCATAGTCCC TCTAAG
1.4 数据统计与分析
本试验数据采用Excel 2016和SPSS 17.0进行数据处理及差异显著性分析,差异显著性分析检验方法为t-检验,P<0.05。利用2-ΔΔCt法分析处理qRT-PCR反应数据,使用SigmaPlot 12.5进行作图分析。
2 结果与分析
2.1 外源GA3和PBZ处理对黄水蜜桃新梢生长及GA合成代谢和信号转导途径相关基因表达的影响
2.1.1 外源GA3和PBZ处理对黄水蜜桃新梢生长的影响 对黄水蜜桃1年生植株分别喷施GA3和PBZ后,定期对不同处理新梢生长量及净生长量进行观察测量,结果如图1所示,外源GA3喷施后随着时间的延长新梢生长量均高于对照处理,而PBZ处理后新梢生长量均低于对照处理,表明外源GA3对新梢生长具有促进作用,PBZ对新梢生长具有抑制作用。此外,对比不同处理的新梢净生长量,发现GA3处理后新梢净生长量高于对照,并在GA3处理后8 d时新梢净生长量显著高于对照;PBZ处理后新梢净生长量低于对照,其新梢净生长量的变化趋势与GA3处理一致,但新梢生长量在PBZ处理后5,8,14 d时均显著低于对照,且在PBZ处理后17 d时极显著低于对照,表明PBZ处理对新梢生长具有明显的抑制作用。
2.1.2 外源GA3和PBZ处理对GA合成代谢途径相关基因表达的影响 在黄水蜜桃新梢生长过程中,对不同处理GA合成代谢途径相关基因在嫩梢组织中的表达量进行测定。结果如图2所示,在外源GA3处理后,与GA合成相关基因KO和GA3-ox的表达量呈现出相同的表达模式,即在处理初期的2 h内2个基因的表达量均略低于对照,此后2个基因表达量呈现先下降后升高趋势,KO基因在处理后17 d时达到峰值;而GA20-ox基因的表达量在处理初期的5 d内与对照类似均处于近乎不表达状态,此后其表达量逐渐上升,在处理后14 d时表达量高于对照,且在17 d时表达量达到峰值,与对照相比上调30倍。在外源PBZ处理后,与GA合成相关基因KO、GA3-ox和GA20-ox的表达趋势各不相同,其中KO基因在处理初期8 h内的表达量低于对照,此后表达量持续高于对照,直到处理后8 d时表达量达到峰值,且高于对照,此后表达量下降并低于对照;GA3-ox基因的表达量在处理初期的8 d内均低于对照,在处理11 d时达到峰值,且高于对照,此后其表达量急剧下降;GA20-ox的表达量在处理初期5 d内与对照类似均处于近乎不表达状态,此后表达量快速升高,在11 d时达到峰值,且低于对照,随后其表达量随着处理时间的延长下降并在处理后17 d时低于对照。
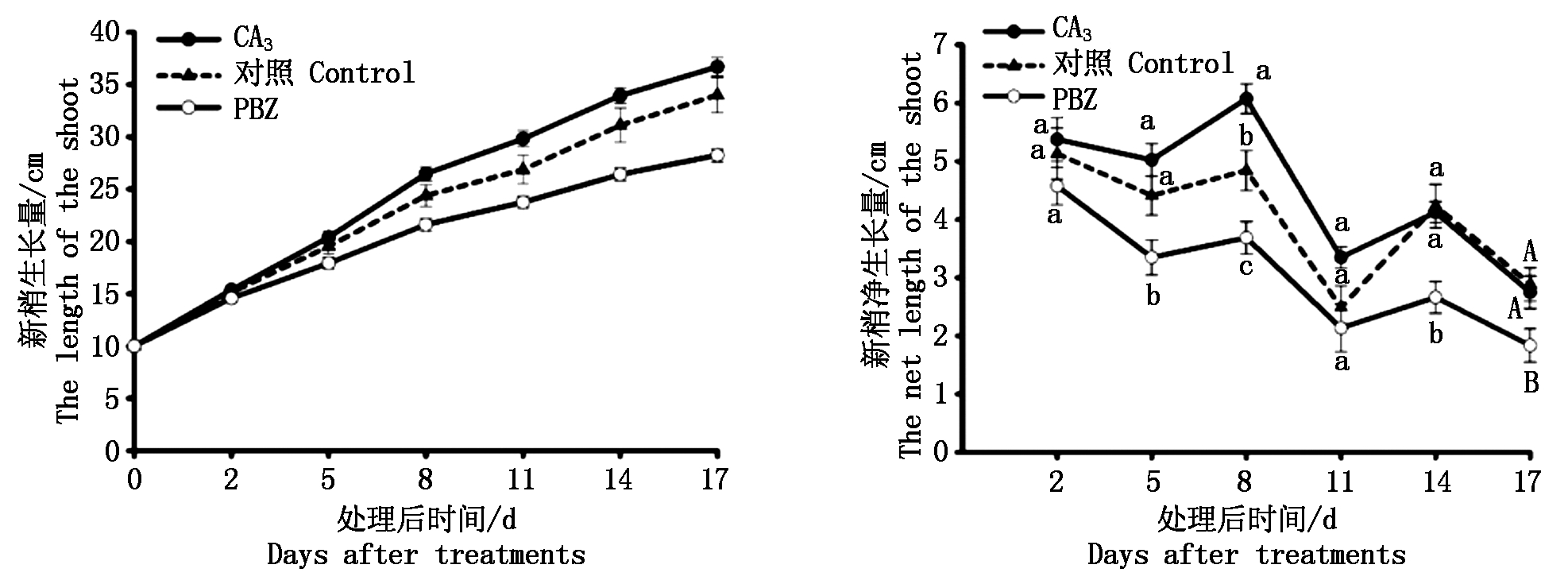
图1 GA3和PBZ处理后黄水蜜桃新梢的生长变化
Fig.1 Changes of shoot growth after GA3 and PBZ treatments on Huangshuimi
与GA代谢相关基因GA2-ox的表达量在不同处理中呈现出相似的表达趋势,在处理前期的8 d内2种处理与对照的GA2-ox基因的表达量均处于近乎不表达状态,在处理11 d时GA2-ox基因的表达量达到峰值且均高于对照,此后GA2-ox基因的表达量在2种处理和对照中都表现出先下降(14 d)后略微上升(17 d)的趋势。

图2 GA合成代谢途径相关基因在黄水蜜桃嫩梢中的表达量
Fig.2 The expression of genes related to the gibberellin biosynthesis pathway in shoot of Huangshuimi
2.1.3 外源GA3和PBZ处理对黄水蜜桃GA信号转导途径相关基因表达的影响 在黄水蜜桃新梢生长过程中,对不同处理GA信号转导途径相关基因在嫩梢组织中的表达量进行检测。结果如图3所示,在外源GA3处理后,嫩梢中DELLA、GID1c和SLY1基因在处理后8 d内与对照类似,均处于近乎不表达状态,随后表达量逐渐升高,在14 d时达到峰值,且此时DELLA、GID1c和SLY1基因的表达量均高于对照,此后表达量随处理时间的延长而降低,而对照处理中DELLA、GID1c和SLY1基因的表达量均在11 d时达到峰值,其后表达量随着处理时间的延长而降低;ERF11基因在处理2h内表达量高于对照,随后下降且趋于不表达,在处理后8 d时表达量逐渐升高并于14 d时达到峰值且高于对照。在外源PBZ处理后,DELLA、GID1c和SLY1基因与对照呈现出相似的表达模式,均在处理后8 d内处于近乎不表达状态,在处理后11 d时达到峰值,且表达量持续低于对照;ERF11基因表达趋势与对照类似,其表达量在处理后2,11 d时出现2个高峰,且与对照相比,ERF11基因表达量始终低于对照。
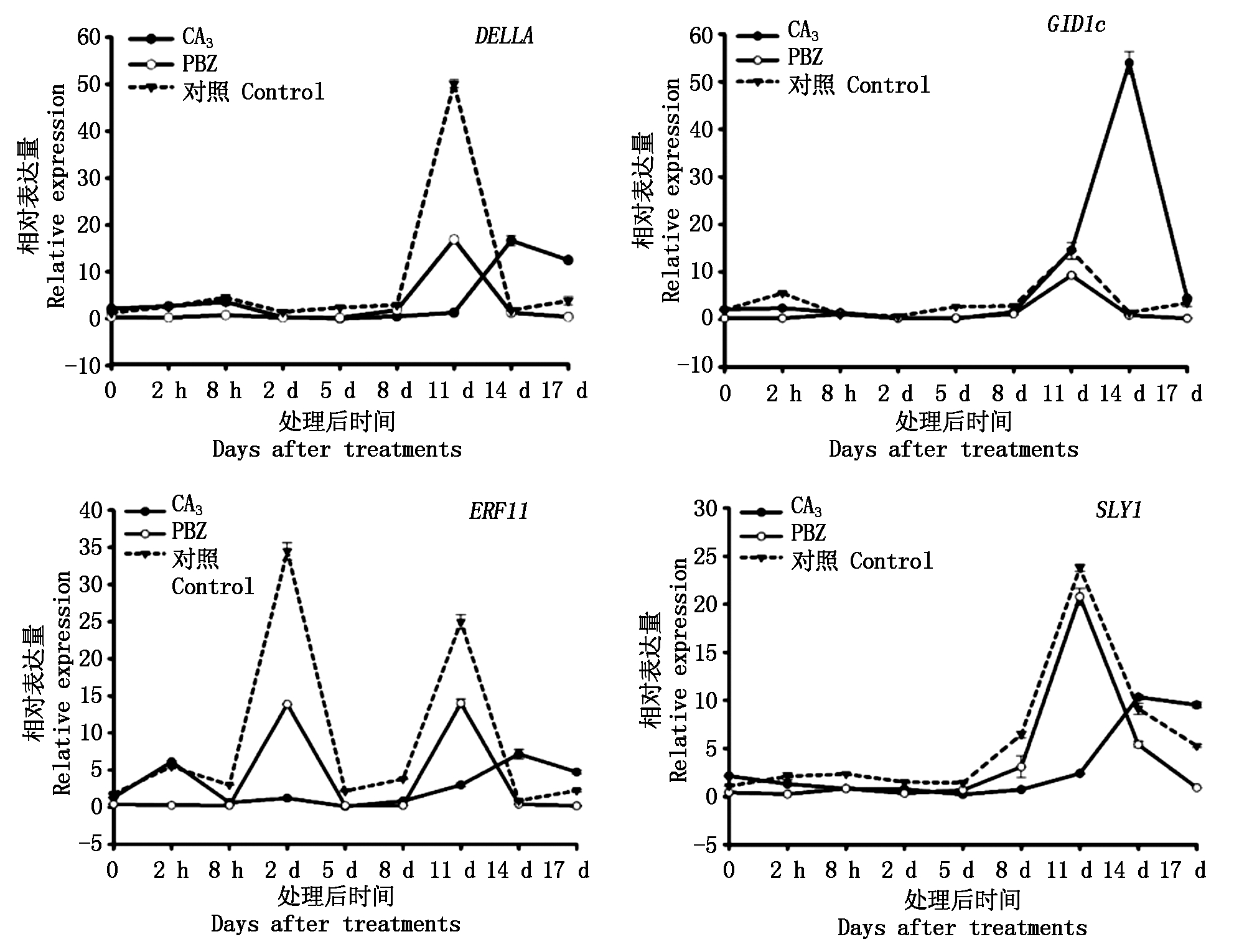
图3 GA信号转导途径中相关基因在黄水蜜桃嫩梢中的表达量
Fig.3 The expression of genes related to the GA signaling transduction pathway in shoot of Huangshuimi
2.2 外源GA3处理对PBZ的逆转过程中黄水蜜桃新梢生长及GA合成代谢和信号转导途径相关基因的表达
2.2.1 逆转处理过程中黄水蜜桃新梢生长变化 对逆转处理后黄水蜜桃新梢生长量的测量结果如图4所示,经过PBZ处理后的黄水蜜桃新梢生长量在外源GA3处理后有所增加,且始终高于对照;GA3逆转处理后新梢净生长量随着处理时间的延长始终高于对照,且在处理后3,6 d时均显著高于对照。表明外源GA3处理可有效逆转PBZ对新梢生长的抑制作用,促进新梢生长。
2.2.2 逆转处理对黄水蜜桃GA合成代谢途径相关基因表达的影响 对黄水蜜桃PBZ处理17 d后,通过叶面喷施GA3对其生长过程进行逆转处理,对逆转过程中GA合成代谢途径相关基因表达水平变化进行测定。结果如图5所示,在外源GA3处理后,黄水蜜桃嫩梢组织中与GA合成相关基因KO和GA20-ox的表达量在处理后8 h内均处于近乎不表达状态,随后其表达量逐渐上升,并于处理后6 d时达到峰值,此时KO基因表达量低于对照,而GA20-ox基因的表达量高于对照,随后KO和GA20-ox基因的表达量逐渐下降,并在处理后12 d时均高于对照;GA3-ox基因在整个逆转时期均处于近乎不表达状态。与GA代谢相关基因GA2-ox的表达量在处理后8 h内逐渐升高,并在处理后3 d时达到峰值,此后表达量逐渐下降,而对照在整个逆转时期均处于近乎不表达状态。
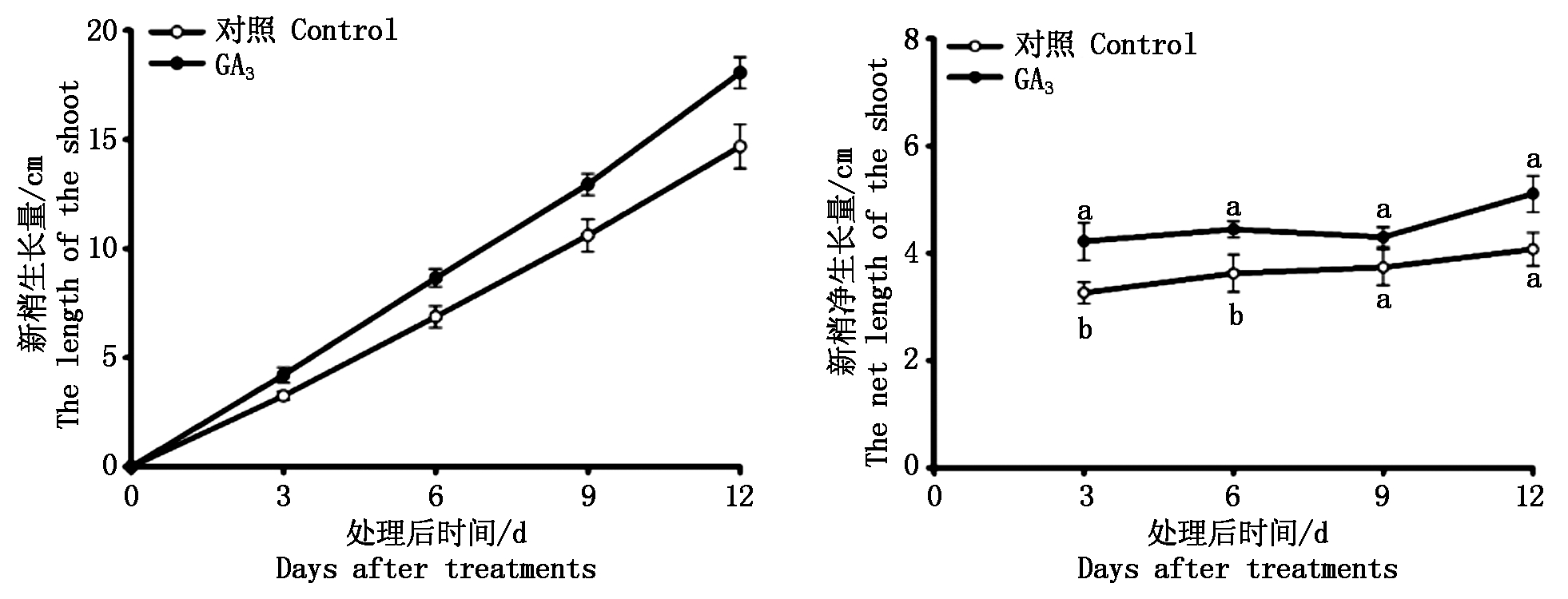
图4 逆转处理后黄水蜜桃新梢生长变化
Fig.4 Changes of shoot growth after reverse treatment on Huangshuimi
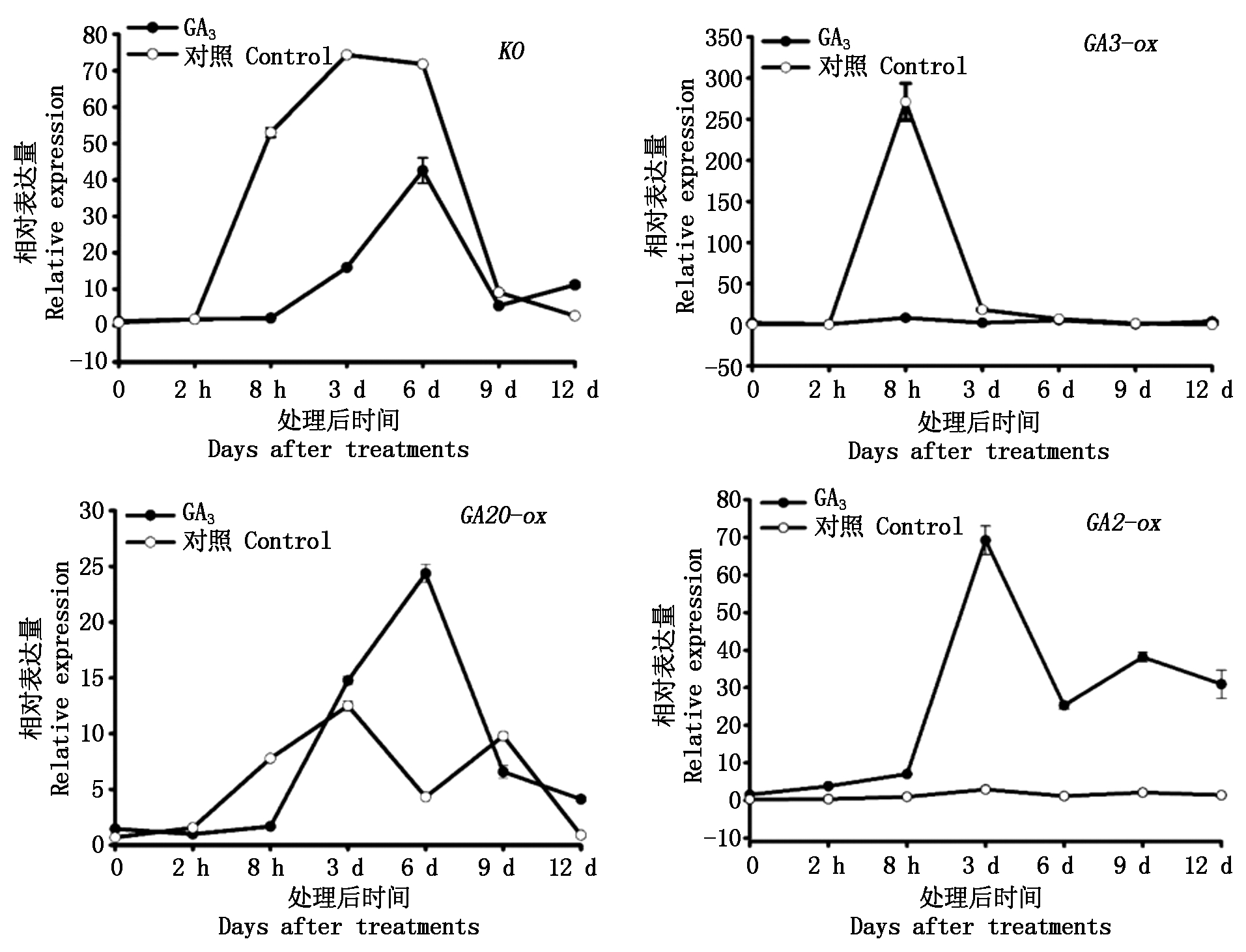
图5 逆转处理后GA合成代谢途径中相关基因在黄水蜜桃嫩梢中的表达量
Fig.5 The expression of genes related to gibberellin biosynthesis pathway in shoot of Huangshuimi after reverse treatment
2.2.3 逆转处理对黄水蜜桃GA信号转导途径相关基因表达的影响 在外源GA3逆转处理后,对黄水蜜桃嫩梢组织中与GA信号转导途径相关基因的表达进行测定。结果如图6所示,GID1c和ERF11基因在处理后8 h内处于近乎不表达状态,随后表达量逐渐升高,其表达量分别在处理后3,6 d时达到峰值,随后表达量逐渐下降且高于对照,而对照处理中GID1c基因在整个时期内均处于近乎不表达状态;DELLA和SLY1基因在处理后2 h内表达量处于下降趋势,随后表达量逐渐上升,DELLA基因表达量在处理后3 d时达到峰值但表达量低于对照,而SLY1基因的表达量在处理初期出现先下降后上升的趋势,并于6 d时表达量达到峰值且表达量高于对照,DELLA和SLY1基因达到峰值后,均逐渐降低并于处理9 d后开始上升,最终表达量均高于对照。
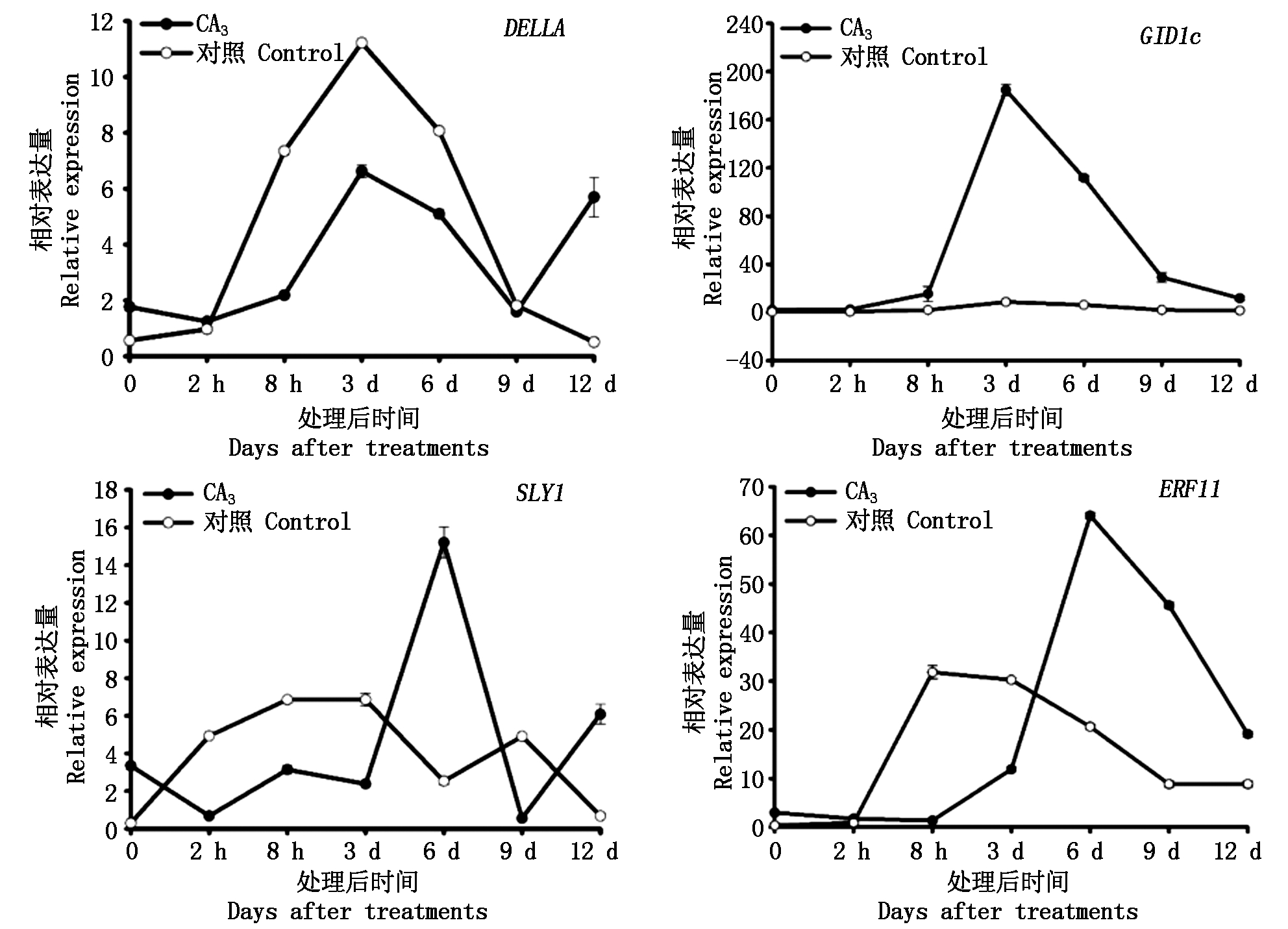
图6 逆转处理后GA信号转导途径中相关基因在黄水蜜桃嫩梢中的表达量
Fig.6 The expression of genes related to the GA signaling transduction pathway in shoot of Huangshuimi after reverse treatment
3 结论与讨论
GA是重要的植物生长调节剂,其最为显著的生理作用是促进植物的茎伸长生长;PBZ作为GA的抑制剂,可使新梢节间缩短,有效抑制果树新梢的营养生长。刘芳等[7]于甜樱桃品种红灯新梢生长期分别对叶面喷施GA3和PP333,结果表明,GA3可明显促进新梢生长而PP333显著抑制新梢生长。本试验中对黄水蜜桃进行外源GA3处理,结果表明,与对照相比桃嫩梢生长量增加,并在GA3处理后8 d时新梢净生长量显著高于对照;在PBZ处理后新梢净生长量低于对照,其新梢净生长量在处理后5,8,14 d时均显著低于对照,并在处理后17 d时达极显著水平。本研究结果与刘芳等[7]研究结果相似,GA3和PBZ处理分别对新梢生长表现出明显的促进和抑制作用。Steffens等[29]通过对苹果枝条进行外源PBZ处理,发现苹果枝条生长受到抑制,节间长度变短,继而喷施GA3后可在短期内使枝条恢复生长。本研究中在PBZ处理后17 d时对黄水蜜桃喷施外源GA3,发现可明显解除PBZ对桃新梢生长的抑制作用,新梢净生长量在处理后3,6 d时均显著高于对照,表明外源GA3处理可有效逆转PBZ对枝条生长的抑制作用,该结果与Steffens等[29]在苹果试验中结果一致。
GA合成代谢途径中关键酶KO、GA20-ox、GA3-ox和GA2-ox对维持植物体内活性GA水平具有重要作用。Carrera等[13]研究发现,StGA20-ox蛋白在马铃薯ga1突变体叶片中高表达,表明GA20-ox受到植物内源活性GA的负反馈调节;Bidadi等[30]对拟南芥茎尖分别喷施GA3和GA合成抑制剂Uniconazole,发现GA3处理导致拟南芥初级根伸长不明显,而Uniconazole处理后初级根明显伸长,且GA20-ox和GA3-ox基因表达量增加,表明GA合成抑制剂的使用提高了活性GA的含量并启动根的伸长;Wuddineh等[15]研究发现,过量表达PvGA2-ox5和PvGA2-ox9基因的转基因柳枝稷(Panicum virgatum L.)均表现出与GA缺陷型突变体类似的矮化表型,外源喷施GA后表型恢复。本试验在对黄水蜜桃进行外源GA3处理后,GA合成相关基因KO和GA3-ox在嫩梢中的表达量在处理2 h后随着处理时间的延长受到抑制作用,而GA20-ox基因在GA处理前期几乎不表达,随着外源GA3药效减弱,KO和GA20-ox基因表达量在处理后14 d时高于对照,结合生长数据进行分析表明,外源GA3处理后GA合成相关基因参与GA负反馈调节;GA代谢相关基因GA2-ox表达量在外源GA3处理后前期近乎不表达,随着处理时间的延长表达量逐渐升高并高于对照,表明外源GA3可促进GA2-ox基因的表达,即GA2-ox基因参与活性GA正反馈调节。该结果与GA3对PBZ逆转处理过程中KO、GA20-ox、GA3-ox和GA2-ox基因表达量变化类似,且与前人在马铃薯[13]、拟南芥[31]中研究结果一致。上述研究结果表明,活性GA对GA合成代谢途径中合成酶基因表达水平具有抑制作用,对GA合成代谢途径中代谢酶基因表达水平具有促进作用。
GA信号转导途径在植物中行使作用的机制为:在植物体内活性GA水平较低的情况下,DELLA蛋白抑制GA效应来减少植物生长,而当植物体内活性GA水平较高时,GID1蛋白受体通过构象变化结合活性GA,之后与DELLA蛋白形成三联体,最后DELLA蛋白被降解,解除对植物生长的抑制作用,开启活性GA对植物生长的促进作用[32-33]。本试验结果表明,在外源GA3处理后,嫩梢中DELLA、GID1c和SLY1基因在处理前期与对照类似均处于近乎不表达状态,随后表达量逐渐升高,在14 d时达到峰值且均高于对照;而在外源GA3对PBZ逆转处理时期,DELLA蛋白基因和GID1c基因的表达与初处理中外源GA3处理的表达趋势不一致,即在逆转处理后其表达量先上升后下降,且在处理后12 d时DELLA蛋白基因和GID1c基因表达量均高于对照,该结果与Hollender等[26]在矮化桃中GID1c基因的研究结果相似。SLY1基因是GA信号转导途径中的正调控因子,在外源GA3处理后,该基因在桃嫩梢中表达量下调,并于后期迅速上升并高于对照;而在逆转处理过程中该基因表达量在处理初期出现先下降后上升的趋势,并于6 d时表达量达到峰值且高于对照;ERF11基因在外源GA3处理后其表达量在处理初期高于对照随后下降且趋于不表达,在处理后8 d时逐渐升高并于14 d时达到峰值且高于对照,进一步印证了Zhou等[23]提出的ERF11对植物生长调节的作用机制。
PBZ是一种植物生长抑制剂,主要通过抑制植物顶端分生组织中GA的产生,从而抑制GA的生物合成[34]。吕文涛等[35]通过对朱顶红品种孔雀花使用不同质量浓度PP333处理发现,300 mg/L PP333处理后可使植株矮化。本试验在对黄水蜜桃进行外源PBZ处理后,与GA合成相关基因KO、GA20-ox和GA3-ox在嫩梢中的表达趋势各不相同,且在处理后17 d时表达量均低于对照,结合生长数据进行分析,表明外源PBZ处理通过下调桃嫩梢中KO、GA20-ox、GA3-ox基因表达量调控枝条生长量,随后进一步下调GA合成基因在不同组织中表达量对生长产生抑制作用,表明外源PBZ处理可抑制与GA合成相关基因(KO、GA20-ox和GA3-ox)的表达;与GA代谢相关基因GA2-ox在外源PBZ处理后初期与对照变化趋势较为一致,在处理后11 d时表达量达到峰值且高于对照,随着外源PBZ药效减弱,于处理后17 d时表达量略低于对照,表明外源PBZ处理可抑制GA2-ox基因的表达;与GA信号转导途径相关基因(DELLA、GID1c、SLY1和ERF11)的表达量表现为在外源PBZ处理后,嫩梢组织在整个处理时期的表达量均低于对照,受到一定的抑制作用。综上所述,推测外源PBZ处理在转录水平上通过抑制GA途径中相关基因表达水平,从而降低GA信号转导途径的效率来行使对植物的生长调节作用。
[1] 王志强, 牛良, 崔国朝, 鲁振华, 曾文芳. 我国桃栽培模式现状与发展建议[J]. 果农之友, 2015(9): 3-4.doi: 10.3969/j.issn.1671-7759.2015.09.001.
Wang Z Q, Niu L, Cui G Z, Lu Z H, Zeng W F. Present situation and development suggestion of peach cultivation model in China[J]. Fruit Growers′ Friend, 2015(9): 3-4.
[2] Lammerts W E. The breeding of ornamental edible peaches for mild climates. i. inheritance of tree and flower characters[J]. American Journal of Botany, 1945, 32(2): 53-61. doi: 10.2307/2437110.
[3] Scorza R. Characterization of four distinct peach tree growth types[J]. Journal of the American Society for Horticultural Science, 1984, 109(4): 455-457.
[4] Moore J N, Rom R C, Brown S A, Klingaman G L.′Bonfire′ dwarf peach, ′Leprechaun′ dwarf nectarine, and ′Crimson Cascade′ and ′Pink Cascade′ weeping peaches[J]. Hortscience, 1993, 28(8): 854.
[5] 宗学普, 张贵荣, 王志强, 刘淑娥. 矮化型油桃新品种──矮丽红[J]. 落叶果树, 1997(2): 26. doi: 10.13855/j.cnki.lygs.1997.02.021.
Zong X P, Zhang G R, Wang Z Q, Liu S E. A new dwarf nectarine variety-Alihong[J]. Deciduous Fruits, 1997(2): 26.
[6] 刘伟, 张安宁, 李桂祥, 董晓民, 陶吉寒. 山东省桃生产成本与效益分析[J].中国农学通报,2016, 32(1): 88-91.doi: 10.11924/j.issn.1000-6850.casb15060047.
Liu W, Zhang A N, Li G X, Dong X M, Tao J H. Production cost and benefit analysis of peach in Shandong province[J]. Chinese Agricultural Science Bulletin, 2016, 32(1): 88-91.
[7] 刘芳,袁华招,沈欣杰,廖雄,李天红.外源GA3和PP333对甜樱桃新梢生长及赤霉素代谢关键基因表达的影响[J].核农学报, 2013, 27(3): 272-278.
Liu F, Yuan H S, Shen X J, Liao X, Li T H. Effects of GA3 And PP333 on shoot growth and gene expression of gibberellins metabolism in Prunus avium[J]. Journal of Nuclear Agricultural Sciences, 2013, 27(3): 272-278.
[8] Sugavanam B. Diastereoisomers and enantiomers of paclobutrazol: Their preparation and biological activity[J]. Pesticide Science, 2010, 15(3): 296-302. doi: 10.1002/ps.2780150312.
[9] Itoh H, Tatsumi T, Sakamoto T, Otomo K, Toyomasu T, Kitano H, Ashikari M, Ichihara S. A rice semi-dwarf gene, Tan-Ginbozu (D35), encodes the gibberellin biosynthesis enzyme, ent-kaurene oxidase[J]. Plant Molecular Biology, 2004, 54(4): 533-547. doi:10.1023/b:plan.0000038261.21060.47.
[10] Spielmeyer W, Ellis M H, Chandler P M. Semidwarf (sd-1), "green revolution" rice, contains a defective gibberellin 20-oxidase gene[J]. Proceedings of the National Academy of Sciences, 2002, 99(13): 9043-9048.doi: 10.1073/pnas.132266399.
[11] Ayele B T, Magome H, Lee S, Shin K, Kamyia Y, Soh M S, Yamaguchi S. GA-sensitive dwarf1-1D, (gsd1-1D) defines a new mutation that controls endogenous GA levels in Arabidopsis[J]. Journal of Plant Growth Regulation, 2014, 33(2): 340-354. doi:10.1007/s00344-013-9385-x.
[12] Xu Y L, Li L, Wu K, Peeters A J, Gage D A, Zeevart J A. The GA5 locus of Arabidopsis thaliana encodes a multifunctional gibberellin 20-oxidase: Molecular cloning and functional expression[J]. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(14): 6640-6644.doi: 10.1073/pnas.92.14.6640.
[13] Carrera E, Jackson S D, Prat S. Feedback control and diurnal regulation of gibberellin 20-oxidase transcript levels in potato[J]. Plant Physiology, 1999, 119(2): 765-773. doi: 10.1104/pp.119.2.765.
[14] Reinecke D M, Wickramarathna A D, Ozga J A, Kurepin L V, Jin A L, Good A G, Pharis R P. Gibberellin 3-oxidase gene expression patterns influence gibberellin biosynthesis, growth, and development in pea[J]. Plant Physiology, 2013, 163(2): 929-945. doi: 10.2307/23598714.
[15] Wuddineh W A, Mazarei M, Zhang J Y, Poovaiah C R, Mann D G J, Ziebell A, Sykes R W, Davis M F, Udvardi M K, Stewart C N. Identification and overexpression of gibberellin 2-oxidase (GA2ox) in switchgrass (Panicum virgatum L.) for improved plant architecture and reduced biomass recalcitrance[J]. Plant Biotechnology Journal, 2015, 13(5): 636-647. doi: 10.1111/pbi.12287.
[16] Ueguchi-Tanaka M, Ashikari M, Nakajima M, Itoh H, Katoh E, Kobayashi M, Chow T, Hsing Y C, Kitano H, Yamaguchi I, Matsuoka M. Gibberellin insensitive DWARF1 encodes a soluble receptor for gibberellin[J]. Nature, 2005, 437(7059): 693-698. doi: 10.1038/nature04028.
[17] Peng J, Carol P, Richards D E, King K E, Cowling R J, Murphy G P, Harberd N P. The Arabidopsis GAI gene defines a signaling pathway that negatively regulates gibberellin responses[J]. Genes & Development, 1997, 11(23): 3194. doi: 10.1101/gad.11.23.3194.
[18] Mcginnis K M, Thomas S G, Soule J D, Strader L C, Zale J M, Sun T P, Steber C M. The Arabidopsis SLEEPY1 gene encodes a putative F-Box subunit of an SCF E3 ubiquitin ligase[J]. Plant Cell, 2003, 15(5): 1120-1130. doi: 10.1105/tpc.010827.
[19] Miller J, Gordon C. The regulation of proteasome degradation by multi-ubiquitin chain binding proteins[J]. Febs Letters, 2005, 579(15): 3224-3230. doi: 10.1016/j.febslet.2005.03.042.
[20] Dill A, Sun T. Synergistic derepression of gibberellin signaling by removing RGA and GAI function in Arabidopsis thaliana[J]. Genetics, 2001, 159(2): 777-785. doi: 10.1002/gene.1080.
[21] Li H, Wang Y, Li X, Wang Z, Zhao Y, Wang M. A GA-insensitive dwarf mutant of Brassica napus L. correlated with mutation in pyrimidine box in the promoter of GID1[J]. Molecular Biology Reports, 2011, 38(1): 191. doi: 10.1007/s11033-010-0094-2.
[22] Kim S I, Park B S, Kim D Y, Yeu S Y, Song S I, Song J T, Seo H S. E3 SUMO ligase AtSIZ1 positively regulates SLY1-mediated GA signalling and plant development[J]. Biochemical Journal, 2015, 469(2): 299-314. doi: 10.1042/BJ20141302.
[23] Zhou X, Zhang Z L, Park J, Tyler L, Yusuke J, Qiu K, Nam E A, Lumba S, Desveaux D, McCourt P, Kamiya Y, Sun T P. The ERF11 transcription factor promotes internode elongation by activating gibberellin biosynthesis and signaling[J]. Plant Physiology, 2016, 171(4): 2760. doi: 10.1104/pp.16.00154.
[24] Boss P K, Thomas M R. Association of dwarfism and floral induction with a grape ′green revolution′ mutation[J]. Nature, 2002, 416(6883): 847-850. doi: 10.1038/416847a.
[25] Zhu L H, Li X Y, Welander M. Overexpression of the Arabidopsis gai gene in apple significantly reduces plant size[J]. Plant Cell Reports, 2008, 27(2): 289-296. doi: 10.1007/s00299-007-0462-0.
[26] Hollender C A, Hadiarto T, Srinivasan C, Scorza R, Dardick C. A brachytic dwarfism trait (dw) in peach trees is caused by a nonsense mutation within the gibberellic acid receptor PpeGID1c[J]. New Phytologist, 2016, 210(1): 227-239. doi: 10.1111/nph.13772.
[27] 郝鹏博, 李敏, 谭彬, 郑先波, 叶霞, 李继东, 冯建灿. 31个桃品种(系)幼树对外源GA3和PBZ的敏感性分析[J]. 江西农业学报, 2017, 29(1): 11-15. doi: 10.19386/j.cnki.jxnyxb.2017.01.03.
Hao P B, Li M, Tan B, Zheng X B, Ye X, Li J D, Feng J C. Sensitivity analysis of 31 peach variety (line) saplings to exogenous GA3 and paclobutrazol[J]. Acta Agriculturae Jiangxi, 2017, 29(1): 11-15.
[28] 郝鹏博. 外源赤霉素和多效唑对桃节间长度及赤霉素代谢基因表达影响[D]. 郑州:河南农业大学, 2017.
Hao P B. Effects of GA3 and PBZ on internode length and gene expression of gibberellins metabolism in peach (Prunus persica L.)[D]. Zhengzhou: Henan Agricultural University, 2017.
[29] Steffens G L, Wang S Y. Biochemical and physiological alteration in apple trees caused by a gibberellin biosynthesis inhibitor, paclobutrazol [J]. Acta Horticulturae, 1986, 179(179): 433-442.doi: 10.17660/ActaHortic.1986.179.68.
[30] Bidadi H, Yamaguchi S, Asahina M, Satoh S. Effects of shoot-applied gibberellin/gibberellin-biosynthesis inhibitors on root growth and expression of gibberellin biosynthesis genes in Arabidopsis thaliana[J]. Plant Root, 2010, 4: 4-11. doi: 10.3117/plantroot.4.4.
[31] Murase K, Hirano Y, Sun T P, Hakoshima T. Gibberellin-induced DELLA recognition by the gibberellin receptor GID1[J]. Nature, 2008, 456(7221): 459-463. doi: 10.1038/nature07519.
[32] Harberd N P, Belfield E, Yasumura Y. The angiosperm Gibberellin-GID1-DELLA growth regulatory mechanism: How an "inhibitor of an inhibitor" enables flexible response to fluctuating environments[J]. Plant Cell, 2009, 21(5): 1328-1339. doi: 10.1105/tpc.109.066969.
[33] Kawaide H. Biochemical and molecular analyses of gibberellin biosynthesis in fungi[J]. Journal of the Agricultural Chemical Society of Japan, 2006, 70(3): 583-590. doi: 10.1271/bbb.70.583.
[34] 邱碧云. 果树密植矮化剂──PP333[J]. 植物杂志, 1987(5): 29.
Qiu B Y. A dwarfing agent for dense planting of fruit trees-PP333[J]. Plants, 1987(5): 29.
[35] 吕文涛, 周玉珍, 娄晓鸣, 成海钟, 陈艳. 多效唑和矮壮素对盆栽朱顶红矮化的影响[J]. 湖北农业科学, 2016(16): 4214-4216. doi: 10.14088/j.cnki.issn0439-8114.2016.16.036.
LÜ W T, Zhou Y Z, Lou X M, Cheng H D, Chen Y. Dwarfing effects of paclobutrazol and chlorocholine chloride on potted Hippeastrum vittatum[J]. Hubei Agricultural Sciences, 2016(16): 4214-4216.