玉米是我国主要的粮食作物,其生长发育过程中经常会遭遇干旱等非生物胁迫的影响,造成不可估量的经济损失。胡瑞法等[1]研究表明,限制不同地区玉米生产发展的第一因素是干旱(除西南地区旱地秋玉米外),干旱严重影响玉米生长,造成产量下降甚至绝产。植物在长期的进化演变过程中,逐渐形成感受、传递干旱信息的系统及一系列生物反应机制来应对胁迫,从而降低干旱胁迫对机体的伤害[2]。植物对干旱信号的感知、传递及抵御过程涉及一系列抗逆相关基因的表达调控。
由蛋白磷酸酶和蛋白激酶介导的蛋白质可逆磷酸化在植物逆境信号传递过程中发挥重要调控作用。蛋白磷酸酶2C (Protein phosphatese 2C,PP2C) 是一类丝氨酸/苏氨酸蛋白磷酸酶,在生物体中以单体酶的形式存在,其活性依赖于Mg2+或Mn2+[3]。植物中PP2C类蛋白数量丰富,在PP2C类蛋白的N-或C-末端含有一个保守的催化结构域,另一端含有一个复杂多变的区域,其结构的多样性表明PP2C类蛋白在信号传导过程中具有不同的功能[4-6]。诸多研究表明,植物中PP2C类蛋白在信号转导中起着非常重要的调控作用,尤其在干旱、高盐及低温等环境胁迫所诱导的信号转导途径中[4]。Miyazaki等[7]发现,在冰叶日中花中有10个PP2C类磷酸酶基因(Mpc1-Mpc10),其中,干旱胁迫下Mpc5在根中的表达量上升,高温胁迫下Mpc8在叶中的表达量升高。对烟草Ntpp2c1基因的转录水平进行研究发现,干旱胁迫能强烈而持续地诱导Ntpp2c1基因表达;而热激却使之表达水平迅速降低[8]。过表达鸢尾IrisPP2C1基因的转基因拟南芥可提高对ABA的敏感性,暗示IrisPP2C1基因在ABA信号调控过程中起正调控作用[9]。藜苜蓿中MtPP2C8基因在干旱、低温、ABA处理下显著上调表达[10]。过表达BdPP2CA6基因的转基因拟南芥植株耐盐性提高[11]。干旱、ABA和盐胁迫可高度诱导水稻PP2C家族A亚族基因OsPP108、MsPP2C的表达,过表达OsPP108、MsPP2C的转基因拟南芥耐盐性提高[12-13]。谷子PP2C家族A亚族基因都能被ABA诱导表达,部分基因被PEG、高盐、低温和低氮胁迫诱导表达[14]。山毛榉中FsPP2C1/C2基因在ABA信号途径中起正调控作用, 在拟南芥中过表达山毛榉中FsPP2C1/C2基因可增强转基因植株对非生物胁迫的抗性[15-16]。而Liu等[17]研究发现,在非生物胁迫下,ZmPP2C基因的组成型表达降低了植物在种子萌发和幼苗生长期间对干旱和盐的耐受性,同时降低了转基因拟南芥对ABA的敏感性。Santiago等[18]报道,过表达PP2Cs家族的HAB1基因导致转基因拟南芥抗旱性减弱,说明PP2C在逆境响应中起负调控作用。FaABI1编码的蛋白磷酸酶PP2C1负调控果实成熟[19]。综上表明,PP2C作为调节因子直接或间接参与逆境胁迫的信号转导。到目前为止,植物中对于PP2C的报道主要集中于拟南芥、水稻等植物[4,20-21]。Schweighofer等[4]报道了拟南芥中有76个PP2C基因,Xue等[21]报道了水稻中有78个PP2C基因,但其中绝大部分基因的功能还未得到深入的研究。玉米上PP2C基因的克隆及功能验证研究较少[17],还有很多PP2C基因未被克隆及分析。为此,以抗旱性较强的玉米自交系豫882为材料,进行转录组测序分析,筛选受干旱诱导强烈上调表达的PP2C基因,然后采用同源克隆方法克隆基因,并进行生物信息学及表达模式分析,初步探讨PP2C基因在逆境胁迫下的响应,为玉米抗逆遗传改良提供基因资源。
1 材料和方法
1.1 植物材料与处理
供试材料为玉米抗旱自交系豫882,由河南农业大学陈彦惠教授实验室馈赠。
挑选籽粒圆润饱满、大小较为一致的玉米种子,播种于装有营养土的花盆中,在自然条件下生长到三叶一心时,对玉米根、茎、叶分别进行取样,用于基因组织特异性表达分析。
挑选大小一致的玉米种子,种于用 Hoagland′s营养液浇透的营养土中,在温室中(26 ℃/22 ℃、16 h光照/8 h黑暗、相对湿度70%)生长到三叶一心,将其从营养钵中连根部营养土一起轻轻拔起,用流动的自来水冲洗干净,然后对幼苗进行以下处理。干旱处理:将玉米幼苗置于含有20% PEG6000的Hoagland′s营养液中,于处理0,2,4,8,12,24,48,60,72,84,96 h及复水(R)1,3 d随机挑3株玉米幼苗分别取根、叶,将3株样品等量混和,迅速置液氮中冷冻备用。ABA、NaCl处理:将玉米幼苗分别置于含有100 μmol/L ABA、200 mmol/L NaCl的Hoagland′s营养液中,于处理0,2,4,8,12,24,48,60,72,84,96 h分别取根、叶,迅速置液氮中冷冻备用。高温处理:将玉米幼苗置于37 ℃培养箱中,处理0,2,4,8,12,24,48,60,72,84,96 h后分别取根、叶迅速置液氮中冷冻备用。以在正常温室(温度26 ℃/22 ℃)生长未进行处理的玉米幼苗为对照。
1.2 20%PEG6000胁迫处理转录组数据分析
将豫882干旱胁迫处理60,90 h及复水3 d的材料(以未处理材料为对照样品)送广州基迪奥生物科技有限公司利用Illumina HiSeq 2000进行测序, 获得转录组数据。采用FPKM(Fragments per kilobase of exon model per million mapped reads)值反映基因的表达丰度,胁迫处理样本与对照样本基因表达量差异倍数以log2(FC)(Fold change)值表示。根据基因在不同处理时间后的表达量, 筛选在胁迫后表达量明显上调、复水后表达量明显下调的编码PP2C的基因。
1.3 总RNA的提取和cDNA的合成
采用TRIzol(Invitrogen,USA)试剂提取样品RNA,并检测其质量。参照反转录试剂盒PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKaRa)的操作说明进行cDNA的合成,然后置于-80 ℃保存备用。
1.4 基因克隆
根据Phytozome数据库中ZmPP2C6-01的同源序列,利用Primer Premier 5.0 软件设计特异引物,引物为ZmPP2C6-01F1:5′-ATGGCCGAGATCTGCT GCGA-3′和ZmPP2C6-01R1:5′-TCATATGCCCCG GCGGAGAT-3′,以玉米cDNA 为模板,PCR 扩增ZmPP2C6-01的完整开放阅读框(ORF)。PCR扩增体系 (25 μL),LA Taq(5 U/μL)0.2 μL、dNTP Mixture(10 mmol/L)2 μL、2×GC Buffer Ⅱ 2 μL、上、下游引物(10 μmmol/L)各1 μL、cDNA模板1 μL,用ddH2O补足至25 μL。 PCR扩增反应程序为:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s,35个循环;72 ℃ 10 min,4 ℃保存。将PCR扩增产物回收纯化后,连接至pMD19-T载体后转化大肠杆菌DH5α感受态细胞,经菌液PCR检测挑取阳性单克隆,送往北京华大基因有限公司测序,利用DNAMAN软件对测序结果进行比对分析。
1.5 生物信息学分析
根据ZmPP2C6-01基因的测序结果,利用 Seqman 软件对基因全长进行拼接, 用Editseq 进行ORF查询及蛋白质分子质量和等电点分析;利用Gene Structure Display Server(GSDS 2. 0) (http: //gsds. cbi. pku. edu. cn /index.php) 对基因结构进行分析;利用SOPMA(http://www.expasy.org/tools/)预测蛋白质的二级结构;采用在线工具Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)进行蛋白质三级结构预测;利用Expasy(http://www.expasy.org/tools/protscale.html)对蛋白质的疏水性/亲水性进行预测;利用DNAMAN和MEGA 5.1对不同物种PP2C蛋白的氨基酸序列进行比对分析,并构建系统进化树;利用STRING(https://string-db.org/cgi/input.pl)预测ZmPP2C6-01的互作蛋白。
1.6 亚细胞定位载体的构建、转化及绿色荧光蛋白(GFP)表达分析
用特异引物ZmPP2C6-01F2:5′-CTAGACTAG TATGGCCGAGATCTGCTGC-3′(划线部分为SpeⅠ酶切位点)和ZmPP2C6-01R2:5′-TTGGCGCGCCATAT GCCCCGGCGGAGAT-3′(划线部分为AscⅠ酶切位点)扩增ZmPP2C6-01基因,用SpeⅠ和AscⅠ双酶切ZmPP2C6-01产物和表达载体pMDC83,然后用T4-DNA连接酶连接酶切产物,构建亚细胞定位载体,转化并进行测序验证。参照刘兆明等[22]方法,采用热激法将正确的重组质粒转至农杆菌EHA105感受态细胞中,再一次酶切测序验证正确后,选取培养至四-六叶期健壮的本氏烟,将含阳性克隆的农杆菌重悬液用1 mL注射器浸染烟叶下表皮,48 h后将注射孔部位的叶片表皮组织制作成临时玻片,倒置于共聚焦荧光显微镜下观察本氏烟表皮细胞内GFP表达情况。
1.7 实时荧光定量PCR(qRT-PCR)
根据ZmPP2C6-01全长cDNA序列设计实时荧光定量PCR引物,前引物为ZmPP2C6-01F3:5′-GCTG TCCGTCGACCACAAG-3′,后引物为ZmPP2C6-01R3:5′-CGCTCCGTCACCGTTACCT-3′。以玉米18SrRNA基因为内参,其引物为18S1: 5′-CCTGCGGCTTAA TTGACTC-3′,18S2:5′-GTTAGCAGGCTGAGGTCT GG-3′。荧光定量PCR反应在Bio-Rad CFX96 荧光定量PCR仪中进行,荧光定量PCR反应体系及反应程序参考SYBR Premix Ex TaqTM(TaKaRa)试剂盒说明书,PCR体系(20 μL)含:SYBR Premix Ex TaqⅡ10 μL,正、反向引物(10 μmmol/L)各1 μL,cDNA模板1 μL,用ddH2O补足至20 μL。反应程序:95 ℃ 30 s;95 ℃ 15 s,60 ℃ 30 s,40个循环。根据 2-ΔΔCt法[23]计算基因相对拷贝数。
2 结果与分析
2.1 干旱强烈诱导表达编码PP2C基因的筛选
通过GO基因功能注释结果筛选到响应干旱胁迫的差异表达的编码PP2C的基因8个,对20%PEG6000处理样本和对照样本进行差异表达分析(表1)发现,除胁迫处理60,96 h的GRMZM2G057907与胁迫处理96 h的 GRMZM2G082487外,其他基因均上调表达;在复水3 d后,8个编码PP2C基因的表达量均低于对照。其中,GRMZM2G057907、GRMZM2G010298、GRMZM2G108309、GRMZM2G155991均只在1个时间点达到显著水平;而GRMZM2G059453在60,96 h均达到显著水平;GRMZM2G082487在60 h、复水3 d时均达到显著水平;GRMZM2G134628、GRMZM2G166297在96 h、复水3 d达到显著水平,因GRMZM2G166297在胁迫60,96 h的表达量及log2(FC)值大于GRMZM2G134628,而复水3 d的 log2(FC)小于GRMZM2G134628,在干旱胁迫下响应强烈,整体呈升-升-降的表达趋势。本研究以GRMZM2G166297为对象,对其进行进一步研究发现,其编码的蛋白为PP2C6,故命名为ZmPP2C6-01。
表1 8个编码PP2C基因的差异表达分析
Tab.1 Differential expression analysis of 8 coding PP2C genes
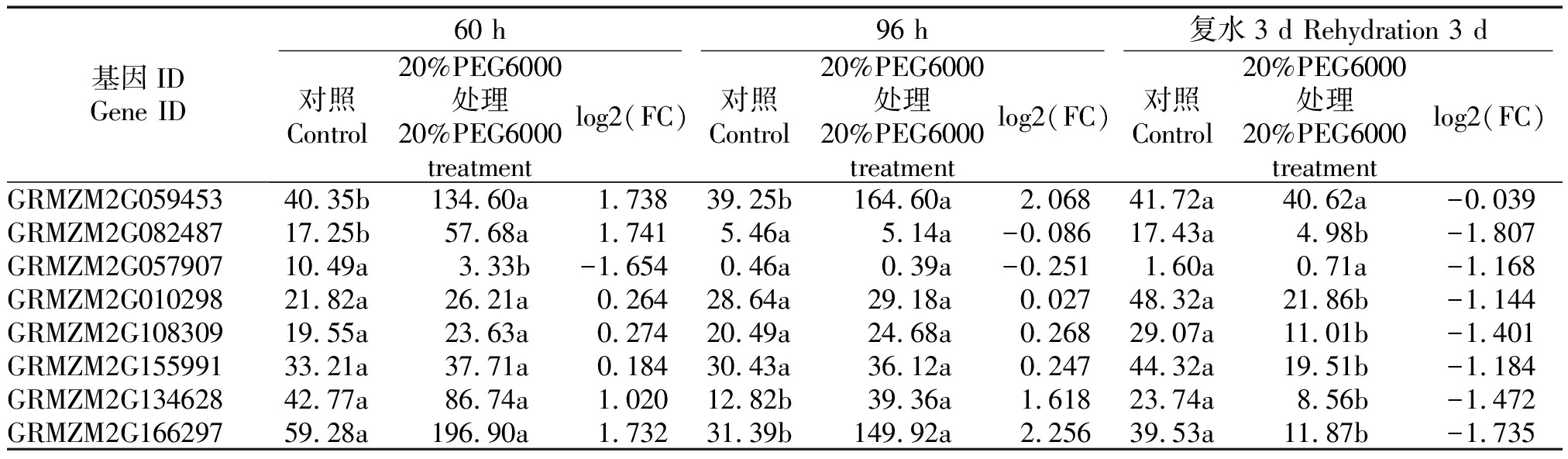
基因IDGene ID60 h96 h复水3 d Rehydration 3 d对照Control20%PEG6000处理20%PEG6000 treatmentlog2(FC)对照Control20%PEG6000处理20%PEG6000 treatmentlog2(FC)对照Control20%PEG6000处理20%PEG6000 treatmentlog2(FC)GRMZM2G05945340.35b134.60a1.73839.25b164.60a2.06841.72a40.62a-0.039GRMZM2G08248717.25b57.68a1.7415.46a5.14a-0.08617.43a4.98b-1.807GRMZM2G05790710.49a3.33b-1.6540.46a0.39a-0.2511.60a0.71a-1.168GRMZM2G01029821.82a26.21a0.26428.64a29.18a0.02748.32a21.86b-1.144GRMZM2G10830919.55a23.63a0.27420.49a24.68a0.26829.07a11.01b-1.401GRMZM2G15599133.21a37.71a0.18430.43a36.12a0.24744.32a19.51b-1.184GRMZM2G13462842.77a86.74a1.02012.82b39.36a1.61823.74a8.56b-1.472GRMZM2G16629759.28a196.90a1.73231.39b149.92a2.25639.53a11.87b-1.735
注:不同字母表示差异显著性(P<0.05)。
Note:Different letters indicate significant differences (P<0.05).
2.2 ZmPP2C6-01基因的克隆及其编码蛋白质结构分析
以特异引物ZmPP2C6-01F1/R1进行PCR扩增,产物用1%琼脂糖凝胶电泳检测发现,目的片段为1 242 bp(图1),经回收纯化,连接至PMD19-T载体,转化大肠杆菌DH5α感受态细胞,挑取正确的阳性克隆送公司测序。
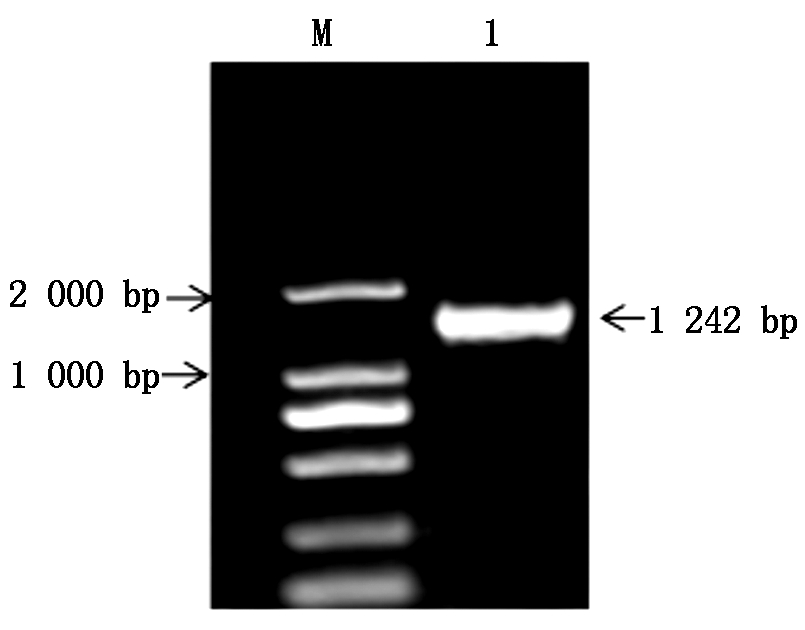
M.DL2000 DNA Marker;1.cDNA的PCR产物。
M.DL2000 DNA Marker;1.PCR product of cDNA.
图1 ZmPP2C6-01的PCR扩增产物
Fig.1 PCR product of ZmPP2C6-01 gene
对ZmPP2C6-01基因结构进行分析发现,该基因有4个外显子、3个内含子,CDS(Coding sequence)全长为1 242 bp,5′UTR为234 bp,3′UTR为220 bp,共编码413个氨基酸,编码的蛋白质分子质量为43.8 ku,等电点为6.6(图2-A)。二级结构分析表明,ZmPP2C6-01含43.58%的α-螺旋、12.84%的延伸链、5.57%的β-转角和38.01%的不规则卷曲(图2-B),由此可知,ZmPP2C6-01蛋白主要由α-螺旋和无规则卷曲组成。预测ZmPP2C6-01 的三级结构(图2-C)发现,ZmPP2C6-01蛋白中包含α-螺旋、β-转角、延伸链和无规则卷曲。对ZmPP2C6-01氨基酸序列的亲水性/疏水性进行预测(图2-D)发现,ZmPP2C6-01氨基酸序列中亲水性氨基酸所占比例高于疏水性氨基酸,因此,整个肽链表现为亲水性,ZmPP2C6-01蛋白为亲水性蛋白。
2.3 ZmPP2C6-01 氨基酸序列比对及进化树分析
对ZmPP2C6-01氨基酸序列进行同源性搜索,选择同源性较高的其他4种植物的PP2C蛋白进行多序列比对和同源性分析发现,参比序列均含有一个非常保守的PP2C蛋白结构域,同时ZmPP2C6-01的氨基酸序列长度与其他物种PP2C蛋白序列长度相近,ZmPP2C6-01氨基酸序列与高粱、玫瑰草、哈氏黍、粟PP2C蛋白氨基酸序列同源性分别达85%,81%,79%,78%(图3)。进化树分析显示,ZmPP2C6-01与高粱的PP2C蛋白亲缘关系最近,玫瑰草、哈氏黍、粟依次次之;而与冬小麦、粗山羊草等的PP2C蛋白亲缘关系相对较远(图4)。

A.基因结构分析;B.蛋白质二级结构预测;C.蛋白质三级结构预测;D.蛋白质亲水性/疏水性预测。B中长竖线区.α螺旋;中竖线区.延伸链;次中竖线区.β-转角;短线区.无规则卷曲。
A.Gene structure analysis; B.Protein secondary structure prediction; C.Protein tertiary structure prediction; D.Protein hydrophilicity/hydrophobicity prediction.B:Long vertical bar area.α-helix; Medium vertical bar area.Extended strand; Sub-medium vertical bar area.β-turn; Short vertical bar area.Random coil.
图2 ZmPP2C6-01基因结构及其编码蛋白质亲水性/疏水性分析
Fig.2 ZmPP2C6-01 gene structure and hydrophily/hydrophobicity of its encoding protein

图3 ZmPP2C6-01蛋白与多种植物PP2C蛋白的多序列比对分析
Fig.3 Multiple sequence alignment of ZmPP2C6-01 and PP2C proteins from other plants
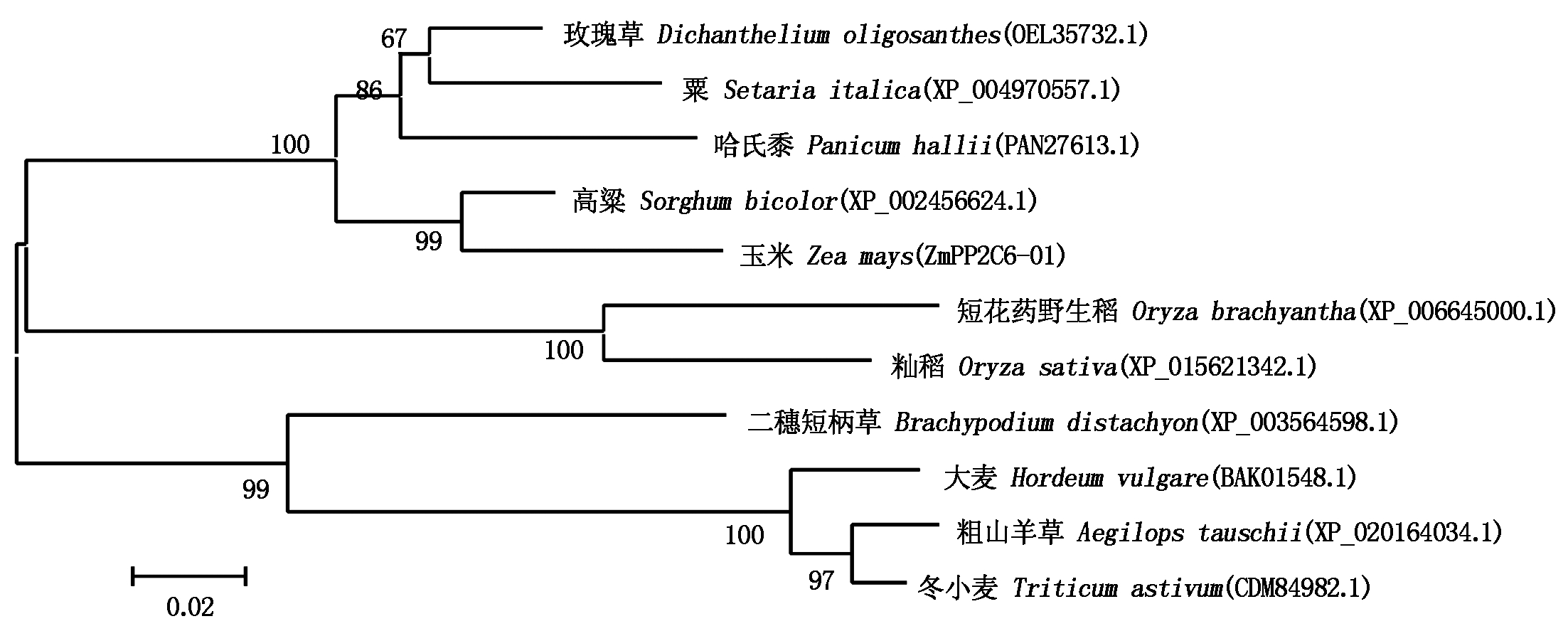
图4 ZmPP2C6-01蛋白的进化树分析
Fig.4 Phylogenetic tree analysis of ZmPP2C6-01 protein
2.4 ZmPP2C6-01的互作蛋白预测
利用在线预测与ZmPP2C6-01互作的蛋白发现(表2),与ZmPP2C6-01互作系数较高的编码相关蛋白的基因有5个,分别编码假设蛋白、丝氨酸/苏氨酸蛋白激酶,互作系数介于0.924~0.973。
2.5 ZmPP2C6-01编码蛋白的亚细胞定位分析
烟草下表皮亚细胞定位结果(图5)表明,在含有对照载体pMDC83-GFP的烟草细胞膜、细胞质和细胞核中均发现了绿色荧光;而对于含有pMDC83-ZmPP2C6-01-GFP 融合表达载体的烟草来说,主要在细胞核中发现了绿色荧光,说明ZmPP2C6-01定位于细胞核中。
表2 ZmPP2C6-01互作蛋白分析
Tab.2 Analysis of ZmPP2C6-01 interacting protein

基因IDGene ID编码蛋白质Encoding proteins互作系数Interaction coefficientGRMZM2G180916-P04假设蛋白0.973pco148380b假设蛋白0.973GRMZM2G138861-P04丝氨酸/苏氨酸蛋白激酶SAPK80.973GRMZM2G066867-P01假设蛋白0.973GRMZM2G700533-P01蛋白激酶0.924

图5 ZmPP2C6-01在烟草表皮中的亚细胞定位
Fig.5 Subcellular localization of ZmPP2C6-01 in tobacco epidermis
2.6 ZmPP2C6-01的表达分析
2.6.1 组织特异性表达分析 基因在植物组织中的富集表达部位与其功能密切相关, 为了研究玉米ZmPP2C6-01基因的功能,对玉米根、茎、叶中ZmPP2C6-01基因的表达水平进行分析(图6)发现,ZmPP2C6-01基因在根中的表达量最高,其次是叶,茎中的表达水平最弱。其中,ZmPP2C6-01基因在根中的表达量是茎的7.3倍,是叶的2.3倍,这暗示ZmPP2C6-01基因可能在根中发挥更重要的作用。
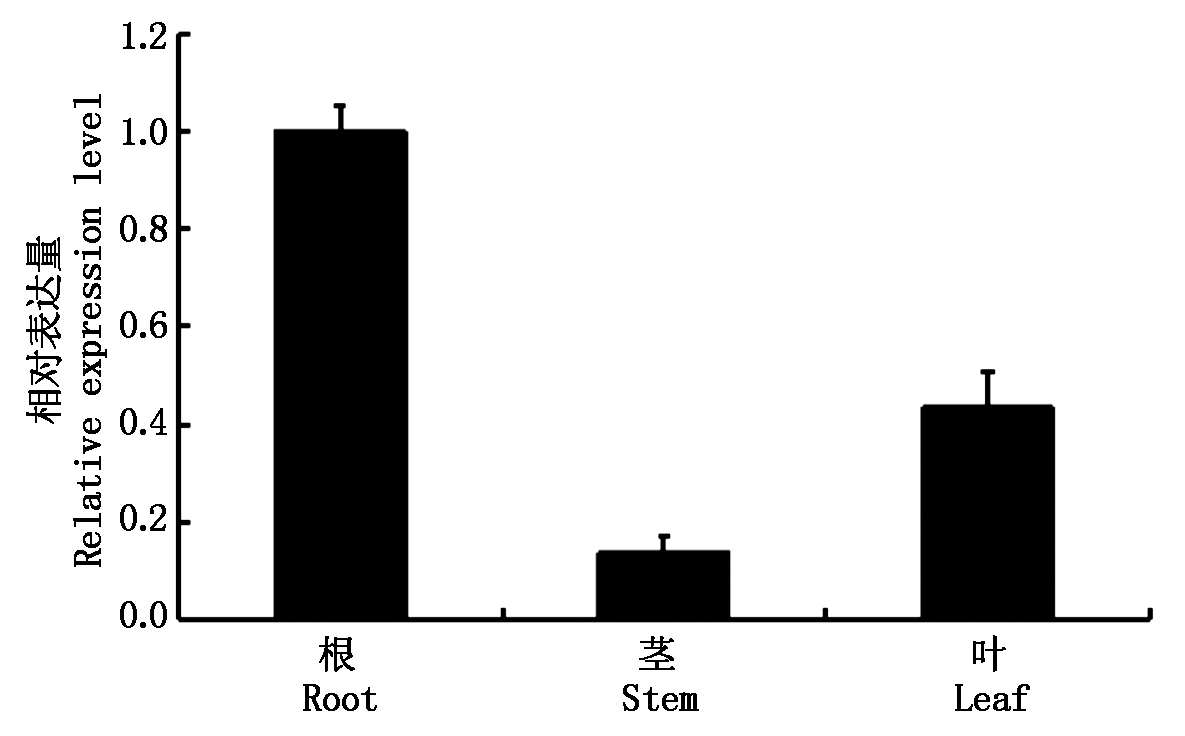
图6 ZmPP2C6-01基因在玉米不同组织中的表达水平
Fig.6 Expression level of ZmPP2C6-01 gene in different tissues of maize
2.6.2 胁迫表达分析
2.6.2.1 20%PEG6000 由图7可知,在20%PEG6000胁迫条件下,ZmPP2C6-01基因在根中的表达量大部分时间点均高于对照,胁迫8 h达到峰值,是对照的8.8倍,胁迫处理96 h后进行复水,复水1~3 d表达量迅速下降,均低于对照;ZmPP2C6-01基因在叶中的表达量均高于对照,在胁迫24~84 h表达量随着胁迫时间的延长逐渐增加,于84 h达到最大值,复水1~3 d表达量上升,均高于对照。
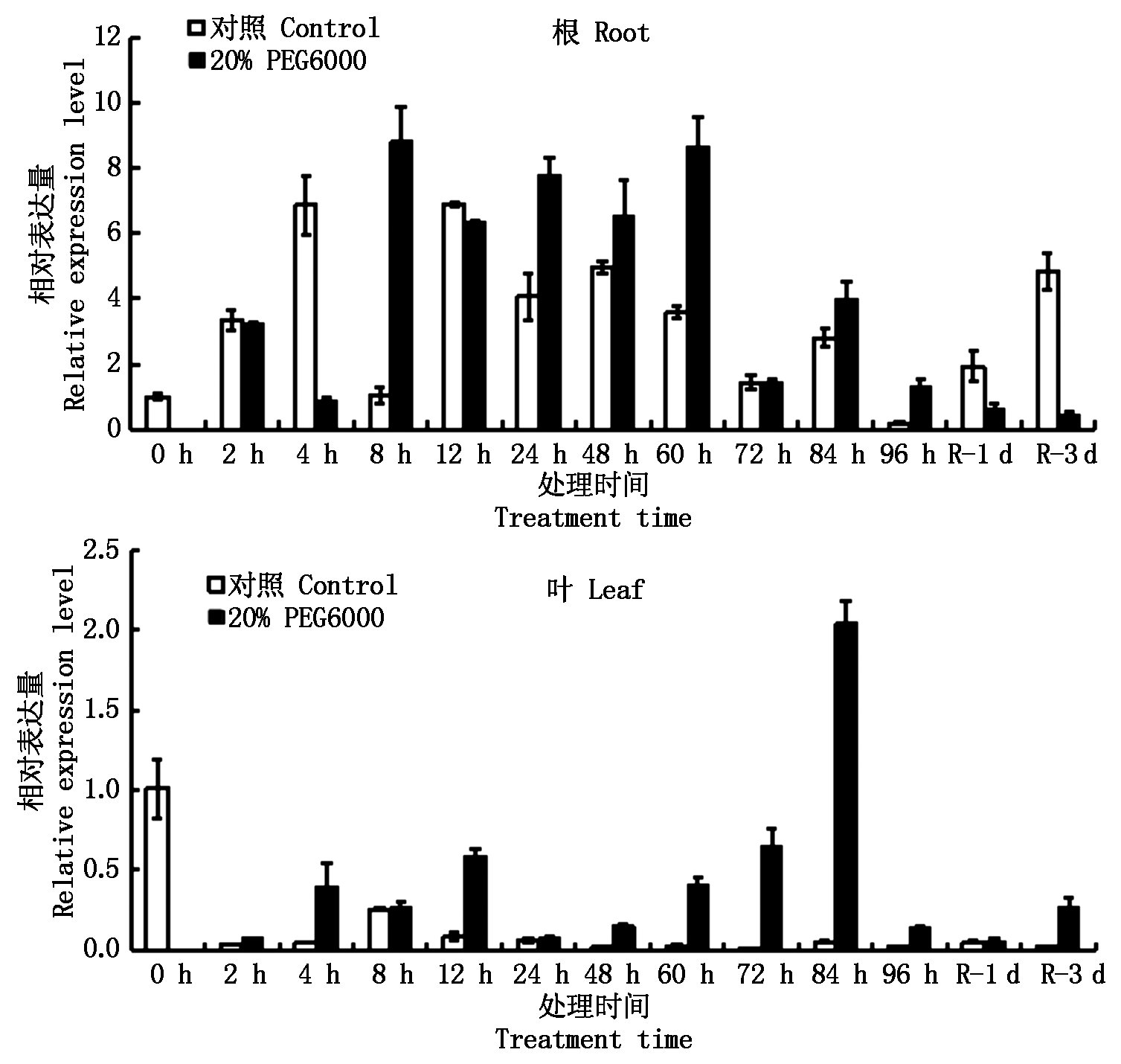
图7 20% PEG6000胁迫条件下ZmPP2C6-01基因的表达分析
Fig.7 Expression analysis of ZmPP2C6-01 gene under 20% PEG6000 stress condition
2.6.2.2 100 μmol/L ABA 100 μmol/L ABA胁迫条件下,ZmPP2C6-01基因在根中的表达量整体上低于对照(8 h除外);ZmPP2C6-01基因在叶中的表达量均高于对照,2 h受诱导表达程度最大,在12~84 h表达量相对比较稳定,96 h表达量升高(图8)。
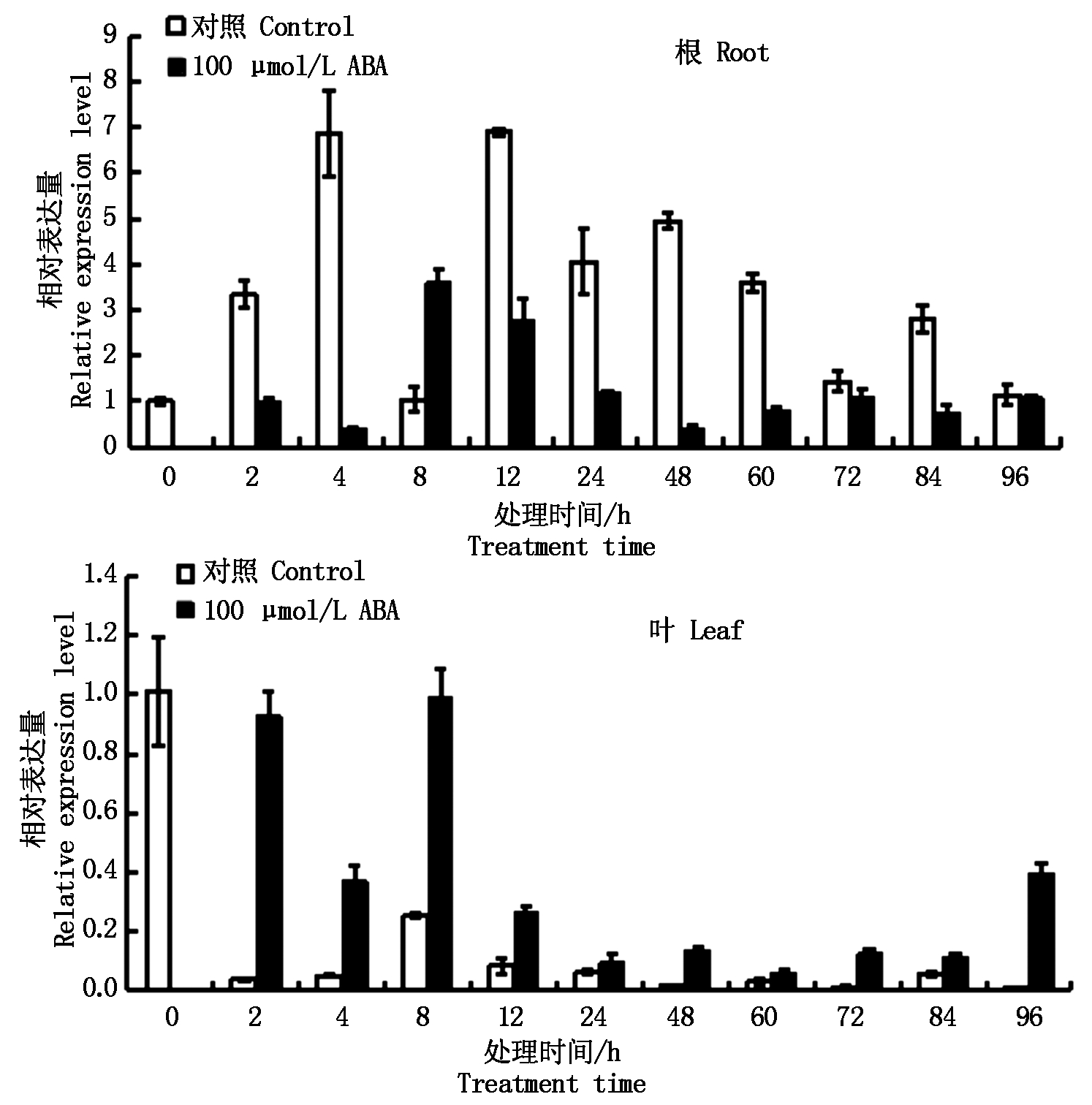
图8 ABA胁迫条件下ZmPP2C6-01基因的表达分析
Fig.8 Expression analysis of ZmPP2C6-01 gene under ABA stress condition
2.6.2.3 200 mmol/L NaCl 在200 mmol/L NaCl胁迫条件下,玉米幼苗于胁迫处理84 h后死亡。在胁迫处理过程中,ZmPP2C6-01基因在根中的表达量在大部分时间点均低于对照(8,60 h除外);0~60 h,ZmPP2C6-01基因在叶中的表达量相对比较稳定,之后表达量急剧上升,在84 h表达量最高(图9)。
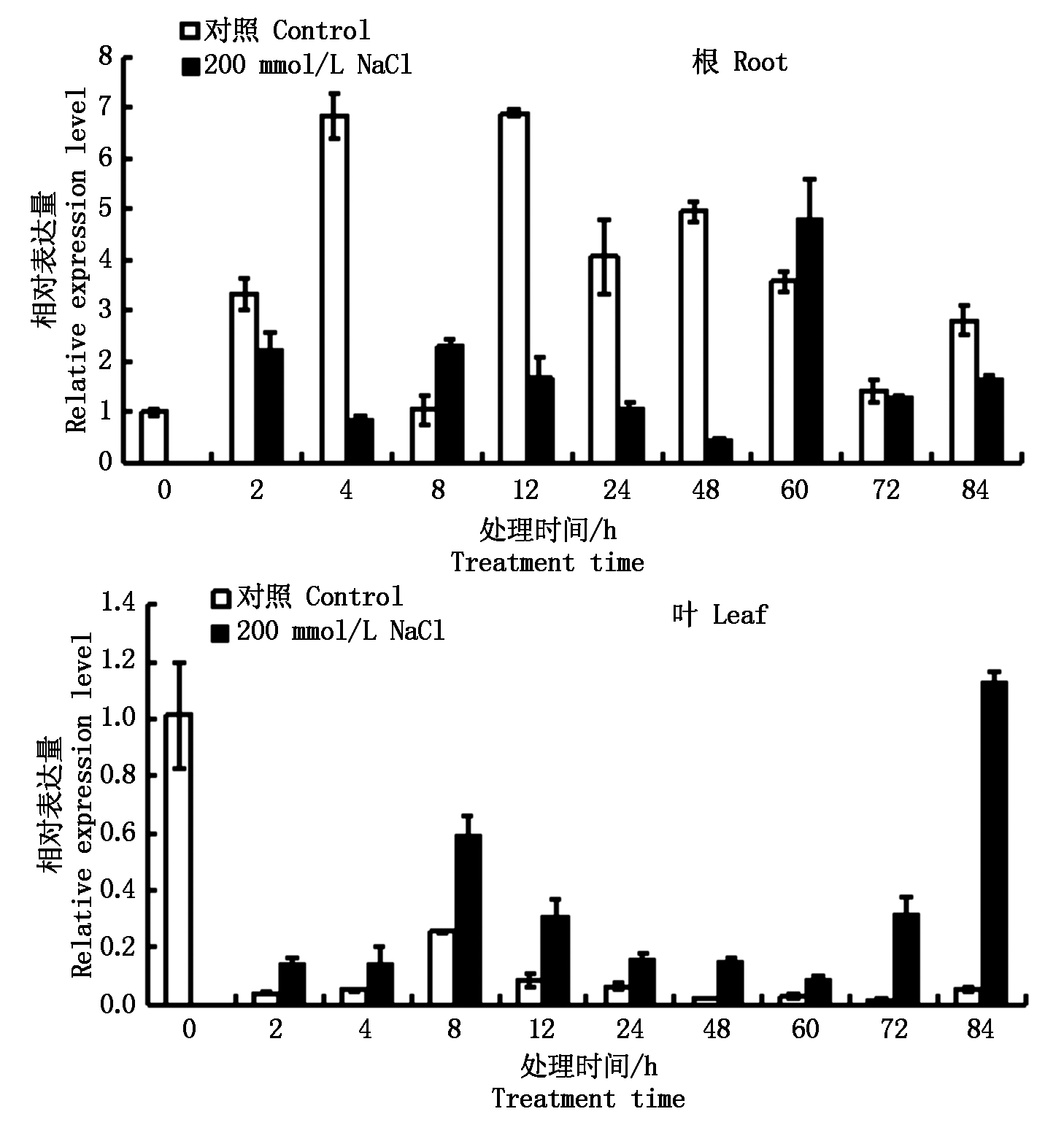
图9 盐胁迫条件下ZmPP2C6-01基因的表达分析
Fig.9 Expression analysis of ZmPP2C6-01 gene under NaCl stress condition
2.6.2.4 高温 在高温(37 ℃)胁迫条件下,ZmPP2C6-01基因在根中的表达量整体上低于对照;ZmPP2C6-01基因在叶中的表达量均高于对照,随着胁迫处理时间的延长,受诱导表达程度先降低后逐渐增强,96 h达到最大(图10)。
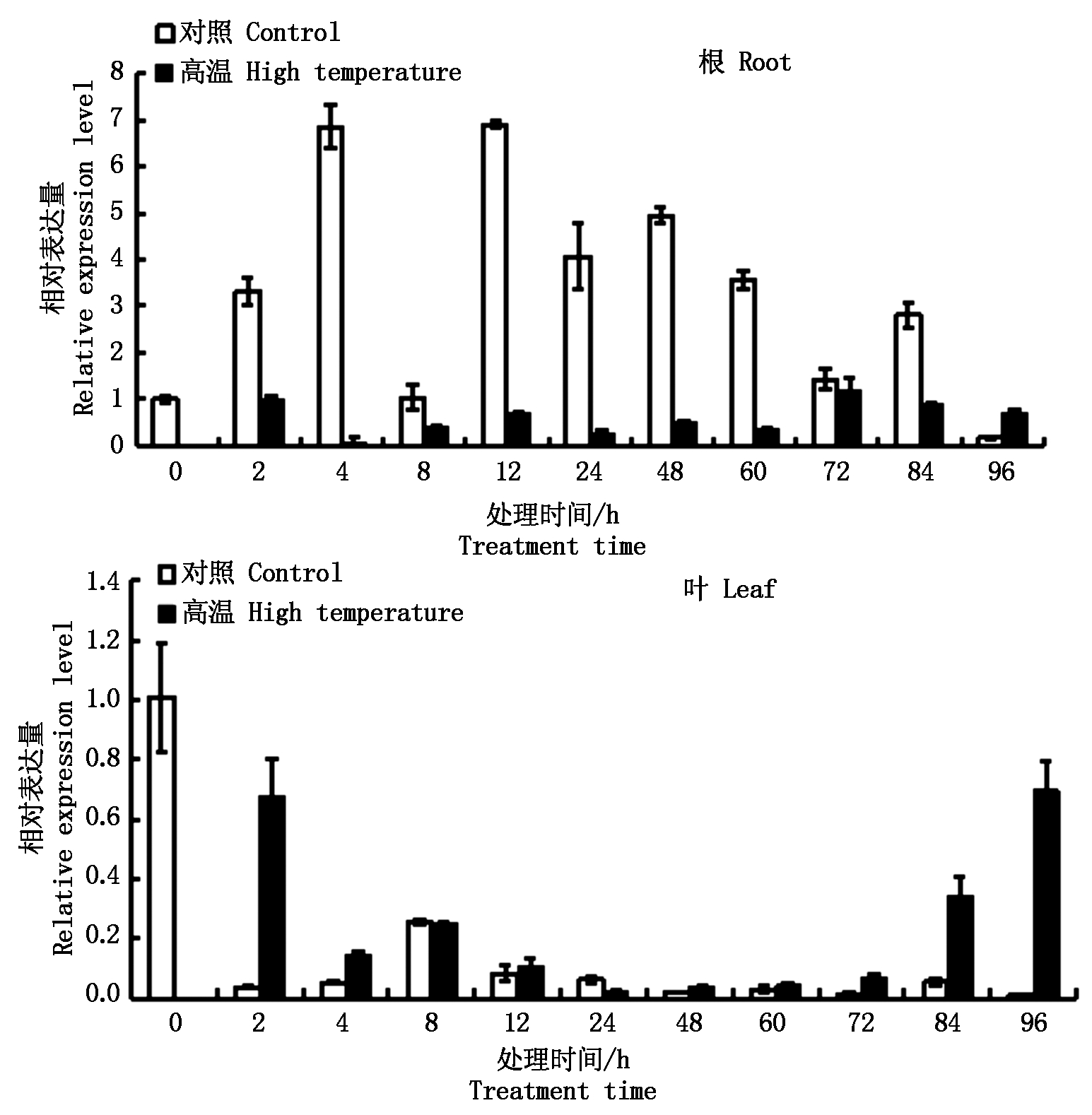
图10 高温胁迫条件下ZmPP2C6-01基因的表达分析
Fig.10 Expression analysis of ZmPP2C6-01 gene under high temperature stress
3 结论与讨论
本研究从玉米干旱胁迫转录组中筛选出8个响应干旱胁迫的PP2C蛋白基因,通过基因表达分析表明,ZmPP2C6-01(GRMZM2G166297)在干旱胁迫下被强烈诱导表达。利用同源克隆技术成功克隆了ZmPP2C6-01基因,经生物信息学软件分析发现,该基因完整的开放阅读框为1 242 bp,编码413个氨基酸,其编码的蛋白质含43.58%的α-螺旋、12.84%的延伸链、5.57%的β-转角和38.01%的不规则卷曲,为亲水性蛋白。ZmPP2C6-01蛋白与高粱的PP2C蛋白同源性最高,亲缘关系最近。亚细胞定位结果显示,ZmPP2C6-01蛋白定位于细胞核中,这与邓克勤等[24]的拟南芥PP2C蛋白定位在细胞核的研究结果一致。
官晓敏[25]发现,LjPP2C在百脉根的不同组织中均有表达,但表达量却不相同,主要在叶和根中表达,其次是接种的根瘤菌,在茎中的表达量低。PdPP2C基因在欧美杨的不同组织中差异表达,表达水平表现为根>功能叶>顶端叶>茎[26]。说明这些基因属于组成型表达基因,且功能存在明显差异。本研究中,ZmPP2C6-01基因的组织特异性表达分析结果表明,该基因在根中的表达量最高,其次是叶,在茎中的表达量最少。说明该基因通过特异的分子表达机制参与植物组织的生长发育。
本研究结果表明,ZmPP2C6-01基因在不同非生物胁迫条件下或同一非生物胁迫条件下不同部位中的表达模式均不一致。胡晓丽[27]对ZmPP2C2基因进行Northern杂交分析发现,玉米幼苗进行PEG处理后,该基因在根系中的表达量明显强于对照。颜彦等[28]发现,在非生物胁迫条件下,二穗短柄草叶中BdPP2C2基因显著被PEG和低温胁迫诱导表达。Liu等[29]报道,在干旱和盐处理下,PP2CG1基因在拟南芥的芽中上调表达,暗示AtPP2CG1正调控植物的耐盐性。本研究结果发现,在干旱胁迫下,ZmPP2C6-01基因在根中的表达量大部分时间点高于对照,胁迫8 h达到峰值,同时在叶中上调表达,在胁迫24~84 h表达量随着胁迫时间的延长总体上逐渐增加,于84 h达到最大值。在ABA、NaCl、高温胁迫下,ZmPP2C6-01基因在根中大部分时间点的表达量均低于对照,整体呈下降趋势,在叶中的表达量均高于对照,呈上调表达模式。而王培龙等[30]研究发现,在非生物胁迫下,刚毛柽柳ThPP2C基因在其不同部位及不同处理下差异表达,在干旱(20%PEG6000)处理后的根中呈下调表达模式,而在叶中,胁迫早期差异不明显,48 h达到高峰,与ZmPP2C6-01被PEG处理下整体呈上调表达趋势相一致;盐渍(NaCl)、脱落酸(ABA)和茉莉酸(JA)处理后,ThPP2C基因在根中均表现为上调表达,而在叶中均表现为下调表达。徐云峰[31]研究发现,干旱、低温胁迫均抑制ZmPP2C-A10基因在玉米根系中的表达,在胁迫处理过程中该基因表达水平与胁迫时间呈负相关;而在复水阶段,该基因表达量又逐渐恢复到正常水平。综上所述,ZmPP2C6-01基因可能参与玉米的抗旱、耐盐及ABA、高温应答反应,但具体调控途径不同。在后续研究中将继续对ZmPP2C6-01基因在玉米抗逆过程中的具体功能和作用机制进行分析。
[1] 胡瑞法, Meng Erika C H, 张世煌, 石晓华. 采用参与式方法评估中国玉米研究的优先序[J]. 中国农业科学,2004, 37(6):781-787.doi:10.3321/j.issn:0578-1752.2004.06.001.
Hu R F, Meng Erika C H, Zhang S H, Shi X H. Using a participatory approach to assess the priority of Chinese corn research[J]. Scientia Agricultura Sinica, 2004, 37(6):781-787.
[2] Mizoi J, Shinozaki K, Yamaguchi-Shinozaki K. AP2/ERF family transcription factors in plant abiotic stress responses[J]. Biochim Biophys Acta, 2012, 1819(2): 86-96.doi:10.1016/j.bbagrm.2011.08.004.
[3] 陈金焕, 夏新莉, 尹伟伦. 植物2C类蛋白磷酸酶及其在逆境信号转导中的作用[J]. 北京林业大学学报, 2010, 32(5):168-171.doi:10.13332/j.1000-1522.2010.05.004.
Chen J H, Xia X L, Yin W L. Plant 2C protein phosphatase and its role in stress signal transduction[J]. Journal of Beijing Forestry University, 2010, 32(5):168-171.
[4] Schweighofer A, Hirt H, Meskiene L. Plant PP2C phosphatases: emerging functions in stress signaling[J]. Trendsin Plant Science, 2004, 9(5):236-243.doi:10.1016/j.tplants.2004.03.007.
[5] Meskiene I, Baudouin E, Schweighofer A, Liwosz A, Jonak C, Rodriguez P L, Jelinek H, Hirt H. Stress-induced protein phos-phatase 2C is a negative regulator of a mitogen-activated protein kinase[J]. J Biol Chem, 2003, 278(21): 18945-18952.doi:10.1074/jbc.M300878200.
[6] Shi Y. Serine/threonine phosphatases: Mechanism through structure[J]. Cell, 2009, 139(3): 468-84. doi: 10.1016/j.cell.2009.10.006.
[7] Miyazaki S, Koga R, Bohnert H J.Tissue and environmental response-specific expression of 10 PP2C transcripts in Mesembryanthemum crystallinum [J]. Mol Gen Genet, 1999,261(2): 307-316.doi:10.1007/s004380050971.
[8] Vranov E, Langebartels C, Van Montagu M,Inze D,Van Camp W. Oxidative stress, heat shock and drought differentially affect expression of a tobacco protein phosphatase 2C[J]. J Exp Bot, 2000,51(351):1763-1764.doi:10.1093/jexbot/51.351.1763.
[9] 倪飞.鸢尾蛋白磷酸酶2C(PP2C)基因的克隆和功能分析及拟南芥PP2C基因家族的鉴定和基因组学分析[D]. 泰安:山东农业大学, 2009.
Ni F. Cloning and functional analysis of iris protein phosphatase 2C(PP2C) gene and identification and genomics analysis of Arabidopsis PP2C gene family[D]. Taian:Shandong Agricultural University, 2009.
[10] Yang Q, Liu K, Niu X, Wang Q, Wan Y, Yang F, Li G, Wang Y, Wang R. Genome-wide identification of PP2C genes and their expression profiling in response to drought and cold stresses in Medicago truncatula[J]. Scientific Reports,2018,8(1):12841.doi: 10.1038/s41598-018-29627-9.
[11] Zhang F,Wei Q H, Shi J C, Jin X, He Y, Zhang Y, Luo Q C, Wang Y S, Chang J L, Yang G X, He G Y. Brachypodium distachyon BdPP2CA6 interacts with BdPYLs and BdSnRK2 and positively regulates salt tolerance in transgenic Arabidopsis[J]. Frontiers Plant Science,2017, 28(8): 264.doi:10.3389/fpls.2017.00264.
[12] Singh A, Jha S K. Jha S K, Bagri J, Pandey G K.ABA inducible rice protein phosphatase 2C confers ABA insensitivity and abiotic stress tolerance in Arabidopsis[J]. PLoS One, 2015,10(4): e0125168.doi:10.1371/journal.pone.0125168.
[13] Guo P, Shi W C, Li L L, Bao Y J.GMsPP2C, a protein phosphatase 2C gene of alfalfa, confers enhanced salt tolerance in Arabidopsis[J]. International Journal of Agriculture and Biology, 2018, 20(1): 62-70.doi:10.17957/IJAB/15.0362.
[14] 闵东红, 薛飞洋, 马亚男, 陈明, 徐兆师, 李连城, 刁现民, 贾冠清, 马有志. 谷子PP2C基因家族的特性[J]. 作物学报, 2013, 39 (12): 2135-2144.doi:10.3724/SP.J.1006.2013.02135.
Min D H, Xue F Y, Ma Y N, Chen M, Xu Z S, Li L C, Diao X M, Jia G Q, Ma Y Z. Characteristics of millet PP2C gene family[J]. Acta Agronomica Sinica, 2013, 39 (12): 2135-2144.
[15] Reyes D, Rodriguez D, Gonzalez-Garcia M P, Lorenzo O, Nicolas G, Garcia-Martinez J L, Nicolas C. Overexpression of a protein phosphatase 2C from beech seeds in Arabidopsis shows phenotypes related to abscisic acid responses and gibberellin biosynthesis[J]. Plant Physiol, 2006, 141(4): 1414-1424.doi:10.1104/pp.106.084681.
[16] Saavedra X, Modrego A, Rodriguez D, Gonzalez-Garcia MP, Sanz L, Nicolas G, Lorenzo O. The nuclear interactor PYL8/RCAR3 of Fagus sylvatica FsPP2C1 is a positive regulator of abscisic acid signaling in seeds and stress[J]. Plant Physiol, 2010, 152(1): 133-150.dio10.1104/pp.109.146381.
[17] Liu L X, Hu X L, Song J A, Zong X J, Li D P, Li D Q. Over-expression of a Zea mays L. protein phosphatase 2C gene (ZmPP2C) in Arabidopsis thaliana decreases tolerance to salt and drought[J].J Plant Physiol, 2009, 166(5): 531-542. doi:10.1016/j.jplph.2008.07.008.
[18] Santiago J, Rodrigues A, Saez A, Rubio S, Antoni R, Dupeux F, Park S Y, M rquez J A, Cutler S R, Rodriguez P L. Modulation of drought resistance by the abscisic acid-receptor PYL5 through inhibition of clade A PP2Cs[J]. Plant Journal, 2009, 60(4): 575-588.doi:10.1111/j.1365-313X.2009.03981x.
[19] Jia H F, Lu D, Sun J H, Li C L, Xing Y, Qin L, Shen Y Y. Type 2C protein phosphatase ABI1 is a negative regulator of strawberry fruit ripening[J]. J Exp Bot, 2013, 64(6): 1677-1687.doi: 10.1093/jxb/ert028.
[20] Li Y S, Sun H, Wang Z F, Duan M, Huang S D, Yang J, Zhang H S. A novel nuclear proteinphosphatase 2C negatively regulated by ABL1 is involvedin abiotic stress and panicle development in rice[J]. Mol Biotechnol, 2013,54(2):703-710. doi: 10.1007/s12033-012-9614-8.
[21] Xue T T, Wang D, Zhang S Z, Ehlting J, Ni F, Jakab S, Zheng C, Zhong Y. Genome-wide and ex-pression analysis of protein phosphatase 2C in rice and Arabidopsis[J].BMC Genomics, 2008,20(9):550.doi:10.1186/1471-2164-9-550.
[22] 刘兆明, 刘宗旨, 白庆武, 方荣祥. Agroinfiltration 在植物分子生物学研究中的应用[J]. 生物工程学报2002,18(4):411-414.doi: 10.3321/j.issn:1000-3061.2002.04.003.
Liu Z M, Liu Z Z, Bai Q W, Fang R X. Application of agroinfiltration in plant molecular biology research[J]. Chinese Journal of Biotechnology, 2002, 18(4): 411-414.
[23] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J].Method, 2001, 25(4): 402-408.doi:10.1006/meth.2001.1262.
[24] 邓克勤, 郭新红, 汪启明, 刘选明. 拟南芥磷酸酶基因亚细胞定位与组织表达[J]. 西北植物学报, 2009, 29(2):234-239. doi:1000-4025(2009)02-0234-06.
Deng K Q, Guo X H, Wang Q M, Liu X M. Subcellular localization and tissue expression of Arabidopsis phosphatase gene[J]. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(2): 234-239.
[25] 官晓敏.百脉根LjPP2C蛋白磷酸酶负调控MPK6信号转导途径[D]. 武汉: 华中农业大学, 2015.
Guan X M. The negative regulation of MPK6 signal transduction pathway by LjPP2C protein phosphatase[D]. Wuhan: Central China Agricultural University, 2015.
[26] 郭鹏, 张士刚, 邢鑫, 姜健. 欧美杨PdPP2C基因的克隆与功能分析[J]. 北京林业大学学报.2015, 37(2):100-106.doi:10.13332/j.cnki.jbfu.2015.02.018.
Guo P, Zhang S G, Xing X, Jiang J. Cloning and functional analysis of PdPP2C gene from Populu[J]. Journal of Beijing Forestry University,2015, 37 (2):100-106.
[27] 胡晓丽.玉米根系蛋白磷酸酶ZmPP2C2基因的分离、功能鉴定及转基因烟草对逆境的响应[D]. 泰安:山东农业大学,2008.
Hu X L. Isolation, functional identification of maize root protein phosphatase ZmPP2C2 gene and response of transgenic tobacco to stress[D]. Taian: Shandong Agricultural University, 2008.
[28] 颜彦, 胡伟. 短柄草2C型蛋白磷酸酶基因BdPP2C2的克隆及表达分析[J]. 广东农业科学, 2014, 1(12): 156-160.doi:10.3969/j.issn.1000-2561.2014.12.013.
Yan Y, Hu W. Cloning and expression analysis of 2C-type protein phosphatase gene BdPP2C2 from Brachypodium serrata[J]. Guangdong Agricultural Sciences, 2014, 1(12): 156-160.
[29] Liu X, Zhu Y M, Zhai H, Cai H, Ji W, Luo X, Li J, Bai X. AtPP2CG1′a protein phosphatase 2C,positively regulates salt tolerance of Arabidopsis in abscisic acid-dependent manner[J]. Biochemicaland Biophysical Research Communications,2012, 422(4):710-715.doi:10.1016/j.bbrc.2012.05.064.
[30] 王培龙, 刘中原, 张腾倩, 曲冠证, 高彩球. 刚毛柽柳ThPP2C基因的克隆和表达分析[J]. 植物研究, 2017, 37(3):395-401.doi:10.7525 /j.issn.1673-5102.2017.03.010.
Wang P L, Liu Z Y, Zhang T Q, Qu G Z, Gao C Q. Cloning and expression analysis of ThPP2C gene from Tamarix chinensis[J]. Bulletin of Botanical Research, 2017, 37(3):395-401.
[31] 徐云峰. 玉米根系蛋白磷酸酶ZmPP2C基因的克隆表达特性及转化的研究[D]. 泰安:山东农业大学, 2005.
Xu Y F. Cloning and expression characteristics and transformation of maize root protein phosphatase ZmPP2C gene[D]. Taian:Shandong Agricultural University, 2005.